Method Article
El cultivo de una epidermis humana reconstruida tridimensional a gran escala
En este artículo
Resumen
Este protocolo describe un método sencillo para cultivar epidermis humana reconstituida tridimensional de una manera reproducible y robusta. Además, caracteriza la relación estructura-función del modelo de barrera epidérmica. Las respuestas biológicas de la epidermis humana reconstituida sobre estímulos proinflammatory también se presentan.
Resumen
Un modelo humano tridimensional de la epidermis reconstruido de keratinocytes primarios neonatales se presenta. Aquí, se describe un protocolo para el proceso de cultivo y la caracterización del modelo. Los queratinocitos primarios neonatales se sumergen en inserciones de policarbonato permeables y se elevan a la interfaz aire-líquido tres días después de la siembra. Después de catorce días de estimulación con factores de crecimiento definidos y ácido ascórbico en medio de cultivo de calcio alto, el modelo está completamente diferenciado. El análisis histológico reveló una epidermis totalmente estratificada, mímico la morfología de la piel humana nativa. Para caracterizar el modelo y sus funciones de barrera, los niveles de la proteína y la localización específicos para la diferenciación del keratinocyte de la temprano-etapa (es decir, queratina 10), la diferenciación de la tarde-etapa (es decir, involucrin, loricrin, y filaggrin) y la adherencia del tejido (es decir, desmoglein 1), fueron evaluados por inmunofluorescencia. La integridad de la barrera tisular se evaluó aún más mediante la medición de la resistencia eléctrica transepitelial. La epidermis humanaeconstructed de R era responsiva a los estímulos proinflammatory (es decir, alfa del factor de necrosis del lipopolysaccharide y de tumor), llevando al lanzamiento creciente del cytokine (es decir, alfa del interleukin 1 e interleukin 8). Este protocolo representa un método in vitro directo y reproducible para cultivar epidermis humana reconstruida como herramienta para evaluar efectos ambientales y una amplia gama de estudios piel-relacionados.
Introducción
La epidermis es la capa más externa de la piel, en la interfaz directa entre el cuerpo humano y el medio ambiente externo. Sus principales funciones son proporcionar protección e hidratación1. La epidermis actúa como una barrera física eficaz contra los agentes externos y previene la pérdida excesiva de agua del cuerpo. Estas funciones de la piel dependen principalmente de la disposición celular en las capas más externas de la piel, la composición y la organización de los lípidos intercelulares2. La epidermis se compone principalmente de queratinocitos que migran hacia arriba hacia el lado externo del tejido y se someten a la diferenciación. Existen 4-5 capas epidérmicas que se caracterizan por su etapa de diferenciación. Del interior al exterior, las capas epidérmicas parten de la epidermis viable, es decir, el estrato basal (SB), el estrato espinoso (SS) y el estrato granuloso (SG), hasta la capa superior no viable, es decir, el estrato córneo (SC)3. La capa basal está compuesta principalmente por queratinocitos enriquecidos con queratina proliferantes, que migran a través de las SS tras la diferenciación4. Durante la maduración de los queratinocitos, se producen varios cambios en la expresión y estructura de las proteínas. Los queratinocitos se adhieren a través de la formación de uniones desmosómicas5. En el SG se inicia la generación de cuerpos laminares. Consisten en precursores lipídicos y enzimas que son cruciales para la formación de la función barrera cutánea6. El SG también se caracteriza por la presencia de gránulos de queratohyalina en el citoplasma de los queratinocitos. En la interfaz con el SC, el contenido de los cuerpos laminares se extruye en los espacios intercelulares y los lípidos no polares como ceramidas, colesterol y ácidos grasos libres se organizan en bicapas lipídicas laminares apiladas para formar la matriz lipídica extracelular7. En el SC, las células pierden todos los orgánulos celulares incluyendo el núcleo, debido a los procesos de degradación enzimática y adoptan una morfología aplanada. Están rodeados por una envoltura cornificada hecha de capas de proteínas reticenadas, y se conocen como corneocitos8,9. Los componentes demosomales están reticenados a la envoltura cornificada para formar corneodesmosomas y unir los corneocitos. El epitelio resultante se renueva continuamente a partir de células madre, con un tiempo de rotación de aproximadamente 5-6 semanas10. El proceso de diferenciación de los queratinocitos, que resulta en una epidermis completamente estratificada, es crucial para la formación de la función barrera de la piel11.
Durante la herida y la inflamación, los queratinocitos inducen cambios en las moléculas de adhesión y los receptores de superficie y desencadenan respuestas proinflamatorias a través de la secreción de citoquinas, quimiocinas y péptidos antimicrobianos12. La piel no es sólo una barrera física contra las sustancias exógenas; también actúa como un sensor inmunológico tras la exposición a patógenos. Además, regula la difusión de varias sustancias a través de sus capas, como el contenido de agua para proteger el cuerpo humano de la deshidratación. La piel también participa en la síntesis de vitamina D y tiene varias otras funciones metabólicas3,13,14.
Para evaluar los efectos adversos de las sustancias exógenas, los toxicólogos han confiado durante décadas en la experimentación con animales, pero hoy en día no es el enfoque preferido. Además de tener una capacidad predictiva limitada para la toxicidad humana, los modelos animales implican numerosas cuestiones éticas. La prohibición de la experimentación con animales en la industria cosmética y la recomendación de seguir el principio de las 3R (es decir, sustitución, reducción y perfeccionamiento) en la investigación han dado lugar al desarrollo de métodos de ensayo alternativos basados en enfoques in vitro15. Los primeros modelos in vitro de células cutáneas ya han sido descritos en los años 90, y se ha logrado un impresionante desarrollo de simples monocultivos de queratinocitos humanos a modelos de epidermis y espesor completo totalmente diferenciados16. Hoy en día, la ingeniería de tejidos cutáneos ha ganado importancia tanto en el campo farmacéutico como en el dermato-cosmético. En las últimas dos décadas, varias compañías han comercializado epidermis humana reconstruida tridimensional (3D) (RhE) que representan herramientas estandarizadas y reproducibles para estudios relacionados con la piel. Se aceptan varios modelos comerciales de RhE para las pruebas in vitro de productos químicos en la piel de acuerdo con las directrices de la OCDE para las pruebas de irritación de la piel17,18 (es decir, la directriz de ensayo 43919)y la corrosión de la piel20 (es decir, la directriz de ensayo 43121). La prueba in vitro para la sensibilización de la piel22 (es decir, el ensayo SENS-IS) se encuentra actualmente en la vía de aprobación y en revisión por pares23. También hay numerosos otros ensayos desarrollados que utilizan modelos comerciales de RhE, para evaluar la fototoxicidad24,para probar formulaciones de fármacos25,formulaciones cosméticas e ingredientes activos26,para estudiar la función de barrera cutánea27 y para probar la respuesta biológica a los estresores ambientales28,29,30,31.
Además de los modelos de piel 3D disponibles en el mercado, múltiples grupos de investigación han desarrollado sus propios RhEs32,33,34,35,36,37. Los RhEs internos ofrecen la ventaja para controlar las condiciones de la cultura según el propósito del estudio. Específicamente, los investigadores pueden seleccionar el tipo y la fuente de los queratinocitos que se utilizarán para la reconstitución de su modelo epidérmico 3D (es decir, primario vs inmortalizado, neonatal vs. envejecido, donantes aleatorios individuales frente a donantes aleatorios agrupados, sexo, etnia, hábitos de vida individuales como fumar, etc.). Tienen la posibilidad de variar la composición del medio de cultivo e incorporar factores de crecimiento, vitaminas u otros compuestos que pueden modular la expresión de proteínas diana o lípidos. Con los RhEs internos, los investigadores también pueden investigar las respuestas biológicas y las propiedades biomecánicas en función del estado de diferenciación del modelo 3D. Además de esos parámetros intuitivos, hay esfuerzos continuos para aumentar la complejidad de los modelos de piel 3D y hacerlos más relevantes fisiológicamente, por ejemplo, agregando otros tipos de células epidérmicas (porejemplo,melanocitos y células inmunes)38,39,cultivando los queratinocitos sobre una matriz de colágeno poblada por fibroblastos40,41,42,e incluyendo componentes de la red vascular43,44,45.
Aunque es posible ajustar las condiciones del cultivo según las necesidades específicas, existen parámetros que deben respetarse para garantizar tanto la calidad como la relevancia de un RhE. Para cultivar los tejidos de RhE, los keratinocytes epidérmicos humanos normales (NHEKs) se siembran en los rellenos permeables específicos de la cultura cuya membrana sintética porosa separa los pozos en dos compartimientos, es decir, el compartimiento apical y basolateral. La porosidad de la membrana (es decir, un tamaño de poro de 0,4 μm) es tal que permite la formación de una monocapa celular en el compartimento apical sin migración de las células al lado del inserto basal, y la alimentación de los queratinocitos con nutrientes esenciales del medio de cultivo contenido en el compartimento basolateral. Al comienzo del proceso de reconstitución, los NHEKs se cultivan en condiciones sumergidas durante unos días para permitir su adhesión a la membrana. El nivel de calcio en ambos compartimentos se incrementa en comparación con la concentración de calcio utilizada para el cultivo 2D de NHEKs para ralentizar la proliferación de las células y promover en su lugar su diferenciación46. Un gradiente epidérmico de calcio es esencial para regular la formación de barreras y la homeostasis47,48. Los niveles altos de calcio (es decir, hasta 1,5 mM) promueven la formación de uniones intercelulares y modulan la formación de la envoltura cornificada durante la diferenciación terminal49. Una vez que los queratinocitos forman una monocapa continua y firmemente adherente en la membrana de soporte, se elimina el medio del compartimento apical y el proceso de cultivo continúa en la interfaz aire-líquido (ALI) para estimular la estratificación y establecer una barrera epidérmica50,51. Las condiciones específicas de cultivo son cruciales para obtener un epitelio completamente estratificado36. Durante el proceso de reconstitución en ALI, el medio en el compartimiento basolateral se complementa con el factor de crecimiento del keratinocyte (KGF), la insulina, el calcio, y el ácido ascórbico. El ácido ascórbico juega un papel importante en la formación de una barrera lipídica sc apropiada, muy parecida a la de la piel humana nativa52. Los queratinocitos cultivados en medio suplementado con ácido ascórbico demuestran un fenotipo diferenciado, con un mayor número de gránulos de queratohyalina, así como laminillas lipídicas intercelulares organizadas en los interstiticos de los corneocitos52. Dicha suplementación es esencial para mejorar la función de barrera epidérmica aumentando el contenido de envoltura cornificada y evitando el agotamiento de las reservas de antioxidantes hidrófilos53,54. KGF, un mediador paracrino importante de la proliferación y de la diferenciación epidérmicas, se utiliza para estimular el NHEKs55.
Las principales desventajas de las REs internas incluyen la pérdida de estandarización entre las instituciones de investigación y el aumento de la intensidad laboral y el consumo de tiempo (hasta 3 semanas en comparación con los modelos comerciales listos para usar). El objetivo del presente documento es abordar estos inconvenientes, sentando las bases para la producción a mayor escala. Además de las ventajas antes mencionadas de las REs internas, el protocolo actual tiene como objetivo reducir la variabilidad intra e interescal entre los tejidos, reducir los riesgos de contaminación y agilizar el proceso de cultivo.
El protocolo actual describe un método reproducible y robusto para cultivar RhEs usando NHEKs neonatal. Por otra parte, muestra resultados representativos de la caracterización de la morfología de rhes, integridad de la barrera, y la expresión de proteínas que son específicas para la diferenciación epidérmica. La estructura morfológica de RhEs fue examinada usando la coloración del hematoxylin y de la eosina (H&E) y la microscopia electrónica de transmisión (TEM). Para evaluar la integridad de la barrera, se midió la resistencia eléctrica transepidérmica (TEER) y el tiempo de exposición a Triton X-100 para reducir el 50% de la viabilidad tisular (ET50). La formación de ensambladuras desmosomal (es decir, desmoglein 1) era analizada por la inmunofluorescencia (SI) para evaluar la adherencia del keratinocyte. La formación de proteínas estructurales epidérmicas (es decir, involucrin, loricrin, y filaggrin) fue evaluada y detectada con SI. Estas proteínas están implicadas en la formación de la envoltura proteica altamente reticenlada que rodea a los corneocitos SC y como resultado son marcadores importantes para la diferenciación epidérmica en estadio tardío56,57. Además, if fue utilizado para analizar la queratina 10, una proteína inducida en células diferenciadas en etapa temprana en los SS58 y encontrada dentro de todas las capas diferenciadas. Finalmente, el RhE' la respuesta de s a los estímulos proinflammatory (es decir, alfa del factor de necrosis del lipopolysaccharide y de tumor) fue investigada. Los niveles de interleucina 1 alfa (IL-1α) e interleucina 8 (IL-8) se midieron en los medios de cultivo celular, utilizando ensayos de inmunoabsorción ligados a enzimas (ELISA).
Protocolo
Revisar y adherirse a las consideraciones y condiciones éticas nacionales e internacionales relacionadas con el uso de células o tejidos humanos antes de planificar y ejecutar cualquier actividad de investigación que involucre este protocolo.
NOTA: Todos los pasos de este protocolo deben llevarse a cabo en condiciones asépticas. Las prácticas de nivel 2 de bioseguridad son el requisito mínimo para el cultivo de rhEs. Se deben tomar todas las precauciones de seguridad necesarias al manipular los productos químicos/reactivos descritos en este protocolo.
1. Preparación de medios de cultivo celular
NOTA: Existen tres tipos diferentes de medios de cultivo sin suero utilizados para el cultivo de RhEs (Tabla 1): (i) el medio basal con bajo nivel de calcio (60 μM Ca2+)utilizado para el cultivo 2D de NHEKs; (ii) el medio sumergido con alto nivel de calcio (1,5 mM Ca2+)utilizado para la siembra de NHEKs en el sistema de inserción de cultivos celulares; y (iii) el medio de la interfaz aire-líquido (ALI) con el alto nivel del calcio (1,5 milímetros Ca2+),el ácido ascórbico, y el factor de crecimiento del keratinocyte (KGF).
| Medio | Información media | Cantidad requerida |
| Medio basal | Medio de crecimiento de queratinocitos | 36 mL/24 pozos |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x antibiótico-antimicótico | ||
| Medio sumergido | Medio de crecimiento de queratinocitos | 36 mL/24 pozos |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x antibiótico-antimicótico | ||
| + 1,5 mM Ca2+ | ||
| Medio de interfaz aire-líquido | Medio de crecimiento de queratinocitos | 216 mL/24 pozos |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x antibiótico-antimicótico | ||
| + 1,5 mM Ca2+ | ||
| + 50 μg/mL de ácido ascórbico | ||
| + 10 ng/mL factor de crecimiento de queratinocitos |
Tabla 1. Tabla sinóptico de los diferentes medios de cultivo utilizados para cultivar RhEs. Lista de diversos medios de la cultura con los suplementos.
- Preparar el medio basal.
- Complemente la botella de 500 ml de medio de crecimiento de queratinocitos(Tabla de materiales)con 5 ml de suplementos de crecimiento de queratinocitos humanos (HKGS) para alcanzar concentraciones finales de 0,2% [v/v] de extracto de hipófisis bovina (BPE), 0,2 ng/mL de factor de crecimiento epidérmico recombinante humano (EGF), 0,18 μg/mL de hidrocortisona, 5 μg/mL de transferrina bovina y 0,01 μg/mL de factor de crecimiento similar a la insulina humana recombinante I (IGF-I).
- Añadir 5 mL de solución antibiótico-antimicótica de 100x que contenga 10.000 unidades/mL de penicilina, 10.000 μg/mL de estreptomicina y 25 μg/mL de anfotericina B.
- Prepare el medio sumergido.
- Complementar el frasco de 500 mL de medio de crecimiento de queratinocitos(Tabla de Materiales)con 5 mL de HKGS para alcanzar concentraciones finales de 0,2% [v/v] de BPE, 0,2 ng/mL de EGF recombinante humano, 0,18 μg/mL de hidrocortisona, 5 μg/mL de transferrina bovina y 0,01 μg/mL de IGF-I recombinante humano.
- Añadir 5 mL de solución antibiótico-antimicótica 100x.
- Añadir 5 mL de una solución común de CaCl 2 (cloruro de calcio) de0,144 M para alcanzar una concentración final de 1,5 mMca2+.
NOTA: La concentración de calcio ya está aumentada durante la fase sumergida para estimular la diferenciación de los queratinocitos e iniciar el proceso de estratificación49.
- Prepare el medio de interfaz aire-líquido (ALI).
- Complemente una botella de 500 mL de medio de crecimiento de queratinocitos(Tabla de Materiales)con 5 mL de HKGS para alcanzar concentraciones finales de 0,2% [v/v] de BPE, 0,2 ng/mL de EGF recombinante humano, 0,18 μg/mL de hidrocortisona, 5 μg/mL de transferrina bovina y 0,01 μg/mL de IGF-I recombinante humano.
- Añadir 5 mL de solución antibiótico-antimicótica 100x.
- Añadir 5 mL de una solución de culata de CaCl2 de 0,144 M para alcanzar una concentración final de 1,5 mM Ca2+.
- Añadir 1 mL de una solución de 25 mg/mL de ácido ascórbico para alcanzar una concentración final de 50 μg/mL de ácido ascórbico.
- Añadir 50 μL de un KGF de 100 μg/mL en albúmina sérica bovina al 1% [p/v] en solución de solución salina tamponada con fosfato (PBS) para alcanzar una concentración final de 10 ng/mL kgf.
NOTA: Dado que el ácido ascórbico es sensible a la oxidación, se recomienda utilizar un derivado estable del ácido ascórbico, como el magnesio l-ascorbilal-2-fosfato59 o el ácido L-ascórbico 2-fosfato sesquimagnesio60. Si se usa ácido ascórbico, se recomienda complementar recientemente el medio ALI con ácido ascórbico antes de cada refresco.
2. Cultura de nheks
NOTA: Dado que los queratinocitos humanos primarios siguen siendo proliferativos en su cuarto o quinto paso61,NHEKs en su tercer paso se utilizan para el cultivo de RhEs. Los queratinocitos primarios deben manipularse con mucho cuidado debido a su alta sensibilidad. El pipeteo cuidadoso y lento de las suspensiones celulares en cualquier momento es muy importante, para no perturbar la condición de las células.
- Descongelar un vial con 1 x10 6 NHEKs criopreservados en un baño de agua a 37 °C, sumergiendo parte del vial en el agua. Incubar el vial durante 1-2 minutos en el baño de agua, hasta que sólo una pequeña astilla de hielo es visible.
PRECAUCIÓN: No sumerja todo el vial en el baño de agua para evitar contaminaciones. No descongele las células más de 2 minutos; esto puede reducir la viabilidad celular. Limpie el vial con una solución de etanol al 70% antes de transferir el tubo a la campana laminar. - Resuspend las células con mucho cuidado, pipeteando hacia arriba y hacia abajo 2-3 veces. Transferir la suspensión celular a dos matraces T75 que contengan un total de 15 mL de medio de descongelación precalentado, lo que da como resultado una densidad de siembra de 6,7 x 104 células/cm2.
NOTA: Para los dos primeros pasajes y el descongelamiento de los NHEKs criopreservados, el medio de cultivo celular se utiliza de acuerdo con las recomendaciones del proveedor. - Coloque los frascos en la incubadora de cultivos celulares (37 °C, 5% deCO2y 95% de humedad relativa (RH)).
- Después de aproximadamente 24 horas, reemplace el medio de descongelación por el medio basal para eliminar el sulfóxido de dimetilo (DMSO) de la solución de congelación de queratinocitos.
- Refrescar el medio basal cada dos días.
- Después de 4-6 días de cultivo, las células deben estar alrededor del 80% confluentes y listas para la siembra en inserciones para el cultivo de RhEs.
NOTA: Los queratinocitos deben cultivarse hasta un máximo del 80% de confluencia para preservar su capacidad proliferativa62. El número de células a descongelar debe tener en cuenta varios parámetros, como el número de paso de la célula, la viabilidad de la célula al descongelarse, la eficiencia de siembra, así como el tiempo de duplicación.
3. Siembra de NHEKs
NOTA: Este protocolo está diseñado para su uso dentro de un formato de placa portadora de 24 pozos. Si se requieren otros formatos de placa (por ejemplo, formato de 12 o 6 pozos), se deben considerar optimizaciones en la densidad de siembra y el volumen medio. La Figura 1 resume una línea de tiempo propuesta para el cultivo de RhE y muestra las condiciones de cultivo.
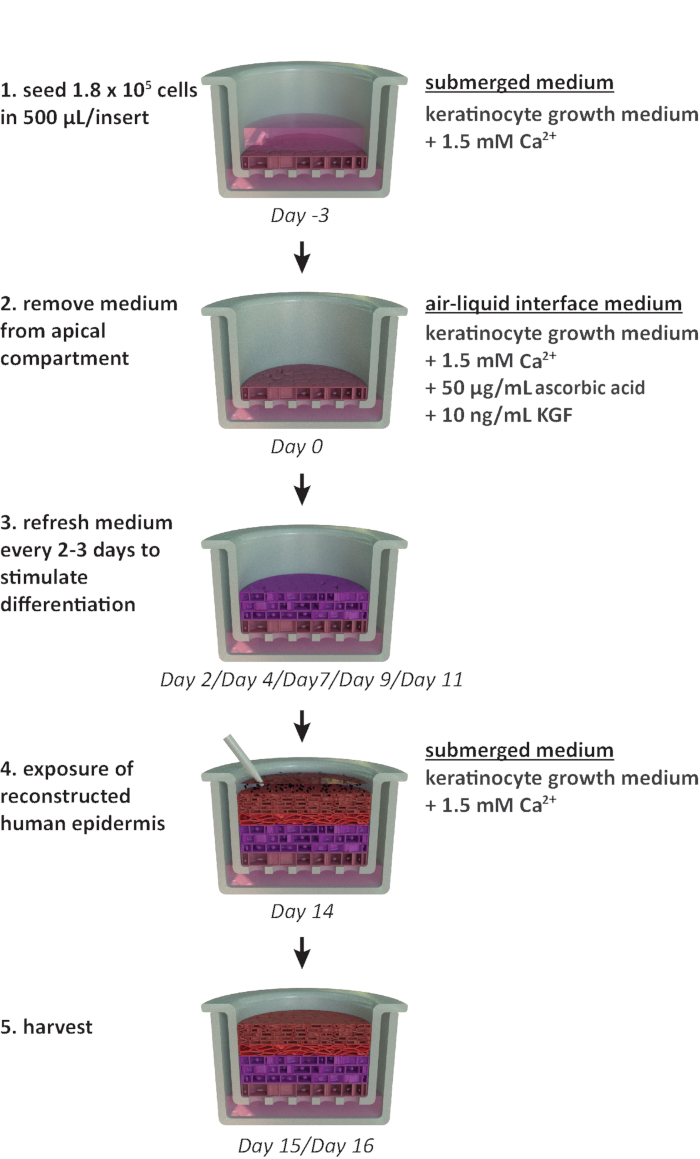
Figura 1:Línea de tiempo esquemática del protocolo de reconstitución. Presentación del modelo rhE preparación, proceso de cultivo y aplicación (exposición a sustancia química). El esquema incluye los tipos de medios de cultivo celular apropiados para cada paso. Haga clic aquí para ver una versión más amplia de esta figura.
- Prellene las placas de 24 pocillos con 1,5 mL de medio sumergido, idealmente utilizando una pipeta dispensadora.
- Retirar el medio basal de los matraces T75 utilizados para el cultivo de los NHEKs.
- Enjuague las células añadiendo 5 ml de PBS precalentado a cada matraz T75.
- Retire el PBS de los matraces.
NOTA: Este paso es crucial, ya que el medio contiene proteínas y calcio que inhibirán la actividad de la tripsina. - Añadir 2-3 ml de tripsina/ácido tetra acético (EDTA) precalentado al 0,05% [v/v] de tripsina/diamina de etileno (EDTA) a cada matraz T75. Asegúrese de que la solución de tripsina esté igualmente distribuida en el área de cultivo celular del matraz.
PRECAUCIÓN: El volumen de 2 mL se basa en la confluencia del 80% mencionada anteriormente. Utilizar 3 mL para matraces con una mayor confluencia. - Colocar los matraces durante 4 minutos en la incubadora de cultivos celulares (37 °C, 5% deCO2y 95% de RH). Compruebe si las células se desprenden con el microscopio a un aumento de 10x. Rap el matraz contra la palma de la mano para ayudar a las células a liberarse de la superficie del matraz. Las células separadas se pueden observar como células redondeadas que flotan en la solución de tripsina.
PRECAUCIÓN: No incube las células en tripsina durante más de 6 minutos. La sobre-tripsinización puede dañar las células y disminuir su adherencia63. - Una vez que todas las células estén separadas, agregue un volumen igual (es decir, 2-3 mL) de inhibidor de tripsina precalentado a cada matraz T75.
- Transfiera la suspensión de la célula de los matraces a un tubo de centrífuga.
- Enjuague los frascos con 5 ml de PBS precalentado y transfiéralo al tubo centrífugo que contiene la suspensión celular.
NOTA: Asegúrese de que la mayoría de las células se recogen comprobando el número de células residuales en los frascos bajo el microscopio. La superficie del matraz debe estar vacía en un 95%. Si este no es el caso, es posible repetir el paso de tripsinización (3.3-3.9). Sin embargo, tenga en cuenta que se debe evitar la re-tripsinización. - Centrifugar las células cosechadas a 400 x g durante 5 min.
- Deseche cuidadosamente la mayor parte del sobrenadante, dejando aproximadamente 100-200 μL en el tubo.
PRECAUCIÓN: No aspire el pellet durante esteprocedimiento. - Resuspend suavemente el pellet de células en un volumen bajo de medio sumergido, pipeta hacia arriba y hacia abajo 5-10 veces para asegurar una suspensión celular uniforme. Comience con un volumen bajo (es decir, 500 μL) para evitar la formación de agregados celulares y agregue hasta 1 mL de medio sumergido en total por matraz T75 inicial.
NOTA: Mueva suavemente el tubo con los dedos para disolver cuidadosamente una parte del pellet celular en el sobrenadante. - Cuente las celdas de la suspensión utilizando el método de exclusión de tripano azul.
- Diluya la tinción azul tripano al 0,4% [v/v] y la suspensión celular en una proporción de 1:1, añadiendo 10 μL de mancha azul tripano al 0,4% [v/v] a 10 μL de suspensión celular. Agregue 10 μL de la solución a una diapositiva de conteo. Mida el recuento celular inmediatamente después de mezclar la suspensión celular con azul tripano, ya que el azul tripano comienza a disminuir la viabilidad celular después de la exposición más de 1 min65.
PRECAUCIÓN: El azul de Trypan fue mostrado para ser un mutágeno potencial, un agente carcinógeno, y un teratógeno64. Maneje el tinte con cuidado y deseche los desechos de manera segura de acuerdo con las regulaciones locales del laboratorio.
NOTA: Un enfoque alternativo al uso de azul tripano es el colorante no peligroso Erythrosin B66.
- Diluya la tinción azul tripano al 0,4% [v/v] y la suspensión celular en una proporción de 1:1, añadiendo 10 μL de mancha azul tripano al 0,4% [v/v] a 10 μL de suspensión celular. Agregue 10 μL de la solución a una diapositiva de conteo. Mida el recuento celular inmediatamente después de mezclar la suspensión celular con azul tripano, ya que el azul tripano comienza a disminuir la viabilidad celular después de la exposición más de 1 min65.
- Diluir la suspensión celular con medio sumergido adicional para alcanzar una concentración de 3,525 x 105 células/mL en medio sumergido añadiendo el volumen V2 como se muestra en la ecuación 1:
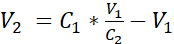
C1 = concentración celular contada en la suspensión celular obtenida en 3,12 (células/mL)
V1 = volumen utilizado para resuspend el pellet de células en 3,12 (mL)
C2 = concentración celular objetivo en la suspensión (es decir, 3,525 x 105 células/mL)
V2 = volumen a añadir para alcanzar la concentración celular objetivo (mL)
NOTA: La superficie del inserto de cultivo recomendado es de 0,47 cm2; por lo tanto, la densidad de siembra correspondiente es de 3,75 x 105 células/cm2. - Realizar un segundo recuento celular (C3) de la solución diluida obtenida en el paso 3.14. Utilice la ecuación 2 para calcular el volumen de suspensión celular (V4)que se sembrará en el inserto de cultivo:
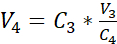
C3 = concentración celular objetivo en la suspensión (es decir, 3,525 x 105 células/mL)
V3 = volumen objetivo de la suspensión celular que se va a sembrar en el inserto de cultivo (es decir, 0,5 mL)
C4 = concentración celular contada en la suspensión diluida obtenida en 3,14 (células/mL)
V4 = volumen real de la suspensión celular que se va a sembrar en el inserto de cultivo (mL) - Cuelgue los 24 insertos de cultivo celular en la posición más alta de la placa portadora recomendada y transfiera la placa portadora a la placa de 24 pocillos precargada con medio sumergido (cf. 3.1).
PRECAUCIÓN: Al transferir la placa portadora a la placa de múltiples pozos, asegúrese de que no haya burbujas de aire atrapadas entre la membrana de inserción y el medio sumergido desde el compartimiento basal, ya que esto afectará la alimentación de las células y, en última instancia, comprometerá la viabilidad y morfología de RhE. - Agregue el volumen determinado V4 (de la ecuación 2) de la suspensión de la celda a cada inserto.
NOTA: Se recomienda utilizar la técnica de pipeteo inverso para dispensar con precisión la suspensión celular a los insertos de cultivo.
PRECAUCIÓN: Asegúrese de no dañar la membrana al dispensar la suspensión celular en el inserto de cultivo. Una precaución es dispensar la suspensión celular a lo largo de la pared del sistema de inserción sin tocar la superficie de la membrana. - Después de la siembra, incube las placas de 24 pocillos durante 10-15 minutos a temperatura ambiente, para superar un efecto de borde (es decir, distribución de temperatura no uniforme entre todos los pozos67). No mueva las placas durante este tiempo.
- Transferir las placas a la incubadora de cultivos celulares (37 °C, 5% deCO2y 95% de RH). Las células se mantienen en condiciones sumergidas durante tres días.
NOTA: Para evitar la variabilidad del tejido, no apile las placas en la incubadora después de la siembra para asegurarse de que cada inserto reciba la misma cantidad de calor. Después de tres días (es decir, durante el cultivo de ALI), es posible apilar las placas.
4. Cultivo en la interfaz aire-líquido
- Después de una incubación de tres días en la incubadora de cultivo celular (37 °C, 5% deCO2y 95% de RH), exponga las células que se han adherido a la superficie de la membrana a la LPA eliminando el medio sumergido del compartimento apical preferiblemente utilizando un sistema de aspiración y una pipeta Pasteur de vidrio.
NOTA: Alternativamente, el medio sumergido del compartimento apical se puede quitar con una micropipeta manual. - Llene las nuevas placas de 24 pocillos con 1,5 mL de medio ALI precalentado fresco y transfiera las placas portadoras con las inserciones de cultivo a las nuevas placas de múltiples pozos.
- Transfiera las placas de múltiples pozos de vuelta a la incubadora de cultivos celulares (37 °C, 5% deCO2y 95% de RH).
- Actualice el medio ALI cada 2-3 días durante 14 días.
- Realice la actualización en dos pasos: 1) prepare una placa nueva que contenga 1.5 mL/pozo de medio ALI precalentado fresco y 2) transfiera la placa portadora a la nueva placa.
PRECAUCIÓN: Durante todo el procedimiento de reconstitución, es mejor no quitar la tapa que cubre la placa portadora para mantener los RhEs protegidos de la contaminación potencial.
NOTA: El paso ali es crucial para el desarrollo de un modelo epidérmico estratificado, ya que permite la diferenciación terminal de los queratinocitos68. Después de ir a ALI, se requiere un control visual de las inserciones, para comprobar si hay 'tejidos permeados': gotitas medianas en la superficie del tejido procedentes del compartimento basolateral. Si la fuga ocurre en ali día 3, retire suavemente el medio de la inserción de cultivo sin tocar la superficie del tejido. Si la fuga persiste, se recomienda descartar los tejidos con fugas, ya que es una indicación de que no hay una formación de barrera correcta en el modelo rhE. - Al final del proceso de reconstitución, los tejidos pueden ser expuestos a varios factores de estrés para inducir, por ejemplo, estrés oxidativo o inflamación. En paralelo, se pueden tratar con compuestos químicos o ingredientes cosméticos. NOTA: Durante la exposición/tratamiento, los tejidos generalmente se mantienen en medio sumergido a partir de ALI D14. Cuando se espera que los tejidos estén expuestos/tratados durante un largo período de tiempo (es decir, 48-72 horas), se recomienda (i) iniciar la exposición/tratamiento antes en el proceso de cultivo de la ALÍ, como D7-D9, para evitar el adelgazamiento de las capas viables y el engrosamiento del SC, y (ii) incubar los tejidos en medio ali, para seguir estimulando la proliferación celular.
- Para la recolección de RhE, recoja los tejidos y el medio de cultivo celular en el punto de interés para el análisis histológico, los ensayos de viabilidad, la extracción de proteínas / ARN y los ensayos de inmunoabsorción ligados a enzimas (ELISAs).
Resultados
Los NHEKs cultivados en 2D muestran una morfología tradicional con una forma poligonal consistente (Figura 2A). Como se describió anteriormente, los NHEKs se siembran en inserciones de cultivo después de alcanzar una confluencia de aproximadamente el 80%. La morfología de los RhEs era analizada usando la coloración de H&E y TEM. Después de 15 días en la LPA, se obtiene un tejido completamente estratificado según lo indicado por sus cuatro capas epidérmicas principales: la SB, la SS, la SG y la SC(Figura 2B). En la capa SB, las celdas tienen una forma de columna. A partir de la segunda capa hacia las capas superiores del RhE, los NHEKs se diferencian según lo observado por los cambios en la morfología celular (desde una forma columnar en la capa SB, hacia una forma espinosa en la capa SS). En la capa SG, las células tienen una forma más aplanada y muestran gránulos de queratohyalina (KG) que se representan como puntos púrpuras en el citoplasma. Su característica forma redonda y estelar está resaltada por flechas blancas en la imagen H&E (Figura 2C). Las células en el SC, se diferencian terminalmente y se aplanan totalmente y carecen de un núcleo de la célula. Los RhEs estratificados tienen un espesor total de 84,3 ± 2,4 μm y su SC tiene un espesor de 19,6 ± 3,2 μm(Figura 2D). Estos valores son comparables a los notificados para la piel humana nativa, es decir, 60-120 μm y 10-20 μm, respectivamente69. El número de capas viables es de 6-7, que es menor en comparación con el de la piel humana nativa, siendo aproximadamente 7-1470. El análisis ultraestructural de rhes en diferentes puntos de tiempo en el protocolo de reconstitución (es decir, 7, 10, 13 y 15 días) revela el proceso de cornificación de los RhEs con un mayor número de capas de corneocitos a lo largo del tiempo (Figura 2E). Después de 15 días en el ALI, el SC del tejido RhE está hecho de aproximadamente 15-25 capas, que es comparable al valor reportado para la piel humana nativa (es decir, 15-20 capas)69.
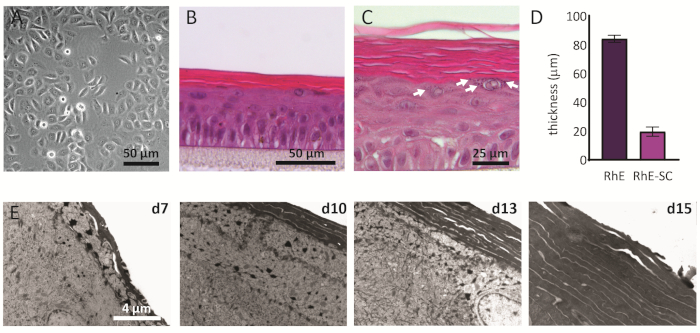
Figura 2:Queratinocitos primarios y epidermis humana reconstruida. (A) Imagen de microscopía de contraste de fase de queratinocitos primarios antes de sembrar en insertos. La barra de escala es de 50 μm.(B-C)H&E imagen de microscopía de campo brillante de RhE. La barra de escala es de 50 μm(B)y 25 μm(C). (D) Cuantificación del espesor de RhE y SC (media ± SEM, n=3). (E)Imágenes de microscopía electrónica de transmisión de secciones transversales de RhE después de 7, 10, 13 y 15 días en ALI. La barra de escala es de 4 μm. Haga clic aquí para ver una versión más grande de esta figura.
Según su etapa de diferenciación, los NHEKs que crecen en 3D muestran diferentes perfiles de expresión de proteínas según su etapa de diferenciación. La expresión de las proteínas específicas para la diferenciación del keratinocyte de la temprano-etapa (es decir, queratina 10), la diferenciación del keratinocyte de la tarde-etapa (es decir, involucrin, loricrin, y filaggrin), y la adherencia del keratinocyte (es decir, desmoglein 1) en RhEs fue determinada usando SI la coloración. La expresión de la involucrina aparece más predominantemente localizada en la capa SG ya que su expresión se inicia antes durante el proceso de diferenciación(Figura 3D),mientras que la filaggrina y la loricrina se expresan en las capas superiores(Figura 3B-C). La expresión de queratina 10 se encontró en todas las capas viables, excepto en la capa SB (Figura 3E). Las RhEs muestran uniones desmosómicas funcionales, como lo indica la expresión de desmogleina 1 en el espacio intercelular de las capas epidérmicas viables(Figura 3F). Para concluir, los cinco marcadores se expresan y localizan en las capas epidérmicas apropiadas y se traducen en un proceso de diferenciación epidérmica saludable.
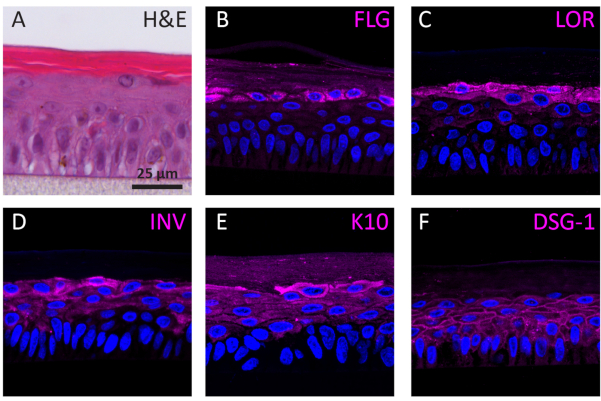
Figura 3:Diferenciación epidérmica, adhesión tisular e integridad tisular de la epidermis humana reconstruida. (A)H&E imagen de microscopía de campo brillante de RhE. Imágenes de microscopía de fluorescencia confocal de(B)filaggrina (FLG),(C)loricrina (LOR),(D)involucrina (INV),(E)queratina 10 (K10), y (F) desmogleina 1 (DSG-1) representada en magenta. La tinción de núcleos (DAPI) se representa en azul. La barra de escala es de 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
Las propiedades de barrera del modelo RhE se investigaron mediante la evaluación de la viabilidad del tejido y la integridad. La integridad tisular se determinó después de 15 días midiendo el TEER utilizando un volthmímetro. Los valores de 2567 ± 415 Ω,cm2 registrados para los RhEs traducen la formación de una barrera continua (Figura 4A). Esos valores están en rango con los reportados para los modelos RhE71,72,73,74. Además, el tiempo de exposición requerido para un producto químico de referencia citotóxico (es decir, Triton X-100) para reducir la viabilidad del tejido en un 50% (ET50)se determinó con un ensayo de bromuro de tetrazolio azul tiazolilo (MTT). El valor de ET50 medido para el RhE fue de 2,1 horas. Este valor se encuentra dentro del rango de aceptación de otros modelos epidérmicos 3D que están calificados para una predicción fiable de la clasificación de la irritación (Directriz 439 de la OCDE)19.
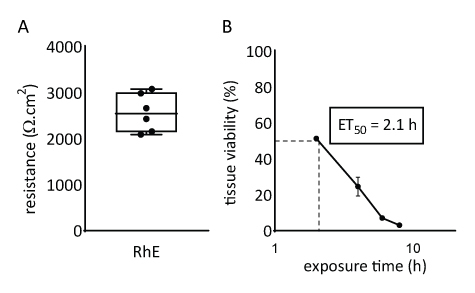
Figura 4: Propiedades de barrera de la epidermis humana reconstruida. (A) Integridad tisular medida con resistencia eléctrica transepitelial (media ± SEM, n= 6). (B)ET50 determinado midiendo la viabilidad tisular (es decir, ensayo MTT) tras la exposición tópica a 78,3 μL de Tritón X-100 al 1% (media ± SEM, n=3).
La sensibilidad de RhEs fue investigada sobre estímulos proinflammatory sabidos. Los RhEs fueron tratados sistémicamente, es decir, adición de estímulos en el medio del compartimiento basolateral, usando el lipopolisacárido de Escherichia coli de 100 μg/mL (LPS) y el alfa del factor de necrosis de tumor de 40 ng/mL (TNF-α). Después de 24 horas de estímulos, el medio de cultivo celular fue recogido. La citotoxicidad se midió mediante un ensayo de lactato deshidrogenasa (LDH) y se comparó con los valores de un disruptor de membrana conocido, el detergente Triton X-100(Figura 5). Un aumento significativo (p < 0,05, ANOVA unidireccional, prueba de comparación múltiple de Dunnett) fue mostrado en actividad de LDH en los RhEs tratados con Triton X-100. Los tratamientos de los LPS y de TNF-α ambos demostraron no ser citotóxicos.

Figura 5: La citotoxicidad medida a través del ensayo de lactato deshidrogenasa (LDH). Los datos se presentan como valores relativos al control, tejidos no tratados (CTRL); media ± SEM, n=9 (Tritón X-100), n=8 (LPS), n=3 (TNF-α). La significación se probó con ANOVA unidireccional, la prueba de comparación múltiple de Dunnett. Asterisco denota diferencia estadísticamente significativa en comparación con CTRL, ****p < 0.0001). Haga clic aquí para ver una versión más amplia de esta figura.
La liberación de interleucina 1 alfa (IL-1α) e interleucina 8 (IL-8) en el medio RhE se cuantificó mediante ELISAs. La Figura 6 muestra tanto la liberación cuantificada y relativa de IL-1α como de IL-8 por parte de los RhEs tras el desafío con LPS y TNF-α. El tratamiento con LPS dio lugar a una liberación inducida estadísticamente significativa (p < 0,05, prueba T de Student no emparejada) de IL-8 (9,6 ± aumento de 1,0 veces) e IL-1α (2,7 ± aumento de 1,3 veces). TNF-α no indujo perceptiblemente el lanzamiento IL-8, aunque una tendencia de los niveles crecientes IL-8 fue observada (aumento 2,3 ± 0,8 dobleces). Sin embargo, TNF-α perceptiblemente (p < 0,05, T-prueba de estudiante desapareada) accionaron el lanzamiento de IL-1α (aumento 1,8 ± 0,5 dobleces).
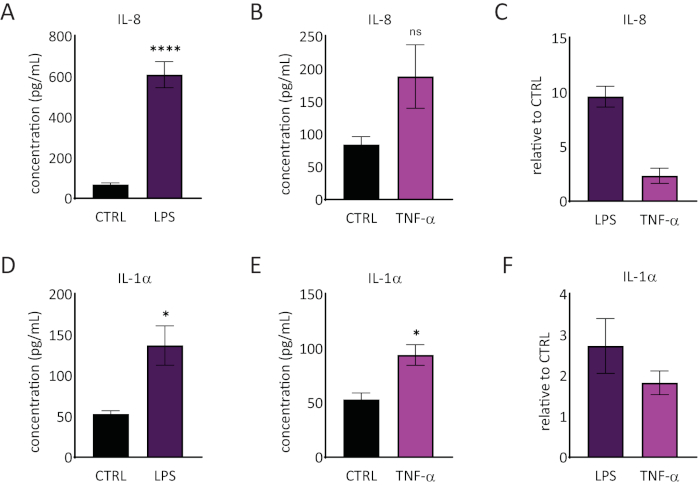
Figura 6: Respuestas proinflamatorias en la epidermis humana reconstruida. Concentraciones de liberación de IL-8 por el RhE sobre un desafío de 24 horas con LPS(A)y TNF-α (B). Los datos se representan como media ± SEM, n=8 (LPS), n=3 (TNF-α). (C)Los datos se representan como la media del valor relativo en comparación con el control, los tejidos no tratados (CTRL) ± SEM, n = 8 (LPS), n = 3 (TNF-α). La concentración de IL-1α liberación de la RhE en un desafío de 24 horas con LPS(D)y TNF-α(E). Los datos se representan como media ± SEM, n=8 (LPS), n=3 (TNF-α). (F) Los datos se representan como la media del valor relativo en comparación con CTRL ± SEM, n = 4 (LPS), n = 3 (TNF-α). La significación fue probada por una T-prueba de Student despareada. El asterisco denota diferencias estadísticamente significativas en comparación con CTRL, *p < 0,05, ****p < 0,0001). Haga clic aquí para ver una versión más amplia de esta figura.
Discusión
Las RTe son ampliamente utilizadas como herramientas de cribado en los campos farmacéutico y dermato-cosmético36,75,76,77,78. Aunque varias compañías han puesto a disposición comercialmente tales RhEs, siguen siendo costosas y limitan la posibilidad de variar los parámetros de cultivo según sea necesario para abordar nuevas preguntas de investigación. Este trabajo describe el procedimiento de producción de rhEs internos de una manera robusta y confiable y proporciona una caracterización detallada de los tejidos obtenidos para confirmar la relevancia del modelo como un enfoque alternativo a la experimentación con animales.
Algunos de los pasos en el protocolo son cruciales para asegurar la diferenciación adecuada de queratinocitos y la reproducibilidad rhE. Esto se puede llevar a cabo utilizando las células óptimas, el tipo de medio (s), y las condiciones de cultivo. En el modelo de RhE propuesto, los NHEKs neonatales fueron seleccionados por su falta de exposición antigénica, en comparación con los NHEKs adultos. Además, los queratinocitos se limitaron a la etnia caucásica para evitar la variabilidad entre especies. Los queratinocitos primarios se utilizan típicamente por su capacidad para diferenciar y estratificar79. Se pueden obtener comercialmente o por aislamiento interno de la piel adulta80. El cultivo de una línea celular (es decir, HaCaT) en una membrana de policarbonato, ha demostrado fallar la diferenciación y ha demostrado una capacidad deteriorada para sintetizar lípidos que son necesarios para la formación de barreras81. Sin embargo, la inclusión de diferentes matrices de cultivo, como hidrogeles, colágeno, fibrina y esferoides, resultó en el desarrollo exitoso de modelos de piel 3D.78,82,83,84,85,86. Las líneas celulares inmortalizadas, N/TERT, han demostrado ser adecuadas para el desarrollo de RhEs35. Los queratinocitos primarios siguen siendo proliferativos en su cuarto o quinto paso61, por lo tanto, el protocolo actual incluye el uso de queratinocitos en su tercer paso. De Vuyst et al. han demostrado que la densidad de siembra celular es de importancia y debe ser suficiente (es decir, ≥ 2.5x105 células/cm2) para garantizar que el medio del compartimento basolateral no se difunda al compartimento apical. Una densidad de siembra insuficiente (es decir, < 2.5x105 células/cm2) puede resultar en una incapacidad para formar una barrera adecuada, que se indica por la difusión del medio desde el basolateral al compartimento apical, lo que resulta en condiciones de cultivo sumergido en lugar de ALI62. Medio de crecimiento de queratinocitos sin suero (ver Tabla de Materiales) se prefirió a efectos de reproducibilidad, ya que ofrece la ventaja de trabajar con un medio químicamente definido y reduce el riesgo de contaminación. Este medio tiene una menor concentración de calcio (es decir, 60 μM) y por lo tanto estimula la proliferación de queratinocitos87. El aumento de la concentración de calcio (es decir, 1,5 mM) desde el primer paso del cultivo de RhE, favorece la diferenciación de queratinocitos y la formación de barreras cutáneas y la homeostasis49. Además, el medio ALI se complementa con ácido ascórbico, que ha demostrado ser crucial para la formación de lípidos SC y para promover la diferenciación52,53,54. El medio ALI también contiene KGF, que es un factor de crecimiento secretado por fibroblastos que pueden unirse a los receptores transmembrana de queratinocitos y tras la activación tiene un doble papel en la diferenciación y reparación de heridas55,88. Es importante refrescar el medio ALI en intervalos de tiempo específicos, para proporcionar un suministro constante de nutrientes frescos a los RhEs. El uso de un sistema de placa portadora es crucial para el cultivo de RhE a mayor escala (es decir, 24 insertos/placa). Ofrece la ventaja de ahorrar tiempo, reducir el riesgo de contaminación y deja menos espacio para la introducción de errores humanos. También proporciona la posibilidad de cultivar RhEs en un alto volumen de medios (es decir, 1,5 mL), lo que reduce el número requerido de actualizaciones de medios ALI. Además, ofrece la posibilidad de transferir una placa completa de inserciones a una placa con medio fresco, evitando el contacto con las inserciones individualmente o descubriendo la tapa de la placa.
Hay varias limitaciones del modelo RhE que deben tenerse en cuenta. En la piel humana nativa hay un equilibrio entre la proliferación de queratinocitos en la capa basal y el desprendimiento de corneocitos en el SC (es decir, descamación)89. Sin embargo, in vitro, la descamación no tiene lugar. Por lo tanto, los corneocitos permanecen unidos al RhE y forman un SC grueso que es menos relevante fisiológicamente. Por lo tanto, hay un tiempo de cultivo limitado de RhEs. Además, este modelo de RhE es simple y directo, ya que consiste en un tipo de célula singular, es decir, el queratinocitos, que es el tipo celular más abundante de la epidermis. Sin embargo, hay otros tipos de células residentes en la epidermis, como melanocitos, células dendríticas (es decir, células de Langerhans), células T (por ejemplo, CD8+ células), y células de Merkel13. Para mejorar la relevancia fisiológica del modelo de piel, los investigadores han hecho que los modelos de piel sean más complejos mediante la adición de melanocitos38 , células inmunitarias39, o células derivadas del paciente90. Uno debe tener en cuenta que las propiedades de barrera de los modelos de piel humana son diferentes en comparación con la piel humana nativa, debido a una composición lipídica SC notablemente diferente y una mayor permeabilidad de barrera 91,92,93,94,95. Sin embargo, varios estudios han reportado cambios en las propiedades de barrera de los modelos de piel humana por el cultivo bajo hipoxia96 o disminución de la humedad relativa97, la modulación de la matriz dérmica con quitosano98, y alteración de los ácidos grasos libres en el medio de cultivo99. Por otra parte, en RhEs simples y más complejos, las condiciones de la cultura y la composición media se pueden modular para mímico características patológicas. Desafiando el modelo con cytokines, una morfología anormal100 y se pueden establecer alteraciones en los niveles de expresión de genes y proteínas que se observan típicamente en trastornos comunes de la piel, como dermatitis atópica y psoriasis35,101,102,103,104,105. Silenciar genes específicos en queratinocitos antes de iniciar el proceso de reconstitución del modelo 3D es otro enfoque utilizado para imitar las características de los trastornos de la piel e investigar nuevas soluciones terapéuticas106,107. Además de modelar solo una capa epidérmica, se puede incluir un compartimento dérmico en el modelo (es decir, los equivalentes de piel humana nombrados o los modelos de espesor completo) mediante la incrustación de fibroblastos en una matriz de colágeno antes de la reconstitución de RhE, lo que lo hace más relevante fisiológicamente y adecuado para el envejecimiento y los estudios relacionados con la cicatrización de heridas.108,109,110. Además, se han añadido esferoides tumorales a los equivalentes de la piel humana para estudiar la progresión del melanoma111,112. Los últimos avances en el campo de los modelos de piel son la bioimpresión y la piel en un chip. Múltiples grupos de investigación han tenido éxito recientemente en el desarrollo de equivalentes de piel bioimpresos (perfusibles)45,113,114. El protocolo propuesto aprovecha un formato de 24 pozos y una placa portadora, evitando inserciones para ser manipuladas individualmente. Sin embargo, la escala de estudio es todavía bastante limitada y carece de automatización. Al implementar el uso de bioimpresión o skin-on-a-chip, se pueden utilizar modelos de piel más pequeños con procesos más automatizados y a mayor escala.
El RhE descrito en este protocolo tiene semejanzas múltiples a los modelos epidérmicos comerciales ya desarrollados y bien caracterizados. El análisis morfológico ha demostrado que aunque el número de capas viables en el modelo RhE propuesto es menor en comparación con el de la piel humana nativa (es decir, 6-7 en comparación con 7-14), es comparable al del modelo EpiDerm RhE (es decir, 8-12)70. De manera similar a los modelos EpiDerm, EpiSkin y SkinEthic, la capa superior de RhE muestra un patrón de tejido de cesta de capas de corneocitos densamente empaquetadas28. Por otra parte, el análisis tem reveló que el número de capas sc en el modelo rhE propuesto (es decir, 15-25) es comparable a la de EpiDerm (es decir, 16-25)70. En general, el modelo de RhE propuesto demuestra una estructura similar a la de otros modelos epidérmicos comercializados, imitando la epidermis humana nativa. La integridad tisular medida por TEER está en rango con los modelos comerciales de RhE (es decir, entre 3000-5600 Ω.cm2)71,72,73 y otros RhEs internos (es decir, aproximadamente 5000 Ω.cm2)74,115. El modelo de RhE propuesto muestra estar bien diferenciado, como lo indica la presencia y correcta localización de marcadores de diferenciación y adhesión tisular. Por otra parte, el modelo propuesto del RhE muestra para ser responsivo a los estímulos proinflammatory (es decir, LPS y TNF-α).
Para concluir, el protocolo actual muestra cómo producir RhEs de una manera confiable y a una escala relativamente grande para satisfacer las necesidades de los investigadores tanto en instituciones académicas como privadas. El modelo de RhE propuesto muestra tener una morfología similar, diferenciación epidérmica y capacidad de respuesta biológica a otros modelos comerciales existentes. Proporciona una herramienta alternativa tanto para el campo farmacéutico como para el dermato-cosmético cuando se requiere acceso a un modelo de piel relevante.
Divulgaciones
Marc Eeman y Benedetta Petracca son empleados de Dow Silicones Belgium. Todos los demás autores no tienen nada que revelar.
Agradecimientos
El Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea en el marco de la beca Marie Skłodowska-Curie con el acuerdo de subvención nº 765602 financiado este trabajo. Todos los autores reconocen el apoyo de la Fundación Adolphe Merkle y la Universidad de Ferrara y agradecen a Dow Silicones Belgium. El Dr. Miguel Spuch-Calvar es reconocido por preparar las imágenes gráficas del proceso de cultivo de RhE. Los autores agradecen a la Dra. Barbara Drasler, al Dr. Franco Cervellati y a la Dra. Agnès Tessier por su apoyo técnico y sus discusiones.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma Aldrich | A6283 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Antibiotic-antimycotic (100x) | Thermo Fisher Scientific (Gibco) | 15240062 | |
| Aqueous Eosin Y solution | Sigma Aldrich | HT110280 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Calcium chloride (CaCl2) | Sigma Aldrich or Merck | C8106 or 1.02378.0500 | Prepare a stock solution of 0.144 M, filter sterilize and store aliquots at -20 °C. It is recommended to prepare new aliquots every 6 months. |
| DAPI | Roche | 10236276001 | Prepare a stock at 100 μg/mL and store aliquots at -20 °C. Working conditon is 1 μg/mL. |
| Entellan mounting medium | Merck | 1.07960.0500 | Mounting medium for H&E staining. |
| EpiLife medium (referred to as keratinocyte growth medium) | Thermo Fisher Scientific (Gibco) | MEPI500CA | Contains 0.06 mM of Ca2+. |
| Ethanol absolute | Any supplier | N/A | |
| Formalin 10% | Leica Biosystems | 3800770 | |
| Human keratinocytes growth supplement (HKGS) (100x) | Thermo Fisher Scientific (Gibco) | S0015 | To reach final concentrations of 0.2% [v/v] BPE, 0.2 ng/mL human recombinant EGF, 0.18 μg/mL hydrocortisone,5 μg/mL bovine transferrin, and 0.01 µg/mL human recombinant insulin-like growth factor-I. |
| Isopropanol | Biosolve B.V. | 0016264102BS | |
| Kaiser's glycerol gelatine, phenol-free | Merck | 1.08635.0100 | Mounting medium for IF staining. |
| Keratinocyte growth factor (KGF) | R&D Systems | 251-KG-050 | Reconstitute KGF protein at 100 μg/mL in sterile 0.1% [w/v] BSA in PBS. Prepare aliquots and store at -20°C. |
| Lactate dehydrogenase (LDH) assay kit | Roche | 4744926001 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | Prepare a stock solution of 25 mg/mL, filter sterilize and store aliquots at -20°C. It is recommended to prepare new aliquots every 6 months. Store in the dark. |
| Lipopolysaccharide (LPS), E.coli strain O55:B5 | Sigma-Aldrich | L4524 | Prepare a stock of 1 mg/mL in sterile PBS and store aliquots at -20 °C. Working concentration is 100 μg/mL. |
| Mayer’s Haematoxylin | Sigma-Aldrich | MHS80 | |
| Normal human epidermal keratinocytes (NHEKs) | Lonza | 00192906 | Human primary keratinocytes isolated from neonatal foreskin, pooled from at least three donors. |
| Phosphate-buffered saline | Thermo Fisher Scientific (Gibco) | 10010056 or 10010-015 | Reference numbers can vary between countries. |
| Recombinant tumor necrosis factor alpha (TNF-α) | ImmunoTools | 11344483 | Prepare a stock of 100 μg/mL in sterile ultrapure water. Working concentration is 40 ng/mL |
| Sterile ultrapure water | Any supplier | N/A | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M5655 | Prepare a stock of 5 mg/mL MTT in sterile PBS. Working concentration is 1 mg/mL. |
| Triton X-100 | Sigma-Aldrich | 93426 | |
| Trypan blue (0.4% [v/v]) | Any supplier | N/A | |
| Trypsin inhibitor | Thermo Fisher Scientific (Gibco) | R007100 | |
| Trypsin/EDTA (0.05% [v/v]) | Thermo Fisher Scientific (Gibco) | 25300054 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | Ab150113 | |
| Tri-sodium citrate dihydrate | Merck | 1.06448.0500 | For antigen retrieval buffer for IF staining. |
| Goat Anti-Rabbit IgG H&L (Dylight 488) | Agrisera | AS09 633 | |
| Filaggrin Mouse antibody | BioTechne (Novus Biologicals) | NBP2-53243 | |
| Involucrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP2-33742 | |
| Keratin 10 Mouse antibody | BioTechne (Novus Biologicals) | NBP2-32962 | |
| Desmoglein-1 Mouse antibody | BioTechne (Novus Biologicals) | MAB944 | |
| Loricrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP1-33610 |
Referencias
- Alberts, B., Johnson, A., Lewis, J. . Molecular Biology of the Cell. 4th edition. Antioxidants & Redox Signaling. , (2002).
- Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., Polla, B. S. The stratum corneum: a double paradox. Journal of Cosmetic Dermatology. 7 (2), 143-148 (2008).
- Moore, K. L., Dalley, A. F. . Clinically Orientated Anatomy. , (2010).
- Barthel, R., Aberdam, D. Epidermal stem cells. Journal of the European Academy of Dermatology and Venereology. 19 (4), 405-413 (2005).
- Green, K. J., Simpson, C. L. Desmosomes: new perspectives on a classic. Journal of Investigative Dermatology. 127 (11), 2499-2515 (2007).
- Feingold, K. R. Lamellar bodies: the key to cutaneous barrier function. Journal of Investigative Dermatology. 132 (8), 1951-1953 (2012).
- Elias, M. P., Feingold, K. R., Fartasch, M. The epidermal lamellar body as a multifunctional secretory organelle. Skin Barrier. , 261-272 (2006).
- Tobin, D. J. Biochemistry of human skin-our brain on the outside. Chemical society reviews. 35 (1), 52-67 (2006).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12), 2080-2095 (2006).
- Weinstein, G. D., McCullough, J. L., Ross, P. Cell proliferation in normal epidermis. Journal of Investigative Dermatology. 82 (6), 623-628 (1984).
- Madison, K. C. Barrier function of the skin: "la raison d'être" of the epidermis. Journal of Investigative Dermatology. 121 (2), 231-241 (2003).
- Suter, M. M., et al. The keratinocyte in epidermal renewal and defence. Veterinary Dermatology. 20 (5-6), 515-532 (2009).
- McLafferty, E., Hendry, C. The integumentary system: anatomy, physiology and function of skin. Nursing Standard. 27 (7), 35-43 (2012).
- Monteiro-Riviere, N. A. . Toxicology of the skin. , (2010).
- Dellambra, E., Odorisio, T., D'Arcangelo, D., Failla, C. M., Facchiano, A. Non-animal models in dermatological research. ALTEX. 36 (2), 177-202 (2019).
- Gordon, S., et al. Non-animal models of epithelial barriers (skin, intestine and lung) in research, industrial applications and regulatory toxicology. Altex. 32 (4), 327-378 (2015).
- Kandárová, H., et al. The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests - An assessment of the performance of the optimised test. Alternatives to laboratory animals : ATLA. 33 (4), 351-367 (2005).
- Kandárová, H., et al. Assessment of the skin irritation potential of chemicals by using the SkinEthic reconstructed human epidermal model and the common skin irritation protocol evaluated in the ECVAM skin irritation validation study. Alternatives to laboratory animals : ATLA. 34 (4), 393-406 (2006).
- OECD. Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. OECD. , (2019).
- Alépée, N., Grandidier, M. H., Cotovio, J. Sub-categorisation of skin corrosive chemicals by the EpiSkinTM reconstructed human epidermis skin corrosion test method according to UN GHS: Revision of OECD Test Guideline 431. Toxicology in Vitro. 28 (2), 131-145 (2014).
- OECD. Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method. OECD. , (2019).
- Mehling, A., et al. In vitro RHE skin sensitisation assays: applicability to challenging substances. Regulatory Toxicology and Pharmacology. 108, 104473 (2019).
- . SENS-IS | EURL ECVAM - TSAR Available from: https://tsar.jrc.ec.europa.eu/test-method/tm2011-11 (2020)
- Lelièvre, D., et al. The episkin phototoxicity assay (EPA): development of an in vitro tiered strategy using 17 reference chemicals to predict phototoxic potency. Toxicology in Vitro. 21 (6), 977-995 (2007).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Pellevoisin, C., Bouez, C., Cotovio, J. Cosmetic industry requirements regarding skin models for cosmetic testing. Skin Tissue Models. , 3-37 (2018).
- Niehues, H., et al. 3D skin models for 3R research: the potential of 3D reconstructed skin models to study skin barrier function. Experimental Dermatology. 27 (5), 501-511 (2018).
- Netzlaff, F., Lehr, C. -. M., Wertz, P. W., Schaefer, U. F. The human epidermis models EpiSkin®, SkinEthic® and EpiDerm®: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport. European Journal of Pharmaceutics and Biopharmaceutics. 60 (2), 167-178 (2005).
- Prieux, R., Eeman, M., Rothen-Rutishauser, B., Valacchi, G. Mimicking cigarette smoke exposure to assess cutaneous toxicity. Toxicology in Vitro. 62, 104664 (2020).
- Petracca, B., Rothen-Rutishauser, B., Valacchi, G., Eeman, M. Bench approaches to study the detrimental cutaneous impact of troposperic ozone. Journal of Exposure Science and Environmental Epidemiology. 31, 137-148 (2021).
- Dijkhoff, I. M., et al. Impact of airborne particulate matter on skin: a systematic review from epidemiology to in vitro studies. Particle and fibre toxicology. 17 (1), 35 (2020).
- El Ghalbzouri, A., Siamari, R., Willemze, R., Ponec, M. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential according to the ECVAM guidelines. Toxicology in Vitro. 22 (5), 1311-1320 (2008).
- Chacón, M., et al. Development of an in-house reconstructed human epidermis model as an alternative method in skin corrosion assessment. Toxicology in Vitro. 65, 104779 (2020).
- Pedrosa, T. d. o. N., et al. A new reconstructed human epidermis for in vitro skin irritation testing. Toxicology in Vitro. 42, 31-37 (2017).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Poumay, Y., Coquette, A. Modelling the human epidermis in vitro: tools for basic and applied research. Archives of dermatological research. 298 (8), 361-369 (2007).
- Rikken, G., Niehues, H., van den Bogaard, E. H. Organotypic 3D skin models: human epidermal equivalent cultures from primary keratinocytes and immortalized keratinocyte cell lines. Methods in Molecular Biology. 2154, 45-61 (2020).
- Duval, C., et al. Human skin model containing melanocytes: essential role of keratinocyte growth factor for constitutive pigmentation-functional response to α-melanocyte stimulating hormone and forskolin. Tissue engineering. Part C, Methods. 18 (12), 947-957 (2012).
- Hutter, V., Kirton, S. B., Chau, D. Y. S. Immunocompetent human in vitro skin models. Skin Tissue Models. , 353-373 (2018).
- Kinsner, A., Lesiak-Cyganowska, E., Śladowski, D. In vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking. 2 (3), 165-171 (2001).
- Black, A. F., Bouez, C., Perrier, E., Schlotmann, K., Chapuis, F., Damour, O. Optimization and characterization of an engineered human skin equivalent. Tissue Engineering. 11 (5-6), 723-733 (2005).
- Reijnders, C. M. A., et al. Development of a full-thickness human skin equivalent in vitro model derived from TERT-immortalized keratinocytes and fibroblasts. Tissue Engineering. Part A. 21 (17-18), 2448-2459 (2015).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering - In vivo and in vitro applications. Advanced Drug Delivery Reviews. 63 (4-5), 352-366 (2011).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Pittelkow, M. R., Scott, R. E. New techniques for the in vitro culture of human skin keratinocytes and perspectives on their use for grafting of patients with extensive burns. Mayo Clinic Proceedings. 61 (10), 771-777 (1986).
- Elias, P. M., Ahn, S. K., Brown, B. E., Crumrine, D., Feingold, K. R. Origin of the epidermal calcium gradient: regulation by barrier status and role of active vs passive mechanisms. Journal of Investigative Dermatology. 119 (6), 1269-1274 (2002).
- Elias, P. M., et al. Modulations in epidermal calcium regulate the expression of differentiation-specific markers. Journal of Investigative Dermatology. 119 (5), 1128-1136 (2002).
- Lee, S. E., Lee, S. H. Skin barrier and calcium. Annals of Dermatology. 30 (3), 265-275 (2018).
- Prunieras, M., Regnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. Journal of Investigative Dermatology. 81, 28-33 (1983).
- Poumay, Y., et al. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Archives of Dermatological Research. 296 (5), 203-211 (2004).
- Ponec, M., et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Savini, I., et al. Characterization of keratinocyte differentiation induced by ascorbic acid: Protein kinase C involvement and vitamin C homeostasis. Journal of Investigative Dermatology. 118 (2), 372-379 (2002).
- Pasonen-Seppänen, S., et al. Vitamin C enhances differentiation of a continuous keratinocyte cell line (REK) into epidermis with normal stratum corneum ultrastructure and functional permeability barrier. Histochemistry and Cell Biology. 116 (4), 287-297 (2001).
- Beer, H. D., et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 34-39 (2000).
- Steven, A. C., Bisher, M. E., Roop, D. R., Steinert, P. M. Biosynthetic pathways of filaggrin and loricrin--two major proteins expressed by terminally differentiated epidermal keratinocytes. Journal of structural biology. 104 (1-3), 150-162 (1990).
- Rice, R. H., Thacher, S. M. Involucrin: a constituent of cross-linked envelopes and marker of squamous maturation. Biology of the Integument. , 752-761 (1986).
- Elias, P. M., Barrier Feingold, K. R. . Skin Barrier. , (2011).
- Marionnet, C., et al. Morphogenesis of dermal-epidermal junction in a model of reconstructed skin: beneficial effects of vitamin C. Experimental Dermatology. 15 (8), 625-633 (2006).
- Frikke-Schmidt, H., Lykkesfeldt, J. Keeping the intracellular vitamin C at a physiologically relevant level in endothelial cell culture. Analytical Biochemistry. 397 (1), 135-137 (2010).
- Castro-Muñozledo, F., Hernández-Quintero, M., Marsch-Moreno, M., Kuri-Harcuch, W. Cultivation, serial transfer, and differentiation of epidermal keratinocytes in serum-free medium. Biochemical and Biophysical Research Communications. 236 (1), 167-172 (1997).
- De Vuyst, E., et al. Reconstruction of normal and pathological human epidermis on polycarbonate filter. Epidermal Cells. Methods in Molecular Biology (Methods and Protocols. , 191-201 (2013).
- Chen, R. H., Zhu, J., Zhang, R. Z., Wang, S. Y., Li, Y. The tolerance of human epidermal cells to trypsinization in vitro. Cell and Tissue Banking. 21 (2), 257-264 (2020).
- Pohanish, R. P. . Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2, (2012).
- Tsaousis, K. T., et al. Time-dependent morphological alterations and viability of cultured human trabecular cells after exposure to Trypan blue. Clinical and Experimental Ophthalmology. 41 (5), 484-490 (2013).
- Kim, S. I., et al. Application of a non-hazardous vital dye for cell counting with automated cell counters. Analytical Biochemistry. 492, 8-12 (2016).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Fartasch, M., Ponec, M. Improved barrier structure formation in air-exposed human keratinocyte culture systems. Journal of Investigative Dermatology. 102 (3), 366-374 (1994).
- Bouwstra, J. A., Honeywell-Nguyen, P. L., Gooris, G. S., Ponec, M. Structure of the skin barrier and its modulation by vesicular formulations. Progress in Lipid Research. 42 (1), 1-36 (2003).
- Ponec, M., Boelsma, E., Gibbs, S., Mommaas, M. Characterization of reconstructed skin models. Skin Pharmacology and Physiology. 15 (1), 4-17 (2002).
- Hubaux, R., Wauters, A., Chrétien, A., Poumay, Y., Salmon, M. Reconstructed human epidermis response to urban particulate matter activates multiple stress-related pathways and impacts the skin barrier function. 23th IFSCC Conference. , 125-134 (2017).
- Lin, Y. -. C., et al. Testing method development and validation for in vitro skin irritation testing (SIT) by using reconstructed human epidermis (RhE) skin equivalent - EPiTRI®. Alternatives to Animal Testing. , 8-19 (2019).
- Alexander, F. A., Eggert, S., Wiest, J. Skin-on-a-chip: Transepithelial electrical resistance and extracellular acidification measurements through an automated air-liquid interface. Genes. 9 (2), 114 (2018).
- van den Bogaard, E., et al. Perspective and consensus opinion: good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Kandárová, H., Hayden, P., Klausner, M., Kubilus, J., Sheasgreen, J. An in vitro skin irritation test (SIT) using the EpiDerm reconstructed human epidermal (RHE) model. Journal of Visualized Experiments. (29), e1366 (2009).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical pharmacology advances and applications. 8, 163-176 (2016).
- De Wever, B., Kurdykowski, S., Descargues, P. Human skin models for research applications in pharmacology and toxicology: introducing nativeSkin, the "missing link" bridging cell culture and/or reconstructed skin models and human clinical testing. Applied In Vitro Toxicology. 1 (1), 26-32 (2015).
- Klicks, J., von Molitor, E., Ertongur-Fauth, T., Rudolf, R., Hafner, M. In vitro skin three-dimensional models and their applications. Journal of Cellular Biotechnology. 3 (1), 21-39 (2017).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cellular and Developmental Biology - Animal. 22 (12), 695-705 (1986).
- Johansen, C. Generation and culturing of primary human keratinocytes from adult skin. Journal of Visualized Experiments. (130), e56863 (2017).
- Boelsma, E., Verhoeven, M. C. H., Ponec, M. Reconstruction of a human skin equivalent using a spontaneously transformed keratinocyte cell line (HaCaT). Journal of Investigative Dermatology. 112 (4), 489-498 (1999).
- Zhao, X., et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering. Advanced Healthcare Materials. 5 (1), 108-118 (2016).
- Peura, M., et al. Paracrine factors from fibroblast aggregates in a fibrin-matrix carrier enhance keratinocyte viability and migration. Journal of Biomedical Materials Research. Part A. 95 (2), 658-664 (2010).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCat keratinocytes in organotypic coculture with human dermal fibroblasts. Journal of Investigative Dermatology. 112 (3), 343-353 (1999).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue engineering. Part C, Methods. 20 (6), 473-484 (2014).
- Alameda, J. P., et al. IKKα regulates the stratification and differentiation of the epidermis: Implications for skin cancer development. Oncotarget. 7 (47), 76779-76792 (2016).
- Bikle, D. D., Xie, Z., Tu, C. L. Calcium regulation of keratinocyte differentiation. Expert Review of Endocrinology and Metabolism. 7 (4), 461-472 (2012).
- Staiano-Coico, L., et al. Human keratinocyte growth factor effects in a porcine model of epidermal wound healing. Journal of Experimental Medicine. 178 (3), 865-878 (1993).
- Egelrud, T. Desquamation in the stratum corneum. Acta Dermato-Venereologica. 80, 44-45 (2000).
- Jean, J., Lapointe, M., Soucy, J., Pouliot, R. Development of an in vitro psoriatic skin model by tissue engineering. Journal of Dermatological Science. 53 (1), 19-25 (2009).
- Lotte, C., Patouillet, C., Zanini, M., Messager, A., Roguet, R. Permeation and skin absorption: reproducibility of various industrial reconstructed human skin models. Skin Pharmacology and Applied Skin Physiology. 15, 18-30 (2002).
- Ponec, M., Weerheim, A., Lankhorst, P., Wertz, P. New acylceramide in native and reconstructed epidermis. Journal of Investigative Dermatology. 120 (4), 581-588 (2003).
- Thakoersing, V. S., et al. Unraveling barrier properties of three different in-house human skin equivalents. Tissue engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Thakoersing, V. S., et al. presence of monounsaturated fatty acids in the stratum corneum of human skin equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Van Smeden, J., et al. Combined LC/MS-platform for analysis of all major stratum corneum lipids, and the profiling of skin substitutes. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1841 (1), 70-79 (2014).
- Mieremet, A., et al. Human skin equivalents cultured under hypoxia display enhanced epidermal morphogenesis and lipid barrier formation. Scientific Reports. 9 (1), 7811 (2019).
- Mieremet, A., et al. Unravelling effects of relative humidity on lipid barrier formation in human skin equivalents. Archives of Dermatological Research. 311 (9), 679-689 (2019).
- Mieremet, A., Rietveld, M., Absalah, S., Van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by Chitosan modulated dermal matrices. PLoS ONE. 12 (3), 0174478 (2017).
- Mieremet, A., et al. Contribution of palmitic acid to epidermal morphogenesis and lipid barrier formation in human skin equivalents. International Journal of Molecular Sciences. 20 (23), 6069 (2019).
- Boniface, K., et al. IL-22 inhibits epidermal fifferentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- De Vuyst, E., Salmon, M., Evrard, C., Lambert de Rouvroit, C., Poumay, Y. Atopic dermatitis studies through in vitro models. Frontiers in Medicine. 4, 119 (2017).
- Danso, M. O., et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents. Journal of Investigative Dermatology. 134 (7), 1941-1950 (2014).
- Soboleva, A. G., Mezentsev, A., Zolotorenko, A., Bruskin, S., Pirusian, E. Three-dimensional skin models of psoriasis. Cells Tissues Organs. 199 (5-6), 301-310 (2014).
- Desmet, E., Ramadhas, A., Lambert, J., Gele, M. Van In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research. Experimental Biology and Medicine. 242 (11), 1158-1169 (2017).
- Niehues, H., van den Bogaard, E. H. Past, present and future of in vitro 3D reconstructed inflammatory skin models to study psoriasis. Experimental Dermatology. 27 (5), 512-519 (2018).
- Pendaries, V., et al. Knockdown of filaggrin in a three-dimensional reconstructed human epidermis impairs keratinocyte differentiation. Journal of Investigative Dermatology. 134 (12), 2938-2946 (2014).
- Niehues, H., et al. Epidermal equivalents of filaggrin null keratinocytes do not show impaired skin barrier function. Journal of Allergy and Clinical Immunology. 139 (6), 1979-1981 (2017).
- Reuter, C., Walles, H., Groeber, F. Preparation of a three-dimensional full thickness skin equivalent. Methods in Molecular Biology. 1612, 191-198 (2017).
- Bataillon, M., et al. Characterization of a new reconstructed full thickness skin model, t-skinTM, and its application for investigations of anti-aging compounds. International Journal of Molecular Sciences. 20 (9), 2240 (2019).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments. (96), e52576 (2015).
- Li, L., Fukunaga-Kalabis, M., Herlyn, M. The three-dimensional human skin reconstruct model: a tool to study normal skin and melanoma progression. Journal of Visualized Experiments. (54), e2937 (2011).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments. (135), e57500 (2018).
- Wei, Z., et al. Two-dimensional cellular and three-dimensional bio-printed skin models to screen topical-use compounds for irritation potential. Frontiers in Bioengineering and Biotechnology. 8, 109 (2020).
- Derr, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated morphology and barrier function. Tissue Engineering - Part C: Methods. 25 (6), 334-343 (2019).
- Frankart, A., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruction at the air-liquid interface. Experimental Dermatology. 21 (11), 871-875 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados