Method Article
טיפוח אפידרמיס אנושי תלת מימדי משוחזר בקנה מידה גדול
In This Article
Summary
פרוטוקול זה מתאר שיטה פשוטה לטיפוח אפידרמיס אנושי תלת מימדי מחדש באופן ניתן לשחזור וחזק. בנוסף, הוא מאפיין את הקשר המבני-פונקציה של מודל מחסום האפידרמיס. התגובות הביולוגיות של האפידרמיס האנושי המחודש על גירויים proinflammatory מוצגים גם.
Abstract
מודל אפידרמיס אנושי תלת מימדי ששוחזר מקרטינוציטים ראשוניים של יילודים מוצג. להלן מתואר פרוטוקול לתהליך הטיפוח ולאפיון המודל. קרטינוציטים ראשוניים של יילודים גדלים שקועים על מוסיף פוליקרבונט חדיר ומרימים לממשק נוזלי האוויר שלושה ימים לאחר הזריעה. לאחר ארבעה עשר ימים של גירוי עם גורמי גדילה מוגדרים וחומצה אסקורבית במדיום תרבית סידן גבוהה, המודל מובחן לחלוטין. ניתוח היסטולוגי חשף אפידרמיס מרובד לחלוטין, מחקה את המורפולוגיה של עור אנושי ילידי. כדי לאפיין את המודל ואת פונקציות המחסום שלו, רמות החלבון והלוקליזציה הספציפית לבידול קרטינוציט בשלב מוקדם (כלומר, קרטין 10), בידול בשלב מאוחר (כלומר, אינוולוקרין, לורירין ופילגרין) והדבקת רקמות (כלומר, desmoglein 1), הוערכו על ידי כשל חיסוני. שלמות מחסום הרקמה הוערכה עוד יותר על ידי מדידת התנגדות חשמלית טרנספיתליאלית. אפידרמיס אנושיeconstructed היה מגיב גירויים proinflammatory (כלומר, lipopolysaccharide ו גורם נמק הגידול אלפא), המוביל שחרור ציטוקינים מוגברת (כלומר, interleukin 1 אלפא ואינטרלוקין 8). פרוטוקול זה מייצג שיטת במבחנה פשוטה הניתנת לשחזור כדי לטפח אפידרמיס אנושי משוחזר ככלי להערכת השפעות סביבתיות ומגוון רחב של מחקרים הקשורים לעור.
Introduction
האפידרמיס הוא השכבה החיצונית ביותר של העור, בממשק הישיר בין גוף האדם לסביבה החיצונית. תפקידיו העיקריים הם לספק הגנה והידרציה1. האפידרמיס פועל כמחסום פיזי יעיל נגד גורמים חיצוניים ומונע אובדן מים מוגזם מהגוף. תפקודי עור אלה תלויים בעיקר בסידור התאי בשכבות החיצוניות ביותר של העור, בהרכב ובארגון השומנים הבין-תאיים2. האפידרמיס מורכב בעיקר מקרטינוציטים הנודדים כלפי מעלה לצד החיצוני של הרקמה ועוברים בידול. ישנן 4-5 שכבות אפידרמיס המאופיינים בשלב הבידול שלהן. מבפנים החוצה, שכבות האפידרמיס מתחילות מהאפידרמיס בר קיימא, כלומר, השכבה basale (SB), ספינוסום השכבה (SS), ואת גרנולוזום השכבה (SG), לשכבה העליונה שאינה בת קיימא, כלומר, קרן השכבה (SC)3. שכבת הבסיס מורכבת בעיקר מקרטינוציטים מועשרים בקרטין מתרבים, הנודדים דרך ה- SS עם הבידול4. במהלך התבגרות קרטינוציט, מתרחשים שינויים שונים בביטוי ובמבנה החלבון. קרטינוציטים דבקים בהיווצרות צמתים דמוסומליים5. בס"ג, דור גופי המללר הוא יזם. הם מורכבים מבשרי שומנים ואנזימים החיוניים להיווצרות תפקוד מחסום העור6. SG מאופיין גם על ידי נוכחות של גרגירי keratohyalin בציטופלסמה של קרטינוציטים. בממשק עם SC, התוכן של גופים lamellar מובלט לתוך החללים הבין תאיים ואת השומנים שאינם קוטב כגון ceramides, כולסטרול, וחומצות שומן חינם להתארגן לתוך bilayers השומנים לאמלרי מוערם כדי ליצור את מטריצת השומנים חוץ תאיים7. ב SC, תאים לאבד את כל אברונים הסלולר כולל הגרעין, בשל תהליכי השפלה אנזימטית לאמץ מורפולוגיה שטוחה. הם מוקפים מעטפה cornified עשוי שכבות חלבון מקושרים, והם מכונים corneocytes8,9. רכיבים דמוסומליים מקושרים למעטפת הקרנית כדי ליצור corneodesmosomes ולקשור את corneocytes יחד. האפיתל שנוצר מתחדש ללא הרף מתאי גזע, עם זמן מחזור של כ 5-6 שבועות10. תהליך הבידול של הקרטינוציטים, שתוצאתו אפידרמיס מרובד לחלוטין, הוא חיוני להיווצרות פונקציית המחסום של העור11.
במהלך פציעה ודלקת, קרטינוציטים לגרום לשינויים מולקולות הידבקות קולטני פני השטח ולהפעיל תגובות proinflammatory באמצעות הפרשת ציטוקינים, כימוקינים, פפטידים מיקרוביאלית12. העור הוא לא רק מחסום פיזי נגד חומרים אקסוגני; הוא משמש גם כחיישן חיסוני בעת חשיפה לפתוגנים. בנוסף, הוא מסדיר את הדיפוזיה של מספר חומרים על פני שכבותיו, כגון תכולת המים כדי להגן על גוף האדם מפני התייבשות. העור מעורב גם בסינתזה של ויטמין D ויש לו פונקציות מטבוליות שונות אחרות3,13,14.
כדי להעריך את ההשפעות השליליות של חומרים אקסוגניים, טוקסיקולוגים הסתמכו במשך עשרות שנים על ניסויים בבעלי חיים, אבל כיום זה לא הגישה המועדפת. מלבד יכולת חיזוי מוגבלת של רעילות אנושית, מודלים של בעלי חיים כרוכים בסוגיות אתיות רבות. האיסור על ניסויים בבעלי חיים בתעשיית הקוסמטיקה וההמלצה לפעול על פי עקרון 3R (כלומר החלפה, הפחתה ועידון) במחקר הובילו לפיתוח שיטות בדיקה חלופיות המבוססות על גישות במבחנה15. מודלים ראשונים של תאי עור במבחנה כבר תוארו בשנות ה -90, והתפתחות מרשימה מתרבויות מונו קרטינוציטים אנושיות פשוטות לאפידרמיס מובחן לחלוטין ומודלים בעובי מלא הושגה16. כיום, הנדסת רקמת העור צברה חשיבות הן בתחום התרופות והן בתחום הדרמטו-קוסמטיקה. בשני העשורים האחרונים, מספר חברות מיסחרו אפידרמיס אנושי תלת מימדי (3D) המשוחזר (RhE) המייצגים כלים סטנדרטיים ומשוחזרים למחקרים הקשורים לעור. מספר דגמי RhE מסחריים מתקבלים לבדיקת עור במבחנה של כימיקלים על פי הנחיות ה-OECD לבדיקת גירוי בעור17,18 (כלומר, הנחיות בדיקה 43919) וקורוזיה בעור20 (כלומר, הנחיות בדיקה 43121). מבחן במבחנה עבור רגישות העור22 (כלומר, SENS-IS assay) נמצא כעת במסלול האישור ותחת ביקורת עמיתים23. ישנם גם מבחנים רבים אחרים שפותחו כי לנצל מודלים מסחריים RhE, כדי להעריך phototoxicity24, כדי לבדוק ניסוחים סמים25, ניסוחים קוסמטיים ומרכיבים פעילים26, כדי ללמוד את תפקוד מחסום העור27 ולבדוק את התגובה הביולוגית לחצים סביבתיים28,29,30,31.
בנוסף לדגמי עור תלת מימדיים זמינים מסחרית, קבוצות מחקר מרובות פיתחו RhEs משלהם32,33,34,35,36,37. Es בתוך הבית מציעים את היתרון לשליטה בתנאי התרבות בהתאם למטרת המחקר. באופן ספציפי, החוקרים יכולים לבחור את הסוג ואת המקור של keratinocytes לשמש לשיחזור מודל האפידרמיס 3D שלהם (כלומר, ראשוני לעומת מונצח, יילודים לעומת גיל, יחיד לעומת בריכה תורמים אקראיים, מין, מוצא אתני, הרגלי חיים בודדים כגון עישון, וכו '). יש להם את האפשרות לשנות את הרכב מדיום התרבות ולשלב גורמי גדילה, ויטמינים, או תרכובות אחרות שיכולות לווסת את הביטוי של חלבוני היעד או שומנים. עם RhEs בתוך הבית, החוקרים יכולים גם לחקור תגובות ביולוגיות ותכונות ביומכניות כפונקציה של מצב הבידול של מודל 3D. בנוסף לפרמטרים אינטואיטיביים אלה, ישנם מאמצים מתמשכים להגביר את המורכבות של מודלים עור 3D ולהפוך אותם רלוונטיים יותר מבחינה פיזיולוגית, למשל על ידי הוספת סוגי תאים אפידרמליים אחרים (למשל מלנוציטים ותאיחיסון) 38,39, על ידי culturing keratinocytes על גבי מטריצת קולגן מאוכלס פיברובלסט40,41,42, ועל ידי הכללת רכיבים של רשת כלי הדם43,44,45.
למרות שניתן לכוונן את תנאי התרבות בהתאם לצרכים ספציפיים, ישנם פרמטרים שיש לכבד כדי להבטיח הן את האיכות ואת הרלוונטיות של RhE. כדי לטפח רקמות RhE, קרטינוציטים אפידרמליים אנושיים נורמליים (NHEKs) נזרעים לתוך תוספות תרבות חדירות ספציפיות אשר קרום סינתטי נקבובי מפריד את הבארות לשני תאים, כלומר, תא apical ו basolateral. נקבוביות הממברנה (כלומר, גודל נקבוביות של 0.4 מיקרומטר) היא כזו שהיא מאפשרת היווצרות של מונולאייר תא בתא האפסי ללא הגירה של תאים לצד הכנס הבסיסי, והאכלת הקרטינוציטים בחומרים מזינים חיוניים מאמצעי התרבות הכלולים בתא הבזולטרלי. בתחילת תהליך ההשבה, NHEKs מתורבתים בתנאים שקועים במשך כמה ימים כדי לאפשר את הדבקותם על הממברנה. רמת הסידן בשני התאים מוגברת בהשוואה לריכוז הסידן המשמש לתרבות הדו-ממד של NHEKs כדי להאט את התפשטות התאים ולקדם במקום זאת את הבידול שלהם46. שיפוע סידן אפידרמלי חיוני כדי לווסת את היווצרות המחסום ואת הומאוסטזיס47,48. רמות סידן גבוהות (כלומר, עד 1.5 מ"מ) לקדם את היווצרותם של צמתים בין תאיים לווסת את היווצרות המעטפה cornified במהלך בידול סופני49. לאחר קרטינוציטים יוצרים monolayer רציף ודבק בחוזקה על הממברנה התומכת, המדיום מהתא apical מוסר ואת תהליך התרבות ממשיך בממשק אוויר נוזלי (עלי) כדי לעורר ריבוד ולהקים מחסום אפידרמיס50,51. תנאי תרבות ספציפיים חיוניים להשגת אפיתל מרובד לחלוטין36. במהלך תהליך ההשבה ב ALI, המדיום בתא basolateral מתווסף פקטורי גדילה קרטינוציט (KGF), אינסולין, סידן, וחומצה אסקורבית. חומצה אסקורבית ממלאת תפקיד מרכזי בהיווצרות מחסום השומנים המתאים SC, דומה מאוד לזה של העור האנושי הילידי52. קרטינוציטים הגדלים במדיום אסקורבי בתוספת חומצה מדגימים פנוטיפ מובחן, עם מספר משופר של גרגירי קרטוהילין, כמו גם לאמלה שומנים בין תאיים מאורגנים ב interstices של corneocytes52. תוספת כזו חיונית כדי לשפר את תפקוד מחסום האפידרמיס על ידי הגדלת תכולת מעטפה cornified והימנעות דלדול של חנויות נוגדות חמצוןהידרופיליות 53,54. KGF, מתווך פרקרין חשוב של התפשטות אפידרמיס ובידול, משמש כדי לעורר את NHEKs55.
החסרונות העיקריים של RhEs בתוך הבית כוללים את אובדן התקינה בין מוסדות מחקר ועוצמה עבודה מוגברת וצריכת זמן (עד 3 שבועות לעומת מודלים מסחריים מוכנים לשימוש). מטרת הנייר הנוכחי היא לטפל בחסרונות אלה, הגדרת הבסיס לייצור בקנה מידה גדול יותר. בנוסף ליתרונות הנ"ל של RhEs בתוך הבית, הפרוטוקול הנוכחי נועד להפחית את השונות התוך-אינטר-משתנה בין הרקמות, להפחית את סיכוני הזיהום ולייעל את תהליך הטיפוח.
הפרוטוקול הנוכחי מתאר שיטה הניתנת לשחזור וחזקה לטיפוח RhEs באמצעות NHEKs יילודים. יתר על כן, הוא מראה תוצאות מייצגות של אפיון המורפולוגיה RhEs, שלמות המחסום, וביטוי של חלבונים ספציפיים לבידול אפידרמיס. המבנה המורפולוגי של ורס נבדק באמצעות מטוקסילין ואאוסין (H&E) מכתימים ומיקרוסקופיית אלקטרונים (TEM). כדי להעריך את שלמות המחסום, נמדדו ההתנגדות החשמלית הטרנס-פידרמלית (TEER) וזמן החשיפה לטריטון X-100 כדי להפחית 50% מכדאיות הרקמות (ET50). היווצרות צמתים desmosomal (כלומר, desmoglein 1) נותח על ידי immunofluorescence (IF) כדי להעריך הידבקות קרטינוציטית. היווצרותם של חלבונים מבניים אפידרמליים (כלומר, involucrin, loricrin, ו filaggrin) הוערך וזוהה עם IF. חלבונים אלה מעורבים בהיווצרות מעטפת החלבון המקושרת מאוד המקיפה את הקורנאוציטים של SC וכתוצאה מכך הם סמנים חשובים לבידול אפידרמיס בשלב מאוחר56,57. בנוסף, IF שימש לניתוח קרטין 10, חלבון המושרה בתאים מובחנים בשלב מוקדם ב- SS58 ונמצא בתוך כל השכבות המובחנות. לבסוף, התגובה של RhE לגירויים פרואינפלמטוריים (כלומר, lipopolysaccharide וגורם נמק הגידול אלפא) נחקרה. רמות האינטרלוקין 1 אלפא (IL-1α) והאינטרלוקין 8 (IL-8) נמדדו במדיית תרבות התא, באמצעות מבחנים אימונוסורבנטיים הקשורים לאנזימים (ELISA).
Protocol
סקור ודבק בשיקולים ובתנאים אתיים לאומיים ובינלאומיים הקשורים לשימוש ברקמות או בתאים אנושיים לפני תכנון וביצוע כל פעילות מחקרית הקשורה לפרוטוקול זה.
הערה: כל השלבים של פרוטוקול זה חייבים להתבצע בתנאים אספטיים. שיטות Biosafety רמה 2 הן הדרישה המינימלית לטיפוח RhEs. יש לנקוט בכל אמצעי הבטיחות הדרושים בעת טיפול בכימיקלים/ריאגנטים המתוארים בפרוטוקול זה.
1. הכנת מדיה של תרבות התא
הערה: ישנם שלושה סוגים שונים של מדיה תרבות ללא סרום המשמש לטיפוח של RhEs (טבלה 1): (i) מדיום הבסיס עם רמת סידן נמוכה (60 μM Ca2 +) המשמש לתרבות 2D של NHEKs; (ii) המדיום השקוע עם רמת סידן גבוהה (1.5 mM Ca2+) המשמש לזריעת NHEKs למערכת הכנסת תרבות התאים; ו-(iii) מדיום ממשק נוזלי-אוויר (ALI) עם רמת סידן גבוהה (1.5 מ"מ Ca2+), חומצה אסקורבית וגורם גדילה קרטינוציט (KGF).
| בינוני | מידע בינוני | כמות נדרשת |
| מדיום בזל | מדיום צמיחה קרטינוציט | 36 מ"ל/24 בארות |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x אנטי-מיקוטי אנטיביוטי | ||
| מדיום שקוע | מדיום צמיחה קרטינוציט | 36 מ"ל/24 בארות |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x אנטי-מיקוטי אנטיביוטי | ||
| + 1.5 מ"מ Ca2+ | ||
| מדיום ממשק נוזלי-אוויר | מדיום צמיחה קרטינוציט | 216 מ"ל/24 בארות |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x אנטי-מיקוטי אנטיביוטי | ||
| + 1.5 מ"מ Ca2+ | ||
| + 50 מיקרוגרם / מ"ל חומצה אסקורבית | ||
| + 10 ננוזל / מ"ל קרטינוציט גורם גדילה |
שולחן 1. טבלת סיכום של המדיה התרבותית השונה המשמשת לטיפוח RhEs. רשימה של מדיה תרבותית שונה עם תוספי מזון.
- הכינו את המדיום הבסיסי.
- להשלים את הבקבוק של 500 מ"ל של מדיום צמיחה keratinocyte (שולחן החומרים)עם 5 מ"ל של תוספי צמיחה קרטינוציט אנושי (HKGS) על מנת להגיע לריכוזים הסופיים של 0.2% [v/v] בור שור תמצית איטוארית (BPE), 0.2 ng/mL גורם גדילה אפידרמיס רקומביננטי אנושי (EGF), 0.18 מיקרוגרם / מ"ל הידרוקורטיזון, 5 מיקרוגרם / מ"ל שור מועבר, ו 0.01 מיקרוגרם / מ"ל של רקומביננטי דמוי אינסולין אנושי פקטורי גדילה-I (IGF-I).
- הוסף 5 מ"ל של 100x אנטיביוטיקה אנטי מיקוטית פתרון המכיל 10,000 יחידות / מ"ל של פניצילין, 10,000 מיקרוגרם / מ"ל של סטרפטומיצין, ו 25 מיקרוגרם / מ"ל של אמפיטריצין B.
- הכינו את המדיום השקוע.
- להשלים את הבקבוק של 500 מ"ל של מדיום צמיחה keratinocyte(שולחן החומרים)עם 5 מ"ל של HKGS על מנת להגיע לריכוזים הסופיים של 0.2% [v/v] BPE, EGF רקומביננטי אנושי 0.2 ng/mL, 0.18 מיקרוגרם / מ"ל הידרוקורטיזון, 5 מיקרוגרם / מ"ל העברת שור, ו 0.01 מיקרוגרם / מ"ל של IGF-I רקומביננטי אנושי.
- הוסף 5 מ"ל של 100x פתרון אנטיביוטי אנטי מיקוטי.
- הוסף 5 מ"ל של 0.144 M CaCl2 (סידן כלורי) פתרון מלאי כדי להגיע לריכוז הסופי של 1.5 mM Ca2 +.
הערה: ריכוז הסידן כבר גדל במהלך השלב השקוע כדי לעורר את הבידול של הקרטינוציטים וליזום את תהליך הריבוד49.
- הכינו את הממשק הנוזלי-אוויר (ALI) בינוני.
- תוספת בקבוק אחד של 500 מ"ל של מדיום צמיחה קרטינוציט(שולחן החומרים)עם 5 מ"ל של HKGS על מנת להגיע לריכוזים הסופיים של 0.2% [v/v] BPE, EGF רקומביננטי אנושי 0.2 ng/mL, 0.18 מיקרוגרם / מ"ל הידרוקורטיזון, 5 מיקרוגרם / מ"ל העברת שור, ו 0.01 מיקרוגרם / מ"ל של IGF-I רקומביננטי אנושי.
- הוסף 5 מ"ל של 100x פתרון אנטיביוטי אנטי מיקוטי.
- הוסף 5 מ"ל של פתרון 0.144 M CaCl2 המניה כדי להגיע לריכוז הסופי של 1.5 mM Ca2+.
- הוסף 1 מ"ל של 25 מ"ג / מ"ל תמיסת מלאי חומצה אסקורבית כדי להגיע לריכוז הסופי של 50 מיקרוגרם / מ"ל חומצה אסקורבית.
- הוסף 50 μL של 100 מיקרוגרם / מ"ל KGF ב 1% [w / v] אלבומין סרום שור בתמיסת מלח אגירה פוספט (PBS) כדי להגיע לריכוז הסופי של 10 ng / mL KGF.
הערה: מכיוון שחומצה אסקורבית רגישה לחמצון, מומלץ להשתמש בחומצה אסקורבית יציבה, כגון מגנזיום l-אסקורביל-2-פוספט59 או חומצה L-אסקורבית 2-פוספט ססקימגנזיום60. אם נעשה שימוש בחומצה אסקורבית, מומלץ להשלים טרי את המדיום ALI עם חומצה אסקורבית לפני כל רענון.
2. תרבות ה-NHEKs
הערה: מכיוון שקרטינוציטים אנושיים ראשוניים נשארים מתרבים בקטע הרביעי או החמישי שלהם61, NHEKs בקטע השלישי שלהם משמשים לטיפוח RhEs. קרטינוציטים ראשוניים צריכים להיות מטופלים בזהירות רבה בשל הרגישות הגבוהה שלהם. צנרת זהירה ואיטית של השעיות תאים בכל עת חשובה מאוד, לא להפריע למצב התאים.
- להפשיר בקבוקון עם 1 x 106 NHEKs cryopreserved באמבט מים ב 37 מעלות צלזיוס, על ידי שקוע חלק של הבקבוקון במים. דגירה את הבקבוקון במשך 1-2 דקות באמבט המים, עד רק רסיס קטן של קרח גלוי.
התראה: אין להטביע את כל הבקבוקון באמבט המים כדי למנוע זיהומים. אין להפשיר את התאים יותר מ-2 דקות; זה יכול להפחית את הכדאיות של התא. לנגב את הבקבוקון עם תמיסת אתנול 70% לפני העברת הצינור לתוך מכסה המנוע למינאר. - Resuspend התאים בזהירות רבה, על ידי pipetting למעלה ולמטה 2-3 פעמים. העבר את המתלה התא לשני בקבוקוני T75 המכילים סך של 15 מ"ל של מדיום הפשרה מחומם מראש, וכתוצאה מכך צפיפות זריעה של 6.7 x 104 תאים / ס"מ2.
הערה: עבור שני הקטעים הראשונים והפשרת NHEKs cryopreserved, מדיום תרבות התא משמש על פי המלצות הספק. - מניחים את הבקבוקים באינקובטור תרבית התא (37 °C (37 °C (5% CO2, ו 95% לחות יחסית (RH)).
- לאחר כ 24 שעות, להחליף את המדיום הפשרה על ידי מדיום הבסיס כדי להסיר דימתיל סולפוקסיד (DMSO) מתמיסת הקפאת קרטינוציט.
- רענן את מדיום הבסיס כל יומיים.
- לאחר 4-6 ימים של טיפוח, התאים צריכים להיות סביב 80% confluent ומוכן זריעה מוסיף לטיפוח של RhEs.
הערה: יש לגדל קרטינוציטים למקסימום 80% מפגש כדי לשמר את הקיבולתשגשוג שלהם62. מספר התאים שיש להפשיר חייב לקחת בחשבון מספר פרמטרים, כגון מספר מעבר התא, הכדאיות של התא בעת הפשרה, יעילות הזריעה כמו גם זמן ההכפלה.
3. זריעת NHEKs
הערה: פרוטוקול זה מיועד לשימוש בתבנית לוח של 24 בארות. אם נדרשות תבניות לוח אחרות (למשל, תבנית של 12 באר או 6 באר), יש לשקול מיטובים בצפיפות הזריעה ובנפח הבינוני. איור 1 מסכם ציר זמן מוצע לטיפוח RhE ומציג את תנאי הטיפוח.
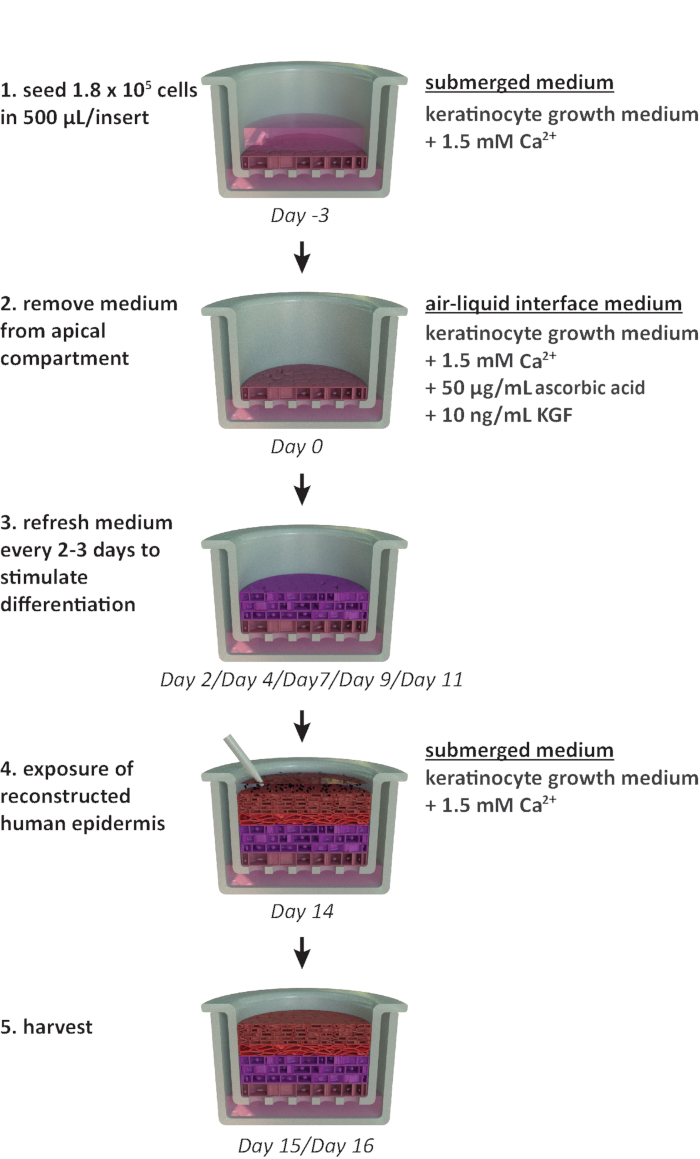
איור 1: ציר זמן סכמטי של פרוטוקול ההשבה. הצגת מודל ההכנה, תהליך הטיפוח והיישום של דגם RhE (חשיפה לחומר כימי). הערכה כוללת את סוגי המדיה המתאימים לתרבות התאים עבור כל שלב. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- ממלאים מראש צלחות 24 באר עם 1.5 מ"ל של מדיום שקוע, באופן אידיאלי באמצעות פיפטה מתקן.
- הסר את המדיום הבסיסי מהבקבוקים T75 המשמשים לתרבות של NHEKs.
- יש לשטוף את התאים על ידי הוספת 5 מ"ל של PBS מחומם מראש לכל בקבוק T75.
- הסר PBS מהבקבוקים.
הערה: שלב זה הוא חיוני, שכן המדיום מכיל חלבונים וסידן שיעכב את פעילות טריפסין. - הוסף 2-3 מ"ל של 0.05% שחומם מראש [v/v] טריפסין / אתילן דיאמין חומצה אצטית טטרה (EDTA) לכל בקבוק T75. ודא כי פתרון טריפסין מופץ באותה מידה על אזור תרבות התא של הבקבוק.
התראה: אמצעי האחסון של 2 מ"ל מבוסס על המפגש של 80% שהוזכר לעיל. השתמש 3 מ"ל עבור בקבוקונים עם מפגש גבוה יותר. - מניחים את הבקבוקים במשך 4 דקות באינקובטור תרבות התא (37 מעלות צלזיוס, 5% CO2, ו 95% RH). בדוק אם התאים ניתוק באמצעות המיקרוסקופ בהגדלה 10x. ראפ הבקבוק על כף היד כדי לעזור לתאים לשחרר מפני השטח של הבקבוק. ניתן לראות תאים מנותקים כתאים מעוגל צפים בתמיסת הנסיון.
התראה: אין להדגיר את התאים ב- trypsin למשך יותר מ- 6 דקות. ניסיון יתר יכול לגרום נזק לתאים ולהפחית את הדבקות שלהם63. - לאחר שכל התאים מנותקים, להוסיף נפח שווה (כלומר, 2-3 מ"ל) של מעכב טריפסין מחומם מראש לכל בקבוק T75.
- העבר את השעיית התא מהבקבוקים לצינור צנטריפוגה.
- לשטוף את הבקבוקים עם 5 מ"ל של PBS שחומם מראש ולהעביר אותו לצינור צנטריפוגה המכיל את השעיית התא.
הערה: ודא כי רוב התאים נאספים על ידי בדיקת מספר התאים שיורית בבקבוקים מתחת למיקרוסקופ. פני השטח של הבקבוק צריך להיות 95% ריק. אם זה לא המקרה ניתן לחזור על שלב הנסיון (3.3-3.9). עם זאת, שים לב שיש להימנע מהנסיון מחדש. - צנטריפוגה התאים שנקטפו ב 400 x g במשך 5 דקות.
- בזהירות להשליך את רוב supernatant, משאיר כ 100-200 μL בצינור.
התראה: אין לשאוף את גלולה במהלך הליך זה. - בעדינות resuspend גלולה של תאים בנפח נמוך של מדיום שקוע, פיפטה למעלה ולמטה 5-10 פעמים כדי להבטיח השעיית תא אחיד. התחל עם נפח נמוך (כלומר, 500 μL) כדי למנוע היווצרות של צבירות תאים ולהוסיף עד 1 מ"ל של מדיום שקוע בסך הכל לכל בקבוק T75 ראשוני.
הערה: בעדינות להעיף את הצינור עם האצבעות כדי להמיס בזהירות חלק גלולת התא ב supernatant. - ספירת התאים בהשעיה באמצעות שיטת אי-הכללה כחולה trypan.
- לדלל 0.4% [v / v] כתם כחול trypan ואת המתלה התא ביחס 1:1, על ידי הוספת 10 μL של 0.4% [v / v] כתם כחול trypan ל 10 μL של השעיית התא. הוסף 10 μL של הפתרון לשקופית ספירה. למדוד את ספירת התאים מיד לאחר ערבוב השעיית התא עם כחול trypan, שכן כחול trypan מתחיל להקטין את הכדאיות של התא לאחר חשיפה ארוכה יותר מ 1 דקות65.
התראה: כחול Trypan הוכח להיות מוטגן פוטנציאלי, מסרטן, ו טרטוגן64. טפל בצבע בזהירות והשליך את הפסולת בבטחה על פי תקנות המעבדה המקומיות.
הערה: גישה חלופית לשימוש בכחול טריפאן היא צבע אריתרוסין B66לא מסוכן .
- לדלל 0.4% [v / v] כתם כחול trypan ואת המתלה התא ביחס 1:1, על ידי הוספת 10 μL של 0.4% [v / v] כתם כחול trypan ל 10 μL של השעיית התא. הוסף 10 μL של הפתרון לשקופית ספירה. למדוד את ספירת התאים מיד לאחר ערבוב השעיית התא עם כחול trypan, שכן כחול trypan מתחיל להקטין את הכדאיות של התא לאחר חשיפה ארוכה יותר מ 1 דקות65.
- לדלל את המתלה התא עם מדיום שקוע נוסף כדי להגיע לריכוז של 3.525 x 105 תאים / מ"ל במדיום שקוע על ידי הוספת אמצעי האחסון V2 כפי שמוצג במשוואה 1:
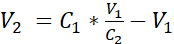
C1 = ריכוז תאים שנספר בהשעיית התא המתקבל ב 3.12 (תאים / מ"ל)
V1 = נפח המשמש לשימוש חוזר גלולה של תאים ב 3.12 (מ"ל)
C2 = ריכוז תאים ממוקד בהשעיה (כלומר, 3.525 x 105 תאים / מ"ל)
V2 = נפח שיש להוסיף כדי להגיע לריכוז התאים הייעודי (mL)
הערה: שטח הפנים של הכנס התרבות המומלצת הוא 0.47 ס"מ2; לכן, צפיפות הזריעה המתאימה היא 3.75 x 105 תאים / ס"מ2. - בצע ספירת תאים שנייה (C3)של הפתרון המדולל המתקבל בשלב 3.14. השתמש במשוואה 2 כדי לחשב את אמצעי האחסון של השעיית התא (V4) כדי להיזרע בתווסף התרבות:
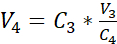
C3 = ריכוז תאים ממוקד בהשעיה (כלומר, 3.525 x 105 תאים / מ"ל)
V3 = נפח ממוקד של השעיית התא שיש לזרוע בהכנסת התרבות (כלומר, 0.5 מ"ל)
C4 = ריכוז תאים נספר בהשעיה מדוללת המתקבלת ב 3.14 (תאים / מ"ל)
V4 = נפח בפועל של השעיית התא שיש לזרוע בהכנסת התרבות (mL) - לתלות את 24 תרבית התא מוסיף במיקום הגבוה ביותר של צלחת המוביל המומלצת ולהעביר את צלחת המוביל ללוח 24 באר מלא מראש עם בינוני שקוע (cf. 3.1).
התראה: בעת העברת צלחת המוביל ללוח רב-הבאר, ודא כי אין בועות אוויר לכודים בין קרום הכנס ואת המדיום שקוע מתא הבסיס, כמו זה ישפיע על האכלת התאים ובסופו של דבר לסכן את הכדאיות RhE ומורפולוגיה. - הוסף את אמצעי האחסון שנקבע V4 (משוואה 2) של השעיית התא לכל הוספה.
הערה: מומלץ להשתמש בטכניקת הצינור ההפוך כדי לוותר במדויק על השעיית התא לתוספות התרבות.
התראה: הקפד לא לפגוע בקרום בעת חלוקת השעיית התא לתוך הכנס תרבות. אמצעי זהירות הוא לוותר על השעיית התא לאורך הקיר של מערכת הכנס מבלי לגעת בפני השטח של הממברנה. - לאחר הזריעה, דגירה את צלחות 24-באר במשך 10-15 דקות בטמפרטורת החדר, כדי להתגבר על אפקט קצה (כלומר, חלוקת טמפרטורה לא אחידה בין כל בארות67). אין להזיז את הצלחות במהלך תקופה זו.
- מעבירים את הצלחות לחממה של תרבית התאים (37 מעלות צלזיוס, 5% CO2ו-95% RH). התאים נשמרים בתנאים שקועים במשך שלושה ימים.
הערה: כדי למנוע שונות רקמות, אין לערום את הצלחות באינקובטור לאחר הזריעה כדי לוודא שכל הכנס מקבל את אותה כמות חום. לאחר שלושה ימים (כלומר, במהלך גידול ALI), ערימה של צלחות אפשרית.
4. טיפוח בממשק אוויר-נוזלי
- לאחר דגירה של שלושה ימים באינקובטור תרבית התא (37 °C (37 °C, 5% CO2, ו 95% RH), לחשוף את התאים שדבקו משטח הממברנה אל ALI על ידי הסרת המדיום שקוע מן התא apical רצוי באמצעות מערכת שאיפה פיפטה פסטר זכוכית.
הערה: לחלופין, ניתן להסיר את המדיום השקוע מהתא האפור באמצעות מיקרופיפט ידני. - מלאו צלחות חדשות של 24 בארות ב-1.5 מ"ל של מדיום ALI טרי ומחממים מראש והעבירו את לוחות המוביל עם תוספות התרבות ללוחות המולטי באר החדשים.
- מעבירים את הצלחות הרב-באר בחזרה לחממה של תרבות התאים (37 מעלות צלזיוס, 5% CO2ו-95% RH).
- רענן את מדיום ALI כל 2-3 ימים במשך 14 ימים.
- בצע את הרענון בשני שלבים: 1) להכין צלחת חדשה המכילה 1.5 מ"ל / באר של בינוני ALI מחומם מראש טרי 2) להעביר את צלחת המוביל לצלחת החדשה.
התראה: במהלך כל הליך ההשבה עדיף לא להסיר את המכסה המכסה את צלחת המוביל כדי לשמור על RhEs מוגן מפני זיהום פוטנציאלי.
הערה: צעד עלי הוא חיוני לפיתוח מודל אפידרמיס מרובד כפי שהוא מאפשר בידול סופני של keratinocytes68. לאחר הולך ALI, שליטה חזותית של מוסיף נדרש, כדי לבדוק אם יש "רקמות דולפות": טיפות בינוניות על פני הרקמה מגיע מתא basolateral. אם הדליפה מתרחשת ביום עלי 3, להסיר בעדינות את המדיום מן התרבות להוסיף מבלי לגעת על פני השטח של הרקמה. אם הדליפה נמשכת, מומלץ להשליך רקמות דולפות כפי שהוא אינדיקציה כי אין היווצרות מחסום נכון במודל RhE. - בסוף תהליך ההשבה, הרקמות יכולות להיחשף ללחצים שונים כדי לגרום למשל מתח חמצוני או דלקת. במקביל, הם יכולים להיות מטופלים עם תרכובות כימיות או מרכיבים קוסמטיים. הערה: במהלך החשיפה /הטיפול, רקמות נשמרות בדרך כלל במדיום שקוע החל ALI D14. כאשר רקמות צפויות להיחשף / לטפל במשך תקופה ארוכה של זמן (כלומר, 48-72 שעות), מומלץ (i) להתחיל את החשיפה / טיפול מוקדם יותר בתהליך הטיפוח ALI, כגון D7-D9, כדי למנוע דילול של שכבות קיימא ועיבוי של SC, ו (ii) כדי להדגיר את הרקמות במדיום ALI, כדי לשמור על גירוי התפשטות התא.
- עבור קציר RhE, לאסוף את הרקמות ואת המדיום תרבות התא בנקודת הזמן של עניין לניתוח היסטולוגי, מבחני הכדאיות, מיצוי חלבון / RNA, ו אנזים מקושר immunosorbent מבחנים (ELISAs).
תוצאות
NHEKs בתרבית דו-מימדית מציגים מורפולוגיה מסורתית עם צורת מצולע עקבית (איור 2A). כפי שתואר לעיל, NHEKs הם זרע לתוך מוסיף תרבות לאחר שהגיעו מפגש של כ 80%. המורפולוגיה של הרז נותחה באמצעות כתמי H&E ו- TEM. לאחר 15 ימים ב- ALI, רקמה מרובדת במלואה מתקבלת כפי שמציינים ארבע שכבות האפידרמיס העיקריות שלה: SB, SS, SG, ו SC (איור 2B). בשכבת SB, לתאים יש צורה טורית. מהשכבה השנייה לכיוון השכבות העליונות של RhE, NHEKs מבדילים כפי שנצפה על ידי השינויים במורפולוגיה של התא (מצורה טורית בשכבת SB, לעבר צורה מסתובבת בשכבת ה- SS). בשכבת SG, לתאים יש צורה שטוחה יותר והם מציגים גרגירי קרטוהיאלין (KG) המיוצגים כנקודות סגולות בציטופלסמה. צורתם העגולה והמכוכמת האופיינית מסומנת בחצים לבנים בתמונת H&E (איור 2C). התאים ב SC, הם מובחנים סופני והם שטוחים לחלוטין וחסר גרעין התא. לעובי הכולל של ה-RHEs המ מרובד של 84.3 ± 2.4 מיקרומטר ועובי ה-SC שלהם הוא 19.6 ± 3.2 מיקרומטר (איור 2D). ערכים אלה דומים לאלה שדווחו עבור עור אנושי ילידי, כלומר, 60-120 מיקרומטר ו 10-20 מיקרומטר, בהתאמה69. מספר שכבות קיימא הוא 6-7, אשר נמוך יותר בהשוואה לזה של העור האנושי המקומי, להיות כ 7-1470. ניתוח אולטרה-מבני של RhEs בנקודות זמן שונות בפרוטוקול ההשבה (כלומר, 7, 10, 13 ו-15 ימים) חושף את תהליך הקורניפיקציה של ה-RhEs עם מספר גדל של שכבות קורנוציטים לאורך זמן (איור 2E). לאחר 15 ימים ב ALI, SC של רקמת RhE עשוי כ 15-25 שכבות, אשר דומה לערך שדווח עבור עור אנושי ילידי (כלומר, 15-20 שכבות)69.
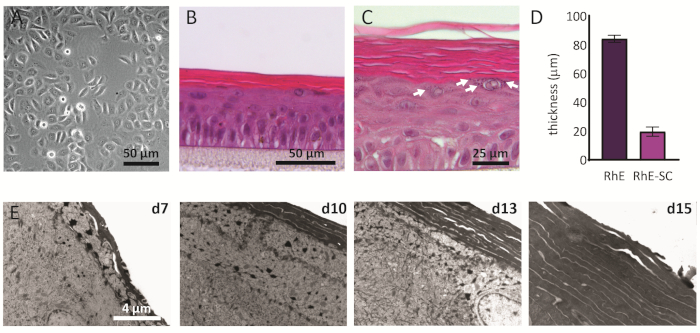
איור 2: קרטינוציטים ראשוניים ואפידרמיס אנושי משוחזר. (A) תמונת מיקרוסקופיה של ניגודיות פאזה של קרטינוציטים ראשוניים לפני הזריעה על מוסיף. סרגל קנה המידה הוא 50 מיקרומטר. (B-C) H&E מיקרוסקופיה שדה בהיר תמונה של RhE. סרגל קנה המידה הוא 50 מיקרומטר (B) ו 25 מיקרומטר(C). (D)כימות עובי של RhE ו- SC (ממוצע ± SEM, n = 3). (ה)העברת תמונות מיקרוסקופיה אלקטרונים של חתכים RhE לאחר 7, 10, 13, ו 15 ימים ב ALI. סרגל קנה המידה הוא 4 מיקרומטר.
על פי שלב הבידול שלהם, NHEKs הגדלים בתלת-ממד מראים פרופילי ביטוי חלבון שונים בהתאם לשלב הבידול שלהם. הביטוי של חלבונים ספציפיים לבידול קרטינוציט בשלב מוקדם (כלומר, קרטין 10), בידול קרטינוציט בשלב מאוחר (כלומר, אינבולוקרין, לורירין ופילגרין), והדבקה קרטינוצית (כלומר, desmoglein 1) ב Rhes נקבע באמצעות כתמי IF. ביטוי Involucrin מופיע בעיקר בשכבת SG מאז הביטוי שלו הוא יזם מוקדם יותר במהלך תהליך הבידול (איור 3D), ואילו filaggrin ו loricrin באים לידי ביטוי בשכבות העליונות (איור 3B-C). ביטוי קרטין 10 נמצא בכל השכבות המעשיות, למעט שכבת SB(איור 3E). RhEs מציגים צמתים desmosomal פונקציונלי, כפי שצוין על ידי הביטוי של desmoglein 1 במרחב הבין תאי של שכבות אפידרמיס קיימא (איור 3F). לסיכום, כל חמשת הסמנים באים לידי ביטוי וממוקמים בשכבות האפידרמיס המתאימות ומתורגמים לתהליך בידול אפידרמיס בריא.
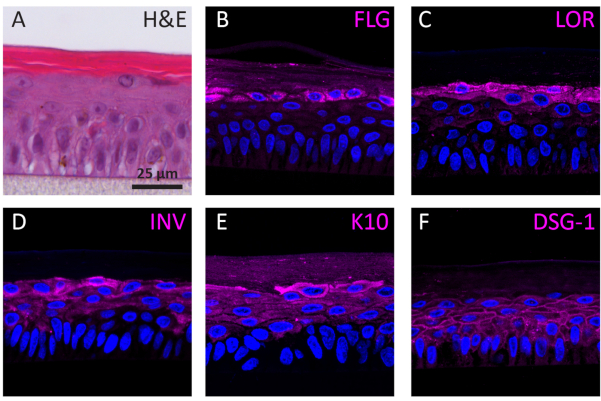
איור 3: התמיינות אפידרמלית, הידבקות ברקמות ושלמות רקמות של אפידרמיס אנושי משוחזר. תמונות מיקרוסקופיות פלואורסצנטיות קונפוקאליות של (B) פילגרין (FLG), (C) לוריקרין (LOR), (D) involucrin (INV), (E) קרטין 10 (K10), ו (F) desmoglein 1 (DSG-1) המיוצג במגנטה. כתמי גרעינים (DAPI) מיוצגים בכחול. סרגל קנה המידה הוא 25 מיקרומטר.
תכונות המחסום של מודל RhE נחקרו על ידי הערכת הכדאיות והיושרה של הרקמה. שלמות הרקמה נקבעה לאחר 15 יום על ידי מדידת TEER באמצעות voltohmmeter. ערכי 2567 ± 415 Ω.cm2 שנרשמו עבור ה-RhEs מתרגמים היווצרות של מחסום רציף (איור 4A). ערכים אלה נמצאים בטווח עם אלה שדווחו עבור דגמי RhE71,72,73,74. בנוסף, זמן החשיפה הנדרש עבור חומר כימי התייחסות ציטוקסי (כלומר, טריטון X-100) כדי להפחית את הכדאיות של הרקמה על ידי 50% (ET50)נקבע עם thiazolyl כחול טטרזוליום ברומיד (MTT) בדיקה. ערך ET50 שנמדד עבור RhE היה 2.1 שעות. ערך זה נופל בטווח הקבלה של מודלים אפידרמיס 3D אחרים המוסמכים לחיזוי אמין של סיווג גירוי (ה-OECD הנחיות 439)19.
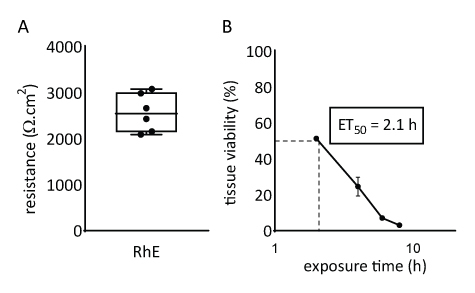
איור 4: מאפייני מחסום של אפידרמיס אנושי משוחזר. (A) שלמות רקמות נמדדה בהתנגדות חשמלית transepithelial (ממוצע ± SEM, n = 6). (B)ET50 נקבע על ידי מדידת הכדאיות של רקמות (כלומר, MTT assay) על חשיפה אקטואלית ל 78.3 μL של 1% טריטון X-100 (ממוצע ± SEM, n = 3).
היענות של ריס נחקרה על גירויים פרואינפלמטוריים ידועים. RhEs טופלו באופן מערכתי, כלומר, תוספת של גירויים במדיום של תא basolateral, באמצעות 100 מיקרוגרם / מ"ל Escherichia coli lipopolysaccharide (LPS) ו 40 ננוגרם / מ"ל גידול נמק גורם אלפא (TNF-α). לאחר 24 שעות של גירויים, מדיום תרבות התא נאסף. הציטוטוקסיות נמדדה באמצעות בדיקת דהידרוגנאז לקטט (LDH) ובהשוואה לערכים של משבש קרום ידוע, חומר הניקוי טריטון X-100 (איור 5). עלייה משמעותית (p < 0.05, ANOVA בכיוון אחד, מבחן ההשוואה המרובות של דאנט) הוצגה בפעילות LDH ב- RhEs שטופלה בטריטון X-100. טיפולי LPS ו-TNF-α הראו שניהם שאינם ציטוטוקסיים.

איור 5: הציטוטוקסיות נמדדה באמצעות בדיקת דהידרוגנאז לקטט (LDH). הנתונים מוצגים כערכים יחסיים לשליטה, רקמות שאינן מטופלות (CTRL); ממוצע ± SEM, n = 9 (טריטון X-100), n = 8 (LPS), n = 3 (TNF-α). משמעות נבדקה עם ANOVA חד כיווני, מבחן ההשוואה המרובים של דאנט. כוכבית מציינת הבדל מובהק סטטיסטית בהשוואה ל- CTRL, ****p < 0.0001). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
שחרורו של אינטרלוקין 1 אלפא (IL-1α) ואינטרלוקין 8 (IL-8) במדיום RhE כומת באמצעות ELISAs. איור 6 מציג הן את מהדורת IL-1α היחסית והן את שחרור IL-8 על ידי ה-RhEs באתגר עם LPS ו-TNF-α. טיפול LPS הביא משמעותי סטטיסטית (p < 0.05, T-test של סטודנט unpaired) המושרה שחרור של IL-8 (9.6 ± 1.0 פי 1.0 עלייה) ו IL-1α (2.7 ± 1.3 פי עלייה). TNF-α לא לגרום באופן משמעותי את שחרור IL-8, למרות שנצפתה נטייה לעלייה ברמות IL-8 (עלייה של 2.3 ± פי 0.8). עם זאת, TNF-α עשה באופן משמעותי (p < 0.05, מבחן T של סטודנט unpaired) להפעיל IL-1α שחרור (1.8 ± 0.5 עלייה קיפול).
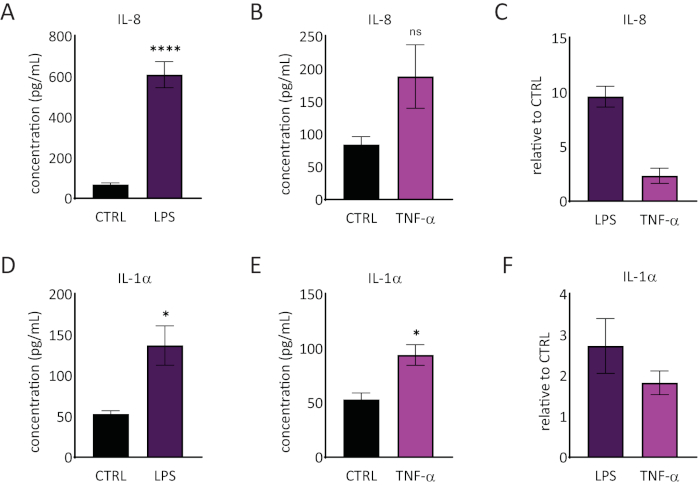
איור 6: תגובות פרוינפלמטוריות באפידרמיס האנושי המשוחזר. ריכוזים של IL-8 שחרור על ידי RhE על אתגר 24 שעות ביממה עם LPS (A) ו TNF-α (B). הנתונים מיוצגים כמשמעותיים ± SEM, n = 8 (LPS), n = 3 (TNF-α). (C) הנתונים מיוצגים כ ממוצע של ערך יחסי בהשוואה לפקד, רקמות לא מטופלות (CTRL) ± SEM, n = 8 (LPS), n = 3 (TNF-α). הריכוז של שחרור IL-1α של RhE על אתגר של 24 שעות עם LPS (D) ו TNF-α (E). הנתונים מיוצגים כמשמעותיים ± SEM, n = 8 (LPS), n = 3 (TNF-α). (F) הנתונים מיוצגים כ ממוצע של ערך יחסי בהשוואה ל- CTRL ± SEM, n = 4 (LPS), n = 3 (TNF-α). המשמעות נבדקה על ידי מבחן T של תלמיד לא משוי. כוכבית מציינת הבדלים מובהקים סטטיסטית בהשוואה ל- CTRL, *p < 0.05, ****p < 0.0001). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
RhEs נמצאים בשימוש נרחב ככלי הקרנה בתחום התרופות והדרמטו-קוסמטיקה36,75,76,77,78. למרות שמספר חברות הפכו RhEs כאלה לזמינים מסחרית, הן נשארות יקרות ומגבילות את האפשרות לשנות את הפרמטרים של הטיפוח כנדרש כדי לענות על שאלות מחקר חדשות. מאמר זה מתאר את הליך הייצור של ריס בתוך הבית בצורה חזקה ואמינה ומספק אפיון מפורט של הרקמות המתקבלות כדי לאשר את הרלוונטיות של המודל כגישה חלופית לניסויים בבעלי חיים.
חלק מהשלבים בפרוטוקול חיוניים כדי להבטיח בידול קרטינוציט נאותה ושחזור RhE. זה יכול להתבצע על ידי ניצול התאים האופטימליים, סוגים בינוניים, ותנאי טיפוח. במודל RhE המוצע, NHEKs יילודים נבחרו בשל חוסר החשיפה האנטיגנית שלהם, בהשוואה NHEKs מבוגרים. יתר על כן, קרטינוציטים הוגבלו למוצא האתני הקווקזי כדי למנוע שונות בין מינים. קרטינוציטים ראשוניים משמשים בדרך כלל ליכולתם להבדיל ולריבוד79. ניתן להשיגם באופן מסחרי או על ידי בידוד פנימי מעור מבוגר80. הטיפוח של קו תאים (כלומר, HaCaT) על קרום פוליקרבונט, הוכיח להיכשל בידול והפגין יכולת לקויה לסנתז שומנים הדרושים להיווצרות מחסום81. עם זאת, הכללת מטריצות תרבות שונות, כגון הידרוג'לים, קולגן, פיברין ותרבויות ספרואידים, הביאה להתפתחות מוצלחת של דגמי עור תלת-ממדיים78,82,83,84,85,86. קווי התאים המונצחים, N/TERT, הוכחו כמתאימים לפיתוח RhEs35. קרטינוציטים ראשוניים נשארים מתרבים בקטע הרביעי או החמישי שלהם61לכן הפרוטוקול הנוכחי כולל שימוש בקרטינוציטים בקטע השלישי שלהם. דה Vuyst ואח ' הוכיחו כי צפיפות זריעת התא הוא בעל חשיבות צריך להיות מספיק (כלומר, ≥ 2.5x105 תאים/ס"מ2) כדי להבטיח שהמדיום מתא הבזולטרלי לא יתפזר לתא האפical. צפיפות זריעה לא מספקת (כלומר, < 2.5x105 תאים/ס"מ2) יכול לגרום לחוסר יכולת ליצור מחסום ראוי, אשר מסומן על ידי דיפוזיה של מדיום מן basolateral לתא apical, וכתוצאה מכך שקוע במקום תנאי תרבות ALI62. מדיום צמיחה קרטינוציט ללא סרום (ראה טבלת חומרים) הועדף למטרות רבייה, שכן הוא מציע את היתרון של עבודה עם מדיום מוגדר כימית ומפחית את הסיכון לזיהום. למדיום זה יש ריכוז סידן נמוך יותר (כלומר, 60 מיקרומטר) ולכן מגרה את התפשטות הקרטינוציטים87. הגדלת ריכוז הסידן (כלומר, 1.5 מ"מ) מהשלב הראשון של טיפוח RhE, מעדיף בידול קרטינוציט והיווצרות מחסום עור והומאוסטזיס49. בנוסף, המדיום ALI הוא בתוספת חומצה אסקורבית, אשר הוכיחה להיות חיוני להיווצרות של שומנים SC ולקדם בידול52,53,54. המדיום ALI מכיל גם KGF, שהוא גורם גדילה המופרש על ידי פיברובלסטים שיכולים להיקשר לקולטנים transmembrane קרטינוציט ותוקפה יש תפקיד כפול בידול ותיקון פצעים55,88. חשוב לרענן את המדיום ALI במרווחי זמן ספציפיים, כדי לספק אספקה מתמדת של חומרים מזינים טריים RhEs. השימוש במערכת לוח נושא חיוני לטיפוח RhE בקנה מידה גדול יותר (כלומר, 24 מוסיף / צלחת). הוא מציע את היתרון של חיסכון בזמן, הפחתת הסיכון לזיהום, ומשאיר פחות מקום להכנסת טעויות אנוש. זה גם מספק את האפשרות לתרבות RhEs בנפח גבוה של מדיה (כלומר, 1.5 מ"ל), אשר מקטין את המספר הנדרש של רענון בינוני ALI. בנוסף, הוא מציע את האפשרות להעביר צלחת מלאה של מוסיף לצלחת עם מדיום טרי, הימנעות ממגע עם מוסיף בנפרד או לחשוף את מכסה הצלחת.
ישנן מספר מגבלות של מודל RhE שיש לציין. בעור האדם המקומי יש שיווי משקל בין התפשטות הקרטינוציטים בשכבת הבסיס לבין ניתוק הקורנפלומיטים ב- SC (כלומר, פירוק)89. עם זאת, במבחנה, desquamation אינו מתרחש. לכן, corneocytes להישאר מחובר RhE וליצור SC עבה כי הוא פחות רלוונטי מבחינה פיזיולוגית. לפיכך, יש טווח זמן טיפוח מוגבל של RhEs. יתר על כן, מודל RhE זה הוא פשוט וישיר, שכן הוא מורכב מסוג תא יחיד, כלומר, קרטינוציט, שהוא סוג התא הנפוץ ביותר של האפידרמיס. עם זאת, ישנם סוגי תאים אחרים המתגוררים באפידרמיס, כגון מלנוציטים, תאים דנדריטיים (כלומר, תאי לנגרהאנס), תאי T (למשל, CD8+ תאים) ותאי מרקל13. כדי לשפר את הרלוונטיות הפיזיולוגית של מודל העור, החוקרים הפכו את מודלי העור למורכבים יותר על ידי הוספת מלנוציטים38 תאי מערכת החיסון,39או תאים שמקורם על-ידי המטופל,90. יש לזכור כי תכונות המחסום של מודלים עור אנושי שונים בהשוואה לעור אנושי ילידי, בשל הרכב שומני SC שונה חדירות מחסום גבוה יותר 91,92,93,94,95. עם זאת, מספר מחקרים דיווחו על שינויים במאפייני המחסום של מודלים של עור אנושי על ידי טיפוח תחת היפוקסיה96 או ירידה בלחות יחסית97אפנון המטריצה העורית עם צ'יטוסאן,98ושינוי בחומצות השומן החופשיות במדיום התרבות,99. יתר על כן, הן RhEs פשוט ומורכב יותר, תנאי התרבות הרכב בינוני ניתן לווסת לחקות תכונות פתולוגיות. על ידי קריאת תיגר על המודל עם ציטוקינים, מורפולוגיה חריגה100 ושינויים ברמות ביטוי גנים וחלבונים ניתן לקבוע כי הם נצפו בדרך כלל בהפרעות עור נפוצות, כגון אטופיק דרמטיטיס ופסוריאזיס35,101,102,103,104,105. השתקת גנים ספציפיים בקרטינוציטים לפני ייזום תהליך ההשתקה מחדש של מודל תלת-ממד היא גישה נוספת המשמשת לחיקוי תכונות של הפרעות עור ולחקור פתרונות טיפוליים חדשים106,107. מלבד דוגמנות שכבת אפידרמיס בלבד, ניתן לכלול במודל תא עורי (כלומר, שווה ערך לעור אנושי או מודלים בעובי מלא) על ידי הטמעת פיברובלסטים במטריצת קולגן לפני ארגון מחדש של RhE, מה שהופך אותו לרלוונטי יותר מבחינה פיזיולוגית ומתאים למחקרים הקשורים להזדקנות וריפוי פצעים.108,109,110. בנוסף, ספירואידים גידול נוספו שווה ערך לעור האדם כדי ללמוד התקדמות מלנומה111,112. ההתקדמות האחרונה בתחום דגמי העור היא ביו-הדפסה ועור על שבב. קבוצות מחקר מרובות הצליחו לאחרונה בפיתוח מקבילות עור ביו-מודפסות (perfusable)45,113,114. הפרוטוקול המוצע מנצל פורמט של 24 באר ולוחית צליל תקשורת, ונמנע מתוספות שיש לטפל בהן בנפרד. עם זאת, סולם המחקר עדיין מוגבל למדי וחסר אוטומציה. על ידי יישום השימוש בביו-הדפסה או עור על שבב, ניתן להשתמש בדגמי עור קטנים יותר עם תהליכים אוטומטיים יותר ובקנה מידה גדול יותר.
ל- RhE המתואר בפרוטוקול זה יש קווי דמיון רבים לדגמי האפידרמיס המסחריים שכבר פותחו ומאופיינים היטב. הניתוח המורפולוגי הוכיח כי למרות שמספר השכבות המעשיות במודל RhE המוצע נמוך יותר בהשוואה לזה של עור אנושי מקומי (כלומר, 6-7 לעומת 7-14), הוא דומה לזה של מודל EpiDerm RhE (כלומר, 8-12)70. בדומה לדגמי האפידרם, האפיסקין ו- SkinEthic, שכבת RhE העליונה מציגה תבנית אריגת סל של שכבות קורנוציטים צפופות28. יתר על כן, ניתוח TEM גילה כי מספר שכבות SC במודל RhE המוצע (כלומר, 15-25) דומה לזה של EpiDerm (כלומר, 16-25)70. בסך הכל, מודל RhE המוצע מדגים מבנה דומה לזה של מודלים אפידרמיס ממוסחרים אחרים, מחקה את האפידרמיס האנושי יליד. שלמות הרקמה כפי שהיא נמדדת על ידי TEER היא בטווח עם דגמי RhE מסחריים (כלומר, בין 3000-5600 Ω.cm2)71,72,73 ו RhEs אחרים בתוך הבית (כלומר, כ 5000 Ω.cm2)74,115. מודל RhE המוצע מראה להיות מובחן היטב, כפי שצוין על ידי נוכחות ולוקליזציה נכונה של בידול וסמני הידבקות רקמות. יתר על כן, מודל RhE המוצע מראה להיות מגיב גירויים proinflammatory (כלומר, LPS ו TNF-α).
לסיכום, הפרוטוקול הנוכחי מראה כיצד לייצר RhEs בצורה אמינה ובקנה מידה גדול יחסית כדי לענות על הצרכים של חוקרים במוסדות אקדמיים ופרטיים כאחד. מודל RhE המוצע מראה שיש מורפולוגיה דומה, בידול אפידרמיס, והיענות ביולוגית למודלים מסחריים קיימים אחרים. הוא מספק כלי חלופי הן לתחום התרופות והן לתחום הדרמטו-קוסמטיקה כאשר נדרשת גישה למודל עור רלוונטי.
Disclosures
מארק איימן ובנדטה פטרקה הם עובדים של דאו סיליקון בלגיה. לכל המחברים האחרים אין מה לחשוף.
Acknowledgements
תוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת מענק מארי סקלודובסקי-קירי עם הסכם המענק מס' 765602 מימנה עבודה זו. כל המחברים מכירים בתמיכת קרן אדולף מרקל ואוניברסיטת פרארה ומכירים בהכרת תודה בדאו סיליקון בלגיה. ד"ר מיגל Spuch-Calvar הוא הודה להכנת התמונות הגרפיות של תהליך הטיפוח RhE. המחברים מודים לד"ר ברברה דרסלר, ד"ר פרנקו סרבלטי וד"ר אגנס טסייה על התמיכה הטכנית והדיונים.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma Aldrich | A6283 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Antibiotic-antimycotic (100x) | Thermo Fisher Scientific (Gibco) | 15240062 | |
| Aqueous Eosin Y solution | Sigma Aldrich | HT110280 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Calcium chloride (CaCl2) | Sigma Aldrich or Merck | C8106 or 1.02378.0500 | Prepare a stock solution of 0.144 M, filter sterilize and store aliquots at -20 °C. It is recommended to prepare new aliquots every 6 months. |
| DAPI | Roche | 10236276001 | Prepare a stock at 100 μg/mL and store aliquots at -20 °C. Working conditon is 1 μg/mL. |
| Entellan mounting medium | Merck | 1.07960.0500 | Mounting medium for H&E staining. |
| EpiLife medium (referred to as keratinocyte growth medium) | Thermo Fisher Scientific (Gibco) | MEPI500CA | Contains 0.06 mM of Ca2+. |
| Ethanol absolute | Any supplier | N/A | |
| Formalin 10% | Leica Biosystems | 3800770 | |
| Human keratinocytes growth supplement (HKGS) (100x) | Thermo Fisher Scientific (Gibco) | S0015 | To reach final concentrations of 0.2% [v/v] BPE, 0.2 ng/mL human recombinant EGF, 0.18 μg/mL hydrocortisone,5 μg/mL bovine transferrin, and 0.01 µg/mL human recombinant insulin-like growth factor-I. |
| Isopropanol | Biosolve B.V. | 0016264102BS | |
| Kaiser's glycerol gelatine, phenol-free | Merck | 1.08635.0100 | Mounting medium for IF staining. |
| Keratinocyte growth factor (KGF) | R&D Systems | 251-KG-050 | Reconstitute KGF protein at 100 μg/mL in sterile 0.1% [w/v] BSA in PBS. Prepare aliquots and store at -20°C. |
| Lactate dehydrogenase (LDH) assay kit | Roche | 4744926001 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | Prepare a stock solution of 25 mg/mL, filter sterilize and store aliquots at -20°C. It is recommended to prepare new aliquots every 6 months. Store in the dark. |
| Lipopolysaccharide (LPS), E.coli strain O55:B5 | Sigma-Aldrich | L4524 | Prepare a stock of 1 mg/mL in sterile PBS and store aliquots at -20 °C. Working concentration is 100 μg/mL. |
| Mayer’s Haematoxylin | Sigma-Aldrich | MHS80 | |
| Normal human epidermal keratinocytes (NHEKs) | Lonza | 00192906 | Human primary keratinocytes isolated from neonatal foreskin, pooled from at least three donors. |
| Phosphate-buffered saline | Thermo Fisher Scientific (Gibco) | 10010056 or 10010-015 | Reference numbers can vary between countries. |
| Recombinant tumor necrosis factor alpha (TNF-α) | ImmunoTools | 11344483 | Prepare a stock of 100 μg/mL in sterile ultrapure water. Working concentration is 40 ng/mL |
| Sterile ultrapure water | Any supplier | N/A | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M5655 | Prepare a stock of 5 mg/mL MTT in sterile PBS. Working concentration is 1 mg/mL. |
| Triton X-100 | Sigma-Aldrich | 93426 | |
| Trypan blue (0.4% [v/v]) | Any supplier | N/A | |
| Trypsin inhibitor | Thermo Fisher Scientific (Gibco) | R007100 | |
| Trypsin/EDTA (0.05% [v/v]) | Thermo Fisher Scientific (Gibco) | 25300054 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | Ab150113 | |
| Tri-sodium citrate dihydrate | Merck | 1.06448.0500 | For antigen retrieval buffer for IF staining. |
| Goat Anti-Rabbit IgG H&L (Dylight 488) | Agrisera | AS09 633 | |
| Filaggrin Mouse antibody | BioTechne (Novus Biologicals) | NBP2-53243 | |
| Involucrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP2-33742 | |
| Keratin 10 Mouse antibody | BioTechne (Novus Biologicals) | NBP2-32962 | |
| Desmoglein-1 Mouse antibody | BioTechne (Novus Biologicals) | MAB944 | |
| Loricrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP1-33610 |
References
- Alberts, B., Johnson, A., Lewis, J. . Molecular Biology of the Cell. 4th edition. Antioxidants & Redox Signaling. , (2002).
- Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., Polla, B. S. The stratum corneum: a double paradox. Journal of Cosmetic Dermatology. 7 (2), 143-148 (2008).
- Moore, K. L., Dalley, A. F. . Clinically Orientated Anatomy. , (2010).
- Barthel, R., Aberdam, D. Epidermal stem cells. Journal of the European Academy of Dermatology and Venereology. 19 (4), 405-413 (2005).
- Green, K. J., Simpson, C. L. Desmosomes: new perspectives on a classic. Journal of Investigative Dermatology. 127 (11), 2499-2515 (2007).
- Feingold, K. R. Lamellar bodies: the key to cutaneous barrier function. Journal of Investigative Dermatology. 132 (8), 1951-1953 (2012).
- Elias, M. P., Feingold, K. R., Fartasch, M. The epidermal lamellar body as a multifunctional secretory organelle. Skin Barrier. , 261-272 (2006).
- Tobin, D. J. Biochemistry of human skin-our brain on the outside. Chemical society reviews. 35 (1), 52-67 (2006).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12), 2080-2095 (2006).
- Weinstein, G. D., McCullough, J. L., Ross, P. Cell proliferation in normal epidermis. Journal of Investigative Dermatology. 82 (6), 623-628 (1984).
- Madison, K. C. Barrier function of the skin: "la raison d'être" of the epidermis. Journal of Investigative Dermatology. 121 (2), 231-241 (2003).
- Suter, M. M., et al. The keratinocyte in epidermal renewal and defence. Veterinary Dermatology. 20 (5-6), 515-532 (2009).
- McLafferty, E., Hendry, C. The integumentary system: anatomy, physiology and function of skin. Nursing Standard. 27 (7), 35-43 (2012).
- Monteiro-Riviere, N. A. . Toxicology of the skin. , (2010).
- Dellambra, E., Odorisio, T., D'Arcangelo, D., Failla, C. M., Facchiano, A. Non-animal models in dermatological research. ALTEX. 36 (2), 177-202 (2019).
- Gordon, S., et al. Non-animal models of epithelial barriers (skin, intestine and lung) in research, industrial applications and regulatory toxicology. Altex. 32 (4), 327-378 (2015).
- Kandárová, H., et al. The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests - An assessment of the performance of the optimised test. Alternatives to laboratory animals : ATLA. 33 (4), 351-367 (2005).
- Kandárová, H., et al. Assessment of the skin irritation potential of chemicals by using the SkinEthic reconstructed human epidermal model and the common skin irritation protocol evaluated in the ECVAM skin irritation validation study. Alternatives to laboratory animals : ATLA. 34 (4), 393-406 (2006).
- OECD. Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. OECD. , (2019).
- Alépée, N., Grandidier, M. H., Cotovio, J. Sub-categorisation of skin corrosive chemicals by the EpiSkinTM reconstructed human epidermis skin corrosion test method according to UN GHS: Revision of OECD Test Guideline 431. Toxicology in Vitro. 28 (2), 131-145 (2014).
- OECD. Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method. OECD. , (2019).
- Mehling, A., et al. In vitro RHE skin sensitisation assays: applicability to challenging substances. Regulatory Toxicology and Pharmacology. 108, 104473 (2019).
- . SENS-IS | EURL ECVAM - TSAR Available from: https://tsar.jrc.ec.europa.eu/test-method/tm2011-11 (2020)
- Lelièvre, D., et al. The episkin phototoxicity assay (EPA): development of an in vitro tiered strategy using 17 reference chemicals to predict phototoxic potency. Toxicology in Vitro. 21 (6), 977-995 (2007).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Pellevoisin, C., Bouez, C., Cotovio, J. Cosmetic industry requirements regarding skin models for cosmetic testing. Skin Tissue Models. , 3-37 (2018).
- Niehues, H., et al. 3D skin models for 3R research: the potential of 3D reconstructed skin models to study skin barrier function. Experimental Dermatology. 27 (5), 501-511 (2018).
- Netzlaff, F., Lehr, C. -. M., Wertz, P. W., Schaefer, U. F. The human epidermis models EpiSkin®, SkinEthic® and EpiDerm®: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport. European Journal of Pharmaceutics and Biopharmaceutics. 60 (2), 167-178 (2005).
- Prieux, R., Eeman, M., Rothen-Rutishauser, B., Valacchi, G. Mimicking cigarette smoke exposure to assess cutaneous toxicity. Toxicology in Vitro. 62, 104664 (2020).
- Petracca, B., Rothen-Rutishauser, B., Valacchi, G., Eeman, M. Bench approaches to study the detrimental cutaneous impact of troposperic ozone. Journal of Exposure Science and Environmental Epidemiology. 31, 137-148 (2021).
- Dijkhoff, I. M., et al. Impact of airborne particulate matter on skin: a systematic review from epidemiology to in vitro studies. Particle and fibre toxicology. 17 (1), 35 (2020).
- El Ghalbzouri, A., Siamari, R., Willemze, R., Ponec, M. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential according to the ECVAM guidelines. Toxicology in Vitro. 22 (5), 1311-1320 (2008).
- Chacón, M., et al. Development of an in-house reconstructed human epidermis model as an alternative method in skin corrosion assessment. Toxicology in Vitro. 65, 104779 (2020).
- Pedrosa, T. d. o. N., et al. A new reconstructed human epidermis for in vitro skin irritation testing. Toxicology in Vitro. 42, 31-37 (2017).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Poumay, Y., Coquette, A. Modelling the human epidermis in vitro: tools for basic and applied research. Archives of dermatological research. 298 (8), 361-369 (2007).
- Rikken, G., Niehues, H., van den Bogaard, E. H. Organotypic 3D skin models: human epidermal equivalent cultures from primary keratinocytes and immortalized keratinocyte cell lines. Methods in Molecular Biology. 2154, 45-61 (2020).
- Duval, C., et al. Human skin model containing melanocytes: essential role of keratinocyte growth factor for constitutive pigmentation-functional response to α-melanocyte stimulating hormone and forskolin. Tissue engineering. Part C, Methods. 18 (12), 947-957 (2012).
- Hutter, V., Kirton, S. B., Chau, D. Y. S. Immunocompetent human in vitro skin models. Skin Tissue Models. , 353-373 (2018).
- Kinsner, A., Lesiak-Cyganowska, E., Śladowski, D. In vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking. 2 (3), 165-171 (2001).
- Black, A. F., Bouez, C., Perrier, E., Schlotmann, K., Chapuis, F., Damour, O. Optimization and characterization of an engineered human skin equivalent. Tissue Engineering. 11 (5-6), 723-733 (2005).
- Reijnders, C. M. A., et al. Development of a full-thickness human skin equivalent in vitro model derived from TERT-immortalized keratinocytes and fibroblasts. Tissue Engineering. Part A. 21 (17-18), 2448-2459 (2015).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering - In vivo and in vitro applications. Advanced Drug Delivery Reviews. 63 (4-5), 352-366 (2011).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Pittelkow, M. R., Scott, R. E. New techniques for the in vitro culture of human skin keratinocytes and perspectives on their use for grafting of patients with extensive burns. Mayo Clinic Proceedings. 61 (10), 771-777 (1986).
- Elias, P. M., Ahn, S. K., Brown, B. E., Crumrine, D., Feingold, K. R. Origin of the epidermal calcium gradient: regulation by barrier status and role of active vs passive mechanisms. Journal of Investigative Dermatology. 119 (6), 1269-1274 (2002).
- Elias, P. M., et al. Modulations in epidermal calcium regulate the expression of differentiation-specific markers. Journal of Investigative Dermatology. 119 (5), 1128-1136 (2002).
- Lee, S. E., Lee, S. H. Skin barrier and calcium. Annals of Dermatology. 30 (3), 265-275 (2018).
- Prunieras, M., Regnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. Journal of Investigative Dermatology. 81, 28-33 (1983).
- Poumay, Y., et al. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Archives of Dermatological Research. 296 (5), 203-211 (2004).
- Ponec, M., et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Savini, I., et al. Characterization of keratinocyte differentiation induced by ascorbic acid: Protein kinase C involvement and vitamin C homeostasis. Journal of Investigative Dermatology. 118 (2), 372-379 (2002).
- Pasonen-Seppänen, S., et al. Vitamin C enhances differentiation of a continuous keratinocyte cell line (REK) into epidermis with normal stratum corneum ultrastructure and functional permeability barrier. Histochemistry and Cell Biology. 116 (4), 287-297 (2001).
- Beer, H. D., et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 34-39 (2000).
- Steven, A. C., Bisher, M. E., Roop, D. R., Steinert, P. M. Biosynthetic pathways of filaggrin and loricrin--two major proteins expressed by terminally differentiated epidermal keratinocytes. Journal of structural biology. 104 (1-3), 150-162 (1990).
- Rice, R. H., Thacher, S. M. Involucrin: a constituent of cross-linked envelopes and marker of squamous maturation. Biology of the Integument. , 752-761 (1986).
- Elias, P. M., Barrier Feingold, K. R. . Skin Barrier. , (2011).
- Marionnet, C., et al. Morphogenesis of dermal-epidermal junction in a model of reconstructed skin: beneficial effects of vitamin C. Experimental Dermatology. 15 (8), 625-633 (2006).
- Frikke-Schmidt, H., Lykkesfeldt, J. Keeping the intracellular vitamin C at a physiologically relevant level in endothelial cell culture. Analytical Biochemistry. 397 (1), 135-137 (2010).
- Castro-Muñozledo, F., Hernández-Quintero, M., Marsch-Moreno, M., Kuri-Harcuch, W. Cultivation, serial transfer, and differentiation of epidermal keratinocytes in serum-free medium. Biochemical and Biophysical Research Communications. 236 (1), 167-172 (1997).
- De Vuyst, E., et al. Reconstruction of normal and pathological human epidermis on polycarbonate filter. Epidermal Cells. Methods in Molecular Biology (Methods and Protocols. , 191-201 (2013).
- Chen, R. H., Zhu, J., Zhang, R. Z., Wang, S. Y., Li, Y. The tolerance of human epidermal cells to trypsinization in vitro. Cell and Tissue Banking. 21 (2), 257-264 (2020).
- Pohanish, R. P. . Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2, (2012).
- Tsaousis, K. T., et al. Time-dependent morphological alterations and viability of cultured human trabecular cells after exposure to Trypan blue. Clinical and Experimental Ophthalmology. 41 (5), 484-490 (2013).
- Kim, S. I., et al. Application of a non-hazardous vital dye for cell counting with automated cell counters. Analytical Biochemistry. 492, 8-12 (2016).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Fartasch, M., Ponec, M. Improved barrier structure formation in air-exposed human keratinocyte culture systems. Journal of Investigative Dermatology. 102 (3), 366-374 (1994).
- Bouwstra, J. A., Honeywell-Nguyen, P. L., Gooris, G. S., Ponec, M. Structure of the skin barrier and its modulation by vesicular formulations. Progress in Lipid Research. 42 (1), 1-36 (2003).
- Ponec, M., Boelsma, E., Gibbs, S., Mommaas, M. Characterization of reconstructed skin models. Skin Pharmacology and Physiology. 15 (1), 4-17 (2002).
- Hubaux, R., Wauters, A., Chrétien, A., Poumay, Y., Salmon, M. Reconstructed human epidermis response to urban particulate matter activates multiple stress-related pathways and impacts the skin barrier function. 23th IFSCC Conference. , 125-134 (2017).
- Lin, Y. -. C., et al. Testing method development and validation for in vitro skin irritation testing (SIT) by using reconstructed human epidermis (RhE) skin equivalent - EPiTRI®. Alternatives to Animal Testing. , 8-19 (2019).
- Alexander, F. A., Eggert, S., Wiest, J. Skin-on-a-chip: Transepithelial electrical resistance and extracellular acidification measurements through an automated air-liquid interface. Genes. 9 (2), 114 (2018).
- van den Bogaard, E., et al. Perspective and consensus opinion: good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Kandárová, H., Hayden, P., Klausner, M., Kubilus, J., Sheasgreen, J. An in vitro skin irritation test (SIT) using the EpiDerm reconstructed human epidermal (RHE) model. Journal of Visualized Experiments. (29), e1366 (2009).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical pharmacology advances and applications. 8, 163-176 (2016).
- De Wever, B., Kurdykowski, S., Descargues, P. Human skin models for research applications in pharmacology and toxicology: introducing nativeSkin, the "missing link" bridging cell culture and/or reconstructed skin models and human clinical testing. Applied In Vitro Toxicology. 1 (1), 26-32 (2015).
- Klicks, J., von Molitor, E., Ertongur-Fauth, T., Rudolf, R., Hafner, M. In vitro skin three-dimensional models and their applications. Journal of Cellular Biotechnology. 3 (1), 21-39 (2017).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cellular and Developmental Biology - Animal. 22 (12), 695-705 (1986).
- Johansen, C. Generation and culturing of primary human keratinocytes from adult skin. Journal of Visualized Experiments. (130), e56863 (2017).
- Boelsma, E., Verhoeven, M. C. H., Ponec, M. Reconstruction of a human skin equivalent using a spontaneously transformed keratinocyte cell line (HaCaT). Journal of Investigative Dermatology. 112 (4), 489-498 (1999).
- Zhao, X., et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering. Advanced Healthcare Materials. 5 (1), 108-118 (2016).
- Peura, M., et al. Paracrine factors from fibroblast aggregates in a fibrin-matrix carrier enhance keratinocyte viability and migration. Journal of Biomedical Materials Research. Part A. 95 (2), 658-664 (2010).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCat keratinocytes in organotypic coculture with human dermal fibroblasts. Journal of Investigative Dermatology. 112 (3), 343-353 (1999).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue engineering. Part C, Methods. 20 (6), 473-484 (2014).
- Alameda, J. P., et al. IKKα regulates the stratification and differentiation of the epidermis: Implications for skin cancer development. Oncotarget. 7 (47), 76779-76792 (2016).
- Bikle, D. D., Xie, Z., Tu, C. L. Calcium regulation of keratinocyte differentiation. Expert Review of Endocrinology and Metabolism. 7 (4), 461-472 (2012).
- Staiano-Coico, L., et al. Human keratinocyte growth factor effects in a porcine model of epidermal wound healing. Journal of Experimental Medicine. 178 (3), 865-878 (1993).
- Egelrud, T. Desquamation in the stratum corneum. Acta Dermato-Venereologica. 80, 44-45 (2000).
- Jean, J., Lapointe, M., Soucy, J., Pouliot, R. Development of an in vitro psoriatic skin model by tissue engineering. Journal of Dermatological Science. 53 (1), 19-25 (2009).
- Lotte, C., Patouillet, C., Zanini, M., Messager, A., Roguet, R. Permeation and skin absorption: reproducibility of various industrial reconstructed human skin models. Skin Pharmacology and Applied Skin Physiology. 15, 18-30 (2002).
- Ponec, M., Weerheim, A., Lankhorst, P., Wertz, P. New acylceramide in native and reconstructed epidermis. Journal of Investigative Dermatology. 120 (4), 581-588 (2003).
- Thakoersing, V. S., et al. Unraveling barrier properties of three different in-house human skin equivalents. Tissue engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Thakoersing, V. S., et al. presence of monounsaturated fatty acids in the stratum corneum of human skin equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Van Smeden, J., et al. Combined LC/MS-platform for analysis of all major stratum corneum lipids, and the profiling of skin substitutes. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1841 (1), 70-79 (2014).
- Mieremet, A., et al. Human skin equivalents cultured under hypoxia display enhanced epidermal morphogenesis and lipid barrier formation. Scientific Reports. 9 (1), 7811 (2019).
- Mieremet, A., et al. Unravelling effects of relative humidity on lipid barrier formation in human skin equivalents. Archives of Dermatological Research. 311 (9), 679-689 (2019).
- Mieremet, A., Rietveld, M., Absalah, S., Van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by Chitosan modulated dermal matrices. PLoS ONE. 12 (3), 0174478 (2017).
- Mieremet, A., et al. Contribution of palmitic acid to epidermal morphogenesis and lipid barrier formation in human skin equivalents. International Journal of Molecular Sciences. 20 (23), 6069 (2019).
- Boniface, K., et al. IL-22 inhibits epidermal fifferentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- De Vuyst, E., Salmon, M., Evrard, C., Lambert de Rouvroit, C., Poumay, Y. Atopic dermatitis studies through in vitro models. Frontiers in Medicine. 4, 119 (2017).
- Danso, M. O., et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents. Journal of Investigative Dermatology. 134 (7), 1941-1950 (2014).
- Soboleva, A. G., Mezentsev, A., Zolotorenko, A., Bruskin, S., Pirusian, E. Three-dimensional skin models of psoriasis. Cells Tissues Organs. 199 (5-6), 301-310 (2014).
- Desmet, E., Ramadhas, A., Lambert, J., Gele, M. Van In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research. Experimental Biology and Medicine. 242 (11), 1158-1169 (2017).
- Niehues, H., van den Bogaard, E. H. Past, present and future of in vitro 3D reconstructed inflammatory skin models to study psoriasis. Experimental Dermatology. 27 (5), 512-519 (2018).
- Pendaries, V., et al. Knockdown of filaggrin in a three-dimensional reconstructed human epidermis impairs keratinocyte differentiation. Journal of Investigative Dermatology. 134 (12), 2938-2946 (2014).
- Niehues, H., et al. Epidermal equivalents of filaggrin null keratinocytes do not show impaired skin barrier function. Journal of Allergy and Clinical Immunology. 139 (6), 1979-1981 (2017).
- Reuter, C., Walles, H., Groeber, F. Preparation of a three-dimensional full thickness skin equivalent. Methods in Molecular Biology. 1612, 191-198 (2017).
- Bataillon, M., et al. Characterization of a new reconstructed full thickness skin model, t-skinTM, and its application for investigations of anti-aging compounds. International Journal of Molecular Sciences. 20 (9), 2240 (2019).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments. (96), e52576 (2015).
- Li, L., Fukunaga-Kalabis, M., Herlyn, M. The three-dimensional human skin reconstruct model: a tool to study normal skin and melanoma progression. Journal of Visualized Experiments. (54), e2937 (2011).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments. (135), e57500 (2018).
- Wei, Z., et al. Two-dimensional cellular and three-dimensional bio-printed skin models to screen topical-use compounds for irritation potential. Frontiers in Bioengineering and Biotechnology. 8, 109 (2020).
- Derr, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated morphology and barrier function. Tissue Engineering - Part C: Methods. 25 (6), 334-343 (2019).
- Frankart, A., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruction at the air-liquid interface. Experimental Dermatology. 21 (11), 871-875 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved