Method Article
Büyük Ölçekte Üç Boyutlu Yeniden Yapılandırılmış İnsan Epidermisi Yetiştirmek
Bu Makalede
Özet
Bu protokol, üç boyutlu yeniden oluşturulmuş insan epidermisini tekrarlanabilir ve sağlam bir şekilde yetiştirmek için basit bir yöntemi açıklar. Ek olarak, epidermal bariyer modelinin yapı-işlev ilişkisini karakterize eder. Yeniden inşa edilen insan epidermisinin proinflamatuar uyaranlar üzerine biyolojik tepkileri de sunulmaktadır.
Özet
Yenidoğan primer keratinositlerden yeniden yapılanan üç boyutlu bir insan epidermis modeli sunulmaktadır. Burada, yetiştirme süreci ve modelin karakterizasyonu için bir protokol açıklanmıştır. Yenidoğan primer keratinositler geçirgen polikarbonat kesici uçlara batırılmış olarak yetiştirilir ve tohumlamadan üç gün sonra hava sıvısı arayüzüne kaldırılır. Yüksek kalsiyum kültürü ortamında tanımlanmış büyüme faktörleri ve askorbik asit ile on dört günlük stimülasyondan sonra model tamamen farklılaştırilir. Histolojik analiz, yerli insan derisinin morfolojisini taklit eden tamamen tabakalı bir epidermis ortaya çıkardı. Modeli ve bariyer fonksiyonlarını karakterize etmek için, erken evre keratinosit farklılaşmasına özgü protein seviyeleri ve lokalizasyon (yani keratin 10), geç evre farklılaşması (yani, involükrin, lorikrin ve filaggrin) ve doku yapışması (yani, desmoglein 1), immünofluorescence ile değerlendirildi. Doku bariyeri bütünlüğü transepithelial elektrik direnci ölçülerek daha da değerlendirildi. Rekonar insan epidermisi proinflamatuar uyaranlara (yani lipopolisakkarit ve tümör nekroz faktör alfa) yanıt verdi ve sitokin salınımını artırdı (yani, interlökin 1 alfa ve interlökin 8). Bu protokol, çevresel etkileri ve ciltle ilgili çok çeşitli çalışmaları değerlendirmek için bir araç olarak yeniden yapılandırılmış insan epidermisini yetiştirmek için basit ve tekrarlanabilir bir in vitro yöntemi temsil eder.
Giriş
Epidermis, insan vücudu ve dış ortam arasındaki doğrudan arayüzde cildin en dış tabakasıdır. Ana işlevleri koruma ve hidrasyon sağlamaktır1. Epidermis, dış ajanlara karşı etkili bir fiziksel bariyer görevi görür ve vücuttan aşırı su kaybını önler. Bu cilt fonksiyonları esas olarak cildin en dış katmanlarındaki hücresel düzenlemeye, hücreler arası lipitlerin bileşimine ve organizasyonuna bağlıdır2. Epidermis öncelikle dokunun dış tarafına doğru göç eden ve farklılaşmaya uğrayan keratinositlerden oluşur. Farklılaşma evreleri ile karakterize edilen 4-5 epidermal tabaka vardır. İçeriden dışarıya, epidermal tabakalar canlı epidermisin, yani stratum bazale (SB), stratum spinosum (SS) ve stratum granülosyumdan (SG) başlayarak, canlı olmayan en üst katmana, yani stratum korneum (SC)3'ekadar başlar. Bazal tabaka esas olarak çoğalan keratin ile zenginleştirilmiş keratinositlerden oluşur, bu da farklılaşma üzerine SS yoluyla göç eder4. Keratinosit olgunlaşması sırasında protein ekspresyasyonunda ve yapısında çeşitli değişiklikler meydana gelir. Keratinositler desmosomal kavşakların oluşumuna yapışır5. SG'de, lameller gövdelerin üretimi başlatılır. Cilt bariyeri fonksiyonunun oluşumu için çok önemli olan lipid öncülleri ve enzimlerden oluşurlar6. SG ayrıca keratinositlerin sitoplazmasında keratohyalin granüllerinin varlığı ile karakterizedir. SC ile arayüzde, lamel gövdelerinin içeriği hücreler arası alanlara ekstrüde edilir ve seramidler, kolesterol ve serbest yağ asitleri gibi polar olmayan lipitler hücre dışı lipid matrisini oluşturmak için istiflenmiş lameller lipid bilayerlerine düzenlenir7. SC'de hücreler, enzymatic bozulma süreçleri nedeniyle çekirdek de dahil olmak üzere tüm hücresel organelleri kaybeder ve düzleştirilmiş bir morfoloji benimser. Çapraz bağlı protein katmanlarından yapılmış cornified bir zarf ile çevrilidirler ve korneositler8,9olarak adlandırılırlar. Desmosomal bileşenler korneodezmozom oluşturmak ve korneositleri birbirine bağlamak için kornealanmış zarfa çapraz bağlanır. Elde edilen epitel, yaklaşık 5-6 haftalık bir devir süresi ile kök hücrelerden sürekli olarak yenilenir10. Tamamen tabakalı bir epidermis ile sonuçlanan keratinositlerin farklılaşma süreci, cildin bariyer fonksiyonunun oluşumu için çok önemlidir11.
Yaralanma ve iltihaplanma sırasında keratinositler yapışma moleküllerinde ve yüzey reseptörlerinde değişikliklere neden olur ve sitokinler, kemokinler ve antimikrobiyal peptitlerin salgılanması yoluyla proinflamatuar yanıtları tetikler12. Cilt sadece eksojen maddelere karşı fiziksel bir bariyer değildir; patojenlere maruz kalındıktan sonra bağışıklık sensörü görevi de görür. Ek olarak, insan vücudunu dehidrasyondan korumak için su içeriği gibi katmanları boyunca birkaç maddenin difüzyonunu düzenler. Cilt ayrıca D vitamini sentezinde yer alır ve diğer çeşitli metabolik fonksiyonlara sahiptir3,13,14.
Eksojen maddelerin olumsuz etkilerini değerlendirmek için, toksikologlar onlarca yıldır hayvan testlerine güvenmektedir, ancak günümüzde tercih edilen yaklaşım değildir. İnsan toksisitesi için sınırlı tahmin kapasitesine sahip olmasının yanı sıra, hayvan modelleri çok sayıda etik sorun içerir. Kozmetik endüstrisinde hayvan testlerinin yasaklanması ve araştırmalarda 3R prensibine (yani Değiştirme, Azaltma ve Arıtma) uyulması önerisi, in vitro yaklaşımlara dayalı alternatif test yöntemlerinin geliştirilmesine yolaçmıştır 15. İlk in vitro cilt hücresi modelleri zaten 90'larda tanımlanmıştır ve basit insan keratinosit mono kültürlerinden tamamen farklılaştırılmış epidermis ve tam kalınlıklı modellere kadar etkileyici bir gelişme elde edilmiştir16. Günümüzde cilt dokusu mühendisliği hem farmasötik hem de dermato-kozmetik alanlarında önem kazanmıştır. Son yirmi yılda, birkaç şirket ciltle ilgili çalışmalar için standartlaştırılmış ve tekrarlanabilir araçları temsil eden üç boyutlu (3D) yeniden yapılandırılmış insan epidermisini (RhE) ticarileştirdi. Cilt tahrişi17 , 18(yani test kılavuzu 439 19) ve cilt korozyonu 20 (yani test kılavuzu431 21)test etmek için OECD yönergelerine göre kimyasalların in vitro cilt testi için çeşitli ticari RhE modelleri kabuledilmektedir. Cilt duyarlılığı22 için in vitro testi (yani, SENS-IS testi) şu anda onay yolunda ve hakem incelemesi altında23. Ayrıca, ticari RhE modellerini kullanan çok sayıda başka tahlil de vardır, fototoksikliği değerlendirmek için24, ilaç formülasyonlarını test etmek için25, kozmetik formülasyonlar ve aktif bileşenler26, cilt bariyeri fonksiyonu27'yi incelemek ve çevresel stresörlere biyolojik yanıtı test etmek için28,29,30,31.
Ticari olarak mevcut 3D cilt modellerine ek olarak, birden fazla araştırma grubu kendi RhE32 , 33,34,35,36,37. Şirket içi RHE'ler, çalışmanın amacına göre kültür koşullarını kontrol etme avantajı sunar. Özellikle, araştırmacılar 3D epidermal modellerinin (yani, birincil ve ölümsüzleştirilmiş, yenidoğan vs. yaşlı, tek ve havuza edilmiş rastgele donörler, cinsiyet, etnik köken, sigara gibi bireysel yaşam alışkanlıkları vb.) yeniden uzlaştırılmasında kullanılacak keratinositlerin türünü ve kaynağını seçebilirler. Kültür ortamının bileşimini değiştirme ve hedef proteinlerin veya lipitlerin ekspresyonunu modüle edebilecek büyüme faktörleri, vitaminler veya diğer bileşikleri içerme olasılığına sahiptirler. Şirket içi RHE'ler ile araştırmacılar, 3D modelin farklılaşma durumunun bir işlevi olarak biyolojik yanıtları ve biyomekanik özellikleri de araştırabilirler. Bu sezgisel parametrelere ek olarak, 3D cilt modellerinin karmaşıklığını artırmak ve fizyolojik olarak daha alakalı hale getirmek için sürekli çabalar vardır, örneğin, diğer epidermal hücre tiplerini (örneğin melanositler ve bağışıklık hücreleri)ekleyerek 38,39, fibroblast nüfuslu bir kollajen matrisinin üzerine keratinositleri kült ederek 40,41,42ve vasküler ağın bileşenlerini dahil ederek43,44,45.
Kültür koşullarını belirli ihtiyaçlara göre ayarlamak mümkün olsa da, bir RhE'nin hem kalitesini hem de alaka düzeyini garanti etmek için saygı duyulan parametreler vardır. RhE dokularını yetiştirmek için, normal insan epidermal keratinositleri (NHEK'ler), gözenekli sentetik zarı kuyuları iki bölmeye, yani apikal ve bazolateral bölmeye ayıran belirli geçirgen kültür kesici uçlarına tohumlanır. Zarın gözenekliliği (yani, 0,4 μm'lik bir gözenek büyüklüğü), hücrelerin bazal kesici uç tarafına geçişi olmayan apikal bölmede bir hücre monolayerinin oluşumuna ve keratinositlerin bazolateral bölmede bulunan kültür ortamından temel besinlerle beslenmesine izin verir. Yeniden yapılanma sürecinin başlangıcında, NHEK'ler zara yapışmalarına izin vermek için birkaç gün boyunca su altında kalırlar. Her iki bölmedeki kalsiyum seviyesi, hücrelerin çoğalmasını yavaşlatmak ve bunun yerine farklılaşmalarını teşvik etmek için NHEK'lerin 2D kültürü için kullanılan kalsiyum konsantrasyonuna kıyasla artar46. Bariyer oluşumunu ve homeostazı düzenlemek için epidermal kalsiyum gradyanı gereklidir47,48. Yüksek kalsiyum seviyeleri (yani 1,5 mM'ye kadar) hücreler arası kavşakların oluşumunu teşvik eder ve terminal farklılaşması sırasında kornişli zarfın oluşumunu modüleeder 49. Keratinositler destekleyici membran üzerinde sürekli ve sıkı yapışan bir monolayer oluşturduktan sonra, apikal bölmeden ortam çıkarılır ve tabakalaşmayı uyarmak ve epidermal bariyer oluşturmak için hava sıvısı arayüzünde (ALI) kültür süreci devam eder50,51. Tamamen katmanlı bir epitel elde etmek için özel kültür koşulları çok önemlidir36. ALI'deki rekonstrüt işlemi sırasında, bazolateral bölmedeki ortam keratinosit büyüme faktörü (KGF), insülin, kalsiyum ve askorbik asit ile desteklenir. Askorbik asit, yerli insan derisininkine çok benzeyen uygun bir SC lipid bariyerinin oluşumunda önemli bir rol oynar52. Askorbik asit takviyeli ortamda yetişen keratinositler, korneositlerin interstiklerinde organize hücrelerarası lipid lamellerin yanı sıra gelişmiş sayıda keratohyalin granülleri ile farklılaştırılmış bir fenotip göstermektedir52. Bu takviye, cornified zarf içeriğini artırarak ve hidrofilik antioksidan depolarının tükenmesini önleyerek epidermal bariyer fonksiyonunu iyileştirmek için gereklidir53,54. Epidermal çoğalma ve farklılaşmanın önemli bir parakrin arabulucusunun kısaltması olan KGF, NHEKs55'iuyarmak için kullanılır.
Şirket içi RHE'lerin başlıca dezavantajları arasında araştırma kurumları arasındaki standardizasyon kaybı ve artan işgücü yoğunluğu ve zaman tüketimi (kullanıma hazır ticari modellere kıyasla 3 haftaya kadar) sayıldı. Mevcut makalenin amacı, bu dezavantajları gidermek ve üretimin temelini daha büyük ölçekte belirlemektir. Mevcut protokol, şirket içi RHE'lerin yukarıda belirtilen avantajlarına ek olarak, dokular arasındaki iç ve değişkenliği azaltmayı, kontaminasyon risklerini azaltmayı ve ekim sürecini kolaylaştırmayı amaçlamaktadır.
Mevcut protokol, yenidoğan NHEK'leri kullanarak RHE'leri yetiştirmek için tekrarlanabilir ve sağlam bir yöntem açıklar. Ayrıca, RhEs morfolojisinin karakterizasyonu, bariyer bütünlüğü ve epidermal farklılaşmaya özgü proteinlerin ekspresyonunun temsili sonuçlarını gösterir. RhEs morfolojik yapısı hematoksilin ve eozin (H&E) boyama ve iletim elektron mikroskopisi (TEM) kullanılarak incelendi. Bariyer bütünlüğünü değerlendirmek için transepidermal elektrik direnci (TEER) ve doku canlılığının %50'sini (ET 50) azaltmak için TritonX-100'emaruz kalma süresi ölçüldü. Keratinosit yapışmasını değerlendirmek için desmozomal kavşakların oluşumu (yani desmoglein 1) immünofluoresans (IF) ile analiz edildi. Epidermal yapısal proteinlerin (yani involükrin, lorikrin ve filaggrin) oluşumu IF ile değerlendirildi ve tespit edildi. Bu proteinler SC korneositlerini çevreleyen yüksek çapraz bağlı protein zarfının oluşumunda rol oynar ve sonuç olarak geç evre epidermal farklılaşma için önemli belirteçlerdir56,57. Ek olarak, IF, SS58'deki erken evre farklılaştırılmış hücrelerde indüklenen ve tüm farklılaştırılmış katmanların içinde bulunan bir protein olan keratin 10'u analiz etmek için kullanıldı. Son olarak, RhE'nin proinflamatuar uyaranlara (yani lipopolisakkarit ve tümör nekroz faktörü alfa) yanıtı araştırıldı. Hücre kültürü medyasında interlökin 1 alfa (IL-1α) ve interlökin 8 (IL-8) düzeyleri enzime bağlı immünorbent tahlilleri (ELISA) kullanılarak ölçüldü.
Protokol
Bu protokolü içeren herhangi bir araştırma faaliyetini planlamadan ve yürütmeden önce insan dokularının veya hücrelerinin kullanımıyla ilgili ulusal ve uluslararası etik hususları ve koşulları gözden geçirmek ve bunlara uymak.
NOT: Bu protokolün tüm adımları aseptik koşullarda gerçekleştirilmelidir. Biyogüvenlik Seviye 2 uygulamaları RHE yetiştiriciliği için minimum gerekliliktir. Bu protokolde açıklanan kimyasallar/reaktifler ele alınırken gerekli tüm güvenlik önlemleri alınmalıdır.
1. Hücre kültürü medyasının hazırlanması
NOT: RHE'lerin yetiştirilmesinde kullanılan üç farklı serumsuz kültür ortamı vardır (Tablo 1): (i) NHEK'lerin2Dkültürü için kullanılan düşük kalsiyum seviyesine (60 μM Ca 2+ ) sahip bazal ortam; (ii) NHEK'lerin hücre kültürü kesici uç sistemine tohumlamada kullanılan yüksek kalsiyum seviyesine (1,5 mM Ca2+) sahip batık ortam; ve (iii) yüksek kalsiyum seviyesine (1,5 mM Ca2+), askorbik asit ve keratinosit büyüme faktörüne (KGF) sahip hava-sıvı arayüzü (ALI) ortamı.
| Orta | Orta bilgi | Gerekli miktar |
| Bazal ortam | Keratinosit büyüme ortamı | 36 mL/24 kuyular |
| + % 1 [v/v] HKGS | ||
| + % 1 [v/v] 100x antibiyotik-antimycotic | ||
| Batık ortam | Keratinosit büyüme ortamı | 36 mL/24 kuyular |
| + % 1 [v/v] HKGS | ||
| + % 1 [v/v] 100x antibiyotik-antimycotic | ||
| + 1,5 mM Ca2+ | ||
| Hava-sıvı arayüz ortamı | Keratinosit büyüme ortamı | 216 mL/24 kuyu |
| + % 1 [v/v] HKGS | ||
| + % 1 [v/v] 100x antibiyotik-antimycotic | ||
| + 1,5 mM Ca2+ | ||
| + 50 μg/mL askorbik asit | ||
| + 10 ng/mL keratinosit büyüme faktörü |
Tablo 1. RhE'leri yetiştirmek için kullanılan farklı kültür ortamlarının özet tablosu. Takviyeleri ile farklı kültür medyası listesi.
- Bazal ortamı hazırlayın.
- %0,2 [v/v] sığırın nihai konsantrasyonlarına ulaşmak için 500 mL keratinosit büyüme ortamı(Malzeme Tablosu)şişesini 5 mL insan keratinosit büyüme takviyeleri (HKGS) ile destekleyin hipofiz özü (BPE), 0.2 ng/mL insan rekombinant epidermal büyüme faktörü (EGF), 0.18 μg/mL hidrokortizon, 5 μg/mL sığır transferin, ve 0.01 μg/mL rekombinant insan insülin benzeri büyüme faktörü-I (IGF-I).
- 10.000 birim/mL penisilin, 10.000 μg/mL streptomisin ve 25 μg/mL amphotericin B içeren 5 mL 100x antibiyotik-antimycotic çözeltisi ekleyin.
- Su altında kalan ortamı hazırlayın.
- %0,2 [v/v] BPE'lik nihai konsantrasyonlara ulaşmak için 500 mL keratinosit büyüme ortamı(Malzeme Tablosu)şişesini 5 mL HKGS ile tamamlayın, 0.2 ng/mL insan rekombinant EGF, 0.18 μg/mL hidrokortizon, 5 μg/mL sığır transferrin ve 0.01 μg/mL insan rekombinant IGF-I.
- 5 mL 100x antibiyotik-antimycotic çözelti ekleyin.
- 1,5 mM Ca 2+ nihai konsantrasyona ulaşmak için0,144 M CaCl 2 (kalsiyum klorür) stok çözeltisinin5mL'lik bir kısmını ekleyin.
NOT: Kalsiyum konsantrasyonu, keratinositlerin farklılaşmasını teşvik etmek ve tabakalaşma sürecini başlatmak için batık faz sırasında zaten artmıştır49.
- Hava sıvısı arabirimi (ALI) ortamını hazırlayın.
- %0,2 [v/v] BPE'lik nihai konsantrasyonlara ulaşmak için 5 mL HKGS ile 500 mL keratinosit büyüme ortamı(Malzeme Tablosu)bir şişe takviye, 0.2 ng/mL insan rekombinant EGF, 0.18 μg/mL hidrokortizon, 5 μg/mL sığır transferrin ve 0.01 μg/mL insan rekombinant IGF-I.
- 5 mL 100x antibiyotik-antimycotic çözelti ekleyin.
- 1,5 mM Ca 2+ nihai konsantrasyona ulaşmak için0,144 M CaCl 2 stok çözeltisinin5mL'lik bir kısmını ekleyin.
- 50 μg/mL askorbik asit nihai konsantrasyonuna ulaşmak için 25 mg/mL askorbik asit stok çözeltisinin 1 mL'lik kısmını ekleyin.
- 10 ng/mL KGF'lik son konsantrasyona ulaşmak için fosfat tamponlu salin (PBS) stok çözeltisine %1 [w/v] sığır serum albüminine 100 μg/mL KGF'nin 50 μL'sini ekleyin.
NOT: Askorbik asit oksidasyona duyarlı olduğundan, magnezyum l-askorbyl-2-fosfat59 veya L-askorbik asit 2-fosfat sesquimagnesium60gibi kararlı bir askorbik asit türevi kullanılması önerilir. Askorbik asit kullanılırsa, her yenilemeden önce ALI ortamını askorbik asitle tazelemeniz önerilir.
2. NHEK Kültürü
NOT: Birincil insan keratinositleri dördüncü veya beşinci pasajları61üzerinde proliferatif kaldığından, üçüncü pasajlarındaki NHEK'ler RHE'lerin yetiştirilmesi için kullanılır. Primer keratinositler yüksek hassasiyetleri nedeniyle çok dikkatli bir şekilde ele alınmalıdır. Hücrelerin durumunu bozmamak için hücre süspansiyonlarının herhangi bir zamanda dikkatli ve yavaş pipetlemesi çok önemlidir.
- Şişenin bir kısmını suya batırarak 37 °C'de bir su banyosunda 1 x 106 kriyoprezer korunmuş NHEKs ile bir şişeyi çözün. Şişeyi su banyosunda 1-2 dakika kuluçkaya yatırın, ta ki sadece küçük bir buz parçası görünene kadar.
DİkKAT: Kirlenmeleri önlemek için şişenin tamamını su banyosuna batırmayın. Hücreleri 2 dakikadan fazla çözmeyin; bu hücre canlılığını azaltabilir. Tüpü laminar davlumbaz içine aktarmadan önce şişeyi% 70 etanol çözeltisi ile silin. - Hücreleri 2-3 kez yukarı ve aşağı pipetleme ile çok dikkatli bir şekilde yeniden biriktirin. Hücre süspansiyonu, toplam 15 mL önceden ısıtılmış çözülme ortamı içeren iki T75 şişesine aktarın, böylece 6,7 x 104 hücre /cm2tohumlama yoğunluğu elde edilir.
NOT: İlk iki pasaj ve kriyoprezite edilmiş NHEK'lerin çözülmesi için, tedarikçinin önerilerine göre hücre kültürü ortamı kullanılır. - Şişeleri hücre kültürü inkübatörüne (37 °C, %5 CO 2 ve%95bağıl nem (RH) yerleştirin.
- Yaklaşık 24 saat sonra, dimetil sülfit (DMSO) keratinosit dondurma çözeltisinden çıkarmak için çözme ortamını bazal ortamla değiştirin.
- Bazal ortamı iki günde bir yenileyin.
- 4-6 günlük ekimden sonra, hücreler yaklaşık% 80 bir arada olmalı ve RHE ekimi için kesici uçlarda tohumlama için hazır olmalıdır.
NOT: Keratinositler proliferatif kapasitelerini korumak için maksimum% 80 izdihama yetiştirilmelidir62. Çözülecek hücre sayısı, hücre geçiş numarası, çözülme sırasında hücre canlılığı, tohumlama verimliliği ve iki katına çıkma süresi gibi çeşitli parametreleri dikkate almalıdır.
3. NHEK'lerin Tohumculuğu
NOT: Bu protokol 24 kuyulu taşıyıcı plaka formatında kullanılmak üzere tasarlanmıştır. Başka plaka formatları gerekiyorsa (örneğin, 12 kuyu veya 6 kuyu formatı), tohumlama yoğunluğu ve orta hacimdeki optimizasyonlar göz önünde bulundurulmalıdır. Şekil 1, RhE ekimi için önerilen bir zaman çizelgesini özetler ve ekim koşullarını gösterir.
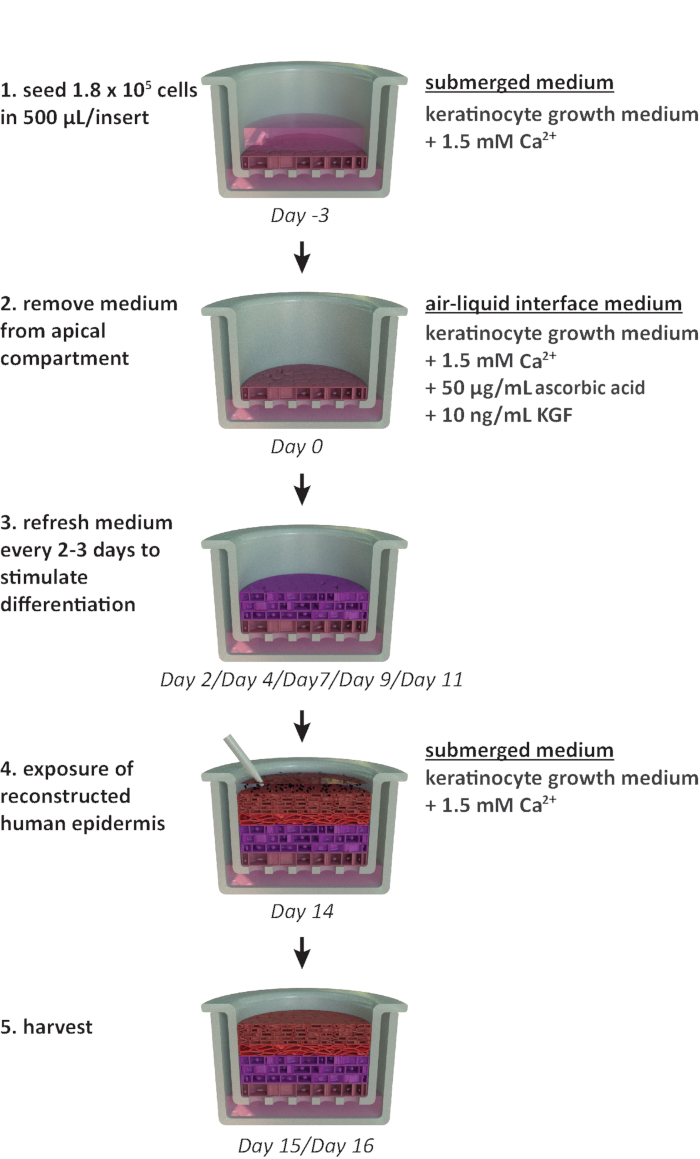
Şekil 1: Yeniden yapılandırma protokolünün şematik zaman çizelgesi. RhE modelinin hazırlanması, ekim süreci ve uygulamasının sunumu (kimyasal maddeye maruz kalma). Düzen, her adım için uygun hücre kültürü ortam türlerini içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 24 kuyu plakalarını 1,5 mL batık ortamla önceden doldurun, ideal olarak bir dağıtıcı pipet kullanın.
- Bazal ortamı NHEK'lerin kültürü için kullanılan T75 şişelerinden çıkarın.
- Her T75 şişesine 5 mL önceden ısıtılmış PBS ekleyerek hücreleri durulayın.
- PBS'yi şişelerden çıkarın.
NOT: Bu adım çok önemlidir, çünkü ortam tripsin aktivitesini inhibe edecek proteinler ve kalsiyum içerir. - Her T75 şişesine 2-3 mL önceden ısıtılmış %0,05 trypsin/etilen diamin tetra asetik asit (EDTA) ekleyin. Tripsin çözeltisinin şişenin hücre kültürü alanına eşit olarak dağıtıldığından emin olun.
DİkKAT: 2 mL hacim yukarıda belirtilen %80 izdihama dayanmaktadır. Daha yüksek izdiah gücüne sahip şişeler için 3 mL kullanın. - Şişeleri hücre kültürü inkübatörüne (%37 °C, %5 CO 2 ve%95RH) 4 dakika yerleştirin. Hücrelerin mikroskobu kullanarak 10 kat büyütmede ayrılıp ayırmadığını kontrol edin. Hücrelerin şişenin yüzeyinden salınmasına yardımcı olmak için şişeyi avuç içine doğru rap. Ayrılmış hücreler, tripsin çözeltisinde yüzen yuvarlatılmış hücreler olarak gözlemlenebilir.
DİkKAT: Tripinlerdeki hücreleri 6 dakikadan uzun süre kuluçkaya yatmayın. Aşırı trypsinization hücrelere zarar verebilir ve yapışmalarını azaltabilir63. - Tüm hücreler ayrıldıktan sonra, her T75 şişesine önceden ısıtılmış tripin inhibitörünün eşit hacmini (yani 2-3 mL) ekleyin.
- Hücre süspansiyonu şişelerden bir santrifüj tüpüne aktarın.
- Şişeleri önceden ısıtılmış 5 mL PBS ile durulayın ve hücre süspansiyonu içeren santrifüj tüpüne aktarın.
NOT: Mikroskop altında şişelerdeki artık hücre sayısını kontrol derek hücrelerin çoğunun toplandığından emin olun. Şişenin yüzeyi% 95 boş olmalıdır. Bu durumda trypsinization adımını (3.3-3.9) tekrarlamak mümkündür. Ancak yeniden denemeden kaçınılması gerektiğini unutmayın. - Hasat edilen hücreleri 5 dakika boyunca 400 x g'da santrifüj edin.
- Tüpte yaklaşık 100-200 μL bırakarak, süpernatantların çoğunu dikkatlice atın.
DİkKAT: Bu işlem sırasında peleti aspireetmeyin. - Tek tip bir hücre süspansiyonu sağlamak için hücrelerin peletini düşük hacimli bir batık ortamda, pipet yukarı ve aşağı 5-10 kez hafifçe yeniden biriktirin. Hücre agregalarının oluşumunu önlemek için düşük hacimli (yani 500 μL) başlayın ve ilk T75 şişesi başına toplamda 1 mL'ye kadar batık ortam ekleyin.
NOT: Hücre peletinin bir kısmını üst kısımda dikkatlice çözmek için tüpü parmaklarla hafifçe kaydırın. - Trypan mavi dışlama yöntemini kullanarak süspansiyondaki hücreleri sayın.
- %0,4 [v/v] trippan mavisi lekeyi ve hücre süspansiyonu 1:1 oranında seyreltin, 10 μL hücre süspansiyonu için %0,4 [v/v] trippan mavi lekesi ekleyerek. Sayım slaydına 10 μL çözelti ekleyin. Hücre süspansiyonu trypan mavisi ile karıştırıldıktan hemen sonra hücre sayısını ölçün, çünkü trypan mavisi maruziyetten sonra hücre canlılığını azaltmaya başlar 1 dk65.
DİkKAT: Trypan mavisi potansiyel bir mutajen, kanserojen ve teratojen64olarak gösterilmiştir. Boyayı dikkatli bir şekilde ele alın ve atıkları yerel laboratuvar yönetmeliklerine göre güvenli bir şekilde atın.
NOT: Trippan mavisi kullanımına alternatif bir yaklaşım tehlikeli olmayan boya eritrosin B66 'dır.
- %0,4 [v/v] trippan mavisi lekeyi ve hücre süspansiyonu 1:1 oranında seyreltin, 10 μL hücre süspansiyonu için %0,4 [v/v] trippan mavi lekesi ekleyerek. Sayım slaydına 10 μL çözelti ekleyin. Hücre süspansiyonu trypan mavisi ile karıştırıldıktan hemen sonra hücre sayısını ölçün, çünkü trypan mavisi maruziyetten sonra hücre canlılığını azaltmaya başlar 1 dk65.
- V2 hacmini denklem 1'de gösterildiği gibi ekleyerek, hücre süspansiyonu, batık ortamda 3.525 x10 5 hücre/mL konsantrasyonuna ulaşmak için ek su altında kalan ortamla seyreltin:
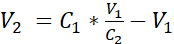
C1 = 3,12'de elde edilen hücre süspansiyonunda sayılan hücre konsantrasyonu (hücreler/mL)
V1 = hücrelerin peletini 3,12 (mL) olarak yeniden çıkarmak için kullanılan hacim
C2 = süspansiyondaki hedeflenen hücre konsantrasyonu (yani, 3.525 x 105 hücre/mL)
V2 = hedeflenen hücre konsantrasyonuna (mL) ulaşmak için eklenecek hacim
NOT: Önerilen kültür kesici ucunun yüzey alanı 0,47 cm2'dir; bu nedenle, karşılık gelen tohumlama yoğunluğu 3,75 x 105 hücre/cm2'dir. - 3.14.adımda elde edilen seyreltilmiş çözeltinin ikinci hücre sayısını (C 3) gerçekleştirin. Kültür ekine tohumlanacak hücre süspansiyon hacmini (V4)hesaplamak için denklem 2'yi kullanın:
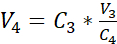
C3 = süspansiyondaki hedeflenen hücre konsantrasyonu (yani, 3.525 x 105 hücre/mL)
V3 = kültür kesici uçta tohumlanacak hücre süspansiyonunun hedeflenen hacmi (yani, 0,5 mL)
C4 = 3,14'te elde edilen seyreltilmiş süspansiyonda sayılan hücre konsantrasyonu (hücreler/mL)
V4 = kültür kesici uçta (mL) tohumlanacak hücre süspansiyonunun gerçek hacmi - 24 hücre kültürü kesici uçlarını önerilen taşıyıcı plakanın en yüksek konumuna asın ve taşıyıcı plakayı önceden batırılmış ortamla doldurulmuş 24 kuyu plakasına aktarın (cf. 3.1).
DİkKAT: Taşıyıcı plakayı çok kuyulu plakaya aktarırken, kesici uç zarı ile bazal bölmeden batırılmış ortam arasına hava kabarcıklarının sıkışmadığından emin olun, çünkü bu hücrelerin beslenmesini etkileyecek ve sonuçta RhE canlılığını ve morfolojisini tehlikeye atacaktır. - Hücre süspansiyonunun belirlenen V4 birimini (denklem 2'den) her kesici uça ekleyin.
NOT: Hücre süspansiyonu kültür kesici uçlarına doğru bir şekilde dağıtmak için ters pipetleme tekniğinin kullanılması önerilir.
DİkKAT: Hücre süspansiyonunu kültür kesici ucuna dağıtırken zara zarar vermediğinden emin olun. Bir önlem, hücre süspansiyonunu membran yüzeyine dokunmadan kesici uç sisteminin duvarı boyunca dağıtmaktır. - Tohumlamadan sonra, bir kenar etkisinin üstesinden gelmek için 24 kuyu plakalarını oda sıcaklığında 10-15 dakika kuluçkaya yatırın (yani, tüm kuyular arasında homojen olmayan sıcaklık dağılımı67). Bu süre zarfında plakaları hareket ettirmeyin.
- Plakaları hücre kültürü inkübatörüne (37 °C, %5 CO2ve %95 RH) aktarın. Hücreler üç gün boyunca su altında tutulur.
NOT: Doku değişkenliğini önlemek için, her kesici ucun aynı miktarda ısı aldığından emin olmak için tohumlamadan sonra plakaları inkübatöre istiflemeyin. Üç gün sonra (yani ALI ekimi sırasında), plakaların istiflenmesi mümkündür.
4. Hava-Sıvı Arayüzünde Yetiştirme
- Hücre kültürü inkübatöründe (%37 °C, %5 CO2ve %95 RH) üç günlük bir inkübasyondan sonra, tercihen bir aspirasyon sistemi ve bir cam Pasteur pipet kullanarak su altında kalan ortamı apikal bölmeden çıkararak membran yüzeyine yapışmış hücreleri ALI'ye maruz bırakır.
NOT: Alternatif olarak, apical bölmeden suya batırılmış ortam manuel bir mikropipette ile çıkarılabilir. - Yeni 24 kuyulu plakaları 1,5 mL taze önceden ısıtılmış ALI ortamı ile doldurun ve taşıyıcı plakaları kültür kesici uçlarla yeni çok kuyulu plakalara aktarın.
- Çok kuyulu plakaları hücre kültürü inkübatörüne (%37 °C, %5 CO2ve %95 RH) geri aktarın.
- ALI ortamını 14 gün boyunca her 2-3 günde bir yenileyin.
- Yenilemeyi iki adımda gerçekleştirin: 1) 1,5 mL / taze önceden ısıtılmış ALI ortamı içeren yeni bir plaka hazırlayın ve 2) taşıyıcı plakayı yeni tabağa aktarın.
DİkKAT: Tüm rekonsup prosedürü sırasında RHE'leri potansiyel kontaminasyondan korumak için taşıyıcı plakayı kaplayan kapağı çıkarmamak en iyisidir.
NOT: ALI adımı, keratinositlerin68.'ninterminal farklılaşmasına izin verdiği için katmanlı bir epidermal modelin geliştirilmesi için çok önemlidir. ALI'ye geçtikten sonra, 'sızdıran dokular' olup olmadığını kontrol etmek için kesici uçların görsel bir kontrolü gerekir: bazolateral bölmeden gelen doku yüzeyinde orta damlacıklar. Sızıntı ALI gün 3'te gerçekleşirse, ortamı doku yüzeyine dokunmadan kültür kesici uçtan hafifçe çıkarın. Sızıntı devam ederse, RhE modelinde doğru bariyer oluşumu olmadığının bir göstergesi olduğu için sızan dokuların atılması önerilir. - Rekonseptif sürecin sonunda, dokular oksidatif stres veya iltihaplanma gibi nedenler için çeşitli stresörlere maruz kalabilir. Buna paralel olarak, kimyasal bileşikler veya kozmetik bileşenlerle tedavi edilebilirler. NOT: Maruz kalma/tedavi sırasında dokular genellikle ALI D14'ten başlayarak batık ortamda tutulur. Dokuların uzun bir süre (yani 48-72 saat) maruz kalması/tedavi edilmesi beklendiğinde, (i) uygulanabilir katmanların incelmesini ve SC'nin kalınlaşmasını önlemek için D7-D9 gibi ALI yetiştirme sürecinde maruziyete/tedaviye daha erken başlanması ve (ii) ALI ortamındaki dokuların kuluçkaya yatması, hücre çoğalmasının uyarılmasını sağlamak önerilir.
- RhE hasadı için, histolojik analiz, canlılık tahlilleri, protein/RNA ekstraksiyonu ve enzime bağlı immünorbent tahlilleri (ELISAs) için ilgi çekici zaman noktasında dokuları ve hücre kültürü ortamını toplayın.
Sonuçlar
2D kültürlü NHEK'ler, tutarlı bir çokgen şekle sahip geleneksel bir morfoloji görüntüler (Şekil 2A). Yukarıda açıklandığı gibi, NHEK'ler yaklaşık% 80'lik bir izdiah süresine ulaştıktan sonra kültür kesici uçlarına tohumlanır. RHE'lerin morfolojisi H&E boyama ve TEM kullanılarak analiz edildi. ALI'de 15 gün sonra, dört ana epidermal katmanında belirtildiği gibi tamamen katmanlı bir doku elde edilir: SB, SS, SG ve SC (Şekil 2B). SB katmanında, hücreler sütunlu bir şekle sahiptir. İkinci katmandan RhE'nin üst katmanlarına doğru, NHEK'ler hücre morfolojislerindeki değişikliklerle gözlendiği gibi farklılaşmaz (SB katmanındaki sütunlu bir şekilden, SS katmanındaki dikenli bir şekle doğru). SG tabakasında, hücreler daha düz bir şekle sahiptir ve sitoplazmda mor noktalar olarak temsil edilen keratohyalin granüllerini (KG) görüntüler. Karakteristik yuvarlak ve yıldız şekilleri H&E görüntüsündeki beyaz oklarla vurgulanır (Şekil 2C). SC'deki hücreler, ölümcül olarak farklılaştırılmıştır ve tamamen düzleştirilmiştir ve bir hücre çekirdeğinden yoksundur. Katmanlı RHE'ler genel kalınlık 84.3 ± 2.4 μm ve SC'leri 19.6 ± 3.2 μm kalınlıklara sahiptir (Şekil 2D). Bu değerler, yerli insan derisi için bildirilenlerle karşılaştırılabilir, yani sırasıyla 60-120 μm ve 10-20 μm,sırasıyla 69. Uygulanabilir katmanların sayısı 6-7'dir, bu da yerli insan derisine kıyasla daha düşüktür, yaklaşık 7-1470. RHE'lerin rekonstrüksiyon protokolünde farklı zaman noktalarında (yani 7, 10, 13 ve 15 gün) ultrayapısal analizi, RHE'lerin zaman içinde artan korneosit katmanları ile kornifikasyon sürecini ortaya koymaktadır(Şekil 2E). ALI'de 15 gün sonra, RhE dokusunun SC'si yaklaşık 15-25 katmandan oluşur, bu da yerli insan derisi için bildirilen değerle karşılaştırılabilir (yani, 15-20 katman)69.
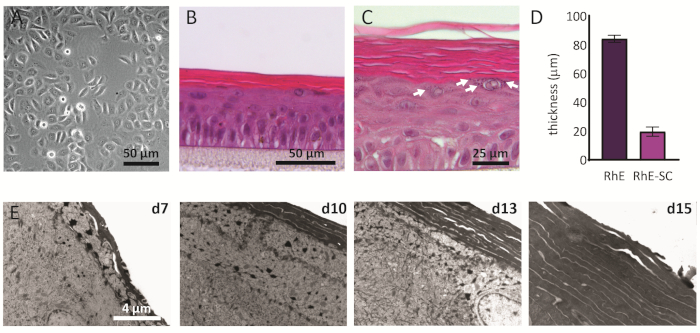
Şekil 2: Primer keratinositler ve yeniden yapılandırılmış insan epidermisi. (A) Kesici uçlara tohumlamadan önce birincil keratinositlerin faz kontrastlı mikroskopi görüntüsü. Ölçek çubuğu 50 μm. (B-C) RhE'nin H&E parlak alan mikroskopi görüntüsüdür. Ölçek çubuğu 50 μm (B) ve 25 μm (C' dir. (D) RhE ve SC kalınlığının nicelemesi (ortalama ± SEM, n=3). (E) ALI'de 7, 10, 13 ve 15 gün sonra RhE kesitlerinin iletim elektron mikroskopi görüntüleri. Ölçek çubuğu 4 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Farklılaşma evrelerine göre 3D olarak büyüyen NHEK'ler farklılaşma evrelerine göre farklı protein ekspresyon profilleri gösterirler. RHE'lerde erken evre keratinosit farklılaşmasına (yani keratin 10), geç evre keratinosit farklılaşmasına (yani involükrin, lorikrin ve filaggrin) ve keratinosit yapışmasına (yani desmoglein 1) özgü proteinlerin ekspresyonu IF boyama kullanılarak belirlendi. İnvolucrin ekspresyasyonu, farklılaşma işlemi sırasında daha önce başlatıldığı için SG katmanında daha ağırlıklı olarak bulunur (Şekil 3D), filaggrin ve lorikrin ise üst katmanlarda ifade edilir (Şekil 3B-C). Keratin 10 ifadesi, SB katmanı hariç tüm uygulanabilir katmanlarda bulunmuştur (Şekil 3E). RHE'ler, desmoglein 1'in uygulanabilir epidermal katmanların hücreler arası boşluğunda ifade edildiği gibi fonksiyonel desmozomal birleşimleri görüntüler (Şekil 3F). Sonuç olarak, beş belirteç de ifade edilir ve uygun epidermal katmanlarda bulunur ve sağlıklı bir epidermal farklılaşma sürecine çevrilir.
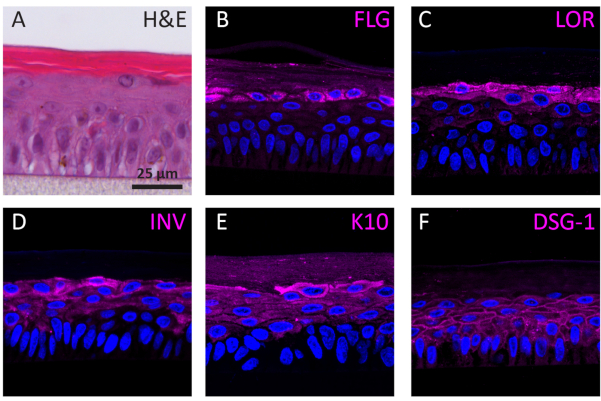
Şekil 3: Yeniden yapılandırılmış insanepidermisinin epidermal farklılaşması, doku yapışması ve doku bütünlüğü. (A) RhE'nin H&E parlak alan mikroskopi görüntüsü. Konfokal floresan mikroskopi görüntüleri (B) filaggrin (FLG), (C) loricrin (LOR), (D) involucrin (INV), (E) keratin 10 (K10) ve (F) desmoglein 1 (DSG-1) macenta temsil edilir. Çekirdek lekesi (DAPI) mavi ile temsil edilir. Ölçek çubuğu 25 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
RhE modelinin bariyer özellikleri hem doku canlılığı hem de bütünlüğü değerlendirilerek araştırılmıştır. Doku bütünlüğü 15 gün sonra teer bir voltohmmetre kullanılarak ölçülerek belirlendi. RHE'ler için kaydedilen 2567 ± 415 Ω.cm2 değerleri sürekli bir bariyer oluşumunu çevirir (Şekil 4A). Bu değerler RhE modelleri71 , 72 , 73,74için bildirilenlerle aynı aralıktadır. Ek olarak, sitotoksik referans kimyasalı (yani Triton X-100) doku canlılığını % 50 (ET50)azaltmak için gerekli maruz kalma süresi tiazolyl mavi tetrazolium bromür (MTT) tahlili ile belirlendi. RhE için ölçülen ET50 değeri 2,1 saatti. Bu değer, tahriş sınıflandırmasının güvenilir tahmini için nitelikli diğer 3D epidermal modellerin kabul aralığına girer (OECD Kılavuzu 439)19.
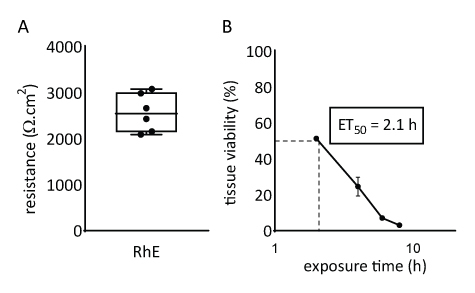
Şekil 4: Yeniden inşa edilen insan epidermisinin bariyer özellikleri. (A) Transepithelial elektrik direnci ile ölçülen doku bütünlüğü (ortalama ± SEM, n=6). (B) ET50, %1 Triton X-100'ün 78,3 μL'sine (ortalama ± SEM, n=3) topikal maruziyet üzerine doku canlılığının ölçülmesine (yani MTT tahlili) göre belirlenir.
RhE'lerin duyarlılığı bilinen proinflamatuar uyaranlar üzerine araştırıldı. RHE'ler, bazolateral bölmenin ortasına 100 μg/mL Escherichia coli lipopolisakkarit (LPS) ve 40 ng/mL tümör nekroz faktörü alfa (TNF-α) kullanılarak sistemik olarak tedavi edildi. 24 saatlik uyaranlardan sonra hücre kültürü ortamı toplandı. Sitotoksiklik bir laktat dehidrogenaz (LDH) tahlili kullanılarak ölçüldü ve bilinen bir membran bozucu olan Triton X-100 deterjanının değerleriyle karşılaştırıldı (Şekil 5). Triton X-100 ile tedavi edilen RHE'lerdeki LDH aktivitesinde önemli bir artış (p < 0.05, tek yönlü ANOVA, Dunnett'in çoklu karşılaştırma testi) gösterildi. LPS ve TNF-α tedavilerinin her ikisi de sitotoksik olmadığını göstermiştir.

Şekil 5: Laktat dehidrogenaz (LDH) tahlili ile ölçülen sitotoksiklik. Veriler kontrol etmek için göreli değerler, tedavi edilmemiş dokular (CTRL); ortalama ± SEM, n=9 (Triton X-100), n=8 (LPS), n=3 (TNF-α). Önem, Dunnett'in çoklu karşılaştırma testi olan tek yönlü ANOVA ile test edildi. Yıldız işareti, CTRL, **p < 0,0001) ile karşılaştırıldığında istatistiksel olarak anlamlı bir fark olduğunu gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
RhE ortamında interlökin 1 alfa (IL-1α) ve interlökin 8 (IL-8) salınımı ELISA'lar kullanılarak ölçüldü. Şekil 6, RHE'ler tarafından LPS ve TNF-α ile meydan okuma üzerine hem nicel hem de göreceli IL-1α ve IL-8 sürümünü göstermektedir. LPS tedavisi istatistiksel olarak anlamlı (p < 0.05, eşleşmemiş Öğrenci T testi) IL-8 (9.6 ± 1.0 kat artış) ve IL-1α (2.7 ± 1.3 kat artış) indüklenmiş bir serbest bırakma ile sonuçlandı. TNF-α, IL-8 seviyelerinde artış eğilimi gözlenmesine rağmen (2,3 ± 0,8 kat artış) IL-8 salınımını önemli ölçüde teşvik etmedi. Bununla birlikte, TNF-α önemli ölçüde (p < 0.05, eşleşmemiş Öğrenci T testi) IL-1α salınımını tetikledi (1.8 ± 0.5 kat artış).
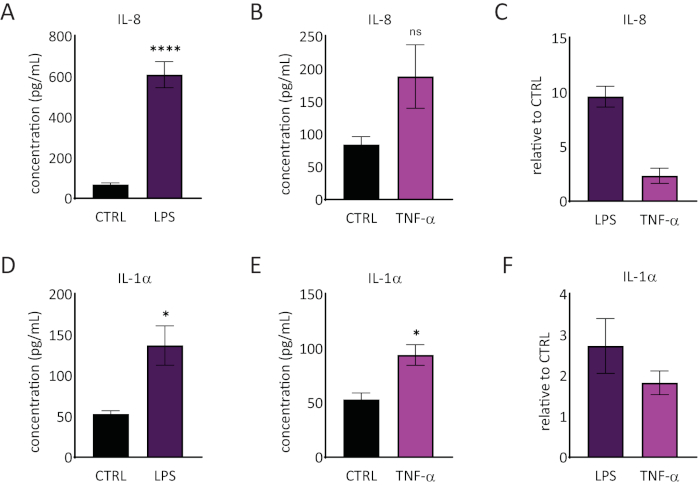
Şekil 6: Yeniden inşa edilen insan epiderminde proinflamatuar yanıtlar. LPS (A) ve TNF-α (B) ile 24 saatlik bir mücadele üzerine RhE tarafından IL-8 sürümükonsantrasyonları. Veriler ortalama ± SEM, n=8 (LPS), n=3 (TNF-α) olarak temsil edilir. (C) Veriler, kontrol, tedavi edilmemiş dokular (CTRL) ± SEM, n=8 (LPS), n=3 (TNF-α) ile karşılaştırıldığında göreli değerin ortalaması olarak temsil edilir. LPS (D) ve TNF-α (E) ile 24 saatlik bir meydan okuma üzerine RhE'nin IL-1α salınımınınkonsantrasyonu. Veriler ortalama ± SEM, n=8 (LPS), n=3 (TNF-α) olarak temsil edilir. (F) Veriler, CTRL ± SEM, n=4 (LPS), n=3 (TNF-α) ile karşılaştırıldığında göreli değer ortalaması olarak temsil edilir. Önemi, eşleşmeyen bir Öğrencinin T testi ile test edildi. Yıldız işareti, CTRL, *p < 0,05, **p < 0,0001) ile karşılaştırıldığında istatistiksel olarak anlamlı farklılıklar gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
RHE'ler farmasötik ve dermato-kozmetik alanlarında tarama aracı olarak yaygın olarak kullanılmaktadır36,75,76,77,78. Birkaç şirket bu tür RHE'leri ticari olarak kullanılabilir hale getirmiş olsa da, maliyetli kalır ve yeni araştırma sorularını ele almak için gerektiği gibi yetiştirme parametrelerini değiştirme olasılığını sınırlar. Bu makale, şirket içi RHE'lerin üretim prosedürünü sağlam ve güvenilir bir şekilde açıklar ve modelin hayvan testlerine alternatif bir yaklaşım olarak alaka düzeyini doğrulamak için elde edilen dokuların ayrıntılı bir karakterizasyonunu sağlar.
Protokoldeki bazı adımlar, uygun keratinosit farklılaşması ve RhE tekrarlanabilirliğini sağlamak için çok önemlidir. Bu, en uygun hücreler, orta tipler ve yetiştirme koşulları kullanılarak gerçekleştirilebilir. Önerilen RhE modelinde, yenidoğan NHEK'ler, yetişkin NHEK'lere kıyasla antijenik maruziyet eksikliği nedeniyle seçildi. Ayrıca, keratinositler türler arası değişkenliği önlemek için Kafkas etnik kökeni ile sınırlıydı. Birincil keratinositler genellikle ayırt etme ve tabakalama yetenekleri için kullanılır79. Ticari olarak veya yetişkin ciltlerinden kurum içi izolasyonla elde edilebilirler.80. Polikarbonat bir membran üzerinde bir hücre hattının (yani HaCaT) yetiştirilmesi, farklılaşmanın başarısız olduğunu göstermiş ve bariyer oluşumu için gerekli olan lipitleri sentezleme kapasitesinin bozulmuş olduğunu göstermiştir.81. Bununla birlikte, hidrojeller, kollajen, fibrin ve küresel kültürler gibi farklı kültür matrislerinin dahil edilmesi, 3D cilt modellerinin başarılı bir şekilde gelişmesine neden oldu.78,82,83,84,85,86. Ölümsüzleştirilmiş hücre hatları, N/TERT, RHE'lerin geliştirilmesi için uygun olduğu gösterilmiştir.35. Birincil keratinositler dördüncü veya beşinci pasajlarında proliferatif kalır61bu nedenle, geçerli protokol keratinositlerin üçüncü pasajlarında kullanılmasını içerir. De Vuyst ve ark. hücre tohumlama yoğunluğunun önemli olduğunu ve yeterli olması gerektiğini göstermiştir (yani, ≥ 2.5x105 hücreler/cm2) bazolateral bölmedeki ortamın apikal bölmeye yayılmasına dikkat etmek için. Yetersiz tohumlama yoğunluğu (yani, < 2.5x105 hücreler/cm2) ortamın bazolateralden apikal bölmeye yayılmasıyla belirtilen uygun bir bariyerin oluşturulamamasına neden olabilir ve bu da ALI kültür koşulları yerine su altında kalmasına neden olabilir62. Serumsuz keratinosit büyüme ortamı (bkz. Malzeme Masası) kimyasal olarak tanımlanmış bir ortamla çalışma avantajı sunduğu ve kontaminasyon riskini azalttığı için tekrarlanabilirlik amacıyla tercih edildi. Bu ortam daha düşük kalsiyum konsantrasyonuna (yani 60 μM) sahiptir ve bu nedenle keratinositlerin çoğalmasını uyarır87. RhE ekiminin ilk adımından itibaren kalsiyum konsantrasyonunun (yani 1,5 mM) artırılması, keratinosit farklılaşması ve cilt bariyeri oluşumu ve homeostazını tercih eder49. Ek olarak, ALI ortamı, SC lipitlerinin oluşumu ve farklılaşmayı teşvik etmek için çok önemli olduğu gösterilen askorbik asit ile desteklenmiştir.52,53,54. ALI ortamı ayrıca, keratinosit transmembran reseptörlerine bağlanabilen fibroblastlar tarafından salgılanan bir büyüme faktörü olan kgf içerir ve aktivasyon üzerine farklılaşma ve yara onarımında çift role sahiptir.55,88. RHE'lere sürekli taze besin sağlamak için ALI ortamını belirli zaman aralıklarında yenilemek önemlidir. Taşıyıcı plaka sisteminin kullanımı, RhE yetiştiriciliği için daha büyük ölçekte (yani 24 kesici uç/ plaka) çok önemlidir. Zamandan tasarruf etme avantajı sunar, kontaminasyon riskini azaltır ve insan hatalarının ortaya konması için daha az yer bırakır. Ayrıca, RHE'leri yüksek miktarda medyada (yani 1,5 mL) kültürleme olanağı sağlar ve bu da gerekli ALI ortam yenileme sayısını azaltır. Ek olarak, tam bir plaka kesici ucu taze ortama sahip bir tabağa aktarma imkanı sunarak kesici uçlarla tek tek temastan kaçınır veya plaka kapağını ortaya çıkarır.
RhE modelinin belirtilmesi gereken birkaç sınırlaması vardır. Yerli insan derisinde bazal tabakadaki keratinositlerin çoğalması ile SC'deki korneositlerin kopması (yani, desquamasyon) arasında bir denge vardır.89. Ancak, in vitro, desquamation gerçekleşmez. Bu nedenle, korneositler RhE'ye bağlı kalır ve fizyolojik olarak daha az alakalı kalın bir SC oluşturur. Bu nedenle, RHE'lerin sınırlı bir ekim süresi vardır. Ayrıca, bu RhE modeli basit ve basittir, çünkü tekil bir hücre tipinden, yani epidermisin en bol hücre türü olan keratinositten oluşur. Bununla birlikte, epidermisin içinde melanositler, dendritik hücreler (örneğin Langerhans hücreleri), T hücreleri (örneğin, CD8) gibi başka hücre tipleri de vardır.+ hücreler) ve Merkel hücreleri13. Cilt modelinin fizyolojik alaka düzeyini artırmak için araştırmacılar melanositler ekleyerek cilt modellerini daha karmaşık hale getirmişlerdir.38 , bağışıklık hücreleri39veya hasta türevi hücreler90. İnsan derisi modellerinin bariyer özelliklerinin, özellikle farklı bir SC lipid bileşimi ve daha yüksek bariyer geçirgenliği nedeniyle, yerli insan cildine kıyasla farklı olduğunu akılda tutmak gerekir. 91,92,93,94,95. Bununla birlikte, çeşitli çalışmalar hipoksi altında ekim yoluyla insan derisi modellerinin bariyer özelliklerinde değişiklikler bildirmektedir.96 veya bağıl nemin azalması97, dermal matrisin chitosan ile modülasyonu98ve kültür ortamında serbest yağ asitlerinde değişiklik99. Ayrıca, hem basit hem de daha karmaşık RHE'lerde, kültür koşulları ve orta kompozisyon patolojik özellikleri taklit etmek için modüle edilebilir. Modele sitokinlerle meydan okuyarak, anormal bir morfoloji100 ve tipik olarak atopik dermatit ve sedef hastalığı gibi yaygın cilt bozukluklarında gözlenen gen ve protein ekspresyon düzeylerinde değişiklikler tespit edilebilir.35,101,102,103,104,105. 3D modelin rekonsiyel sürecini başlatmadan önce keratinositlerdeki spesifik genlerin susturulması, cilt bozukluklarının özelliklerini taklit etmek ve yeni terapötik çözümleri araştırmak için kullanılan bir başka yaklaşımdır.106,107. Sadece epidermal bir tabakayı modellemenin yanı sıra, RhE rekonsesi öncesinde fibroblastlar bir kollajen matrisine katıştırılarak modele bir dermal bölme (yani, insan derisi eşdeğerleri veya tam kalınlıklı modeller olarak adlandırılır) dahil edilebilir, bu da onu fizyolojik olarak daha alakalı ve yaşlanma ve yara iyileşmesi ile ilgili çalışmalar için uygun hale getirir.108,109,110. Ek olarak, melanom ilerlemesini incelemek için insan derisi eşdeğerlerine tümör sferoidleri eklenmiştir.111,112. Cilt modelleri alanındaki en son gelişmeler biyo-baskı ve çip üzerinde cilttir. Son zamanlarda (perfusable) biyo-baskılı cilt eşdeğerlerinin geliştirilmesinde birden fazla araştırma grubu başarılı oldu45,113,114. Önerilen protokol, 24 kuyulu bir formattan ve bir taşıyıcı plakadan yararlanarak, kesici uçların ayrı ayrı işlenmesini önler. Bununla birlikte, çalışma ölçeği hala oldukça sınırlıdır ve otomasyondan yoksundur. Biyo-baskı veya çip üzerinde cilt kullanımı uygulanarak, daha küçük cilt modelleri daha otomatik süreçlerle ve daha büyük ölçekte kullanılabilir.
Bu protokolde açıklanan RhE, zaten geliştirilmiş ve iyi karakterize edilmiş ticari epidermal modellere birden fazla benzerlik sürmüştir. Morfolojik analiz, önerilen RhE modelinde uygulanabilir katmanların sayısının yerli insan derisine kıyasla daha düşük olmasına rağmen (yani, 7-14'e kıyasla 6-7), EpiDerm RhE modelinin (yani 8-12)70ile karşılaştırılabilir olduğunu göstermiştir. EpiDerm, EpiSkin ve SkinEthic modellerine benzer şekilde, üst RhE katmanı yoğun paketlenmiş korneosit katmanlarının sepet örgü desenini gösterir28. Ayrıca, TEM analizi, önerilen RhE modelinde (yani 15-25) SC katmanlarının sayısının EpiDerm (yani 16-25)70ile karşılaştırılabilir olduğunu ortaya koydu. Genel olarak, önerilen RhE modeli, yerli insan epidermisini taklit eden diğer ticarileştirilmiş epidermal modellerle benzer bir yapı göstermektedir. TEER tarafından ölçülen doku bütünlüğü ticari RhE modelleri (yani, 3000-5600 Ω.cm2)71,72,73ve diğer şirket içi RhE'ler (yani, yaklaşık 5000 Ω.cm2)74,115ile arasındadır. Önerilen RhE modeli, farklılaşma ve doku yapışma belirteçlerinin varlığı ve doğru lokalizasyonu ile belirtildiği gibi iyi ayırt edildiğini göstermektedir. Ayrıca, önerilen RhE modeli proinflamatuar uyaranlara (lps ve TNF-α) duyarlı olduğunu göstermektedir.
Sonuç olarak, mevcut protokol, hem akademik hem de özel kurumlardaki araştırmacıların ihtiyaçlarını karşılamak için RHE'lerin güvenilir bir şekilde ve nispeten büyük ölçekte nasıl üretılacağını göstermektedir. Önerilen RhE modeli, mevcut diğer ticari modellere benzer morfolojiye, epidermal farklılaşmaya ve biyolojik yanıt vermeye sahip olduğunu göstermektedir. İlgili bir cilt modeline erişim gerektiğinde hem farmasötik hem de dermato-kozmetik alanı için alternatif bir araç sağlar.
Açıklamalar
Marc Eeman ve Benedetta Petracca, Dow Silicones Belgium'un çalışanlarıdır. Diğer tüm yazarların açıklayacak hiçbir şeyi yoktur.
Teşekkürler
Avrupa Birliği'nin Marie Skłodowska-Curie Grant kapsamındaki Horizon 2020 Araştırma ve İnovasyon Programı, 765602 numaralı hibe anlaşması ile bu çalışmayı finanse etti. Tüm yazarlar Adolphe Merkle Vakfı ve Ferrara Üniversitesi'nin desteğini kabul eder ve Dow Silicones Belçika'yı minnetle kabul eder. Dr. Miguel Spuch-Calvar, RhE yetiştirme sürecinin grafiksel görüntülerini hazırladığı için kabul edilir. Yazarlar teknik destekleri ve tartışmaları için Dr. Barbara Drasler, Dr. Franco Cervellati ve Dr. Agnès Tessier'e teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma Aldrich | A6283 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Antibiotic-antimycotic (100x) | Thermo Fisher Scientific (Gibco) | 15240062 | |
| Aqueous Eosin Y solution | Sigma Aldrich | HT110280 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Calcium chloride (CaCl2) | Sigma Aldrich or Merck | C8106 or 1.02378.0500 | Prepare a stock solution of 0.144 M, filter sterilize and store aliquots at -20 °C. It is recommended to prepare new aliquots every 6 months. |
| DAPI | Roche | 10236276001 | Prepare a stock at 100 μg/mL and store aliquots at -20 °C. Working conditon is 1 μg/mL. |
| Entellan mounting medium | Merck | 1.07960.0500 | Mounting medium for H&E staining. |
| EpiLife medium (referred to as keratinocyte growth medium) | Thermo Fisher Scientific (Gibco) | MEPI500CA | Contains 0.06 mM of Ca2+. |
| Ethanol absolute | Any supplier | N/A | |
| Formalin 10% | Leica Biosystems | 3800770 | |
| Human keratinocytes growth supplement (HKGS) (100x) | Thermo Fisher Scientific (Gibco) | S0015 | To reach final concentrations of 0.2% [v/v] BPE, 0.2 ng/mL human recombinant EGF, 0.18 μg/mL hydrocortisone,5 μg/mL bovine transferrin, and 0.01 µg/mL human recombinant insulin-like growth factor-I. |
| Isopropanol | Biosolve B.V. | 0016264102BS | |
| Kaiser's glycerol gelatine, phenol-free | Merck | 1.08635.0100 | Mounting medium for IF staining. |
| Keratinocyte growth factor (KGF) | R&D Systems | 251-KG-050 | Reconstitute KGF protein at 100 μg/mL in sterile 0.1% [w/v] BSA in PBS. Prepare aliquots and store at -20°C. |
| Lactate dehydrogenase (LDH) assay kit | Roche | 4744926001 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | Prepare a stock solution of 25 mg/mL, filter sterilize and store aliquots at -20°C. It is recommended to prepare new aliquots every 6 months. Store in the dark. |
| Lipopolysaccharide (LPS), E.coli strain O55:B5 | Sigma-Aldrich | L4524 | Prepare a stock of 1 mg/mL in sterile PBS and store aliquots at -20 °C. Working concentration is 100 μg/mL. |
| Mayer’s Haematoxylin | Sigma-Aldrich | MHS80 | |
| Normal human epidermal keratinocytes (NHEKs) | Lonza | 00192906 | Human primary keratinocytes isolated from neonatal foreskin, pooled from at least three donors. |
| Phosphate-buffered saline | Thermo Fisher Scientific (Gibco) | 10010056 or 10010-015 | Reference numbers can vary between countries. |
| Recombinant tumor necrosis factor alpha (TNF-α) | ImmunoTools | 11344483 | Prepare a stock of 100 μg/mL in sterile ultrapure water. Working concentration is 40 ng/mL |
| Sterile ultrapure water | Any supplier | N/A | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M5655 | Prepare a stock of 5 mg/mL MTT in sterile PBS. Working concentration is 1 mg/mL. |
| Triton X-100 | Sigma-Aldrich | 93426 | |
| Trypan blue (0.4% [v/v]) | Any supplier | N/A | |
| Trypsin inhibitor | Thermo Fisher Scientific (Gibco) | R007100 | |
| Trypsin/EDTA (0.05% [v/v]) | Thermo Fisher Scientific (Gibco) | 25300054 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | Ab150113 | |
| Tri-sodium citrate dihydrate | Merck | 1.06448.0500 | For antigen retrieval buffer for IF staining. |
| Goat Anti-Rabbit IgG H&L (Dylight 488) | Agrisera | AS09 633 | |
| Filaggrin Mouse antibody | BioTechne (Novus Biologicals) | NBP2-53243 | |
| Involucrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP2-33742 | |
| Keratin 10 Mouse antibody | BioTechne (Novus Biologicals) | NBP2-32962 | |
| Desmoglein-1 Mouse antibody | BioTechne (Novus Biologicals) | MAB944 | |
| Loricrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP1-33610 |
Referanslar
- Alberts, B., Johnson, A., Lewis, J. . Molecular Biology of the Cell. 4th edition. Antioxidants & Redox Signaling. , (2002).
- Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., Polla, B. S. The stratum corneum: a double paradox. Journal of Cosmetic Dermatology. 7 (2), 143-148 (2008).
- Moore, K. L., Dalley, A. F. . Clinically Orientated Anatomy. , (2010).
- Barthel, R., Aberdam, D. Epidermal stem cells. Journal of the European Academy of Dermatology and Venereology. 19 (4), 405-413 (2005).
- Green, K. J., Simpson, C. L. Desmosomes: new perspectives on a classic. Journal of Investigative Dermatology. 127 (11), 2499-2515 (2007).
- Feingold, K. R. Lamellar bodies: the key to cutaneous barrier function. Journal of Investigative Dermatology. 132 (8), 1951-1953 (2012).
- Elias, M. P., Feingold, K. R., Fartasch, M. The epidermal lamellar body as a multifunctional secretory organelle. Skin Barrier. , 261-272 (2006).
- Tobin, D. J. Biochemistry of human skin-our brain on the outside. Chemical society reviews. 35 (1), 52-67 (2006).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12), 2080-2095 (2006).
- Weinstein, G. D., McCullough, J. L., Ross, P. Cell proliferation in normal epidermis. Journal of Investigative Dermatology. 82 (6), 623-628 (1984).
- Madison, K. C. Barrier function of the skin: "la raison d'être" of the epidermis. Journal of Investigative Dermatology. 121 (2), 231-241 (2003).
- Suter, M. M., et al. The keratinocyte in epidermal renewal and defence. Veterinary Dermatology. 20 (5-6), 515-532 (2009).
- McLafferty, E., Hendry, C. The integumentary system: anatomy, physiology and function of skin. Nursing Standard. 27 (7), 35-43 (2012).
- Monteiro-Riviere, N. A. . Toxicology of the skin. , (2010).
- Dellambra, E., Odorisio, T., D'Arcangelo, D., Failla, C. M., Facchiano, A. Non-animal models in dermatological research. ALTEX. 36 (2), 177-202 (2019).
- Gordon, S., et al. Non-animal models of epithelial barriers (skin, intestine and lung) in research, industrial applications and regulatory toxicology. Altex. 32 (4), 327-378 (2015).
- Kandárová, H., et al. The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests - An assessment of the performance of the optimised test. Alternatives to laboratory animals : ATLA. 33 (4), 351-367 (2005).
- Kandárová, H., et al. Assessment of the skin irritation potential of chemicals by using the SkinEthic reconstructed human epidermal model and the common skin irritation protocol evaluated in the ECVAM skin irritation validation study. Alternatives to laboratory animals : ATLA. 34 (4), 393-406 (2006).
- OECD. Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. OECD. , (2019).
- Alépée, N., Grandidier, M. H., Cotovio, J. Sub-categorisation of skin corrosive chemicals by the EpiSkinTM reconstructed human epidermis skin corrosion test method according to UN GHS: Revision of OECD Test Guideline 431. Toxicology in Vitro. 28 (2), 131-145 (2014).
- OECD. Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method. OECD. , (2019).
- Mehling, A., et al. In vitro RHE skin sensitisation assays: applicability to challenging substances. Regulatory Toxicology and Pharmacology. 108, 104473 (2019).
- . SENS-IS | EURL ECVAM - TSAR Available from: https://tsar.jrc.ec.europa.eu/test-method/tm2011-11 (2020)
- Lelièvre, D., et al. The episkin phototoxicity assay (EPA): development of an in vitro tiered strategy using 17 reference chemicals to predict phototoxic potency. Toxicology in Vitro. 21 (6), 977-995 (2007).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Pellevoisin, C., Bouez, C., Cotovio, J. Cosmetic industry requirements regarding skin models for cosmetic testing. Skin Tissue Models. , 3-37 (2018).
- Niehues, H., et al. 3D skin models for 3R research: the potential of 3D reconstructed skin models to study skin barrier function. Experimental Dermatology. 27 (5), 501-511 (2018).
- Netzlaff, F., Lehr, C. -. M., Wertz, P. W., Schaefer, U. F. The human epidermis models EpiSkin®, SkinEthic® and EpiDerm®: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport. European Journal of Pharmaceutics and Biopharmaceutics. 60 (2), 167-178 (2005).
- Prieux, R., Eeman, M., Rothen-Rutishauser, B., Valacchi, G. Mimicking cigarette smoke exposure to assess cutaneous toxicity. Toxicology in Vitro. 62, 104664 (2020).
- Petracca, B., Rothen-Rutishauser, B., Valacchi, G., Eeman, M. Bench approaches to study the detrimental cutaneous impact of troposperic ozone. Journal of Exposure Science and Environmental Epidemiology. 31, 137-148 (2021).
- Dijkhoff, I. M., et al. Impact of airborne particulate matter on skin: a systematic review from epidemiology to in vitro studies. Particle and fibre toxicology. 17 (1), 35 (2020).
- El Ghalbzouri, A., Siamari, R., Willemze, R., Ponec, M. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential according to the ECVAM guidelines. Toxicology in Vitro. 22 (5), 1311-1320 (2008).
- Chacón, M., et al. Development of an in-house reconstructed human epidermis model as an alternative method in skin corrosion assessment. Toxicology in Vitro. 65, 104779 (2020).
- Pedrosa, T. d. o. N., et al. A new reconstructed human epidermis for in vitro skin irritation testing. Toxicology in Vitro. 42, 31-37 (2017).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Poumay, Y., Coquette, A. Modelling the human epidermis in vitro: tools for basic and applied research. Archives of dermatological research. 298 (8), 361-369 (2007).
- Rikken, G., Niehues, H., van den Bogaard, E. H. Organotypic 3D skin models: human epidermal equivalent cultures from primary keratinocytes and immortalized keratinocyte cell lines. Methods in Molecular Biology. 2154, 45-61 (2020).
- Duval, C., et al. Human skin model containing melanocytes: essential role of keratinocyte growth factor for constitutive pigmentation-functional response to α-melanocyte stimulating hormone and forskolin. Tissue engineering. Part C, Methods. 18 (12), 947-957 (2012).
- Hutter, V., Kirton, S. B., Chau, D. Y. S. Immunocompetent human in vitro skin models. Skin Tissue Models. , 353-373 (2018).
- Kinsner, A., Lesiak-Cyganowska, E., Śladowski, D. In vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking. 2 (3), 165-171 (2001).
- Black, A. F., Bouez, C., Perrier, E., Schlotmann, K., Chapuis, F., Damour, O. Optimization and characterization of an engineered human skin equivalent. Tissue Engineering. 11 (5-6), 723-733 (2005).
- Reijnders, C. M. A., et al. Development of a full-thickness human skin equivalent in vitro model derived from TERT-immortalized keratinocytes and fibroblasts. Tissue Engineering. Part A. 21 (17-18), 2448-2459 (2015).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering - In vivo and in vitro applications. Advanced Drug Delivery Reviews. 63 (4-5), 352-366 (2011).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Pittelkow, M. R., Scott, R. E. New techniques for the in vitro culture of human skin keratinocytes and perspectives on their use for grafting of patients with extensive burns. Mayo Clinic Proceedings. 61 (10), 771-777 (1986).
- Elias, P. M., Ahn, S. K., Brown, B. E., Crumrine, D., Feingold, K. R. Origin of the epidermal calcium gradient: regulation by barrier status and role of active vs passive mechanisms. Journal of Investigative Dermatology. 119 (6), 1269-1274 (2002).
- Elias, P. M., et al. Modulations in epidermal calcium regulate the expression of differentiation-specific markers. Journal of Investigative Dermatology. 119 (5), 1128-1136 (2002).
- Lee, S. E., Lee, S. H. Skin barrier and calcium. Annals of Dermatology. 30 (3), 265-275 (2018).
- Prunieras, M., Regnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. Journal of Investigative Dermatology. 81, 28-33 (1983).
- Poumay, Y., et al. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Archives of Dermatological Research. 296 (5), 203-211 (2004).
- Ponec, M., et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Savini, I., et al. Characterization of keratinocyte differentiation induced by ascorbic acid: Protein kinase C involvement and vitamin C homeostasis. Journal of Investigative Dermatology. 118 (2), 372-379 (2002).
- Pasonen-Seppänen, S., et al. Vitamin C enhances differentiation of a continuous keratinocyte cell line (REK) into epidermis with normal stratum corneum ultrastructure and functional permeability barrier. Histochemistry and Cell Biology. 116 (4), 287-297 (2001).
- Beer, H. D., et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 34-39 (2000).
- Steven, A. C., Bisher, M. E., Roop, D. R., Steinert, P. M. Biosynthetic pathways of filaggrin and loricrin--two major proteins expressed by terminally differentiated epidermal keratinocytes. Journal of structural biology. 104 (1-3), 150-162 (1990).
- Rice, R. H., Thacher, S. M. Involucrin: a constituent of cross-linked envelopes and marker of squamous maturation. Biology of the Integument. , 752-761 (1986).
- Elias, P. M., Barrier Feingold, K. R. . Skin Barrier. , (2011).
- Marionnet, C., et al. Morphogenesis of dermal-epidermal junction in a model of reconstructed skin: beneficial effects of vitamin C. Experimental Dermatology. 15 (8), 625-633 (2006).
- Frikke-Schmidt, H., Lykkesfeldt, J. Keeping the intracellular vitamin C at a physiologically relevant level in endothelial cell culture. Analytical Biochemistry. 397 (1), 135-137 (2010).
- Castro-Muñozledo, F., Hernández-Quintero, M., Marsch-Moreno, M., Kuri-Harcuch, W. Cultivation, serial transfer, and differentiation of epidermal keratinocytes in serum-free medium. Biochemical and Biophysical Research Communications. 236 (1), 167-172 (1997).
- De Vuyst, E., et al. Reconstruction of normal and pathological human epidermis on polycarbonate filter. Epidermal Cells. Methods in Molecular Biology (Methods and Protocols. , 191-201 (2013).
- Chen, R. H., Zhu, J., Zhang, R. Z., Wang, S. Y., Li, Y. The tolerance of human epidermal cells to trypsinization in vitro. Cell and Tissue Banking. 21 (2), 257-264 (2020).
- Pohanish, R. P. . Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2, (2012).
- Tsaousis, K. T., et al. Time-dependent morphological alterations and viability of cultured human trabecular cells after exposure to Trypan blue. Clinical and Experimental Ophthalmology. 41 (5), 484-490 (2013).
- Kim, S. I., et al. Application of a non-hazardous vital dye for cell counting with automated cell counters. Analytical Biochemistry. 492, 8-12 (2016).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Fartasch, M., Ponec, M. Improved barrier structure formation in air-exposed human keratinocyte culture systems. Journal of Investigative Dermatology. 102 (3), 366-374 (1994).
- Bouwstra, J. A., Honeywell-Nguyen, P. L., Gooris, G. S., Ponec, M. Structure of the skin barrier and its modulation by vesicular formulations. Progress in Lipid Research. 42 (1), 1-36 (2003).
- Ponec, M., Boelsma, E., Gibbs, S., Mommaas, M. Characterization of reconstructed skin models. Skin Pharmacology and Physiology. 15 (1), 4-17 (2002).
- Hubaux, R., Wauters, A., Chrétien, A., Poumay, Y., Salmon, M. Reconstructed human epidermis response to urban particulate matter activates multiple stress-related pathways and impacts the skin barrier function. 23th IFSCC Conference. , 125-134 (2017).
- Lin, Y. -. C., et al. Testing method development and validation for in vitro skin irritation testing (SIT) by using reconstructed human epidermis (RhE) skin equivalent - EPiTRI®. Alternatives to Animal Testing. , 8-19 (2019).
- Alexander, F. A., Eggert, S., Wiest, J. Skin-on-a-chip: Transepithelial electrical resistance and extracellular acidification measurements through an automated air-liquid interface. Genes. 9 (2), 114 (2018).
- van den Bogaard, E., et al. Perspective and consensus opinion: good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Kandárová, H., Hayden, P., Klausner, M., Kubilus, J., Sheasgreen, J. An in vitro skin irritation test (SIT) using the EpiDerm reconstructed human epidermal (RHE) model. Journal of Visualized Experiments. (29), e1366 (2009).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical pharmacology advances and applications. 8, 163-176 (2016).
- De Wever, B., Kurdykowski, S., Descargues, P. Human skin models for research applications in pharmacology and toxicology: introducing nativeSkin, the "missing link" bridging cell culture and/or reconstructed skin models and human clinical testing. Applied In Vitro Toxicology. 1 (1), 26-32 (2015).
- Klicks, J., von Molitor, E., Ertongur-Fauth, T., Rudolf, R., Hafner, M. In vitro skin three-dimensional models and their applications. Journal of Cellular Biotechnology. 3 (1), 21-39 (2017).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cellular and Developmental Biology - Animal. 22 (12), 695-705 (1986).
- Johansen, C. Generation and culturing of primary human keratinocytes from adult skin. Journal of Visualized Experiments. (130), e56863 (2017).
- Boelsma, E., Verhoeven, M. C. H., Ponec, M. Reconstruction of a human skin equivalent using a spontaneously transformed keratinocyte cell line (HaCaT). Journal of Investigative Dermatology. 112 (4), 489-498 (1999).
- Zhao, X., et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering. Advanced Healthcare Materials. 5 (1), 108-118 (2016).
- Peura, M., et al. Paracrine factors from fibroblast aggregates in a fibrin-matrix carrier enhance keratinocyte viability and migration. Journal of Biomedical Materials Research. Part A. 95 (2), 658-664 (2010).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCat keratinocytes in organotypic coculture with human dermal fibroblasts. Journal of Investigative Dermatology. 112 (3), 343-353 (1999).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue engineering. Part C, Methods. 20 (6), 473-484 (2014).
- Alameda, J. P., et al. IKKα regulates the stratification and differentiation of the epidermis: Implications for skin cancer development. Oncotarget. 7 (47), 76779-76792 (2016).
- Bikle, D. D., Xie, Z., Tu, C. L. Calcium regulation of keratinocyte differentiation. Expert Review of Endocrinology and Metabolism. 7 (4), 461-472 (2012).
- Staiano-Coico, L., et al. Human keratinocyte growth factor effects in a porcine model of epidermal wound healing. Journal of Experimental Medicine. 178 (3), 865-878 (1993).
- Egelrud, T. Desquamation in the stratum corneum. Acta Dermato-Venereologica. 80, 44-45 (2000).
- Jean, J., Lapointe, M., Soucy, J., Pouliot, R. Development of an in vitro psoriatic skin model by tissue engineering. Journal of Dermatological Science. 53 (1), 19-25 (2009).
- Lotte, C., Patouillet, C., Zanini, M., Messager, A., Roguet, R. Permeation and skin absorption: reproducibility of various industrial reconstructed human skin models. Skin Pharmacology and Applied Skin Physiology. 15, 18-30 (2002).
- Ponec, M., Weerheim, A., Lankhorst, P., Wertz, P. New acylceramide in native and reconstructed epidermis. Journal of Investigative Dermatology. 120 (4), 581-588 (2003).
- Thakoersing, V. S., et al. Unraveling barrier properties of three different in-house human skin equivalents. Tissue engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Thakoersing, V. S., et al. presence of monounsaturated fatty acids in the stratum corneum of human skin equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Van Smeden, J., et al. Combined LC/MS-platform for analysis of all major stratum corneum lipids, and the profiling of skin substitutes. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1841 (1), 70-79 (2014).
- Mieremet, A., et al. Human skin equivalents cultured under hypoxia display enhanced epidermal morphogenesis and lipid barrier formation. Scientific Reports. 9 (1), 7811 (2019).
- Mieremet, A., et al. Unravelling effects of relative humidity on lipid barrier formation in human skin equivalents. Archives of Dermatological Research. 311 (9), 679-689 (2019).
- Mieremet, A., Rietveld, M., Absalah, S., Van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by Chitosan modulated dermal matrices. PLoS ONE. 12 (3), 0174478 (2017).
- Mieremet, A., et al. Contribution of palmitic acid to epidermal morphogenesis and lipid barrier formation in human skin equivalents. International Journal of Molecular Sciences. 20 (23), 6069 (2019).
- Boniface, K., et al. IL-22 inhibits epidermal fifferentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- De Vuyst, E., Salmon, M., Evrard, C., Lambert de Rouvroit, C., Poumay, Y. Atopic dermatitis studies through in vitro models. Frontiers in Medicine. 4, 119 (2017).
- Danso, M. O., et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents. Journal of Investigative Dermatology. 134 (7), 1941-1950 (2014).
- Soboleva, A. G., Mezentsev, A., Zolotorenko, A., Bruskin, S., Pirusian, E. Three-dimensional skin models of psoriasis. Cells Tissues Organs. 199 (5-6), 301-310 (2014).
- Desmet, E., Ramadhas, A., Lambert, J., Gele, M. Van In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research. Experimental Biology and Medicine. 242 (11), 1158-1169 (2017).
- Niehues, H., van den Bogaard, E. H. Past, present and future of in vitro 3D reconstructed inflammatory skin models to study psoriasis. Experimental Dermatology. 27 (5), 512-519 (2018).
- Pendaries, V., et al. Knockdown of filaggrin in a three-dimensional reconstructed human epidermis impairs keratinocyte differentiation. Journal of Investigative Dermatology. 134 (12), 2938-2946 (2014).
- Niehues, H., et al. Epidermal equivalents of filaggrin null keratinocytes do not show impaired skin barrier function. Journal of Allergy and Clinical Immunology. 139 (6), 1979-1981 (2017).
- Reuter, C., Walles, H., Groeber, F. Preparation of a three-dimensional full thickness skin equivalent. Methods in Molecular Biology. 1612, 191-198 (2017).
- Bataillon, M., et al. Characterization of a new reconstructed full thickness skin model, t-skinTM, and its application for investigations of anti-aging compounds. International Journal of Molecular Sciences. 20 (9), 2240 (2019).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments. (96), e52576 (2015).
- Li, L., Fukunaga-Kalabis, M., Herlyn, M. The three-dimensional human skin reconstruct model: a tool to study normal skin and melanoma progression. Journal of Visualized Experiments. (54), e2937 (2011).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments. (135), e57500 (2018).
- Wei, Z., et al. Two-dimensional cellular and three-dimensional bio-printed skin models to screen topical-use compounds for irritation potential. Frontiers in Bioengineering and Biotechnology. 8, 109 (2020).
- Derr, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated morphology and barrier function. Tissue Engineering - Part C: Methods. 25 (6), 334-343 (2019).
- Frankart, A., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruction at the air-liquid interface. Experimental Dermatology. 21 (11), 871-875 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır