Method Article
Coltivare un'epidermide umana ricostruita tridimensionale su larga scala
In questo articolo
Riepilogo
Questo protocollo descrive un metodo semplice per coltivare l'epidermide umana ricostituita tridimensionale in modo riproducibile e robusto. Inoltre, caratterizza la relazione struttura-funzione del modello di barriera epidermica. Vengono presentate anche le risposte biologiche dell'epidermide umana ricostituita su stimoli proinflammatori.
Abstract
Viene presentato un modello tridimensionale di epidermide umana ricostruito da cheratinociti primari neonatale. Qui viene descritto un protocollo per il processo di coltivazione e la caratterizzazione del modello. I cheratinociti primari neonatale vengono coltivati immersi su inserti in policarbonato permeabile e sollevati nell'interfaccia aria-liquido tre giorni dopo la semina. Dopo quattordici giorni di stimolazione con fattori di crescita definiti e acido ascorbico in mezzo di coltura ad alto calcio, il modello è completamente differenziato. L'analisi istologica ha rivelato un'epidermide completamente stratificata, imitando la morfologia della pelle umana nativa. Per caratterizzare il modello e le sue funzioni barriera, i livelli proteici e la localizzazione specifici per la differenziazione dei cheratinociti allo stadio iniziale (cioè la cheratina 10), la differenziazione in fase avanzata (cioè involucrina, loricrina e filaggrina) e l'adesione dei tessuti (cioè la desmogleina 1), sono stati valutati per immunofluorescenza. L'integrità della barriera tissutale è stata ulteriormente valutata misurando la resistenza elettrica transepiteliale. Rl'epidermide umana edistruta rispondeva agli stimoli proinflammatori (cioè lipopolysaccaride e fattore alfa della necrosi tumorale), portando ad un aumento del rilascio di citochine (cioè l'interleuchina 1 alfa e l'interleuchina 8). Questo protocollo rappresenta un metodo in vitro semplice e riproducibile per coltivare l'epidermide umana ricostruita come strumento per valutare gli effetti ambientali e un'ampia gamma di studi relativi alla pelle.
Introduzione
L'epidermide è lo strato più esterno della pelle, all'interfaccia diretta tra il corpo umano e l'ambiente esterno. Le sue funzioni principali sono fornire protezione e idratazione1. L'epidermide agisce come un'efficace barriera fisica contro gli agenti esterni e previene l'eccessiva perdita d'acqua dal corpo. Queste funzioni della pelle dipendono principalmente dalla disposizione cellulare negli strati più esterni della pelle, dalla composizione e dall'organizzazione dei lipidi intercellulari2. L'epidermide è composta principalmente da cheratinociti che migrano verso l'alto verso il lato esterno del tessuto e subiscono differenziazione. Ci sono 4-5 strati epidermici che sono caratterizzati dal loro stadio di differenziazione. Dall'interno verso l'esterno, gli strati epidermici partono dall'epidermide praticabile, cioè lo strato basale (SB), lo strato spinoso (SS) e lo strato granulosum (SG), allo strato più alto non vitale, cioè lo strato corneo (SC)3. Lo strato basale è composto principalmente da cheratinociti proliferati arricchiti di cheratinociti, che migrano attraverso le SS al momento delladifferenziazione 4. Durante la maturazione dei cheratinociti, si verificano vari cambiamenti nell'espressione e nella struttura delle proteine. I cheratinociti aderiscono attraverso la formazione di giunzioni demosomali5. Nell'SG, viene avviata la generazione di corpi lamellari. Sono costituiti da precursori lipidici ed enzimi che sono cruciali per la formazione della funzione barriera cutanea6. L'SG è anche caratterizzato dalla presenza di granuli di cheratoialina nel citoplasma dei cheratinociti. All'interfaccia con l'SC, il contenuto dei corpi lamellari viene estruso negli spazi intercellulari e i lipidi non polari come ceramidi, colesterolo e acidi grassi liberi si organizzano in bistrati lipidici lamellari impilati per formare la matrice lipidica extracellulare7. Nel SC, le cellule perdono tutti gli organelli cellulari compreso il nucleo, a causa di processi di degradazione enzimatica e adottano una morfologia appiattita. Sono circondati da una busta cornificata fatta di strati proteici incrociati e sono indicati come corneociti8,9. I componenti desmosomiali sono collegati all'involucro cornificato per formare corneodesmosomes e legare i corneociti insieme. L'epitelio risultante viene continuamente rinnovato dalle cellule staminali, con un tempo di turnover di circa 5-6 settimane10. Il processo di differenziazione dei cheratinociti, che si traduce in un'epidermide completamente stratificata, è cruciale per la formazione della funzione barriera della pelle11.
Durante il mento e l'infiammazione, i cheratinociti inducono cambiamenti nelle molecole di adesione e nei recettori superficiali e innescano risposte proinfiammatorie attraverso la secrezione di citochine, chemiochine e peptidi antimicrobici12. La pelle non è solo una barriera fisica contro le sostanze esogene; agisce anche come sensore immunitario all'esposizione a agenti patogeni. Inoltre, regola la diffusione di diverse sostanze attraverso i suoi strati, come il contenuto di acqua per proteggere il corpo umano dalla disidratazione. La pelle è anche coinvolta nella sintesi della vitamina D e ha varie altre funzionimetaboliche 3,13,14.
Per valutare gli effetti negativi delle sostanze esogene, i tossicologi si affidano da decenni alla sperimentazione animale, ma al giorno d'oggi non è l'approccio preferito. Oltre ad avere una capacità predittiva limitata per la tossicità umana, i modelli animali comportano numerose questioni etiche. Il divieto della sperimentazione animale nell'industria cosmetica e la raccomandazione di seguire il principio 3R (vale a dire sostituzione, riduzione e perfezionamento) nella ricerca hanno portato allo sviluppo di metodi di prova alternativi basati su approcci in vitro15. I primi modelli di cellule della pelle in vitro sono già stati descritti negli anni '90 e un impressionante sviluppo dalle semplici mono colture di cheratinociti umani all'epidermide completamente differenziata e ai modelli a pieno spessore è statoraggiunto 16. Al giorno d'oggi, l'ingegneria dei tessuti cutanei ha acquisito importanza sia nel campo farmaceutico che in quello dermato-cosmetico. Negli ultimi due decenni, diverse aziende hanno commercializzato epidermide umana ricostruita tridimensionale (3D) (RhE) che rappresentano strumenti standardizzati e riproducibili per studi relativi alla pelle. Diversi modelli commerciali rhe sono accettati per il test cutaneo in vitro di sostanze chimiche secondo le linee guida dell'OCSE per la prova dell'irritazione cutanea17,18 (cioè, linea guida di prova 43919)e corrosione cutanea20 (cioè, linea guida di prova 43121). Il test in vitro per la sensibilizzazione cutanea22 (cioè il saggio SENS-IS) è attualmente in pista di approvazione e sotto peer-review23. Ci sono anche numerosi altri saggi sviluppati che utilizzano modelli rhe commerciali, per valutare la fototossicità24,per testare formulazionidi farmaci 25,formulazioni cosmetiche e principi attivi26,per studiare la funzione barriera cutanea27 e per testare la risposta biologica agli stressanti ambientali28,29,30,31.
Oltre ai modelli di pelle 3D disponibili in commercio, più gruppi di ricerca hanno sviluppato il proprio RhEs32,33,34,35,36,37. I RhEs internamente offrono il vantaggio di controllare le condizioni di coltura in base allo scopo dello studio. In particolare, i ricercatori possono selezionare il tipo e la fonte dei cheratinociti da utilizzare per la ricostituzione del loro modello epidermico 3D (cioè primario vs immortalato, neonatale vs invecchiato, donatori casuali single vs. Hanno la possibilità di variare la composizione del mezzo di coltura e incorporare fattori di crescita, vitamine o altri composti che possono modulare l'espressione di proteine target o lipidi. Con RhEs interno, i ricercatori possono anche indagare le risposte biologiche e le proprietà biomeccaniche in funzione dello stato di differenziazione del modello 3D. Oltre a questi parametri intuitivi, ci sono continui sforzi per aumentare la complessità dei modelli di pelle 3D e renderli più fisiologicamente rilevanti, ad esempio aggiungendo altri tipi di cellule epidermiche (ad esempio melanociti e cellule immunitarie)38,39,coltivando i cheratinociti sopra una matrice di collagene popolata da fibroblasti40,41,42e includendo componenti della rete vascolare43,44,45.
Sebbene sia possibile ottimizzare le condizioni culturali in base a specifiche esigenze, ci sono parametri che devono essere rispettati per garantire sia la qualità che la pertinenza di un RhE. Per coltivare tessuti RhE, i normali cheratinociti epidermici umani (NHEK) vengono seminati in specifici inserti di coltura permeabili la cui membrana sintetica porosa separa i pozzi in due compartimenti, cioè il compartimento apicale e basolaterale. La porosità della membrana (cioè una dimensione dei pori di 0,4 μm) è tale da consente la formazione di un monostrato cellulare nel compartimento apicale senza migrazione delle cellule al lato dell'inserto basale e l'alimentazione dei cheratinociti con nutrienti essenziali dal mezzo di coltura contenuto nel compartimento basolaterale. All'inizio del processo di ricostituzione, gli NHEK vengono coltivati in condizioni sommerse per alcuni giorni per consentire la loro adesione alla membrana. Il livello di calcio in entrambi i compartimenti è aumentato rispetto alla concentrazione di calcio utilizzata per la coltura 2D degli NHEK per rallentare la proliferazione delle cellule e promuovere invece la lorodifferenziazione 46. Un gradiente epidermico di calcio è essenziale per regolare la formazione della barriera e l'omeostasi47,48. Alti livelli di calcio (cioè fino a 1,5 mM) promuovono la formazione di giunzioni intercellulari e modulano la formazione dell'involucro cornificato durante la differenziazione terminale49. Una volta cheratinociti formano un monostrato continuo e strettamente aderente sulla membrana di supporto, il mezzo dal compartimento apicale viene rimosso e il processo di coltura continua all'interfaccia aria-liquido (ALI) per stimolare la stratificazione e stabilire una barriera epidermica50,51. Condizioni di coltura specifiche sono cruciali per ottenere un epitelio completamente stratificato36. Durante il processo di ricostituzione all'ALI, il mezzo nel compartimento basolaterale viene integrato con fattore di crescita cheratinocita (KGF), insulina, calcio e acido ascorbico. L'acido ascorbico svolge un ruolo importante nella formazione di un'appropriata barriera lipidica SC, molto simile a quella della pelle umana nativa52. I cheratinociti coltivati in mezzo integrato con acido ascorbico dimostrano un fenotipo differenziato, con un maggior numero di granuli di cheratoialina, così come lamelle lipidiche intercellulari organizzate negli interstizi dei corneociti52. Tale integrazione è essenziale per migliorare la funzione barriera epidermica aumentando il contenuto di buste cornificate ed evitando l'esaurimento delle riserve di antiossidanti idrofili53,54. Kgf, un importante mediatore paracrino di proliferazione e differenziazione epidermica, viene utilizzato per stimolare gli NHEK55.
I principali aspetti negativi dei RhEs interni includono la perdita di standardizzazione tra gli istituti di ricerca e l'aumento dell'intensità di lavoro e del consumo di tempo (fino a 3 settimane rispetto ai modelli commerciali pronti all'uso). L'obiettivo del presente documento è quello di affrontare questi inconvenienti, stabilendo le basi per la produzione su scala più ampia. Oltre ai vantaggi di cui sopra dei RhEs interno, l'attuale protocollo mira a ridurre l'intra-e l'intervariabilità tra i tessuti, a ridurre i rischi di contaminazione e a snellire il processo di coltivazione.
L'attuale protocollo descrive un metodo riproducibile e robusto per coltivare rhes utilizzando NHEK neonatale. Inoltre, mostra risultati rappresentativi della caratterizzazione della morfologia delle Re, dell'integrità della barriera e dell'espressione di proteine specifiche per la differenziazione epidermica. La struttura morfologica delle re è stata esaminata utilizzando la colorazione ematossilina e l'eosina (H&E) e la microscopia elettronica a trasmissione (TEM). Per valutare l'integrità della barriera, sono stati misurati la resistenza elettrica transepidermica (TEER) e il tempo di esposizione a Triton X-100 per ridurre il 50% della vitalità tissutale (ET50). La formazione di giunzioni demosomali (cioè desmogleina 1) è stata analizzata mediante immunofluorescenza (IF) per valutare l'adesione dei cheratinociti. La formazione di proteine strutturali epidermiche (cioè involucrina, loricrina e filaggrina) è stata valutata e rilevata con IF. Queste proteine sono coinvolte nella formazione dell'involucro proteico altamente incrociato che circonda i corneociti SC e di conseguenza sono marcatori importanti per la differenziazione epidermica in fase avanzata56,57. Inoltre, l'IF è stato utilizzato per analizzare la cheratina 10, una proteina indotta in cellule differenziate in fase iniziale nell'SS58 e trovata all'interno di tutti gli strati differenziati. Infine, è stata studiata la risposta del RhE agli stimoli proinfiammatori (cioè lipopolysaccaride e fattore alfa della necrosi tumorale). I livelli di interleuchina 1 alfa (IL-1α) e interleuchina 8 (IL-8) sono stati misurati nei mezzi di coltura cellulare, utilizzando saggi immunoassorbenti legati all'enzima (ELISA).
Protocollo
Rivedere e aderire a considerazioni e condizioni etiche nazionali e internazionali relative all'uso di tessuti o cellule umane prima di pianificare ed eseguire qualsiasi attività di ricerca che coinvolga questo protocollo.
NOTA: Tutte le fasi di questo protocollo devono essere eseguite in condizioni asettiche. Le pratiche di biosicurezza di livello 2 sono il requisito minimo per la coltivazione del RhEs. Tutte le precauzioni di sicurezza necessarie devono essere prese quando si maneggiano le sostanze chimiche/reagenti descritte nel presente protocollo.
1. Preparazione dei mezzi di coltura cellulare
NOTA: Esistono tre diversi tipi di mezzi di coltura senza siero utilizzati per la coltivazione del re (tabella 1): (i) il mezzo basale a basso livello di calcio (60 μM Ca2+)utilizzato per la coltura 2D degli NHEK; ii il mezzo sommerso ad alto livello di calcio (1,5 mM Ca2+)utilizzato per la semina degli NHEK nel sistema di inserti di coltura cellulare; e iii) il mezzo di interfaccia aria-liquido (ALI) ad alto livello di calcio (1,5 mM Ca2+),acido ascorbico e fattore di crescita dei cheratinociti (KGF).
| Medio | Informazioni medie | Quantità richiesta |
| Mezzo basale | Mezzo di crescita cheratinocita | 36 mL/24 pozzali |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x antibiotico-antimicotico | ||
| Mezzo sommerso | Mezzo di crescita cheratinocita | 36 mL/24 pozzali |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x antibiotico-antimicotico | ||
| + 1,5 mM Ca2+ | ||
| Mezzo di interfaccia aria-liquido | Mezzo di crescita cheratinocita | 216 mL/24 pozzali |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x antibiotico-antimicotico | ||
| + 1,5 mM Ca2+ | ||
| + 50 μg/mL acido ascorbico | ||
| + 10 ng/mL fattore di crescita cheratinocita |
La tabella 1. Tabella riassuntiva dei diversi mezzi di coltura utilizzati per coltivare rhes. Elenco di diversi media culturali con integratori.
- Preparare il mezzo basale.
- Integrare la bottiglia di 500 ml di mezzo di crescita dei cheratinociti (Tabella deimateriali)con 5 ml di integratori per la crescita dei cheratinociti umani (HKGS) al fine di raggiungere concentrazioni finali dello 0,2% [v/v] bovino estratto ipofisi (BPE), 0,2 ng/mL fattore di crescita epidermico ricombinante umano (FEG), 0,18 μg/mL idrocortisone, 5 μg/mL di transferrina bovina, e 0,01 μg/mL di fattore di crescita insulino-simile all'insulina ricombinante-I (IGF-I).
- Aggiungere 5 mL di soluzione antibiotico-antimicotica 100x contenente 10.000 unità/mL di penicillina, 10.000 μg/mL di streptomicina e 25 μg/mL di an oiltericina B.
- Preparare il mezzo sommerso.
- Integrare la bottiglia di 500 ml di mezzo di crescita dei cheratinociti(Tabella dei materiali)con 5 ml di HKGS al fine di raggiungere concentrazioni finali dello 0,2% [v/v] BPE, 0,2 ng/mL EGF ricombinante umano, 0,18 μg/mL idrocortisone, 5 μg/mL di transferrin bovino e 0,01 μg/mL di IGF-I ricombinante umano.
- Aggiungere 5 mL di soluzione antibiotico-antimicotica 100x.
- Aggiungere 5 mL di una soluzione di 0,144 M CaCl2 (cloruro di calcio) per raggiungere una concentrazione finale di 1,5 mM Ca2+.
NOTA: La concentrazione di calcio è già aumentata durante la fase sommersa per stimolare la differenziazione dei cheratinociti e avviare il processo di stratificazione49.
- Preparare il mezzo di interfaccia aria-liquido (ALI).
- Integrare una bottiglia da 500 ml di mezzo di crescita dei cheratinociti(Tabella dei materiali)con 5 ml di HKGS al fine di raggiungere concentrazioni finali dello 0,2% [v/v] BPE, 0,2 ng/mL EGF ricombinante umano, 0,18 μg/mL idrocortisone, 5 μg/mL di transferrin bovino e 0,01 μg/mL di IGF-I ricombinante umano.
- Aggiungere 5 mL di soluzione antibiotico-antimicotica 100x.
- Aggiungere 5 mL di una soluzione stock CaCl 2 da0,144 M per raggiungere una concentrazione finale di 1,5 mM Ca2+.
- Aggiungere 1 mL di una soluzione di 25 mg/mL di acido ascorbico per raggiungere una concentrazione finale di acido ascorbico da 50 μg/mL.
- Aggiungere 50 μL di un KGF da 100 μg/mL nell'albumina del siero bovino all'1% [con v] nella soluzione di stock di saline tamponate da fosfati (PBS) per raggiungere una concentrazione finale di 10 ng/mL KGF.
NOTA: Poiché l'acido ascorbico è sensibile all'ossidazione, si raccomanda di utilizzare un derivato stabile dell'acido ascorbico, come il magnesio l-ascorbyl-2-fosfato59 o l'acido L-ascorbico 2-fosfato sesquimagnesio60. Se si utilizza acido ascorbico, si consiglia di integrare appena il mezzo ALI con acido ascorbico prima di ogni aggiornamento.
2. Cultura degli NHEK
NOTA: Poiché i cheratinociti umani primari rimangono proliferativi al loro quarto o quintopassaggio 61, gli NHEK nel loro terzo passaggio sono utilizzati per la coltivazione del RhEs. I cheratinociti primari devono essere maneggiati con molta attenzione a causa della loro elevata sensibilità. Una pipettazione attenta e lenta delle sospensioni cellulari in qualsiasi momento è molto importante, per non disturbare le condizioni delle cellule.
- Scongelare una fiala con NOK crioconservati 1 x10 6 in un bagno d'acqua a 37 °C, immergendo parte del flaconcino nell'acqua. Incubare il flaconcino per 1-2 minuti nel bagno d'acqua, fino a quando non è visibile solo una piccola slitteria di ghiaccio.
ATTENZIONE: Non immergere l'intera fiala nel bagno d'acqua per evitare contaminazioni. Non scongelare le cellule per più di 2 minuti; questo può ridurre la vitalità cellulare. Pulire il flaconcino con una soluzione di etanolo al 70% prima di trasferire il tubo nella cappa laminare. - Rimorsi le cellule con molta attenzione, condando su e giù 2-3 volte. Trasferire la sospensione cellulare in due mastri T75 contenenti un totale di 15 mL di mezzo di scongelamento prerifapidto, con una densità di semina di 6,7 x 104 celle/cm2.
NOTA: Per i primi due passaggi e lo scongelamento degli NHEK crioconservati, il supporto di coltura cellulare viene utilizzato secondo le raccomandazioni del fornitore. - Posizionare i contenitori nell'incubatore di coltura cellulare (37 °C, 5% CO2e 95% di umidità relativa (RH)).
- Dopo circa 24 ore, sostituire il mezzo di scongelamento con il mezzo basale per rimuovere il solfossido di dimetile (DMSO) dalla soluzione di congelamento dei cheratinociti.
- Rinfrescare il mezzo basale ogni due giorni.
- Dopo 4-6 giorni di coltivazione, le cellule dovrebbero essere circa l'80% confluenti e pronte per la semina in inserti per la coltivazione del RhEs.
NOTA: I cheratinociti devono essere coltivati fino ad una confluenza massima dell'80% per preservare la loro capacitàproliferativa 62. Il numero di cellule da scongelare deve prendere in considerazione diversi parametri, come il numero di passaggio cellulare, la vitalità cellulare al momento dello scongelamento, l'efficienza di semina e il tempo di raddoppio.
3. Semina di NHEK
NOTA: Questo protocollo è progettato per l'uso all'interno di un formato di piastra portante a 24 po porsi. Se sono richiesti altri formati di piastra (ad esempio, formato a 12 o 6 pozzi), devono essere prese in considerazione le ottimizzazioni nella densità di semina e nel volume medio. La figura 1 riassume un calendario proposto per la coltivazione del RhE e mostra le condizioni di coltivazione.
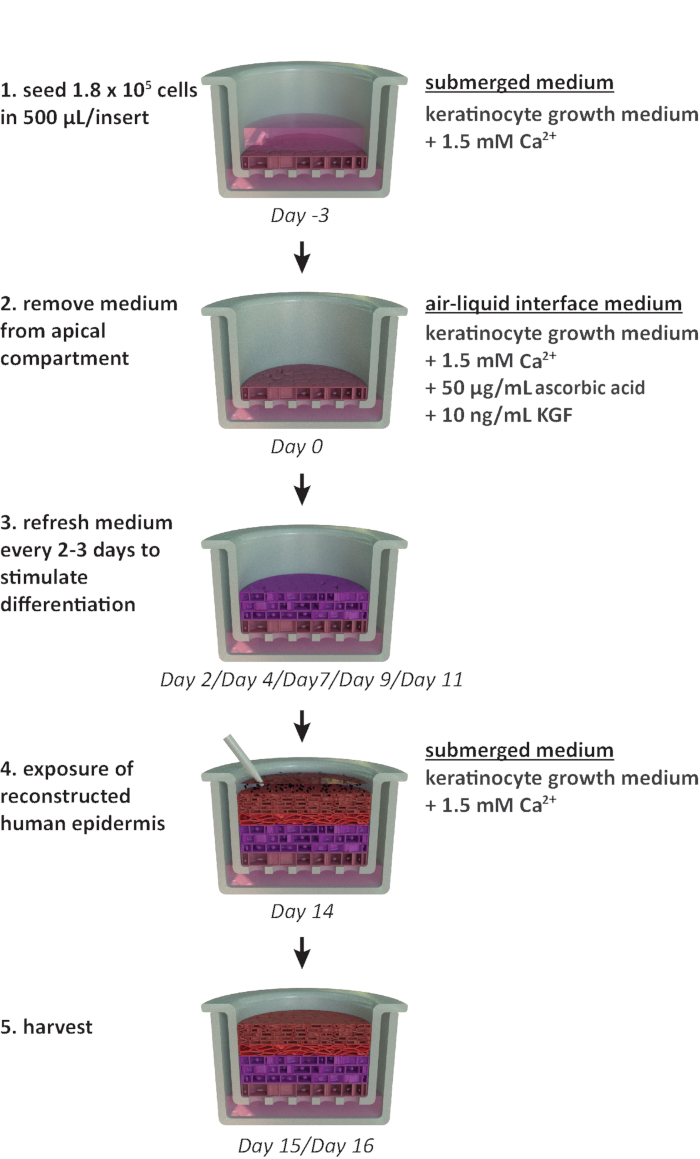
Figura 1: Sequenza temporale schematica del protocollo di ricostituzione. Presentazione del modello RhE preparazione, processo di coltivazione e applicazione (esposizione a sostanza chimica). Lo schema include i tipi di supporto delle impostazioni cultura delle celle appropriati per ogni passaggio. Clicca qui per visualizzare una versione più grande di questa figura.
- Pre-riempire piastre da 24 potte con 1,5 mL di mezzo sommerso, idealmente utilizzando una pipetta dispenser.
- Rimuovere il mezzo basale dai contenitori T75 utilizzati per la coltura degli NHEK.
- Risciacquare le cellule aggiungendo 5 ml di PBS prerifabbrolato a ogni pallone T75.
- Rimuovere PBS dai contenitori.
NOTA: Questo passaggio è cruciale, poiché il mezzo contiene proteine e calcio che inibiscono l'attività della tripside. - Aggiungere 2-3 ml di acido tetra acetico prerifampito 0,05% [v/v] tripside/etilene diammina tetra acetico (EDTA) a ciascun pallone T75. Assicurarsi che la soluzione di tripina sia equamente distribuita sull'area di coltura cellulare del pallone.
ATTENZIONE: Il volume di 2 mL si basa sulla confluenza dell'80% sopra menzionata. Utilizzare 3 mL per i contenitori con una maggiore confluenza. - Posizionare i contenitori per 4 minuti nell'incubatore di coltura cellulare (37 °C, 5% CO2e 95% RH). Verificare se le celle si staccano utilizzando il microscopio con un ingrandimento di 10x. Rapare il pallone contro il palmo della mano per aiutare le cellule a rilasciare dalla superficie del pallone. Le cellule staccate possono essere osservate come cellule arrotondate che galleggiano nella soluzione di tripina.
ATTENZIONE: Non incubare le cellule in tripina per più di 6 minuti. L'over-trypsinization può danneggiare le cellule e diminuire la loroaderenza 63. - Una volta staccate tutte le cellule, aggiungere un volume uguale (cioè 2-3 ml) di inibitore della tripsiderina preri warmed ad ogni pallone T75.
- Trasferire la sospensione cellulare dai contenitori a un tubo di centrifuga.
- Risciacquare i contenitori con 5 ml di PBS prerifabbro e trasferirli nel tubo di centrifuga contenente la sospensione cellulare.
NOTA: Assicurarsi che la maggior parte delle cellule siano raccolte controllando il numero di cellule residue nei contenitori al microscopio. La superficie del pallone dovrebbe essere vuota al 95%. In caso contrario è possibile ripetere il passaggio di tripsinzizzazione (3.3-3.9). Si noti tuttavia che la riprovazione deve essere evitata. - Centrifugare le cellule raccolte a 400 x g per 5 min.
- Scartare con cura la maggior parte del supernatante, lasciando circa 100-200 μL nel tubo.
ATTENZIONE: Non aspirare il pellet durante questa procedura. - Rimorsi delicatamente il pellet di cellule in un basso volume di mezzo sommerso, pipetta su e giù 5-10 volte per garantire una sospensione cellulare uniforme. Iniziare con un volume basso (cioè 500 μL) per evitare la formazione di aggregati cellulari e aggiungere fino a 1 ml di mezzo sommerso in totale per pallone T75 iniziale.
NOTA: Sfarfallare delicatamente il tubo con le dita per sciogliere con cura una parte del pellet cellulare nel supernatante. - Contare le celle nella sospensione utilizzando il metodo di esclusione blu trypan.
- Diluire lo 0,4% [v/v] la macchia blu trypan e la sospensione cellulare in un rapporto 1:1, aggiungendo 10 μL dello 0,4% [v/v] trypan blue macchia a 10 μL di sospensione cellulare. Aggiungere 10 μL della soluzione a una diapositiva di conteggio. Misurare il numero di celle immediatamente dopo aver mescolato la sospensione cellulare con il blu trypan, poiché il blu del trypan inizia a diminuire la vitalità della cella dopo un'esposizione superiore a 1 min65.
ATTENZIONE: Il blu di tripano è stato dimostrato essere un potenziale mutageno, cancerogeno e teratogeno64. Maneggiare il colorante con cura e smaltire i rifiuti in modo sicuro secondo le normative di laboratorio locali.
NOTA: Un approccio alternativo all'uso del blu trypan è il colorante non pericoloso Erythrosin B66.
- Diluire lo 0,4% [v/v] la macchia blu trypan e la sospensione cellulare in un rapporto 1:1, aggiungendo 10 μL dello 0,4% [v/v] trypan blue macchia a 10 μL di sospensione cellulare. Aggiungere 10 μL della soluzione a una diapositiva di conteggio. Misurare il numero di celle immediatamente dopo aver mescolato la sospensione cellulare con il blu trypan, poiché il blu del trypan inizia a diminuire la vitalità della cella dopo un'esposizione superiore a 1 min65.
- Diluire la sospensione cellulare con mezzo sommerso aggiuntivo per raggiungere una concentrazione di 3,525 x 105 celle/mL in mezzo sommerso aggiungendo il volume V2 come mostrato nell'equazione 1:
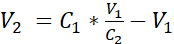
C1 = concentrazione di cellule conteggiate nella sospensione cellulare ottenuta in 3,12 (cellule/mL)
V1 = volume utilizzato per rimosogliere il pellet di cellule in 3,12 (mL)
C2 = concentrazione di cellule mirate nella sospensione (cioè 3,525 x 105 celle/mL)
V2 = volume da aggiungere per raggiungere la concentrazione cellulare mirata (mL)
NOTA: La superficie dell'inserto di coltura consigliato è di 0,47 cm2; pertanto, la corrispondente densità di semina è di 3,75 x 105 celle/cm2. - Eseguire un secondo conteggio delle celle (C3)della soluzione diluita ottenuta nel passaggio 3.14. Utilizzare l'equazione 2 per calcolare il volume di sospensione cellulare (V4) da seminare nell'inserto delle impostazioni cultura:
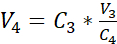
C3 = concentrazione di cellule mirate nella sospensione (cioè 3,525 x 105 celle/mL)
V3 = volume mirato della sospensione cellulare da seminare nell'inserto delle coltura (cioè 0,5 mL)
C4 = concentrazione di cellule contate nella sospensione diluita ottenuta in 3,14 (cellule/mL)
V4 = volume effettivo della sospensione cellulare da seminare nell'inserto di coltura (mL) - Appendere gli inserti di coltura a 24 celle nella posizione più alta della piastra portante consigliata e trasferire la piastra portante sulla piastra a 24 pozzi preriempito con mezzo sommerso (cfr. paragrafo 3.1).
ATTENZIONE: Quando si trasferisce la piastra portante nella piastra multi-pozzo, assicurarsi che nessuna bolla d'aria sia intrappolata tra la membrana dell'inserto e il mezzo sommerso dal compartimento basale, in quanto ciò influenzerà l'alimentazione delle cellule e alla fine comprometterà la vitalità e la morfologia del RhE. - Aggiungere il volume determinato V4 (dall'equazione 2) della sospensione cellulare ad ogni inserto.
NOTA: Si consiglia di utilizzare la tecnica di pipettazione inversa per erogare con precisione la sospensione cellulare agli inserti di coltura.
ATTENZIONE: Assicurarsi di non danneggiare la membrana quando si eroga la sospensione cellulare nell'inserto di coltura. Una precauzione è di erogare la sospensione cellulare lungo la parete del sistema di inserto senza toccare la superficie della membrana. - Dopo la semina, incubare le piastre a 24 pozzi per 10-15 minuti a temperatura ambiente, per superare un effetto bordo (cioè, distribuzione della temperatura non uniforme tra tutti i pozzi67). Non spostare le piastre durante questo periodo.
- Trasferire le piastre nell'incubatore di coltura cellulare (37 °C, 5% CO2e 95% RH). Le cellule vengono mantenute in condizioni sommerse per tre giorni.
NOTA: Per evitare la variabilità dei tessuti, non impilare le piastre nell'incubatrice dopo la semina per assicurarsi che ogni inserto riceva la stessa quantità di calore. Dopo tre giorni (cioè durante la coltivazione dell'ALI), è possibile impilare le piastre.
4. Coltivazione all'interfaccia aria-liquido
- Dopo tre giorni di incubazione nell'incubatore di coltura cellulare (37 °C, 5% CO 2 e 95% RH), esporre le cellule che hanno aderito alla superficie della membrana all'ALI rimuovendo il mezzo sommerso dal compartimento apicalepreferibilmenteutilizzando un sistema di aspirazione e una pipetta Pasteur in vetro.
NOTA: In alternativa, il mezzo sommerso dal vano apicico può essere rimosso con una micropipetta manuale. - Riempire le nuove piastre da 24 po' con 1,5 mL di mezzo ALI fresco prerifatti e trasferire le piastre portanti con gli inserti di coltura alle nuove piastre multi-pozzo.
- Trasferire le piastre multi-pozzo all'incubatore di coltura cellulare (37 °C, 5% CO2e 95% RH).
- Rinfrescare il mezzo ALI ogni 2-3 giorni per 14 giorni.
- Eseguire l'aggiornamento in due fasi: 1) preparare una nuova piastra contenente 1,5 mL/porsi di mezzo ALI fresco prerifato e 2) trasferire la piastra portante sulla nuova piastra.
ATTENZIONE: Durante l'intera procedura di ricostituzione è meglio non rimuovere il coperchio che copre la piastra portante per mantenere le RhEs protette da potenziali contaminazioni.
NOTA: Il passaggio ALI è fondamentale per lo sviluppo di un modello epidermico stratificato in quanto consente la differenziazione terminale dei cheratinociti68. Dopo essere andate in ALI, è necessario un controllo visivo degli inserti, per verificare se ci sono 'tessuti che perdono': goccioline medie sulla superficie tissutale provenienti dal compartimento basolaterale. Se la perdita avviene al giorno 3 dell'ALI, rimuovere delicatamente il mezzo dall'inserto di coltura senza toccare la superficie del tessuto. Se la perdita persiste, si consiglia di scartare i tessuti che perdono in quanto è un'indicazione che non esiste una formazione barriera corretta nel modello RhE. - Alla fine del processo di ricostituzione, i tessuti possono essere esposti a vari fattori di stress per indurre ad esempio stress ossidativo o infiammazione. In parallelo, possono essere trattati con composti chimici o ingredienti cosmetici. NOTA: Durante l'esposizione/trattamento, i tessuti vengono solitamente mantenuti in mezzo sommerso a partire da ALI D14. Quando si prevede che i tessuti siano esposti/trattati per un lungo periodo di tempo (cioè 48-72 ore), si raccomanda (i) di iniziare l'esposizione/trattamento prima nel processo di coltivazione dell'ALI, come D7-D9, di evitare il diradamento degli strati vitali e l'ispessimento del SC e (ii) di incubare i tessuti nel mezzo ALI, per continuare a stimolare la proliferazione cellulare.
- Per la raccolta del RhE, raccogliere i tessuti e il mezzo di coltura cellulare al momento di interesse per l'analisi istologica, i saggi di vitalità, l'estrazione di proteine / RNA e i saggi immunoassorbenti legati agli enzimi (ELISA).
Risultati
Gli NOK coltivati in 2D mostrano una morfologia tradizionale con una forma poligonale coerente (Figura 2A). Come descritto in precedenza, gli NHEK vengono seminati in inserti di coltura dopo aver raggiunto una confluenza di circa l'80%. La morfologia delle RhEs è stata analizzata utilizzando colorazione H&E e TEM. Dopo 15 giorni in ALI, un tessuto completamente stratificato viene ottenuto come indicato dai suoi quattro principali strati epidermici: l'SB, l'SS, l'SG e il SC (Figura 2B). Nel livello SB, le celle hanno una forma colonnare. Dal secondo strato in avanti verso gli strati superiori del RhE, gli NHEK si differenziano come osservato dai cambiamenti nella morfologia cellulare (da una forma colonnare nello strato SB, verso una forma spinosa nello strato SS). Nello strato SG, le cellule hanno una forma più appiattita e mostrano granuli di cheratoialina (KG) che sono rappresentati come punti viola nel citoplasma. La loro caratteristica forma rotonda e stellare è evidenziata da frecce bianche sull'immagine H&E (Figura 2C). Le cellule nell'SC, sono differenziate terminalemente e sono completamente appiattite e mancano di un nucleo cellulare. Le re stratificate hanno uno spessore complessivo di 84,3 ± 2,4 μm e il loro SC ha uno spessore di 19,6 ± 3,2 μm(Figura 2D). Questi valori sono paragonabili a quelli riportati per la pelle umana nativa, vale a dire 60-120 μm e 10-20 μm,rispettivamente 69. Il numero di strati vitali è 6-7, che è inferiore rispetto a quello della pelle umana nativa, essendo di circa 7-1470. L'analisi ultrastrutturale dei rhes in diversi punti di tempo nel protocollo di ricostituzione (cioè 7, 10, 13 e 15 giorni) rivela il processo di cornificazione delle re con un numero maggiore di strati di corneociti nel tempo(Figura 2E). Dopo 15 giorni presso l'ALI, l'SC del tessuto RhE è composto da circa 15-25 strati, che è paragonabile al valore riportato per la pelle umana nativa (cioè 15-20 strati)69.
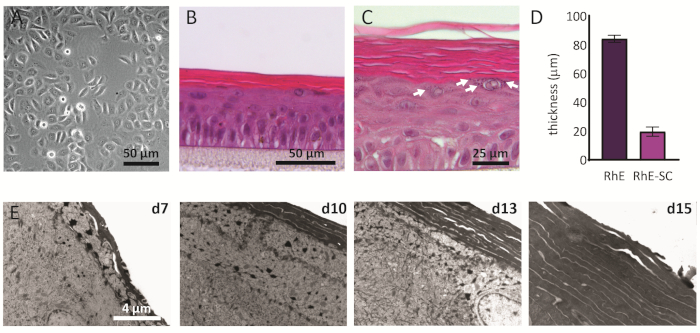
Figura 2: Cheratinociti primari ed epidermide umana ricostruita. (A) Immagine della microscopia a contrasto di fase dei cheratinociti prima della semina su inserti. La barra di scala è di 50 μm. (B-C) H&E immagine di microscopia a campo luminoso di RhE. La barra di scala è di 50 μm(B)e 25 μm(C). (D) Quantificazione dello spessore di RhE e SC (media ± SEM, n=3). (E) Immagini di microscopia elettronica a trasmissione di sezioni trasversali rhe dopo 7, 10, 13 e 15 giorni presso ALI. La barra di scala è di 4 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Secondo la loro fase di differenziazione, gli NHEK che crescono in 3D mostrano diversi profili di espressione proteica in base alla loro fase di differenziazione. L'espressione di proteine specifiche per la differenziazione dei cheratinociti allo stadio iniziale (cioè la cheratina 10), la differenziazione dei cheratinociti in fase avanzata (cioè involucrina, loricrina e filaggrina), e l'adesione dei cheratinociti (cioè la desmogleina 1) nelle re è stata determinata usando la colorazione IF. L'espressione involucrina appare più prevalentemente situata nel livello SG poiché la sua espressione viene avviata in precedenza durante il processo di differenziazione (Figura 3D), mentre filaggrina e loricrina sono espresse nei livelli superiori (Figura 3B-C). L'espressione cheratina 10 è stata trovata in tutti gli strati vitali, ad eccezione del livello SB (Figura 3E). Le re mostrano giunzioni desmosomali funzionali, come indicato dall'espressione della desmogleina 1 nello spazio intercellulare degli strati epidermici vitali (Figura 3F). Per concludere, tutti e cinque i marcatori sono espressi e situati negli strati epidermici appropriati e si traducono in un sano processo di differenziazione epidermica.
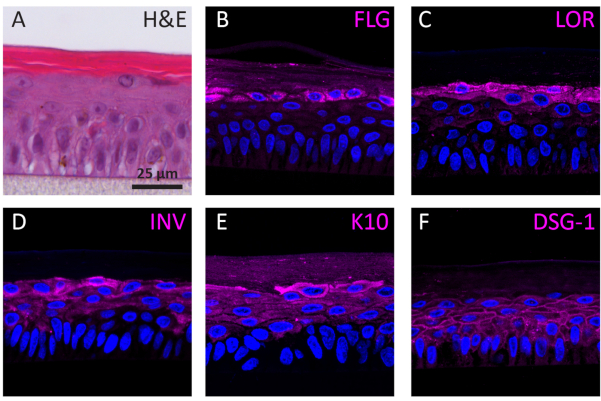
Figura 3: Differenziazione epidermica, adesione dei tessuti e integrità tissutale dell'epidermide umana ricostruita. ( A ) Immagine di microscopiaacampo luminoso H&E di RhE. Immagini al microscopio a fluorescenza confocale di (B) filaggrina (FLG), (C) loricrina (LOR), (D) involucrina (INV), (E) cheratina 10 (K10) e (F) desmogleina 1 (DSG-1) rappresentata in magenta. La colorazione dei nuclei (DAPI) è rappresentata in blu. La barra di scala è di 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Le proprietà barriera del modello RhE sono state studiate valutando sia la vitalità che l'integrità dei tessuti. L'integrità del tessuto è stata determinata dopo 15 giorni misurando il TEER utilizzando un voltohmmetro. I valori di 2567 ± 415 Ω,cm2 registrati per le re traducono la formazione di una barriera continua(figura 4A). Tali valori sono compresi tra quelli riportati per i modelli RhE71,72,73,74. Inoltre, il tempo di esposizione richiesto per una sostanza chimica di riferimento citotossica (cioè Triton X-100) per ridurre la vitalità tissutale del 50% (ET50)è stato determinato con un saggio sul bromuro di tetrazolio blu tiazolile (MTT). Il valore ET50 misurato per il RhE è stato di 2,1 ore. Questo valore rientra nell'intervallo di accettazione di altri modelli epidermici 3D qualificati per una previsione affidabile della classificazione dell'irritazione (linee guida OCSE 439)19.
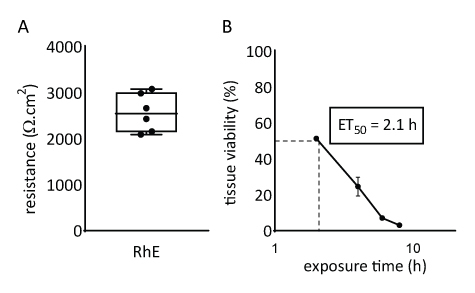
Figura 4: Proprietà barriera dell'epidermide umana ricostruita. (A) Integrità tissutale misurata con resistenza elettrica transepiteliale (media ± SEM, n=6). (B) ET50 determinato misurando la vitalità dei tessuti (cioè il saggio MTT) in caso di esposizione topica a 78,3 μL dell'1% di Tritone X-100 (media ± SEM, n=3).
La reattività di RhEs è stata studiata su stimoli proinfiammatori noti. Le re sono state trattate sistemicamente, cioè l'aggiunta di stimoli nel mezzo del compartimento basolaterale, usando 100 μg/mL Escherichia coli lipopolysaccharide (LPS) e 40 ng/mL fattore di necrosi tumorale alfa (TNF-α). Dopo 24 ore di stimoli, è stato raccolto il mezzo di coltura cellulare. La citotossicità è stata misurata utilizzando un saggio di lattato deidrogenasi (LDH) e rispetto ai valori di un noto disgregatore a membrana, il detergente Triton X-100 (Figura 5). Un aumento significativo (p < 0,05, ANOVA uni-way, il test di confronto multiplo di Dunnett) è stato mostrato nell'attività LDH nelle rhes trattate con Triton X-100. I trattamenti LPS e TNF-α entrambi non hanno mostrato essere citotossici.

Figura 5: La citotossicità misurata tramite saggio di lattato deidrogenasi (LDH). I dati sono presentati come valori relativi per il controllo, tessuti non trattati (CTRL); media ± SEM, n=9 (Tritone X-100), n=8 (LPS), n=3 (TNF-α). Significance è stato testato con ANOVA uni-way, il test di confronto multiplo di Dunnett. L'asterisco indica una differenza statisticamente significativa rispetto a CTRL, ****p < 0,0001). Clicca qui per visualizzare una versione più grande di questa figura.
Il rilascio di interleuchina 1 alfa (IL-1α) e interleuchina 8 (IL-8) nel mezzo RhE è stato quantificato usando le ELISA. La figura 6 mostra sia la versione quantificata che quella relativa di IL-1α e IL-8 da parte dei RhE in caso di sfida con LPS e TNF-α. Il trattamento LPS ha portato a un rilascio indotto statisticamente significativo (p < 0,05, test T dello studente spaiato) di IL-8 (aumento di 9,6 ± 1,0 volte) e IL-1α (aumento di 2,7 ± 1,3 volte). Il TNF-α non ha indotto in modo significativo il rilascio di IL-8, anche se è stata osservata una tendenza all'aumento dei livelli di IL-8 (2,3 ± aumento di 0,8 volte). Tuttavia, TNF-α ha attivato in modo significativo (p < 0,05, test T dello studente spaiato) il rilascio IL-1α (aumento di 1,8 ± 0,5 volte).
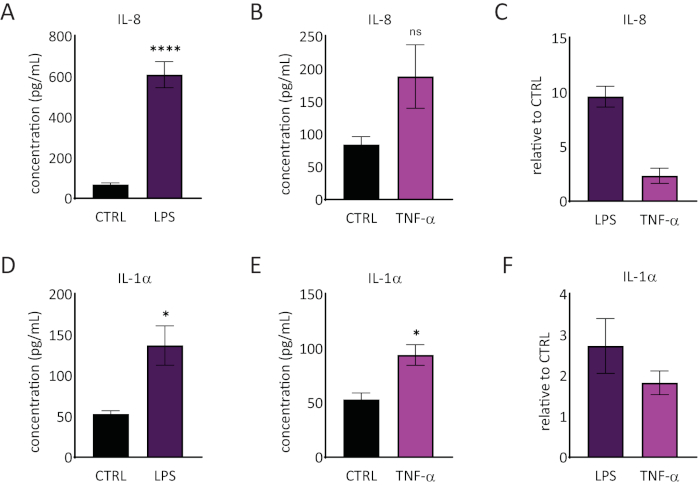
Figura 6: Risposte proinfiammatorie nell'epidermide umana ricostruita. Concentrazioni di il-8 rilasciato dal RhE in una sfida di 24 ore con LPS (A) e TNF-α (B) . I dati sono rappresentati come ± SEM, n=8 (LPS), n=3 (TNF-α). (C) I dati sono rappresentati come la media del valore relativo rispetto al controllo, tessuti non trattati (CTRL) ± SEM, n=8 (LPS), n=3 (TNF-α). Concentrazione del rilascio IL-1α del RhE in una sfida di 24 ore con LPS (D) e TNF-α (E) . I dati sono rappresentati come ± SEM, n=8 (LPS), n=3 (TNF-α). (F) I dati sono rappresentati come media del valore relativo rispetto a CTRL ± SEM, n=4 (LPS), n=3 (TNF-α). Significance è stato testato da un test T di student non accoppiato. L'asterisco indica differenze statisticamente significative rispetto a CTRL, *p < 0,05, ****p < 0,0001). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Le re sono ampiamente utilizzate come strumenti di screening nei settori farmaceutico e dermato-cosmetico36,75,76,77,78. Sebbene diverse aziende abbiano reso tali RhEs disponibili in commercio, rimangono costose e limitano la possibilità di variare i parametri di coltivazione come richiesto per affrontare nuove domande di ricerca. Questo documento descrive la procedura di produzione dei RhEs interni in modo robusto e affidabile e fornisce una caratterizzazione dettagliata dei tessuti ottenuti per confermare la pertinenza del modello come approccio alternativo alla sperimentazione animale.
Alcuni dei passaggi del protocollo sono cruciali per garantire una corretta differenziazione dei cheratinociti e riproducibilità RhE. Questo può essere effettuato utilizzando le cellule ottimali, i tipi medi e le condizioni di coltivazione. Nel modello RhE proposto, gli NHEK neonatale sono stati selezionati per la loro mancanza di esposizione antigenica, rispetto agli NHEK adulti. Inoltre, i cheratinociti erano limitati all'etnia caucasica per evitare la variabilità tra specie. I cheratinociti primari sono tipicamente usati per la loro capacità di differenziare e stratificare79. Possono essere ottenuti commercialmente o per isolamento interno dalla pelle adulta80. La coltivazione di una linea cellulare (cioè HaCaT) su una membrana in policarbonato, ha dimostrato di non differenziarsi e ha dimostrato una ridotta capacità di sintetizzare lipidi necessari per la formazione di barriere81. Tuttavia, l'inclusione di diverse matrici di coltura, come idrogel, collagene, fibrina e colture di sferoidi, ha portato al successo dello sviluppo di modelli di pelle 3D78,82,83,84,85,86. Le linee cellulari immortalate, N/TERT, si sono dimostrate adatte allo sviluppo di RhEs35. I cheratinociti primari rimangono proliferativi al loro quarto o quinto passaggio61, quindi l'attuale protocollo include l'uso di cheratinociti nel loro terzo passaggio. Hanno dimostrato che la densità di semina cellulare è importante e deve essere sufficiente (cioè ≥ 2,5x105 celle/cm2) per garantire che il mezzo del compartimento basolaterale non si dissolva nel compartimento apicali. Una densità di semina insufficiente (cioè < 2.5x105 celle/cm2) può comportare l'incapacità di formare una barriera adeguata, che è indicata dalla diffusione del mezzo dal basolaterale al compartimento apicale, con conseguente immersione anziché condizioni di coltura ALI62. Mezzo di crescita dei cheratinociti senza siero (vedi Tavola dei materiali) è stato preferito a fini di riproducibilità, in quanto offre il vantaggio di lavorare con un mezzo definito chimicamente e riduce il rischio di contaminazione. Questo mezzo ha una concentrazione di calcio inferiore (cioè 60 μM) e quindi stimola la proliferazione dei cheratinociti87. Aumentare la concentrazione di calcio (cioè 1,5 mM) fin dal primo passo della coltivazione del RhE, favorisce la differenziazione dei cheratinociti e la formazione di barriere cutanee e l'omeostasi49. Inoltre, il mezzo ALI è integrato con acido ascorbico, che si è dimostrato cruciale per la formazione di lipidi SC e per promuovere la differenziazione52,53,54. Il mezzo ALI contiene anche KGF, che è un fattore di crescita secreto da fibroblasti che possono legarsi ai recettori transmembrana cheratinociti e all'attivazione ha un duplice ruolo nella differenziazione e nella riparazione delle ferite55,88. È importante rinfrescare il mezzo ALI a intervalli di tempo specifici, per fornire un apporto costante di nutrienti freschi alle RhEs. L'uso di un sistema di piastre portanti è fondamentale per la coltivazione del RhE su larga scala (cioè 24 inserti / piastra). Offre il vantaggio di risparmiare tempo, ridurre il rischio di contaminazione e lascia meno spazio all'introduzione di errori umani. Fornisce anche la possibilità di coltura rhes in un alto volume di media (cioè, 1,5 mL), che riduce il numero richiesto di aggiornamenti medi ALI. Inoltre, offre la possibilità di trasferire una piastra completa di inserti su una piastra con mezzo fresco, evitando il contatto con gli inserti singolarmente o scoprendo il coperchio della piastra.
Ci sono diverse limitazioni del modello RhE che dovrebbero essere notati. Nella pelle umana nativa c'è un equilibrio tra la proliferazione dei cheratinociti nello strato basale e il distacco di corneociti nel SC (cioè la desquamazione)89. Tuttavia, in vitro, la desquamazione non ha luogo. Pertanto, i corneociti rimangono attaccati al RhE e formano un SC spesso che è meno fisiologicamente rilevante. Quindi, c'è un periodo di coltivazione limitato di RhEs. Inoltre, questo modello RhE è semplice e diretto, poiché consiste in un tipo di cellula singolare, cioè il cheratinocita, che è il tipo cellulare più abbondante dell'epidermide. Tuttavia, ci sono altri tipi di cellule residenti nell'epidermide, come melanociti, cellule dendritiche (cioè cellule di Langerhans), cellule T (ad esempio, CD8+ cellule), e cellule di Merkel13. Per migliorare la rilevanza fisiologica del modello cutaneo, i ricercatori hanno reso i modelli cutanei più complessi aggiungendo melanociti38 , cellule immunitarie39, o cellule derivate dal paziente90. Si dovrebbe tenere presente che le proprietà barriera dei modelli di pelle umana sono diverse rispetto alla pelle umana nativa, a causa in particolare di una diversa composizione lipidica SC e di una maggiore permeabilità alla barriera 91,92,93,94,95. Tuttavia, diversi studi hanno riportato cambiamenti nelle proprietà barriera dei modelli di pelle umana mediante coltivazione in ipossia96 o diminuzione dell'umidità relativa97, la modulazione della matrice dermica con chitosano98, e alterazione degli acidi grassi liberi nel mezzo di coltura99. Inoltre, sia nelle RhEs semplici che in quello più complesse, le condizioni di coltura e la composizione media possono essere modulate per imitare le caratteristiche patologiche. Sfidando il modello con citochine, una morfologia anomala100 e possono essere stabilite alterazioni nei livelli di espressione genica e proteica che sono tipicamente osservate nei disturbi cutanei comuni, come dermatite atopica e psoriasi35,101,102,103,104,105. Silenziare geni specifici nei cheratinociti prima di iniziare il processo di ricostituzione del modello 3D è un altro approccio utilizzato per imitare le caratteristiche dei disturbi della pelle e studiare nuove soluzioni terapeutiche106,107. Oltre a modellare solo uno strato epidermico, un compartimento dermico può essere incluso nel modello (cioè, chiamato equivalenti della pelle umana o modelli a pieno spessore) incorporando fibroblasti in una matrice di collagene prima della ricostituzione rhe, rendendolo più fisiologicamente rilevante e adatto per studi relativi all'invecchiamento e alla guarigione delle ferite108,109,110. Inoltre, gli sferoidi tumorali sono stati aggiunti agli equivalenti della pelle umana per studiare la progressione del melanoma111,112. Gli ultimi progressi nel campo dei modelli di pelle sono la bio-stampa e la pelle su un chip. Più gruppi di ricerca sono recentemente riusciti nello sviluppo di equivalenti cutanei biostampati (perfusibili)45,113,114. Il protocollo proposto sfrutta un formato a 24 po' e una piastra portante, evitando che gli inserti siano maneggiati singolarmente. Tuttavia, la scala di studio è ancora piuttosto limitata e manca di automazione. Implementando l'uso della bio-stampa o skin-on-a-chip, i modelli di pelle più piccoli possono essere utilizzati con processi più automatizzati e su scala più ampia.
Il RhE descritto in questo protocollo ha molteplici somiglianze con i modelli epidermici commerciali già sviluppati e ben caratterizzati. L'analisi morfologica ha dimostrato che, sebbene il numero di strati vitali nel modello RhE proposto sia inferiore rispetto a quello della pelle umana nativa (cioè 6-7 rispetto a 7-14), è paragonabile a quello del modello EpiDerm RhE (cioè 8-12)70. Analogamente ai modelli EpiDerm, EpiSkin e SkinEthic, lo strato superiore rhe mostra un motivo a trama cesto di strati di corneociti densamente imballati28. Inoltre, l'analisi TEM ha rivelato che il numero di strati SC nel modello RhE proposto (cioè 15-25) è paragonabile a quello di EpiDerm (cioè 16-25)70. Nel complesso, il modello RhE proposto dimostra una struttura simile a quella di altri modelli epidermici commercializzati, imitando l'epidermide umana nativa. L'integrità tissutale misurata da TEER è in linea con i modelli commerciali RhE (cioè tra 3000-5600 Ω,cm2)71,72,73 e altre re in-house (cioè circa 5000 Ω,cm2)74,115. Il modello RhE proposto si dimostra ben differenziato, come indicato dalla presenza e dalla corretta localizzazione dei marcatori di differenziazione e adesione dei tessuti. Inoltre, il modello RhE proposto dimostra di essere reattivo agli stimoli proinfiammatori (cioè LPS e TNF-α).
Per concludere, l'attuale protocollo mostra come produrre rhes in modo affidabile e su scala relativamente ampia per soddisfare le esigenze dei ricercatori sia negli istituti accademici che in quello privato. Il modello RhE proposto mostra di avere morfologia, differenziazione epidermica e reattività biologica simili ad altri modelli commerciali esistenti. Fornisce uno strumento alternativo sia per il campo farmaceutico che per quello dermato-cosmetico quando è richiesto l'accesso a un modello cutaneo pertinente.
Divulgazioni
Marc Eeman e Benedetta Petracca sono dipendenti di Dow Silicones Belgium. Tutti gli altri autori non hanno nulla da rivelare.
Riconoscimenti
Il programma di ricerca e innovazione Horizon 2020 dell'Unione europea nell'ambito della sovvenzione Marie Skłodowska-Curie con la sovvenzione n. 765602 finanziato questo lavoro. Tutti gli autori riconoscono il sostegno della Fondazione Adolphe Merkle e dell'Università di Ferrara e riconoscono con gratitudine Dow Silicones Belgium. Il Dr. Miguel Spuch-Calvar è riconosciuto per aver preparato le immagini grafiche del processo di coltivazione del RhE. Gli autori ringraziano la Dott.ssa Barbara Drasler, il Dott. Franco Cervellati e il Dott. Agnès Tessier per il loro supporto tecnico e le loro discussioni.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma Aldrich | A6283 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Antibiotic-antimycotic (100x) | Thermo Fisher Scientific (Gibco) | 15240062 | |
| Aqueous Eosin Y solution | Sigma Aldrich | HT110280 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Calcium chloride (CaCl2) | Sigma Aldrich or Merck | C8106 or 1.02378.0500 | Prepare a stock solution of 0.144 M, filter sterilize and store aliquots at -20 °C. It is recommended to prepare new aliquots every 6 months. |
| DAPI | Roche | 10236276001 | Prepare a stock at 100 μg/mL and store aliquots at -20 °C. Working conditon is 1 μg/mL. |
| Entellan mounting medium | Merck | 1.07960.0500 | Mounting medium for H&E staining. |
| EpiLife medium (referred to as keratinocyte growth medium) | Thermo Fisher Scientific (Gibco) | MEPI500CA | Contains 0.06 mM of Ca2+. |
| Ethanol absolute | Any supplier | N/A | |
| Formalin 10% | Leica Biosystems | 3800770 | |
| Human keratinocytes growth supplement (HKGS) (100x) | Thermo Fisher Scientific (Gibco) | S0015 | To reach final concentrations of 0.2% [v/v] BPE, 0.2 ng/mL human recombinant EGF, 0.18 μg/mL hydrocortisone,5 μg/mL bovine transferrin, and 0.01 µg/mL human recombinant insulin-like growth factor-I. |
| Isopropanol | Biosolve B.V. | 0016264102BS | |
| Kaiser's glycerol gelatine, phenol-free | Merck | 1.08635.0100 | Mounting medium for IF staining. |
| Keratinocyte growth factor (KGF) | R&D Systems | 251-KG-050 | Reconstitute KGF protein at 100 μg/mL in sterile 0.1% [w/v] BSA in PBS. Prepare aliquots and store at -20°C. |
| Lactate dehydrogenase (LDH) assay kit | Roche | 4744926001 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | Prepare a stock solution of 25 mg/mL, filter sterilize and store aliquots at -20°C. It is recommended to prepare new aliquots every 6 months. Store in the dark. |
| Lipopolysaccharide (LPS), E.coli strain O55:B5 | Sigma-Aldrich | L4524 | Prepare a stock of 1 mg/mL in sterile PBS and store aliquots at -20 °C. Working concentration is 100 μg/mL. |
| Mayer’s Haematoxylin | Sigma-Aldrich | MHS80 | |
| Normal human epidermal keratinocytes (NHEKs) | Lonza | 00192906 | Human primary keratinocytes isolated from neonatal foreskin, pooled from at least three donors. |
| Phosphate-buffered saline | Thermo Fisher Scientific (Gibco) | 10010056 or 10010-015 | Reference numbers can vary between countries. |
| Recombinant tumor necrosis factor alpha (TNF-α) | ImmunoTools | 11344483 | Prepare a stock of 100 μg/mL in sterile ultrapure water. Working concentration is 40 ng/mL |
| Sterile ultrapure water | Any supplier | N/A | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M5655 | Prepare a stock of 5 mg/mL MTT in sterile PBS. Working concentration is 1 mg/mL. |
| Triton X-100 | Sigma-Aldrich | 93426 | |
| Trypan blue (0.4% [v/v]) | Any supplier | N/A | |
| Trypsin inhibitor | Thermo Fisher Scientific (Gibco) | R007100 | |
| Trypsin/EDTA (0.05% [v/v]) | Thermo Fisher Scientific (Gibco) | 25300054 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | Ab150113 | |
| Tri-sodium citrate dihydrate | Merck | 1.06448.0500 | For antigen retrieval buffer for IF staining. |
| Goat Anti-Rabbit IgG H&L (Dylight 488) | Agrisera | AS09 633 | |
| Filaggrin Mouse antibody | BioTechne (Novus Biologicals) | NBP2-53243 | |
| Involucrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP2-33742 | |
| Keratin 10 Mouse antibody | BioTechne (Novus Biologicals) | NBP2-32962 | |
| Desmoglein-1 Mouse antibody | BioTechne (Novus Biologicals) | MAB944 | |
| Loricrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP1-33610 |
Riferimenti
- Alberts, B., Johnson, A., Lewis, J. . Molecular Biology of the Cell. 4th edition. Antioxidants & Redox Signaling. , (2002).
- Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., Polla, B. S. The stratum corneum: a double paradox. Journal of Cosmetic Dermatology. 7 (2), 143-148 (2008).
- Moore, K. L., Dalley, A. F. . Clinically Orientated Anatomy. , (2010).
- Barthel, R., Aberdam, D. Epidermal stem cells. Journal of the European Academy of Dermatology and Venereology. 19 (4), 405-413 (2005).
- Green, K. J., Simpson, C. L. Desmosomes: new perspectives on a classic. Journal of Investigative Dermatology. 127 (11), 2499-2515 (2007).
- Feingold, K. R. Lamellar bodies: the key to cutaneous barrier function. Journal of Investigative Dermatology. 132 (8), 1951-1953 (2012).
- Elias, M. P., Feingold, K. R., Fartasch, M. The epidermal lamellar body as a multifunctional secretory organelle. Skin Barrier. , 261-272 (2006).
- Tobin, D. J. Biochemistry of human skin-our brain on the outside. Chemical society reviews. 35 (1), 52-67 (2006).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12), 2080-2095 (2006).
- Weinstein, G. D., McCullough, J. L., Ross, P. Cell proliferation in normal epidermis. Journal of Investigative Dermatology. 82 (6), 623-628 (1984).
- Madison, K. C. Barrier function of the skin: "la raison d'être" of the epidermis. Journal of Investigative Dermatology. 121 (2), 231-241 (2003).
- Suter, M. M., et al. The keratinocyte in epidermal renewal and defence. Veterinary Dermatology. 20 (5-6), 515-532 (2009).
- McLafferty, E., Hendry, C. The integumentary system: anatomy, physiology and function of skin. Nursing Standard. 27 (7), 35-43 (2012).
- Monteiro-Riviere, N. A. . Toxicology of the skin. , (2010).
- Dellambra, E., Odorisio, T., D'Arcangelo, D., Failla, C. M., Facchiano, A. Non-animal models in dermatological research. ALTEX. 36 (2), 177-202 (2019).
- Gordon, S., et al. Non-animal models of epithelial barriers (skin, intestine and lung) in research, industrial applications and regulatory toxicology. Altex. 32 (4), 327-378 (2015).
- Kandárová, H., et al. The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests - An assessment of the performance of the optimised test. Alternatives to laboratory animals : ATLA. 33 (4), 351-367 (2005).
- Kandárová, H., et al. Assessment of the skin irritation potential of chemicals by using the SkinEthic reconstructed human epidermal model and the common skin irritation protocol evaluated in the ECVAM skin irritation validation study. Alternatives to laboratory animals : ATLA. 34 (4), 393-406 (2006).
- OECD. Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. OECD. , (2019).
- Alépée, N., Grandidier, M. H., Cotovio, J. Sub-categorisation of skin corrosive chemicals by the EpiSkinTM reconstructed human epidermis skin corrosion test method according to UN GHS: Revision of OECD Test Guideline 431. Toxicology in Vitro. 28 (2), 131-145 (2014).
- OECD. Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method. OECD. , (2019).
- Mehling, A., et al. In vitro RHE skin sensitisation assays: applicability to challenging substances. Regulatory Toxicology and Pharmacology. 108, 104473 (2019).
- . SENS-IS | EURL ECVAM - TSAR Available from: https://tsar.jrc.ec.europa.eu/test-method/tm2011-11 (2020)
- Lelièvre, D., et al. The episkin phototoxicity assay (EPA): development of an in vitro tiered strategy using 17 reference chemicals to predict phototoxic potency. Toxicology in Vitro. 21 (6), 977-995 (2007).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Pellevoisin, C., Bouez, C., Cotovio, J. Cosmetic industry requirements regarding skin models for cosmetic testing. Skin Tissue Models. , 3-37 (2018).
- Niehues, H., et al. 3D skin models for 3R research: the potential of 3D reconstructed skin models to study skin barrier function. Experimental Dermatology. 27 (5), 501-511 (2018).
- Netzlaff, F., Lehr, C. -. M., Wertz, P. W., Schaefer, U. F. The human epidermis models EpiSkin®, SkinEthic® and EpiDerm®: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport. European Journal of Pharmaceutics and Biopharmaceutics. 60 (2), 167-178 (2005).
- Prieux, R., Eeman, M., Rothen-Rutishauser, B., Valacchi, G. Mimicking cigarette smoke exposure to assess cutaneous toxicity. Toxicology in Vitro. 62, 104664 (2020).
- Petracca, B., Rothen-Rutishauser, B., Valacchi, G., Eeman, M. Bench approaches to study the detrimental cutaneous impact of troposperic ozone. Journal of Exposure Science and Environmental Epidemiology. 31, 137-148 (2021).
- Dijkhoff, I. M., et al. Impact of airborne particulate matter on skin: a systematic review from epidemiology to in vitro studies. Particle and fibre toxicology. 17 (1), 35 (2020).
- El Ghalbzouri, A., Siamari, R., Willemze, R., Ponec, M. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential according to the ECVAM guidelines. Toxicology in Vitro. 22 (5), 1311-1320 (2008).
- Chacón, M., et al. Development of an in-house reconstructed human epidermis model as an alternative method in skin corrosion assessment. Toxicology in Vitro. 65, 104779 (2020).
- Pedrosa, T. d. o. N., et al. A new reconstructed human epidermis for in vitro skin irritation testing. Toxicology in Vitro. 42, 31-37 (2017).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Poumay, Y., Coquette, A. Modelling the human epidermis in vitro: tools for basic and applied research. Archives of dermatological research. 298 (8), 361-369 (2007).
- Rikken, G., Niehues, H., van den Bogaard, E. H. Organotypic 3D skin models: human epidermal equivalent cultures from primary keratinocytes and immortalized keratinocyte cell lines. Methods in Molecular Biology. 2154, 45-61 (2020).
- Duval, C., et al. Human skin model containing melanocytes: essential role of keratinocyte growth factor for constitutive pigmentation-functional response to α-melanocyte stimulating hormone and forskolin. Tissue engineering. Part C, Methods. 18 (12), 947-957 (2012).
- Hutter, V., Kirton, S. B., Chau, D. Y. S. Immunocompetent human in vitro skin models. Skin Tissue Models. , 353-373 (2018).
- Kinsner, A., Lesiak-Cyganowska, E., Śladowski, D. In vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking. 2 (3), 165-171 (2001).
- Black, A. F., Bouez, C., Perrier, E., Schlotmann, K., Chapuis, F., Damour, O. Optimization and characterization of an engineered human skin equivalent. Tissue Engineering. 11 (5-6), 723-733 (2005).
- Reijnders, C. M. A., et al. Development of a full-thickness human skin equivalent in vitro model derived from TERT-immortalized keratinocytes and fibroblasts. Tissue Engineering. Part A. 21 (17-18), 2448-2459 (2015).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering - In vivo and in vitro applications. Advanced Drug Delivery Reviews. 63 (4-5), 352-366 (2011).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Pittelkow, M. R., Scott, R. E. New techniques for the in vitro culture of human skin keratinocytes and perspectives on their use for grafting of patients with extensive burns. Mayo Clinic Proceedings. 61 (10), 771-777 (1986).
- Elias, P. M., Ahn, S. K., Brown, B. E., Crumrine, D., Feingold, K. R. Origin of the epidermal calcium gradient: regulation by barrier status and role of active vs passive mechanisms. Journal of Investigative Dermatology. 119 (6), 1269-1274 (2002).
- Elias, P. M., et al. Modulations in epidermal calcium regulate the expression of differentiation-specific markers. Journal of Investigative Dermatology. 119 (5), 1128-1136 (2002).
- Lee, S. E., Lee, S. H. Skin barrier and calcium. Annals of Dermatology. 30 (3), 265-275 (2018).
- Prunieras, M., Regnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. Journal of Investigative Dermatology. 81, 28-33 (1983).
- Poumay, Y., et al. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Archives of Dermatological Research. 296 (5), 203-211 (2004).
- Ponec, M., et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Savini, I., et al. Characterization of keratinocyte differentiation induced by ascorbic acid: Protein kinase C involvement and vitamin C homeostasis. Journal of Investigative Dermatology. 118 (2), 372-379 (2002).
- Pasonen-Seppänen, S., et al. Vitamin C enhances differentiation of a continuous keratinocyte cell line (REK) into epidermis with normal stratum corneum ultrastructure and functional permeability barrier. Histochemistry and Cell Biology. 116 (4), 287-297 (2001).
- Beer, H. D., et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 34-39 (2000).
- Steven, A. C., Bisher, M. E., Roop, D. R., Steinert, P. M. Biosynthetic pathways of filaggrin and loricrin--two major proteins expressed by terminally differentiated epidermal keratinocytes. Journal of structural biology. 104 (1-3), 150-162 (1990).
- Rice, R. H., Thacher, S. M. Involucrin: a constituent of cross-linked envelopes and marker of squamous maturation. Biology of the Integument. , 752-761 (1986).
- Elias, P. M., Barrier Feingold, K. R. . Skin Barrier. , (2011).
- Marionnet, C., et al. Morphogenesis of dermal-epidermal junction in a model of reconstructed skin: beneficial effects of vitamin C. Experimental Dermatology. 15 (8), 625-633 (2006).
- Frikke-Schmidt, H., Lykkesfeldt, J. Keeping the intracellular vitamin C at a physiologically relevant level in endothelial cell culture. Analytical Biochemistry. 397 (1), 135-137 (2010).
- Castro-Muñozledo, F., Hernández-Quintero, M., Marsch-Moreno, M., Kuri-Harcuch, W. Cultivation, serial transfer, and differentiation of epidermal keratinocytes in serum-free medium. Biochemical and Biophysical Research Communications. 236 (1), 167-172 (1997).
- De Vuyst, E., et al. Reconstruction of normal and pathological human epidermis on polycarbonate filter. Epidermal Cells. Methods in Molecular Biology (Methods and Protocols. , 191-201 (2013).
- Chen, R. H., Zhu, J., Zhang, R. Z., Wang, S. Y., Li, Y. The tolerance of human epidermal cells to trypsinization in vitro. Cell and Tissue Banking. 21 (2), 257-264 (2020).
- Pohanish, R. P. . Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2, (2012).
- Tsaousis, K. T., et al. Time-dependent morphological alterations and viability of cultured human trabecular cells after exposure to Trypan blue. Clinical and Experimental Ophthalmology. 41 (5), 484-490 (2013).
- Kim, S. I., et al. Application of a non-hazardous vital dye for cell counting with automated cell counters. Analytical Biochemistry. 492, 8-12 (2016).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Fartasch, M., Ponec, M. Improved barrier structure formation in air-exposed human keratinocyte culture systems. Journal of Investigative Dermatology. 102 (3), 366-374 (1994).
- Bouwstra, J. A., Honeywell-Nguyen, P. L., Gooris, G. S., Ponec, M. Structure of the skin barrier and its modulation by vesicular formulations. Progress in Lipid Research. 42 (1), 1-36 (2003).
- Ponec, M., Boelsma, E., Gibbs, S., Mommaas, M. Characterization of reconstructed skin models. Skin Pharmacology and Physiology. 15 (1), 4-17 (2002).
- Hubaux, R., Wauters, A., Chrétien, A., Poumay, Y., Salmon, M. Reconstructed human epidermis response to urban particulate matter activates multiple stress-related pathways and impacts the skin barrier function. 23th IFSCC Conference. , 125-134 (2017).
- Lin, Y. -. C., et al. Testing method development and validation for in vitro skin irritation testing (SIT) by using reconstructed human epidermis (RhE) skin equivalent - EPiTRI®. Alternatives to Animal Testing. , 8-19 (2019).
- Alexander, F. A., Eggert, S., Wiest, J. Skin-on-a-chip: Transepithelial electrical resistance and extracellular acidification measurements through an automated air-liquid interface. Genes. 9 (2), 114 (2018).
- van den Bogaard, E., et al. Perspective and consensus opinion: good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Kandárová, H., Hayden, P., Klausner, M., Kubilus, J., Sheasgreen, J. An in vitro skin irritation test (SIT) using the EpiDerm reconstructed human epidermal (RHE) model. Journal of Visualized Experiments. (29), e1366 (2009).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical pharmacology advances and applications. 8, 163-176 (2016).
- De Wever, B., Kurdykowski, S., Descargues, P. Human skin models for research applications in pharmacology and toxicology: introducing nativeSkin, the "missing link" bridging cell culture and/or reconstructed skin models and human clinical testing. Applied In Vitro Toxicology. 1 (1), 26-32 (2015).
- Klicks, J., von Molitor, E., Ertongur-Fauth, T., Rudolf, R., Hafner, M. In vitro skin three-dimensional models and their applications. Journal of Cellular Biotechnology. 3 (1), 21-39 (2017).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cellular and Developmental Biology - Animal. 22 (12), 695-705 (1986).
- Johansen, C. Generation and culturing of primary human keratinocytes from adult skin. Journal of Visualized Experiments. (130), e56863 (2017).
- Boelsma, E., Verhoeven, M. C. H., Ponec, M. Reconstruction of a human skin equivalent using a spontaneously transformed keratinocyte cell line (HaCaT). Journal of Investigative Dermatology. 112 (4), 489-498 (1999).
- Zhao, X., et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering. Advanced Healthcare Materials. 5 (1), 108-118 (2016).
- Peura, M., et al. Paracrine factors from fibroblast aggregates in a fibrin-matrix carrier enhance keratinocyte viability and migration. Journal of Biomedical Materials Research. Part A. 95 (2), 658-664 (2010).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCat keratinocytes in organotypic coculture with human dermal fibroblasts. Journal of Investigative Dermatology. 112 (3), 343-353 (1999).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue engineering. Part C, Methods. 20 (6), 473-484 (2014).
- Alameda, J. P., et al. IKKα regulates the stratification and differentiation of the epidermis: Implications for skin cancer development. Oncotarget. 7 (47), 76779-76792 (2016).
- Bikle, D. D., Xie, Z., Tu, C. L. Calcium regulation of keratinocyte differentiation. Expert Review of Endocrinology and Metabolism. 7 (4), 461-472 (2012).
- Staiano-Coico, L., et al. Human keratinocyte growth factor effects in a porcine model of epidermal wound healing. Journal of Experimental Medicine. 178 (3), 865-878 (1993).
- Egelrud, T. Desquamation in the stratum corneum. Acta Dermato-Venereologica. 80, 44-45 (2000).
- Jean, J., Lapointe, M., Soucy, J., Pouliot, R. Development of an in vitro psoriatic skin model by tissue engineering. Journal of Dermatological Science. 53 (1), 19-25 (2009).
- Lotte, C., Patouillet, C., Zanini, M., Messager, A., Roguet, R. Permeation and skin absorption: reproducibility of various industrial reconstructed human skin models. Skin Pharmacology and Applied Skin Physiology. 15, 18-30 (2002).
- Ponec, M., Weerheim, A., Lankhorst, P., Wertz, P. New acylceramide in native and reconstructed epidermis. Journal of Investigative Dermatology. 120 (4), 581-588 (2003).
- Thakoersing, V. S., et al. Unraveling barrier properties of three different in-house human skin equivalents. Tissue engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Thakoersing, V. S., et al. presence of monounsaturated fatty acids in the stratum corneum of human skin equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Van Smeden, J., et al. Combined LC/MS-platform for analysis of all major stratum corneum lipids, and the profiling of skin substitutes. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1841 (1), 70-79 (2014).
- Mieremet, A., et al. Human skin equivalents cultured under hypoxia display enhanced epidermal morphogenesis and lipid barrier formation. Scientific Reports. 9 (1), 7811 (2019).
- Mieremet, A., et al. Unravelling effects of relative humidity on lipid barrier formation in human skin equivalents. Archives of Dermatological Research. 311 (9), 679-689 (2019).
- Mieremet, A., Rietveld, M., Absalah, S., Van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by Chitosan modulated dermal matrices. PLoS ONE. 12 (3), 0174478 (2017).
- Mieremet, A., et al. Contribution of palmitic acid to epidermal morphogenesis and lipid barrier formation in human skin equivalents. International Journal of Molecular Sciences. 20 (23), 6069 (2019).
- Boniface, K., et al. IL-22 inhibits epidermal fifferentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- De Vuyst, E., Salmon, M., Evrard, C., Lambert de Rouvroit, C., Poumay, Y. Atopic dermatitis studies through in vitro models. Frontiers in Medicine. 4, 119 (2017).
- Danso, M. O., et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents. Journal of Investigative Dermatology. 134 (7), 1941-1950 (2014).
- Soboleva, A. G., Mezentsev, A., Zolotorenko, A., Bruskin, S., Pirusian, E. Three-dimensional skin models of psoriasis. Cells Tissues Organs. 199 (5-6), 301-310 (2014).
- Desmet, E., Ramadhas, A., Lambert, J., Gele, M. Van In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research. Experimental Biology and Medicine. 242 (11), 1158-1169 (2017).
- Niehues, H., van den Bogaard, E. H. Past, present and future of in vitro 3D reconstructed inflammatory skin models to study psoriasis. Experimental Dermatology. 27 (5), 512-519 (2018).
- Pendaries, V., et al. Knockdown of filaggrin in a three-dimensional reconstructed human epidermis impairs keratinocyte differentiation. Journal of Investigative Dermatology. 134 (12), 2938-2946 (2014).
- Niehues, H., et al. Epidermal equivalents of filaggrin null keratinocytes do not show impaired skin barrier function. Journal of Allergy and Clinical Immunology. 139 (6), 1979-1981 (2017).
- Reuter, C., Walles, H., Groeber, F. Preparation of a three-dimensional full thickness skin equivalent. Methods in Molecular Biology. 1612, 191-198 (2017).
- Bataillon, M., et al. Characterization of a new reconstructed full thickness skin model, t-skinTM, and its application for investigations of anti-aging compounds. International Journal of Molecular Sciences. 20 (9), 2240 (2019).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments. (96), e52576 (2015).
- Li, L., Fukunaga-Kalabis, M., Herlyn, M. The three-dimensional human skin reconstruct model: a tool to study normal skin and melanoma progression. Journal of Visualized Experiments. (54), e2937 (2011).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments. (135), e57500 (2018).
- Wei, Z., et al. Two-dimensional cellular and three-dimensional bio-printed skin models to screen topical-use compounds for irritation potential. Frontiers in Bioengineering and Biotechnology. 8, 109 (2020).
- Derr, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated morphology and barrier function. Tissue Engineering - Part C: Methods. 25 (6), 334-343 (2019).
- Frankart, A., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruction at the air-liquid interface. Experimental Dermatology. 21 (11), 871-875 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon