Method Article
3次元の再構築されたヒト表皮を大規模に育成
要約
このプロトコルは、再現性と堅牢な方法で三次元再構成ヒト表皮を栽培するための簡単な方法を記述する。さらに、表皮バリアモデルの構造機能関係を特徴付けます。炎症促進刺激の際に再構成されたヒト表皮の生物学的応答も提示される。
要約
新生児原発性角化細胞から再構築された3次元ヒト表皮モデルを発表する。本明細書において、モデルの育成過程および特性評価のためのプロトコルについて説明する。新生児一次角化細胞は、透過性ポリカーボネートインサートに水没して成長し、播種の3日後に空気液体界面に持ち上げられる。高カルシウム培養培地における定義された成長因子およびアスコルビン酸による刺激の14日後、モデルは完全に分化される。組織学的分析は、完全に階層化された表皮を明らかにし、人間の皮膚の形態を模倣した。モデルおよびそのバリア機能を特徴付けるために、初期段階のケラチノサイト分化(すなわち、ケラチン10)に特異的なタンパク質レベルおよび局在化、後期分化(すなわち、インボルクリン、ロリクリン、およびフィラグリン)および組織接着(すなわち、デスモグレイン1)を免疫学的に評価した。組織バリア完全性を、経上皮電気抵抗を測定することによってさらに評価した。ヒト表皮が 炎症促進性刺激(すなわち、リポ多糖および腫瘍壊死因子α)に反応し、サイトカイン放出の増加(すなわち、インターロイキン1アルファおよびインターロイキン8)に至った。このプロトコルは、環境への影響と幅広い皮膚関連研究を評価するためのツールとして 、再構築された ヒト表皮を育成するための簡単で再現可能なインビトロ法を表しています。
概要
表皮は、人体と外部環境との直接の界面で、皮膚の最外層である。その主な機能は、保護と水分補給1を提供することです。表皮は、外部剤に対する効果的な物理的障壁として機能し、身体からの過度の水の損失を防ぎます。これらの皮膚機能は、主に皮膚の最外層における細胞配列、組成、および細胞間脂質2の構成に依存する。表皮は主に組織の外側に上方に移動し、分化を受ける角化細胞で構成される。分化の段階によって特徴付けられる4-5の表皮層がある。内側から外側に、表皮層は生存性表皮、すなわち、層バサレ(SB)、尖層(SS)、および層顆粒球(SG)から、最上層、すなわち角層(SC)3から始まる。基底層は主に増殖性ケラチン濃縮ケラチノサイトで構成され、分化時にSSを介して移動する。ケラチノサイト成熟の間、タンパク質の発現および構造に様々な変化が生じる。ケラチノサイトはデスモソーム接合部5の形成を通して接着する。SGでは、ラメラ体の生成が開始される。それらは、皮膚バリア機能6の形成に重要な脂質前駆体および酵素からなる。SGはまた、ケラチノサイトの細胞質におけるケラトヒヤリン顆粒の存在によって特徴付けられる。SCとの界面では、ラメラ体の含有量が細胞間空間に押し出され、セラミド、コレステロール、遊離脂肪酸などの非極性脂質が積層層ラメラ脂質二重層に組織化され、細胞外脂質マトリックス7を形成する。SCでは、細胞は酵素分解プロセスのために核を含むすべての細胞小器官を失い、平坦化された形態を採用する。それらは架橋された蛋白質層から成っている角膜化された封筒に囲まれ、そして、角質細胞8,9と呼ばれる。デスモソーム成分は、角膜状エンベロープに架橋して、コルネオデスモソームを形成し、角質細胞を結合する。得られた上皮は、幹細胞から継続的に更新され、約5〜6週間のターンオーバー時間が10である。完全に層状表皮をもたらすケラチノサイトの分化過程は、皮膚11のバリア機能の形成にとって極めて重要である。
創傷および炎症の間、ケラチノサイトは接着分子および表面受容体の変化を誘発し、サイトカイン、ケモカイン、および抗菌ペプチド12の分泌を介して炎症反応を引き起こす。皮膚は外因性物質に対する物理的な障壁だけではありません。また、病原体への暴露時に免疫センサーとして機能します。さらに、脱水から人体を保護するために水分含有量など、その層全体にいくつかの物質の拡散を調節します。皮膚はまた、ビタミンDの合成に関与しており、他の様々な代謝機能3、13、14を有する。
外因性物質の有害作用を評価するために、毒物学者は何十年も動物実験に依存してきましたが、今日では好ましいアプローチではありません。人間の毒性に対する予測能力が限られていることに加えて、動物モデルには多くの倫理的問題が伴います。化粧品業界における動物実験の禁止と研究における3R原理(すなわち、交換、削減、および改良)に従うことを勧告することは、インビトロアプローチ15に基づく代替試験方法の開発につながっている。初のin vitro皮膚細胞モデルは90年代にすでに記載されており、単純なヒトケラチノサイト単培養から完全に分化した表皮および完全な厚さのモデルへの印象的な開発は16を達成した。今日では、皮膚組織工学は、医薬品と皮膚化粧品の両方の分野で重要性を増しています。過去20年間で、いくつかの企業は、皮膚関連の研究のための標準化され、再現可能なツールを表す3次元(3D)再構築ヒト表皮(RhE)を製品化しました。いくつかの市販のRhEモデルは、皮膚刺激の試験のためのOECDガイドラインに従って化学物質のインビトロ皮膚試験のために受け入れられている17,18 (すなわち, 試験ガイドライン 43919)および皮膚腐食20 (すなわち, 試験ガイドライン 43121).皮膚感作22(すなわち、SENS-ISアッセイ)のインビトロ試験は、現在承認トラック中であり、ピアレビュー23の下にある。また、市販のRhEモデルを利用する他にも数多くのアッセイが開発されており、光毒性24を評価し、薬物製剤25を試験し、化粧品製剤および有効成分26を試験し、皮膚バリア機能27を研究し、環境ストレッサー28、29、30、31に対する生物学的応答を試験する。
市販の3Dスキンモデルに加えて、複数の研究グループが独自のRhE32、33、34、35、36、37を開発しました。社内のRhEは、研究の目的に応じて培養条件を制御するための利点を提供します。具体的には、研究者は、3D表皮モデルの再構成に使用されるケラチノサイトの種類と供給源を選択することができます(すなわち、一次対不死化、新生児対高齢者、単一対プールランダムドナー、性別、民族性、喫煙などの個人生活習慣)。彼らは、培養培地の組成を変化させ、増殖因子、ビタミン、または標的タンパク質または脂質の発現を調節することができる他の化合物を組み込む可能性を有する。社内のRhEを使用すると、3Dモデルの分化状態の関数として生物学的応答と生体力学的特性を調査することもできます。これらの直観的なパラメータに加えて、例えば他の表皮細胞タイプ(例えばメラノサイトおよび免疫細胞)38、39を加えることによって、線維芽細胞が含まれるコラーゲンマトリックス40、41、42、および44の構成要素によって、3D皮膚モデルの複雑さを増大させ、より生理的に関連するようにする継続的な努力がある。
特定のニーズに応じてカルチャ条件を調整することは可能ですが、RhE の品質と関連性の両方を保証するために尊重する必要があるパラメーターがあります。RhE組織を培養するために、正常なヒト表皮角化細胞(NHEKs)は、多孔質合成膜がウェルを2つの区画、すなわち、有端およびバソラテラコンパートメントに分離する特定の透過培養インサートに播種される。膜の空隙率(すなわち、0.4μmの孔径)は、基底挿入側への細胞の移動を伴う有端コンパートメント内の細胞単層の形成、およびバソラテラコンパートメントに含まれる培養培地からの必須栄養素を含むケラチノサイトの供給を可能にするものである。再構成プロセスの開始時に、NHEKsは数日間水没した状態で培養され、膜への接着が可能になります。両方の区画のカルシウム濃度は、細胞の増殖を遅くし、その分化を促進するためにNHEKsの2D培養に使用されるカルシウム濃度に比べて増加する46.表皮カルシウム勾配は、バリア形成およびホメオスタシス47,48を調節するために不可欠である。高カルシウムレベル(すなわち、最大1.5mM)は、細胞間接合の形成を促進し、末端分化中に角膜状エンベロープの形成を調節する。一旦、角化膜上に連続的かつ堅固な単層を形成すると、その空気室からの培地が除去され、培養プロセスは、空気・液体界面(ALI)で継続して層形成を刺激し、表皮バリア50,51を確立する。完全に階層化された上皮36を得るためには、特定の培養条件が重要である。ALIでの再構成プロセス中に、バソラテラルコンパートメント内の培地は、ケラチノサイト成長因子(KGF)、インスリン、カルシウム、およびアスコルビン酸で補充される。アスコルビン酸は、適切なSC脂質バリアの形成において大きな役割を果たし、ヒトの皮膚52に近い。アスコルビン酸添加培地で増殖したケラチノサイトは、角質藻肉の粒状化の数を増強した、ならびに角質細胞52のインターステクスにおける細胞間脂質ラメラを組織化した分化表現型を示す。このような補充は、角膜化エンベロープ含有量を増加させ、親水性抗酸化ストア53,54の枯渇を回避することによって表皮バリア機能を改善するために不可欠である。KGFは、表皮増殖および分化の重要なパラクリンメディケーターであり、NHEKs55を刺激するために使用される。
社内のRhEの主な欠点は、研究機関間の標準化の喪失と労働強度と時間消費の増加(すぐに使用できる商用モデルと比較して最大3週間)です。本稿の目的は、これらの欠点に対処し、生産の基礎を大きな規模にすることです。上記の社内RhEの利点に加えて、現在のプロトコルは、組織間の可変性と組織間の変動性を低減し、汚染リスクを低減し、栽培プロセスを合理化することを目的としています。
現在のプロトコルは新生児のNHEKsを使用してRhEを栽培するために再生可能で、強い方法を記述する。さらに、表皮分化に特異的なRhEs形態の特徴づけ、バリア完全性、およびタンパク質の発現の代表的な結果を示す。RhEs形態構造を、ヘマトキシリンおよびエオシン(H&E)染色および透過電子顕微鏡(TEM)を用いて検討した。バリア完全性を評価するために、経上皮電気抵抗(TEER)とトリトンX-100への曝露時間を組織生存率の50%を減少させる(ET50)測定した。デスモソーム接合(すなわちデスモグレン1)の形成を免疫蛍光(IF)で解析し、ケラチノサイト接着を評価した。表皮構造タンパク質(すなわち、インボルクリン、ロリクリン、フィラグリン)の形成を評価し、IFで検出した。これらのタンパク質は、SC角質細胞を取り囲む高度に架橋されたタンパク質エンベロープの形成に関与し、その結果、後期表皮分化56,57の重要なマーカーである。さらに、IFを用いて、SS58において初期の分化細胞において誘導されるタンパク質であるケラチン10を分析し、全ての分化層の内部に見つかった。最後に、炎症促進性刺激(すなわち、リポ多糖および腫瘍壊死因子α)に対するRhEの反応を調査した。インターロイキン1α(IL-1α)およびインターロイキン8(IL-8)のレベルを、酵素結合免疫吸着アッセイ(ELISA)を用いて細胞培養培地で測定した。
プロトコル
このプロトコルに関連する研究活動を計画し実行する前に、ヒト組織または細胞の使用に関連する国内および国際的な倫理的配慮および条件を検討し、遵守する。
注: このプロトコルのすべての手順は、無菌条件で実行する必要があります。バイオセーフティレベル2のプラクティスは、RhEの栽培に最低限必要です。このプロトコルに記載されている化学物質/試薬を取り扱う際には、必要な安全対策をすべて講じる必要があります。
1. 細胞培養培地の調製
注:RhEの栽培に使用される無血清培養培地には3種類あります(表1):(i)NHEKsの2D培養に使用されるカルシウムレベルの低い基底培地(60μM Ca2+);(ii) 細胞培養インサートシステムへのNHEKの播種に使用される高カルシウムレベル(1.5 mM Ca2+)を有する水没培地。(iii)高カルシウムレベル(1.5 mMCa2+)、アスコルビン酸、およびケラチノサイト成長因子(KGF)を有する空気液体界面(ALI)培地。
| 中程度 | 中程度の情報 | 必要数量 |
| 基底培地 | ケラチノサイト増殖培地 | 36 mL/24ウェル |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x抗生物質抗ミキサン | ||
| 水没培地 | ケラチノサイト増殖培地 | 36 mL/24ウェル |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x抗生物質抗ミキサン | ||
| + 1.5 mM Ca2+ | ||
| 空気液体インターフェース媒体 | ケラチノサイト増殖培地 | 216 mL/24ウェル |
| + 1 % [v/v] HKGS | ||
| + 1 % [v/v] 100x抗生物質抗ミキサン | ||
| + 1.5 mM Ca2+ | ||
| + 50 μg/mL アスコルビン酸 | ||
| + 10 ng/mL角化細胞成長因子 |
表 1.RhEを栽培するために使用されるさまざまな培養媒体の要約表。サプリメントを含む異なる文化メディアのリスト。
- 基底培地を準備します。
- 0.2%[v/v]ウシ下垂体抽出物(BPE)、0.2 ng/mLヒト組換え表皮成長因子(EGF)の最終濃度に達するために、500 mLのケラチノサイト成長培地(材料表)を5 mLのヒトケラチノサイト成長サプリメント(HKGS)で補う 5 μg/mL ウシトランスフェリン、および組換えヒトインスリン様成長因子I(IGF-I)の0.01 μg/mL。
- ペニシリン10,000単位/mL、ストレプトマイシン10,000μg/mL、アンホテリシンBの25μg/mLを含む100x抗生物質抗ミキマチ溶液5mLを加えます。
- 水没した媒体を準備します。
- 0.2%[v/v]BPEの最終濃度に達するために、5mLのケラチノサイト成長培地(材料表)を5 mLのHKGSで補い、 0.2 ng/mL ヒト組換えEGF、0.18 μg/mLヒドロコルチゾン、5 μg/mL ウシトランスフェリン、および0.01 μg/mLのヒト組換えIGF-I.
- 100倍の抗生物質抗ミキサン溶液を5 mL加えます。
- 0.144 M CaCl2 (塩化カルシウム) ストック溶液の 5 mL を加え、最終濃度の 1.5 mM Ca2+に到達します。
注:カルシウム濃度は、ケラチノサイトの分化を刺激し、成層プロセス49を開始するために、水没期中にすでに増加しています。
- 空気/液体インターフェイス (ALI) 媒体を準備します。
- 0.2%[v/v]BPEの最終濃度に達するために、5mLのケラチノサイト成長培地(材料表)を5mLのHKGSで補い、 0.2 ng/mL ヒト組換えEGF、0.18 μg/mLヒドロコルチゾン、5 μg/mL ウシトランスフェリン、および0.01 μg/mLのヒト組換えIGF-I.
- 100倍の抗生物質抗ミキサン溶液を5 mL加えます。
- 0.144 M CaCl2 ストック溶液の 5 mL を加え、最終濃度の 1.5 mM Ca2+ に到達します。
- 25 mg/mL アスコルビン酸ストック溶液を 1 mL 加えて、50 μg/mL アスコルビン酸の最終濃度に達します。
- リン酸緩衝生理食塩水(PBS)ストック溶液に1%のウシ血清アルブミンで100 μg/mL KGFの50 μLを加え、10 ng/mL KGFの最終濃度に到達します。
注:アスコルビン酸は酸化に敏感であるため、l-アスコルビン-2リン酸マグネシウム59 またはL-アスコルビン酸2リン酸2リン酸など安定なアスコルビン酸誘導体を使用することをお勧めします。アスコルビン酸を使用する場合, 各リフレッシュの前にアスコルビン酸で ALI 培地を新鮮に補充することをお勧めします。.
2. NHEKsの文化
注:原発性ヒトケラチノサイトは第4または5節61で増殖し続けるため、第3の通路のNHEKはRhEの栽培に使用されます。一次角化細胞は、その高感度のために非常に慎重に処理する必要があります。細胞懸濁液の慎重かつ遅いピペットは、細胞の状態を乱さないことが非常に重要です。
- 37°Cの水浴で1 x 106 凍結保存されたNHEKを有するバイアルを解凍し、バイアルの一部を水中に浸す。小さな氷が見えるまで、水浴でバイアルを1〜2分間インキュベートします。
注意:汚染を避けるために、水浴中のバイアル全体を水没しないでください。2分以上の細胞を解凍しないでください。これにより、細胞の生存率を低下させることができます。チューブを薄層フードに移す前に、70%エタノール溶液でバイアルを拭きます。 - 2-3回上下にピペットを入れ、細胞を非常に慎重に再懸濁させる。細胞懸濁液を、合計15mLの予熱解凍媒体を含む2つのT75フラスコに移し、6.7 x 104 細胞/cm2の播種密度を生じる。
注:最初の2つの通路と凍結保存されたNHEKsの解凍のために、細胞培養培地は、サプライヤーの勧告に従って使用されます。 - フラスコを細胞培養インキュベーター(37°C、5%CO2、相対湿度95%)に入れる。
- 約24時間後、解凍媒体を基底培地で交換し、ケラチノサイト凍結溶液からジメチルスルホキシド(DMSO)を除去する。
- 2日ごとに基底培地をリフレッシュします。
- 4-6日間の培養後、細胞は約80%コンフルエントで、RhEの栽培のためのインサートに播種する準備ができているはずです。
注:ケラチノサイトは、増殖容量62を維持するために最大80%の合流点に成長する必要があります。解凍される細胞の数は、細胞通過数、解凍時の細胞生存率、播種効率、倍率などの複数のパラメータを考慮する必要があります。
3. NHEKsのシード
注: このプロトコルは、24 ウェルキャリア プレート形式で使用するように設計されています。他のプレートフォーマットが必要な場合(例えば、12ウェルまたは6ウェル形式)、シード密度と中量の最適化を考慮する必要があります。 図1 は、RhE栽培の計画を要約し、栽培条件を示す。
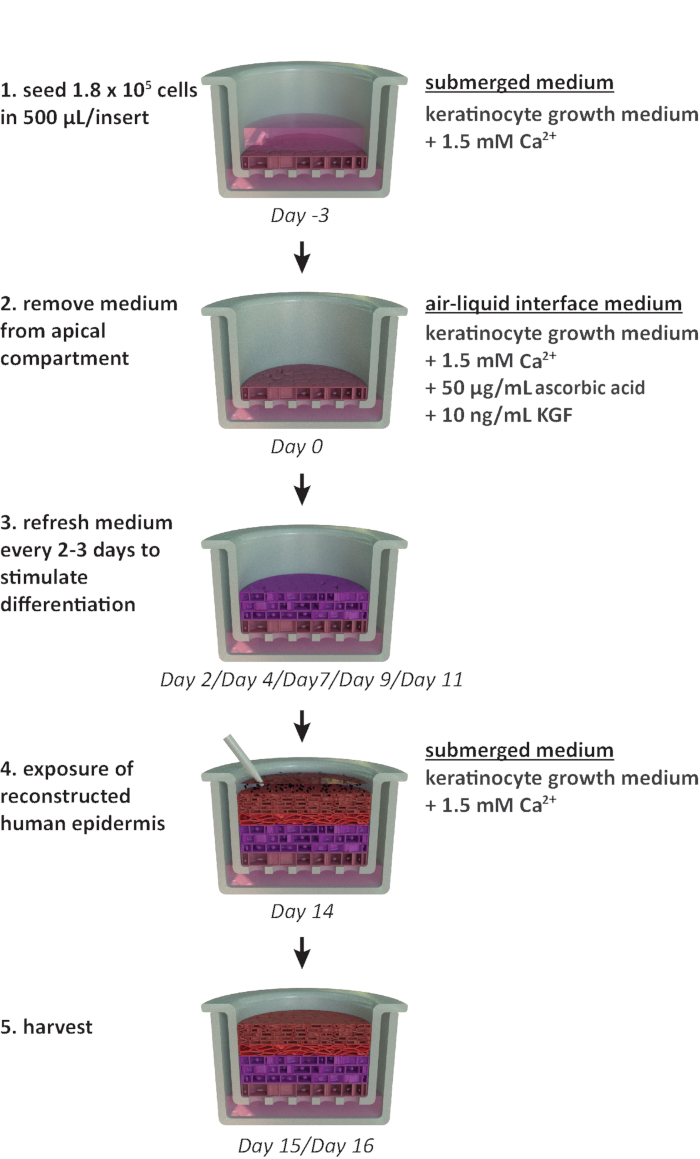
図1:再構成プロトコルの概略タイムラインRhEモデルの調製、栽培プロセス、および適用(化学物質への暴露)の提示。スキームには、各ステップに適した細胞培養培地タイプが含まれます。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 24ウェルプレートに1.5 mLの水没培地をプレフィルし、理想的にはディスペンサーピペットを使用します。
- NHEKsの培養に使用されるT75フラスコから基底培地を取り除きます。
- 各T75フラスコに5mLの予温PBSを加えて細胞をリンスします。
- フラスコからPBSを取り出します。
注:このステップは、トリプシン活性を阻害するタンパク質およびカルシウムが含まれているため、非常に重要です。 - 2~3 mLのプリウォーム 0.05% [v/v] トリプシン/エチレンジアミンテトラ酢酸 (EDTA) を各 T75 フラスコに加えます。トリプシン溶液がフラスコの細胞培養領域に均等に分布していることを確認します。
注意: 2 mL の体積は、上記の 80% の合流度に基づいています。より高い合流性を有するフラスコに3mLを使用してください。 - フラスコを細胞培養インキュベーター(37°C、5%CO2、および95%RH)に4分間入れます。顕微鏡を使用して10倍の倍率で細胞が取り外されるかどうかを確認します。フラスコを手のひらにラップして、フラスコの表面から細胞が放出するのを助けます。剥離細胞は、トリプシン溶液中に浮遊する丸みを帯びた細胞として観察することができる。
注意:トリプシン中の細胞を6分以上インキュベートしないでください。過剰トリプシンゼーションは細胞を損傷し、その付着率を減少させる可能性があります 63. - すべての細胞が切り離されたら、各T75フラスコにプリウォームトリプシン阻害剤の等しい体積(すなわち、2〜3 mL)を加えます。
- フラスコから遠心分離管に細胞懸濁液を移します。
- 5 mLの予温PBSでフラスコをリンスし、細胞懸濁液を含む遠心分離管に移します。
注:顕微鏡下のフラスコ内の残余細胞数を確認して、ほとんどの細胞が収集されていることを確認してください。フラスコの表面は95%空でなければなりません。この場合、トリプシン化手順(3.3-3.9)を繰り返すことができます。ただし、再試行は避けるべきです。 - 収穫した細胞を 400xg で5分間遠心する。
- 上清の大部分を慎重に廃棄し、チューブに約100〜200μLを残します。
注意:この手順中にペレットを吸引しないでください。 - 少量の水没培地で細胞ペレットを穏やかに再懸濁し、ピペットを5〜10回上下させて均一な細胞懸濁液を確保する。低容量(すなわち、500 μL)から始め、細胞凝集体の形成を回避し、初期T75フラスコごとに合計で最大1mLの水没培地を添加します。
注:指でチューブを軽くフリックして、上清の細胞ペレットの一部を慎重に溶解します。 - トリパンブルー除外法を使用して、懸濁液中のセルをカウントします。
- 0.4%[v/v]トリパンブルーステインとセル懸濁液を1:1比で希釈し、10 μLの0.4%[v/v]トリパンブルーステインを10μLのセルサスペンションに加えます。10 μLの溶液を計数スライドに追加します。細胞懸濁液をトリパンブルーと混合した直後に細胞数を測定し、トリパンブルーは1分65より長く曝露した後に細胞生存率を低下し始めるからである。
注意:トリパンブルーは、潜在的な変異原、発がん性物質、およびテラトーゲン64であることが示された。地元の実験室の規則に従って、慎重に染料を処理し、廃棄物を安全に処分します。
注:トリパンブルーの使用に対する別のアプローチは、非危険な染料エリスロシンB66です。
- 0.4%[v/v]トリパンブルーステインとセル懸濁液を1:1比で希釈し、10 μLの0.4%[v/v]トリパンブルーステインを10μLのセルサスペンションに加えます。10 μLの溶液を計数スライドに追加します。細胞懸濁液をトリパンブルーと混合した直後に細胞数を測定し、トリパンブルーは1分65より長く曝露した後に細胞生存率を低下し始めるからである。
- 式1に示すように体積V2を加えることによって、3.525 x 105細胞/mLの濃度に達するために、追加の水没培地で細胞懸濁液を希釈します。
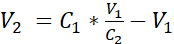
C1 =3.12で得られた細胞懸濁液中の細胞濃度をカウントした(細胞/mL)
V1 = 細胞のペレットを 3.12 (mL) で再懸濁するために使用される体積
C2 =懸濁液中の標的細胞濃度(すなわち、3.525 x 105細胞/mL)
V2 = ターゲットセル濃度(mL)に到達するために追加するボリューム
注: 推奨カルチャ挿入物の表面積は 0.47 cm2です。したがって、対応するシード密度は 3.75 x 105 セル/cm2 です。 - ステップ3.14で得られた希釈液の第2の細胞数(C3)を行う。式 2 を使用して、培養挿入物にシードされるセル懸濁液量 (V4)を計算します。
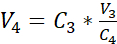
C3 =懸濁液中の標的細胞濃度(すなわち、3.525 x 105細胞/mL)
V3 =培養インサートに播種される細胞懸濁液の標的体積(すなわち、0.5 mL)
C4 = 3.14で得られた希釈懸濁液中の細胞濃度をカウント(細胞/mL)
V4 = 培養インサート(mL)に播種される細胞懸濁液の実体積 - 24個の細胞培養インサートを推奨キャリアプレートの最高位置に掛け、液状の培地であらかじめ充填された24ウェルプレートにキャリアプレートを移す(図3.1)。
注意:キャリアプレートをマルチウェルプレートに移す場合、細胞の供給に影響を与え、最終的にはRhEの生存率と形態を損なうため、基底コンパートメントから挿入膜と水没した媒体の間に気泡が閉じ込められないようにしてください。 - セル懸濁液の決定されたボリュームV4( 式2から)を各挿入物に加えます。
注:逆ピペット法を使用して、細胞懸濁液を培養インサートに正確に分配することをお勧めします。
注意:細胞懸濁液を培養インサートに分配する際に膜を損傷しないようにしてください。予防措置は、膜の表面に触れることなく、挿入システムの壁に沿って細胞懸濁液を分配することです。 - 播種後、24ウェルプレートを室温で10〜15分間インキュベートし、エッジ効果を克服する(すなわち、全ウェル67間の不均一な温度分布)。この間はプレートを動かさないで下します。
- プレートを細胞培養インキュベーター(37°C、5%CO2、および95%RH)に移します。細胞は3日間水没状態で維持される。
注:組織の変動を避けるために、各インサートが同じ熱量を受け取ることを確認するために、播種後にインキュベーターにプレートを積み重ねないでください。3日後(すなわち、ALI栽培中)、プレートの積み重ねが可能である。
4. 空気液体インターフェースでの栽培
- 細胞培養インキュベーター(37°C、5%CO2、および95%RH)で3日間のインキュベーション後、吸引システムとガラスパスツールピペットを使用して、頂状コンパートメントから水没した培地を除去することによって膜表面に付着した細胞をALIに露出させる。
注:または、アピカルコンパートメントから水没した媒体は、手動マイクロピペットで取り除くことができます。 - 新しい24ウェルプレートに1.5 mLの新鮮な事前温めたALI培地を充填し、新しいマルチウェルプレートに培養インサートを使用してキャリアプレートを転送します。
- マルチウェルプレートを細胞培養インキュベーター(37°C、5%CO2、および95%RH)に戻します。
- ALI メディアを 2 ~ 3 日ごとに 14 日間更新します。
- 2つのステップでリフレッシュを行います:1)新鮮な事前温めたALI培地の1.5 mL/wellを含む新しいプレートを準備し、2)キャリアプレートを新しいプレートに移します。
注意: 全体の再構成手順の間、潜在的な汚染からRhEsを保護するためにキャリアプレートを覆う蓋を取り外さないのが最善です。
注:ALIステップは、角化細胞68の末端分化を可能にするので、階層化された表皮モデルの開発にとって極めて重要です。ALIに行った後、挿入物の視覚的な制御が必要であり、「漏れやすい組織」があるかどうかを確認する:バソラテラコンパートメントから来る組織表面の中液滴。漏れがALI 3日目に起こった場合、組織の表面に触れることなく、培養インサートから培地を静かに取り出す。漏れが続く場合は、RhEモデルに正しいバリア形成がないことを示すため、漏れ出した組織を廃棄することをお勧めします。 - 再構成プロセスの最後に、組織は、例えば酸化ストレスや炎症を誘発するために様々なストレッサーにさらされ得る。並行して、それらは化学化合物または化粧品の成分で処理することができる。注:暴露/治療中、組織は通常、ALI D14から始まる水没培地に維持されます。組織が長期間(すなわち、48〜72時間)暴露/治療されると予想される場合、(i)生存層の薄化とSCの肥厚を避けるために、D7-D9などのALI培養プロセスの早い段階で暴露/治療を開始し、(ii)細胞増殖を促進し、(ii)細胞増殖を促進するために、細胞の増殖を妨げるための、刺激を受ける。
- RhEの収穫のために、組織学的分析、生存率アッセイ、タンパク質/RNA抽出、および酵素結合免疫吸着アッセイ(ELISA)の目的の時点で組織および細胞培養培地を収集する。
結果
2Dで培養されたNHEKsは、一貫した多角形の形状を持つ伝統的な形態を表示する(図2A)。上述のように、NHEKは約80%の合流度に達した後に培養インサートに播種される。RhEsの形態をH&E染色とTEMを用いて解析した。ALIでの15日後、その4つの主要な表皮層(SB、SS、SG、およびSC)によって示されるように完全に層状組織が得られる(図2B)。SB レイヤーでは、セルは柱状の形状を持っています。2番目の層からRhEの上層に向かって、NHEKsは細胞形態の変化によって観察されるように区別する(SB層の柱状形状から、SS層の棘形状に向かって)。SG層では、細胞はより平坦な形状を有し、細胞質に紫色の点として表される角質ヒヤリン顆粒(KG)を表示する。その特徴的な丸い形状と恒星形状は、H&E画像上の白い矢印で強調されています(図2C)。SC内の細胞は、末端分化され、完全に平坦化され、細胞核を欠いている。層状のRhEの全体の厚さは84.3±2.4 μmで、SCの厚さは19.6±3.2μm(図2D)です。これらの値は、ネイティブのヒト皮膚、すなわち60-120 μmおよび10-20 μm、それぞれ69に対して報告されるものと同等である。生存層の数は6~7で、人間の皮膚に比べて少ないが、7~1470程度である。再構成プロトコルの異なる時点でのRhEの超構造解析(すなわち、7、10、13、および15日)は、時間の経過とともに多くの角質層を有するRhEの角化プロセスを明らかにする(図2E)。ALIで15日後、RhE組織のSCは、約15〜25層で作られており、これは、ネイティブのヒト皮膚(すなわち、15〜20層)69に対して報告された値に匹敵する。
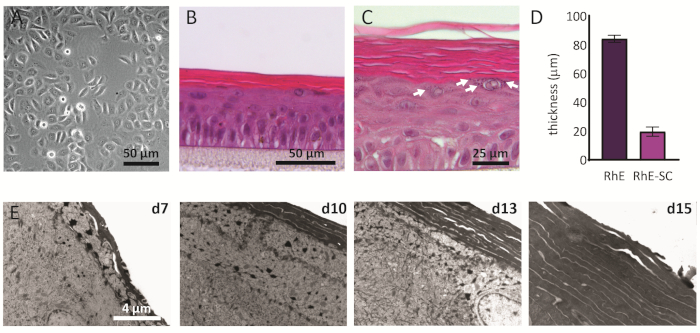
図2:一次角化細胞および再構成されたヒト表皮(A)挿入物に播種する前の第一次角化細胞の位相対照顕微鏡画像。スケールバーは、RhEの50μm(B-C)H&E明るいフィールド顕微鏡画像です。スケールバーは50μm(B)、25μm(C)です。(D) RhE および SC の厚さの定量化 (平均 ± SEM、n =3)。(E) ALIで7、10、13、および15日後のRhE断面の透過型電子顕微鏡画像。スケールバーは4μmです。この図の大きなバージョンを表示するには、ここをクリックしてください。
彼らの分化段階によると、3Dで成長するNHEKは、その分化段階に応じて異なるタンパク質発現プロファイルを示す。初期のケラチノサイト分化に特異的なタンパク質(すなわち、ケラチン10)、後期ケラチノサイト分化(すなわち、インボルクリン、ロリクリン、フィラグリン)、およびケラチノサイトの接着(すなわち、デスモグライン1)を用いて決定した。インボルクリン発現は、その発現が分化プロセス(図3D)の間に早く開始されるので、より主にSG層に位置するように見えるが、フィラグリンとロリクリンは上層で表される(図3B-C)。ケラチン10発現は、SB層を除くすべての実行可能な層に見つかった(図3E)。RhEは、生き生きした表皮層の細胞間空間におけるデスモグレイン1の発現によって示されるように、機能的デスモソーム接合部を表示する(図3F)。結論として、5つのマーカーすべてが適切な表皮層に発現され、位置し、健全な表皮分化プロセスに翻訳される。
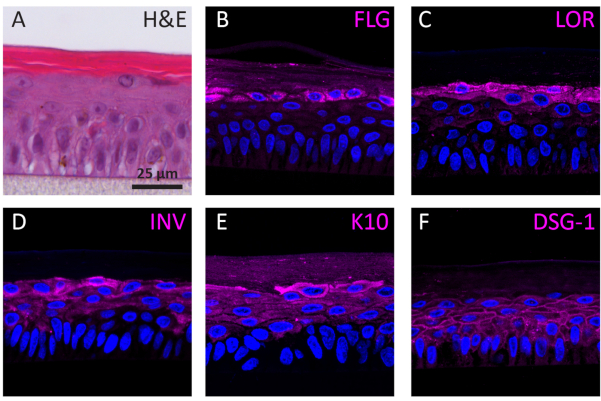
図3:表皮分化、組織接着、および再構築されたヒト表皮の組織完全性を示す(A)H&E明るい視野顕微鏡画像RhE(B)フィラグリン(FLG)、(C)ロリクリン(LOR)、(D)インボルクリン(INV)、(E)ケラチン10(K10)、および(F)デスモグレン1(DSG-1)の共焦点蛍光顕微鏡画像。核染色(DAPI)は青色で表される。スケールバーは25μmです。この図の大きなバージョンを表示するには、ここをクリックしてください。
RhEモデルのバリア特性を、組織の生存率と完全性の両方を評価することによって調査した。組織の完全性は、電圧計を用いてTEERを測定することによって15日後に決定した。2567 ± 415 Ω.cm2値は、RhEs に記録され、連続的なバリアの形成を変換します (図 4A)。これらの値は、RhE モデル71、72、73、74で報告された値と範囲内にあります。さらに、細胞毒性基準化学物質(すなわち、トリトンX-100)が組織生存率を50%減少させるために必要な暴露時間(ET50)をチアゾリルブルーの臭化テトラゾリウム(MTT)アッセイで決定した。RhEについて測定したET50値は2.1時間であった。この値は、刺激分類の信頼性の高い予測のために修飾されている他の3D表皮モデルの受け入れ範囲内に収まる (OECD ガイドライン 439)19.
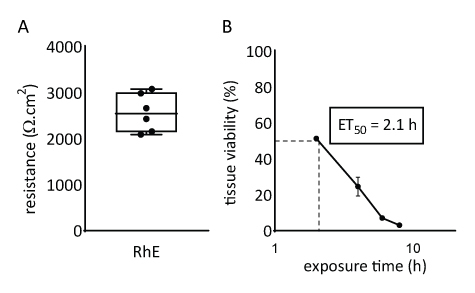
図4:再構成されたヒト表皮のバリア特性(A)経上皮電気抵抗(平均 ±sEM、n=6)で測定された組織の完全性。(B) ET 50は、トリトンX-100(± 平均sEM、n=3)の78.3 μLへの局所暴露時の組織生存率(すなわちMTTアッセイ)を測定することによって決定される。
RhEの応答性は、既知の炎症刺激を受けた上で調べた。RHEは、100μg/mL大腸大腸リポ多糖(LPS)および40ng/mL腫瘍壊死因子α(TNF-α)を用いて、バソラテラコンパートメントの培地に刺激を加えて全身的に処理した。24時間の刺激後、細胞培養培地を採取した。細胞毒性を乳酸脱水素酵素(LDH)アッセイを用いて測定し、既知の膜破壊剤の値と比較して、Triton X-100洗剤を比較した(図5)。トリトンX-100で処理されたRhEsのLDH活性において有意な増加(p<0.05、一方向ANOVA、ダネットの多重比較検定)が示された。LPSおよびTNF α治療はいずれも細胞毒性を示さなかった。

図5:乳酸脱水素酵素(LDH)アッセイを用いて測定した細胞毒性。 データは、コントロール、未処理の組織(CTRL)に対する相対値として表示されます。± 平均は、SEM、n=9(トリトンX-100)、n=8(LPS)、n=3(TNF-α) を意味します。有意性は、ダネットの多重比較試験である一方向のANOVAで試験された。アスタリスクは、CTRL、****p < 0.0001) と比較して統計的に有意な差を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
RhE培地におけるインターロイキン1α(IL-1α)及びインターロイキン8(IL-8)の放出を、エリザを用いて定量した。 図6 はLPSおよびTNF-αでの挑戦時にRhEsによる定量および相対IL-1αおよびIL-8放出の両方を示す。LPS処理は、IL-8(9.6±1.0倍増加)およびIL-1α(2.7±1.3倍増加)の放出を誘発した統計的に有意な(p<0.05、未組の学生のTテスト)をもたらした。TNF-αは、IL-8レベルの上昇傾向が認められたにもかかわらず、IL-8放出を有意に誘導しなかった(2.3±0.8倍増加)。しかし、TNF-αは有意に(p <0.05、未組の学生のT検定)はIL-1α放出を引き起こした(1.8±0.5倍増加)。
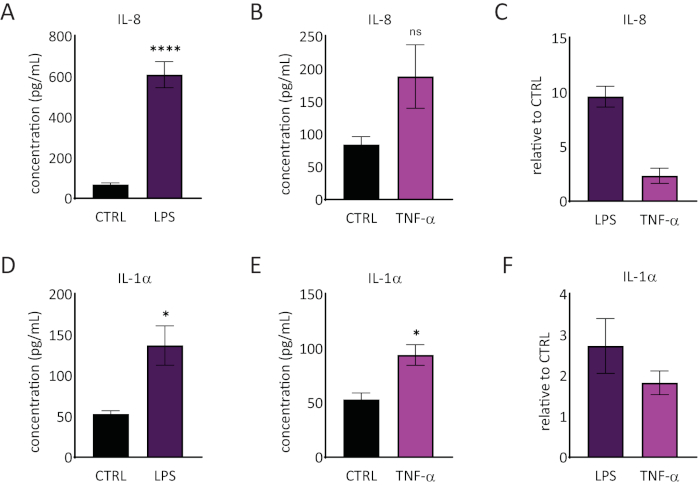
図6:再構築されたヒト表皮における炎症反応を示す。LPS(A)とTNF-α(B)による24時間の挑戦に対するRhEによるIL-8放出の濃度。データは、SEM、n=8 (LPS)、n=3 (TNF-α) ±平均として表されます。(C) データは、制御、未処理組織 (CTRL) ± SEM、n=8 (LPS)、n=3 (TNF-α) と比較した相対値の平均として表されます。LPS(D)およびTNF-α(E)による24時間チャレンジ時のRhEのIL-1α放出の濃度。 データは、SEM、n=8 (LPS)、n=3 (TNF-α) ±平均として表されます。(F) データは、Ctrl ± SEM、n=4 (LPS)、n=3 (TNF-α) と比較した相対値の平均として表されます。有意性は、ペアになっていない学生のT検定によってテストされました。アスタリスクは、CTRL、*p <0.05、****p <0.0001)と比較して統計的に有意な差を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
RhEsは医薬品および皮膚化粧品分野36、75、76、77、78のスクリーニングツールとして広く使用されています。いくつかの企業は、このようなRhEsを市販していますが、コストが残っており、新しい研究の質問に対処するために必要に応じて栽培パラメータを変更する可能性を制限しています。本論文では、堅牢で信頼性の高い方法で社内RhEの製造手順を説明し、動物実験の代替アプローチとしてモデルの関連性を確認するために得られた組織の詳細な特徴付けを提供する。
プロトコルの一部のステップは、適切なケラチノサイト分化およびRhE再現性を保証するために重要です。最適な細胞、培地タイプ、栽培条件を利用して行うことができます。提案されたRhEモデルでは、新生児のNHEKsは、成人のNHEKと比較して、抗原暴露の欠如のために選択された。さらに、ケラチノサイトは、種間変動を避けるために白人民族に限定された。一次角化細胞は、通常、差別化と階層化の能力のために使用される79.それらは商業的にまたは大人の皮からの社内の隔離によって得ることができる80.ポリカーボネート膜上の細胞株(すなわち、HaCaT)の培養は、分化を失敗させ、バリア形成に必要な脂質を合成する能力の低下を示した。81.しかし、ヒドロゲル、コラーゲン、フィブリン、スフェロイドなどの異なる培養マトリックスを含めることで、3Dスキンモデルの開発に成功しました。78,82,83,84,85,86.不死化細胞株N/TERTは、RhEの開発に適することが示されている35.原発性角化細胞は4番目または5番目の通路で増殖し続ける61したがって、現在のプロトコルは、第3の通路におけるケラチノサイトの使用を含む。De Vuystら. 細胞の播種密度が重要であり、十分である必要があることを実証しました(すなわち、≥2.5x105 セル/cm2)を使用して、バソラテラコンパートメントからの媒体が、補助コンパートメントに拡散しないようにする。不十分なシード密度(すなわち、 < 2.5x105 セル/cm2) は、適切なバリアを形成できなくなる可能性があり、これは、バソラテラからアピカルコンパートメントへの培地の拡散によって示され、ALI培養条件の代わりに水没する結果となる62.無血清ケラチノサイト増殖培地(参照) 資料表)は、化学的に定義された媒体を使用して作業する利点を提供し、汚染のリスクを低減するので、再現性の目的のために好ましい。この培地はカルシウム濃度が低く(すなわち、60μM)、したがってケラチノサイトの増殖を刺激する87.RhE栽培の第1段階からカルシウム濃度(すなわち1.5mM)を増加させ、ケラチノサイト分化および皮膚バリア形成および恒常性を好む49.さらに、アリ培地は、SC脂質の形成および分化を促進するために重要であることが示されているアスコルビン酸を添加する52,53,54.ALI培地にはKGFも含まれており、角化膜貫通受容体に結合し、活性化時に分化および創傷修復に二重の役割を果たす線維芽細胞によって分泌される成長因子である55,88.RHEに新鮮な栄養素を一定に供給するために、特定の時間間隔でALI培地をリフレッシュすることが重要です。キャリアプレートシステムの使用は、より大きなスケール(すなわち、24のインサート/プレート)でのRhE栽培にとって非常に重要です。これは、時間を節約し、汚染のリスクを減らし、人為的ミスの導入のための余地を少なくする利点を提供します。また、大量のメディア(すなわち、1.5 mL)でRhEを培養する可能性もあり、ALI培地のリフレッシュの必要数を減らすことができます。さらに、挿入物の完全なプレートを新鮮な媒体でプレートに移し、挿入物との接触を個別に避けたり、プレートの蓋を明らかにしたりする可能性があります。
RhE モデルには、いくつかの制限があります。ネイティブのヒト皮膚では、基底層におけるケラチノサイトの増殖とSCにおける角質細胞の剥離(すなわち、脱生物)との間に平衡がある89.しかし、体外では、デスクワモレーションは行われません。したがって、角性細胞はRhEに付着したままで、生理学的に関連性の低い厚いSCを形成する。したがって、レーズの栽培期間は限られています。さらに、このRhEモデルは、表皮の最も豊富な細胞型である単数形細胞型、すなわちケラチノサイトから構成されているため、単純で簡単である。しかし、表皮に存在する他の細胞タイプは、例えばメラノサイト、樹状細胞(すなわち、ランゲルハンス細胞)、T細胞(例えば、CD8)+ セル) およびメルケルセル13.皮膚モデルの生理学的関連性を高めるために、研究者はメラノサイトを加えることによって皮膚モデルをより複雑にした38 、免疫細胞39、または患者由来細胞90.人間の皮膚モデルのバリア特性は、特に異なるSC脂質組成とより高いバリア透過性のために、ネイティブのヒト皮膚と比較して異なることを覚えておいてください 91,92,93,94,95.しかし、いくつかの研究は低酸素下での培養によるヒト皮膚モデルのバリア特性の変化を報告している96 または相対湿度の低下97、真皮マトリックスのキトサンによる変調98、および培地中の遊離脂肪酸の変化99.さらに、単純で複雑なRhEの両方において、培養条件および培地組成を病理学的特徴を模倣するように変調することができる。サイトカインでモデルに挑戦することで、異常な形態100 アトピー性皮膚炎や乾癬などの一般的な皮膚障害で一般的に観察される遺伝子およびタンパク質発現レベルの変化が確立される35,101,102,103,104,105.3Dモデルの再構成プロセスを開始する前にケラチノサイトの特定の遺伝子をサイレンシングすることは、皮膚障害の特徴を模倣し、新しい治療ソリューションを調査するために使用されるもう一つのアプローチです106,107.表皮層のみをモデル化することに加えて、RhE再構成前にコラーゲンマトリックスに線維芽細胞を埋め込むことで、真皮コンパートメント(すなわち、ヒトの皮膚同等物または全厚モデル)をモデルに含めることができ、老化および創傷治癒関連の研究により生理学的に関連し、治癒関連する研究に適している108,109,110.さらに、腫瘍スフェロイドは、黒色腫の進行を研究するためにヒトの皮膚同等物に追加されました111,112.皮膚モデルの分野における最新の進歩は、バイオプリンティングとスキンオンチップです。最近、複数の研究グループが(透過性の)バイオプリントされた皮膚の開発に成功しました45,113,114.提案された議定書は24ウェルフォーマットおよびキャリア版を利用し、個々に取り扱われる挿入を避ける。しかし、研究規模は依然としてかなり限られており、自動化が欠けている。バイオプリンティングまたはスキンオンチップの使用を実装することにより、より小さなスキンモデルは、より自動化されたプロセスとより大きなスケールで使用することができます。
このプロトコルで説明されているRhEは、既に開発され、よく特徴づけられる商業表皮モデルと複数の類似点を有する。形態学的解析は、提案されたRhEモデルにおける生存可能な層の数が、ネイティブのヒト皮膚のそれと比較して低い(すなわち、7-14と比較して6-7)、EpiDerm RhEモデル(すなわち、8-12)70のそれに匹敵することを実証した。エピダーム、エピスキン、およびスキンエチシカルモデルと同様に、上側RhE層は、密に詰まったコロネサイト層28のバスケット織りパターンを示す。さらに、TEM解析は、提案されたRhEモデルにおけるSC層の数(すなわち、15-25)がEpiDerm(すなわち、16-25)70のSC層の数に匹敵することを明らかにした。全体として、提案されたRhEモデルは、他の商業化された表皮モデルと同様の構造を示し、ヒトの表皮を模倣する。TEERによって測定される組織の完全性は、市販のRhEモデル(すなわち、3000-5600 Ω.cm2)71、72、73および他の社内RhEs(すなわち、約5000 Ω.cm2)74、115と範囲内である。提案されたRhEモデルは、分化および組織接着マーカーの存在および正しい局在化によって示されるように、十分に分化されることを示す。さらに、提案されたRhEモデルは、炎症促進刺激(すなわち、LPSおよびTNF-α)に対して応答性を示す。
結論として、現在のプロトコルは、学術機関と民間機関の両方の研究者のニーズを満たすために、RhEを信頼性の高い方法で比較的大規模に生産する方法を示しています。提案されたRhEモデルは、他の既存の商用モデルと同様の形態、表皮分化、および生物学的応答性を有することを示している。関連する皮膚モデルへのアクセスが必要な場合、医薬品および皮膚化粧品分野の両方に代替ツールを提供します。
開示事項
マーク・イーマンとベネデッタ・ペトラッカはダウ・シリコーンズ・ベルギーの従業員です。他のすべての著者は開示するものは何もありません。
謝辞
マリー・スクウォトフスカ・キュリー・グラントの下での欧州連合(EU)のホライゾン2020研究・イノベーションプログラムは、765602がこの仕事に資金を提供しました。すべての著者は、アドルフ・メルクル財団とフェラーラ大学の支援を認め、ダウ・シリコーンズ・ベルギーを感謝しています。ミゲル・スプチ=カルバー博士は、RhE栽培プロセスのグラフィック画像を作成したことで認められています。著者らは、バーバラ・ドラスラー博士、フランコ・セルヴェラティ博士、アニエス・テシエ博士の技術支援と議論に感謝している。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma Aldrich | A6283 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Antibiotic-antimycotic (100x) | Thermo Fisher Scientific (Gibco) | 15240062 | |
| Aqueous Eosin Y solution | Sigma Aldrich | HT110280 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Calcium chloride (CaCl2) | Sigma Aldrich or Merck | C8106 or 1.02378.0500 | Prepare a stock solution of 0.144 M, filter sterilize and store aliquots at -20 °C. It is recommended to prepare new aliquots every 6 months. |
| DAPI | Roche | 10236276001 | Prepare a stock at 100 μg/mL and store aliquots at -20 °C. Working conditon is 1 μg/mL. |
| Entellan mounting medium | Merck | 1.07960.0500 | Mounting medium for H&E staining. |
| EpiLife medium (referred to as keratinocyte growth medium) | Thermo Fisher Scientific (Gibco) | MEPI500CA | Contains 0.06 mM of Ca2+. |
| Ethanol absolute | Any supplier | N/A | |
| Formalin 10% | Leica Biosystems | 3800770 | |
| Human keratinocytes growth supplement (HKGS) (100x) | Thermo Fisher Scientific (Gibco) | S0015 | To reach final concentrations of 0.2% [v/v] BPE, 0.2 ng/mL human recombinant EGF, 0.18 μg/mL hydrocortisone,5 μg/mL bovine transferrin, and 0.01 µg/mL human recombinant insulin-like growth factor-I. |
| Isopropanol | Biosolve B.V. | 0016264102BS | |
| Kaiser's glycerol gelatine, phenol-free | Merck | 1.08635.0100 | Mounting medium for IF staining. |
| Keratinocyte growth factor (KGF) | R&D Systems | 251-KG-050 | Reconstitute KGF protein at 100 μg/mL in sterile 0.1% [w/v] BSA in PBS. Prepare aliquots and store at -20°C. |
| Lactate dehydrogenase (LDH) assay kit | Roche | 4744926001 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | Prepare a stock solution of 25 mg/mL, filter sterilize and store aliquots at -20°C. It is recommended to prepare new aliquots every 6 months. Store in the dark. |
| Lipopolysaccharide (LPS), E.coli strain O55:B5 | Sigma-Aldrich | L4524 | Prepare a stock of 1 mg/mL in sterile PBS and store aliquots at -20 °C. Working concentration is 100 μg/mL. |
| Mayer’s Haematoxylin | Sigma-Aldrich | MHS80 | |
| Normal human epidermal keratinocytes (NHEKs) | Lonza | 00192906 | Human primary keratinocytes isolated from neonatal foreskin, pooled from at least three donors. |
| Phosphate-buffered saline | Thermo Fisher Scientific (Gibco) | 10010056 or 10010-015 | Reference numbers can vary between countries. |
| Recombinant tumor necrosis factor alpha (TNF-α) | ImmunoTools | 11344483 | Prepare a stock of 100 μg/mL in sterile ultrapure water. Working concentration is 40 ng/mL |
| Sterile ultrapure water | Any supplier | N/A | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M5655 | Prepare a stock of 5 mg/mL MTT in sterile PBS. Working concentration is 1 mg/mL. |
| Triton X-100 | Sigma-Aldrich | 93426 | |
| Trypan blue (0.4% [v/v]) | Any supplier | N/A | |
| Trypsin inhibitor | Thermo Fisher Scientific (Gibco) | R007100 | |
| Trypsin/EDTA (0.05% [v/v]) | Thermo Fisher Scientific (Gibco) | 25300054 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | Ab150113 | |
| Tri-sodium citrate dihydrate | Merck | 1.06448.0500 | For antigen retrieval buffer for IF staining. |
| Goat Anti-Rabbit IgG H&L (Dylight 488) | Agrisera | AS09 633 | |
| Filaggrin Mouse antibody | BioTechne (Novus Biologicals) | NBP2-53243 | |
| Involucrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP2-33742 | |
| Keratin 10 Mouse antibody | BioTechne (Novus Biologicals) | NBP2-32962 | |
| Desmoglein-1 Mouse antibody | BioTechne (Novus Biologicals) | MAB944 | |
| Loricrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP1-33610 |
参考文献
- Alberts, B., Johnson, A., Lewis, J. . Molecular Biology of the Cell. 4th edition. Antioxidants & Redox Signaling. , (2002).
- Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., Polla, B. S. The stratum corneum: a double paradox. Journal of Cosmetic Dermatology. 7 (2), 143-148 (2008).
- Moore, K. L., Dalley, A. F. . Clinically Orientated Anatomy. , (2010).
- Barthel, R., Aberdam, D. Epidermal stem cells. Journal of the European Academy of Dermatology and Venereology. 19 (4), 405-413 (2005).
- Green, K. J., Simpson, C. L. Desmosomes: new perspectives on a classic. Journal of Investigative Dermatology. 127 (11), 2499-2515 (2007).
- Feingold, K. R. Lamellar bodies: the key to cutaneous barrier function. Journal of Investigative Dermatology. 132 (8), 1951-1953 (2012).
- Elias, M. P., Feingold, K. R., Fartasch, M. The epidermal lamellar body as a multifunctional secretory organelle. Skin Barrier. , 261-272 (2006).
- Tobin, D. J. Biochemistry of human skin-our brain on the outside. Chemical society reviews. 35 (1), 52-67 (2006).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12), 2080-2095 (2006).
- Weinstein, G. D., McCullough, J. L., Ross, P. Cell proliferation in normal epidermis. Journal of Investigative Dermatology. 82 (6), 623-628 (1984).
- Madison, K. C. Barrier function of the skin: "la raison d'être" of the epidermis. Journal of Investigative Dermatology. 121 (2), 231-241 (2003).
- Suter, M. M., et al. The keratinocyte in epidermal renewal and defence. Veterinary Dermatology. 20 (5-6), 515-532 (2009).
- McLafferty, E., Hendry, C. The integumentary system: anatomy, physiology and function of skin. Nursing Standard. 27 (7), 35-43 (2012).
- Monteiro-Riviere, N. A. . Toxicology of the skin. , (2010).
- Dellambra, E., Odorisio, T., D'Arcangelo, D., Failla, C. M., Facchiano, A. Non-animal models in dermatological research. ALTEX. 36 (2), 177-202 (2019).
- Gordon, S., et al. Non-animal models of epithelial barriers (skin, intestine and lung) in research, industrial applications and regulatory toxicology. Altex. 32 (4), 327-378 (2015).
- Kandárová, H., et al. The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests - An assessment of the performance of the optimised test. Alternatives to laboratory animals : ATLA. 33 (4), 351-367 (2005).
- Kandárová, H., et al. Assessment of the skin irritation potential of chemicals by using the SkinEthic reconstructed human epidermal model and the common skin irritation protocol evaluated in the ECVAM skin irritation validation study. Alternatives to laboratory animals : ATLA. 34 (4), 393-406 (2006).
- OECD. Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. OECD. , (2019).
- Alépée, N., Grandidier, M. H., Cotovio, J. Sub-categorisation of skin corrosive chemicals by the EpiSkinTM reconstructed human epidermis skin corrosion test method according to UN GHS: Revision of OECD Test Guideline 431. Toxicology in Vitro. 28 (2), 131-145 (2014).
- OECD. Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method. OECD. , (2019).
- Mehling, A., et al. In vitro RHE skin sensitisation assays: applicability to challenging substances. Regulatory Toxicology and Pharmacology. 108, 104473 (2019).
- . SENS-IS | EURL ECVAM - TSAR Available from: https://tsar.jrc.ec.europa.eu/test-method/tm2011-11 (2020)
- Lelièvre, D., et al. The episkin phototoxicity assay (EPA): development of an in vitro tiered strategy using 17 reference chemicals to predict phototoxic potency. Toxicology in Vitro. 21 (6), 977-995 (2007).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Pellevoisin, C., Bouez, C., Cotovio, J. Cosmetic industry requirements regarding skin models for cosmetic testing. Skin Tissue Models. , 3-37 (2018).
- Niehues, H., et al. 3D skin models for 3R research: the potential of 3D reconstructed skin models to study skin barrier function. Experimental Dermatology. 27 (5), 501-511 (2018).
- Netzlaff, F., Lehr, C. -. M., Wertz, P. W., Schaefer, U. F. The human epidermis models EpiSkin®, SkinEthic® and EpiDerm®: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport. European Journal of Pharmaceutics and Biopharmaceutics. 60 (2), 167-178 (2005).
- Prieux, R., Eeman, M., Rothen-Rutishauser, B., Valacchi, G. Mimicking cigarette smoke exposure to assess cutaneous toxicity. Toxicology in Vitro. 62, 104664 (2020).
- Petracca, B., Rothen-Rutishauser, B., Valacchi, G., Eeman, M. Bench approaches to study the detrimental cutaneous impact of troposperic ozone. Journal of Exposure Science and Environmental Epidemiology. 31, 137-148 (2021).
- Dijkhoff, I. M., et al. Impact of airborne particulate matter on skin: a systematic review from epidemiology to in vitro studies. Particle and fibre toxicology. 17 (1), 35 (2020).
- El Ghalbzouri, A., Siamari, R., Willemze, R., Ponec, M. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential according to the ECVAM guidelines. Toxicology in Vitro. 22 (5), 1311-1320 (2008).
- Chacón, M., et al. Development of an in-house reconstructed human epidermis model as an alternative method in skin corrosion assessment. Toxicology in Vitro. 65, 104779 (2020).
- Pedrosa, T. d. o. N., et al. A new reconstructed human epidermis for in vitro skin irritation testing. Toxicology in Vitro. 42, 31-37 (2017).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Poumay, Y., Coquette, A. Modelling the human epidermis in vitro: tools for basic and applied research. Archives of dermatological research. 298 (8), 361-369 (2007).
- Rikken, G., Niehues, H., van den Bogaard, E. H. Organotypic 3D skin models: human epidermal equivalent cultures from primary keratinocytes and immortalized keratinocyte cell lines. Methods in Molecular Biology. 2154, 45-61 (2020).
- Duval, C., et al. Human skin model containing melanocytes: essential role of keratinocyte growth factor for constitutive pigmentation-functional response to α-melanocyte stimulating hormone and forskolin. Tissue engineering. Part C, Methods. 18 (12), 947-957 (2012).
- Hutter, V., Kirton, S. B., Chau, D. Y. S. Immunocompetent human in vitro skin models. Skin Tissue Models. , 353-373 (2018).
- Kinsner, A., Lesiak-Cyganowska, E., Śladowski, D. In vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking. 2 (3), 165-171 (2001).
- Black, A. F., Bouez, C., Perrier, E., Schlotmann, K., Chapuis, F., Damour, O. Optimization and characterization of an engineered human skin equivalent. Tissue Engineering. 11 (5-6), 723-733 (2005).
- Reijnders, C. M. A., et al. Development of a full-thickness human skin equivalent in vitro model derived from TERT-immortalized keratinocytes and fibroblasts. Tissue Engineering. Part A. 21 (17-18), 2448-2459 (2015).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering - In vivo and in vitro applications. Advanced Drug Delivery Reviews. 63 (4-5), 352-366 (2011).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Pittelkow, M. R., Scott, R. E. New techniques for the in vitro culture of human skin keratinocytes and perspectives on their use for grafting of patients with extensive burns. Mayo Clinic Proceedings. 61 (10), 771-777 (1986).
- Elias, P. M., Ahn, S. K., Brown, B. E., Crumrine, D., Feingold, K. R. Origin of the epidermal calcium gradient: regulation by barrier status and role of active vs passive mechanisms. Journal of Investigative Dermatology. 119 (6), 1269-1274 (2002).
- Elias, P. M., et al. Modulations in epidermal calcium regulate the expression of differentiation-specific markers. Journal of Investigative Dermatology. 119 (5), 1128-1136 (2002).
- Lee, S. E., Lee, S. H. Skin barrier and calcium. Annals of Dermatology. 30 (3), 265-275 (2018).
- Prunieras, M., Regnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. Journal of Investigative Dermatology. 81, 28-33 (1983).
- Poumay, Y., et al. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Archives of Dermatological Research. 296 (5), 203-211 (2004).
- Ponec, M., et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Savini, I., et al. Characterization of keratinocyte differentiation induced by ascorbic acid: Protein kinase C involvement and vitamin C homeostasis. Journal of Investigative Dermatology. 118 (2), 372-379 (2002).
- Pasonen-Seppänen, S., et al. Vitamin C enhances differentiation of a continuous keratinocyte cell line (REK) into epidermis with normal stratum corneum ultrastructure and functional permeability barrier. Histochemistry and Cell Biology. 116 (4), 287-297 (2001).
- Beer, H. D., et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 34-39 (2000).
- Steven, A. C., Bisher, M. E., Roop, D. R., Steinert, P. M. Biosynthetic pathways of filaggrin and loricrin--two major proteins expressed by terminally differentiated epidermal keratinocytes. Journal of structural biology. 104 (1-3), 150-162 (1990).
- Rice, R. H., Thacher, S. M. Involucrin: a constituent of cross-linked envelopes and marker of squamous maturation. Biology of the Integument. , 752-761 (1986).
- Elias, P. M., Barrier Feingold, K. R. . Skin Barrier. , (2011).
- Marionnet, C., et al. Morphogenesis of dermal-epidermal junction in a model of reconstructed skin: beneficial effects of vitamin C. Experimental Dermatology. 15 (8), 625-633 (2006).
- Frikke-Schmidt, H., Lykkesfeldt, J. Keeping the intracellular vitamin C at a physiologically relevant level in endothelial cell culture. Analytical Biochemistry. 397 (1), 135-137 (2010).
- Castro-Muñozledo, F., Hernández-Quintero, M., Marsch-Moreno, M., Kuri-Harcuch, W. Cultivation, serial transfer, and differentiation of epidermal keratinocytes in serum-free medium. Biochemical and Biophysical Research Communications. 236 (1), 167-172 (1997).
- De Vuyst, E., et al. Reconstruction of normal and pathological human epidermis on polycarbonate filter. Epidermal Cells. Methods in Molecular Biology (Methods and Protocols. , 191-201 (2013).
- Chen, R. H., Zhu, J., Zhang, R. Z., Wang, S. Y., Li, Y. The tolerance of human epidermal cells to trypsinization in vitro. Cell and Tissue Banking. 21 (2), 257-264 (2020).
- Pohanish, R. P. . Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2, (2012).
- Tsaousis, K. T., et al. Time-dependent morphological alterations and viability of cultured human trabecular cells after exposure to Trypan blue. Clinical and Experimental Ophthalmology. 41 (5), 484-490 (2013).
- Kim, S. I., et al. Application of a non-hazardous vital dye for cell counting with automated cell counters. Analytical Biochemistry. 492, 8-12 (2016).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Fartasch, M., Ponec, M. Improved barrier structure formation in air-exposed human keratinocyte culture systems. Journal of Investigative Dermatology. 102 (3), 366-374 (1994).
- Bouwstra, J. A., Honeywell-Nguyen, P. L., Gooris, G. S., Ponec, M. Structure of the skin barrier and its modulation by vesicular formulations. Progress in Lipid Research. 42 (1), 1-36 (2003).
- Ponec, M., Boelsma, E., Gibbs, S., Mommaas, M. Characterization of reconstructed skin models. Skin Pharmacology and Physiology. 15 (1), 4-17 (2002).
- Hubaux, R., Wauters, A., Chrétien, A., Poumay, Y., Salmon, M. Reconstructed human epidermis response to urban particulate matter activates multiple stress-related pathways and impacts the skin barrier function. 23th IFSCC Conference. , 125-134 (2017).
- Lin, Y. -. C., et al. Testing method development and validation for in vitro skin irritation testing (SIT) by using reconstructed human epidermis (RhE) skin equivalent - EPiTRI®. Alternatives to Animal Testing. , 8-19 (2019).
- Alexander, F. A., Eggert, S., Wiest, J. Skin-on-a-chip: Transepithelial electrical resistance and extracellular acidification measurements through an automated air-liquid interface. Genes. 9 (2), 114 (2018).
- van den Bogaard, E., et al. Perspective and consensus opinion: good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Kandárová, H., Hayden, P., Klausner, M., Kubilus, J., Sheasgreen, J. An in vitro skin irritation test (SIT) using the EpiDerm reconstructed human epidermal (RHE) model. Journal of Visualized Experiments. (29), e1366 (2009).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical pharmacology advances and applications. 8, 163-176 (2016).
- De Wever, B., Kurdykowski, S., Descargues, P. Human skin models for research applications in pharmacology and toxicology: introducing nativeSkin, the "missing link" bridging cell culture and/or reconstructed skin models and human clinical testing. Applied In Vitro Toxicology. 1 (1), 26-32 (2015).
- Klicks, J., von Molitor, E., Ertongur-Fauth, T., Rudolf, R., Hafner, M. In vitro skin three-dimensional models and their applications. Journal of Cellular Biotechnology. 3 (1), 21-39 (2017).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cellular and Developmental Biology - Animal. 22 (12), 695-705 (1986).
- Johansen, C. Generation and culturing of primary human keratinocytes from adult skin. Journal of Visualized Experiments. (130), e56863 (2017).
- Boelsma, E., Verhoeven, M. C. H., Ponec, M. Reconstruction of a human skin equivalent using a spontaneously transformed keratinocyte cell line (HaCaT). Journal of Investigative Dermatology. 112 (4), 489-498 (1999).
- Zhao, X., et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering. Advanced Healthcare Materials. 5 (1), 108-118 (2016).
- Peura, M., et al. Paracrine factors from fibroblast aggregates in a fibrin-matrix carrier enhance keratinocyte viability and migration. Journal of Biomedical Materials Research. Part A. 95 (2), 658-664 (2010).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCat keratinocytes in organotypic coculture with human dermal fibroblasts. Journal of Investigative Dermatology. 112 (3), 343-353 (1999).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue engineering. Part C, Methods. 20 (6), 473-484 (2014).
- Alameda, J. P., et al. IKKα regulates the stratification and differentiation of the epidermis: Implications for skin cancer development. Oncotarget. 7 (47), 76779-76792 (2016).
- Bikle, D. D., Xie, Z., Tu, C. L. Calcium regulation of keratinocyte differentiation. Expert Review of Endocrinology and Metabolism. 7 (4), 461-472 (2012).
- Staiano-Coico, L., et al. Human keratinocyte growth factor effects in a porcine model of epidermal wound healing. Journal of Experimental Medicine. 178 (3), 865-878 (1993).
- Egelrud, T. Desquamation in the stratum corneum. Acta Dermato-Venereologica. 80, 44-45 (2000).
- Jean, J., Lapointe, M., Soucy, J., Pouliot, R. Development of an in vitro psoriatic skin model by tissue engineering. Journal of Dermatological Science. 53 (1), 19-25 (2009).
- Lotte, C., Patouillet, C., Zanini, M., Messager, A., Roguet, R. Permeation and skin absorption: reproducibility of various industrial reconstructed human skin models. Skin Pharmacology and Applied Skin Physiology. 15, 18-30 (2002).
- Ponec, M., Weerheim, A., Lankhorst, P., Wertz, P. New acylceramide in native and reconstructed epidermis. Journal of Investigative Dermatology. 120 (4), 581-588 (2003).
- Thakoersing, V. S., et al. Unraveling barrier properties of three different in-house human skin equivalents. Tissue engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Thakoersing, V. S., et al. presence of monounsaturated fatty acids in the stratum corneum of human skin equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Van Smeden, J., et al. Combined LC/MS-platform for analysis of all major stratum corneum lipids, and the profiling of skin substitutes. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1841 (1), 70-79 (2014).
- Mieremet, A., et al. Human skin equivalents cultured under hypoxia display enhanced epidermal morphogenesis and lipid barrier formation. Scientific Reports. 9 (1), 7811 (2019).
- Mieremet, A., et al. Unravelling effects of relative humidity on lipid barrier formation in human skin equivalents. Archives of Dermatological Research. 311 (9), 679-689 (2019).
- Mieremet, A., Rietveld, M., Absalah, S., Van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by Chitosan modulated dermal matrices. PLoS ONE. 12 (3), 0174478 (2017).
- Mieremet, A., et al. Contribution of palmitic acid to epidermal morphogenesis and lipid barrier formation in human skin equivalents. International Journal of Molecular Sciences. 20 (23), 6069 (2019).
- Boniface, K., et al. IL-22 inhibits epidermal fifferentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- De Vuyst, E., Salmon, M., Evrard, C., Lambert de Rouvroit, C., Poumay, Y. Atopic dermatitis studies through in vitro models. Frontiers in Medicine. 4, 119 (2017).
- Danso, M. O., et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents. Journal of Investigative Dermatology. 134 (7), 1941-1950 (2014).
- Soboleva, A. G., Mezentsev, A., Zolotorenko, A., Bruskin, S., Pirusian, E. Three-dimensional skin models of psoriasis. Cells Tissues Organs. 199 (5-6), 301-310 (2014).
- Desmet, E., Ramadhas, A., Lambert, J., Gele, M. Van In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research. Experimental Biology and Medicine. 242 (11), 1158-1169 (2017).
- Niehues, H., van den Bogaard, E. H. Past, present and future of in vitro 3D reconstructed inflammatory skin models to study psoriasis. Experimental Dermatology. 27 (5), 512-519 (2018).
- Pendaries, V., et al. Knockdown of filaggrin in a three-dimensional reconstructed human epidermis impairs keratinocyte differentiation. Journal of Investigative Dermatology. 134 (12), 2938-2946 (2014).
- Niehues, H., et al. Epidermal equivalents of filaggrin null keratinocytes do not show impaired skin barrier function. Journal of Allergy and Clinical Immunology. 139 (6), 1979-1981 (2017).
- Reuter, C., Walles, H., Groeber, F. Preparation of a three-dimensional full thickness skin equivalent. Methods in Molecular Biology. 1612, 191-198 (2017).
- Bataillon, M., et al. Characterization of a new reconstructed full thickness skin model, t-skinTM, and its application for investigations of anti-aging compounds. International Journal of Molecular Sciences. 20 (9), 2240 (2019).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments. (96), e52576 (2015).
- Li, L., Fukunaga-Kalabis, M., Herlyn, M. The three-dimensional human skin reconstruct model: a tool to study normal skin and melanoma progression. Journal of Visualized Experiments. (54), e2937 (2011).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments. (135), e57500 (2018).
- Wei, Z., et al. Two-dimensional cellular and three-dimensional bio-printed skin models to screen topical-use compounds for irritation potential. Frontiers in Bioengineering and Biotechnology. 8, 109 (2020).
- Derr, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated morphology and barrier function. Tissue Engineering - Part C: Methods. 25 (6), 334-343 (2019).
- Frankart, A., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruction at the air-liquid interface. Experimental Dermatology. 21 (11), 871-875 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved