Method Article
Análisis automatizado de gaita para evaluar la recuperación funcional en roedores con daño de contusión de nervio periférico o médula espinal
En este artículo
Resumen
El análisis automatizado de la marcha es una herramienta factible para evaluar la recuperación funcional en modelos de roedores de lesión del nervio periférico y lesión por contusión de la médula espinal. Si bien sólo se requiere una configuración para evaluar la función locomotora en varios modelos experimentales, el ajuste meticuloso de software duro y suave y el entrenamiento de los animales es muy importante.
Resumen
Las lesiones nerviosas periféricas y centrales se estudian principalmente en roedores, especialmente ratas, dado el hecho de que estos modelos animales son rentables y se han publicado muchos datos comparativos en la literatura. Esto incluye una multitud de métodos de evaluación para estudiar la recuperación funcional después de la lesión nerviosa y la reparación. Además de la evaluación de la regeneración nerviosa por medio de histología, electrofisiología y otras técnicas de evaluación in vivo e in vitro, la recuperación funcional es el criterio más importante para determinar el grado de regeneración neuronal. El análisis automatizado de la marcha permite registrar una gran cantidad de parámetros relacionados con la marcha, como el área de impresión de patas y la velocidad de oscilación de la pata, así como medidas de coordinación entre extremidades. Además, el método proporciona datos digitales de las patas de las ratas después del daño neuronal y durante la regeneración nerviosa, lo que aumenta nuestra comprensión de cómo las lesiones nerviosas periféricas y centrales afectan su comportamiento locomotor. Además del modelo de lesión del nervio ciático predominantemente utilizado, otros modelos de lesión del nervio periférico como el nervio femoral se pueden estudiar por medio de este método. Además de las lesiones del sistema nervioso periférico, se pueden evaluar lesiones del sistema nervioso central, por ejemplo, contusión de la médula espinal. La evaluación de datos válida y reproducible depende en gran medida del ajuste meticuloso de la configuración de hardware y software antes de la adquisición de datos. Además, el entrenamiento adecuado de los animales experimentales es de crucial importancia. Este trabajo tiene como objetivo ilustrar el uso de análisis automatizados informatizados de la marcha para evaluar la recuperación funcional en diferentes modelos animales de lesión del nervio periférico, así como la lesión de contusión de la médula espinal. También hace hincapié en las limitaciones del método, por ejemplo, la evaluación de la regeneración nerviosa en ratas con neurotmesis del nervio ciático debido a la recuperación funcional limitada. Por lo tanto, este protocolo se piensa para ayudar a los investigadores interesados en lesiones nerviosas periféricas y centrales para evaluar la recuperación funcional en modelos de roedores.
Introducción
Las lesiones del sistema nervioso periférico y central a menudo se estudian en roedores, lo que resulta en una gran cantidad de datos comparativos sobre el curso de la lesión nerviosa, reparación, o neuroprotección para contrarrestar otras lesiones secundarias y la regeneración1,2,3. El resultado de las estrategias de tratamiento experimental en modelos de roedores se puede evaluar mediante una variedad de técnicas tales como histología, inmunohistoquímica, electrofisiología y técnicas de imagen, como las exploraciones por microtomografía de rayos X (ECC), pero el criterio más importante para determinar el éxito de un tratamiento es, como en los pacientes humanos, el grado de recuperación funcional4,5. Los primeros estudios que investigan el rendimiento locomotor en roedores se remontan a la década de 19406,7,8. Ratas y ratones fueron sometidos a una gran cantidad de estudios que investigaron su comportamiento locomotor en las décadas siguientes9,10,11. Hoy en día, existe una amplia gama de técnicas de evaluación para modelos de roedores de lesiones nerviosas periféricas y centrales, que van desde el análisis de la vía a pie con tinta y papel12,13,14 sobre cinemática de tobillo y marcha15,16,17 hasta métodos mejorados de aprendizaje automático, que permiten la estimación compleja de la marcha, las extremidades y las trayectorias articulares18,19.
El Análisis Automatizado Computarizado de Gait (AGA) se utiliza para evaluar la función locomotora después de lesiones nerviosas periféricas y centrales y el tratamiento experimental potencial de dichas lesiones. El dispositivo consiste principalmente en una pasarela de vidrio y una fuente de luz que ilumina las impresiones de la pata del roedor en correlación con la presión excedida por ellos. A continuación, estos datos se informatizan para calcular una amplia gama de parámetros estáticos y dinámicos. Según Deumens, estos parámetros se pueden subdividir en las categorías de parámetros generales, parámetros relacionados con el dolor, así como parámetros relacionados con la coordinación de la marcha20 (Tabla 1). La viabilidad de AGA para detectar cambios en el comportamiento de la marcha se ha demostrado en varios modelos animales de lesión nerviosa periférica (PNI)21,como el nervio ciático20,el nervio femoral22y el nervio mediano23,24. También se utiliza habitualmente para evaluar la función locomotora en ratas con lesiones nerviosas centrales, por ejemplo, accidente cerebrovascular25 o contusión de la médula espinal26. Los avances del método residen en la gran cantidad de datos comparables y su posibilidad de registrar una gran cantidad de parámetros relacionados con la marcha27. Este artículo tiene como objetivo proporcionar a los investigadores interesados en modelos animales de PNI y lesión de la médula espinal (SCI) una guía detallada y práctica para evaluar la función locomotora en estos modelos.
| Categoría | Parámetro | Descripción | |
| Parámetros generales de la marcha | Zona de impresión (unidad de distancia) | Zona de la huella de la pata | |
| Longitud de impresión (unidad de distancia) | Longitud de la huella de la pata | ||
| Base de soporte (BoS) (unidad de distancia) | Distancia entre las dos patas traseras o delanteras | ||
| Longitud de zancada (unidad de distancia) | Distancia entre dos colocaciones consecutivas de una pata | ||
| Parámetros relacionados con el dolor de la marcha | Tiempo de oscilación (s) | Duración de la fase de oscilación | |
| Tiempo de espera (s) | Duración de la fase de postura | ||
| Intensidad media de impresión de pata (unidad arbitraria) | Media iIntensity de la huella de la pata durante la fase de postura | ||
| Parámetros de marcha relacionados con la coordinación | Patrones de secuencia de pasos normales (NSSP) | Secuencias específicas de colocaciones de patas durante un ciclo de pasos | |
| Dispersiones de fase (%) | Diferencias temporales entre los ciclos de paso de dos patas específicas | ||
| Indice de regularidad (RI) (%) | Cuantificación de la coordinación entre las extremidades dividiendo la cantidad de NSSP impecable por 4 por el número total de colocación de la pata durante un ciclo de paso | ||
Tabla 1: Parámetros de la marcha evaluables con el análisis automatizado de la marcha. Las categorías en las que se clasifican los parámetros se eligen según Deumens et al.20.
Protocolo
El protocolo experimental para todos los experimentos fue aprobado previamente por la Junta de Revisión del Protocolo Animal del Gobierno de la Ciudad de Viena. Todos los procedimientos se llevaron a cabo de conformidad con la Declaración de Helsinki sobre los derechos de los animales y la Guía para el cuidado y el uso de animales de laboratorio de los Institutos Nacionales de Salud.
1. Viviendas para animales
- Ratas macho de la casa (Lewis o Sprague Dawley) que pesan 250-300 g bajo un ciclo de luz/oscuridad de 12 h con acceso ad libitum a alimentos y agua.
- Controlar tanto la temperatura ambiente (mantenida a 20–22 oC) como la humedad (45%–65 %) para una vivienda animal adecuada. Para este trabajo, se utilizaron ratas macho Lewis (PNIs) y Sprague Dawley (SCI).
- Proporcione una jaula nueva y limpia dos veces por semana. Ratas de la casa en grupos de dos o tres y monitorean de cerca su comportamiento social y la interacción. Permita a las ratas un período de aclimatación de al menos 1 semana antes de cualquier procedimiento quirúrgico o prueba funcional.
NOTA: Las ratas requieren al menos 5 días de entrenamiento diario en el aparato de análisis de la marcha antes de la cirugía, así que calcule al menos 2 semanas entre la llegada de las ratas a la instalación y los datos programados para la cirugía experimental28.
2. Inducción de la lesión nerviosa
NOTA: Use equipo de protección personal, como una bata quirúrgica, guantes y una máscara. En caso de que una bata quirúrgica estéril no esté disponible, también es suficiente una capa de laboratorio limpia y lavada. A menos que se contabise, la bata o el pelaje no necesita ser cambiado entre animales, sino entre sesiones de cirugía. Se recomienda el uso de guantes quirúrgicos estériles. En caso de que estos guantes no estén disponibles, los guantes de examen también se pueden utilizar, pero deben lavarse antes de la cirugía utilizando un desinfectante quirúrgico. Los guantes deben cambiarse entre animales.
- El día de la cirugía, trate de minimizar cualquier cantidad de estrés a los animales, ya que esto podría interferir con la anestesia, por ejemplo, los animales requerirán dosis más altas de anestésicos.
- El día de la cirugía, inyectar 0,05 mg de buprenorfina/kg de peso en suspensión con 100-200 l 0,9% de NaCl por vía subcutánea utilizando una cánula de 25 G 1 h antes de la cirugía para proporcionar analgesia pre e interoperativa. Si no se indica lo contrario, el flanco de la rata es el lugar preferido para la inyección.
- Anestfetizar las ratas colocándolas en una cámara de inducción de anestesia conectada a un vaporizador de sevoflurano y un recipiente de tiza activo para absorber el CO2. Anestesiar a la rata inundando la caja de anestesia con 4%-5% mezcla de sevoflurano-oxígeno durante aproximadamente 5 min utilizando un flujo de oxígeno de 1.5 L/min (fase de iniciación). Conecte un clip de oximetría de pulso a una de las patas para controlar la saturación de oxígeno en sangre del roedor. Mantener el estado de anestesia general con 2.5%–4.5% mezcla de sevoflurano-oxígeno.
NOTA: Para la cirugía experimental, la anestesia general es obligatoria. Confirme la anestesia general comprobando la falta de respuesta para pellizcar el estímulo de la cola o las patas. - Cuando la rata haya entrado en anestesia general, afeite el areal respectivo que se va a operar y desinfecte la zona deslizándola alternamente con alcohol y desinfectante de la piel. El dedo final debe realizarse con desinfectante de la piel.
- Colóquelo en una almohadilla de calentamiento ajustable en la posición requerida (supino para el modelo de nervio femoral, propenso al modelo ciático y SCI). Inserte una sonda termómetro flexible en el recto de la rata para controlar la temperatura del animal y mantenerla a unos 37 oC durante la cirugía. Durante la anestesia, proteja los ojos de la rata de la desceración usando ung ón para los ojos
3. Inducción quirúrgica de lesión nerviosa
- Al realizar procedimientos quirúrgicos, adhiérase estrictamente a los siete principios de Halsted29 de la siguiente manera:
- Siempre manipule los tejidos suavemente cuando trabaje con ellos. Evite rasgar o aplastar los tejidos.
NOTA: Los sistemas retractoresauto-hechos 30 o disponibles comercialmente son útiles para mantener los músculos y los vasos fuera del campo de operación. - Mantener cuidadosamente la hemostasia utilizando un hemostat eléctrico para cauterizar vasos o ligaduras para garantizar una hemostasia cuidadosa.
- Mantenga siempre el suministro de sangre a los tejidos diseccionándolos cuidadosamente y manezándolos delicadamente.
- Mantenga una asepsia estricta usando una máscara, una bata y guantes estériles.
- Evite la tensión en los tejidos aplicando suturas que no son ni demasiado apretadas ni demasiado sueltas.
- Meticulosamente aprecis los tejidos reuniendo sus respectivos bordes sin ningún solapamiento.
NOTA: Esto es particularmente importante en el caso de la neurorrhiafia epineurial o perineurial. Realice todos los procedimientos microquirúrgicos con un aumento de 6x-16x utilizando un microscopio operativo. Idealmente, el microscopio proporciona dos pares de oculares para permitir la observación de la operación por un asistente. - Evite la creación de espacios muertos suturando cuidadosamente las diferentes capas de tejido.
- Siempre manipule los tejidos suavemente cuando trabaje con ellos. Evite rasgar o aplastar los tejidos.
- Inducción de la neurotmesis del nervio ciático de la extremidad posterior derecha
- Exponga el nervio ciático derecho en el nivel medio alto realizando una incisión de 5 cm de largo en el lado dorsal de la extremidad posterior con una hoja de bisturí #10 conectada a un mango de bisturí #3 y diseccionando la musculatura superable y el tejido blando. Coloque un retractor dentro de la herida para mantener la musculatura diseccionada y la piel fuera de las instalaciones. Exponga suavemente el nervio retirando el tejido circundante utilizando tijeras microquirúrgicas curvas.
- Retire un segmento nervioso de 8 mm de largo del nervio ciático de 1-2 mm proximal a su trifurcación con tijeras microquirúrgicas rectas.
- Gire el segmento nervioso 180o, colóquelo entre el muñón proximal y distal del nervio ciático transectado y realice neurorafia epineurial en cada sitio con dos suturas interrumpidas de 10-0 y un soporte de aguja microquirúrgico.
- Inducción de la neurotmesis del nervio femoral en la extremidad posterior derecha
- Realizar una incisión longitudinal de la ingle de 3-4 cm con una hoja de bisturí #10 conectada a un mango de bisturí #3 con el fin de exponer el haz neurovascular femoral derecho. Utilice tijeras quirúrgicas para la disección contundente hasta que la bifurcación del nervio femoral quede expuesta. Coloque un retractor dentro de la herida para mantener la musculatura diseccionada y la piel fuera de las instalaciones.
- Transecte las ramas motoras y sensoriales expuestas distale a la bifurcación e implica un segmento nervioso de 6 mm de largo de cada rama, respectivamente, utilizando tijeras microquirúrgicas rectas.
- Gire ambos segmentos nerviosos 180o, colóquelos entre el muñón proximal y distal de las ramas nerviosas femorales transectadas y realice neurorafia epineurial en cada sitio con dos suturas interrumpidas de 11-0 y un soporte de aguja microquirúrgico.
NOTA: Realice un injerto nervioso autólogo homólogo injertando el injerto del motor a la rama del motor original y el injerto sensorial a la rama sensorial original. Alternativamente, realice un injerto de nervio autólogo heterotópico injertando el injerto motor a la rama sensorial original y viceversa.
- Inducción de la lesión por contusión de la médula espinal torácica
- Realizar una incisión cutánea a través de la columna vertebral torácica con una hoja de bisturí #10 conectada a un mango de bisturí #3 seguido de dos incisiones musculares paralelas a los procesos espinosos para facilitar la retracción muscular. Coloque un retractor dentro de la herida para mantener la musculatura diseccionada y la piel fuera de las instalaciones.
- Identificar la 11a vértebra torácica (Th) y exponer la lámina del arco vertebral mediante la eliminación de tejido excesivo, así como el proceso espinoso utilizando un rongeur.
- Realizar una laminectomía usando un micro taladro y una rebaba apropiada para perforar un pequeño agujero en la lámina, ligeramente más grande que la punta del impactador. Para evitar daños en la médula espinal, sólo adelgazar la lámina al abrir y ampliar el agujero usando un rongeur. Si el periosteo sigue intacto, retírelo cuidadosamente con una sonda puntiaguda sin dañar la duramadre.
- Después de asegurar que se hace un agujero lo suficientemente grande sin desestabilizar la lámina, sostenga la columna vertebral del animal en su lugar sujetando rostralmente e caudalmente a Th11 con los fórceps estabilizadores del impactador. Usando las ruedas de mano en la parte delantera y lateral, coloque la varilla de acero 3-5 mm por encima del orificio de laminectomía. Por último, someta a todos los animales a un impacto con una fuerza definida de 150 kilodinas para inducir un grado leve a moderado de lesión de contusión de la médula espinal4.
- Realice el cierre de la herida en capas anatómicas utilizando suturas interrumpidas de poliglactina 4-0 o 5-0 y un soporte quirúrgico para agujas. Limpie bien la herida limpiándola suavemente con una gasa empapada en naCl estéril al 0,9%.
- Después de la cirugía, regrese a los animales a su jaula de origen y cuéltelos de la exposición a la luz y el sonido. Supervise el comportamiento de los animales de cerca hasta el día postoperatorio (DPO) 7 y asegure la ingesta suficiente de alimentos y agua. Si es necesario, proporcione líquido adicional mediante inyecciones subcutáneas (p. ej., 10 ml de NaCl 0,9%).
- Proporcionar analgesia postoperatoria durante un mínimo de 2 días por medio de, por ejemplo, opioides (0,05 mg/kg de buprenorfina por vía subcutánea (s.c.)) y/o antipiréticos (4 mg/kg de peso corporal, .c.). Si es necesario, y en el caso del modelo SCI, también proporcionar terapia antibiótica postoperatoria (7,5 mg/kg de peso corporal Enrofloxacino por os (p.o.)).
- En caso de lesión de la médula espinal, vacíe manualmente la vejiga de la rata hasta que vuelva la micción espontánea.
4. Recuperación de las intervenciones quirúrgicas antes del análisis de la marcha
NOTA: Las ratas con lesión del nervio ciático muestran la tendencia a roer en sus patas traseras debido a la aparición de neuropatía dolorosa después de una lesión nerviosa. Esta forma de automoción puede resultar en autoamplión de los dedos de los pies o partes de la pata trasera respectiva. Prefiere ratas Lewis sobre otras cepas de rata en caso de que se utilice el modelo de lesión del nervio ciático, ya que esta cepa de rata muestra una tendencia menor a la automutilación31. Las ratas con lesión del nervio ciático también muestran la tendencia a desarrollar contracturas de la extremidad operada, lo que podría resultar en su exclusión del estudio debido a la interferencia con la adquisición de datos. Tales eventos adversos ocurren mucho menos comunes en ratas con lesiones femorales.
- Inspeccione los animales operados diariamente después de la cirugía con especial atención sobre el estado de sus extremidades y patas, respectivamente.
NOTA: En ratas con SCI, a la altura de Th11, el prolapso del pene o del recto puede ocurrir debido al deterioro de la capacidad natural de los animales para orinar y defecar. Estos eventos se definen comúnmente como puntos finales humanos del estudio e implican la exclusión inmediata del animal afectado del estudio. - Continúe con la analgesia postoperatoria hasta que las ratas dejen de mostrar cualquier síntoma relacionado con el dolor.
- En caso de dolor persistente, administrar gabapentina (30–120 mg/kg de peso corporal) p.o. para tratar el dolor neuropático.
5. Preparación antes de realizar análisis automatizados de la marcha
NOTA: La metodología del sistema de análisis de marcha se basa en registrar a los animales desde abajo mientras cruzan una placa de vidrio, que está iluminada por una luz LED verde. Cuando las patas de los animales se en contacto con el suelo, el área de la huella de la pata es iluminada y grabada por una cámara de video de alta velocidad. Estos datos se envían a través de un cable Ethernet a un ordenador que ejecuta el software de análisis de marcha. Mientras que las huellas individuales pueden ser clasificadas manualmente por el experimentador, la última versión de software también cuenta con clasificación automática de huellas.
- Realice todos los procedimientos de prueba en la oscuridad y en ausencia de ruidos perturbadores. Puesto que las ratas son capaces de percibir frecuencias supersónicas, también verifique que ninguna fuente está emitiendo tales sonidos.
NOTA: Realizar análisis de marcha semanal o cada dos semanas, pero no probar ratas con demasiada frecuencia, ya que especialmente las ratas Lewis tienden a perder interés en participar en el procedimiento con el tiempo cuando están expuestas a un determinado ejercicio con demasiada frecuencia. Sin embargo, se requiere entrenar ratas diariamente durante 5 días antes de la cirugía para aclimatarlas al entorno y procedimiento de prueba. - Durante las sesiones de entrenamiento y el día de la prueba, prepare la sala de pruebas conductuales apagando todas las fuentes de luz, lo que de otro modo podría interferir con la cámara del dispositivo de análisis de marcha automatizado. Coloque la pantalla del ordenador necesaria para la adquisición de datos lejos de la cámara para evitar que su luz interfiera con la cámara.
- Asegúrese de que el dispositivo está instalado en una posición estable y de una manera que evite cualquier forma de vibración, ya que esto interferirá seriamente con el procedimiento de adquisición de datos.
- Lleve a las ratas a la sala de pruebas conductuales y aclimatelas en su propia jaula de casa durante al menos 30 minutos antes de la prueba.
NOTA: Siempre que manipule a los animales, use equipo de protección personal, como una bata quirúrgica o una bata de laboratorio, guantes y una máscara.
6. Realizar análisis automatizados de la marcha
- Sesiones de formación
NOTA: Durante el entrenamiento, los animales se someterán a una curva de aprendizaje, por lo que se recomienda ajustar el horario de entrenamiento gradualmente. Utilice recompensas alimentarias (por ejemplo, 1-2 piezas de cereales para el desayuno) para recompensar a los animales después de completar con éxito cada sesión de entrenamiento.- El primer día de entrenamiento, levante suavemente al animal sosteniéndolo debajo de su tronco y llévelo suavemente a la entrada de la pasarela.
- Coloque al animal en la zona de entrada y déjelo explorar la apertura del pasillo sin interferencias de la persona que lleva a cabo el procedimiento de prueba.
NOTA: No grite, silbe, golpee o golpee al animal en un intento de motivarlo a cruzar la pasarela. Todo este comportamiento hará hincapié gravemente en el animal y complicará aún más el procedimiento de adquisición de datos. - Espere hasta que el animal cruce voluntariamente la pasarela para llegar a su jaula de origen. A veces, especialmente en animales no entrenados, esto puede tomar hasta varios minutos. En el primer día de entrenamiento, el animal no se espera ni se requiere para hacer carreras ininterrumpidas con una velocidad de marcha uniforme. En su lugar, debe aclimatarse con el aparato de prueba y el procedimiento.
- En el segundo día de entrenamiento, los animales acostumbrados a entrar en la pasarela sin dudarlo y, también para volver a su jaula de origen sin dudarlo. Algunos animales probablemente ya habrán aprendido a cruzar la pasarela sin interrupciones, pero esto todavía no es necesario al final del segundo día.
- En el tercer día de entrenamiento, asegúrese de que los animales aprendan a cruzar la pasarela sin dudarlo, oler o explorar movimientos de otro modo. Asegúrese de que caminan con una velocidad uniforme.
- En el cuarto y quinto día de entrenamiento, repita el ejercicio anterior para consolidar el procedimiento de prueba.
NOTA: En caso de que un animal no adquiera la habilidad necesaria para cruzar la pasarela correctamente al final del período de entrenamiento de 5 días, agregue 2 días adicionales de entrenamiento (por ejemplo, el fin de semana). Además, considere realizar hasta 3 sesiones de entrenamiento al día, separadas por al menos 2 horas de descanso entre sesiones individuales. En el 95% de los casos, el animal habrá adquirido la experiencia de entrenamiento requerida al final de este período de entrenamiento prolongado. En el raro caso de que un animal aún no haya adquirido esta habilidad después de 7 días de entrenamiento, se recomienda posponer la sesión de cirugía experimental prevista durante al menos 1 semana y repetir el régimen de entrenamiento antes mencionado.
7. Adquisición de datos
NOTA: El sistema de análisis de marcha visualiza cada huella de pata mientras el animal camina y analiza automáticamente varios parámetros de marcha, como el área de impresión de la pata, la intensidad de impresión de la pata, el tiempo de oscilación de la pata y la velocidad de oscilación de la pata (Tabla 1). A medida que el sistema de análisis de la marcha registra todos los datos en función de la intensidad generada por las impresiones de la pata de los animales, asegúrese de que la configuración de la cámara se ajusta de acuerdo con el peso y el tamaño de las ratas. Además, asegúrese de que la pasarela esté seca y limpia antes de la grabación de datos para evitar cualquier influencia en la adquisición de datos.
- Antes de la adquisición de cualquier dato, limpie la pasarela con un limpiador de vidrio comercial y una escobilla. Rocíe la placa de vidrio varias veces y luego límpiela con la escobilla para eliminar cualquier partícula de su superficie. Además, limpie la parte inferior. Asegúrese de eliminar cualquier líquido de los extremos de la pasarela, ya que los animales podrían pisarlo, lo que afectaría a los datos registrados.
- Repita el procedimiento de limpieza siempre que sea necesario, por ejemplo, la contaminación de la pasarela y antes de registrar los datos de una rata de una jaula diferente. Esto se piensa para evitar que el animal se distraiga por el aroma de sus conespecíficos.
- Antes de la primera adquisición de datos, ajuste la configuración de la cámara que se ajuste al peso de los animales. Confirme esto poniendo al animal más ligero y pesado en la pasarela y elija un ajuste de cámara que permita una buena calidad de datos en ambos casos. Ajuste la ganancia de la cámara, la luz roja del techo, la luz verde de la pasarela y el umbral de intensidad verde (GIT) para garantizar una detección óptima de la impresión de la pata.
NOTA: No cambie la configuración elegida después de que la adquisición de datos haya comenzado, ya que esto dificultará la comparabilidad de los datos adquiridos. Como excepción, el GIT se puede cambiar durante la clasificación de datos, pero esto debe hacerse para todas las pruebas de forma uniforme. - Defina y calibre la pasarela utilizando la hoja de calibración proporcionada.
- Elija una cámara registrada en la pestaña Configuración.
- Haga clic en el botón Abrir adquisición que se encuentra en la pestaña Adquirir.
- Tome una instantánea de la pasarela vacía y limpia, que se utilizará como referencia durante el siguiente procedimiento de adquisición de datos.
- Observe el cambio de estado de Espera de instantánea a Listo para adquisición.
- Haga clic en el botón Iniciar adquisición y observe el cambio de estado de Listo para adquisición a Esperando a que se inicie ejecutar.
- Coloque una rata en la pasarela y siga el movimiento del animal en la pantalla del ordenador. Observe el cambio de estado de Espera para ejecutar a Inicio a Ejecución de grabación.
NOTA: El software clasificará automáticamente las ejecuciones que considere compatibles de acuerdo con las características de ejecución preestablecidas con un símbolo verde, mientras que las ejecuciones no conformes se marcarán con un símbolo rojo. El software detiene automáticamente la adquisición de datos cuando se registraron tres ejecuciones compatibles, pero la adquisición de datos se puede continuar haciendo clic de nuevo en el botón Iniciar adquisición.
8. Clasificación de datos
NOTA: Consulte la Tabla 1 para obtener una lista de los parámetros de resultado de AGA. Se necesitan al menos tres carreras conformes en las que el animal debe cruzar la pasarela de forma constante sin dudar27. Además, las velocidades de funcionamiento deben coincidir dentro de las mismas categorías que se definen en la literatura30.
- Haga clic en el botón Clasificar en la pestaña Explorador experimental de las pruebas respectivas que se van a clasificar.
- Reproduzca la ejecución adquirida con velocidad normal para obtener una impresión de si los datos se ajustan a los requisitos enumerados anteriormente.
- En la esquina superior izquierda, haga clic en el botón Clasificación automática para la clasificación automática de las impresiones de pata por el software.
NOTA: Aunque el software tiene una alta tasa de clasificación correcta de la pata, a veces no puede asignar una pata a las impresiones o asigna la pata incorrecta. Por lo tanto, siempre compruebe dos veces las impresiones de la pata autofinesificar después. - Para el cálculo correcto de los patrones de secuencia de pasos normales (NSSP), asegúrese de que el algoritmo de clasificación no se confunda mediante impresiones de patas no visibles, lo que da lugar a NSSP defectuoso (Figura 1A). Por lo tanto, sólo incluya las impresiones de la pata que son detectables mientras que la pata contralateral también es visible para los cálculos NSSP, por ejemplo, la pata delantera izquierda (LF) y la pata trasera derecha (RH) (Figura 1B).

Figura 1: Datos ejemplares de AGA, lo que demuestra la necesidad de la doble comprobación manual de la clasificación correcta de los datos. En caso de que la colocación detectada de una pata delantera sea sucedida por la colocación detectada de otra pata delantera (A) el software AGA podría confundir esto con un patrón de caminar descoordinado ya que no se han detectado patas traseras. Por lo tanto, se recomienda comprobar siempre dos veces y seleccionar una impresión de pata inicial, que se detecta cuando la pata contralateral también es visible (B). Haga clic aquí para ver una versión más grande de esta figura.
9. Cálculo de estadísticas
NOTA: Para ajustar los datos de ejecución para cambios relacionados con el aumento de peso a lo largo del tiempo, se recomienda encarecidamente calcular una relación de la pata experimental con una pata no experimental (por ejemplo, control). Además, calcule la relación con los valores preoperatorios de esta comparación de pata a pata para tener en cuenta las diferencias individuales en el uso de la pata.
- Haga clic en el botón Ver estadísticas de ejecución para obtener una visión general completa de las estadísticas de ejecución.
- Seleccione Archivo y exportación para exportar estadísticas de ejecución o estadísticas de prueba a un software de hoja de cálculo.
Resultados
12 ratas se sometieron a una cirugía experimental de nervio periférico. La resección del nervio ciático (Figura 2A) se realizó en 7 ratas, mientras que la neurotmesis del nervio femoral (Figura 2B) se indujo en 5 ratas. En todos los animales, el defecto nervioso fue reconstruido por medio de un injerto nervioso autólogo. Lesión por contusión de la médula espinal (Figura 2C) en el nivel Th11 se indujo en 6 ratas, resultando en un total de 18 ratas.
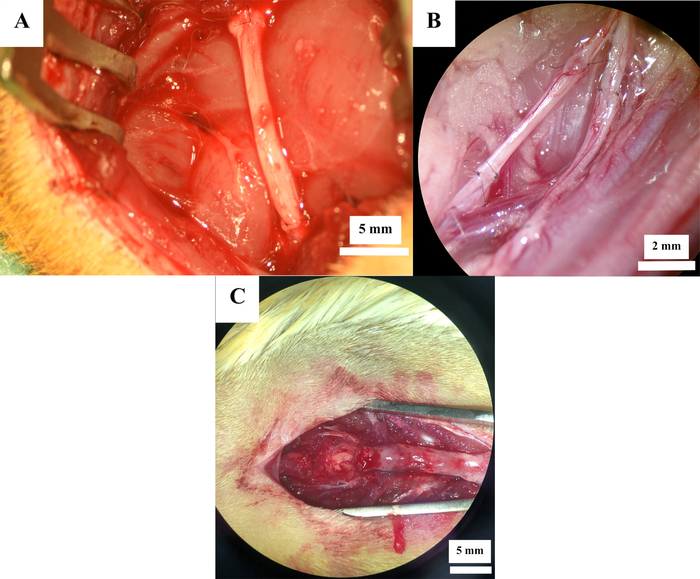
Figura 2: Sitios operativos después de la reconstrucción nerviosa. Reconstrucción nerviosa con autoinjertos en el nervio ciático (A) y nervio femoral (B), así como después de la lesión por contusión de la médula espinal (C). Haga clic aquí para ver una versión más grande de esta figura.
Todos los animales se recuperaron bien de la cirugía y no se produjeron casos de automutilación. Un animal del grupo de lesiones nerviosas ciáticas desarrolló fuertes contracturas de la pata trasera derecha durante el período de observación postoperatoria y tuvo que ser excluido de un análisis de datos posterior.
Neurotmesis del nervio ciático
Dado que el nervio ciático proporciona inervación muscular y sensorial a la mayoría de la extremidad posterior, su resección resulta en un deterioro grave de la función locomotora. Después de la lesión, las ratas utilizan el talón de la pata para el soporte de peso solamente (Figura 3B–E) y la extremidad se mueve en un movimiento circunductorio de barrido. Por lo tanto, los cambios en la locomotora evaluados a través de AGA se hacen evidentes mediante una zona de impresión significativamente reducida (Figura 4A) y un aumento significativo del tiempo de oscilación (Figura 4B). Ambos parámetros todavía se modificaron significativamente en comparación con las mediciones pre-OP al final del período de observación. Cabe destacar que un animal desarrolló fuertes contracturas de la pata trasera derecha a partir de la semana postoperatoria (WPO) 10. Esto dio lugar a un aumento del área de impresión de la pata trasera derecha a más del 150% en comparación con la pata izquierda en WPO12 (Figura 5). Como se trataba de un extremo en comparación con todos los demás animales evaluados en este estudio, excluimos a este animal del análisis de datos con respecto a la zona de impresión.

Figura 3: Impresiones de patas representativas antes y después de la resección de tamaño crítico del nervio ciático derecho y reparación de autoinjertos. Tenga en cuenta la fuerte disminución en el área de impresión después de una lesión nerviosa (B) en comparación con preoperatoriamente (A). A pesar de un ligero incremento en el área de impresión durante el período de observación (C–E) las huellas de la pata de la extremidad posterior derecha permanecieron notablemente cambiadas de las grabaciones basales. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: El curso de la recuperación funcional después de la resección de tamaño crítico y la reparación del autoinjerto del nervio ciático. La relación de área de impresión (A) y la relación de tiempo de oscilación (B) se cambiaron estadísticamente significativamente a partir de los valores preoperatorios inmediatamente después de la resección del nervio ciático. Mientras que el área de impresión se mantuvo significativamente disminuida en comparación con la línea de base hasta WPO10, el tiempo de oscilación todavía se incrementó significativamente a los valores preoperatorios en WPO12. *: p < 0.05 en comparación con Pre-OP, **: p < 0.01 en comparación con Pre-OP. Las barras de error indican la media ± error estándar de la media (SEM). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Gráfica de caja del área de impresión después de una lesión del nervio ciático. Observe el extremo (elipse roja) en WPO12, lo que se explica por el hecho de que un animal desarrolló fuertes contracturas de la pata trasera derecha a partir de WPO10. Por lo tanto, el animal fue excluido del análisis estadístico que figura en la Figura 4. Haga clic aquí para ver una versión más grande de esta figura.
Neurotmesis del nervio femoral
La resección del nervio femoral da lugar a la denervación del músculo del cuádriceps del muslo33,34. En consecuencia, la extensión de la rodilla se ve afectada, lo que resulta en hiperflexión de la articulación del tobillo con elevación consecutiva del talón de la pata. Por lo tanto, el área de impresión de la pata respectiva(Figura 6B), se reduce fuertemente después de la cirugía. El área de impresión de la pata trasera izquierda aumenta debido a un desplazamiento compensatorio del peso hacia la izquierda. Esto debe tenerse en cuenta, ya que este fenómeno influye directamente en la relación calculada entre la pata "experimental" y la pata de "control". A partir de la reinnervación WPO4 del cuádriceps por el nervio femoral regenerador conduce a la reversión de estos cambios, lo que resulta en un aumento del área de impresión de la pata trasera derecha (Figura 7A). Como el músculo del cuádriceps del muslo también juega un papel en la fase de oscilación de la pata respectiva, Swing Time (Figura 7B) se prolonga en gran medida en ratas con lesión del nervio femoral. Reflejando el retorno del área de impresión, el tiempo de oscilación disminuye a medida que el nervio femoral regenerador alcanza el músculo del cuádriceps del muslo. En WPO10, ambos parámetros de la marcha regresaron a la línea de base, lo que indica una recuperación funcional completa.

Figura 6: Impresiones de patas representativas. Impresiones representativas de la pata antes de (A) y siguientes (B–E) resección del nervio femoral derecho y reparación de autoinjertos. El área de impresión de RH disminuyó fuertemente en WPO2 (B), mientras que un aumento en el área de impresión de la pata trasera izquierda (LH) debido al aumento de la carga de peso se hizo visible. El área de impresión RH comenzó a aumentar a partir de WPO6 (C) acompañada de una disminución en el área de impresión de LH. En el área de impresión WPO8 (D) y WPO10 (E) de RH se recuperó cerca de los niveles preoperatorios. (Adaptado con permiso de Heinzel et al.22, licenciado bajo CC BY 4.0.) Haga clic aquí para ver una versión más grande de esta figura.
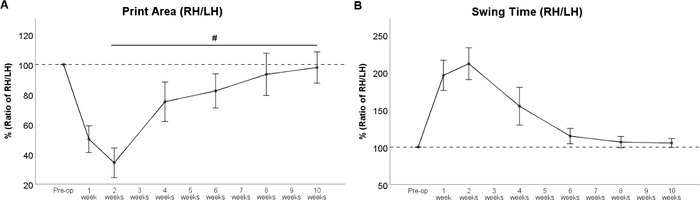
Figura 7: El curso de la recuperación funcional después de la resección de 7 mm y la reparación del autoinjerto del nervio femoral. El curso de la relación de área de impresión (A) y la relación de tiempo de oscilación (B) revelaron un fuerte cambio inmediatamente después de la resección del nervio femoral, pero los valores se recuperaron de nuevo a los valores preoperatorios en WPO8. •: p < 0.05. Las barras de error indican la media ± SEM. (Adaptado con permiso de Heinzel et al.22, licenciado bajo CC BY 4.0.) Haga clic aquí para ver una versión más grande de esta figura.
Contusión de la médula espinal
El análisis de gait reveló impresiones de patas marcadamente alteradas después de una lesión de contusión de la médula espinal torácica (Figura 8), un decremento más notable en el área de impresión y una marcada rotación interna de las patas traseras en WPO2 (Figura 8B). Cabe destacar que la rotación de la pata también se implementa como una característica evaluable en el BBB, subrayando la aplicabilidad del análisis computarizado de la marcha para evaluar los cambios de marcha que fueron evaluados originalmente con pruebas de campo abierto. En cuanto al curso de los parámetros individuales de la marcha, la contusión de la médula espinal en el nivel Th11 dio lugar a una disminución de la relación de área de impresión (Figura 9A) y el incremento de la relación de tiempo de oscilación (Figura 9B). Ambos parámetros llegaron a los niveles de referencia durante el curso posterior del período de observación, pero no hubo cambios estadísticamente significativos observables. El índice de regularidad de los parámetros relacionados con la coordinación(Figura 9C)también disminuyó en WPO2, pero el grado varió mucho entre los animales. También se dirigió hacia los valores preoperatorios hasta WPO16. Base de apoyo de las patas traseras (Figura 9D), un parámetro general de marcha según Deumens, mostró un aumento marcado, que fue estadísticamente significativo desde WPO10 hasta WPO14. Se destinaba a los niveles de referencia en WPO16 y ya no se modificaba significativamente del valor preoperatorio en este momento.

Figura 8: Impresiones de pata representativas de las dos patas traseras. Las impresiones de la pata preoperatoriamente (A) y después de la lesión de contusión de la médula espinal torácica (B–F). Tenga en cuenta la reducción del área de impresión a partir de WPO2 (B) acompañada de una notable rotación interna de las patas. Durante el transcurso del período de observación (C–F) se observa un incremento del área de impresión, así como el aclaramiento de la rotación interna. Haga clic aquí para ver una versión más grande de esta figura.
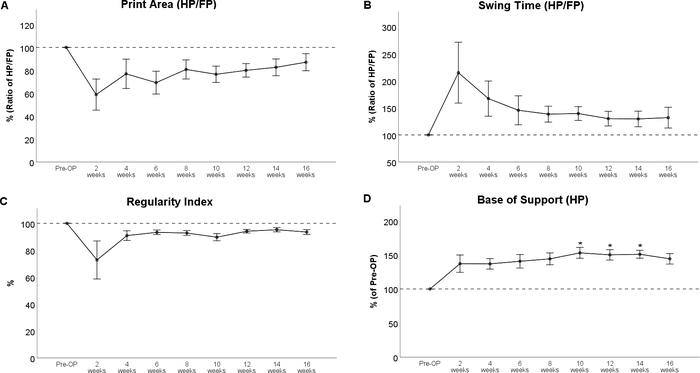
Figura 9: Contusión de la médula espinal en el nivel Th 11. La contusión de la médula espinal en la th 11 dio lugar a alteraciones observables de la relación de área de impresión (A) y el tiempo de oscilación (B) y el índice de regularidad (C), pero estos cambios no fueron estadísticamente significativos. Después de la lesión, Base de apoyo de las patas traseras mostró un marcado aumento en comparación con la línea de base, lo que fue estadísticamente significativo en WPO10 hasta WPO14. *: p < 0.05 en comparación con Pre-OP. Las barras de error indican la media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
Archivo suplementario 1: Detalles de solución de problemas. Haga clic aquí para descargar este archivo.
Discusión
La evaluación de la recuperación funcional en modelos animales de PNI y SCI sigue siendo difícil debido a la gran variedad de métodos de evaluación, cada uno con ventajas y desventajas individuales. Sólo unos pocos enfoques han sido probados y validados en múltiples modelos de lesiones nerviosas periféricas y centrales, aunque nuevas técnicas prometedoras que combinan el seguimiento del movimiento y el aprendizaje automático podrían potencialmente impulsar la investigación neuroconductual al siguiente nivel de pruebas funcionales. Estamos convencidos de que pronto surgirán métodos de vanguardia ampliamente aplicables a una amplia variedad de modelos de animales y lesiones. A la luz de estas consideraciones, una de las ventajas de AGA es la posibilidad de evaluar la recuperación funcional en múltiples modelos de lesión nerviosa utilizando un solo dispositivo. Desde principios de la década de 2000 este enfoque se ha utilizado en modelos experimentales de PNI como elciático 37,peroneal38,y lesión del nervio femoral modelo22, así como después de la avulsión de raíz tanto dellumbar 39 como del plexo braquial40. Varias lesiones nerviosas centrales, incluyendo la lesión por contusión de la médula espinal, también se han estudiado con el método41,42. Con este artículo, presentamos un protocolo detallado sobre cómo inducir tres lesiones nerviosas comúnmente estudiadas, así como cómo evaluar la recuperación funcional después. En nuestra opinión, una guía práctica para los investigadores interesados en el área de la lesión, reparación y regeneración de nervios experimentales sobre cómo hacer un uso óptimo de las características ventajosas del método sería de gran ayuda.
Varios autores han abordado el potencial de AGA para evaluar la recuperación funcional en roedores, destacando la ventaja del método para evaluar simultáneamente los parámetros de marcha relacionados con la reinnervación motora y sensorial27,28. Además, la comparación de datos de una pata experimental, por ejemplo, una lesión nerviosa reconstruida a una pata no operada como se muestra en ambos modelos presentados permite la inclusión de un control positivo intra-animal. Inversamente, una pata operada sin reconstrucción quirúrgica o tratamiento adicional podría servir como un control negativo intra-animal. También se demostró que es posible combinar AGA con enfoques de aprendizaje automático43. A pesar de las ventajas del método, también tiene varias limitaciones e inconvenientes, como los esfuerzos de entrenamiento que consumen mucho tiempo, que son obligatorios para acostumbrar al animal al procedimiento de adquisición28,44. Otra limitación de AGA es el tamaño máximo de los animales elegibles para las pruebas debido a las dimensiones limitadas del aparato. Por lo tanto, el uso de AGA se limita actualmente a los animales del tamaño de roedores y hurones45. Además, los enfoques de evaluación neuroconductual recientemente emergentes en el campo del seguimiento del movimiento capaces de aprendizaje automático pueden superar a AGA tanto en la amplitud como en las posibles aplicaciones18,19,46. Lo más notable, pero de acuerdo con otros métodos de evaluación, parece que la recuperación funcional evaluada por AGA es fuertemente limitada, si incluso ocurre, en modelos de neurotmesis del nervio ciático47,48. Por otro lado, AGA permite una evaluación integral del curso de la recuperación funcional después de la neurotmesis del nervio femoral como se muestra en nuestros datos. Con este trabajo, demostramos que el área de impresión de patas es un parámetro representativo de la marcha evaluable a través de AGA, que es ejemplar para el curso de la recuperación funcional en los dos modelos de lesiones de nervios periféricos antes mencionados presentados por nosotros. Mientras que la recuperación funcional ad integrum fue observable después de la reparación del autoinjerto del nervio femoral, los parámetros de AGA todavía cambiaron significativamente desde el inicio al final del período de observación después de la reparación del autoinjerto del nervio ciático. En este contexto, cabe destacar que las contracturas de las extremidades son un fenómeno común en ratas con lesión del nervio ciático y es necesario tener precaución para no confundir estos signos de desequilibrio muscular y parálisis con el procedimiento de recuperación funcional32. Esto, por un lado, subraya la incapacidad del método AGA para detectar una recuperación funcional significativa después de una lesión de neurotmesis en este modelo. Por otro lado, plantea la cuestión de si es factible evaluar el modelo de lesión nerviosa ciática de la rata, que sigue siendo el modelo de reparación del nervio experimental más utilizado, mediante análisis de la marcha en general en caso de que la lesión nerviosa sea más grave que la axonotmesis48. Los detalles de solución de problemas se proporcionan en el archivo suplementario 1.
También proporcionamos datos ejemplares sobre el uso del método para evaluar la función locomotora en ratas con lesión de la médula espinal, que es posible sin ningún cambio necesario en el procedimiento de configuración o adquisición del hardware. El mismo principio se aplica a otros modelos de roedores de lesión nerviosa central (CNI)26,49,50 y lesión por avulsión de raíz. A diferencia de los PNI aislados, las lesiones de la médula espinal son mucho más complejas en sus consecuencias fisiopatológicas, ya que una multitud de estructuras muy importantes están dañadas, que implican vías eferentes como los tracto corticospinal y rubrospinal y vías aferentes como las columnas dorsales y las vías espinootálmicas35. El desafío de evaluar adecuadamente estos cambios patológicos se refleja en el armamentario integral de las pruebas de comportamiento, como la puntuación de Basso, Beattie y Bresnahan (BBB)36. El parámetro de marcha Base de Apoyo se ha divulgado para aumentar después de lesiones nerviosas centrales, muy probablemente para tener en cuenta una marcha instable resultante. La base de soporte cambió significativamente desde la línea de base de WPO10 hasta WPO14 en nuestro modelo, apoyando nuestra presunción de que este parámetro permite evaluar el curso de la recuperación funcional por AGA después de una lesión de contusión torácica en la médula espinal.
Estamos convencidos de que AGA es una herramienta factible para evaluar la recuperación funcional en roedores con lesiones del sistema nervioso. Sin embargo, aconsejamos reflejar los cambios observados de la marcha cuidadosamente y a fondo en cada configuración experimental respectiva. Las alteraciones en los parámetros de marcha, por ejemplo, un aumento en el área de impresión después de un decremento postoperatorio inmediato o una disminución del tiempo de oscilación que provoca una elevación postoperatoria inmediata de este parámetro, en el transcurso del período de observación no se relacionan inevitablemente con la recuperación funcional. En cambio, estos cambios también pueden estar relacionados con una posible adaptación funcional para mantener una marcha discreta, dado que las ratas son una especie de presa y tratan de evitar mostrar dolor o discapacidad a los depredadores potenciales51. Por lo tanto, se recomienda utilizar el análisis automatizado de la marcha como herramienta complementaria para relacionar los cambios de marcha con otras medidas de resultado de la lesión y regeneración de los nervios periféricos21. Como se mencionó anteriormente, también creemos que debe reflejarse cuidadosamente si los roedores con neurotmesis del nervio ciático deben ser investigados por medio de AGA, ya que nuestro hallazgo indica fuertemente que la recuperación funcional está severamente limitada en este caso.
Como se muestra en nuestro trabajo, el principal activo de AGA es la posibilidad de estudiar tanto la reinnervación motora como sensorial en una multitud de modelos experimentales de PNI, así como en CNI, a la vez que requieren una sola configuración. Por lo tanto, el método es, en nuestra opinión, una herramienta muy valiosa para las pruebas neuroconductuales integrales. Uno de los activos de AGA, que es la posibilidad de estudiar la reinnervación motora y sensorial en varios modelos animales de PNI y CNI mientras se requiere una sola configuración, es en nuestra opinión la principal ventaja del método en comparación con otros métodos de evaluación para estudiar la recuperación funcional, como el análisis de pista a pie52,von Frey testing53, o la cinemática de la marcha16. El potencial de evaluar simultáneamente los cambios de marcha que se correlacionan con los resultados de las investigaciones electrofisiológicas del músculo reinnervado22 o los métodos de evaluación de la función sensorial54 es prometedor con respecto a las aplicaciones futuras del método. Por lo tanto, recomendamos utilizar AGA para investigar la recuperación funcional en modelos de roedores de PNI de extremidades anteriores, como el nervio cubital, radial o mediano, o los modelos experimentales de transferencia de nervios55,que aún no se han estudiado con este método.
Por la presente proporcionamos un protocolo detallado sobre cómo utilizar el análisis automatizado de la marcha para estudiar la recuperación funcional en tres modelos de roedores de lesión nerviosa. Si bien el método requiere una cuidadosa consideración de varios aspectos clave, como el entrenamiento adecuado y la calibración meticulosa de hardware y software, es una herramienta complementaria factible y valiosa para evaluar la regeneración nerviosa en modelos de roedores de lesión nerviosa central y periférica.
Divulgaciones
Los autores declaran que este trabajo fue apoyado por Noldus Inc. por la cobertura de la tarifa de publicación de acceso abierto. Ninguno de los autores recibió ningún salario personal o ningún tipo de propina financiera. Los autores no tienen otros intereses en competencia que declarar.
Agradecimientos
Los autores quieren agradecer a Karin Brenner por su apasionado cuidado de los animales. Los autores también quieren agradecer a Claudia Keibl, James Ferguson, Gabriele Leinfellner y Susanne Drechsler por su ayuda durante las cirugías experimentales.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | B. Braun Austria | 3570410 | Vehicle for drug delivery |
| 1 ml syringe | B. Braun Austria | 9161708V | Injecting device |
| 10 ml syringe | B. Braun Austria | 4606728 V | Injecting device |
| 1-Propanol, 2-Propanol, Hexetidin | Gebro Pharma | N/A | Alcoholic skin disinfection |
| 23-gauge (G) canula | B. Braun Austria | 4657667 | Canula for s.c. injection |
| 26-gauge (G) canula | B. Braun Austria | 4657683 | Canula for s.c. injection |
| 5 ml syringe | B. Braun Austria | 4606710 V | Injecting device |
| Buprenorphine hydrochloride | Sigma | B9275 | Analgetic agent |
| Burrs for Micro Drill | F.S.T | 19007-29 | Drilling of a hole inside the lamina |
| Caprofen | Zoetis Austria | N/A | Analgetic agent |
| Catwalk Automated gait analysis system | Noldus | N/A | Automatic analysis software of animal gait |
| Cauterizer Kit | F.S.T | 18010-00 | Cauterization of vessels during surgery |
| Enrofloxacin | Bayer Austria | N/A | Antibiotic |
| Ethilon (10-0) | ETHICON | 2810G | Suture material for neurrorhaphy |
| Ethilon (11-0) | ETHICON | EH7465G | Suture material for neurrorhaphy |
| Eye ointment | Fresenius Kabi Austria | 4302436 | Eye protection during anesthesia |
| Friedman-Pearson Rongeurs | F.S.T | 16221-14 | Surgical instrument |
| Gabapentin | Wedgewood Pharmacy | N/A | Analgetic agent |
| Goldstein retractor | F.S.T | 17003-03 | Retraction of tissues during surgery |
| Hair trimmer | Aescular | N/A | Hair trimmer for shaving of the operation site prior to surgery |
| Heating Pad for rodents | ALA Scientific Instruments | N/A | Regulation of body temperature |
| Impactor | Precision Systems and Instrumentation | N/A | Induction of spinal cord contusion |
Lewis rat ( ) ) | Janvier | N/A | Experimental animal |
| Magnetic Fixator Retraction System | F.S.T | 18200-50 | Retraction of tissues during surgery |
| Metzenbaum Baby Scissors | F.S.T | 14019-13 | Surgical instrument |
| Micro Drill | Word Precision Instruments | 503599 | Instrument for bone drilling |
| Micro Needle holder | F.S.T | 12076-12 | Surgical instrument |
| Micro-scissors (curved) | F.S.T | 15023-10 | Surgical instrument |
| Micro-scissors (straight) | F.S.T | 15007-08 | Surgical instrument |
| Mirror Finish Forceps | F.S.T | 11251-23 | Surgical instrument |
| Needle holder | F.S.T | 12002-12 | Surgical instrument |
| Operating microscope | Leica | M651 MSD | Magnification of the operative site |
| Povidone Iod | B. Braun Melsungen | N/A | Non-alcoholic skin disinfectant |
| Pulse Oximeter | STARR Life Sciences | N/A | Surveillance of heart rate and oxygen saturation |
| Rodent thermometer | BIOSEB | BIO-TK8851 | Surveillance of body temperature |
| Scalpel blade | F.S.T | 10010-00 (#10) | Surgical instrument to make an incision |
| Scalpel handle | F.S.T | 10003-12 (#3) | Surgical instrument to make an incision |
| Sevoflurane Inhalation Vapour, Liquid (100%) | Baxter | HDG9117A | Anesthetic |
| Spatula & Probe | F.S.T | 10090-13 | Surgical instrument |
Sprague Dawley rat ( ) ) | Janvier | N/A | Experimental animal |
| Sterila gauze 5x5cm | EVAC MEDICAL | E010.03.00215 | Sterile gauze compress |
| Tissue Forceps | F.S.T | 11021-12 | Surgical instrument |
| Vicryl (4-0) | ETHICON | V3040H | Suture material for subcutaneous sutures |
| Vicryl (5-0) | ETHICON | V303H | Suture material for subcutaneous sutures |
| Vicryl cutting needle (4-0) | ETHICON | V392ZH | Suture material for skin sutures |
| Vicryl cutting needle (5-0) | ETHICON | V391H | Suture material for skin sutures |
Referencias
- Mohanty, C. B., Bhat, D. I., Devi, B. I. Use of animal models in peripheral nerve surgery and research. Neurology India. 9, 100-105 (2019).
- Vela, F. J., et al. Animal models used to study direct peripheral nerve repair: a systematic review. Neural Regeneration Research. 15 (3), 491-502 (2020).
- Verma, R., Virdi, J. K., Singh, N., Jaggi, A. S. Animals models of spinal cord contusion injury. The Korean Journal of Pain. 32 (1), 12-21 (2019).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. The European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Sperry, R. W. The functional results of muscle transposition in the hind limb of the rat. The Journal of Comparative Neurology. 73 (3), 379-404 (1940).
- Sperry, R. W. The effect of crossing nerves to antagonistic muscles in the hind limb of the rat. The Journal of Comparative Neurology. 75 (1), 1-19 (1941).
- Sperry, R. W. Transplantation of motor nerves and muscles in the forelimb of the rat. The Journal of Comparative Neurology. 76 (2), 283-321 (1942).
- Zimmerman, E. A., Chambers, W. W., Liu, C. N. An experimental study of the anatomical organization of the Cortico-Bulbar System in the Albino Rat. The Journal of Comparative Neurology. 123, 301-323 (1964).
- Cohen, A. H., Gans, C. Muscle activity in rat locomotion: movement analysis and electromyography of the flexors and extensors of the elbow. Journal of Morphology. 146 (2), 177-196 (1975).
- Barnett, S. A. . The Rat: A Study in Behaviour. , (1963).
- Hare, G. M., et al. Walking track analysis: utilization of individual footprint parameters. Annals of Plastic Surgery. 30 (2), 147-153 (1993).
- Hare, G. M., et al. Walking track analysis: a long-term assessment of peripheral nerve recovery. Plastic and Reconstructive Surgery. 89 (2), 251-258 (1992).
- Bertelli, J. A., Mira, J. C. Behavioral evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journa of Neuroscience Methods. 46 (3), 203-208 (1993).
- Varejao, A. S., Melo-Pinto, P., Meek, M. F., Filipe, V. M., Bulas-Cruz, J. Methods for the experimental functional assessment of rat sciatic nerve regeneration. Neurological Research. 26 (2), 186-194 (2004).
- Varejao, A. S., et al. Functional assessment of peripheral nerve recovery in the rat: gait kinematics. Microsurgery. 21 (8), 383-388 (2001).
- Varejao, A. S., et al. Ankle kinematics to evaluate functional recovery in crushed rat sciatic nerve. Muscle and Nerve. 27 (6), 706-714 (2003).
- Nath, T., et al. Using DeepLabCut for 3D markerless pose estimation across species and behaviors. Nature Protocols. 14 (7), 2152-2176 (2019).
- Mathis, A., et al. DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nature Neuroscience. 21 (9), 1281-1289 (2018).
- Deumens, R., Jaken, R. J., Marcus, M. A., Joosten, E. A. The CatWalk gait analysis in assessment of both dynamic and static gait changes after adult rat sciatic nerve resection. Journal of Neuroscience Methods. 164 (1), 120-130 (2007).
- Heinzel, J., et al. Use of the CatWalk gait analysis system to assess functional recovery in rodent models of peripheral nerve injury - a systematic review. Journal of Neuroscience Methods. 345, 108889 (2020).
- Heinzel, J. C., Hercher, D., Redl, H. The course of recovery of locomotor function over a 10-week observation period in a rat model of femoral nerve resection and autograft repair. Brain and Behavior. , 01580 (2020).
- Chen, S. H., et al. Changes in GABA and GABA(B) receptor expressions are involved in neuropathy in the rat cuneate nucleus following median nerve transection. Synapse. 66 (6), 561-572 (2012).
- Chen, S. H., et al. Decreases of glycine receptor expression induced by median nerve injury in the rat cuneate nucleus contribute to NPY release and c-Fos expression. Life Sciences. 90 (7-8), 278-288 (2012).
- Hetze, S., Romer, C., Teufelhart, C., Meisel, A., Engel, O. Gait analysis as a method for assessing neurological outcome in a mouse model of stroke. Journal of Neuroscience Methods. 206 (1), 7-14 (2012).
- Sandner, B., et al. Systemic epothilone D improves hindlimb function after spinal cord contusion injury in rats. Experimental Neurology. 306, 250-259 (2018).
- Kappos, E. A., et al. Validity and reliability of the CatWalk system as a static and dynamic gait analysis tool for the assessment of functional nerve recovery in small animal models. Brain and Behavior. 7 (7), 00723 (2017).
- Deumens, R., Marinangeli, C., Bozkurt, A., Brook, G. A. Assessing motor outcome and functional recovery following nerve injury. Methods in Molecular Biology. 1162, 179-188 (2014).
- Webster, G. V. Halstedian principles in the practice of plastic and reconstructive surgery. Stanford Medical Bulletin. 13 (3), 315-316 (1955).
- Bozkurt, A., et al. A flexible, sterile, and cost-effective retractor system for microsurgery. Microsurgery. 31 (8), 668-670 (2011).
- Carr, M. M., Best, T. J., Mackinnon, S. E., Evans, P. J. Strain differences in autotomy in rats undergoing sciatic nerve transection or repair. Annals of Plastic Surgery. 28 (6), 538-544 (1992).
- Dellon, A. L., Mackinnon, S. E. Sciatic nerve regeneration in the rat. Validity of walking track assessment in the presence of chronic contractures. Microsurgery. 10 (3), 220-225 (1989).
- Jackson, C. M. Anatomy of the rat. Transactions of the American Philosophical Society, Philadelphia, New Series, Volume XXVII, 1935. The Anatomical Record. 65 (1), 127-129 (1936).
- Pena, M. C., Baron, J. Femoral nerve and rectus femoris muscle of the rat: a study in anatomy, histology, and histoenzymes. Annals of Plastic Surgery. 20 (6), 527-532 (1988).
- Kjell, J., Olson, L. Rat models of spinal cord injury: from pathology to potential therapies. Disease Models and Mechanisms. 9 (10), 1125-1137 (2016).
- Basso, D. M., Beattie, M. S., Bresnahan, J. C. A sensitive and reliable locomotor rating scale for open field testing in rats. Journal of Neurotrauma. 12 (1), 1-21 (1995).
- Bozkurt, A., et al. CatWalk gait analysis in assessment of functional recovery after sciatic nerve injury. Journal of Neuroscience Methods. 173 (1), 91-98 (2008).
- Godinho, M. J., et al. Immunohistochemical, ultrastructural and functional analysis of axonal regeneration through peripheral nerve grafts containing Schwann cells expressing BDNF, CNTF or NT3. PLoS One. 8 (8), 69987 (2013).
- Pajenda, G., et al. Spatiotemporally limited BDNF and GDNF overexpression rescues motoneurons destined to die and induces elongative axon growth. Experimental Neurology. 261, 367-376 (2014).
- Matsuura, Y., et al. The effect of anti-NGF receptor (p75 Neurotrophin Receptor) antibodies on nociceptive behavior and activation of spinal microglia in the rat brachial plexus avulsion model. Spine (Phila Pa 1976). 38 (6), 332-338 (2013).
- Hamers, F. P., Lankhorst, A. J., van Laar, T. J., Veldhuis, W. B., Gispen, W. H. Automated quantitative gait analysis during overground locomotion in the rat: its application to spinal cord contusion and transection injuries. Journal of Neurotrauma. 18 (2), 187-201 (2001).
- Koopmans, G. C., et al. The assessment of locomotor function in spinal cord injured rats: the importance of objective analysis of coordination. Journal of Neurotrauma. 22 (2), 214-225 (2005).
- Frohlich, H., Claes, K., De Wolf, C., Van Damme, X., Michel, A. A machine learning approach to automated gait analysis for the Noldus Catwalk system. IEEE Transaction on Bio-medical Engineering. 65 (5), 1133-1139 (2018).
- Batka, R. J., et al. The need for speed in rodent locomotion analyses. Anatomical Record (Hoboken, N. J). 297 (10), 1839-1864 (2014).
- Wood, T., et al. A ferret model of encephalopathy of prematurity. Developmental Neuroscience. 40 (5-6), 475-489 (2018).
- Abbas, W., Masip Rodo, D. Computer methods for automatic locomotion and gesture tracking in mice and small animals for neuroscience applications: a survey. Sensors. 19 (15), (2019).
- Irintchev, A. Potentials and limitations of peripheral nerve injury models in rodents with particular reference to the femoral nerve. Annals of Anatomy. 193 (4), 276-285 (2011).
- Haastert-Talini, K., Haastert-Talini, K., Assmus, H., Antoniadis, G. . Modern Concepts of Peripheral Nerve Repair. , 127-138 (2017).
- Lu, L., et al. Growth differentiation factor 11 promotes neurovascular recovery after stroke in mice. Frontiers in Cellular Neuroscience. 12, (2018).
- Caballero-Garrido, E., Pena-Philippides, J. C., Galochkina, Z., Erhardt, E., Roitbak, T. Characterization of long-term gait deficits in mouse dMCAO, using the CatWalk system. Behavioral Brain Research. 331, 282-296 (2017).
- Graham, D. M., Hampshire, V. Methods for measuring pain in laboratory animals. Lab Animal. 45 (3), 99-101 (2016).
- Monte-Raso, V. V., Barbieri, C. H., Mazzer, N., Yamasita, A. C., Barbieri, G. Is the sciatic functional index always reliable and reproducible. Journal of Neuroscience Methods. 170 (2), 255-261 (2008).
- Stossel, M., et al. Comparative evaluation of chitosan nerve guides with regular or increased bendability for acute and delayed peripheral nerve repair: a comprehensive comparison with autologous nerve grafts and muscle-in-vein grafts. Anatomical Record (Hoboken). 301 (10), 1697-1713 (2018).
- Vrinten, D. H., Hamers, F. F. CatWalk' automated quantitative gait analysis as a novel method to assess mechanical allodynia in the rat; a comparison with von Frey testing. Pain. 102 (1-2), 203-209 (2003).
- Aman, M., Sporer, M., Bergmeister, K., Aszmann, O. Animal models for selective nerve transfers of the upper extremity. Handchirurgie Mikrochirurgie Plastische Chirurgie. 51 (4), 319-326 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados