Method Article
Automatisierte Gait-Analyse zur Beurteilung der funktionellen Erholung bei Nagetieren mit peripheren Nerven- oder Rückenmarkskontitionsverletzungen
In diesem Artikel
Zusammenfassung
Die automatisierte Ganganalyse ist ein praktikables Werkzeug zur Bewertung der funktionellen Erholung in Nagetiermodellen von peripheren Nervenverletzungen und Rückenmarksprellungen. Während es nur ein Setup erfordert, um die Funktion des Bewegungsapparates in verschiedenen experimentellen Modellen zu bewerten, ist eine sorgfältige Hard- und Software-Anpassung und Das Training der Tiere sehr wichtig.
Zusammenfassung
Periphere und zentrale Nervenverletzungen werden meist bei Nagetieren, insbesondere Ratten, untersucht, da diese Tiermodelle sowohl kostengünstig sind als auch viele vergleichende Daten in der Literatur veröffentlicht wurden. Dazu gehört eine Vielzahl von Bewertungsmethoden zur Untersuchung der funktionellen Erholung nach Nervenverletzungen und -reparaturen. Neben der Bewertung der Nervenregeneration mittels Histologie, Elektrophysiologie und anderen In-vivo- und In-vitro-Bewertungstechniken ist die funktionelle Regeneration das wichtigste Kriterium, um den Grad der neuronalen Regeneration zu bestimmen. Die automatisierte Ganganalyse ermöglicht die Aufzeichnung einer großen Menge von Gangparametern wie Paw Print Area und Paw Swing Speed sowie Messungen der Interlimb-Koordination. Darüber hinaus liefert die Methode digitale Daten der Pfoten der Ratten nach neuronalen Schäden und während der Nervenregeneration, was unser Verständnis dafür ergänzt, wie periphere und zentrale Nervenverletzungen ihr Bewegungsverhalten beeinflussen. Neben dem überwiegend verwendeten Ischias-Nervenverletzungsmodell können mit dieser Methode auch andere Modelle peripherer Nervenverletzungen wie der Oberschenkelnerv untersucht werden. Neben Verletzungen des peripheren Nervensystems können auch Läsionen des Zentralnervensystems, z.B. Rückenmarkskontusion, bewertet werden. Eine gültige und reproduzierbare Datenauswertung hängt stark von einer sorgfältigen Anpassung der Hard- und Softwareeinstellungen vor der Datenerfassung ab. Darüber hinaus ist eine angemessene Ausbildung der Versuchstiere von entscheidender Bedeutung. Diese Arbeit soll den Einsatz einer computergestützten automatisierten Ganganalyse veranschaulichen, um die funktionelle Erholung in verschiedenen Tiermodellen von peripheren Nervenverletzungen sowie Rückenmarksprellungen zu bewerten. Es betont auch die Grenzen der Methode, z.B. die Bewertung der Nervenregeneration bei Ratten mit Ischiasnervneurotmese aufgrund einer begrenzten funktionellen Erholung. Daher soll dieses Protokoll Forschern helfen, die an peripheren und zentralen Nervenverletzungen interessiert sind, um die funktionelle Genesung in Nagetiermodellen zu bewerten.
Einleitung
Verletzungen des peripheren und zentralen Nervensystems werden oft bei Nagetieren untersucht, was zu einer großen Menge an vergleichenden Daten über den Verlauf von Nervenverletzungen, Reparaturen oder Neuroprotektion führt, um weiteren Sekundärverletzungen und Regeneration1,2,3entgegenzuwirken. Das Ergebnis experimenteller Behandlungsstrategien in Nagetiermodellen kann anhand einer Vielzahl von Techniken wie Histologie, Immunhistochemie, Elektrophysiologie und bildgebenden Verfahren wie Röntgenmikrotomographie (CT) untersucht werden, aber das wichtigste Kriterium, um den Erfolg einer Behandlung zu bestimmen, ist – wie bei menschlichen Patienten – der Grad der funktionellen Genesung4,5. Die ersten Studien zur Untersuchung der motorischen Leistung bei Nagetieren stammen aus den 1940er Jahren6,7,8. Ratten und Mäuse wurden in den folgenden Jahrzehnten einer Vielzahl von Studien unterzogen, die ihr bewegungsmotorisches Verhalten untersuchten9,10,11. Heutzutage gibt es eine breite Palette von Bewertungstechniken für Nagetiermodelle von peripheren und zentralen Nervenverletzungen, die von der Walking-Track-Analyse mit Tinte und Papier12,13,14 über Knöchel- und Gangkinematik15,16,17 bis hin zu maschinell-learning-verbesserten Methoden reichen, die eine komplexe Abschätzung von Gang-, Gliedmaßen- und Gelenkbahnen18,19ermöglichen.
Computerized Automated Gait Analysis (AGA) wird verwendet, um die Funktion des Bewegungsapparates nach peripheren und zentralen Nervenverletzungen und einer möglichen experimentellen Behandlung solcher Verletzungen zu bewerten. Das Gerät besteht hauptsächlich aus einem gläsernen Gehweg und einer Lichtquelle, die die Pfotenabdrücke des Nagers in Korrelation mit dem von ihnen überschrittenen Druck beleuchtet. Diese Daten werden dann computerisiert, um eine breite Palette statischer und dynamischer Parameter zu berechnen. Deumens zufolge können diese Parameter weiter in die Kategorien allgemeiner Parameter, schmerzbezogener Parameter sowie koordinationsbezogener Parameter von Gang20 (Tabelle 1) unterteilt werden. Die Machbarkeit von AGA zum Nachweis von Veränderungen des Gangverhaltens wurde in verschiedenen Tiermodellen der peripheren Nervenverletzung (PNI)21nachgewiesen, wie z. B. dem Ischiasnerv20, dem Oberschenkelnerv22und dem Mediannerv23,24. Es wird auch routinemäßig verwendet, um die motorische Funktion bei Ratten mit zentralen Nervenverletzungen zu bewerten, z.B. Schlaganfall25 oder Rückenmarkskontusion26. Die Fortschritte der Methode liegen in der großen Menge vergleichbarer Daten und ihrer Möglichkeit, eine Fülle von Parametern im Zusammenhang mit Gang27aufzuzeichnen. Dieses Papier zielt darauf ab, Forschern, die an Tiermodellen von PNI und Rückenmarksverletzungen (SCI) interessiert sind, eine detaillierte und praktische Leitlinie zur Beurteilung der Funktion des Bewegungsapparates in solchen Modellen zur Verfügung zu stellen.
| Kategorie | Parameter | Beschreibung | |
| Allgemeine Parameter des Ganges | Druckbereich (Entfernungseinheit) | Bereich des Pfotendrucks | |
| Drucklänge (Entfernungseinheit) | Länge des Pfotendrucks | ||
| Basis der Unterstützung (BoS) (Entfernungseinheit) | Abstand zwischen den beiden Hinter- oder Vorderpfoten | ||
| Schrittlänge (Entfernungseinheit) | Abstand zwischen zwei aufeinanderfolgenden Platzierungen einer Pfote | ||
| Schmerzbedingte Parameter des Ganges | Swing Time (s) | Dauer der Schwenkphase | |
| Standzeit (s) | Dauer der Haltungsphase | ||
| Mittlere Paw Print Intensität (willkürliche Einheit) | Mittlere iIntensität des Pfotendrucks während der Haltungsphase | ||
| Koordinationsbezogene Parameter des Ganges | Normal Step Sequence Patterns (NSSP) | Spezifische Sequenzen von Pfotenplatzierungen während eines Schrittzyklus | |
| Phasendispersionen (%) | Zeitliche Unterschiede zwischen den Schrittzyklen zweier spezifischer Pfoten | ||
| Regelmäßigkeitsindex (RI) (%) | Quantifizierung der Interlimb-Koordination durch Division der Menge der einwandfreien NSSP-Zeiten 4 durch die Gesamtzahl der Pfotenplatzierung während eines Schrittzyklus | ||
Tabelle 1: Parameter des Ganges, die mit der automatisierten Ganganalyse bewertet werden können. Die Kategorien, in denen die Parameter klassifiziert werden, werden nach Deumens et al.20ausgewählt.
Protokoll
Das Versuchsprotokoll für alle Experimente wurde im Vorfeld vom Animal Protocol Review Board der Stadtwien genehmigt. Alle Verfahren wurden in voller Übereinstimmung mit der Erklärung von Helsinki über die Tierrechte und dem Leitfaden für die Pflege und Verwendung von Labortieren der Nationalen Gesundheitsinstitute durchgeführt.
1. Tierhaltung
- Haus männlich Ratten (Lewis oder Sprague Dawley) mit einem Gewicht von 250–300 g unter einem 12 h Licht/Dunkel-Zyklus mit ad libitum Zugang zu Nahrung und Wasser.
- Kontrollieren Sie sowohl Raumtemperatur (bei 20–22 °C) als auch Luftfeuchtigkeit (45%–65 %) für eine angemessene Tierhaltung. Für diese Arbeit wurden männliche Lewis (PNIs) und Sprague Dawley (SCI) Ratten verwendet.
- Stellen Sie zweimal pro Woche einen neuen, gereinigten Käfig zur Verfügung. Hausratten in Zweier- oder Dreiergruppen und überwachen ihr soziales Verhalten und ihre Interaktion genau. Erlauben Sie den Ratten eine Akklimatisierungszeit von mindestens 1 Woche vor einem chirurgischen Eingriff oder Funktionstests.
ANMERKUNG: Ratten benötigen mindestens 5 Tage tägliches Training auf dem Ganganalysegerät vor der Operation, so berechnen Sie mindestens 2 Wochen zwischen der Ankunft der Ratten in der Einrichtung und die geplanten Daten für experimentelle Chirurgie28.
2. Induktion von Nervenverletzungen
HINWEIS: Tragen Sie persönliche Schutzausrüstung wie ein chirurgisches Kleid, Handschuhe und eine Maske. Falls kein steriles OP-Kleid verfügbar ist, genügt auch ein sauberer, gewaschener Labormantel. Es sei denn, es wird kontaminiert, das Kleid oder Mantel muss nicht zwischen Tieren, sondern zwischen chirurgischen Sitzungen gewechselt werden. Die Verwendung von sterilen chirurgischen Handschuhen wird empfohlen. Falls solche Handschuhe nicht verfügbar sind, können auch Untersuchungshandschuhe verwendet werden, sollten aber vor der Operation mit chirurgischem Desinfektionsmittel gewaschen werden. Handschuhe sollten zwischen Tieren gewechselt werden.
- Versuchen Sie am Tag der Operation, jegliche Belastung der Tiere zu minimieren, da dies die Anästhesie beeinträchtigen könnte, z. B. benötigen Tiere höhere Dosen von Anästhetika.
- Am Tag der Operation, injizieren 0,05 mg Buprenorphin/kg Körpergewicht in Suspension mit 100-200 l 0,9% NaCl subkutan mit einer 25 G Kanüle 1 h vor der Operation, um vor- und interoperative Analgesie zu bieten. Wenn nicht anders angegeben, ist die Flanke der Ratte die bevorzugte Injektionsstelle.
- Anästhesisieren Sie die Ratten, indem Sie sie in eine Anästhesie-Induktionskammer legen, die mit einem Sevofluran-Verdampfer und einem aktiven Kreidebehälter verbunden ist, um dasCO2zu absorbieren. Anästhesisieren Sie die Ratte, indem Sie die Anästhesiebox mit 4%–5% Sevofluran-Sauerstoff-Gemisch ca. 5 min mit einem Sauerstoffstrom von 1,5 l/min (Einweihungsphase) überfluten. Schließen Sie einen Pulsoximetrieclip an eine der Pfoten an, um die Sauerstoffsättigung des Nagers zu überwachen. Halten Sie den Zustand der Vollnarkose mit 2,5%–4,5% Sevofluran-Sauerstoff-Gemisch aufrecht.
HINWEIS: Bei experimentellen Operationen ist eine Vollnarkose obligatorisch. Bestätigen Sie die Vollnarkose, indem Sie den Mangel an Reaktion auf Kneifreize des Schwanzes oder der Pfoten überprüfen. - Wenn die Ratte in die Vollnarkose eingetreten ist, rasieren Sie das jeweilige Areal, das operiert werden soll, und desinfizieren Sie den Bereich, indem Sie es abwechselnd mit Alkohol und Hautdesinfektionsmittel wischen. Das letzte Wischen sollte mit dem Hautdesinfektionsmittel durchgeführt werden.
- Legen Sie es auf einem verstellbaren Heizkissen in der gewünschten Position (Supine für das Femoral-Nervenmodell, anfällig für das Ischias- und SCI-Modell). Legen Sie eine flexible Thermometersonde in das Rektum der Ratte ein, um die Temperatur des Tieres zu überwachen und es während der Operation bei etwa 37 °C zu halten. Während der Anästhesie, schützen Sie die Augen der Ratte vor Austrocknung mit Augensalbe
3. Chirurgische Induktion von Nervenverletzungen
- Bei chirurgischen Eingriffen sollten Sie sich strikt an die sieben Prinzipien von Halsted29 halten:
- Behandeln Sie das Gewebe immer vorsichtig, wenn Sie mit ihnen arbeiten. Vermeiden Sie das Reißen oder Zerkleinern des Gewebes.
HINWEIS: Selbstgemachte30 oder kommerziell erhältliche Retraktorsysteme sind hilfreich, um Muskeln und Gefäße aus dem Betriebsbereich fernzuhalten. - Pflegen Sie vorsichtig die Hämostase mit einem elektrischen Hämostat, um Gefäße oder Ligaturen zu kauterisieren, um eine sorgfältige Hämostase zu gewährleisten.
- Halten Sie die Blutversorgung der Gewebe immer aufrecht, indem Sie sie sorgfältig sezieren und fein behandeln.
- Halten Sie strenge Asepsis durch das Tragen einer Maske, ein Kleid, und sterile Handschuhe.
- Vermeiden Sie Verspannungen am Gewebe, indem Sie Nähte auftragen, die weder zu eng noch zu locker sind.
- Akribisch appose die Gewebe, indem sie ihre jeweiligen Kanten zusammen ohne Überlappung.
HINWEIS: Dies ist besonders wichtig bei epineurialer oder perineurialer Neurorrhaphy. Führen Sie alle mikrochirurgischen Eingriffe unter der 6x–16-fachen Vergrößerung mit einem Operationsmikroskop durch. Idealerweise bietet das Mikroskop zwei Augenpaare, um die Operation durch einen Assistenten beobachten zu können. - Vermeiden Sie die Schaffung von Totenräumen, indem Sie die verschiedenen Gewebeschichten sorgfältig nähren.
- Behandeln Sie das Gewebe immer vorsichtig, wenn Sie mit ihnen arbeiten. Vermeiden Sie das Reißen oder Zerkleinern des Gewebes.
- Induktion der Ischiasnervenneurotmese des rechten Hinterglieds
- Setzen Sie den rechten Ischiasnerv auf der mittleren Ebene aus, indem Sie einen 5 cm langen Schnitt auf der Rückenseite mit einer #10 Skalpellklinge durchführen, die mit einem #3 Skalpellgriff verbunden ist, und indem Sie die darüber liegende Muskulatur und das Weichgewebe sezieren. Legen Sie einen Retraktor in die Wunde, um die sezierte Muskulatur und Haut aus dem Situs herauszuhalten. Bedecken Sie den Nerv vorsichtig, indem Sie das umgebende Gewebe mit einer gekrümmten mikrochirurgischen Schere entfernen.
- Entfernen Sie ein 8 mm langes Nervensegment des Ischiasnervs 1–2 mm proximal zu seiner Trifurkation mit gerader mikrochirurgischer Schere.
- Drehen Sie das Nervensegment um 180°, platzieren Sie es zwischen dem proximalen und distalen Stumpf des transectierten Ischiasnervs und führen Sie an jeder Stelle epineuriale Neurorrhaphy mit zwei unterbrochenen 10:0-Nähten und einem mikrochirurgischen Nadelhalter durch.
- Induktion der femoralen Nervenneurotmese am rechten Hinterglied
- Führen Sie einen längsigen 3-4 cm Leistenschnitt mit einer #10 Skalpellklinge durch, die mit einem #3 Skalpellgriff verbunden ist, um das rechte femorale neurovaskuläre Bündel freizulegen. Verwenden Sie eine chirurgische Schere für die stumpfe Sezierung, bis die Bifurkation des Oberschenkelnervs exponiert ist. Legen Sie einen Retraktor in die Wunde, um die sezierte Muskulatur und Haut aus dem Situs herauszuhalten.
- Transect die exponierten motorischen und sensorischen Zweige distal auf die Bifurkation und Verbrauch ein 6 mm langes Nervensegment von jedem Zweig, jeweils mit geraden mikrochirurgischen Scheren.
- Drehen Sie beide Nervensegmente um 180°, platzieren Sie sie zwischen dem proximalen und distalen Stumpf der transected femoralen Nervenzweige und führen Sie an jeder Stelle epineuriale Neurorrhaphy mit zwei unterbrochenen 11:0-Nähten und einem mikrochirurgischen Nadelhalter durch.
HINWEIS: Führen Sie ein homtopisches autologes Nerventransplantat durch, indem Sie das Motortransplantat auf den ursprünglichen Motorzweig und das sensorische Transplantat auf den ursprünglichen sensorischen Zweig transplantieren. Alternativ können Sie ein heterotopisches autologes Nerventransplantat durchführen, indem Sie das Motortransplantat auf den ursprünglichen sensorischen Zweig transplantieren und umgekehrt.
- Induktion von Thoraxrückenmarksprellung
- Führen Sie einen Hautschnitt über die Brustwirbelsäule mit einer #10 Skalpellklinge, die mit einem #3 Skalpellgriff verbunden ist, gefolgt von zwei Muskelschnitten parallel zu den spinalen Prozessen, um den Muskelrückzug zu erleichtern. Legen Sie einen Retraktor in die Wunde, um die sezierte Muskulatur und Haut aus dem Situs herauszuhalten.
- Identifizieren Sie den 11. Brustwirbel (Th) und setzen Sie die Lamina des Wirbelbogens frei, indem Sie darüber liegendes Gewebe sowie den spinösen Prozess mit einem Rongeur entfernen.
- Führen Sie eine Laminektomie mit einem Mikrobohrer und einem geeigneten Grat durch, um ein kleines Loch in die Lamina zu bohren, etwas größer als die Spitze des Stoßsops. Um Schäden am Rückenmark zu vermeiden, dünnen Sie die Lamina nur aus, während Sie das Loch mit einem Rongeur öffnen und vergrößern. Wenn das Periostnoch intakt ist, entfernen Sie es vorsichtig mit einer scharfen spitzen Sonde, ohne die Dura mater zu beschädigen.
- Nachdem Sie sichergestellt haben, dass ein ausreichend großes Loch gemacht wird, ohne die Lamina zu destabilisieren, halten Sie die Wirbelsäule des Tieres an Ort und Stelle, indem Sie sie rostral und kauarisch mit den stabilisierenden Zangen des Stoßstoßes an Th11 klemmen. Positionieren Sie die Stahlstange mit den Handrädern vorne und seitlich 3–5 mm über dem Laminektomieloch. Schließlich unterziehen Sie alle Tiere einem Aufprall mit einer definierten Kraft von 150 Kilodyne, um einen leichten bis mittelschweren Grad der Rückenmarkskontusionsverletzung zu induzieren4.
- Führen Sie den Wundverschluss in anatomischen Schichten mit Polyglactin 4:0 oder 5:0 unterbrochenen Nähten und einem chirurgischen Nadelhalter durch. Reinigen Sie die Wunde gründlich, indem Sie sie vorsichtig mit einem Gazepad abwischen, das in sterilen 0,9% NaCl eingeweicht ist.
- Nach der Operation bringen Sie die Tiere in ihren heimischen Käfig zurück und schützen Sie sie vor Licht- und Schallexposition. Überwachen Sie das Verhalten der Tiere bis zum postoperativen Tag (DSB) 7 genau und sorgen Sie für eine ausreichende Nahrungs- und Wasseraufnahme. Bei Bedarf zusätzliche Flüssigkeit durch subkutane Injektionen (z. B. 10 ml NaCl 0,9%).
- Bieten Sie postoperative Analgesie für mindestens 2 Tage mit z.B. Opioiden (0,05 mg/kg Körpergewicht Buprenorphin subkutan (s.c.)) und/oder Antipyretika (4 mg/kg Körpergewicht Carprofen s.c.). Falls erforderlich, und im Fall des SCI-Modells, bieten auch postoperative Antibiotika-Therapie (7,5 mg/kg Körpergewicht Enrofloxacin per os (p.o.)).
- Im Falle einer Rückenmarksverletzung, manuell leeren Sie die Blase der Ratte, bis spontanes Wasserlassen zurückkehrt.
4. Wiederherstellung von chirurgischen Eingriffen vor der Ganganalyse
HINWEIS: Ratten mit Ischiasnervenverletzungen zeigen die Tendenz, an ihren Hinterpfoten zu nagen, da die schmerzhafte Neuropathie nach einer Nervenverletzung zubeginn ist. Diese Form der Automutilation kann zu einer Autoamputation von Zehen oder Teilen der jeweiligen Hinterpfote führen. Bevorzugen Sie Lewis-Ratten gegenüber anderen Rattenstämmen, wenn Sie das Ischias-Nervenverletzungsmodell verwenden, da dieser Rattenstamm eine geringere Tendenz zur Automutilation31zeigt. Ratten mit Ischiasnervenverletzungen zeigen auch die Tendenz, Kontrakturen der operierten Gliedmaße zu entwickeln, was zu ihrem Ausschluss von der Studie aufgrund von Eingriffen in die Datenerfassung führen könnte. Solche unerwünschten Ereignisse treten weit weniger häufig bei Ratten mit Femoralverletzungen auf.
- Untersuchen Sie operierte Tiere täglich nach der Operation mit besonderem Augenmerk auf den Status ihrer Gliedmaßen bzw. Pfoten.
HINWEIS: Bei Ratten mit GG kann auf der Höhe von Th11 Einfeiner oder rektaler Prolaps aufgrund der Beeinträchtigung der natürlichen Fähigkeit der Tiere, zu urinieren und zu defätieren, auftreten. Diese Ereignisse werden allgemein als menschliche Endpunkte der Studie definiert und implizieren den sofortigen Ausschluss des betroffenen Tieres von der Studie. - Setzen Sie die postoperative Analgesie fort, bis Ratten keine schmerzbedingten Symptome mehr zeigen.
- Bei anhaltenden Schmerzen Gabapentin (30–120 mg/kg Körpergewicht) p.o. zur Behandlung neuropathisber Schmerzen verabreichen.
5. Vorbereitung vor der durchführung der automatisierten Ganganalyse
HINWEIS: Die Methodik des Ganganalysesystems basiert auf der Erfassung der Tiere von unten beim Überqueren einer Glasplatte, die durch ein grünes LED-Licht beleuchtet wird. Wenn die Pfoten der Tiere auf den Boden kommen, wird der Bereich des Pfotenabdrucks beleuchtet und von einer Hochgeschwindigkeits-Videokamera aufgezeichnet. Diese Daten werden dann über ein Ethernet-Kabel an einen Computer mit der Ganganalysesoftware gesendet. Während einzelne Footprints vom Experimentator manuell klassifiziert werden können, verfügt die neueste Softwareversion auch über eine automatische Footprint-Klassifizierung.
- Führen Sie alle Prüfverfahren im Dunkeln und in Ermangelung störender Geräusche durch. Da Ratten in der Lage sind, Überschallfrequenzen wahrzunehmen, überprüfen Sie auch, dass keine Quellen solche Geräusche aussenden.
HINWEIS: Führen Sie Eine Ganganalyse entweder wöchentlich oder jede zweite Woche durch, aber testen Sie Ratten nicht zu häufig, da vor allem Lewis-Ratten im Laufe der Zeit das Interesse an der Teilnahme an dem Verfahren verlieren, wenn sie einer bestimmten Übung zu häufig ausgesetzt sind. Es ist jedoch erforderlich, Ratten täglich für 5 Tage vor der Operation zu trainieren, um sie an die Testumgebung und das Verfahren zu akklimatisieren. - Bereiten Sie während der Trainingseinheiten und am Testtag den Verhaltenstestraum vor, indem Sie alle Lichtquellen ausschalten, die andernfalls die Kamera des automatisierten Ganganalysegeräts stören könnten. Platzieren Sie den Computerbildschirm, der für die Datenerfassung von der Kamera entfernt ist, um zu verhindern, dass das Licht die Kamera beeinträchtigt.
- Stellen Sie sicher, dass das Gerät in einer stabilen Position und in einer Weise installiert ist, die jede Form von Vibrationen verhindert, da dies den Datenerfassungsvorgang ernsthaft beeinträchtigt.
- Bringen Sie die Ratten in den Verhaltenstestraum und akklimatisieren Sie sie mindestens 30 min vor dem Test in ihrem eigenen Käfig.
HINWEIS: Tragen Sie beim Umgang mit den Tieren persönliche Schutzausrüstung wie ein OP-Kleid oder laborkleidung, Handschuhe und eine Maske.
6. Durchführung einer automatisierten Ganganalyse
- Schulungen
HINWEIS: Während des Trainings durchlaufen die Tiere eine Lernkurve, daher wird empfohlen, den Trainingsplan schrittweise anzupassen. Verwenden Sie Lebensmittelbelohnungen (z. B. 1–2 Stück Frühstücksflocken), um die Tiere nach erfolgreichem Abschluss jeder Trainingseinheit zu belohnen.- Heben Sie das Tier am ersten Trainingstag vorsichtig an, indem Sie es unter seinem Stamm halten und sanft zum Eingang des Gehwegs tragen.
- Legen Sie das Tier in den Eingangsbereich und lassen Sie es die Öffnung des Korridors ohne Einmischung der Person, die das Testverfahren durchführt, erkunden.
HINWEIS: Schreien, pfeifen, blasen oder stechen Sie das Tier nicht, um es zu motivieren, den Gehweg zu überqueren. All dies wird das Tier stark belasten und das Datenerfassungsverfahren weiter erschweren. - Warten Sie, bis das Tier freiwillig den Gehweg überquert, um seinen Heimatkäfig zu erreichen. Manchmal, vor allem bei untrainierten Tieren, kann dies bis zu mehreren Minuten dauern. Am ersten Trainingstag wird das Tier weder erwartet noch benötigt, um ununterbrochene Läufe mit gleichmäßiger Gehgeschwindigkeit zu machen. Stattdessen sollte es sich mit dem Prüfgerät und verfahren akklimatisieren.
- Am zweiten Trainingstag gewöhnen Sie tiere, ohne zu zögern den Gehweg zu betreten und auch ohne zu zögern in ihren heimischen Käfig zurückzukehren. Einige Tiere werden wahrscheinlich schon gelernt haben, den Gehweg ohne Unterbrechungen zu überqueren, aber das ist am Ende des zweiten Tages noch nicht erforderlich.
- Achten Sie am dritten Trainingstag darauf, dass die Tiere lernen, den Gehweg ohne Zuzögern, Schnüffeln oder auf andere Weise explorative Bewegungen zu überqueren. Stellen Sie sicher, dass sie mit gleichmäßiger Geschwindigkeit gehen.
- Wiederholen Sie am vierten und fünften Trainingstag die vorherige Übung, um das Testverfahren zu konsolidieren.
HINWEIS: Falls ein Tier bis zum Ende der 5-tägigen Trainingszeit nicht die erforderliche Fertigkeit erworben hat, um den Gehweg richtig zu überqueren, fügen Sie 2 zusätzliche Trainingstage hinzu (z. B. das Wochenende). Erwägen Sie auch, bis zu 3 Trainingseinheiten pro Tag durchzuführen, getrennt durch mindestens 2 H Ruhe zwischen den einzelnen Sitzungen. In 95 % der Fälle wird das Tier bis zum Ende dieser verlängerten Ausbildungszeit die erforderliche Ausbildungserfahrung erworben haben. In dem seltenen Fall, dass ein Tier diese Fähigkeit nach 7 Tagen Training noch nicht erworben hat, wird empfohlen, die geplante experimentelle Operation um mindestens 1 Woche zu verschieben und das oben erwähnte Trainingsregime zu wiederholen.
7. Datenerfassung
HINWEIS: Das Ganganalysesystem visualisiert jeden Pfotenabdruck während des Gehens des Tieres und analysiert automatisch verschiedene Gangparameter wie Paw Print Area, Paw Print Intensity, Paw Swing Time und Paw Swing Speed (Tabelle 1). Wenn das Ganganalysesystem alle Daten basierend auf der Intensität aufzeichnet, die durch die Pfotenabdrücke der Tiere erzeugt wird, stellen Sie sicher, dass die Kameraeinstellungen an das Gewicht und die Größe der Ratten angepasst werden. Stellen Sie außerdem sicher, dass der Gehweg vor der Datenaufzeichnung trocken und sauber ist, um jeglichen Einfluss auf die Datenerfassung zu vermeiden.
- Vor der Erfassung von Daten, reinigen Sie den Gehweg mit kommerziellen Glasreiniger und ein Rakel. Sprühen Sie die Glasplatte mehrmals und wischen Sie sie dann mit dem Rakel ab, um Partikel von ihrer Oberfläche zu entfernen. Reinigen Sie auch die darunter liegende. Achten Sie darauf, Flüssigkeit von den Enden des Gehwegs zu entfernen, da die Tiere sonst darauf treten könnten, was sich auf die aufgezeichneten Daten auswirken würde.
- Wiederholen Sie den Reinigungsvorgang, wann immer dies erforderlich ist, z. B. kontaminationen Sie den Gehweg und vor der Aufzeichnung der Daten einer Ratte aus einem anderen Käfig. Dies soll verhindern, dass das Tier durch den Duft seiner Konspezifen abgelenkt wird.
- Passen Sie vor der allerersten Datenerfassung die Kameraeinstellungen an das Gewicht der Tiere an. Bestätigen Sie dies, indem Sie das leichteste und schwerste Tier auf den Gehweg stellen und wählen Sie eine Kameraeinstellung, die in beiden Fällen eine gute Datenqualität ermöglicht. Passen Sie den Kameragewinn, die rote Deckenleuchte, die grüne Gehwegleuchte und die Grüne Intensitätsschwelle (GIT) an, um eine optimale Erkennung des Paw-Drucks zu gewährleisten.
HINWEIS: Ändern Sie die gewählten Einstellungen nicht, nachdem die Datenerfassung begonnen hat, da dies die Vergleichbarkeit der erfassten Daten behindert. Ausnahmsweise kann das GIT während der Datenklassifizierung geändert werden, dies muss jedoch für alle Versuche einheitlich erfolgen. - Definieren und kalibrieren Sie den Gehweg mit dem mitgelieferten Kalibrierblatt.
- Wählen Sie eine registrierte Kamera aus, die auf der Registerkarte Setup aufgeführt ist.
- Klicken Sie auf die Schaltfläche "Akquisition öffnen", die Sie auf der Registerkarte Acquire finden.
- Erstellen Sie eine Momentaufnahme des leeren, gereinigten Gehwegs, der während des folgenden Datenerfassungsverfahrens als Referenz verwendet wird.
- Beachten Sie, dass sich der Status von Warten auf Snapshot zu Bereit für die Erfassungändert.
- Klicken Sie auf die Schaltfläche "Erfassung starten" und beachten Sie die Statusänderung von Bereit für die Anschaffung zu Warten auf Ausführen zum Start.
- Legen Sie eine Ratte auf den Gehweg und folgen Sie der Bewegung des Tieres auf dem Computerbildschirm. Beachten Sie die Statusänderung von Warten auf Ausführen zu Starten zu Aufnahmelauf.
HINWEIS: Die Software klassifizieren automatisch Läufe, die sie für konform hält, entsprechend voreingestellten Ausführungsmerkmalen mit einem grünen Symbol, während nicht konforme Durchläufe mit einem roten Symbol gekennzeichnet werden. Die Software stoppt automatisch die Datenerfassung, wenn drei konforme Durchläufe aufgezeichnet wurden, aber die Datenerfassung kann fortgesetzt werden, indem Sie erneut auf die Schaltfläche "Erfassung starten" klicken.
8. Datenklassifizierung
HINWEIS: Eine Liste der AGA-Ergebnisparameter finden Sie in Tabelle 1. Mindestens drei regelkonforme Läufe sind erforderlich, bei denen das Tier den Gehweg ohne zu zögern stetig überqueren muss27. Darüber hinaus sollten die Laufgeschwindigkeiten innerhalb der gleichen Kategorien übereinstimmen, wie sie in der Literatur30definiert sind.
- Klicken Sie auf die Schaltfläche Klassifizieren im Experimentellen Explorer der jeweiligen Studien, die klassifiziert werden sollen.
- Spielen Sie den erworbenen Lauf mit normaler Geschwindigkeit, um einen Eindruck davon zu erhalten, ob die Daten den zuvor aufgeführten Anforderungen entsprechen.
- Klicken Sie in der linken oberen Ecke auf die Schaltfläche Auto Klassifizieren für die automatische Klassifizierung von Pfotenabdrücken durch die Software.
HINWEIS: Obwohl die Software eine hohe Rate der korrekten Pfotenklassifizierung hat, versäumt es sie manchmal, den Drucken eine Pfote zuzuweisen oder die falsche Pfote zuzuweisen. Überprüfen Sie daher immer die automatisch klassifizierten Pfotenabzüge nach. - Für die korrekte Berechnung von Normal Step Sequence Patterns (NSSPs) stellen Sie sicher, dass der Klassifizierungsalgorithmus nicht durch nicht sichtbare Pfotenabdrücke verwechselt wird, was zu fehlerhaftem NSSP führt (Abbildung 1A). Schließen Sie daher nur die Pfotenabdrücke ein, die nachweisbar sind, während die kontralaterale Pfote auch für NSSP-Berechnungen sichtbar ist, z.B. die linke Vorderpfote (LF) und die rechte Hinterpfote (RH) (Abbildung 1B).

Abbildung 1: Beispielhafte AGA-Daten, die die Notwendigkeit einer manuellen doppelten Überprüfung der korrekten Datenklassifizierung belegen. Für den Fall, dass eine erkannte Platzierung einer Vorderpfote durch die erkannte Platzierung einer anderen Vorderpfote (A) gelingt, könnte die AGA-Software dies mit einem unkoordinierten Gehmuster verwechseln, da keine Hinterpfoten erkannt wurden. Daher wird empfohlen, immer zu überprüfen und einen anfänglichen Pfotenabdruck auszuwählen, der erkannt wird, wenn die kontralaterale Pfote auch sichtbar ist (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
9. Berechnung von Statistiken
ANMERKUNG: Um Laufdaten für Gewichtszunahme-bezogene Veränderungen im Laufe der Zeit anzupassen, wird dringend empfohlen, ein Verhältnis der experimentellen Pfote mit einer nicht-experimentellen (z. B. Kontrollpfote) zu berechnen. Berechnen Sie zusätzlich das Verhältnis zu den präoperativen Werten dieses Pfoten-zu-Pfoten-Vergleichs unter Berücksichtigung individueller Unterschiede im Pfotenverbrauch.
- Klicken Sie auf die Schaltfläche Statistik anzeigen, um einen umfassenden Überblick über die Laufstatistiken zu erhalten.
- Wählen Sie Datei und Export aus, um entweder Ausführungsstatistiken oder Teststatistiken in eine Tabellenkalkulationssoftware zu exportieren.
Ergebnisse
12 Ratten unterziehen sich einer experimentellen peripheren Nervenoperation. Die ischitische Nervenresektion (Abbildung 2A) wurde bei 7 Ratten durchgeführt, während die femorale Nervenneurotmese (Abbildung 2B) bei 5 Ratten induziert wurde. Bei allen Tieren wurde der Nervendefekt mittels eines autologen Nerventransplantats rekonstruiert. Rückenmarkskontusionsverletzung (Abbildung 2C) auf Ebene Th11 wurde bei 6 Ratten induziert, was zu insgesamt 18 Ratten führte.
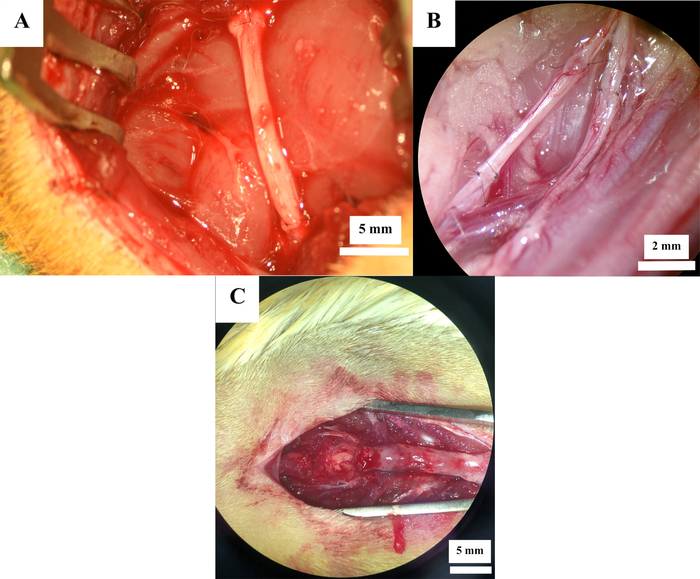
Abbildung 2: Operative Standorte nach Nervenrekonstruktion. Nervenrekonstruktion mit Autotransplantaten im Ischiasnerv (A) und Oberschenkelnerv (B) sowie nach Rückenmarkskontusionsverletzung (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Alle Tiere erholten sich gut von der Operation und es kam zu keinen Fällen von Selbstverstümmelung. Ein Tier der Ischiasnervenverletzungsgruppe entwickelte im Laufe der postoperativen Beobachtungsphase starke Kontrakturen der rechten Hinterpfote und musste von der weiteren Datenanalyse ausgeschlossen werden.
Ischiasnervenneurotmese
Da der Ischiasnerv den Großteil des Hinterbeins muskulös und sensorisch innerviert, führt seine Resektion zu einer schweren Beeinträchtigung der Bewegungsfunktion. Nach einer Verletzung verwenden Ratten die Ferse der Pfote nur zur Gewichtsstütze(Abbildung 3B-E) und die Gliedmaße wird in einer schwungvollen Umlaufbewegung bewegt. Daher werden die über AGA bewerteten Bewegungsveränderungen durch eine deutlich reduzierte Druckfläche (Abbildung 4A) und eine deutlich erhöhte Schwingzeit (Abbildung 4B) sichtbar. Beide Parameter wurden im Vergleich zu DenOP-Messungen am Ende des Beobachtungszeitraums noch deutlich verändert. Bemerkenswert ist, dass ein Tier ab der Postoperativen Woche (WPO) 10 starke Kontrakturen der rechten Hinterpfote entwickelte. Dies führte zu einer Erhöhung der Druckfläche der rechten Hinterpfote auf mehr als 150% im Vergleich zur linken Pfote bei WPO12 (Abbildung 5). Da dies im Vergleich zu allen anderen in dieser Studie bewerteten Tieren ein Extremum war, haben wir dieses Tier von der Datenanalyse in Bezug auf die Druckfläche ausgeschlossen.

Abbildung 3: Repräsentative Pfotenabdrücke vor und nach kritischer Größenresektion des rechten Ischiasnervs und der Autograftreparatur. Beachten Sie die starke Abnahme des Druckbereichs nach einer Nervenverletzung (B) im Vergleich zu präoperativ (A). Trotz eines leichten Anstiegs der Druckfläche im Beobachtungszeitraum (C-E) blieben die Pfotenabdrücke der rechten Hinterseite gegenüber den Basisaufnahmen deutlich verändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Der Verlauf der funktionellen Erholung nach kritischer Größenresektion und Autograft-Reparatur des Ischiasnervs. Das Druckflächenverhältnis (A) und das Swing Time Ratio (B) wurden unmittelbar nach der Ischiasnervenresektion statistisch signifikant von den Pre-OP-Werten geändert. Während die Druckfläche im Vergleich zum Ausgangswert bis WPO10 deutlich zurückblieb, wurde Swing Time bei WPO12 noch deutlich auf Pre-OP-Werte erhöht. *: p < 0,05 im Vergleich zu Pre-OP, **: p < 0,01 im Vergleich zu Pre-OP. Fehlerbalken geben ± Standardfehler des Mittelwerts (SEM) an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Boxplot des Verlaufs des Druckbereichs nach einer Ischiasnervverletzung. Beachten Sie das Extremum (rote Ellipse) bei WPO12, was durch die Tatsache erklärt wird, dass ein Tier starke Kontrakturen der rechten Hinterpfote ab WPO10 entwickelt hat. Das Tier wurde daher von der statistischen Analyse in Abbildung 4ausgeschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Femorale Nervenneurotmese
Femorale Nervenresektion führt zu Denervation des Quadrizepsmuskels des Oberschenkels33,34. In der Folge ist die Knieverlängerung beeinträchtigt, was zu einer Hyperflexion des Sprunggelenks mit konsegem Heben der Ferse der Pfote führt. Daher wird der Druckbereich der jeweiligen Pfote (Abbildung 6B) nach der Operation stark reduziert. Die Druckfläche der linken Hinterpfote wird durch eine kompensatorische Gewichtsverlagerung nach links vergrößert. Dies sollte berücksichtigt werden, da dieses Phänomen direkt das berechnete Verhältnis zwischen der "experimentellen" und der "Kontrollpfote" beeinflusst. Ausgehend von WPO4 führt die Reinnervation der Quadrizeps durch den regenerierenden Oberschenkelnerv zur Umkehrung dieser Veränderungen, was zu einer erhöhten Paw-Druckfläche der rechten Hinterpfote führt (Abbildung 7A). Da der Quadrizepsmuskel des Oberschenkels auch in der Schwingphase der jeweiligen Pfote eine Rolle spielt, wird Swing Time (Abbildung 7B) bei Ratten mit Oberschenkelnervenverletzungen stark verlängert. Die Swing-Zeit spiegelt die Rückkehr des Druckbereichs wider, während der regenerierende Oberschenkelnerv den Quadrizepsmuskel des Oberschenkels erreicht. Bei WPO10 kehrten beide Parameter des Ganges zur Baseline zurück und signalisierten eine vollständige funktionale Wiederherstellung.

Abbildung 6: Repräsentative Pfotenabdrücke. Repräsentative Pfotenabdrücke vor (A) und folgenden (B-E) rechten Femoral Nervenresektion und Autograft Reparatur. Die Druckfläche des RH ging bei WPO2 (B) stark zurück, während eine Zunahme der Druckfläche der linken Hinterpfote (LH) aufgrund der erhöhten Gewichtsbelastung sichtbar wurde. RH Print Area begann ab WPO6 (C) zu wachsen, begleitet von einer Abnahme der Druckfläche von LH. Bei WPO8 (D) und WPO10 (E) hat sich die Druckfläche von RH wieder in der Nähe der präoperativen Werte erholt. (Angepasst mit Genehmigung von Heinzel et al.22, lizenziert unter CC BY 4.0.) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
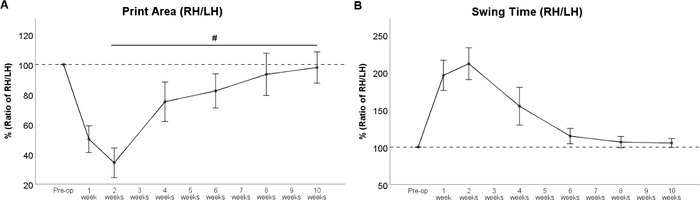
Abbildung 7: Der Verlauf der funktionellen Erholung nach 7-mm-Resektion und Autograft-Reparatur des Oberschenkelnervs. Der Verlauf des Druckbereichsverhältnisses (A) und des Swing Time Ratio (B) zeigte unmittelbar nach der Femoralnervenresektion eine starke Veränderung, aber die Werte erholten sich wieder auf präoperative Werte bei WPO8. Nr.: p < 0,05. Fehlerbalken geben den Mittelwert ± SEM an. (Angepasst mit Genehmigung von Heinzel et al.22, lizenziert unter CC BY 4.0.) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Rückenmarkskontusion
Die Gait-Analyse ergab deutlich veränderte Pfotenabdrücke nach einer Brustmarkskontusionsverletzung (Abbildung 8), am bemerkenswertesten eine Dekremente im Druckbereich und eine deutliche innere Drehung der Hinterpfoten bei WPO2 (Abbildung 8B). Bemerkenswert ist, dass die Pfotenrotation auch als bewertbares Merkmal im BBB implementiert wird, was die Anwendbarkeit einer computergestützten Ganganalyse zur Bewertung von Gangänderungen unterstreicht, die ursprünglich mit Open Field-Tests bewertet wurden. Was den Verlauf der einzelnen Gangparameter betrifft, so führte die Rückenmarkskontusion auf der Ebene Th11 zu einer Abnahme des Druckflächenverhältnisses (Abbildung 9A) und des Inkrements des Swing Time Ratio (Abbildung 9B). Beide Parameter tendierten im weiteren Verlauf des Beobachtungszeitraums in Richtung Ausgangswerte, aber es gab keine statistisch signifikanten Veränderungen, die beobachtbar waren. Der koordinationsbezogene Parameter Regularity Index (Abbildung 9C) ging ebenfalls bei WPO2 zurück, aber der Grad variierte stark zwischen den Tieren. Es tendierte auch zu präoperativen Werten bis WPO16. Basis der Unterstützung der Hinterpfoten (Abbildung 9D), ein allgemeiner Parameter des Ganges nach Deumens, zeigte einen deutlichen Anstieg, der statistisch signifikant von WPO10 bis WPO14 war. Er tendierte in Richtung Basiswerte bei WPO16 und wurde zu diesem Zeitpunkt nicht mehr signifikant vom Pre-OP-Wert geändert.

Abbildung 8: Repräsentative Pfotenabdrücke der beiden Hinterpfoten. Pfotendrucke präoperativ (A) und nach einer Brustmarkskontuskontusverletzung (B-F). Beachten Sie die Reduzierung der Druckfläche ab WPO2 (B) begleitet von einer bemerkenswerten inneren Drehung der Pfoten. Im Laufe des Beobachtungszeitraums (C–F) ist ein Inkrement des Druckbereichs ebenso beobachtbar wie die Freigabe der inneren Drehung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
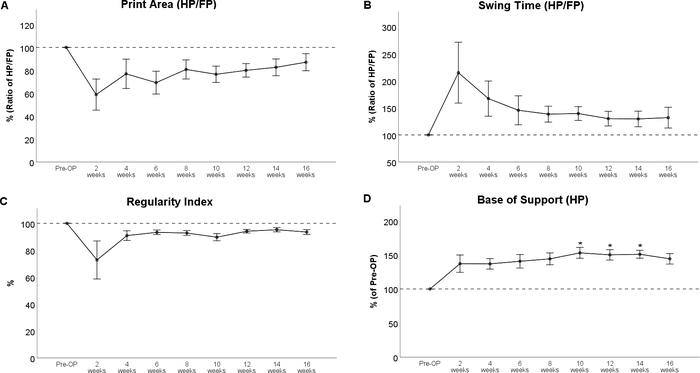
Abbildung 9: Rückenmarkskontusion auf der Ebene Th 11. Die Rückenmarkskontusion an Th 11 führte zu beobachtbaren Veränderungen des Druckflächenverhältnisses (A) und der Swing Time (B) und des Regularity Index (C), aber diese Änderungen waren statistisch nicht signifikant. Nach der Verletzung zeigte die Basis der Unterstützung der Hinterpfoten einen deutlichen Anstieg im Vergleich zum Ausgangswert, was bei WPO10 bis WPO14 statistisch signifikant war. *: p < 0,05 im Vergleich zu Pre-OP. Fehlerbalken geben den Mittelwert ± SEM an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei 1: Details zur Fehlerbehebung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Bewertung der funktionellen Verwertung in Tiermodellen von PNI und SCI bleibt aufgrund der großen Vielfalt an Bewertungsmethoden mit individuellen Vor- und Nachteilen eine Herausforderung. Nur wenige Ansätze wurden in mehreren Modellen von peripheren und zentralen Nervenverletzungen getestet und validiert, obwohl vielversprechende neue Techniken, die Bewegungsverfolgung und maschinelles Lernen kombinieren, die neurobehaviorale Forschung potenziell auf die nächste Stufe der funktionellen Tests treiben könnten. Wir sind davon überzeugt, dass sich bald modernste Methoden herausstellen werden, die im Großen und Ganzen auf eine Vielzahl von Tier- und Verletzungsmodellen anwendbar sind. Angesichts dieser Überlegungen besteht einer der Vorteile von AGA in der Möglichkeit, die funktionelle Erholung in mehreren Modellen von Nervenverletzungen mit nur einem Gerät zu bewerten. Seit den frühen 2000er Jahren wird dieser Ansatz in experimentellen Modellen von PNI wie dem ischitischen37, peronealenwerten 38, und femoralen Nervenverletzung Modell22 sowie nach Wurzelavulsion sowohl der Lenden39 und der Brachialplexus40verwendet . Verschiedene zentrale Nervenverletzungen einschließlich Rückenmarksprellung wurden auch mit der Methode41,42untersucht. Mit diesem Beitrag haben wir ein detailliertes Protokoll vorgestellt, wie man drei häufig untersuchte Nervenverletzungen induzieren kann und wie wir die funktionelle Genesung anschließend bewerten können. Unserer Meinung nach wäre eine praktische Leitlinie für Forscher, die sich für den Bereich experimentelle Rinnsamung, Reparatur und Regeneration interessieren, wie die vorteilhaften Merkmale der Methode optimal genutzt werden können, von großer Hilfe.
Mehrere Autoren haben das Potenzial von AGA angesprochen, die funktionelle Erholung bei Nagetieren zu bewerten, und den Vorteil der Methode hervorgehoben, gleichzeitig Gangparameter im Zusammenhang mit motorischer und sensorischer Reinnervation zu bewerten27,28. Zusätzlich ermöglicht der Vergleich von Daten von einer experimentellen Pfote, z.B. rekonstruierte Nervenverletzungen an einer nicht operierten Pfote, wie in beiden vorgestellten Modellen gezeigt wurde, die Aufnahme einer intratierischen Positivkontrolle. Umgekehrt könnte eine operierte Pfote ohne chirurgische Rekonstruktion oder zusätzliche Behandlung als innertierische Negativkontrolle dienen. Es wurde auch gezeigt, dass es möglich ist, AGA mit machine learning Ansätzen zu kombinieren43. Trotz der Vorteile der Methode hat sie auch einige Einschränkungen und Nachteile, wie die zeitaufwändigen Trainingsanstrengungen, die obligatorisch sind, um das Tier an das Erwerbsverfahren zu gewöhnen28,44. Eine weitere Einschränkung von AGA ist die maximale Größe der Tiere, die aufgrund der begrenzten Abmessungen des Geräts für die Prüfung in Frage kommen. Daher ist die Verwendung von AGA derzeit auf Tiere von der Größe von Nagetieren und Frettchen45beschränkt. Darüber hinaus können kürzlich neue neurobehaviorale Bewertungsansätze im Bereich motion tracking, die maschinell lernen können, AGA sowohl in der Vollständigkeit als auch in möglichen Anwendungen18,19,46übertreffen. Am bemerkenswertesten, aber in Übereinstimmung mit anderen Bewertungsmethoden, scheint es, dass die funktionelle Erholung, die von AGA beurteilt wird, stark begrenzt ist – wenn auch sogar auftretend – in Modellen der Ischiasnervenneurotmese47,48. Auf der anderen Seite ermöglicht AGA eine umfassende Auswertung des Verlaufs der funktionellen Erholung nach der femoralen Nervenneurotmese, wie unsere Daten zeigen. Mit dieser Arbeit haben wir gezeigt, dass Paw Print Area ein repräsentativer Gangparameter ist, der über AGA bewertbar ist, der beispielhaft für den Verlauf der funktionellen Erholung in den beiden von uns vorgestellten peripheren Nervenverletzungsmodellen ist. Während die funktionelle Wiederherstellung ad integrum nach der Autograft-Reparatur des Oberschenkelnervs beobachtbar war, wurden die AGA-Parameter am Ende des Beobachtungszeitraums nach der Autograft-Reparatur des Ischiasnervs noch signifikant von der Ausgangsbasis geändert. Es ist in diesem Zusammenhang bemerkenswert, dass Gliedmaßenkontrakturen ein häufiges Phänomen bei Ratten mit Ischiasnervenverletzungen sind und Vorsicht geboten ist, um diese Anzeichen von Muskelungleichgewicht und Lähmung nicht mit der fortschreitenden funktionellen Erholung zu verwechseln32. Dies unterstreicht einerseits die Unfähigkeit der AGA-Methode, eine signifikante funktionelle Erholung nach Einer Neurotmese-Verletzung in diesem Modell zu erkennen. Andererseits wirft es die Frage auf, ob es möglich ist, das Ischiasnervenverletzungsmodell der Ratte, das immer noch das am häufigsten verwendete experimentelle Nervenreparaturmodell ist, mittels Ganganalyse im Allgemeinen zu bewerten, falls die Nervenverletzung schwerer ist als Axonotmesis48. Details zur Fehlerbehebung finden Sie in der Zusatzdatei 1.
Wir haben auch beispielhafte Daten über den Einsatz der Methode zur Bewertung der Bewegungsfunktion bei Ratten mit Rückenmarksverletzung zur Verfügung gestellt, was ohne erforderliche Änderungen des Hardware-Setups oder -erfassungsverfahrens möglich ist. Das gleiche Prinzip gilt für andere Nagetiermodelle der zentralen Nervenverletzung (CNI)26,49,50 und Wurzelavulsion Verletzungen. Im Gegensatz zu isolierten PNIs sind Verletzungen des Rückenmarks in ihren pathophysiologischen Folgen viel komplexer, da eine Vielzahl von sehr wichtigen Strukturen beschädigt sind, die effedünne Bahnen wie den Kortikospinal- und Rubrospinaltrakt und die affebralen Bahnen wie die dorsalen Säulen und spinothalamischen Traktate35. Die Herausforderung, diese pathologischen Veränderungen angemessen zu bewerten, spiegelt sich in der umfassenden Bewaffnung von Verhaltenstests wider, wie Basso, Beattie und Bresnahan (BBB)36Punkte. Der Gangparameter Base of Support hat berichtet, dass er nach zentralen Nervenverletzungen zunimmt, höchstwahrscheinlich, um einen resultierenden instabilen Gang zu berücksichtigen. Die Basis des Supports wurde von Derbbasis von WPO10 auf WPO14 in unserem Modell erheblich geändert, was unsere Vermutung bestätigt, dass dieser Parameter eine Beurteilung des Verlaufs der funktionellen Erholung durch AGA nach einer Verletzung der Brustmarkskontusion ermöglicht.
Wir sind überzeugt, dass AGA ein praktikables Instrument ist, um die funktionelle Erholung bei Nagetieren mit Verletzungen des Nervensystems zu bewerten. Dennoch empfehlen wir, die beobachteten Gangwechsel in jedem Versuchsaufbau sorgfältig und gründlich zu reflektieren. Änderungen der Gangparameter, z.B. eine Vergrößerung der Druckfläche nach einer sofortigen postoperativen Dekrementierung oder eine Abnahme der Swing Time, die eine sofortige postoperative Erhöhung dieses Parameters im Laufe des Beobachtungszeitraums vorannimmt, beziehen sich nicht zwangsläufig auf die funktionelle Wiederherstellung. Stattdessen können diese Veränderungen auch mit einer möglichen funktionellen Anpassung zusammenhängen, um einen unauffälligen Gang aufrechtzuerhalten, da Ratten eine Beuteart sind und versuchen, Schmerzen oder Behinderungen gegenüber potenziellen Raubtieren zu vermeiden51. Es wird daher empfohlen, die automatisierte Ganganalyse als ergänzendes Instrument zu verwenden, um Gangänderungen mit anderen Ergebnismessungen der peripheren Nervenverletzung und Regeneration in Beziehung zu setzen21. Wie bereits erwähnt, sind wir auch der Meinung, dass es sorgfältig reflektiert werden sollte, wenn Nagetiere mit Ischiasnervneurotmese mittels AGA untersucht werden sollten, da unser Befund stark darauf hindeutet, dass die funktionelle Erholung in diesem Fall stark eingeschränkt ist.
Wie unsere Arbeit zeigt, ist der Hauptvorteil von AGA die Möglichkeit, sowohl die motorische als auch die sensorische Reinnervation in einer Vielzahl von experimentellen PNI-Modellen sowie CNI zu untersuchen und dabei nur ein Setup zu benötigen. Daher ist die Methode unserer Meinung nach ein sehr wertvolles Werkzeug für umfassende neurobehaviorale Tests. Eines der Aktivposten der AGA, das die Möglichkeit ist, die motorische und sensorische Reinnervation in verschiedenen Tiermodellen von PNI und CNI zu untersuchen, während nur ein Setup erforderlich ist, ist unserer Meinung nach der Hauptvorteil der Methode im Vergleich zu anderen Bewertungsmethoden zur Untersuchung der funktionellen Erholung, wie z. B. Der Walking-Track-Analyse52, von Frey testet53oder Gangkinematik16. Das Potenzial, gleichzeitig Gangveränderungen zu bewerten, die entweder mit den Ergebnissen elektrophysiologischer Untersuchungen des reinvierten Muskels22 oder Mitbewertungsmethoden für die Sensorikfunktion54 korrelieren, ist im Hinblick auf zukünftige Anwendungen der Methode vielversprechend. Wir empfehlen daher die Verwendung von AGA zur Untersuchung der funktionellen Rückgewinnung in Nagetiermodellen von Vorderbeinen PNI, wie dem Ulnar-, Radial- oder Mediannerv oder den experimentellen Nerventransfermodellen55, die bei dieser Methode noch nicht untersucht wurden.
Wir liefern hiermit ein detailliertes Protokoll, wie die automatisierte Ganganalyse verwendet werden kann, um die funktionelle Erholung in drei Nagetiermodellen von Nervenverletzungen zu untersuchen. Während die Methode eine sorgfältige Berücksichtigung verschiedener Schlüsselaspekte wie angemessenes Training und sorgfältige Hard- und Softwarekalibrierung erfordert, ist sie ein praktikables und wertvolles ergänzendes Werkzeug, um die Nervenregeneration in Nagetiermodellen zentraler und peripherer Nervenverletzungen zu bewerten.
Offenlegungen
Die Autoren erklären, dass dieses Werk von Noldus Inc. durch die Berichterstattung über die Open-Access-Publikationsgebühr unterstützt wurde. Keiner der Autoren erhielt ein persönliches Gehalt oder irgendeine Art von finanziellem Trinkgeld. Die Autoren haben keine anderen konkurrierenden Interessen zu erklären.
Danksagungen
Die Autoren danken Karin Brenner für ihre leidenschaftliche Pflege der Tiere. Die Autoren danken auch Claudia Keibl, James Ferguson, Gabriele Leinfellner und Susanne Drechsler für ihre Unterstützung bei den experimentellen Operationen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | B. Braun Austria | 3570410 | Vehicle for drug delivery |
| 1 ml syringe | B. Braun Austria | 9161708V | Injecting device |
| 10 ml syringe | B. Braun Austria | 4606728 V | Injecting device |
| 1-Propanol, 2-Propanol, Hexetidin | Gebro Pharma | N/A | Alcoholic skin disinfection |
| 23-gauge (G) canula | B. Braun Austria | 4657667 | Canula for s.c. injection |
| 26-gauge (G) canula | B. Braun Austria | 4657683 | Canula for s.c. injection |
| 5 ml syringe | B. Braun Austria | 4606710 V | Injecting device |
| Buprenorphine hydrochloride | Sigma | B9275 | Analgetic agent |
| Burrs for Micro Drill | F.S.T | 19007-29 | Drilling of a hole inside the lamina |
| Caprofen | Zoetis Austria | N/A | Analgetic agent |
| Catwalk Automated gait analysis system | Noldus | N/A | Automatic analysis software of animal gait |
| Cauterizer Kit | F.S.T | 18010-00 | Cauterization of vessels during surgery |
| Enrofloxacin | Bayer Austria | N/A | Antibiotic |
| Ethilon (10-0) | ETHICON | 2810G | Suture material for neurrorhaphy |
| Ethilon (11-0) | ETHICON | EH7465G | Suture material for neurrorhaphy |
| Eye ointment | Fresenius Kabi Austria | 4302436 | Eye protection during anesthesia |
| Friedman-Pearson Rongeurs | F.S.T | 16221-14 | Surgical instrument |
| Gabapentin | Wedgewood Pharmacy | N/A | Analgetic agent |
| Goldstein retractor | F.S.T | 17003-03 | Retraction of tissues during surgery |
| Hair trimmer | Aescular | N/A | Hair trimmer for shaving of the operation site prior to surgery |
| Heating Pad for rodents | ALA Scientific Instruments | N/A | Regulation of body temperature |
| Impactor | Precision Systems and Instrumentation | N/A | Induction of spinal cord contusion |
Lewis rat ( ) ) | Janvier | N/A | Experimental animal |
| Magnetic Fixator Retraction System | F.S.T | 18200-50 | Retraction of tissues during surgery |
| Metzenbaum Baby Scissors | F.S.T | 14019-13 | Surgical instrument |
| Micro Drill | Word Precision Instruments | 503599 | Instrument for bone drilling |
| Micro Needle holder | F.S.T | 12076-12 | Surgical instrument |
| Micro-scissors (curved) | F.S.T | 15023-10 | Surgical instrument |
| Micro-scissors (straight) | F.S.T | 15007-08 | Surgical instrument |
| Mirror Finish Forceps | F.S.T | 11251-23 | Surgical instrument |
| Needle holder | F.S.T | 12002-12 | Surgical instrument |
| Operating microscope | Leica | M651 MSD | Magnification of the operative site |
| Povidone Iod | B. Braun Melsungen | N/A | Non-alcoholic skin disinfectant |
| Pulse Oximeter | STARR Life Sciences | N/A | Surveillance of heart rate and oxygen saturation |
| Rodent thermometer | BIOSEB | BIO-TK8851 | Surveillance of body temperature |
| Scalpel blade | F.S.T | 10010-00 (#10) | Surgical instrument to make an incision |
| Scalpel handle | F.S.T | 10003-12 (#3) | Surgical instrument to make an incision |
| Sevoflurane Inhalation Vapour, Liquid (100%) | Baxter | HDG9117A | Anesthetic |
| Spatula & Probe | F.S.T | 10090-13 | Surgical instrument |
Sprague Dawley rat ( ) ) | Janvier | N/A | Experimental animal |
| Sterila gauze 5x5cm | EVAC MEDICAL | E010.03.00215 | Sterile gauze compress |
| Tissue Forceps | F.S.T | 11021-12 | Surgical instrument |
| Vicryl (4-0) | ETHICON | V3040H | Suture material for subcutaneous sutures |
| Vicryl (5-0) | ETHICON | V303H | Suture material for subcutaneous sutures |
| Vicryl cutting needle (4-0) | ETHICON | V392ZH | Suture material for skin sutures |
| Vicryl cutting needle (5-0) | ETHICON | V391H | Suture material for skin sutures |
Referenzen
- Mohanty, C. B., Bhat, D. I., Devi, B. I. Use of animal models in peripheral nerve surgery and research. Neurology India. 9, 100-105 (2019).
- Vela, F. J., et al. Animal models used to study direct peripheral nerve repair: a systematic review. Neural Regeneration Research. 15 (3), 491-502 (2020).
- Verma, R., Virdi, J. K., Singh, N., Jaggi, A. S. Animals models of spinal cord contusion injury. The Korean Journal of Pain. 32 (1), 12-21 (2019).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. The European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Sperry, R. W. The functional results of muscle transposition in the hind limb of the rat. The Journal of Comparative Neurology. 73 (3), 379-404 (1940).
- Sperry, R. W. The effect of crossing nerves to antagonistic muscles in the hind limb of the rat. The Journal of Comparative Neurology. 75 (1), 1-19 (1941).
- Sperry, R. W. Transplantation of motor nerves and muscles in the forelimb of the rat. The Journal of Comparative Neurology. 76 (2), 283-321 (1942).
- Zimmerman, E. A., Chambers, W. W., Liu, C. N. An experimental study of the anatomical organization of the Cortico-Bulbar System in the Albino Rat. The Journal of Comparative Neurology. 123, 301-323 (1964).
- Cohen, A. H., Gans, C. Muscle activity in rat locomotion: movement analysis and electromyography of the flexors and extensors of the elbow. Journal of Morphology. 146 (2), 177-196 (1975).
- Barnett, S. A. . The Rat: A Study in Behaviour. , (1963).
- Hare, G. M., et al. Walking track analysis: utilization of individual footprint parameters. Annals of Plastic Surgery. 30 (2), 147-153 (1993).
- Hare, G. M., et al. Walking track analysis: a long-term assessment of peripheral nerve recovery. Plastic and Reconstructive Surgery. 89 (2), 251-258 (1992).
- Bertelli, J. A., Mira, J. C. Behavioral evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journa of Neuroscience Methods. 46 (3), 203-208 (1993).
- Varejao, A. S., Melo-Pinto, P., Meek, M. F., Filipe, V. M., Bulas-Cruz, J. Methods for the experimental functional assessment of rat sciatic nerve regeneration. Neurological Research. 26 (2), 186-194 (2004).
- Varejao, A. S., et al. Functional assessment of peripheral nerve recovery in the rat: gait kinematics. Microsurgery. 21 (8), 383-388 (2001).
- Varejao, A. S., et al. Ankle kinematics to evaluate functional recovery in crushed rat sciatic nerve. Muscle and Nerve. 27 (6), 706-714 (2003).
- Nath, T., et al. Using DeepLabCut for 3D markerless pose estimation across species and behaviors. Nature Protocols. 14 (7), 2152-2176 (2019).
- Mathis, A., et al. DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nature Neuroscience. 21 (9), 1281-1289 (2018).
- Deumens, R., Jaken, R. J., Marcus, M. A., Joosten, E. A. The CatWalk gait analysis in assessment of both dynamic and static gait changes after adult rat sciatic nerve resection. Journal of Neuroscience Methods. 164 (1), 120-130 (2007).
- Heinzel, J., et al. Use of the CatWalk gait analysis system to assess functional recovery in rodent models of peripheral nerve injury - a systematic review. Journal of Neuroscience Methods. 345, 108889 (2020).
- Heinzel, J. C., Hercher, D., Redl, H. The course of recovery of locomotor function over a 10-week observation period in a rat model of femoral nerve resection and autograft repair. Brain and Behavior. , 01580 (2020).
- Chen, S. H., et al. Changes in GABA and GABA(B) receptor expressions are involved in neuropathy in the rat cuneate nucleus following median nerve transection. Synapse. 66 (6), 561-572 (2012).
- Chen, S. H., et al. Decreases of glycine receptor expression induced by median nerve injury in the rat cuneate nucleus contribute to NPY release and c-Fos expression. Life Sciences. 90 (7-8), 278-288 (2012).
- Hetze, S., Romer, C., Teufelhart, C., Meisel, A., Engel, O. Gait analysis as a method for assessing neurological outcome in a mouse model of stroke. Journal of Neuroscience Methods. 206 (1), 7-14 (2012).
- Sandner, B., et al. Systemic epothilone D improves hindlimb function after spinal cord contusion injury in rats. Experimental Neurology. 306, 250-259 (2018).
- Kappos, E. A., et al. Validity and reliability of the CatWalk system as a static and dynamic gait analysis tool for the assessment of functional nerve recovery in small animal models. Brain and Behavior. 7 (7), 00723 (2017).
- Deumens, R., Marinangeli, C., Bozkurt, A., Brook, G. A. Assessing motor outcome and functional recovery following nerve injury. Methods in Molecular Biology. 1162, 179-188 (2014).
- Webster, G. V. Halstedian principles in the practice of plastic and reconstructive surgery. Stanford Medical Bulletin. 13 (3), 315-316 (1955).
- Bozkurt, A., et al. A flexible, sterile, and cost-effective retractor system for microsurgery. Microsurgery. 31 (8), 668-670 (2011).
- Carr, M. M., Best, T. J., Mackinnon, S. E., Evans, P. J. Strain differences in autotomy in rats undergoing sciatic nerve transection or repair. Annals of Plastic Surgery. 28 (6), 538-544 (1992).
- Dellon, A. L., Mackinnon, S. E. Sciatic nerve regeneration in the rat. Validity of walking track assessment in the presence of chronic contractures. Microsurgery. 10 (3), 220-225 (1989).
- Jackson, C. M. Anatomy of the rat. Transactions of the American Philosophical Society, Philadelphia, New Series, Volume XXVII, 1935. The Anatomical Record. 65 (1), 127-129 (1936).
- Pena, M. C., Baron, J. Femoral nerve and rectus femoris muscle of the rat: a study in anatomy, histology, and histoenzymes. Annals of Plastic Surgery. 20 (6), 527-532 (1988).
- Kjell, J., Olson, L. Rat models of spinal cord injury: from pathology to potential therapies. Disease Models and Mechanisms. 9 (10), 1125-1137 (2016).
- Basso, D. M., Beattie, M. S., Bresnahan, J. C. A sensitive and reliable locomotor rating scale for open field testing in rats. Journal of Neurotrauma. 12 (1), 1-21 (1995).
- Bozkurt, A., et al. CatWalk gait analysis in assessment of functional recovery after sciatic nerve injury. Journal of Neuroscience Methods. 173 (1), 91-98 (2008).
- Godinho, M. J., et al. Immunohistochemical, ultrastructural and functional analysis of axonal regeneration through peripheral nerve grafts containing Schwann cells expressing BDNF, CNTF or NT3. PLoS One. 8 (8), 69987 (2013).
- Pajenda, G., et al. Spatiotemporally limited BDNF and GDNF overexpression rescues motoneurons destined to die and induces elongative axon growth. Experimental Neurology. 261, 367-376 (2014).
- Matsuura, Y., et al. The effect of anti-NGF receptor (p75 Neurotrophin Receptor) antibodies on nociceptive behavior and activation of spinal microglia in the rat brachial plexus avulsion model. Spine (Phila Pa 1976). 38 (6), 332-338 (2013).
- Hamers, F. P., Lankhorst, A. J., van Laar, T. J., Veldhuis, W. B., Gispen, W. H. Automated quantitative gait analysis during overground locomotion in the rat: its application to spinal cord contusion and transection injuries. Journal of Neurotrauma. 18 (2), 187-201 (2001).
- Koopmans, G. C., et al. The assessment of locomotor function in spinal cord injured rats: the importance of objective analysis of coordination. Journal of Neurotrauma. 22 (2), 214-225 (2005).
- Frohlich, H., Claes, K., De Wolf, C., Van Damme, X., Michel, A. A machine learning approach to automated gait analysis for the Noldus Catwalk system. IEEE Transaction on Bio-medical Engineering. 65 (5), 1133-1139 (2018).
- Batka, R. J., et al. The need for speed in rodent locomotion analyses. Anatomical Record (Hoboken, N. J). 297 (10), 1839-1864 (2014).
- Wood, T., et al. A ferret model of encephalopathy of prematurity. Developmental Neuroscience. 40 (5-6), 475-489 (2018).
- Abbas, W., Masip Rodo, D. Computer methods for automatic locomotion and gesture tracking in mice and small animals for neuroscience applications: a survey. Sensors. 19 (15), (2019).
- Irintchev, A. Potentials and limitations of peripheral nerve injury models in rodents with particular reference to the femoral nerve. Annals of Anatomy. 193 (4), 276-285 (2011).
- Haastert-Talini, K., Haastert-Talini, K., Assmus, H., Antoniadis, G. . Modern Concepts of Peripheral Nerve Repair. , 127-138 (2017).
- Lu, L., et al. Growth differentiation factor 11 promotes neurovascular recovery after stroke in mice. Frontiers in Cellular Neuroscience. 12, (2018).
- Caballero-Garrido, E., Pena-Philippides, J. C., Galochkina, Z., Erhardt, E., Roitbak, T. Characterization of long-term gait deficits in mouse dMCAO, using the CatWalk system. Behavioral Brain Research. 331, 282-296 (2017).
- Graham, D. M., Hampshire, V. Methods for measuring pain in laboratory animals. Lab Animal. 45 (3), 99-101 (2016).
- Monte-Raso, V. V., Barbieri, C. H., Mazzer, N., Yamasita, A. C., Barbieri, G. Is the sciatic functional index always reliable and reproducible. Journal of Neuroscience Methods. 170 (2), 255-261 (2008).
- Stossel, M., et al. Comparative evaluation of chitosan nerve guides with regular or increased bendability for acute and delayed peripheral nerve repair: a comprehensive comparison with autologous nerve grafts and muscle-in-vein grafts. Anatomical Record (Hoboken). 301 (10), 1697-1713 (2018).
- Vrinten, D. H., Hamers, F. F. CatWalk' automated quantitative gait analysis as a novel method to assess mechanical allodynia in the rat; a comparison with von Frey testing. Pain. 102 (1-2), 203-209 (2003).
- Aman, M., Sporer, M., Bergmeister, K., Aszmann, O. Animal models for selective nerve transfers of the upper extremity. Handchirurgie Mikrochirurgie Plastische Chirurgie. 51 (4), 319-326 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten