Method Article
Analyse automatisée de la démarche pour évaluer la récupération fonctionnelle chez les rongeurs ayant des lésions périphériques du nerf ou de la contusion de la moelle épinière
Dans cet article
Résumé
L’analyse automatisée de démarche est un outil faisable pour évaluer la récupération fonctionnelle dans les modèles de rongeur des dommages périphériques de nerf et des dommages de contusion de moelle épinière. Bien qu’il ne nécessite qu’une seule configuration pour évaluer la fonction locomotrice dans divers modèles expérimentaux, l’ajustement méticuleux des marchandises dures et douces et la formation des animaux est très important.
Résumé
Les lésions nerveuses périphériques et centrales sont principalement étudiées chez les rongeurs, en particulier les rats, étant donné que ces modèles animaux sont à la fois rentables et que beaucoup de données comparatives ont été publiées dans la littérature. Ceci inclut une multitude de méthodes d’évaluation pour étudier la récupération fonctionnelle après des dommages et la réparation de nerf. Outre l’évaluation de la régénération nerveuse au moyen de l’histologie, de l’électrophysiologie et d’autres techniques d’évaluation in vivo et in vitro, la récupération fonctionnelle est le critère le plus important pour déterminer le degré de régénération neuronale. L’analyse automatisée de la démarche permet l’enregistrement d’une grande quantité de paramètres liés à la démarche tels que paw print area et paw swing speed ainsi que des mesures de coordination entre les membres. En outre, la méthode fournit des données numériques des pattes des rats après des dommages neuronaux et pendant la régénération nerveuse, ajoutant à notre compréhension de la façon dont les blessures nerveuses périphériques et centrales affectent leur comportement locomoteur. Outre le modèle principalement utilisé de lésions nerveuses sciatiques, d’autres modèles de lésions nerveuses périphériques telles que le nerf fémoral peuvent être étudiés au moyen de cette méthode. En plus des blessures du système nerveux périphérique, des lésions du système nerveux central, par exemple, la contusion de moelle épinière peuvent être évaluées. L’évaluation des données valide et reproductible dépend fortement de l’ajustement méticuleux des paramètres durs et logiciels avant l’acquisition des données. En outre, une bonne formation des animaux expérimentaux est d’une importance cruciale. Ces travaux visent à illustrer l’utilisation de l’analyse automatisée informatisée de la démarche pour évaluer la récupération fonctionnelle dans différents modèles animaux de lésions nerveuses périphériques ainsi que les lésions de contusion de la moelle épinière. Il met également l’accent sur les limitations de la méthode, par exemple, l’évaluation de la régénération nerveuse chez les rats atteintes de neurotmésis nerveux sciatique en raison d’une récupération fonctionnelle limitée. Par conséquent, ce protocole est pensé pour aider les chercheurs intéressés par les blessures nerveuses périphériques et centrales pour évaluer la récupération fonctionnelle dans les modèles de rongeurs.
Introduction
Les blessures du système nerveux périphérique et central sont souvent étudiées chez les rongeurs, ce qui entraîne une grande quantité de données comparatives concernant le cours des lésions nerveuses, la réparation ou la neuroprotection pour contrer d’autres blessures secondaires et larégénération 1,2,3. Les résultats des stratégies expérimentales de traitement dans les modèles de rongeurs peuvent être évalués par une variété de techniques telles que l’histologie, l’immunohistochimie, l’électrophysiologie et les techniques d’imagerie telles que la microtomographie aux rayons X (μCT), mais le critère le plus important pour déterminer le succès d’un traitement est — comme chez les patients humains — le degré de récupérationfonctionnelle 4,5. Les premières études portant sur la performance locomotrice chez les rongeurs remontent aux années 19406,7,8. Les rats et les souris ont fait l’objet d’une grande quantité d’études sur leur comportement locomoteur dans lesdécennies suivantes 9,10,11. Aujourd’hui, il existe un large éventail de techniques d’évaluation pour les modèles de rongeurs de lésions nerveuses périphériques et centrales, allant de l’analyse de la piste de marche àl’encre et au papier 12,13,14 au-dessus de la cheville et de la cinétique de la démarche15,16,17 aux méthodes améliorées d’apprentissage automatique, qui permettent l’estimation complexe de la démarche, des membres et des trajectoiresarticulaires 18,19.
L’analyse automatisée informatisée de démarche (AGA) est employée pour évaluer la fonction locomotrice suivant des dommages nerveux périphériques et centraux et le traitement expérimental potentiel de telles blessures. L’appareil se compose principalement d’une passerelle en verre et d’une source lumineuse qui illumine les empreintes de pattes du rongeur en corrélation avec la pression qu’ils ont dépassée. Ces données sont ensuite informatisées pour calculer un large éventail de paramètres statiques et dynamiques. Selon Deumens, ces paramètres peuvent être subdivisés en catégories de paramètres généraux, de paramètres liés à la douleur ainsi que de paramètres liés à la coordination de ladémarche 20 (tableau 1). La faisabilité de l’AGA pour détecter des changements dans le comportement de démarche a été prouvée dans divers modèles animaux des dommages périphériques de nerf (PNI)21,tels que le nerfsciatique 20,le nerf fémoral22,et lenerf médian 23,24. Il est également couramment utilisé pour évaluer la fonction locomotrice chez les rats ayant des blessures nerveuses centrales, par exemple, accident vasculairecérébral 25 ou contusion de la moelleépinière 26. Les avancées de la méthode résident dans la grande quantité de données comparables et sa possibilité d’enregistrer une pléthore de paramètres liés à la démarche27. Cet article vise à fournir aux chercheurs intéressés par les modèles animaux d’INP et de lésions médullaires (SCI) une ligne directrice détaillée et pratique pour évaluer la fonction locomotrice dans ces modèles.
| Catégorie | Paramètre | Description | |
| Paramètres généraux de la démarche | Zone d’impression (unité de distance) | Zone de l’impression de patte | |
| Longueur d’impression (unité de distance) | Longueur de l’impression de patte | ||
| Base de soutien (BoS) (unité de distance) | Distance entre les deux pattes arrière ou avant | ||
| Longueur de foulée (unité de distance) | Distance entre deux placements consécutifs d’une patte | ||
| Paramètres liés à la douleur de la démarche | Swing Time (s) | Durée de la phase de balançoire | |
| Temps de stand (s) | Durée de la phase de position | ||
| Intensité moyenne d’impression de patte (unité arbitraire) | Moyenne iIntensity de l’impression de patte pendant la phase de position | ||
| Paramètres liés à la coordination de la démarche | Modèles normaux de séquence d’étape (NSSP) | Séquences spécifiques de placement des pattes au cours d’un cycle d’étapes | |
| Dispersions de phase (%) | Différences temporelles entre les cycles d’étape de deux pattes spécifiques | ||
| Indice de régularité (RI) (%) | Quantification de la coordination interlimb en divisant la quantité de temps NSSP impeccables 4 par le nombre global de placement des pattes au cours d’un cycle d’étape | ||
Tableau 1 : Paramètres de démarche évaluables à l’analyse automatisée de la démarche. Les catégories dans lesquelles les paramètres sont classés sont choisies selon Deumens et coll.20.
Protocole
Le protocole expérimental pour toutes les expériences a été approuvé à l’avance par la Commission d’examen du protocole animal du gouvernement de la ville de Vienne. Toutes les procédures ont été menées conformément à la Déclaration d’Helsinki sur les droits des animaux et au Guide pour le soin et l’utilisation des animaux de laboratoire des Instituts nationaux de la santé.
1. Logement pour animaux
- Abritez des rats mâles (Lewis ou Sprague Dawley) pesant de 250 à 300 g sous un cycle clair/sombre de 12 h avec accès ad libitum à la nourriture et à l’eau.
- Contrôler à la fois la température ambiante (maintenue à 20-22 °C) et l’humidité (45 %-65 %) pour un logement adéquat des animaux. Pour ce travail, des rats mâles Lewis (PNIs) et Sprague Dawley (SCI) ont été utilisés.
- Fournir une nouvelle cage nettoyée deux fois par semaine. Abritez des rats en groupes de deux ou trois et surveillez de près leur comportement social et leur interaction. Prévoyez aux rats une période d’acclimation d’au moins 1 semaine avant toute intervention chirurgicale ou test fonctionnel.
REMARQUE : Les rats ont besoin d’au moins 5 jours d’entraînement quotidien sur l’appareil d’analyse de la démarche avant la chirurgie, alors calculez au moins 2 semaines entre l’arrivée des rats à l’établissement et les données prévues pour la chirurgieexpérimentale 28.
2. Induction de lésions nerveuses
REMARQUE : Portez de l’équipement de protection individuelle comme une robe chirurgicale, des gants et un masque. Dans le cas où une robe chirurgicale stérile n’est pas disponible, un manteau de laboratoire propre et blanchi est également suffisant. À moins qu’il ne soit contaminé, la robe ou le manteau n’a pas besoin d’être changé entre les animaux, mais entre les séances de chirurgie. L’utilisation de gants chirurgicaux stériles est recommandée. Dans le cas où ces gants ne sont pas disponibles, des gants d’examen peuvent également être utilisés, mais doivent être lavés avant la chirurgie à l’aide d’un désinfectant chirurgical. Les gants doivent être changés entre les animaux.
- Le jour de la chirurgie, essayez de minimiser toute quantité de stress pour les animaux car cela pourrait interférer avec l’anesthésie, par exemple, les animaux auront besoin de doses plus élevées d’anesthésiques.
- Le jour de la chirurgie, injecter 0,05 mg buprénorphine/kg de poids corporel en suspension avec 100-200 μL 0,9% NaCl sous-cutanée en utilisant une canule de 25 G 1 h avant la chirurgie pour fournir une analgésie pré et interopératoire. S’il n’est pas indiqué le contraire, le flanc du rat est le site préféré pour l’injection.
- Anesthésier les rats en les plaçant dans une chambre d’induction d’anesthésie reliée à un vaporisateur de sevoflurane et un récipient actif de craie pour absorber le CO2. Anesthésier le rat en inondant la boîte d’anesthésie avec 4%-5% de mélange sevoflurane-oxygène pendant environ 5 min en utilisant un flux d’oxygène de 1,5 L/min (phase d’initiation). Connectez un clip d’oximétrie d’impulsion à l’une des pattes pour surveiller la saturation en oxygène du rongeur. Maintenir l’état d’anesthésie générale avec 2,5%-4,5% mélange sevoflurane-oxygène.
REMARQUE : Pour la chirurgie expérimentale, l’anesthésie générale est obligatoire. Confirmez l’anesthésie générale en vérifiant l’absence de réponse au stimulus de pincement de la queue ou des pattes. - Lorsque le rat est entré dans l’anesthésie générale, raser l’areal respectif qui va être opéré et désinfecter la zone en la faisant glisser en alternance avec de l’alcool et désinfectant pour la peau. Le balayage final doit être effectué avec désinfectant pour la peau.
- Placez-le sur un coussin chauffant réglable dans la position requise (supine pour le modèle nerveux fémoral, sujette pour le modèle sciatique et SCI). Insérez une sonde thermomètre flexible dans le rectum du rat pour surveiller la température de l’animal et la maintenir à environ 37 °C pendant la chirurgie. Pendant l’anesthésie, protéger les yeux du rat contre la dessication à l’aide d’onguent pour les yeux
3. Induction chirurgicale des lésions nerveuses
- Lors de l’exécution des interventions chirurgicales, respecter strictement les sept principes de Halsted29 comme suit:
- Manipulez toujours les tissus doucement lorsque vous travaillez avec eux. Évitez de déchirer ou d’écraser les tissus.
REMARQUE : Les systèmes derétractation self-made 30 ou disponibles dans le commerce sont utiles pour garder les muscles et les vaisseaux hors du champ d’opération. - Maintenez soigneusement l’hémostase à l’aide d’un hémostat électrique pour cautériser les vaisseaux ou les ligatures afin de garantir une hémostase soigneuse.
- Maintenez toujours l’approvisionnement en sang aux tissus en les disséquant soigneusement et en les manipulant délicatement.
- Maintenez une asepsie stricte en portant un masque, une robe et des gants stériles.
- Évitez les tensions sur les tissus en appliquant des sutures qui ne sont ni trop serrées ni trop lâches.
- Apposez méticuleusement les tissus en réunissant leurs bords respectifs sans aucun chevauchement.
REMARQUE : Ceci est particulièrement important dans le cas de la neurorrhaphy épineuriale ou périneuriale. Effectuez toutes les interventions microchirurgicales sous grossissement 6x-16x à l’aide d’un microscope d’opération. Idéalement, le microscope fournit deux paires d’oculaires pour permettre l’observation de l’opération par un assistant. - Évitez la création d’espaces morts en suturant soigneusement les différentes couches tissulaires.
- Manipulez toujours les tissus doucement lorsque vous travaillez avec eux. Évitez de déchirer ou d’écraser les tissus.
- Induction de la neurotmésis sciatique de nerf de l’arrière-point droit
- Exposez le nerf sciatique droit au niveau moyen en effectuant une incision de 5 cm de long sur le côté dorsal du membre postérieur avec une lame de scalpel de #10 reliée à une poignée de scalpel #3 et en disséquant la musculature et le tissu mou overlying. Placez un rétracteur à l’intérieur de la plaie pour garder la musculature disséquée et la peau hors du situs. Exposez doucement le nerf en enlevant le tissu environnant à l’aide de ciseaux microchirurgiens incurvés.
- Retirez un segment nerveux de 8 mm de long du nerf sciatique 1-2 mm proximal à sa trifurcation avec des ciseaux microchirurgical droits.
- Faites pivoter le segment nerveux à 180°, placez-le entre la souche proximale et distale du nerf sciatique transecté et effectuez une neurorrhaphy épineuriale à chaque site avec deux sutures interrompues de 10 à 0 et un porte-aiguille microchirurgical.
- Induction de la neurotmésis fémorale de nerf sur l’arrière droit
- Effectuer une incision longitudinale de 3-4 cm à l’aine avec une lame de scalpel #10 reliée à une poignée de scalpel #3 afin d’exposer le faisceau neurovasculaire fémoral droit. Utilisez des ciseaux chirurgicaux pour la dissection émoussée jusqu’à ce que la bifurcation du nerf fémoral soit exposée. Placez un rétracteur à l’intérieur de la plaie pour garder la musculature disséquée et la peau hors du situs.
- Transectez le moteur exposé et les branches sensorielles distales à la bifurcation et excisez un segment nerveux de 6 mm de long de chaque branche, respectivement, à l’aide de ciseaux microchirurgiens droits.
- Faites pivoter les deux segments nerveux à 180°, placez-les entre la souche proximale et distale des branches transectées du nerf fémoral et effectuez une neurorrhaphy épineuriale à chaque site avec deux sutures interrompues de 11 à 0 et un porte-aiguille microchirurgical.
REMARQUE : Effectuez une greffe autologue homotopique de nerf en greffant la greffe de moteur à la branche motrice originale et la greffe sensorielle à la branche sensorielle originale. Alternativement, effectuez une greffe autologue hétérotopique de nerf en greffant la greffe de moteur à la branche sensorielle originale et vice versa.
- Induction d’une lésion thoracique de contusion de la moelle épinière
- Effectuez une incision cutanée à travers la colonne vertébrale thoracique avec une lame de scalpel #10 reliée à une poignée de scalpel #3 suivie de deux incisions musculaires parallèles aux processus épineux pour faciliter la rétractation musculaire. Placez un rétracteur à l’intérieur de la plaie pour garder la musculature disséquée et la peau hors du situs.
- Identifier la 11e vertèbre thoracique (Th) et exposer le lamina de l’arc vertébral en enlevant le tissu superposé ainsi que le processus épineux à l’aide d’un rongeur.
- Effectuez une laminectomie à l’aide d’une micro-perceuse et d’une bavure appropriée pour percer un petit trou dans le laminaire, légèrement plus grand que la pointe de l’impacteur. Pour éviter les dommages à la moelle épinière, mincez seulement le lamina tout en ouvrant et en agrandissant le trou à l’aide d’un rongeur. Si le périoste est encore intact, retirez-le soigneusement à l’aide d’une sonde pointue tranchante sans endommager le dura mater.
- Après s’être assuré qu’un trou assez grand est fait sans déstabiliser le lamina, maintenez la colonne vertébrale de l’animal en place en la serrant rostrally et caudally à Th11 avec les forceps stabilisateurs de l’impacteur. À l’aide des roues à main à l’avant et sur le côté, placez la tige d’acier à 3-5 mm au-dessus du trou de laminectomie. Enfin, soumettons tous les animaux à un impact avec une force définie de 150 kilodyne pour induire un degré doux à modéré de lésion de contusion de la moelleépinière 4.
- Effectuer la fermeture des plaies en couches anatomiques à l’aide de polyglactine 4-0 ou 5-0 sutures interrompues et un porte-aiguille chirurgical. Nettoyez soigneusement la plaie en l’essuyant doucement avec un tampon de gaze trempé dans stérile 0,9% NaCl.
- Après la chirurgie, retournez les animaux dans leur cage et abritez-les contre l’exposition à la lumière et au son. Surveillez de près le comportement des animaux jusqu’au jour postopératoire (DPO) 7 et assurez une consommation suffisante de nourriture et d’eau. Si nécessaire, fournir du liquide supplémentaire par injections sous-cutanées (p. ex., 10 ml de NaCl 0,9 %).
- Fournir une analgésie postopératoire pendant au moins 2 jours au moyen, par exemple, d’opioïdes (0,05 mg/kg de poids corporel Buprénorphine sous-cutanée (s.c.)) et/ou d’antipyrétiques (4 mg/kg de poids corporel Carprofen s.c.). Si nécessaire, et dans le cas du modèle SCI, fournir également une thérapie antibiotique postopératoire (7,5 mg/kg de poids corporel Enrofloxacine par os (p.o.)).
- En cas de lésion de la moelle épinière, videz manuellement la vessie du rat jusqu’à ce que la miction spontanée revienne.
4. Récupération des interventions chirurgicales avant l’analyse de la démarche
NOTE : Les rats avec des dommages sciatiques de nerf montrent la tendance à ronger sur leurs pattes postérieures dues au début de la neuropathie douloureuse suivant des dommages de nerf. Cette forme d’automutilation peut entraîner l’autoamputation des orteils ou des parties de la patte arrière respective. Préférez les rats De Lewis au-dessus d’autres souches de rat au cas où en utilisant le modèle sciatique de dommages de nerf, car cette souche de rat montre une plus petite tendance pour l’automutilation31. Les rats avec des dommages sciatiques de nerf montrent également la tendance à développer des contractures du membre opéré, qui pourraient avoir comme conséquence leur exclusion de l’étude due à l’interférence avec l’acquisition de données. De tels événements défavorables se produisent beaucoup moins communs chez les rats avec des dommages fémoraux.
- Inspecter les animaux opérés tous les jours après la chirurgie avec une attention particulière sur l’état de leurs membres et pattes, respectivement.
REMARQUE : Chez les rats avec SCI, à la hauteur de Th11, le prolapsus pénien ou rectal peut se produire en raison de l’affaiblissement de la capacité naturelle des animaux à uriner et déféquer. Ces événements sont généralement définis comme des critères d’évaluation humains de l’étude et impliquent l’exclusion immédiate de l’animal affecté de l’étude. - Poursuivre l’analgésie postopératoire jusqu’à ce que les rats cessent d’afficher des symptômes liés à la douleur.
- En cas de douleur persistante, administrer de la gabapentine (30-120 mg/kg de poids corporel) p.o. pour traiter la douleur neuropathique.
5. Préparation avant d’effectuer une analyse automatisée de la démarche
REMARQUE : La méthodologie du système d’analyse de la démarche est basée sur l’enregistrement des animaux d’en bas tout en traversant une plaque de verre, qui est éclairée par une lumière LED verte. Lorsque les pattes des animaux contactent le sol, la zone de l’empreinte de la patte est éclairée et enregistrée par une caméra vidéo à grande vitesse. Ces données sont ensuite envoyées via un câble Ethernet à un ordinateur exécutant le logiciel d’analyse de la démarche. Bien que les empreintes individuelles puissent être classées manuellement par l’expérimentateur, la dernière version logicielle comporte également une classification automatique de l’empreinte.
- Effectuez toutes les procédures d’essai dans l’obscurité et en l’absence de bruits perturbateurs. Puisque les rats sont capables de percevoir des fréquences supersoniques, vérifiez également qu’aucune source n’émet de tels sons.
REMARQUE: Effectuer l’analyse de la démarche soit hebdomadaire ou toutes les deux semaines, mais ne pas tester les rats trop fréquemment que surtout les rats Lewis ont tendance à perdre l’intérêt à participer à la procédure au fil du temps quand ils sont exposés à un certain exercice trop fréquemment. Il est toutefois nécessaire de former les rats quotidiennement pendant 5 jours avant la chirurgie pour les acclimater à l’environnement d’essai et à la procédure. - Pendant les séances d’entraînement et le jour du test, préparez la salle de test comportementale en éteignez toutes les sources de lumière, ce qui pourrait autrement interférer avec la caméra du dispositif automatisé d’analyse de la démarche. Placez l’écran d’ordinateur nécessaire à l’acquisition de données loin de la caméra pour empêcher sa lumière d’interférer avec la caméra.
- Assurez-vous que l’appareil est installé dans une position stable et d’une manière qui empêche toute forme de vibration, car cela interférera sérieusement avec la procédure d’acquisition de données.
- Amenez les rats à la salle d’essai comportementale et acclimatez-les dans leur propre cage pendant au moins 30 minutes avant le test.
REMARQUE : Chaque fois que vous manipulez les animaux, portez de l’équipement de protection individuelle comme une robe chirurgicale ou un manteau de laboratoire, des gants et un masque.
6. Effectuer une analyse automatisée de la démarche
- Formations
REMARQUE : Pendant l’entraînement, les animaux subiront une courbe d’apprentissage, il est donc recommandé d’ajuster graduellement le calendrier d’entraînement. Utilisez des récompenses alimentaires (p. ex., 1 à 2 morceaux de céréales pour le petit déjeuner) pour récompenser les animaux après avoir terminé avec succès chaque séance d’entraînement.- Le premier jour de formation, soulevez doucement l’animal en le tenant sous son tronc et portez-le doucement jusqu’à l’entrée de la passerelle.
- Placez l’animal dans la zone d’entrée et laissez-le explorer l’ouverture du couloir sans aucune interférence de la personne effectuant la procédure d’essai.
REMARQUE : Ne pas crier, siffler, souffler ou piquer l’animal pour tenter de le motiver à traverser la passerelle. Tous ces comportements stresseront gravement l’animal et compliqueront davantage la procédure d’acquisition de données. - Attendez que l’animal traverse volontairement la passerelle pour atteindre sa cage d’origine. Parfois, surtout chez les animaux non entraînés, cela peut prendre jusqu’à plusieurs minutes. Le premier jour d’entraînement, l’animal n’est ni attendu ni tenu de faire des courses ininterrompues avec une vitesse de marche uniforme. Au lieu de cela, il devrait s’acclimater avec l’appareil d’essai et la procédure.
- Le deuxième jour d’entraînement, habituer les animaux à entrer dans la passerelle sans hésitation et, aussi à retourner à leur cage d’origine sans hésitation. Certains animaux auront probablement déjà appris à traverser la passerelle sans interruption, mais ce n’est toujours pas nécessaire à la fin de la deuxième journée.
- Le troisième jour d’entraînement, assurez-vous que les animaux apprennent à traverser la passerelle sans hésitation, reniflant ou explorant des mouvements. Assurez-vous qu’ils marchent à une vitesse uniforme.
- Le quatrième et cinquième jour d’entraînement, répétez l’exercice précédent pour consolider la procédure d’essai.
REMARQUE : Dans le cas où un animal n’acquiert pas les compétences nécessaires pour traverser correctement la passerelle d’ici la fin de la période d’entraînement de 5 jours, ajouter 2 jours supplémentaires d’entraînement (p. ex., le week-end). Pensez également à effectuer jusqu’à 3 séances d’entraînement par jour, séparées par au moins 2 h de repos entre chaque séance. Dans 95 % des cas, l’animal aura acquis l’expérience de formation requise d’ici la fin de cette longue période de formation. Dans les rares cas où un animal n’a toujours pas acquis cette compétence après 7 jours d’entraînement, il est recommandé de reporter la séance de chirurgie expérimentale prévue d’au moins 1 semaine et de répéter le régime d’entraînement susmentionné.
7. Acquisition de données
REMARQUE : Le système d’analyse de la démarche visualise chaque empreinte de patte pendant que l’animal marche et analyse automatiquement divers paramètres de démarche tels que paw print area, paw print intensity, paw swing time et paw swing speed (tableau 1). Comme le système d’analyse de la démarche enregistre toutes les données en fonction de l’intensité générée par les empreintes de pattes des animaux, assurez-vous que les paramètres de la caméra sont ajustés en fonction du poids et de la taille des rats. De plus, assurez-vous que la passerelle est sèche et propre avant l’enregistrement des données afin d’éviter toute influence sur l’acquisition de données.
- Avant l’acquisition de données, nettoyez la passerelle à l’aide d’un nettoyeur de verre commercial et d’un raclette. Vaporisez la plaque de verre plusieurs fois, puis essuyez-la avec le raclette pour enlever les particules de sa surface. Aussi, nettoyer le dessous. Assurez-vous d’enlever tout liquide des extrémités de la passerelle puisque les animaux pourraient autrement marcher dessus, ce qui affecterait les données enregistrées.
- Répétez la procédure de nettoyage chaque fois que cela est nécessaire, par exemple, la contamination de la passerelle et avant d’enregistrer les données d’un rat d’une cage différente. On pense que cela empêche l’animal d’être distrait par l’odeur de ses conspécifiques.
- Avant la toute première acquisition de données, ajustez les paramètres de la caméra en adaptant le poids des animaux. Confirmez cela en plaçant l’animal le plus léger et le plus lourd sur la passerelle et choisissez un réglage de caméra qui permet une bonne qualité de données dans les deux cas. Ajustez le gain de caméra, la lumière rouge de plafond, la lumière verte de passerelle, et le seuil vert d’intensité (GIT) pour assurer la détection optimale d’impression de patte.
REMARQUE : Ne modifiez pas les paramètres choisis après le début de l’acquisition de données, car cela nuira à la comparabilité des données acquises. À titre d’exception, le GIT peut être modifié lors de la classification des données, mais cela doit être fait pour tous les essais uniformément. - Définissez et calibrez la passerelle à l’aide de la feuille d’étalonnage fournie.
- Choisissez un appareil photo enregistré répertorié dans l’onglet Configuration.
- Cliquez sur le bouton Acquisition ouverte que l’on peut trouver dans l’onglet Acquérir.
- Prenez un instantané de la passerelle vide et nettoyée, qui sera utilisée comme référence tout au long de la procédure d’acquisition de données suivante.
- Notez le changement d’état de Waiting for Snapshot à Ready for Acquisition.
- Cliquez sur le bouton Démarrer l’acquisition et remarquez le changement d’état de Ready for Acquisition à Waiting for Run to Start.
- Placez un rat sur la passerelle et suivez le mouvement de l’animal sur l’écran de l’ordinateur. Notez le changement d’état de Waiting for Run à Start to Recording Run.
REMARQUE : Le logiciel classera automatiquement les exécuteurs qu’il juge conformes en fonction des caractéristiques d’exécuter prédéfiniales avec un symbole vert, tandis que les courses non conformes seront marquées d’un symbole rouge. Le logiciel arrête automatiquement l’acquisition de données lorsque trois courses conformes ont été enregistrées, mais l’acquisition de données peut être poursuivie en cliquant à nouveau sur le bouton Start Acquisition.
8. Classification des données
REMARQUE : Reportez-vous au tableau 1 pour une liste des paramètres de résultats de l’AGA. Au moins trois pistes conformes sont nécessaires dans lesquelles l’animal doit traverser la passerelle régulièrement sans hésitation27. En outre, les vitesses de fonctionnement devraient correspondre dans les mêmes catégories que définies dans lalittérature 30.
- Cliquez sur le bouton Classifier dans l’onglet Explorateur expérimental des essais respectifs qui doivent être classifiés.
- Jouez à la course acquise avec une vitesse normale pour avoir une impression si les données sont conformes aux exigences énumérées auparavant.
- Dans le coin supérieur gauche, cliquez sur le bouton Auto Classify pour la classification automatique des empreintes de pattes par le logiciel.
REMARQUE : Bien que le logiciel ait un taux élevé de classification correcte des pattes, il ne parvient parfois pas à attribuer une patte aux impressions ou attribue la mauvaise patte. Par conséquent, vérifiez toujours les empreintes de pattes auto-classées par la suite. - Pour un calcul correct des modèles de séquences d’étapes normales (PSNS), assurez-vous que l’algorithme de classification n’est pas confondu par des empreintes de pattes non visibles, ce qui entraîne une faille duPSNS (figure 1A). Par conséquent, n’incluez que les empreintes de pattes qui sont détectables alors que la patte contralatérale est également visible pour les calculs du PSN, par exemple, la patte avant gauche (LF) et la patte arrière droite (RH) (Figure 1B).

Figure 1 : Données AGA exemplaires, démontrant la nécessité d’une double vérification manuelle de la classification correcte des données. Dans le cas où un placement détecté d’une patte avant est remplacé par le placement détecté d’une autre patte avant (A) le logiciel AGA pourrait confondre cela avec un modèle de marche non coordonné car aucune pattes postérieures n’a été détectée. Par conséquent, il est recommandé de toujours vérifier et sélectionner une impression initiale de patte, qui est détectée lorsque la patte contralatérale est également visible (B). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
9. Calcul des statistiques
REMARQUE : Pour ajuster les données d’exécuter pour les changements liés au gain de poids au fil du temps, il est fortement recommandé de calculer un rapport de la patte expérimentale avec une patte non expérimentale (p. ex., contrôle). En outre, calculer le rapport aux valeurs préopératoires de cette comparaison patte-patte pour tenir compte des différences individuelles dans l’utilisation des pattes.
- Cliquez sur le bouton Afficher les statistiques pour obtenir une vue d’ensemble complète des statistiques d’exécuter.
- Sélectionnez Fichier et Exportation pour exporter des statistiques d’exécuter ou des statistiques d’essai dans un logiciel de feuille de calcul.
Résultats
12 rats ont subi la chirurgie périphérique expérimentale de nerf. La résection sciatique de nerf (figure 2A) a été exécutée dans 7 rats, alors que la neurotmesis fémorale de nerf (figure 2B) a été induite dans 5 rats. Chez tous les animaux, le défaut nerveux a été reconstruit au moyen d’une greffe autologue de nerf. Des lésions de contusion de moelle épinière (figure 2C) au niveauTh 11 ont été induites chez 6 rats, ayant pour résultat un total de 18 rats.
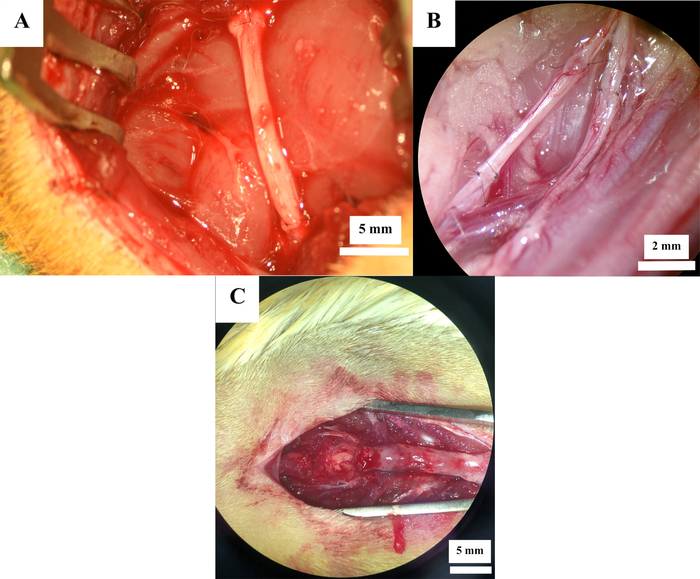
Figure 2 : Sites opératoires après reconstruction nerveuse. Reconstruction nerveuse avec des autogreffes dans le nerfsciatique( A ) et le nerf fémoral (B) ainsi qu’après une lésion de contusion de la moelle épinière (C). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Tous les animaux se sont bien remis de la chirurgie et aucun cas d’automutilation ne s’est produit. Un animal du groupe sciatique de dommages de nerf a développé des contractures fortes de la patte arrière droite au cours de la période postopératoire d’observation et a dû être exclu de davantage d’analyse de données.
Neurotmésis sciatique de nerf
Puisque le nerf sciatique fournit l’innervation musculaire et sensorielle à la majorité de l’arrière-point, sa résection a comme conséquence une affaiblissement grave de la fonction locomotrice. Après des blessures, les rats utilisent le talon de la patte pour le soutien du poids seulement (Figure 3B-E) et le membre est déplacé dans un mouvement circumducteur de balayage. Par conséquent, les changements locomoteurs évalués par l’intermédiaire de l’AGA deviennent apparents au moyen d’une zone d’impression considérablement réduite (figure 4A) et d’une augmentation significative du temps de swing (figure 4B). Les deux paramètres ont encore été considérablement modifiés par rapport aux mesures pré-OP à la fin de la période d’observation. Fait à noter, un animal a développé de fortes contractures de la patte arrière droite à partir de la semaine postopératoire (WPO) 10. Cela a entraîné une augmentation de la zone d’impression de la patte arrière droite à plus de 150% par rapport à la patte gauche à WPO12 (Figure 5). Comme il s’agissait d’un extrémité par rapport à tous les autres animaux évalués dans cette étude, nous avons exclu cet animal de l’analyse des données en ce qui concerne la zone d’impression.

Figure 3 : Empreintes représentatives de pattes avant et après la résection de taille critique du nerf sciatique droit et de la réparation d’autogreffe. Notez la forte diminution de la zone d’impression à la suited’une lésion nerveuse( B ) par rapport à préopératoirement (A). Malgré une légère augmentation de la zone d’impression au cours de la périoded’observation ( C-E), les empreintes de pattes du membre arrière droit sont restées particulièrement modifiées par rapport aux enregistrements de base. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4 : Le cours de la récupération fonctionnelle après la résection critique de taille et la réparation d’autogreffe du nerf sciatique. Le rapport de zoned’impression( A ) et le rapport de temps de oscillation (B) ont été statistiquement changés de manière significative des valeurs de pré-OP immédiatement après la résection sciatique de nerf. Bien que la zone d’impression soit demeurée sensiblement diminuée par rapport à la ligne de base jusqu’au WPO10, l’heure des fluctuations a tout de même été considérablement augmentée pour s’établir aux valeurs pré-OP à WPO12. *: p < 0,05 par rapport à Pré-OP, **: p < 0,01 par rapport à Pré-OP. Les barres d’erreur indiquent ±'erreur standard de la moyenne (SEM). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5 : Boxplot du cours de la zone d’impression suivant la blessure sciatique de nerf. Notez l’extrémité (ellipse rouge) à WPO12, ce qui s’explique par le fait qu’un animal a développé de fortes contractures de la patte arrière droite à partir de WPO10. L’animal a donc été exclu de l’analyse statistique affichée à la figure 4. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Neurotmésis fémorale de nerf
La résection fémorale de nerf a comme résultat la dénervation du muscle de quadriceps dela cuisse 33,34. En conséquence, l’extension de genou est altérée, ayant pour résultat l’hyperflexion de l’articulation de cheville avec le levage consécutif du talon de la patte. Par conséquent, la zone d’impression de la patte respective (figure 6B), est fortement réduite après la chirurgie. La zone d’impression de la patte arrière gauche est augmentée en raison d’un déplacement compensatoire du poids vers la gauche. Ceci devrait être gardé à l’esprit, car ce phénomène influence directement le rapport calculé entre la patte « expérimentale » et la patte « de contrôle ». À partir de WPO4, la réinnervation des quadriceps par le nerf fémoral régénérant entraîne l’inversion de ces changements, ce qui entraîne une augmentation de la zone d’impression paw de la patte arrière droite (figure 7A). Comme le muscle quadriceps de la cuisse joue également un rôle dans la phase de swing de la patte respective, Swing Time (Figure 7B) est grandement prolongée chez les rats avec des lésions nerveuses fémorales. Reflétant le retour de la zone d’impression, Swing Time diminue à mesure que le nerf fémoral régénérant atteint le muscle quadriceps de la cuisse. À WPO10, les deux paramètres de la démarche sont retournés à la ligne de base, signalant la récupération fonctionnelle complète.

Figure 6 : Empreintes de pattes représentatives. Empreintes de pattes représentatives avant (A) et suivant (B-E) résection du nerf fémoral droit et réparation autogreffe. La zone d’impression de RH a fortement diminué à WPO2 (B), tandis qu’une augmentation de la zone d’impression de la patte arrière gauche (LH) en raison de la charge de poids accrue est devenue visible. RH Print Area a commencé à augmenter à partir de WPO6 ( C )accompagnéd’une diminution de la zone d’impression de LH. À WPO8 (D) et WPO10 (E) Zone d’impression de RH récupéré près des niveaux préopératoires. (Adapté avec la permission de Heinzel et coll.22, sous licence CC BY 4.0.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
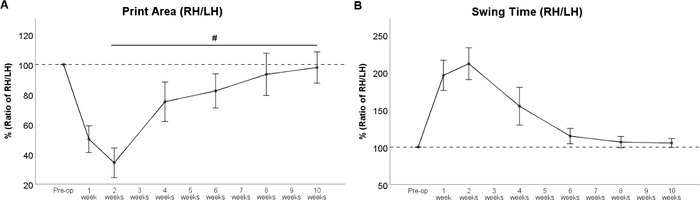
Figure 7 : Le cours de la récupération fonctionnelle après résection de 7 millimètres et réparation d’autogreffe du nerf fémoral. Le cours du rapport de zone d’impression (A) et du rapport de temps de oscillation (B) a indiqué un changement fort immédiatement après la résection fémorale de nerf, mais les valeurs ont récupéré de nouveau aux valeurs préopératoires à WPO8. #: p < 0,05. Les barres d’erreur indiquent ± sem. (Adapté avec la permission de Heinzel et coll.22, sous licence CC BY 4.0.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Contusion de la moelle épinière
L’analyse de la démarche a révélé des empreintes de pattes nettement altérées après une lésion thoracique de contusion de la moelle épinière (figure 8), le plus remarquable d’un décrément dans la zone d’impression et une rotation interne marquée des pattes postérieures à WPO2 (Figure 8B). Il convient de noter que la rotation des pattes est également implémentée en tant que caractéristique évaluable dans le BBB, soulignant l’applicabilité de l’analyse informatisée de la démarche pour évaluer les changements de démarche qui ont été évalués à l’origine avec des essais en plein champ. En ce qui concerne le cours des paramètres individuels de la démarche, la contusion de la moelle épinière auniveau th 11 a entraîné une diminution du rapport de zone d’impression (figure 9A) et l’augmentation du rapport de temps de balançoire (figure 9B). Les deux paramètres ont tendance vers des niveaux de référence au cours de la période d’observation, mais il n’y a pas eu de changements statistiquement significatifs observables. L’indice de régularité des paramètres liés à la coordination (figure 9C) a également diminué au WPO2, mais le degré variait considérablement d’un animal à l’autre. Il a également tendance vers des valeurs préopératoires jusqu’à WPO16. Base de soutien des pattes postérieures (Figure 9D), un paramètre général de la démarche selon Deumens, a montré une augmentation marquée, qui a été statistiquement significative de WPO10 jusqu’à WPO14. Il s’est orienté vers des niveaux de référence à WPO16 et n’a plus été sensiblement modifié par rapport à la valeur pré-OP à ce moment-là.

Figure 8 : Empreintes représentatives des pattes arrière des deux pattes postérieures. Empreintes de pattes préopératoirement ( A )etsuite à des lésions thoraciques de contusion de la moelle épinière (B-F). Notez la réduction de la surface d’impression à partir de WPO2 (B) accompagnée d’une rotation interne notable des pattes. Au cours de la période d’observation (C-F) une augmentation de la zone d’impression est observable ainsi que le dégagement de la rotation interne. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
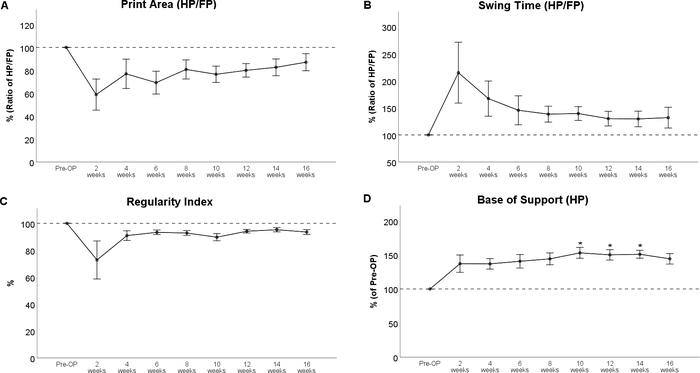
Figure 9 : Contusion de la moelle épinière au niveau Th 11. La contusion de la moelle épinière au Th 11 a entraîné des altérations observables du rapport de zone d’impression (A) et de l’heure de swing (B) et de l’indice de régularité (C), mais ces changements n’étaient pas statistiquement significatifs. À la suite d’une blessure, la base de soutien des pattes postérieures a montré une augmentation marquée par rapport à la ligne de base, ce qui était statistiquement significatif à WPO10 jusqu’à WPO14. *: p < 0,05 par rapport à Pré-OP. Les barres d’erreur indiquent ± sem. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Fichier supplémentaire 1 : Détails du dépannage. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
L’évaluation de la récupération fonctionnelle dans les modèles animaux de pni et sci reste difficile en raison de la grande variété de méthodes d’évaluation, chacune avec des avantages et des inconvénients individuels. Seules quelques approches ont été testées et validées dans de multiples modèles de lésions nerveuses périphériques et centrales, bien que de nouvelles techniques prometteuses qui combinent le suivi des mouvements et l’apprentissage automatique pourraient potentiellement propulser la recherche neurocomportemental au niveau suivant des tests fonctionnels. Nous sommes convaincus que des méthodes de pointe largement applicables à une grande variété de modèles d’animaux et de blessures émergeront bientôt. À la lumière de ces considérations, l’un des avantages de l’AGA est la possibilité d’évaluer la récupération fonctionnelle dans plusieurs modèles de lésions nerveuses à l’aide d’un seul appareil. Depuis le début des années 2000, cette approche a été utilisée dans des modèles expérimentaux de PNI tels que lesciatique 37, peroneal38, et le modèle de lésions nerveuses fémorales22 ainsi que l’avulsion des racines de l’avulsion lombaire39 et le plexus brachial40. Diverses blessures nerveuses centrales, y compris des lésions de contusion de la moelle épinière ont également été étudiéesavec la méthode 41,42. Avec cet article, nous avons présenté un protocole détaillé sur la façon d’induire trois lésions nerveuses couramment étudiées ainsi que la façon d’évaluer la récupération fonctionnelle par la suite. À notre avis, une ligne directrice pratique pour les chercheurs intéressés par le domaine des lésions nerveuses expérimentales, de la réparation et de la régénération sur la façon d’utiliser de façon optimale les caractéristiques avantageuses de la méthode serait d’une grande aide.
Plusieurs auteurs se sont adressés au potentiel d’AGA d’évaluer la récupération fonctionnelle chez les rongeurs, soulignant l’avantage de la méthode d’évaluer simultanément les paramètres de démarche liés à la réinnervation motrice et sensorielle27,28. En outre, la comparaison des données d’une patte expérimentale, par exemple, les lésions nerveuses reconstruites à une patte non opérante comme cela a été montré dans les deux modèles présentés permet l’inclusion d’un contrôle positif intra-animal. Inversement, une patte opérée sans reconstruction chirurgicale ou traitement supplémentaire pourrait servir de contrôle négatif intra-animal. Il a également été démontré qu’il est possible de combiner AGA avec des approches d’apprentissage automatique43. Malgré les avantages de la méthode, elle présente également plusieurs limitations et inconvénients, tels que les efforts de formation qui prennent beaucoup de temps, qui sont obligatoires pour habituer l’animal à la procédure d’acquisition28,44. Une autre limitation de l’AGA est la taille maximale des animaux admissibles à l’essai en raison des dimensions limitées de l’appareil. Par conséquent, l’utilisation de l’AGA est actuellement limitée aux animaux de la taille de rongeurs et furets45. En outre, les approches d’évaluation neurocomportemental récemment émergentes dans le domaine du suivi des mouvements capables d’apprentissage automatique peuvent dépasser l’AGA tant dans l’exhaustivité que dans les applicationspossibles 18,19,46. Plus remarquable, mais conformément à d’autres méthodes d’évaluation, il semble que la récupération fonctionnelle telle qu’évaluée par AGA est fortement limitée, voire se produisant, dans les modèles de neurotmésis nerveuxsciatique 47,48. D’autre part, AGA permet l’évaluation complète du cours de la récupération fonctionnelle suivant la neurotmesis fémorale de nerf comme montré par nos données. Avec ce travail, nous avons démontré que Paw Print Area est un paramètre de démarche représentatif évaluable par l’intermédiaire d’AGA, ce qui est exemplaire pour le cours de la récupération fonctionnelle dans les deux modèles de lésions nerveuses périphériques susmentionnées présentés par nous. Tandis que l’intégrum fonctionnel d’annonce de rétablissement était observable après réparation d’autograft du nerf fémoral, les paramètres d’AGA ont été sensiblement changés de la ligne de base à la fin de la période d’observation suivant la réparation d’autogreffe du nerf sciatique. Il convient de noter dans ce contexte que les contractures des membres sont un phénomène courant chez les rats avec des lésions nerveuses sciatiques et la prudence est nécessaire pour ne pas confondre ces signes de déséquilibre musculaire et de paralysie avec la récupération fonctionnelleen cours 32. Ceci d’une part souligne l’incapacité de la méthode d’AGA de détecter la récupération fonctionnelle significative suivant des dommages de neurotmesis dans ce modèle. D’autre part, il soulève la question de savoir s’il est possible d’évaluer le modèle de lésion sciatique des lésions nerveuses du rat, qui est encore le modèle expérimental de réparation des nerfs le plus couramment utilisé, au moyen de l’analyse de la démarche en général au cas où les lésions nerveuses sont plus graves que l’axonotmésis48. Les détails du dépannage sont fournis dans le fichier supplémentaire 1.
Nous avons également fourni des données exemplaires sur l’utilisation de la méthode pour évaluer la fonction locomotrice chez les rats ayant subi une lésion de la moelle épinière, ce qui est possible sans aucun changement requis de la configuration matérielle ou de la procédure d’acquisition. Le même principe s’applique à d’autres modèles de rongeurs de lésions nerveuses centrales (CNI)26,49,50 etles lésions de l’avulsion des racines. Contrairement aux INN isolées, les lésions de la moelle épinière sont beaucoup plus complexes dans leurs conséquences pathophysiologiques, car une multitude de structures très importantes sont endommagées, impliquant des voies efferent telles que les voies corticospinales et rubrospinales et des voies afferentes telles que les colonnes dorsales et les voies spinothalamiques35. Le défi d’évaluer adéquatement ces changements pathologiques se reflète dans l’arsenal complet des tests comportementaux, tels que le basso, Beattie, et Bresnahan (BBB) score36. Le paramètre de démarche Base of Support a été signalé à augmenter à la suite de blessures nerveuses centrales, très probablement pour expliquer une démarche instable résultant. La base de soutien a été sensiblement changée de la ligne de base de WPO10 jusqu’à WPO14 dans notre modèle, soutenant notre présomption que ce paramètre permet l’évaluation du cours du rétablissement fonctionnel par AGA suivant la lésion thoracique de contusion de moelle épinière.
Nous sommes convaincus que l’AGA est un outil réalisable pour évaluer la récupération fonctionnelle chez les rongeurs ayant subi des blessures au système nerveux. Néanmoins, nous conseillons de refléter soigneusement et soigneusement les changements observés de démarche dans chaque configuration expérimentale respective. Les modifications apportées aux paramètres de la démarche, par exemple, une augmentation de la zone d’impression à la suite d’une diminution postopératoire immédiate ou d’une diminution du temps de balançoire procédant à une élévation postopératoire immédiate de ce paramètre, au cours de la période d’observation, ne se rapportent pas inévitablement à la récupération fonctionnelle. Au lieu de cela, ces changements peuvent également être liés à une adaptation fonctionnelle possible pour maintenir une démarche discrète, étant donné que les rats sont une espèce proie et essayer d’éviter de montrer de la douleur ou de l’incapacité aux prédateurspotentiels 51. Il est donc recommandé d’utiliser l’analyse automatisée de la démarche comme outil complémentaire pour relier les changements de démarche à d’autres mesures des résultats des lésions nerveuses périphériques et de larégénération 21. Comme mentionné précédemment, nous croyons également qu’il devrait être soigneusement reflété si les rongeurs avec la neurotmésis sciatique de nerf devraient être étudiés au moyen de l’AGA car notre conclusion indique fortement que la récupération fonctionnelle est sévèrement limitée dans ce cas.
Comme le montrent nos travaux, le principal atout d’AGA est la possibilité d’étudier à la fois la réinnervation motrice et sensorielle dans une multitude de modèles expérimentaux PNI ainsi que CNI tout en ne nécessitant qu’une seule configuration. Par conséquent, la méthode est, à notre avis, un outil très précieux pour des tests neurocomportementaux complets. L’un des atouts d’AGA, qui est la possibilité d’étudier la réinnervation motrice et sensorielle dans divers modèles animaux de PNI et CNI tout en ne nécessitant qu’une seule configuration, est à notre avis le principal avantage de la méthode par rapport à d’autres méthodes d’évaluation pour étudier la récupération fonctionnelle, telles que l’analyse des pistesde marche 52, Von Freytestant 53, ou la cinématique démarche16. Le potentiel d’évaluer simultanément les changements de démarche qui sont soit corrélés avec les résultats des investigations électrophysiologiques du muscle réinnervated22 ou des méthodes d’évaluation pour la fonctionsensorielle 54 est prometteur en ce qui concerne les applications futures de la méthode. Nous recommandons donc d’utiliser aga pour étudier la récupération fonctionnelle dans les modèles de rongeurs de PNI antérieur, tels que l’ulnaire, le nerf radial ou médian, ou les modèles expérimentaux de transfert denerf 55, qui restent non étudiés avec cette méthode encore.
Nous fournissons par la présente un protocole détaillé sur la façon d’utiliser l’analyse automatisée de la démarche pour étudier la récupération fonctionnelle dans trois modèles de rongeurs de lésions nerveuses. Bien que la méthode exige un examen attentif de divers aspects clés tels que la formation adéquate et l’étalonnage méticuleux dur et logiciel, c’est un outil complémentaire faisable et précieux pour évaluer la régénération nerveuse dans les modèles de rongeurs de lésions nerveuses centrales et périphériques.
Déclarations de divulgation
Les auteurs déclarent que ces travaux ont été appuyés par Noldus Inc. par la couverture des frais de publication en libre accès. Aucun des auteurs n’a reçu de salaire personnel ou de pourboire financier. Les auteurs n’ont pas d’autres intérêts concurrents à déclarer.
Remerciements
Les auteurs tenons à remercier Karin Brenner pour sa prise en charge passionnée des animaux. Les auteurs aimeraient également remercier Claudia Keibl, James Ferguson, Gabriele Leinfellner et Susanne Drechsler pour leur aide pendant les chirurgies expérimentales.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | B. Braun Austria | 3570410 | Vehicle for drug delivery |
| 1 ml syringe | B. Braun Austria | 9161708V | Injecting device |
| 10 ml syringe | B. Braun Austria | 4606728 V | Injecting device |
| 1-Propanol, 2-Propanol, Hexetidin | Gebro Pharma | N/A | Alcoholic skin disinfection |
| 23-gauge (G) canula | B. Braun Austria | 4657667 | Canula for s.c. injection |
| 26-gauge (G) canula | B. Braun Austria | 4657683 | Canula for s.c. injection |
| 5 ml syringe | B. Braun Austria | 4606710 V | Injecting device |
| Buprenorphine hydrochloride | Sigma | B9275 | Analgetic agent |
| Burrs for Micro Drill | F.S.T | 19007-29 | Drilling of a hole inside the lamina |
| Caprofen | Zoetis Austria | N/A | Analgetic agent |
| Catwalk Automated gait analysis system | Noldus | N/A | Automatic analysis software of animal gait |
| Cauterizer Kit | F.S.T | 18010-00 | Cauterization of vessels during surgery |
| Enrofloxacin | Bayer Austria | N/A | Antibiotic |
| Ethilon (10-0) | ETHICON | 2810G | Suture material for neurrorhaphy |
| Ethilon (11-0) | ETHICON | EH7465G | Suture material for neurrorhaphy |
| Eye ointment | Fresenius Kabi Austria | 4302436 | Eye protection during anesthesia |
| Friedman-Pearson Rongeurs | F.S.T | 16221-14 | Surgical instrument |
| Gabapentin | Wedgewood Pharmacy | N/A | Analgetic agent |
| Goldstein retractor | F.S.T | 17003-03 | Retraction of tissues during surgery |
| Hair trimmer | Aescular | N/A | Hair trimmer for shaving of the operation site prior to surgery |
| Heating Pad for rodents | ALA Scientific Instruments | N/A | Regulation of body temperature |
| Impactor | Precision Systems and Instrumentation | N/A | Induction of spinal cord contusion |
Lewis rat ( ) ) | Janvier | N/A | Experimental animal |
| Magnetic Fixator Retraction System | F.S.T | 18200-50 | Retraction of tissues during surgery |
| Metzenbaum Baby Scissors | F.S.T | 14019-13 | Surgical instrument |
| Micro Drill | Word Precision Instruments | 503599 | Instrument for bone drilling |
| Micro Needle holder | F.S.T | 12076-12 | Surgical instrument |
| Micro-scissors (curved) | F.S.T | 15023-10 | Surgical instrument |
| Micro-scissors (straight) | F.S.T | 15007-08 | Surgical instrument |
| Mirror Finish Forceps | F.S.T | 11251-23 | Surgical instrument |
| Needle holder | F.S.T | 12002-12 | Surgical instrument |
| Operating microscope | Leica | M651 MSD | Magnification of the operative site |
| Povidone Iod | B. Braun Melsungen | N/A | Non-alcoholic skin disinfectant |
| Pulse Oximeter | STARR Life Sciences | N/A | Surveillance of heart rate and oxygen saturation |
| Rodent thermometer | BIOSEB | BIO-TK8851 | Surveillance of body temperature |
| Scalpel blade | F.S.T | 10010-00 (#10) | Surgical instrument to make an incision |
| Scalpel handle | F.S.T | 10003-12 (#3) | Surgical instrument to make an incision |
| Sevoflurane Inhalation Vapour, Liquid (100%) | Baxter | HDG9117A | Anesthetic |
| Spatula & Probe | F.S.T | 10090-13 | Surgical instrument |
Sprague Dawley rat ( ) ) | Janvier | N/A | Experimental animal |
| Sterila gauze 5x5cm | EVAC MEDICAL | E010.03.00215 | Sterile gauze compress |
| Tissue Forceps | F.S.T | 11021-12 | Surgical instrument |
| Vicryl (4-0) | ETHICON | V3040H | Suture material for subcutaneous sutures |
| Vicryl (5-0) | ETHICON | V303H | Suture material for subcutaneous sutures |
| Vicryl cutting needle (4-0) | ETHICON | V392ZH | Suture material for skin sutures |
| Vicryl cutting needle (5-0) | ETHICON | V391H | Suture material for skin sutures |
Références
- Mohanty, C. B., Bhat, D. I., Devi, B. I. Use of animal models in peripheral nerve surgery and research. Neurology India. 9, Supplement 100-105 (2019).
- Vela, F. J., et al. Animal models used to study direct peripheral nerve repair: a systematic review. Neural Regeneration Research. 15 (3), 491-502 (2020).
- Verma, R., Virdi, J. K., Singh, N., Jaggi, A. S. Animals models of spinal cord contusion injury. The Korean Journal of Pain. 32 (1), 12-21 (2019).
- de Medinaceli, L., Freed, W. J., Wyatt, R. J. An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Experimental Neurology. 77 (3), 634-643 (1982).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. The European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Sperry, R. W. The functional results of muscle transposition in the hind limb of the rat. The Journal of Comparative Neurology. 73 (3), 379-404 (1940).
- Sperry, R. W. The effect of crossing nerves to antagonistic muscles in the hind limb of the rat. The Journal of Comparative Neurology. 75 (1), 1-19 (1941).
- Sperry, R. W. Transplantation of motor nerves and muscles in the forelimb of the rat. The Journal of Comparative Neurology. 76 (2), 283-321 (1942).
- Zimmerman, E. A., Chambers, W. W., Liu, C. N. An experimental study of the anatomical organization of the Cortico-Bulbar System in the Albino Rat. The Journal of Comparative Neurology. 123, 301-323 (1964).
- Cohen, A. H., Gans, C. Muscle activity in rat locomotion: movement analysis and electromyography of the flexors and extensors of the elbow. Journal of Morphology. 146 (2), 177-196 (1975).
- Barnett, S. A. The Rat: A Study in Behaviour. , Aldine Publishing Company. (1963).
- Hare, G. M., et al. Walking track analysis: utilization of individual footprint parameters. Annals of Plastic Surgery. 30 (2), 147-153 (1993).
- Hare, G. M., et al. Walking track analysis: a long-term assessment of peripheral nerve recovery. Plastic and Reconstructive Surgery. 89 (2), 251-258 (1992).
- Bertelli, J. A., Mira, J. C. Behavioral evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journa of Neuroscience Methods. 46 (3), 203-208 (1993).
- Varejao, A. S., Melo-Pinto, P., Meek, M. F., Filipe, V. M., Bulas-Cruz, J. Methods for the experimental functional assessment of rat sciatic nerve regeneration. Neurological Research. 26 (2), 186-194 (2004).
- Varejao, A. S., et al. Functional assessment of peripheral nerve recovery in the rat: gait kinematics. Microsurgery. 21 (8), 383-388 (2001).
- Varejao, A. S., et al. Ankle kinematics to evaluate functional recovery in crushed rat sciatic nerve. Muscle and Nerve. 27 (6), 706-714 (2003).
- Nath, T., et al. Using DeepLabCut for 3D markerless pose estimation across species and behaviors. Nature Protocols. 14 (7), 2152-2176 (2019).
- Mathis, A., et al. DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nature Neuroscience. 21 (9), 1281-1289 (2018).
- Deumens, R., Jaken, R. J., Marcus, M. A., Joosten, E. A. The CatWalk gait analysis in assessment of both dynamic and static gait changes after adult rat sciatic nerve resection. Journal of Neuroscience Methods. 164 (1), 120-130 (2007).
- Heinzel, J., et al. Use of the CatWalk gait analysis system to assess functional recovery in rodent models of peripheral nerve injury - a systematic review. Journal of Neuroscience Methods. 345, 108889(2020).
- Heinzel, J. C., Hercher, D., Redl, H. The course of recovery of locomotor function over a 10-week observation period in a rat model of femoral nerve resection and autograft repair. Brain and Behavior. , 01580(2020).
- Chen, S. H., et al. Changes in GABA and GABA(B) receptor expressions are involved in neuropathy in the rat cuneate nucleus following median nerve transection. Synapse. 66 (6), 561-572 (2012).
- Chen, S. H., et al. Decreases of glycine receptor expression induced by median nerve injury in the rat cuneate nucleus contribute to NPY release and c-Fos expression. Life Sciences. 90 (7-8), 278-288 (2012).
- Hetze, S., Romer, C., Teufelhart, C., Meisel, A., Engel, O. Gait analysis as a method for assessing neurological outcome in a mouse model of stroke. Journal of Neuroscience Methods. 206 (1), 7-14 (2012).
- Sandner, B., et al. Systemic epothilone D improves hindlimb function after spinal cord contusion injury in rats. Experimental Neurology. 306, 250-259 (2018).
- Kappos, E. A., et al. Validity and reliability of the CatWalk system as a static and dynamic gait analysis tool for the assessment of functional nerve recovery in small animal models. Brain and Behavior. 7 (7), 00723(2017).
- Deumens, R., Marinangeli, C., Bozkurt, A., Brook, G. A. Assessing motor outcome and functional recovery following nerve injury. Methods in Molecular Biology. 1162, 179-188 (2014).
- Webster, G. V. Halstedian principles in the practice of plastic and reconstructive surgery. Stanford Medical Bulletin. 13 (3), 315-316 (1955).
- Bozkurt, A., et al. A flexible, sterile, and cost-effective retractor system for microsurgery. Microsurgery. 31 (8), 668-670 (2011).
- Carr, M. M., Best, T. J., Mackinnon, S. E., Evans, P. J. Strain differences in autotomy in rats undergoing sciatic nerve transection or repair. Annals of Plastic Surgery. 28 (6), 538-544 (1992).
- Dellon, A. L., Mackinnon, S. E. Sciatic nerve regeneration in the rat. Validity of walking track assessment in the presence of chronic contractures. Microsurgery. 10 (3), 220-225 (1989).
- Jackson, C. M. Anatomy of the rat. Transactions of the American Philosophical Society, Philadelphia, New Series, Volume XXVII, 1935. The Anatomical Record. 65 (1), By Eunice Chace Greene. With Foreword by Henry H Donaldson 127-129 (1936).
- Pena, M. C., Baron, J. Femoral nerve and rectus femoris muscle of the rat: a study in anatomy, histology, and histoenzymes. Annals of Plastic Surgery. 20 (6), 527-532 (1988).
- Kjell, J., Olson, L. Rat models of spinal cord injury: from pathology to potential therapies. Disease Models and Mechanisms. 9 (10), 1125-1137 (2016).
- Basso, D. M., Beattie, M. S., Bresnahan, J. C. A sensitive and reliable locomotor rating scale for open field testing in rats. Journal of Neurotrauma. 12 (1), 1-21 (1995).
- Bozkurt, A., et al. CatWalk gait analysis in assessment of functional recovery after sciatic nerve injury. Journal of Neuroscience Methods. 173 (1), 91-98 (2008).
- Godinho, M. J., et al. Immunohistochemical, ultrastructural and functional analysis of axonal regeneration through peripheral nerve grafts containing Schwann cells expressing BDNF, CNTF or NT3. PLoS One. 8 (8), 69987(2013).
- Pajenda, G., et al. Spatiotemporally limited BDNF and GDNF overexpression rescues motoneurons destined to die and induces elongative axon growth. Experimental Neurology. 261, 367-376 (2014).
- Matsuura, Y., et al. The effect of anti-NGF receptor (p75 Neurotrophin Receptor) antibodies on nociceptive behavior and activation of spinal microglia in the rat brachial plexus avulsion model. Spine (Phila Pa 1976). 38 (6), 332-338 (2013).
- Hamers, F. P., Lankhorst, A. J., van Laar, T. J., Veldhuis, W. B., Gispen, W. H. Automated quantitative gait analysis during overground locomotion in the rat: its application to spinal cord contusion and transection injuries. Journal of Neurotrauma. 18 (2), 187-201 (2001).
- Koopmans, G. C., et al. The assessment of locomotor function in spinal cord injured rats: the importance of objective analysis of coordination. Journal of Neurotrauma. 22 (2), 214-225 (2005).
- Frohlich, H., Claes, K., De Wolf, C., Van Damme, X., Michel, A. A machine learning approach to automated gait analysis for the Noldus Catwalk system. IEEE Transaction on Bio-medical Engineering. 65 (5), 1133-1139 (2018).
- Batka, R. J., et al. The need for speed in rodent locomotion analyses. Anatomical Record (Hoboken, N. J). 297 (10), 1839-1864 (2014).
- Wood, T., et al. A ferret model of encephalopathy of prematurity. Developmental Neuroscience. 40 (5-6), 475-489 (2018).
- Abbas, W., Masip Rodo, D. Computer methods for automatic locomotion and gesture tracking in mice and small animals for neuroscience applications: a survey. Sensors. 19 (15), Basel, Switzerland. (2019).
- Irintchev, A. Potentials and limitations of peripheral nerve injury models in rodents with particular reference to the femoral nerve. Annals of Anatomy. 193 (4), 276-285 (2011).
- Haastert-Talini, K. Modern Concepts of Peripheral Nerve Repair. Haastert-Talini, K., Assmus, H., Antoniadis, G. , Springer International Publishing. 127-138 (2017).
- Lu, L., et al. Growth differentiation factor 11 promotes neurovascular recovery after stroke in mice. Frontiers in Cellular Neuroscience. 12, (2018).
- Caballero-Garrido, E., Pena-Philippides, J. C., Galochkina, Z., Erhardt, E., Roitbak, T. Characterization of long-term gait deficits in mouse dMCAO, using the CatWalk system. Behavioral Brain Research. 331, 282-296 (2017).
- Graham, D. M., Hampshire, V. Methods for measuring pain in laboratory animals. Lab Animal. 45 (3), 99-101 (2016).
- Monte-Raso, V. V., Barbieri, C. H., Mazzer, N., Yamasita, A. C., Barbieri, G. Is the sciatic functional index always reliable and reproducible. Journal of Neuroscience Methods. 170 (2), 255-261 (2008).
- Stossel, M., et al. Comparative evaluation of chitosan nerve guides with regular or increased bendability for acute and delayed peripheral nerve repair: a comprehensive comparison with autologous nerve grafts and muscle-in-vein grafts. Anatomical Record (Hoboken). 301 (10), 1697-1713 (2018).
- Vrinten, D. H., Hamers, F. F. CatWalk' automated quantitative gait analysis as a novel method to assess mechanical allodynia in the rat; a comparison with von Frey testing. Pain. 102 (1-2), 203-209 (2003).
- Aman, M., Sporer, M., Bergmeister, K., Aszmann, O. Animal models for selective nerve transfers of the upper extremity. Handchirurgie Mikrochirurgie Plastische Chirurgie. 51 (4), 319-326 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon