Method Article
Imágenes transpupilares de dos fotones in vivo de la retina del ratón
En este artículo
Resumen
La imagen in vivo es una herramienta poderosa para el estudio de la biología en la salud y la enfermedad. Este protocolo describe imágenes transpupilares de la retina del ratón con un microscopio estándar de dos fotones. También demuestra diferentes métodos de imagen in vivo para etiquetar fluorescentemente múltiples cohortes celulares de la retina.
Resumen
La retina transforma las señales de luz del entorno en señales eléctricas que se propagan al cerebro. Las enfermedades de la retina son prevalentes y causan discapacidad visual y ceguera. Comprender cómo progresan estas enfermedades es fundamental para formular nuevos tratamientos. La microscopía in vivo en modelos animales de enfermedad es una herramienta poderosa para comprender la neurodegeneración y ha llevado a un progreso importante hacia el tratamiento de afecciones que van desde la enfermedad de Alzheimer hasta el accidente cerebrovascular. Dado que la retina es la única estructura del sistema nervioso central inherentemente accesible por enfoques ópticos, naturalmente se presta hacia imágenes in vivo. Sin embargo, la óptica nativa de la lente y la córnea presenta algunos desafíos para el acceso efectivo a las imágenes.
Este protocolo describe métodos para obtener imágenes in vivo de dos fotones de cohortes y estructuras celulares en la retina del ratón a resolución celular, aplicables para experimentos de imágenes de duración aguda y crónica. Presenta ejemplos de células ganglionares de la retina (RGC), células amacrinas, microgliales e imágenes vasculares utilizando un conjunto de técnicas de etiquetado que incluyen vectores de virus adenoasociados (AAV), ratones transgénicos y colorantes inorgánicos. Es importante destacar que estas técnicas se extienden a todos los tipos de células de la retina, y se describen los métodos sugeridos para acceder a otras poblaciones celulares de interés. También se detallan ejemplos de estrategias para el postprocesamiento manual de imágenes para su visualización y cuantificación. Estas técnicas son directamente aplicables a los estudios de la función retiniana en la salud y la enfermedad.
Introducción
La visualización in vivo del sistema nervioso central generalmente requiere procedimientos invasivos como el adelgazamiento del cráneo y la instalación de ventanas de vidrio o lentes de relé óptico. La retina es la única estructura en el sistema nervioso que se puede observar directamente sin la necesidad de una preparación invasiva, ya que recibe luz nativa del medio ambiente. La facilidad de acceso óptico a la retina lo convierte en un sistema modelo atractivo para estudiar el sistema nervioso central.
Las imágenes fluorescentes en vivo de la retina en ratones se han utilizado para rastrear la muerte por RGC en modelos de glaucoma 1,2, lesión del nervio óptico 1,3,4 y accidente cerebrovascular5, así como cambios en la activación microglial 6,7,8 y vasculatura9 en condiciones degenerativas. Las señales intrínsecas también se pueden utilizar para visualizar fotorreceptores 10,11,12 y células epiteliales pigmentarias de la retina 13. Muchos enfoques para la obtención de imágenes in vivo de la retina utilizan dispositivos altamente especializados diseñados específicamente para fines oftalmológicos6 o sistemas ópticos altamente modificados para corregir las aberraciones nativas de la córnea y el cristalino 8,9,11,12,13,14.
El presente protocolo demuestra un enfoque para la obtención de imágenes in vivo de señales fluorescentes en la retina a resolución celular, utilizando un método básico de corrección parcial de la óptica anterior del ojo del ratón. Esta estrategia requiere adaptaciones muy pequeñas a las configuraciones de microscopio multifotónico que se usan comúnmente para obtener imágenes in vivo del cerebro. Como este enfoque es fácil de configurar, y los ratones están bajo poco estrés, es propicio para realizar experimentos de lapso de tiempo durante duraciones agudas y crónicas. Además, los procedimientos genéticos y orgánicos basados en colorantes que etiquetan componentes individuales de la retina, incluidas las CGR, las células amacrinas, la microglía y la vasculatura, son compatibles con esta técnica de imagen y permiten la observación in vivo de tipos de células y estructuras críticas para la función retiniana. Estas herramientas se pueden adaptar para etiquetar la mayoría de los otros tipos de células neuronales, así como los componentes gliales y vasculares de la retina.
Protocolo
NOTA: El siguiente procedimiento se realizó de conformidad con las pautas del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Washington en St. Louis. Consulte la Tabla de materiales para obtener detalles sobre los reactivos, el equipo y los animales utilizados en este estudio.
1. Inyección de virus adenoasociados
NOTA: El etiquetado de células específicas en la retina se puede lograr en líneas de ratones transgénicos Cre con patrones de expresión restringidos. Esta sección describe la administración intravítrea de vectores AAV que codifican la expresión dependiente de Cre de una proteína fluorescente, marcando así células retinianas específicas. Inyecte ratones (machos y hembras), a partir de las 4 semanas de edad.
- Preparación de la aguja de micropipeta
- Utilice un extractor de micropipetas para crear una aguja capilar de vidrio de borosilicato. Cargue un capilar de vidrio en el extractor de micropipetas y realice la prueba de rampa, registrando el valor resultante. Deseche el capilar de vidrio utilizado para la prueba de rampa.
- Tire de las micropipetas con los siguientes ajustes: calor: valor de prueba de rampa menos 10; tirón: 55; velocidad: 65; tiempo: 120; presión de aire: 500; Tiempo de aire al inicio de la extracción: 20.
NOTA Es posible que sea necesario ajustar la configuración para diferentes extractores. - Bajo un microscopio de disección, use una cuchilla de afeitar para cortar la punta de la micropipeta tirada en el lugar donde la punta de vidrio se desvía ligeramente bajo fuerza, ~ 10 mm del extremo de la sección cónica. Corte en un ángulo agudo tal que el corte produzca una punta biselada. Deseche las puntas contundentes.
- Preparación de la jeringa para inyección
- Coloque una micropipeta de vidrio cortada en un segmento de 2 cm de tubo de plástico de acetato de etilo y vinilo (EVA) (0.05" de diámetro interior, 0.09" de diámetro exterior). Conecte el otro extremo de este segmento de tubería a una longitud de 20 cm de tubería EVA (0.02" de diámetro interior, 0.06" de diámetro exterior).
- Conecte el tubo a una jeringa de vidrio de 50 μL con una aguja cementada de 22 G. Retire el émbolo de la jeringa de vidrio y rellene la jeringa y el tubo conectado con aceite mineral utilizando una aguja de jeringa de 25 G. Deje 4 mm de espacio de aire en la punta de la micropipeta.
- Inyección intravítrea de AAV
- Realizar inyección intravítrea con técnica aséptica estándar, utilizando guantes quirúrgicos estériles, bata de laboratorio limpia, mascarilla, campo estéril e instrumentos esterilizados en autoclave de acuerdo con los protocolos institucionales para la cirugía de supervivencia.
- Retirar una alícuota del vector AAV del almacenamiento a -80 °C y descongelar en hielo. Después de la descongelación, centrifugar durante 10 s a 2.000 × g para eliminar cualquier burbuja de aire.
- Siga las pautas de anestesia y sustancias controladas del Comité de Estudios Animales institucional. Usando una aguja hipodérmica de 30 G, realice una inyección intraperitoneal (IP) de 0,1 ml / 10 g de peso corporal de un cóctel de ketamina / xilazina (10 mg / ml de ketamina, 1 mg / ml de xilazina en solución salina, dosis efectiva para ratón: 100 mg / kg de ketamina, 10 mg / kg de xilazina). Devuelva el ratón a su jaula y espere 5 minutos para que la anestesia haga efecto.
- Usando una aguja hipodérmica de 30 G, realice una inyección subcutánea de meloxicam de 0,1 mL/10 g de peso corporal (0,5 mg/ml en cloruro de sodio al 0,9%).
- Pruebe la profundidad de la anestesia confirmando la pérdida del reflejo corneal y el reflejo de retirada en el pellizco de la cola y el dedo del pie. Si el reflejo corneal persiste después de la pérdida del reflejo de retirada de la cola y el dedo del pie, aplique una gota de solución de proparacaína al 0,5% en cada ojo y espere 10 s.
- Coloque el ratón de lado debajo del microscopio estereoscópico. Use una mini pinza hemostática bulldog para agarrar la piel superior e inferior a la órbita, y asegure la pinza en el canto medial para desplazar parcialmente el globo fuera de la órbita.
- Perfore la esclerótica lateral con la micropipeta cortada conectada a la jeringa de vidrio, ~1-2 mm posterior al limbo. Evite alterar la vasculatura que corre circunferencialmente inmediatamente posterior al limbo. Realice la punción en un ángulo perpendicular a la esclerótica y retraiga ligeramente la micropipeta inmediatamente después de perforar la esclerótica para evitar dañar la lente.
- Utilice el émbolo de la jeringa de vidrio para extraer 1-2 μL de humor vítreo, que corresponde aproximadamente al volumen de líquido destinado a la inyección. Retire la micropipeta del ojo y expulse el humor vítreo eliminado.
- Llene la punta de la micropipeta con 1-2 μL de AAV, dejando ~4 mm de espacio de aire entre el vector viral y el aceite mineral para evitar la mezcla. Inserte la micropipeta en el orificio de la esclerótica creado por la primera punción y presione lentamente el émbolo de la jeringa de vidrio para inyectar el vector viral en el transcurso de 20-30 s. Visualice el nivel de líquido del vector viral en la punta de la micropipeta y tenga cuidado de dejar de inyectar antes de que entre aire en el ojo.
- Mantenga la micropipeta en la misma posición durante 10 s y, a continuación, retraiga la micropipeta. Retire la pinza hemostática bulldog.
- Aplique ungüento oftálmico antibiótico oxitetraciclina/polimixina B en el ojo inyectado. Colocar el ratón sobre una almohadilla térmica y controlar su recuperación de la anestesia (véase 3.4.3).
- Devuelva el ratón a su carcasa y realice el cuidado postoperatorio según las pautas institucionales. Espere 2-3 semanas para la expresión mediada por virus de fluoróforos antes de la obtención de imágenes.
2. Configuración del microscopio
NOTA: En la Figura 1 se muestra un esquema de la trayectoria de la luz del microscopio.
- Equipo "siempre encendido": Estos instrumentos siempre deben permanecer encendidos a menos que se sometan a ajustes o mantenimiento. Ajuste la temperatura alta del sistema de refrigeración por láser a 20,0 °C. Encienda la alimentación principal del láser Ti:Sapphire ultrarrápido, deje tiempo para completar los procesos de inicio del sistema y gire la tecla "Laser Enable" a la posición "On".
- Configuración de la trayectoria de la luz de emisión
- Configure la ruta de recolección de emisiones de fluorescencia para muestrear longitudes de onda utilizando conjuntos de filtros dicroicos y de paso de banda apropiados para los fluoróforos de interés.
NOTA: En este manuscrito, las imágenes de Twitch2b utilizaron un cubo de filtro que consiste en un 505 par de filtros dicroicos de paso largo y 480/40 y 535/30. Se obtuvo una imagen de GFP utilizando un cubo de filtro rojo/verde que consiste en un filtro de paso largo 560 con filtros de paso de banda 525/50 y 605/70. Evans Blue fue fotografiado usando un filtro de paso corto 560. El cambio de filtros de emisión expone la trayectoria de la luz de emisión a la luz parásita de la habitación que podría dañar los tubos fotomultiplicadores (PMT). Asegúrese de que los PMT estén apagados y apague las luces de la habitación antes de modificar la ruta de luz de recolección, ya que la exposición a la luz puede afectar negativamente la función de PMT.
- Configure la ruta de recolección de emisiones de fluorescencia para muestrear longitudes de onda utilizando conjuntos de filtros dicroicos y de paso de banda apropiados para los fluoróforos de interés.
- Inicio de la adquisición de imágenes
NOTA: La exposición directa al láser de dos fotones es peligrosa, especialmente para el ojo, ya que la luz roja lejana no inducirá una respuesta de parpadeo. Se debe tener el cuidado adecuado para garantizar que el láser esté cerrado a lo largo de la trayectoria de la luz, y se hayan instalado sistemas de seguridad para proteger al usuario de la exposición a través de los oculares o las emisiones del objetivo del microscopio. Los usuarios deben comprender en qué condiciones emitirá el láser desde el objetivo y tomar las precauciones adecuadas para no exponerse a tales peligros.- Encienda el dispositivo de adquisición de datos, la computadora, la celda Pockels, el microscopio y el controlador de escenario, el controlador de obturador mecánico y la alimentación principal PMT. Mantenga los PMT en el estado "Deshabilitado" hasta que estén listos para la adquisición de imágenes y protegidos de la luz parásita. Abra la interfaz de control láser en la computadora y el software de adquisición de imágenes. Encienda el láser desde la interfaz de la computadora y asegúrese de que el modo de bloqueo.
- Ajuste la longitud de onda del láser deseada. Asegúrese de que la luz láser entre en la celda Pockels abriendo el obturador láser y espere 30 minutos para que la potencia del láser se estabilice.
- Medir la potencia del láser en el objetivo y establecer el porcentaje máximo de láser
NOTA: La radiación láser se emite desde la lente del objetivo durante la medición de potencia. Cierre la cortina de la carcasa del microscopio y use la protección ocular adecuada antes de activar el obturador de imágenes. Mida la potencia del láser en el momento de la instalación inicial del sistema para establecer la curva de potencia de salida para cada longitud de onda de interés y mensualmente a partir de entonces para verificar la estabilidad de la potencia de excitación.- Encienda el medidor de potencia óptica y seleccione la longitud de onda de medición correspondiente a la longitud de onda del láser. Coloque el detector del medidor de potencia óptica en la etapa del microscopio y manécelo directamente debajo de la lente del objetivo en las dimensiones X-Y. Con la unidad de enfoque motorizada de dimensión Z, baje la lente del objetivo hasta que el detector del medidor de potencia esté ~ 1 mm por debajo de la lente del objetivo.
- Cambie de la iluminación de epifluorescencia al láser como la trayectoria de la luz de excitación del microscopio. Habilite el obturador mecánico.
- En el software de adquisición de imágenes, inicie un escaneo puntual para abrir el obturador de imágenes y envíe el láser al medidor de potencia óptica. Ajuste la potencia del láser al 100% en el software de escaneo. Optimice las posiciones X-Y y Z del detector del medidor de potencia hasta que se logre la medición de potencia láser más alta.
- Mida la potencia del láser en el objetivo de 0.1% a 100% en la celda Pockels, tomando medidas a intervalos del 10%. Registre el porcentaje de Pockels Cell correspondiente a 45 mW de potencia en el objetivo. Establezca este porcentaje como la potencia máxima del láser en el software de adquisición de imágenes.
NOTA: La potencia más alta observada para imágenes retinianas de ratón in vivo sin daño visible al tejido objetivo fue de 45 mW, según lo ensayado por tinción histológica dos semanas después de la imagen. El daño retiniano obvio es evidente después de la imagen con 55 mW en el objetivo. - Desactive el obturador de imagen y devuelva la trayectoria de la luz de excitación a la epifluorescencia.
3. Preparación del ratón para la adquisición de imágenes
- Anestesia del ratón para obtener imágenes
NOTA: Asegure la eliminación adecuada de los gases residuales para mitigar la exposición al isoflurano. Asegúrese de que el puerto de escape de la cámara de inducción de anestesia esté conectado a un recipiente de filtro de gas de barrido pasivo, y la salida de la pieza nasal de anestesia del ratón esté conectada a un recipiente de filtro de gas de barrido activo con vacío proporcionado por un aparato de evacuación de gas. Siga las pautas del fabricante para monitorear el peso del recipiente del filtro para su reemplazo.- Anestesiar al ratón con el cóctel de ketamina/xilazina como se ha descrito anteriormente en el paso 1.3.3. Alternativamente, inducir la anestesia por inhalación de isoflurano si también se usa isoflurano para el mantenimiento de la anestesia (sesión de imagen > 30 min). Coloque el dispositivo de anestesia para animales pequeños para llenar la cámara de inducción con isoflurano al 5% mezclado con aire ambiente a un caudal de 0,5 L/min. Coloque el ratón en la cámara de inducción y espere 15 s para que el ratón se anestesie.
- Cambie el vaporizador de isoflurano al 0% y dirija el flujo de anestesia a la pieza nasal. Realice un "lavadoO2 " de 5 segundos de la cámara de inducción. Saque el ratón de la cámara de inducción y asegúrelo en el soporte de la cabeza (ver sección 3.3), fijando la pieza nasal.
- Use una mezcla de isoflurano al 1% con aire ambiente a un caudal de 0,5 L/min para el mantenimiento de la anestesia. Controle la frecuencia respiratoria a intervalos de 5 minutos durante la anestesia, ajustando el porcentaje de isoflurano para mantener una frecuencia respiratoria de ~ 60 respiraciones / min.
NOTA: Estos ajustes (% isoflurano, caudal) también se pueden utilizar para el mantenimiento de la anestesia inducida por el cóctel de ketamina/xilazina.
- Dilatación de la pupila
- Prepare una solución de 1% p/v de atropina y 2,5% p/v de fenilefrina clorhidrato en agua. Guarde la solución dilatadora a temperatura ambiente protegida de la luz.
- Con un gotero de pipeta desechable, aplique una gota de la solución dilatadora en cada ojo del que se tomarán imágenes. Apague las luces de la habitación y espere 5 minutos a que la pupila se dilate. Cuando la pupila esté dilatada, seque la solución dilatadora con tejido libre de pelusa.
NOTA: Asegúrese de que la solución dilatadora no entre en las fosas nasales. - Aplique una gota grande de gel lubricante para ojos en cada ojo del que se tomarán imágenes. Si se van a obtener imágenes de ambos ojos, aplique un pequeño trozo de película adhesiva de plástico sobre el gel ocular en el ojo sin imágenes para prevenir la deshidratación. Si solo toma imágenes de un ojo, aplique ungüento lubricante para los ojos en el ojo que no se visualizará.
- Posicionamiento del ratón para la obtención de imágenes
- Para fijar el ratón en el soporte de la cabeza de imagen, gire el brazo principal del portacabezas hasta que la barra del auricular esté inclinada en un ángulo de 60° o más por debajo de la horizontal. Asegure el pasador del canal auditivo inferior en la posición extendida hacia adentro y el pasador del canal auditivo superior en la posición retirada.
- Con el ratón mirando hacia la barra de mordida, monte una oreja en el pin inferior extendido, insertando el pasador en el canal auditivo. Afloje el tornillo que asegura el pasador del canal auditivo superior y extienda el pasador hacia el otro canal auditivo. Apriete el tornillo para asegurar la cabeza.
- Deslice la barra de mordida hacia la cabeza del ratón. Eleve suavemente la cabeza del ratón, luego baje los incisivos maxilares del ratón en el orificio de la barra de mordida. Retraiga la barra de mordida con una fuerza suave para asegurar la cabeza del ratón y asegure la posición de la barra de mordida apretando el tornillo.
- Si usa isoflurano, deslice la pieza nasal a través de su ranura sobre la barra de mordida antes de asegurar los incisivos del ratón. Asegure y apriete la posición de la barra de mordida como en el paso 3.3.3. Apriete la pieza de la nariz con los dos tornillos en su cara superior hasta que se ajuste perfectamente a la nariz del ratón, pero no constriñe el hocico.
- Transfiera el ratón, en el soporte de la cabeza, a la etapa del microscopio debajo del objetivo. Gire el brazo principal del soporte de la cabeza hasta que la pupila del ojo esté orientada hacia arriba, en línea con la trayectoria de la luz (Figura 2).
- Coloque un cubreobjetos #1.5 en el soporte del filtro compacto y fije el soporte a la etapa del microscopio. Baje el cubreobjetos hacia el ojo, en contacto con el gel lubricante para los ojos, de modo que el cubreobjetos quede horizontalmente inmediatamente por encima de la córnea (Figura 2). Asegúrese de que el cubreobjetos no toque la córnea.
NOTA: En el microscopio, asegúrese de que la trayectoria de la luz de excitación esté establecida en epifluorescencia y la trayectoria de la luz de emisión esté establecida en el ocular. Encienda el iluminador de epifluorescencia a su potencia más baja y abra el obturador del iluminador. Elija la longitud de onda del iluminador de epifluorescencia y el filtro de fluorescencia correspondientes al fluoróforo del que se está fotografiando. - Maniobra la etapa en las dimensiones X-Y y el objetivo en la posición Z utilizando el control de la etapa y la unidad de enfoque motorizada hasta que la luz de excitación de campo amplio cubra completamente la córnea. Mirando a través del ocular, continúe ajustando la posición Z del escenario hasta que las células o estructuras fluorescentes de la retina se enfoquen. Aumente la potencia del iluminador de epifluorescencia si la señal de muestra no es lo suficientemente brillante como para resolver células individuales o estructuras de interés a través del ocular.
NOTA: Si tiene problemas para localizar la retina, el iris es un punto de referencia de alto contraste para anclar y luego enfocar hacia abajo hacia la retina. Este paso también permitirá verificar que la pupila está dilatada al máximo. - Obtenga un área de imagen en el eje con la lente del ratón. Ajuste el ángulo del ratón utilizando los distintos grados de libertad en el soporte de la cabeza hasta que solo se produzca una expansión o contracción de la luz desenfocada al ajustar el plano focal. Apague el iluminador de epifluorescencia y cierre el obturador del iluminador.
NOTA: El paralaje X-Y significativo de luz desenfocada mientras se desplaza por los planos focales de dirección Z indica que la retina no está en el eje con respecto a la trayectoria de la luz de la imagen.
4. Adquisición de imágenes de dos fotones
- Configuración de imágenes y parámetros de adquisición
NOTA: Apague las luces de la habitación y cubra las fuentes de luz parásitas en la habitación. Asegúrese de que el iluminador de epifluorescencia esté apagado y que el obturador del iluminador esté cerrado.- Cambie la ruta de la luz de excitación al láser y la ruta de la luz de emisión a los PMT.
- En el software de adquisición de imágenes, establezca un tamaño de fotograma de 512 x 512 y un promedio de fotogramas de 3. Ajuste los pasos por sector a -8 μm. Designe el paso z para comenzar en la parte superior de la pila y progresar hacia abajo, minimizando la activación láser de dos fotones de los fotorreceptores.
NOTA: El tamaño del paso se puede reducir para aumentar la resolución Z a costa de un mayor tiempo de imagen, pero los pasos de 8 μm son suficientes para resolver el somata celular en esta configuración de imágenes. - Encienda y habilite los PMT. Ajuste el voltaje PMT a 680 V. Habilite el obturador de excitación.
NOTA: Los PMT con energía son susceptibles a daños leves. Asegúrese de que el iluminador de epifluorescencia esté apagado, que la cortina del gabinete del microscopio esté cerrada y que las luces de la habitación estén apagadas. - Comience una vista previa de la imagen en vivo del tejido objetivo, comenzando con una potencia láser del 1%. Ajuste automático del brillo de la pantalla para visualizar las celdas o estructuras de interés. Ajuste automático de la fase de escaneo. Si el tejido objetivo es tenue o poco claro, aumente el porcentaje de potencia del láser hasta que las estructuras se hagan visibles sin superar el límite establecido en el paso 2.4.4 correspondiente a 45 mW.
NOTA: Para una imagen de 16 bits, un valor de visualización de ~1000 cuando se ajusta automáticamente el brillo en un plano Z que contiene estructuras de interés indica suficiente brillo de la muestra. - Maniobra la etapa del microscopio en la dirección X-Y para centrarse en un área de imagen deseada, luego navegue hasta el plano Z con las estructuras de interés enfocadas.
NOTA: Las imágenes adyacentes a la cabeza del nervio óptico le permiten servir como un punto de referencia inequívoco para experimentos de imágenes crónicas. - Si se trata de un experimento de lapso de tiempo crónico, tenga una imagen previa abierta en la computadora de adquisición y utilícela como referencia para encontrar la misma área de interés. Asegúrese de que el ángulo de imagen sea similar al de las imágenes anteriores para adquirir el mismo conjunto de celdas con un paralaje mínimo.
NOTA: Es probable que sea necesario ajustar aún más la posición de la cabeza del ratón para obtener imágenes de las mismas celdas que en puntos de tiempo anteriores (Figura 3). - Establezca los límites Z de la pila de imágenes navegando a los planos Z más alto e inferior de interés, y adquiera la imagen. Al finalizar la adquisición de la imagen, desactive los PMT y el obturador de emisión. Cambie la trayectoria de la luz de emisión de nuevo al ocular y la trayectoria de la luz de excitación a la iluminación de epifluorescencia. Retire el ratón de la etapa de microscopio.
- Apagado de software y hardware del sistema
- Salga del software de adquisición de imágenes. Apague el láser en la interfaz de la computadora. Apague el hardware en orden de inicio inverso, con la excepción del equipo "Siempre encendido".
- Recuperación del ratón
- Retire el soporte de la cabeza y el ratón de la etapa del microscopio. Si corresponde, ajuste el vaporizador de isoflurano al 0%. Retire el ratón del portacabezas.
- Limpie suavemente el gel lubricante para ojos con un pañuelo de papel sin pelusa y aplique ungüento para ojos lubricante con aceite mineral de vaselina blanca en ambos ojos. Coloque el ratón sobre la almohadilla térmica de circulación de agua tibia (establecida a 37 °C), continúe atendiendo al ratón y controlando su frecuencia respiratoria hasta que el ratón se despierte y recupere la capacidad ambulatoria. Devuelva el ratón a su carcasa.
- Si procede, evaluar la actividad y la morbilidad en animales a las 24 h después de la inyección intravítrea. Al finalizar el estudio, eutanasia al ratón con una sobredosis de tribromoetanol (250 mg / kg) y realizar perfusión transcárdica con paraformaldehído al 4% para preservar el tejido retiniano.
5. Procesamiento y análisis de imágenes
- Desintercalar y combinar datos multicanal
- Como ciertos programas de software de adquisición de imágenes almacenan imágenes multicanal en un formato intercalado, abra el archivo de imagen .tif utilizando software, como Fiji (https://imagej.net/Fiji), para separar los canales.
- En el menú Imagen de Fiyi, seleccione Pilas | Herramientas | Desintercalar. Introduzca el número de canales que componen la imagen y haga clic en Aceptar.
- Para combinar los canales separados en un solo archivo, vaya a Imagen | Color | Combinar canales. Coloque los canales de imagen desintercalados en canales de color independientes y haga clic en Aceptar para crear la imagen compuesta multicanal. Guarde esta imagen compuesta como un nuevo archivo .tif.
- Cuantificación de la intensidad de fluorescencia en imágenes multicanal
NOTA: La intensidad de fluorescencia dentro de las regiones designadas de interés (ROI) se puede cuantificar en planos de una sola imagen utilizando Fiji. La cuantificación de las lecturas ratiométricas se puede lograr midiendo la intensidad de fluorescencia en diferentes canales de una imagen compuesta dentro del mismo ROI. Para experimentos de imágenes crónicas, es mejor usar biosensores basados en salidas de excitación o proporción de emisiones.- En Fiji, ir a Analizar | Herramientas | Gerente de ROI. Abra la imagen compuesta en Fiyi. Desplácese hasta el segmento z correspondiente a la estructura de interés y utilice las herramientas Selección (como Selección rectangular, Selección ovalada, Selección de polígonos) para delinear los ROI.
- Presione T en el teclado para agregar cada selección al Administrador de ROI. Al finalizar la selección de ROI, haga clic en Medir en el Administrador de ROI para registrar varios datos de los ROI, como el área y el valor de intensidad media.
- Copie las mediciones del canal seleccionado actualmente registradas en la ventana Resultados en una hoja de cálculo. Cambie al siguiente canal en la ventana Imagen compuesta y haga clic en Medir para obtener mediciones para ese canal dentro del mismo conjunto de ROI. Dentro del ROI Manager, vaya a Más | Guarde y guarde los ROI como un archivo .zip.
- Proyecciones de intensidad máxima para visualización
- Para crear visualizaciones de los datos de imagen, utilice la función Z-project en Fiji. En el menú Imagen , seleccione Pila | Proyecto Z. Elija solo los marcos dentro de los cuales están presentes las áreas de interés para reducir el fondo.
- Si se desea eliminar el ruido de disparo PMT, utilice la función de filtro Mediano. En el menú Proceso, seleccione Proceso | Filtros | Mediana. Elija un valor de 1,0 para mantener los detalles espaciales.
- Para crear proyecciones de máxima intensidad enfocadas en celdas individuales, repita este proceso eligiendo solo los marcos de imagen que correspondan a la celda de interés.
NOTA: Esto puede mejorar en gran medida la capacidad de resolver cenadores celulares (Figura 4). Las mediciones de la intensidad de fluorescencia deben realizarse en planos de una sola imagen y no en proyecciones de intensidad máxima.
Resultados
Se pueden utilizar varios enfoques transgénicos, de vectores virales o de marcado de colorantes inorgánicos para visualizar específicamente varios tipos y estructuras de células de la retina in vivo utilizando una adaptación simple de un microscopio multifotónico básico. Para visualizar las CGR y las células amacrinas, los ratones transgénicos VGlut2-Cre y VGat-Cre, respectivamente, recibieron una inyección intravítrea de una construcción de expresión de AAV dependiente de Cre que codifica Twitch2b, un sensor de Ca 2+ basado en transferencia de energía de resonancia de fluorescencia citoplasmática (FRET) que contiene proteínas fluorescentes cian y amarillas (CFP y YFP, respectivamente) y el dominio de unión a Ca2+ de la troponina15 . En ratones VGlut2-Cre, los somas RGC son claramente discernibles, y los fascículos de los axones son a menudo aparentes (Figura 3).
Cabe señalar que la trayectoria de los axones y la imagen negativa de la vasculatura hace que sea muy sencillo identificar la cabeza del nervio óptico en ratones VGlut2-Cre, lo que es útil como punto de referencia en experimentos de imagen crónica (Figura 3). Aunque las células amacrinas parecen menos brillantes que las CGR, posiblemente debido a su tamaño de soma más pequeño y / o transducción AAV menos eficiente, sus somas todavía son fácilmente evidentes en la capa nuclear interna. En contraste con las CGR, las neuritas de células amacrinas se observan con mayor frecuencia en las capas plexiformes internas (Figura 4). La microglía retiniana se puede visualizar en la línea6 de ratones transgénicos Cx3cr1-GFP. La microglía se asocia con la vasculatura, lo que permite encontrar la misma región en experimentos de imágenes de lapso de tiempo.
Este enfoque se puede utilizar para rastrear la dinámica de los procesos de microglía fina, un procedimiento que tiene una mejor resolución espacial en imágenes de un solo plano, o si se preparan proyecciones de máxima intensidad centradas en células individuales (Figura 5). La mala resolución axial causada por la aberración óptica a través de la lente del ratón impide el examen de detalles finos en la dimensión z. Para determinar si esta técnica de imagen puede observar cambios degenerativos en la ultraestructura celular, se inyectó 1 μL de 50 mM N-metil-D-aspartato (NMDA) en el vítreo para inducir lesión excitotóxica. Un día después de la inyección, la microglía demostró procesos cortos o morfología ameboide (Figura 5) de acuerdo con relatos anteriores16. Cabe señalar que las células en la línea transgénica Cx3cr1-GFP exhibieron una expresión de proteína fluorescente más uniforme y completa en toda la cohorte celular que en experimentos con administración mediada por AAV de casetes de expresión de proteínas fluorescentes. Los beneficios del etiquetado variado y disperso versus completo y uniforme deben considerarse al diseñar experimentos.
Para etiquetar la vasculatura retiniana como se describió anteriormente8, los ratones fueron inyectados por vía intraperitoneal con 200 μL de colorante azul de Evans (20 mg / ml en solución salina estéril) 30-60 minutos antes de la imagen. Esto condujo a un fuerte etiquetado de los vasos sanguíneos que emanan de la cabeza del nervio óptico (Figura 6). Sorprendentemente, la señal fluorescente de una sola inyección persistió durante al menos siete días. Se utilizaron dos métodos distintos para estimar las dimensiones de las imágenes in vivo. Primero, se obtuvieron imágenes de las mismas regiones retinianas in vivo y después de la fijación en montones enteros de retina aplanados utilizando microscopía confocal (Figura 7). Se seleccionaron pares de células aleatorias de cuatro muestras in vivo diferentes, y la distancia real entre pares de células se midió en escaneos confocales y se comparó con la distancia de píxeles in vivo para obtener un tamaño de píxel promedio de 0.99 μm con un aumento digital de 1x. El uso de métodos similares que correlacionan imágenes in vivo con exploraciones confocales de montaje completo ha revelado que una sola posición de la cabeza permite obtener imágenes de un parche de retina de aproximadamente 650 mm2 .
El reposicionamiento del portacabezas a lo largo de un eje torsional puede permitir el acceso a una región lineal de la retina de 2,2 mm de longitud (no se muestra). Además, se inyectaron microesferas fluorescentes de 1 o 2 μm de diámetro en los ojos de ratones y su diámetro se midió como medio máximo de ancho completo de escaneos de línea de imágenes in vivo con zoom digital de 10x. Esto dio una estimación de tamaño de píxel ligeramente mayor, pero con más varianza (Figura 7). En general, las imágenes confocales de muestras de montaje completo después de completar los experimentos in vivo son el método más consistente para asignar escala a imágenes individuales, ya que la varianza en las propiedades de la córnea y la lente puede alterar la escala de la imagen de una muestra a otra.
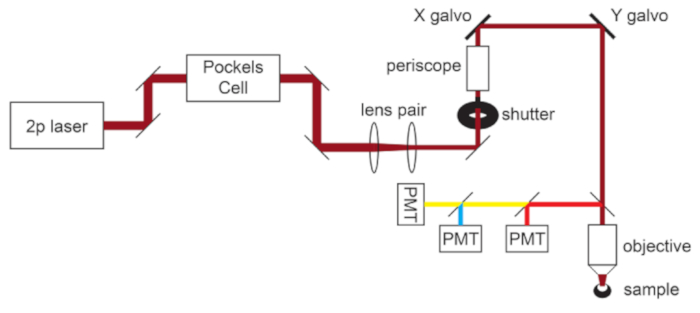
Figura 1: Esquema de trayectoria de luz. Los componentes básicos del microscopio de dos fotones utilizados en este protocolo consisten en una celda Pockels para modular la potencia del láser, un par de lentes para reducir el diámetro del rayo láser para que coincida con la apertura posterior del objetivo del microscopio y un par de espejos de escaneo galvo para la dirección del haz. Un par de espejos de dirección están presentes antes de cada componente óptico principal. El enfoque es controlado por un motor que impulsa el soporte del objetivo. La trayectoria de la luz de emisión se puede personalizar para diferentes fluoróforos cambiando los filtros dicroicos y de barrera. Se muestra una configuración general para imágenes cian/amarillo/rojo en la que un espejo dicroico de paso corto dirige la luz roja al primer PMT, y un espejo dicroico de paso largo emparejado con filtros de paso de banda apropiados se utiliza para separar las emisiones cian y amarillas. Abreviatura: PMT = tubo fotomultiplicador. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Posicionamiento de ratones para imágenes in vivo. Para colocar el mouse con la pupila en el eje con la trayectoria de la luz, el ratón anestesiado primero se sujeta en un soporte para la cabeza, la cabeza se gira y se inclina, se coloca una gran gota de gel lubricante para los ojos en el ojo y el mouse se coloca en el escenario. Se monta un cubreobjetos en el soporte del cubreobjetos perpendicular a la trayectoria de la luz y se baja hacia el ojo. El cubreobjetos no debe entrar en contacto con la córnea o la cabeza del ratón (izquierda), lo que será evidente si el cubreobjetos se desvía. Sin embargo, el cubreobjetos también debe estar lo suficientemente cerca como para evitar la caída de la gota (derecha), ya que esto tendrá un efecto demagnificador en la muestra. Después de aplicar la inmersión en gel y asegurar el cubreobjetos, la etapa debe moverse en su lugar directamente debajo del objetivo del microscopio. Haga clic aquí para ver una versión más grande de esta figura.
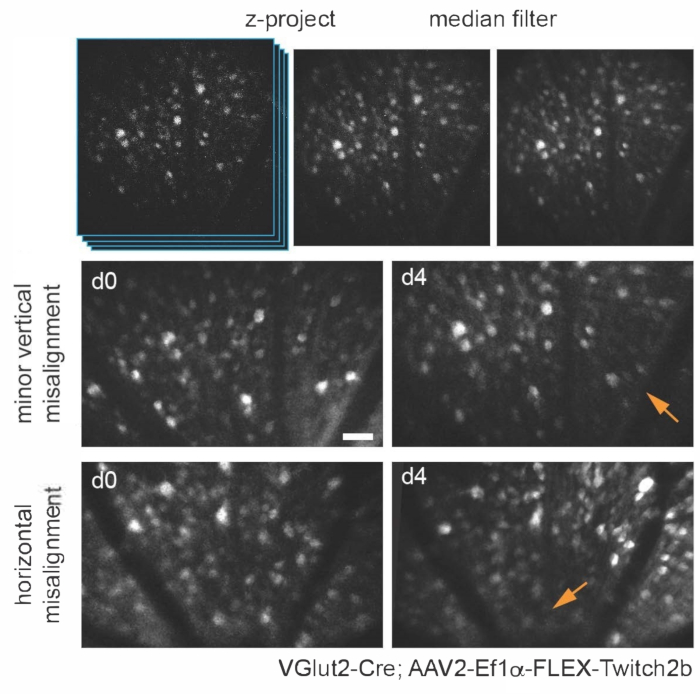
Figura 3: Obtención de imágenes de células ganglionares de la retina. Para la visualización de imágenes, se crean proyecciones de intensidad máxima con los planos z que contienen celdas de interés, y las imágenes resultantes se filtran con la mediana para eliminar el ruido de disparo PMT. Se muestran dos ejemplos de células ganglionares de la retina marcadas mediante la inyección de AAV-EF1α-FLEX-Twitch2b en ratones transgénicos VGlut2-Cre, específicamente la señal CFP. Las imágenes se adquirieron en sesiones con cuatro días de diferencia, y se utilizaron puntos de referencia vasculares para regresar a la misma región cerca de la cabeza del nervio óptico. La cabeza del nervio óptico está orientada hacia la parte inferior de la imagen. Aunque ambas muestras muestran cierta variación en la orientación (las regiones con intensidad disminuida se indican con flechas), la mayoría de las células están presentes en ambos puntos de tiempo. Barra de escala = aproximadamente 50 μm. Abreviaturas: PMT = tubo fotomultiplicador; AAV = virus adenoasociado; EF1α = factor de elongación-1alfa; FLEX = escisión flip; VGlut2 = transportador vesicular de glutamato 2; CFP = proteína fluorescente cian. Haga clic aquí para ver una versión más grande de esta figura.
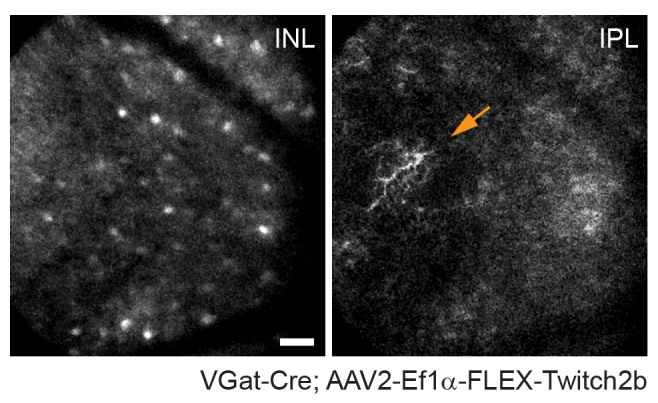
Figura 4: Obtención de imágenes de células amacrinas. Las células amacrinas se marcaron inyectando AAV-EF1α-FLEX-Twitch2b en ratones transgénicos VGat-Cre. La señal CFP de Twitch 2b se muestra específicamente. Pequeñas proyecciones de intensidad máxima enfocadas en las profundidades de la capa nuclear interna indican somas de células amacrinas, mientras que al enfocarse en el plexiforme interno resuelve neuritas de células amacrinas (flecha). La cabeza del nervio óptico está orientada hacia la derecha de la imagen. Barra de escala = aproximadamente 50 μm. Abreviaturas: AAV = virus adenoasociado; EF1α = factor de elongación-1alfa; FLEX = escisión flip; VGat = transportador vesicular de ácido gamma aminobutírico; CFP = proteína fluorescente cian; INL = capa nuclear interna; IPL = capa plexiforme interna. Haga clic aquí para ver una versión más grande de esta figura.
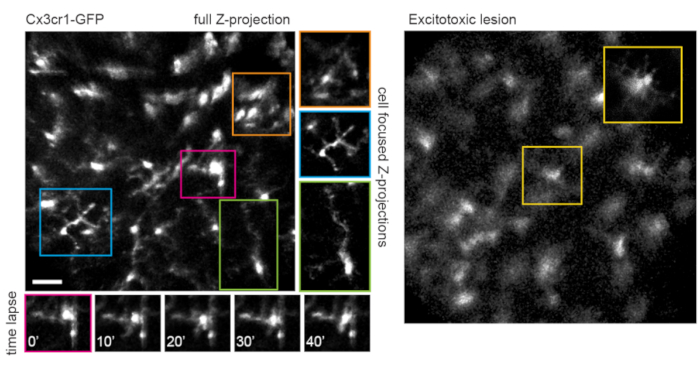
Figura 5: Imágenes de la microglía. La línea de ratones transgénicos Cx3cr1-GFP se utilizó para etiquetar la microglía. Una proyección de intensidad máxima del volumen completo de escaneo muestra muchas microglías, algunas con detalles finos del proceso que se pueden resolver. Tenga en cuenta que las celdas hacia la parte inferior izquierda del campo tienen menos distorsión en la proyección máxima que aquellas hacia la parte superior derecha debido al paralaje en esta región. Las proyecciones de intensidad máxima que contienen solo la celda de interés reducen significativamente este paralaje (centro, en caja en los colores correspondientes). Además, esta estrategia de imagen puede documentar la dinámica de la remodelación del proceso de microglía fina (paneles inferiores). Comparativamente, muchas microglías se pueden ver con procesos cortos o morfología ameboide un día después de una lesión excitotóxica por inyección intravítrea de 50 mM NMDA (derecha). Barra de escala = aproximadamente 50 μm. Abreviaturas: GFP = proteína verde fluorescente; Cx3cr1 = receptor de quimiocinas Cx3 1; NMDA = N-metil-D-aspartato. Haga clic aquí para ver una versión más grande de esta figura.
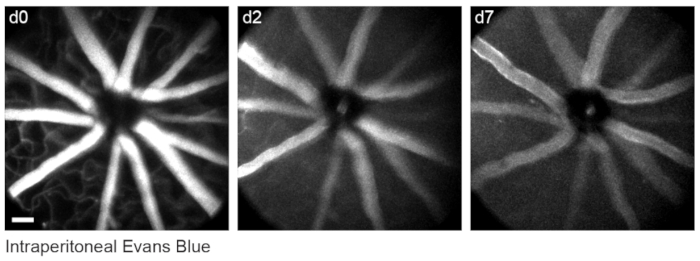
Figura 6: Etiquetado de puntos de referencia vasculares. A los ratones se les inyectaron 200 μL de 20 mg/ml de azul de Evans por vía intraperitoneal 30-60 min antes de la primera sesión de imagen. Las proyecciones de intensidad máxima de espesor completo demuestran una fluorescencia duradera en la vasculatura retiniana que persistió durante al menos siete días. Barra de escala = aproximadamente 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
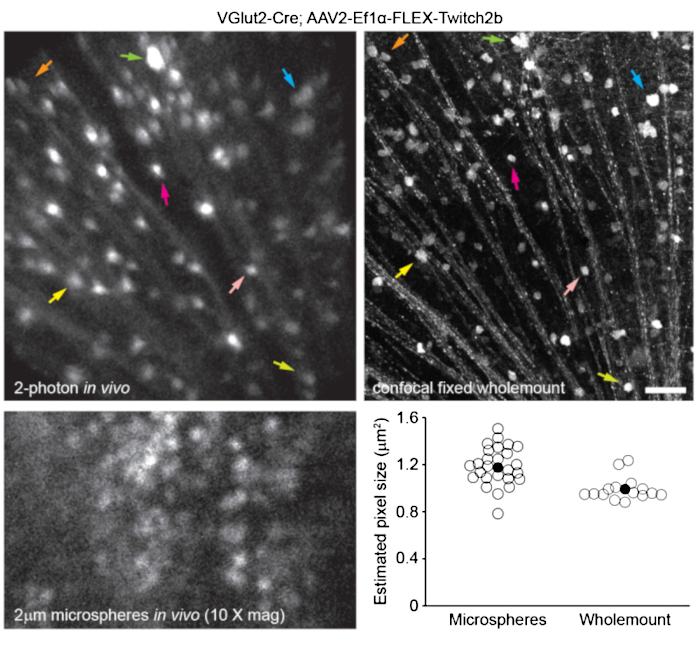
Figura 7: Dimensiones de la imagen. Las células ganglionares de la retina marcadas mediante la inyección de AAV-EF1α-FLEX-Twitch2b en ratones transgénicos VGlut2-Cre se obtuvieron imágenes in vivo, y luego se obtuvo una imagen de la misma región mediante microscopía de barrido láser confocal después de la fijación y la preparación de montaje completo de la retina. Se muestra un canal de proteína fluorescente amarillo para ambos. Los pares de flechas de colores indican la misma celda en ambas preparaciones (paneles superiores). Imagen de un solo plano de microesferas fluorescentes de 2 μm de diámetro inyectadas por vía intravítrea y fotografiadas in vivo (panel inferior izquierdo). Las microesferas no se asentaron y, por lo tanto, estaban en constante movimiento, lo que hacía imposible la medición de la resolución axial. Tamaños de píxel calculados a partir de mediciones de ancho completo a medio máximo de microesferas fluorescentes in vivo o mediciones confocales correlativas tomadas de 2-4 retinas por grupo (abajo a la derecha). Barra de escala = 50 μm. Abreviaturas: AAV = virus adenoasociado; EF1α = factor de elongación-1alfa; FLEX = escisión flip; VGlut2 = transportador vesicular de glutamato 2. Haga clic aquí para ver una versión más grande de esta figura.
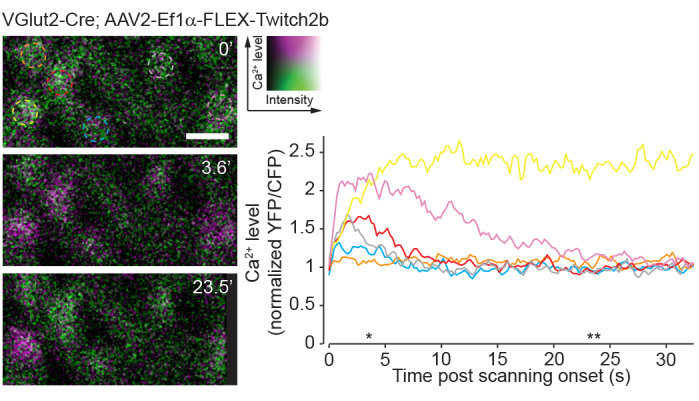
Figura 8: Actividad de calcio inducida por escaneo de dos fotones. Células ganglionares de la retina marcadas mediante la inyección de AAV-EF1α-FLEX-Twitch2b en ratones transgénicos VGlut2-Cre, YFP es magenta pseudocolor y verde CFP, fotografiado en un solo plano como una serie temporal a 4,22 Hz. Todos los GRC tenían una relación YFP/CFP inicial similar. La mayoría respondió con un aumento en la relación FRET (excluyendo la célula naranja), y uno mantuvo una alta relación YFP / CFP a lo largo de la serie de tiempo (celda amarilla). Las relaciones YFP / CFP se normalizaron al primer promedio de cuadro, y los círculos de color coinciden con las trazas de colores. Los asteriscos indican puntos de tiempo con imágenes representativas a la izquierda. Barra de escala = 20 μm. Abreviaturas: AAV = virus adenoasociado; EF1α = factor de elongación-1alfa; FLEX = escisión flip; VGlut2 = transportador vesicular de glutamato 2; YFP = proteína fluorescente amarilla; CFP = proteína fluorescente cian; CGR = células ganglionares de la retina; FRET = transferencia de energía de resonancia de fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El procedimiento de imagen de dos fotones descrito en este documento permite obtener imágenes longitudinales in vivo de la retina del ratón. Se pueden obtener imágenes repetibles de la misma región de la retina durante un período continuo de hasta 6 o más h bajo isoflurano. El ratón también se puede visualizar en diferentes días utilizando puntos de referencia celulares y vasculares para localizar la misma área de imagen (Figura 3). El uso de una inmersión en gel transparente combinada con vidrio de cubierta para este propósito se ha aplicado previamente a una variedad de procedimientos, incluida la visualización de la retina para inyección subretiniana, modelos de lesiones retinianas inducidas por láser e imágenes de fondo de ojo20,21,22.
La anatomía del ojo presenta desafíos únicos para las imágenes in vivo, ya que la alta potencia óptica de la córnea y la lente del ratón impide la obtención de imágenes directas a través de la pupila sin corrección. Varios otros métodos de imagen in vivo se basan en el uso de una lente de contacto plano-cóncava para la corrección de la óptica anterior del ojo del ratón 7,17,18,19. Con solo corrección óptica en la córnea, la alta potencia óptica de la lente del ratón da como resultado una cantidad inevitable de paralaje, particularmente de estructuras en el campo de escaneo periférico, que se manifiesta como estiramiento y movimiento de traslación en la dimensión X-Y en diferentes planos Z. Para minimizar la distorsión relacionada con el paralaje de la imagen en las dimensiones X e Y, es crucial que el ojo del ratón esté orientado de tal manera que el plano tangente a la retina en el área de imagen sea perpendicular a la trayectoria de la luz del microscopio. La configuración descrita aquí es propicia para la manipulación precisa del ángulo del ojo para lograr esta alineación. Un soporte de cabeza de ratón ajustable que permite la rotación a lo largo de dos ejes permite ajustes manuales fáciles del ángulo del ojo a medida que el experimentador se desplaza a través de la dimensión Z para minimizar el paralaje. Esta inclinación también evita el efecto de parada de campo de la pupila para permitir obtener imágenes de áreas más grandes de la retina. La sujeción del soporte de la cabeza también reduce en gran medida los artefactos de movimiento causados por la respiración.
Se debe tener cuidado para mantener la claridad del ojo del ratón, ya que la calidad de la imagen se deteriorará con la opacificación durante la obtención continua de imágenes. La reaplicación frecuente de gel lubricante durante la obtención de imágenes y la aplicación de ungüento después de cada sesión de imágenes ayudan a evitar que el ojo se seque y desarrolle opacidades. Algunas opacidades corneales se resolverán espontáneamente después de 24-48 h. El uso de gel transparente y vidrio de cubierta como se describe en este protocolo proporciona una calidad de imagen y corrección de aberración similar a la de una lente de contacto 7, al tiempo que permite ajustes más fáciles del ángulo del ojo sin la necesidadde realinear el vidrio de la cubierta. Además, el gel proporciona una hidratación continua al ojo, lo que permite realizar sesiones de imagen agudas de hasta varias horas. Finalmente, dado que el vidrio de la cubierta no entra en contacto con la córnea, causa una irritación mínima en el ojo que puede reducir la claridad óptica para repetir las sesiones de imágenes.
Una limitación de este enfoque es el hecho de que las aberraciones ópticas no se corrigen por completo. Si bien esto disminuye severamente la resolución axial debido al paralaje pesado, las mediciones cuantitativas del soma se pueden obtener en planos de una sola imagen. Cabe señalar que como la intensidad de la señal de fluorescencia de las neuronas retinianas depende de la alineación de la muestra con este método, los sensores basados en la relación de excitación y emisión son más apropiados para experimentos que comparan muestras crónicamente en diferentes sesiones de imágenes. Un enfoque para corregir las aberraciones ópticas a nivel de sistema es la óptica adaptativa, que permite la resolución subcelular en la retina 8,9,14,21. Sin embargo, la óptica adaptativa requiere equipos altamente especializados y una amplia experiencia para implementarla.
Los enfoques alternativos a las imágenes retinianas in vivo de dos fotones son la microscopía confocal o la oftalmoscopia6. El enfoque presentado aquí debe ser fácilmente traducible a microscopía de campo amplio o confocal. Las imágenes de fotón único son quizás más robustas y presentan menos riesgo de dañar la retina debido a la alta energía del láser de dos fotones necesaria para lograr un efecto eficiente de dos fotones a través de la córnea y la lente del ojo. Para evitar el daño del láser de dos fotones, el umbral para la potencia máxima del láser debe determinarse empíricamente mediante el examen de retinas de montaje completo después de completar los experimentos de imágenes y la inmunotinción para los tipos de células en las capas fotografiadas. En el sistema presentado aquí, las CGR se etiquetaron con el marcador pan-RGC, Rbpms, y las densidades fueron normales hasta 45 mW de potencia de imagen, mientras que 55 mW causaron una pérdida significativa de CGR (no se muestra).
Un inconveniente de la imagen de fotón único es el hecho de que este enfoque estimulará fuertemente los circuitos visuales nativos de la retina en comparación con las imágenes de dos fotones23. Experimentos previos que utilizan monturas enteras de retina o preparaciones oculares han demostrado que el escaneo láser de dos fotones provoca la activación del circuito que es en gran medida transitoria24. Aquí, las imágenes de la actividad de RGC con el sensor de Ca 2+ Twitch2b muestran que el inicio del escaneo láser induce elevaciones de Ca 2+, que vuelven a la línea de base en el transcurso de5-20 s en la mayoría de las CGR (Figura 8). Dado que la potencia del láser en este protocolo está en el rango de experimentos previos que informan una respuesta a la luz retiniana in vivo8, el método descrito actualmente es probablemente susceptible de registros de la actividad del circuito en la retina. Tales consideraciones son importantes para experimentos que pueden estar influenciados por la actividad del circuito.
Este protocolo demuestra imágenes in vivo de dos tipos de neuronas retinianas, CGR y células amacrinas. Se puede lograr un etiquetado similar de otros tipos de células principales, incluidas las células horizontales (Cx57-Cre 25), las células bipolares (Chx10-Cre 26; mGluR6-GFP 27), los fotorreceptores de cono (S- o M-opsina-Cre 28), los fotorreceptores de bastones (Nrl-Cre 29), la glía de Müller (Foxg1-Cre 26) y los pericitos (NG2-DsRed9). Los ratones transgénicos también están disponibles para etiquetar subconjuntos discretos de CGR (por ejemplo, KCNG4-Cre para αRGC30; OPN4-Cre para ipRGCs31; JAM-B-CreER para J-RGCs 32) y células amacrinas (por ejemplo, ChAT-Cre para células amacrinas con brotes de formación estelar26 y impulsores promotores de neuropéptidos para varios subtipos de células amacrinas 3,34). Los vectores virales se pueden utilizar para dirigirse a poblaciones celulares específicas en lugar de ratones transgénicos. Las inyecciones intravítreas de AAV2 con un elemento promotor CAG ubicuo marcan casi exclusivamente CGR, células amacrinas y células horizontales25. El emparejamiento de la cápside AAV2.7m8-Y444F modificada con una construcción promotora mGluR6 diseñada permite un amplio etiquetado de las células bipolares ON35. Las inyecciones subretinianas de AAV conducen a un enriquecimiento de los fotorreceptores, siendo el serotipo AAV2/5 el que tiene la mayor eficiencia de transducción36. Se ha demostrado que Shh10, una proteína de cápside AAV6 modificada, emparejada con elementos promotores de proteínas ácidas fibrilares gliales, es específica para la glía37 de Müller.
La capacidad de observar células en el sistema nervioso central con un enfoque completamente no invasivo puede ser utilizada para estudiar tanto las propiedades básicas de los circuitos neuronales8, como los mecanismos de neurodegeneración 3,4,5,6,38. Muchas enfermedades de ceguera se dirigen a las poblaciones celulares en la retina, y los enfoques de imágenes in vivo en ratones se han utilizado para estudiar la lesión del nervio óptico 1,3,4, la degeneración macular13, el accidente cerebrovascular5, el glaucoma 2,6 y la uveítis 7. Además, muchas afecciones neurodegenerativas del sistema nervioso central se manifiestan en la retina, incluida la enfermedad de Alzheimer39, la esclerosis múltiple40 y la enfermedad de Parkinson41. Por lo tanto, esta técnica de fácil acceso para la obtención de imágenes in vivo de la retina se puede aplicar como una herramienta para estudiar un amplio conjunto de afecciones neurodegenerativas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Fundación de Investigación para Prevenir la Ceguera (Premio de Desarrollo Profesional a P.R.W. y una subvención sin restricciones al Departamento de Oftalmología y Ciencias Visuales de la Facultad de Medicina de la Universidad de Washington en St. Louis), National Glaucoma Research (un programa de la Fundación BrightFocus) y el Centro McDonnell de Neurobiología Celular y Molecular. Z.W. cuenta con el apoyo de un Premio del Servicio Nacional de Investigación Institucional T32 EY013360. Este trabajo también fue apoyado por el Hope Center Viral Vectors Core en la Facultad de Medicina de la Universidad de Washington.
Materiales
| Name | Company | Catalog Number | Comments |
| #1.5 coverslip | ThermoFisher | 152440 | Richard-Allan #1.5 24 mm x 40 mm |
| 50 mL glass syringe | Hamilton | 80950 | 22G cemented needle |
| Adeno-associated virus (AAV2) | Hope Center Viral Core | NA | |
| Anesthesia Air Pump | RWD Life Science | R510-30 | |
| Atropine | Sigma | A0132 | For pupil dilator solution |
| Basic Small Animal Anesthesia Device | RWD Life Science | R500IE | |
| Borosilicate glass capillary | Sutter | B150-86-10 | Outside diameter 1.50 mm, inside diameter 0.86 mm, length 10 cm |
| CFP/YFP filter cube | Chroma | custom | 480/40, 505 long pass, 535/30 |
| ChromoFlex - Two channel PMT detection unit | Scientifica | S-MPLG-1002 | |
| Circulating heating pump | Braintree Scientific | tp-700 | Set to 37 °C |
| Cling film | VWR | 10713-916 | |
| Compact Filter Holder | ThorLabs | DH1 | Holds coverslip over mouse eye |
| Cx3cr1-GFP transgenic mice (B6.129P2(Cg)-Cx3cr1tm1Litt/J) | The Jackson Laboratory | 005582 | |
| DAQ controller chassis | National Instruments | PXIe-1073 | |
| Data acquisition device | National Instruments | BNC-2090A | |
| Evans Blue dye | Fisher Scientific | AAA1677409 | |
| FPGA module with digitizer | National Instruments | NI-5734 | |
| Gas Evacuation Apparatus | RWD Life Science | R546W | |
| GenTeal Severe lubricant eye gel | Alcon | (from local pharmacy) | For use during imaging |
| GFP/Red filter cube | Chroma | custom | 535/30, 560 long pass, 605/70 |
| Heating pad | McKesson Medical and Surgical | 190147 | |
| HyperScope Launch Optics for use with Pockels Cell | Scientifica | S-MP-101080 | |
| HyperScope Main module | Scientifica | S-MP-100466 | |
| HyperScope Scan Path | Scientifica | S-MP-100406 | |
| HyperScope X galvo Module | Scientifica | MP-100443 | |
| ImageJ Fiji software | Freeware | ||
| Isoflurane | Patterson Veterinary | NDC 14043-704-06 | |
| Isoflurane gas filter cannister (active scavenging) | RWD Life Science | R510-31 | |
| Isoflurane gas filter cannister (passive scavenging) | RWD Life Science | R510-31S | |
| ketamine HCl (100 mg/mL) | Vedco | NDC 50989-161-06 | |
| M32 to M26 adapter | ThorLabs | M32M26S | |
| MaiTai GUI software | Spectra-Physics | NA | |
| MATLAB software | MathWorks | NA | R2015b |
| meloxicam (5 mg/mL) | Boehringer Ingelheim | NDC 0010-6013-01 | Analgesic |
| Micorscope Objective | Edmund Optics | 46-404 | Mitutoyo WE715042319 |
| micropipette puller | Sutter | Flaming/Brown Model P-97 | |
| Mineral oil | Fisher | BP2629-1 | |
| Mini bulldog hemostatic clamp | Fine Science Tools | 18053-28 | |
| Miniature EVA Tubing 0.02" ID, 0.06" OD | McMaster Carr | 1883T1 | |
| Miniature EVA Tubing 0.05" ID, 0.09" OD | McMaster Carr | 1883T4 | |
| Mouse head holder | Narishige | SGM-4 | |
| No. 5 Forceps | Fine Science Tools | 11251-10 | |
| Optic Posts 1/2" | ThorLabs | TR3-P5 | |
| Optical power meter kit | ThorLabs | PM100D | |
| pE-300 Ultra LLG Deivery | Scientifica | COO-LED3ULLGs | |
| Phenylephrine hydrochloride | Sigma | P6126 | For pupil dilator solution |
| Pockels cell | Conoptics | 350-80-02 | |
| Pockels cell amplifier | Conoptics | Model 302RM | |
| Proparacaine hydrochloride | Sigma | 1571001 | For eye immobilization |
| Red & Far Red short pass filter Cube | Chroma | custom | 560 short pass |
| Rotating 1/2" post clamp | ThorLabs | SWC | |
| ScanImage package | Vidrio Technologies | Freeware | Image acquisition software; Version 5.4.0 (2018); requires MATLAB |
| sodium chloride solution, sterile (0.9%) | Fresenius Kabi | NDC 63323-186-01 | |
| Stereomicroscope | Leica | S9 E | |
| Tabletop centrifuge | Oxford | Benchmate C8 | |
| Terramycin oxytetracycline/polymyxin B antibiotic ophthalmic ointment | Zoetisus | NA | For use after intravitreal injection |
| ThermoRack cooling system | Solid State Cooling Systems | ThermoRack 401 | Set to 20 °C |
| Ultrafast Ti:Sapphire laser | Spectra-Physics | Mai Tai DeepSee | |
| Vgat-Cre transgenic mice (Slc32a1tm2(cre)Lowl/J) | The Jackson Laboratory | 016962 | |
| VGlut2-Cre transgenic mice (Slc17a6tm2(cre)Lowl/J) | The Jackson Laboratory | 016963 | |
| VivoScope for In Vivo Imaging | Scientifica | S-MPVS-1200-00P | |
| White petrolatum-mineral oil lubricant eye ointment | Stye | NA | For use after imaging |
| xylazine HCl (20 mg/mL) | Akorn | NDC 59399-110-20 |
Referencias
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Scientific Reports. 8 (1), 1490 (2018).
- Liu, H., Ding, C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose. Experimental and Therapeutic Medicine. 14 (3), 1953-1960 (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), 40352 (2012).
- Leung, C. K., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Investigative Ophthalmology & Visual Science. 49 (11), 4898-4902 (2008).
- Murata, H., et al. Imaging mouse retinal ganglion cells and their loss in vivo by a fundus camera in the normal and ischemia-reperfusion model. Investigative Ophthalmology & Visual Science. 49 (12), 5546-5552 (2008).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. Journal of Visualized Experiments. (99), e52731 (2015).
- Bremer, D., et al. Longitudinal Intravital Imaging of the Retina Reveals Long-term Dynamics of Immune Infiltration and Its Effects on the Glial Network in Experimental Autoimmune Uveoretinitis, without Evident Signs of Neuronal Dysfunction in the Ganglion Cell Layer. Frontiers in Immunology. 7, 642 (2016).
- Qin, Z., et al. Adaptive optics two-photon microscopy enables near-diffraction-limited and functional retinal imaging in vivo. Light: Science & Applications. 9, 79 (2020).
- Schallek, J., Geng, Y., Nguyen, H., Williams, D. R. Morphology and topography of retinal pericytes in the living mouse retina using in vivo adaptive optics imaging and ex vivo characterization. Investigative Ophthalmology & Visual Science. 54 (13), 8237-8250 (2013).
- Williams, D. R. Imaging single cells in the living retina. Vision Research. 51 (13), 1379-1396 (2011).
- Carroll, J., Neitz, M., Hofer, H., Neitz, J., Williams, D. R. Functional photoreceptor loss revealed with adaptive optics: an alternate cause of color blindness. Proceedings of the National Academy of Sciences of the United States of America. 101 (22), 8461-8466 (2004).
- Rossi, E. A., et al. Imaging retinal mosaics in the living eye. Eye. 25 (3), 301-308 (2011).
- Rossi, E. A., et al. In vivo imaging of retinal pigment epithelium cells in age related macular degeneration. Biomedical Optics Express. 4 (11), 2527-2539 (2013).
- Geng, Y., et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 3 (4), 715-734 (2012).
- Thestrup, T., et al. Optimized ratiometric calcium sensors for functional in vivo imaging of neurons and T lymphocytes. Nature Methods. 11 (2), 175-182 (2014).
- Takeda, A., et al. Microglia mediate non-cell-autonomous cell death of retinal ganglion cells. Glia. 66 (11), 2366-2384 (2018).
- Ikeda, W., Nakatani, T., Uemura, A. Cataract-preventing contact lens for in vivo imaging of mouse retina. Biotechniques. 65 (2), 101-104 (2018).
- Palczewska, G., Kern, T. S., Palczewski, K., Weber, B. H. F., Langmann, T. Noninvasive two-photon microscopy imaging of mouse retina and retinal pigment epithelium. Retinal Degeneration. Methods in Molecular Biology. 1834, 333-343 (2019).
- Wahl, D. J., Jian, Y., Bonora, S., Zawadzki, R. J., Sarunic, M. V. Wavefront sensorless adaptive optics fluorescence biomicroscope for in vivo retinal imaging in mice. Biomedical Optics Express. 7 (1), 1-12 (2016).
- Park, S. W., Kim, J. H., Park, W. J., Kim, J. H. Limbal approach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium. Journal of Visualized Experiments. (102), e53030 (2015).
- Biss, D. P., et al. In vivo fluorescent imaging of the mouse retina using adaptive optics. Optics Letters. 32 (6), 659-661 (2007).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A mouse model for laser-induced choroidal neovascularization. Journal of Visualized Experiments. (106), e53502 (2015).
- Palczewska, G., et al. Human infrared vision is triggered by two-photon chromophore isomerization. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5445-5454 (2014).
- Euler, T., et al. Eyecup scope--optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Archive-European Journal of Physiology. 457 (6), 1393-1414 (2009).
- Zhang, Y., et al. Elevating Growth Factor Responsiveness and Axon Regeneration by Modulating Presynaptic Inputs. Neuron. 103 (1), 39-51 (2019).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Akimoto, M., et al. Transgenic mice expressing Cre-recombinase specifically in M- or S-cone photoreceptors. Investigative Ophthalmology & Visual Science. 45 (1), 42-47 (2004).
- Brightman, D. S., Razafsky, D., Potter, C., Hodzic, D., Chen, S. Nrl-Cre transgenic mouse mediates loxP recombination in developing rod photoreceptors. Genesis. 54 (3), 129-135 (2016).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85 (6), 1244-1256 (2015).
- Ecker, J. L., et al. Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron. 67 (1), 49-60 (2010).
- Kim, I. J., Zhang, Y., Yamagata, M., Meister, M., Sanes, J. R. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452 (7186), 478-482 (2008).
- Akrouh, A., Kerschensteiner, D. Morphology and function of three VIP-expressing amacrine cell types in the mouse retina. Journal of Neurophysiology. 114 (4), 2431-2438 (2015).
- Zhu, Y., Xu, J., Hauswirth, W. W., DeVries, S. H. Genetically targeted binary labeling of retinal neurons. Journal of Neuroscience. 34 (23), 7845-7861 (2014).
- Lu, Q., et al. AAV-mediated transduction and targeting of retinal bipolar cells with improved mGluR6 promoters in rodents and primates. Gene Therapy. 23 (8-9), 680-689 (2016).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Research. 48 (3), 353-359 (2008).
- Yao, K., et al. Wnt regulates proliferation and neurogenic potential of Muller glial cells via a Lin28/let-7 miRNA-dependent pathway in adult mammalian retinas. Cell Reports. 17 (1), 165-178 (2016).
- Williams, P. R., et al. A recoverable state of axon injury persists for hours after spinal cord contusion in vivo. Nature Communications. 5, 5683 (2014).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's & Dementia. 10 (2), 135-142 (2014).
- Kerrison, J. B., Flynn, T., Green, W. R. Retinal pathologic changes in multiple sclerosis. Retina. 14 (5), 445-451 (1994).
- Sung, M. S., et al. Inner retinal thinning as a biomarker for cognitive impairment in de novo Parkinson's disease. Scientific Reports. 9 (1), 11832 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados