Method Article
Transpupiller İki Foton Fare Retinasının In vivo Görüntülenmesi
Bu Makalede
Özet
İn vivo görüntüleme, sağlık ve hastalıkta biyoloji çalışmaları için güçlü bir araçtır. Bu protokol, standart iki foton mikroskobu ile fare retinasının transpupiller görüntülemesini tanımlar. Ayrıca, retinanın birden fazla hücresel kohortunu floresan olarak etiketlemek için farklı in vivoimaging yöntemleri göstermektedir.
Özet
Retina, çevreden gelen ışık sinyallerini beyne yayılan elektrik sinyallerine dönüştürür. Retina hastalıkları yaygındır ve görme bozukluğuna ve körlüğe neden olur. Bu tür hastalıkların nasıl ilerlediğini anlamak, yeni tedavilerin formüle edilmesinde kritik öneme sahiptir. Hayvan hastalık modellerinde in vivo mikroskopi, nörodejenerasyonu anlamak için güçlü bir araçtır ve Alzheimer hastalığından inmeye kadar değişen durumların tedavilerine yönelik önemli ilerlemelere yol açmıştır. Retinanın optik yaklaşımlarla doğal olarak erişilebilen tek merkezi sinir sistemi yapısı olduğu göz önüne alındığında, doğal olarak in vivo görüntülemeye doğru kendini ödünç verir. Bununla birlikte, lens ve korneanın doğal optikleri, etkili görüntüleme erişimi için bazı zorluklar ortaya koymaktadır.
Bu protokol, hücresel kohortların ve fare retinasındaki yapıların hücresel çözünürlükte in vivo iki fotonlu görüntülenmesi için hem akut hem de kronik süreli görüntüleme deneyleri için geçerli olan yöntemleri özetlemektedir. Adeno ilişkili virüs (AAV) vektörleri, transgenik fareler ve inorganik boyalar dahil olmak üzere bir dizi etiketleme tekniği kullanarak retinal ganglion hücresi (RGC), amakrin hücre, mikroglial ve vasküler görüntüleme örnekleri sunar. Önemli olarak, bu teknikler retinanın tüm hücre tiplerine uzanır ve ilgilenilen diğer hücresel popülasyonlara erişmek için önerilen yöntemler açıklanmaktadır. Ayrıca, görüntüleme ve niceleme için manuel görüntü son işleme için örnek stratejiler de ayrıntılandırılmıştır. Bu teknikler sağlık ve hastalıkta retina fonksiyonu çalışmalarına doğrudan uygulanabilir.
Giriş
Merkezi sinir sisteminin in vivo görselleştirilmesi genellikle kafatası inceltme ve cam pencerelerin veya optik röle lenslerinin takılması gibi invaziv prosedürler gerektirir. Retina, sinir sisteminde, doğal olarak çevreden ışık aldığı için invaziv preparata gerek kalmadan doğrudan gözlemlenebilen tek yapıdır. Retinaya optik erişim kolaylığı, onu merkezi sinir sistemini incelemek için çekici bir model sistem haline getirir.
Farelerde retinanın canlı floresan görüntülemesi, glokom 1,2, optik sinir hasarı 1,3,4 ve inme 5 modellerinde RGC ölümünü ve ayrıca dejeneratif koşullarda mikroglial aktivasyon 6,7,8 ve vaskülatür 9'daki değişiklikleri izlemek için kullanılmıştır. İçsel sinyaller ayrıca fotoreseptörleri10,11,12 ve retinal pigment epitel hücrelerini görselleştirmek için de kullanılabilir13. Retinanın in vivo görüntülenmesine yönelik birçok yaklaşım, oftalmolojik amaçlar için özel olarak tasarlanmış son derece uzmanlaşmış cihazlar6 veya kornea ve lensin doğal anormalliklerini düzeltmek için yüksek oranda modifiye edilmiş optik sistemler kullanır 8,9,11,12,13,14.
Mevcut protokol, retinadaki floresan sinyallerinin hücresel çözünürlükte in vivo görüntülenmesine, fare gözünün ön optikleri için kısmen düzeltilmesi için temel bir yöntem kullanan bir yaklaşım göstermektedir. Bu strateji, beynin in vivo görüntülemesi için yaygın olarak kullanılan multifoton mikroskop kurulumlarına çok küçük uyarlamalar gerektirir. Bu yaklaşımın kurulumu basit olduğundan ve fareler çok az stres altında olduğundan, hem akut hem de kronik süreler boyunca hızlandırılmış deneyler yapmak için elverişlidir. Ek olarak, RGC'ler, amakrin hücreler, mikroglia ve vaskülatür dahil olmak üzere bireysel retinal bileşenleri etiketleyen genetik ve organik boya bazlı prosedürler bu görüntüleme tekniğiyle uyumludur ve retina fonksiyonu için kritik olan hücre tiplerinin ve yapılarının in vivo olarak gözlemlenmesini sağlar. Bu araçlar, retinanın glial ve vasküler bileşenlerinin yanı sıra diğer nöronal hücre tiplerinin çoğunu etiketlemek için uyarlanabilir.
Protokol
NOT: Aşağıdaki prosedür, St. Louis'deki Washington Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin yönergelerine uygun olarak gerçekleştirilmiştir. Bu çalışmada kullanılan reaktifler, ekipman ve hayvanlar hakkında ayrıntılar için Malzeme Tablosuna bakınız.
1. Adeno ilişkili virüs enjeksiyonu
NOT: Retinadaki belirli hücrelerin etiketlenmesi, sınırlı ifade kalıplarına sahip Cre transgenik fare çizgilerinde gerçekleştirilebilir. Bu bölümde, bir floresan proteinin Cre'ye bağımlı ekspresyonunu kodlayan AAV-vektörlerinin intravitreal iletimi açıklanmakta ve böylece spesifik retinal hücreleri etiketlemektedir. 4 haftalıktan itibaren fareleri (erkek ve dişi) enjekte edin.
- Mikropipet iğnesinin hazırlanması
- Borosilikat cam kılcal iğne oluşturmak için bir mikropipet çektirici kullanın. Mikropipet çektiriciye bir cam kılcal damar yerleştirin ve elde edilen değeri kaydederek Rampa Testini gerçekleştirin. Rampa Testi için kullanılan cam kılcal damarı atın.
- Mikropipetleri aşağıdaki ayarlarla çekin: ısı: Rampa Test değeri eksi 10; çekme: 55; hız: 65; zaman: 120; hava basıncı: 500; çekme başlangıcındaki hava süresi: 20.
NOT Ayarların farklı çektiriciler için ayarlanması gerekebilir. - Diseksiyon mikroskobu altında, çekilen mikropipetin ucunu, cam ucun kuvvet altında hafifçe saptığı yerde, konik bölümün sonundan ~ 10 mm uzakta kesmek için bir tıraş bıçağı kullanın. Keskin bir açıyla kesin, böylece kesim eğimli bir uç üretir. Kör uçları atın.
- Enjeksiyon şırıngası hazırlama
- Kesilmiş cam mikropipeti 2 cm'lik bir etil vinil asetat (EVA) plastik boru segmentine (0,05" iç çap, 0,09" dış çap) takın. Bu boru segmentinin diğer ucunu 20 cm uzunluğunda bir EVA borusuna bağlayın (0,02" iç çap, 0,06" dış çap).
- Boruyu 22 G çimentolu iğne ile 50 μL cam şırıngaya bağlayın. Pistonu cam şırıngadan çıkarın ve şırıngayı ve bağlı boruyu 25 G şırınga iğnesi kullanarak mineral yağ ile doldurun. Mikropipetin ucunda 4 mm hava boşluğu bırakın.
- AAV'nin intravitreal enjeksiyonu
- Hayatta kalma cerrahisi için kurumsal protokollere göre steril cerrahi eldivenler, temiz laboratuvar önlüğü, maske, steril alan ve otoklavlanmış aletler kullanarak standart aseptik teknikle intravitreal enjeksiyon yapın.
- AAV vektörünün bir aliquot'unu -80 ° C'de depolamadan çıkarın ve buz üzerinde çözün. Çözüldükten sonra, hava kabarcıklarını gidermek için 2.000 × g'de 10 sn santrifüj yapın.
- Kurumsal Hayvan Çalışmaları Komitesi'nin anestezi ve kontrollü maddeler kılavuzlarını takip edin. 30 G'lık bir hipodermik iğne kullanarak, bir ketamin / ksilazin kokteylinin 0.1 mL / 10 g vücut ağırlığı intraperitoneal (IP) enjeksiyonunu gerçekleştirin (10 mg / mL ketamin, tuzlu suda 1 mg / mL ksilazin, fareye etkili doz: 100 mg / kg ketamin, 10 mg / kg ksilazin). Fareyi kafesine geri döndürün ve anestezinin etkili olması için 5 dakika bekleyin.
- 30 G hipodermik iğne kullanarak, 0.1 mL / 10 g vücut ağırlığı deri altı meloksikam enjeksiyonu yapın (% 0.9 sodyum klorürde 0.5 mg / mL).
- Kornea refleksinin kaybını ve kuyruk ve ayak parmağı sıkışmasına geri çekilme refleksini doğrulayarak anestezi derinliğini test edin. Kuyruk ve ayak parmağı çekilme refleksi kaybedildikten sonra kornea refleksi devam ederse, her göze % 0.5'lik bir proparakain çözeltisi damlası uygulayın ve 10 s bekleyin.
- Fareyi stereomikroskop altında yan tarafına yerleştirin. Cildi yörüngeden üstün ve aşağı tutmak için mini bir bulldog hemostatik kelepçe kullanın ve dünyayı yörüngeden kısmen çıkarmak için kelepçeyi medial kanthus'a sabitleyin.
- Lateral sklerayı, cam şırıngaya bağlı kesilmiş mikropipetle, limbusun ~ 1-2 mm posterioruyla delin. Limbusun hemen arkasından çevresel olarak uzanan vaskülatürü rahatsız etmekten kaçının. Delinmeyi skleraya dik bir açıyla gerçekleştirin ve lense zarar vermemek için sklerayı deldikten hemen sonra mikropipeti hafifçe geri çekin.
- Kabaca enjeksiyon için amaçlanan sıvı hacmine karşılık gelen 1-2 μL vitreus mizahını geri çekmek için cam şırınganın pistonunu kullanın. Mikropipeti gözden çekin ve çıkarılan vitreus mizahını çıkarın.
- Mikropipetin ucunu 1-2 μL AAV ile doldurun, karışmayı önlemek için viral vektör ile mineral yağ arasında ~4 mm hava boşluğu bırakın. Mikropipeti ilk delinmenin yarattığı skleradaki deliğe yerleştirin ve viral vektörü 20-30 s boyunca enjekte etmek için cam şırınganın pistonuna yavaşça basın. Mikropipetin ucundaki viral vektörün sıvı seviyesini görselleştirin ve göze herhangi bir hava girmeden önce enjekte etmeyi bırakmaya dikkat edin.
- Mikropipeti 10 saniye boyunca aynı konumda tutun, ardından mikropipeti geri çekin. Bulldog hemostatik kelepçesini çıkarın.
- Enjekte edilen göze oksitetrasiklin / polimiksin B antibiyotik oftalmik merhem uygulayın. Fareyi bir ısıtma yastığına yerleştirin ve anesteziden iyileşmesini izleyin (bkz. 3.4.3).
- Fareyi yuvasına geri döndürün ve kurumsal yönergelere göre ameliyat sonrası bakım yapın. Görüntülemeden önce floroforların viral aracılı ekspresyonu için 2-3 hafta bekleyin.
2. Mikroskop kurulumu
NOT: Mikroskop ışık yolunun şeması Şekil 1'de gösterilmiştir.
- "Her Zaman Açık" ekipman: Bu aletler ayarlama veya bakım yapılmadığı sürece her zaman açık kalmalıdır. Lazer soğutma sisteminin yüksek sıcaklığını 20,0 ° C'ye ayarlayın. Ultra hızlı Ti: Safir lazerin ana gücünü açın, sistem başlatma işlemlerinin tamamlanması için zaman tanıyın ve "Lazer Etkinleştir" tuşunu "Açık" konumuna getirin.
- Emisyon ışık yolu yapılandırması
- İlgilenilen floroforlar için uygun dikroik ve bant geçişli filtre setlerini kullanarak numune dalga boylarına giden floresan emisyon toplama yolunu yapılandırın.
NOT: Bu yazıda Twitch2b görüntülemede 505 uzun geçişli dikroik ve 480/40 ve 535/30 bant geçişli filtre çiftlerinden oluşan bir filtre küpü kullanılmıştır. GFP, 525/50 ve 605/70 bant geçiş filtreli 560 uzun geçirgen filtreden oluşan kırmızı/yeşil bir filtre küpü kullanılarak görüntülendi. Evans Blue, 560 kısa geçiş filtresi kullanılarak görüntülendi. Emisyon filtrelerinin değiştirilmesi, emisyon ışığının yollarını, fotoçarpan tüplerine (PMT'ler) zarar verebilecek başıboş oda ışığına maruz bırakır. PMT'lerin kapalı olduğundan emin olun ve ışığa maruz kalma PMT işlevini olumsuz yönde etkileyebileceğinden, toplama ışığı yolunu değiştirmeden önce oda ışıklarını kapatın.
- İlgilenilen floroforlar için uygun dikroik ve bant geçişli filtre setlerini kullanarak numune dalga boylarına giden floresan emisyon toplama yolunu yapılandırın.
- Görüntü yakalamayı başlatma
NOT: İki fotonlu lazere doğrudan maruz kalmak, özellikle kırmızı ışık yanıp sönme tepkisine neden olmayacağı için göze zararlıdır. Lazerin ışık yolu boyunca kapalı olduğundan emin olmak için uygun özen gösterilmelidir ve kullanıcıyı göz mercekleri yoluyla maruz kalmaktan veya mikroskop hedefinden kaynaklanan emisyonlardan korumak için arıza kasaları mevcuttur. Kullanıcılar, lazerin hangi koşullar altında amaçtan yayılacağını anlamalı ve kendilerini bu tür tehlikelere maruz bırakmamak için uygun önlemleri almalıdır.- Veri toplama cihazını, bilgisayarı, Pockels hücresini, mikroskop ve sahne kontrolörünü, mekanik deklanşör kontrolörünü ve PMT ana gücünü açın. PMT'leri görüntü almaya hazır olana ve başıboş ışıktan korunana kadar "Devre Dışı" durumunda tutun. Bilgisayarda lazer kontrol arayüzünü ve görüntü alma yazılımını açın. Lazeri bilgisayar arayüzünden açın ve mod kilitlemeyi sağlayın.
- İstediğiniz lazer dalga boyunu ayarlayın. Lazer deklanşörünü açarak lazer ışığının Pockels Hücresine girdiğinden emin olun ve lazer gücünün dengelenmesi için 30 dakika bekleyin.
- Lazer gücünü hedefte ölçme ve maksimum lazer yüzdesini ayarlama
NOT: Lazer radyasyonu, güç ölçümü sırasında objektif lensten yayılır. Mikroskop muhafaza perdesini kapatın ve görüntüleme deklanşörünü etkinleştirmeden önce uygun göz koruması takın. İlgilenilen her dalga boyu için güç çıkış eğrisini oluşturmak için ilk sistem kurulumu sırasında lazer gücünü ölçün ve bundan sonra uyarma gücünün kararlılığını doğrulamak için aylık olarak.- Optik güç ölçeri açın ve lazer dalga boyuna karşılık gelen ölçüm dalga boyunu seçin. Optik güç ölçer dedektörünü mikroskop aşamasına yerleştirin ve X-Y boyutlarında objektif lensin altında doğrudan manevra yapın. Z boyutlu motorlu odak sürücüsünü kullanarak, güç ölçer dedektörü objektif lensin ~1 mm altına gelene kadar objektif lensi indirin.
- Epifloresan aydınlatmadan mikroskop uyarma ışık yolu olarak lazere geçin. Mekanik deklanşörü etkinleştirin.
- Görüntü alma yazılımında, görüntüleme deklanşörünü açmak için bir nokta taraması başlatın ve lazeri optik güç ölçere gönderin. Tarama yazılımında lazer gücünü% 100'e ayarlayın. En yüksek lazer güç ölçümü elde edilene kadar güç ölçer dedektörünün X-Y ve Z konumlarını optimize edin.
- Pockels Hücresinde lazer gücünü hedefte% 0,1 ila% 100 arasında ölçün,% 10 aralıklarla ölçümler yapın. Hedefte 45 mW güce karşılık gelen Pockels Hücresi yüzdesini kaydedin. Bu yüzdeyi görüntü alma yazılımında maksimum lazer gücü olarak ayarlayın.
NOT: Hedef dokuya gözle görülür bir hasar vermeden in vivo fare retinal görüntüleme için gözlenen en yüksek güç, görüntülemeden iki hafta sonra histolojik boyama ile test edildiği gibi 45 mW idi. Belirgin retina hasarı, hedefte 55 mW ile yapılan görüntülemeden sonra belirgindir. - Görüntüleme deklanşörünü devre dışı bırakın ve uyarma ışığı yolunu epifloresansa döndürün.
3. Görüntü yakalama için farenin hazırlanması
- Görüntüleme için anestezi yapan fare
NOT: İzoflurana maruz kalmayı azaltmak için uygun atık gaz temizlemeyi sağlayın. Anestezi indüksiyon odasının egzoz portunun pasif bir süpürme gazı filtresi kabına bağlı olduğundan ve fare anestezi burun parçasının çıkışının, bir gaz tahliye aparatı tarafından sağlanan vakumlu aktif bir süpürme gazı filtresi kabına bağlı olduğundan emin olun. Değiştirilmek üzere filtre kutusu ağırlığını izlemek için üreticinin yönergelerine uyun.- Yukarıda adım 1.3.3'te açıklandığı gibi ketamin / ksilazin kokteylini kullanarak fareyi anestezi altına alın. Alternatif olarak, anestezinin idamesi için izofluran kullanılıyorsa, izofluran inhalasyonu yoluyla anesteziyi indükleyin (görüntüleme seansı 30 dakika >). Küçük hayvan anestezi cihazını, indüksiyon odasını 0,5 L / dak akış hızında oda havası ile karıştırılmış% 5 izofluran ile dolduracak şekilde ayarlayın. Fareyi indüksiyon odasına yerleştirin ve farenin anestezi alması için 15 s bekleyin.
- İzofluran buharlaştırıcıyı% 0'a değiştirin ve anestezi akışını burun parçasına yönlendirin. İndüksiyon odasının 5 saniyelik "O2 yıkama" işlemini gerçekleştirin. Fareyi indüksiyon odasından çıkarın ve burun parçasını takarak kafa tutucusuna sabitleyin (bkz. bölüm 3.3).
- Anestezinin sürdürülmesi için oda havası ile 0.5 L / dak akış hızında %1 izofluran karışımı kullanın. Anestezi boyunca 5 dakikalık aralıklarla solunum hızını izleyin, ~ 60 nefes / dak solunum hızını korumak için izofluran yüzdesini ayarlayın.
NOT: Bu ayarlar (% izofluran, akış hızı) ketamin / ksilazin kokteyli tarafından indüklenen anestezinin sürdürülmesi için de kullanılabilir.
- Öğrenci genişlemesi
- Suda %1 w/v atropin ve %2,5 w/v fenilefrin hidroklorür çözeltisi hazırlayın. Dilatör çözeltisini ışıktan korunan oda sıcaklığında saklayın.
- Tek kullanımlık pipet göz damlalığı kullanarak, görüntülenecek her göze bir damla dilatör çözeltisi uygulayın. Oda ışıklarını kapatın ve öğrencinin genişlemesi için 5 dakika bekleyin. Göz bebeği genişlediğinde, dilatör çözeltisini tüy bırakmayan doku ile temizleyin.
NOT: Dilatör solüsyonunun burun deliklerine girmediğinden emin olun. - Görüntülenecek her göze büyük bir damla yağlayıcı göz jeli uygulayın. Her iki göz de görüntülenecekse, dehidrasyonu önlemek için görüntüleme yapmayan gözün üzerindeki göz jeli üzerine küçük bir plastik streç film parçası uygulayın. Sadece bir gözü görüntülüyorsanız, görüntülenmeyecek göze kayganlaştırıcı göz merhemi uygulayın.
- Görüntüleme için fareyi konumlandırma
- Fareyi görüntüleme kafası tutucusuna sabitlemek için, kulaklık çubuğu yataydan 60° veya daha fazla bir açıyla eğilene kadar kafa tutucunun ana kolunu döndürün. Alt kulak kanalı pimini içe doğru uzatılmış pozisyonda ve üst kulak kanalı pimini çekilmiş pozisyonda sabitleyin.
- Fare ısırık çubuğuna bakarken, bir kulağını uzatılmış alt pime monte edin ve pimi kulak kanalına yerleştirin. Üst kulak kanalı pimini sabitleyen vidayı gevşetin ve pimi diğer kulak kanalına uzatın. Kafayı sabitlemek için vidayı sıkın.
- Isırık çubuğunu farenin başına doğru kaydırın. Farenin başını yavaşça yükseltin, ardından farenin maksiller kesici dişlerini ısırık çubuğunun deliğine indirin. Farenin kafasını sabitlemek için ısırık çubuğunu yumuşak bir kuvvetle geri çekin ve vidayı sıkarak ısırık çubuğu konumunu sabitleyin.
- İzofluran kullanıyorsanız, farenin kesici dişlerini sabitlemeden önce burun parçasını yuvasından ısırık çubuğuna kaydırın. Isırma çubuğu pozisyonunu adım 3.3.3'teki gibi sabitleyin ve sıkın. Üst yüzündeki iki vidayı kullanarak burun parçasını, farenin burnuna sıkıca oturana kadar sıkın, ancak burnu daraltmaz.
- Fareyi, kafa tutucusunda, hedefin altındaki mikroskop aşamasına aktarın. Baş tutucunun ana kolunu, gözün göz bebeği ışık yoluna uygun olarak düz bir şekilde yukarı doğru yönlendirilene kadar döndürün (Şekil 2).
- Kompakt filtre tutucusuna #1,5 kapak kapağı yerleştirin ve tutucuyu mikroskop aşamasına takın. Kapak kaymasını göze doğru indirin, yağlayıcı göz jeli ile temas ettirin, böylece kapak kayması korneanın hemen üzerinde yatay olarak uzanır (Şekil 2). Örtü kaymasının korneaya temas etmediğinden emin olun.
NOT: Mikroskopta, uyarma ışık yolunun epifloresan ve emisyon ışık yolunun göz merceği olarak ayarlandığından emin olun. Epifloresan aydınlatıcıyı en düşük güçte açın ve aydınlatıcı deklanşörünü açın. Görüntülenen florofora karşılık gelen epifloresan aydınlatıcı dalga boyunu ve floresan filtresini seçin. - Geniş alan uyarma ışığı korneayı tamamen kaplayana kadar sahne kontrolünü ve motorlu odak tahrikini kullanarak sahneyi X-Y boyutlarında manevra yapın ve Z-konumunda hedefleyin. Göz merceğinden bakıldığında, retinadaki floresan hücreler veya yapılar odaklanana kadar sahnenin Z-pozisyonunu ayarlamaya devam edin. Numune sinyali, ilgilenilen hücreleri veya yapıları göz merceği aracılığıyla çözmek için yeterince parlak değilse, epifloresan aydınlatıcı gücünü artırın.
NOT: Retinayı bulmakta sorun yaşıyorsanız, iris üzerine sabitlenmek ve ardından retinaya doğru odaklanmak için yüksek kontrastlı bir dönüm noktasıdır. Bu adım aynı zamanda öğrencinin maksimum derecede genişlemiş olduğunun doğrulanmasına da izin verecektir. - Fare lensiyle eksen üzerinde bir görüntüleme alanı elde edin. Odak düzlemini ayarlarken yalnızca odak dışı ışığın genişlemesi veya daralması gerçekleşene kadar kafa tutucudaki çeşitli serbestlik derecelerini kullanarak farenin açısını ayarlayın. Epifloresan aydınlatıcıyı kapatın ve aydınlatıcı deklanşörünü kapatın.
NOT: Z-yönü odak düzlemleri arasında gezinirken odak dışı ışığın önemli X-Y paralaksı, retinanın görüntüleme ışığı yoluna göre eksende olmadığını gösterir.
4. İki fotonlu görüntü yakalama
- Görüntü kurulumu ve alma parametreleri
NOT: Oda ışıklarını kapatın ve odadaki başıboş ışık kaynaklarını örtün. Epifloresan aydınlatıcının kapalı olduğundan ve aydınlatıcı deklanşörünün kapalı olduğundan emin olun.- Uyarma ışığı yolunu lazere ve emisyon ışık yolunu PMT'lere geçirin.
- Görüntü alma yazılımında, kare boyutunu 512 x 512 ve kare ortalamasını 3 olarak ayarlayın. Dilim başına adımları -8 μm olarak ayarlayın. Yığının tepesinden başlayıp aşağıya doğru ilerlemek için z-adımlamayı belirleyin, böylece fotoreseptörlerin iki fotonlu lazer aktivasyonunu en aza indirin.
NOT: Adım boyutu, daha uzun görüntüleme süresi pahasına Z-çözünürlüğünü artırmak için küçültülebilir, ancak bu görüntüleme konfigürasyonunda hücre somatasını çözmek için 8 μm adım yeterlidir. - PMT'leri açın ve etkinleştirin. PMT voltajını 680 V'a ayarlayın.
NOT: Güç beslemeli PMT'ler hafif hasara karşı hassastır. Epifloresan aydınlatıcının kapalı olduğundan, mikroskop muhafaza perdesinin çekildiğinden ve oda ışıklarının kapalı olduğundan emin olun. - Hedef dokunun %1 lazer gücüyle başlayan canlı görüntü önizlemesine başlayın. İlgilenilen hücreleri veya yapıları görselleştirmek için ekran parlaklığını otomatik olarak ayarlayın. Tarama aşamasını otomatik olarak ayarlayın. Hedef doku loş veya belirsizse, 45 mW'a karşılık gelen adım 2.4.4'te belirlenen sınırı aşmadan yapılar görünür hale gelene kadar lazer güç yüzdesini artırın.
NOT: 16 bitlik bir görüntü için, ilgilenilen yapıları içeren bir Z-düzleminde parlaklığı otomatik olarak ayarladığında ~1000 ekran değeri, numunenin yeterli parlaklığını gösterir. - İstenilen bir görüntüleme alanını ortalamak için mikroskop aşamasını X-Y yönünde manevra yapın, ardından odakta ilgilenilen yapılarla Z-düzlemine gidin.
NOT: Optik sinir kafasına bitişik görüntüleme, kronik görüntüleme deneyleri için açık bir dönüm noktası olarak hizmet etmesini sağlar. - Bu kronik bir hızlandırılmış denemeyse, edinme bilgisayarında önceki bir görüntüyü açın ve aynı ilgi alanını bulmak için referans olarak kullanın. Minimum paralaksla aynı hücre kümesini elde etmek için görüntüleme açısının önceki görüntülerinkine benzer olduğundan emin olun.
NOT: Önceki zaman noktalarında olduğu gibi aynı hücreleri görüntülemek için fare kafası konumunun daha fazla ayarlanması gerekebilir (Şekil 3). - İlgilenilen en üstteki ve en alttaki Z-düzlemlerine giderek görüntüleme yığınının Z-sınırlarını ayarlayın ve görüntüyü alın. Görüntü alma işlemi tamamlandıktan sonra, PMT'leri ve emisyon deklanşörünü devre dışı bırakın. Emisyon ışık yolunu tekrar göz merceğine ve uyarma ışığı yolunu epifloresan aydınlatmaya geçirin. Fareyi mikroskop aşamasından çıkarın.
- Sistem yazılımı ve donanımının kapatılması
- Görüntü alma yazılımından çıkın. Bilgisayar arayüzündeki lazeri kapatın. "Her Zaman Açık" Ekipman hariç, donanımı ters başlatma sırasına göre kapatın.
- Fare kurtarma
- Kafa tutucuyu ve fareyi mikroskop aşamasından çıkarın. Varsa, izofluran buharlaştırıcıyı% 0'a ayarlayın. Fareyi baş tutucusundan çıkarın.
- Yağlayıcı göz jelini tüy bırakmayan bir mendille nazikçe silin ve her iki göze de beyaz petrolatum-mineral yağ yağlayıcı göz merhemi uygulayın. Fareyi ılık su dolaşımdaki ısıtma yastığının üzerine yerleştirin (37 ° C'ye ayarlayın), fare uyanana ve ambulatuar kapasiteyi yeniden kazanana kadar fareye katılmaya ve solunum hızını izlemeye devam edin. Fareyi yuvasına geri getirin.
- Mümkünse, intravitreal enjeksiyondan 24 saat sonra hayvan aktivitesini ve morbiditesini değerlendirin. Çalışmanın tamamlanmasının ardından, fareyi aşırı dozda tribromoetanol (250 mg / kg) ile ötenazi yapın ve retina dokusunu korumak için% 4 paraformaldehit ile transkardiyal perfüzyon gerçekleştirin.
5. Görüntü işleme ve analizi
- Çok kanallı verileri ayırın ve birleştirin
- Bazı görüntü alma yazılımı programları çok kanallı görüntüleri araya eklenmiş bir biçimde depoladığından, kanalları ayırmak için Fiji (.tif) gibi bir yazılım kullanarak https://imagej.net/Fiji görüntü dosyasını açın.
- Fiji'nin Görüntü menüsünde Yığınlar | Araçlar | Deinterleave. Görüntüyü oluşturan kanal sayısını girin ve Tamam'ı tıklatın.
- Ayrılmış kanalları tek bir dosyada birleştirmek için Görüntü | Renk | Kanalları Birleştir. Araya sökülmüş görüntü kanallarını ayrı renk kanallarına yerleştirin ve çok kanallı bileşik görüntüyü oluşturmak için Tamam'ı tıklatın. Bu bileşik görüntüyü yeni bir .tif dosyası olarak kaydedin.
- Çok kanallı görüntülerde floresan yoğunluğunun ölçülmesi
NOT: Belirlenen ilgi bölgelerindeki (ROI'ler) floresan yoğunluğu, Fiji kullanılarak tek görüntülü düzlemlerde ölçülebilir. Oranmetrik okumaların nicelleştirilmesi, aynı ROI içindeki kompozit bir görüntünün farklı kanallarındaki floresan yoğunluğunun ölçülmesiyle elde edilebilir. Kronik görüntüleme deneyleri için, uyarma veya emisyon oranımetrik çıktılarına dayanan biyosensörlerin kullanılması en iyisidir.- Fiji'de Analiz | Araçlar | Yatırım Getirisi Yöneticisi. Bileşik görüntüyü Fiji'de açın. İlgilenilen yapıya karşılık gelen z dilimine ilerleyin ve YG'leri özetlemek için Seçim araçlarını (Dikdörtgen seçimi, Oval seçim, Çokgen seçimi gibi) kullanın.
- Her seçimi YG Yöneticisi'ne eklemek için klavyede T düğmesine basın. YG seçimi tamamlandıktan sonra, YG'lerden Alan ve Ortalama Yoğunluk değeri gibi çeşitli verileri kaydetmek için YG Yöneticisi'nde Ölç'e tıklayın.
- Sonuçlar penceresinde kayıtlı o anda seçili olan kanalın ölçümlerini bir e-tabloya kopyalayın. Bileşik görüntü penceresinde bir sonraki Kanala geçin ve aynı YG kümesi içinde bu kanalın ölçümlerini almak için Ölçüm'ü tıklatın. Yatırım getirisi Yöneticisi'nde Diğer | Yatırım getirilerini kaydedin ve .zip dosyası olarak kaydedin.
- Ekran için maksimum yoğunluk projeksiyonları
- Görüntü verilerinin görüntülerini oluşturmak için Fiji'deki Z-project işlevini kullanın. Görüntü menüsünde Yığın | Z projesi. Arka planı azaltmak için yalnızca ilgi alanlarının bulunduğu çerçeveleri seçin.
- PMT atış gürültüsünün giderilmesi isteniyorsa, Medyan filtre işlevini kullanın. İşlem menüsünde İşlem | Filtreler | Medyan. Uzamsal ayrıntıları korumak için 1,0 değerini seçin.
- Tek hücrelere odaklanan maksimum yoğunluklu projeksiyonlar oluşturmak için, yalnızca ilgilenilen hücreye karşılık gelen görüntü karelerini seçerek bu işlemi tekrarlayın.
NOT: Bu, hücresel arborsları çözme yeteneğini büyük ölçüde artırabilir (Şekil 4). Floresan yoğunluğu ölçümleri, maksimum yoğunluk projeksiyonlarında değil, tek resimli düzlemlerde yapılmalıdır.
Sonuçlar
Çeşitli transgenik, viral vektör veya inorganik boya etiketleme yaklaşımları, temel bir çoklu foton mikroskobunun basit bir adaptasyonunu kullanarak çeşitli retinal hücre tiplerini ve yapılarını in vivo olarak görselleştirmek için kullanılabilir. RGC'leri ve amakrin hücreleri görselleştirmek için, sırasıyla VGlut2-Cre ve VGat-Cre transgenik farelerine, camgöbeği ve sarı floresan proteinleri (sırasıyla CFP ve YFP) içeren sitoplazmik floresan rezonans enerji transferi (FRET) tabanlı bir Ca2+ sensörü olan Twitch2b'yi kodlayan Cre'ye bağımlı bir AAV ekspresyon yapısının intravitreal enjeksiyonu verildi ve troponin15'in Ca2 + bağlanma alanı . VGlut2-Cre farelerde, RGC somalar açıkça ayırt edilebilir ve aksonların fasikülleri sıklıkla belirgindir (Şekil 3).
Aksonların yörüngesinin ve vaskülatürün negatif görüntüsünün, kronik görüntüleme deneylerinde bir dönüm noktası olarak yararlı olan VGlut2-Cre farelerinde optik sinir kafasını tanımlamayı çok kolay hale getirdiği belirtilmelidir (Şekil 3). Her ne kadar amakrin hücreler RGC'lerden daha az parlak görünse de, muhtemelen daha küçük soma boyutları ve / veya daha az verimli AAV transdüksiyonları nedeniyle, somaları hala iç nükleer tabakada kolayca görülebilir. RGC'lerin aksine, amakrin hücreli nöritler iç pleksiform tabakalarda daha sık görülür (Şekil 4). Retinal mikroglia, Cx3cr1-GFP transgenik fare hattı6'da görüntülenebilir. Mikroglia, vaskülatür ile ilişkilidir ve hızlandırılmış görüntüleme deneylerinde aynı bölgeyi bulmayı mümkün kılar.
Bu yaklaşım, ince mikroglia süreçlerinin dinamiklerini, tek düzlemli görüntülerde daha iyi uzamsal çözünürlüğe sahip bir prosedürü veya bireysel hücrelere odaklanarak maksimum yoğunluklu projeksiyonların hazırlanıp hazırlanmadığını izlemek için kullanılabilir (Şekil 5). Fare merceğindeki optik sapmanın neden olduğu zayıf eksenel çözünürlük, z boyutundaki ince ayrıntıların incelenmesini engeller. Bu görüntüleme tekniğinin hücresel ultrayapıdaki dejeneratif değişiklikleri gözlemleyip gözlemleyemeyeceğini belirlemek için, eksitotoksik lezyonu indüklemek için vitreusa 1 μL 50 mM N-metil-D-aspartat (NMDA) enjekte edildi. Enjeksiyondan bir gün sonra, mikroglia önceki raporlara göre kısa süreçler veya amip morfolojisi gösterdi (Şekil 5)16. Cx3cr1-GFP transgenik hattındaki hücrelerin, hücresel kohort boyunca, floresan protein ekspresyon kasetlerinin AAV aracılı dağıtımı ile yapılan deneylerden daha düzgün ve eksiksiz floresan protein ekspresyonu sergilediği belirtilmelidir. Deneyler tasarlanırken çeşitli ve seyrek ile tam ve tekdüze etiketlemenin faydaları göz önünde bulundurulmalıdır.
Retinal vaskülatürü dahaönce tarif edildiği gibi 8 olarak etiketlemek için, farelere görüntülemeden 30-60 dakika önce 200 μL Evans mavi boya (steril salinde 20 mg / mL) ile intraperitoneal olarak enjekte edildi. Bu, optik sinir kafasından çıkan kan damarlarının güçlü bir şekilde etiketlenmesine yol açtı (Şekil 6). Şaşırtıcı bir şekilde, tek bir enjeksiyonun floresan sinyali en az yedi gün boyunca devam etti. İn vivo görüntülerin boyutlarını tahmin etmek için iki farklı yöntem kullanıldı. İlk olarak, aynı retinal bölgeler konfokal mikroskopi kullanılarak düzleştirilmiş retinal bütünlüklerde in vivo ve fiksasyondan sonra görüntülendi (Şekil 7). Dört farklı in vivo örnekten rastgele hücre çiftleri seçildi ve hücre çiftleri arasındaki gerçek mesafe konfokal taramalarda ölçüldü ve 1x dijital büyütme ile ortalama 0.99 μm'lik bir piksel boyutu elde etmek için in vivo piksel mesafesi ile eşleştirildi. İn vivo görüntüleri konfokal bütünmonte taramalarla ilişkilendiren benzer yöntemlerin kullanılması, tek bir kafa pozisyonunun kabaca 650mm2'lik bir retina yaması üzerinde görüntülemeye izin verdiğini ortaya koymuştur.
Kafa tutucunun bir burulma ekseni boyunca yeniden konumlandırılması, retinanın 2,2 mm uzunluğundaki doğrusal bir bölgesine erişime izin verebilir (gösterilmemiştir). Ayrıca, farelerin gözlerine 1 veya 2 μm çapında floresan mikrosferler enjekte edildi ve çapları, 10x dijital yakınlaştırma ile in vivo görüntülerden tam genişlikte yarım maksimum çizgi taraması olarak ölçüldü. Bu, biraz daha büyük bir piksel boyutu tahmini verdi, ancak daha fazla varyans ile (Şekil 7). Genel olarak, in vivo deneylerin tamamlanmasından sonra tüm numunelerin konfokal görüntülemesi, kornea ve lens özelliklerindeki varyans, numuneden numuneye görüntü ölçeğini değiştirebileceğinden, bireysel görüntülere ölçek atamak için en tutarlı yöntemdir.
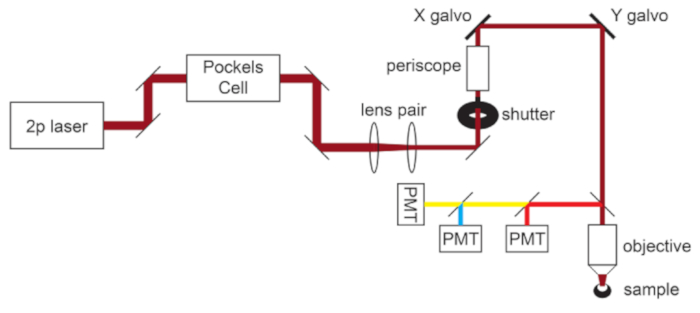
Şekil 1: Işık yolu şeması. Bu protokolde kullanılan iki fotonlu mikroskobun temel bileşenleri, lazer gücünü modüle etmek için bir Pockels Hücresi, mikroskop hedefinin arka açıklığına uyacak şekilde lazer ışını çapını azaltmak için bir lens çifti ve ışın yönlendirme için bir çift galvo tarama aynasından oluşur. Her ana optik bileşenden önce bir çift direksiyon aynası bulunur. Odak, objektif montajı yönlendiren bir motor tarafından kontrol edilir. Emisyon ışık yolu, dikroik ve bariyer filtreleri değiştirilerek farklı floroforlar için özelleştirilebilir. Camgöbeği/sarı/kırmızı görüntüleme için genel bir kurulum, kısa geçişli dikroik aynanın kırmızı ışığı ilk PMT'ye yönlendirdiği ve camgöbeği ve sarı emisyonları ayırmak için uygun bant geçiş filtreleriyle eşleştirilmiş uzun geçişli dikroik aynanın kullanıldığı bir kurulum görüntülenir. Kısaltma: PMT = fotoçarpan tüpü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 2: Fareleri in vivo görüntüleme için konumlandırma. Fareyi göz bebeği ile ışık yolu ile eksen üzerinde konumlandırmak için, anestezi uygulanan fare önce bir kafa tutucusunda tutulur, kafa döndürülür ve açılı, göze büyük bir damla yağlayıcı göz jeli yerleştirilir ve fare sahneye yerleştirilir. Işık yoluna dik olan kapak fişi tutucusuna bir kapak kayması monte edilir ve göze doğru indirilir. Örtü kayması, kornea veya fare kafasına (solda) temas etmemelidir, bu da örtü kayması saptırılırsa belirgin olacaktır. Bununla birlikte, kapak kayması, damlacıktan feragat etmesini önlemek için yeterince yakın olmalıdır (sağda), çünkü bunun numune üzerinde büyütücü bir etkisi olacaktır. Jel daldırma uygulandıktan ve kapak kayması sabitlendikten sonra, aşama doğrudan mikroskop hedefinin altında yerinde hareket ettirilmelidir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
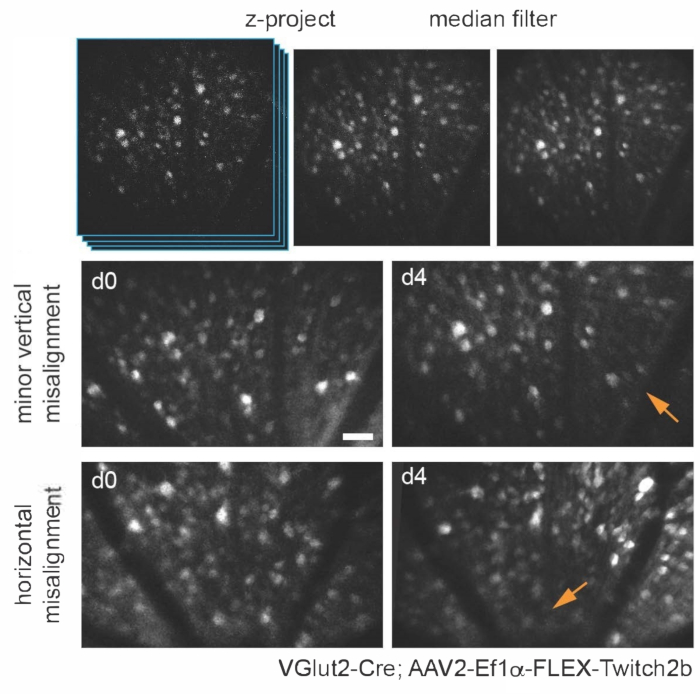
Şekil 3: Retinal ganglion hücrelerinin görüntülenmesi. Görüntü görüntüleme için, ilgilenilen hücreleri içeren z-düzlemleri ile maksimum yoğunluk projeksiyonları oluşturulur ve sonuçta ortaya çıkan görüntüler PMT çekim gürültüsünü gidermek için medyan filtrelenir. AAV-EF1α-FLEX-Twitch2b'nin VGlut2-Cre transgenik farelere, özellikle CFP sinyaline enjekte edilmesiyle etiketlenen retinal ganglion hücrelerinin iki örneği gösterilmiştir. Görüntüler dört gün arayla yapılan seanslarda elde edildi ve optik sinir başının yakınındaki aynı bölgeye dönmek için vasküler işaretler kullanıldı. Optik sinir kafası görüntünün altına doğru yönlendirilir. Her iki örnek de oryantasyonda bir miktar farklılık gösterse de (yoğunluğu azalmış bölgeler oklarla gösterilir), çoğu hücre her iki zaman noktasında da bulunur. Ölçek çubuğu = yaklaşık 50 μm. Kısaltmalar: PMT = fotoçarpan tüpü; AAV = adeno ilişkili virüs; EF1α = uzama faktörü-1alfa; FLEX = flip-eksizyon; VGlut2 = veziküler glutamat taşıyıcı 2; CFP = camgöbeği floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
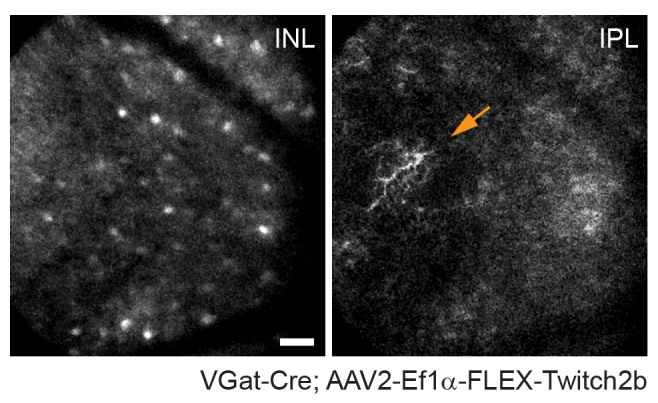
Şekil 4: Amakrin hücrelerin görüntülenmesi. Amakrin hücreleri, VGat-Cre transgenik farelere AAV-EF1α-FLEX-Twitch2b enjekte edilerek etiketlendi. Twitch 2b'nin CFP sinyali özellikle gösterilmiştir. İç nükleer tabakanın derinliklerine odaklanan küçük maksimum yoğunluklu projeksiyonlar amakrin hücre somalarını gösterirken, iç pleksiforma odaklanmak amakrin hücre nöritlerini (ok) çözer. Optik sinir başı görüntünün sağına doğru yönlendirilir. Ölçek çubuğu = yaklaşık 50 μm. Kısaltmalar: AAV = adeno ilişkili virüs; EF1α = uzama faktörü-1alfa; FLEX = flip-eksizyon; VGat = veziküler gama aminobütirik asit taşıyıcısı; CFP = camgöbeği floresan proteini; INL = iç nükleer tabaka; IPL = iç pleksiform tabaka. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
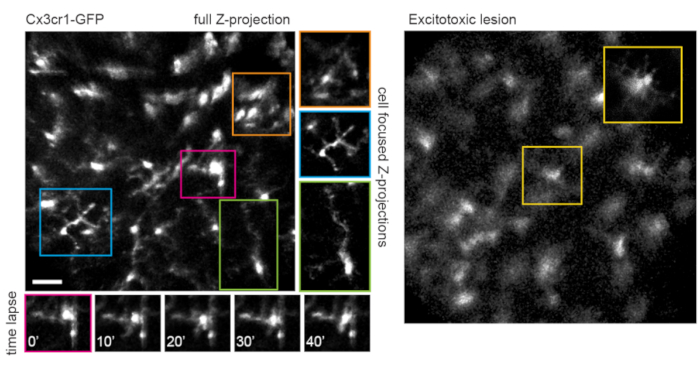
Şekil 5: Görüntüleme mikrogliası. Transgenik fare hattı Cx3cr1-GFP, mikrogliayı etiketlemek için kullanıldı. Tam tarama hacminin maksimum yoğunluklu bir projeksiyonu, bazıları çözülebilecek ince proses ayrıntılarına sahip birçok mikroglia gösterir. Alanın sol alt köşesindeki hücrelerin, bu bölgedeki paralaks nedeniyle maksimum projeksiyonda sağ üste doğru olanlardan daha az bozulmaya sahip olduğunu unutmayın. Sadece ilgilenilen hücreyi içeren maksimum yoğunluklu projeksiyonlar bu paralaksı önemli ölçüde azaltır (merkez, karşılık gelen renklerde kutulu). Ayrıca, bu görüntüleme stratejisi ince mikroglia sürecinin yeniden şekillendirilmesinin dinamiklerini (alt paneller) belgeleyebilir. Karşılaştırmalı olarak, birçok mikroglia, eksitotoksik bir lezyondan bir gün sonra, 50 mM NMDA intravitreal enjeksiyonu ile kısa süreçler veya amip morfolojisi ile görülebilir (sağda). Ölçek çubuğu = yaklaşık 50 μm. Kısaltmalar: GFP = yeşil floresan protein; Cx3cr1 = Cx3 kemokin reseptörü 1; NMDA = N-metil-D-aspartat. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
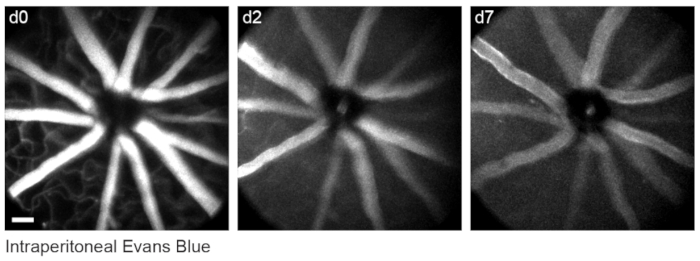
Şekil 6: Vasküler yer işaretlerini etiketleme. Farelere, ilk görüntüleme seansından 30-60 dakika önce intraperitoneal olarak 200 μL 20 mg / mL Evans mavisi enjekte edildi. Tam kalınlıktaki maksimum yoğunluklu projeksiyonlar, retina vaskülatüründe en az yedi gün boyunca devam eden kalıcı floresan gösterir. Ölçek çubuğu = yaklaşık 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
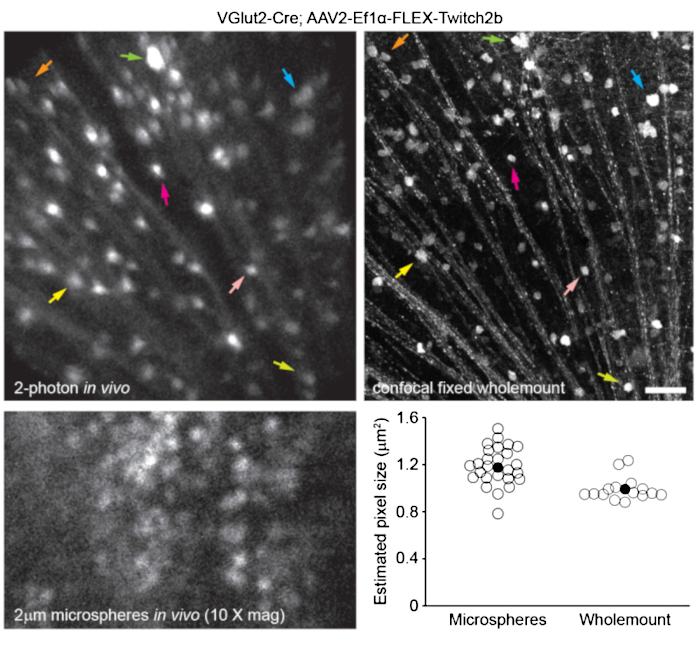
Şekil 7: Görüntü boyutları. VGlut2-Cre transgenik farelere AAV-EF1α-FLEX-Twitch2b enjekte edilerek etiketlenen retinal ganglion hücreleri in vivo olarak görüntülendi ve aynı bölge daha sonra fiksasyon ve retinanın tamamen hazırlanmasından sonra konfokal lazer tarama mikroskobu ile görüntülendi. Her ikisi için de sarı floresan protein kanalı gösterilmiştir. Renkli ok çiftleri her iki preparatta da aynı hücreyi gösterir (üst paneller). 2 μm çapında floresan mikrosferlerin tek düzlemli görüntüsü intravitreal olarak enjekte edildi ve in vivo olarak görüntülendi (sol alt panel). Mikrosferler yerleşmedi ve bu nedenle eksenel çözünürlüğün ölçülmesini imkansız kılan sürekli hareket halindeydi. Piksel boyutları, in vivo floresan mikrosferlerin tam genişlikte yarı maksimum ölçümlerinden veya grup başına 2-4 retinadan alınan korelasyonel konfokal ölçümlerden (sağ altta) hesaplanmıştır. Ölçek çubuğu = 50 μm. Kısaltmalar: AAV = adeno ilişkili virüs; EF1α = uzama faktörü-1alfa; FLEX = flip-eksizyon; VGlut2 = veziküler glutamat taşıyıcı 2. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
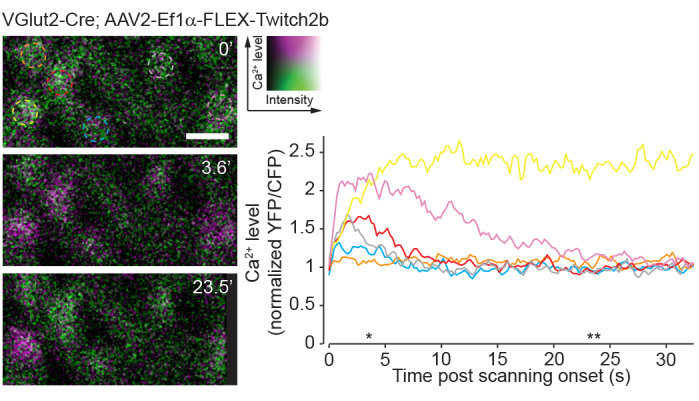
Şekil 8: İki foton taraması ile indüklenen kalsiyum aktivitesi. VGlut2-Cre transgenik farelere AAV-EF1α-FLEX-Twitch2b enjekte edilerek etiketlenen retinal ganglion hücreleri, YFP, 4.22 Hz'de bir zaman serisi olarak tek bir düzlemde görüntülenen sahte renkli macenta ve CFP yeşilidir. Tüm RGC'ler benzer bir başlangıç YFP / CFP oranına sahipti. Çoğu FRET oranında bir artışla yanıt verdi (turuncu hücre hariç) ve biri zaman serisi boyunca (sarı hücre) yüksek bir YFP / CFP oranını korudu. YFP/CFP oranları ilk kare ortalamasına normalleştirildi ve renkli daireler renkli izlerle eşleşti. Yıldız işaretleri, solda görüntülenen temsili resimlerle zaman noktalarını gösterir. Ölçek çubuğu = 20 μm. Kısaltmalar: AAV = adeno ilişkili virüs; EF1α = uzama faktörü-1alfa; FLEX = flip-eksizyon; VGlut2 = veziküler glutamat taşıyıcı 2; YFP = sarı floresan protein; CFP = camgöbeği floresan proteini; RGC'ler = retinal ganglion hücreleri; FRET = floresan rezonans enerji transferi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan iki fotonlu görüntüleme prosedürü, fare retinasının uzunlamasına in vivo görüntülenmesini sağlar. Aynı retina bölgesinin tekrarlanabilir görüntüleri, izofluran altında 6 veya daha fazla saate kadar sürekli bir süre boyunca elde edilebilir. Fare, aynı görüntüleme alanını bulmak için hücresel ve vasküler işaretler kullanılarak farklı günlerde de görüntülenebilir (Şekil 3). Bu amaçla kapak camı ile kombine edilmiş berrak bir jel daldırma kullanımı daha önce subretinal enjeksiyon için retinanın görselleştirilmesi, lazerle indüklenen retina hasarı modelleri ve fundus görüntüleme20,21,22 dahil olmak üzere bir dizi prosedüre uygulanmıştır.
Gözün anatomisi, in vivo görüntüleme için benzersiz zorluklar sunar, çünkü fare korneasının ve lensin yüksek optik gücü, göz bebeğinin düzeltilmeden doğrudan görüntülenmesini engeller. Diğer bazı in vivo görüntüleme yöntemleri, fare gözünün ön optiklerinin düzeltilmesi için plano-içbükey kontakt lens kullanımına dayanır 7,17,18,19. Korneada sadece optik düzeltme ile, fare lensinin yüksek optik gücü, özellikle periferik tarama alanındaki yapıların kaçınılmaz miktarda paralaksına neden olur ve farklı Z-düzlemlerinde X-Y boyutunda gerilme ve translasyonel hareket olarak kendini gösterir. X ve Y boyutlarında görüntü paralaksına bağlı bozulmayı en aza indirmek için, fare gözünün görüntüleme alanındaki retinaya teğet düzlemin mikroskop ışık yoluna dik olacak şekilde yönlendirilmesi çok önemlidir. Burada açıklanan kurulum, bu hizalamayı elde etmek için göz açısının hassas bir şekilde manipüle edilmesine elverişlidir. İki eksen boyunca dönmeye izin veren ayarlanabilir bir fare kafası tutucusu, deneyci paralaksı en aza indirmek için Z boyutunda gezinirken göz açısının manuel olarak kolayca ayarlanmasını sağlar. Bu eğilme aynı zamanda retinanın daha geniş alanlarının görüntülenmesine izin vermek için göz bebeğinin alan durdurma etkisini de atlatmaktadır. Baş tutucunun kısıtlanması, solunumun neden olduğu hareket artefaktlarını da büyük ölçüde azaltır.
Sürekli görüntüleme sırasında opaklaştırma ile görüntü kalitesi bozulacağından, fare gözünün netliğini korumak için özen gösterilmelidir. Görüntüleme sırasında yağlayıcı jelin sık sık yeniden uygulanması ve her görüntüleme seansından sonra merhem uygulanması, gözün kurumasını ve opaklık geliştirmesini önlemeye yardımcı olur. Bazı kornea opasiteleri 24-48 saat sonra kendiliğinden düzelir. Bu protokolde açıklandığı gibi şeffaf jel ve kapak camının kullanılması, kontakt lens7 ile benzer görüntü kalitesi ve sapma düzeltmesi sağlarken, kapak camını yeniden hizalamanıza gerek kalmadan göz açısının daha kolay ayarlanmasını sağlar. Ek olarak, jel göze sürekli hidrasyon sağlar ve birkaç saate kadar akut görüntüleme seanslarının gerçekleştirilmesini mümkün kılar. Son olarak, kapak camı korneaya temas etmediğinden, tekrar görüntüleme seansları için optik netliği azaltabilecek gözde minimum tahrişe neden olur.
Bu yaklaşımın bir sınırlaması, optik sapmaların tamamen düzeltilmemesidir. Bu, ağır paralaks nedeniyle eksenel çözünürlüğü ciddi şekilde azaltırken, soma'nın kantitatif ölçümleri tek resimli düzlemlerde elde edilebilir. Retinal nöronların floresan sinyal yoğunluğu bu yöntemle numune hizalamasına bağlı olduğundan, uyarma ve emisyon oranımetrik tabanlı sensörlerin, farklı görüntüleme oturumlarında örnekleri kronik olarak karşılaştıran deneyler için daha uygun olduğu belirtilmelidir. Sistem düzeyinde optik anormallikleri düzeltmeye yönelik bir yaklaşım, retinadahücre altı çözünürlüğe izin veren adaptif optiktir 8,9,14,21. Bununla birlikte, uyarlanabilir optik, uygulanması için son derece özel ekipman ve kapsamlı uzmanlık gerektirir.
İki foton in vivo retinal görüntülemeye alternatif yaklaşımlar konfokal mikroskopi veya oftalmoskopidir6. Burada sunulan yaklaşım, geniş alan veya konfokal mikroskopiye kolayca çevrilebilir olmalıdır. Tek foton görüntüleme belki de daha sağlamdır ve gözün korneası ve merceği aracılığıyla verimli iki foton etkisi elde etmek için gerekli olan iki fotonlu lazerin yüksek enerjisi nedeniyle retinaya zarar verme riski daha azdır. İki fotonlu lazer hasarını önlemek için, maksimum lazer gücü eşiği, görüntüleme deneylerinin tamamlanmasından sonra tüm retinalar incelenerek ve görüntülenen katmanlardaki hücre tipleri için immün boyama yapılarak ampirik olarak belirlenmelidir. Burada sunulan sistemde, RGC'ler pan-RGC işaretleyicisi, Rbpms ile etiketlendi ve yoğunluklar 45 mW görüntüleme gücüne kadar normalken, 55 mW önemli bir RGC kaybına neden oldu (gösterilmedi).
Tek fotonlu görüntülemenin bir dezavantajı, bu yaklaşımın retinanın doğal görsel devrelerini iki fotonlu görüntülemeye kıyasla çok ağır bir şekilde uyaracağı gerçeğidir23. Retinal bütünler veya vizör adaptörü preparatları kullanılarak yapılan önceki deneyler, iki fotonlu lazer taramanın büyük ölçüde geçici olan devre aktivasyonunu ortaya çıkardığını göstermiştir24. Burada, RGC aktivitesinin Ca 2+ sensörü Twitch2b ile görüntülenmesi, lazer taramanın başlangıcının, çoğu RGC'de 5-20 s boyunca taban çizgisine geri dönen Ca2+ yüksekliklerini indüklediğini göstermektedir (Şekil 8). Bu protokoldeki lazer gücünün, in vivo retinal ışık yanıtı8'i bildiren önceki deneyler aralığında olduğu göz önüne alındığında, şu anda açıklanan yöntem, retinadaki devre aktivitesinin kayıtlarına muhtemelen uygundur. Bu tür hususlar, devre aktivitesinden etkilenebilecek deneyler için önemlidir.
Bu protokol, iki tip retinal nöronun, RGC'lerin ve amakrin hücrelerin in vivo görüntülemesini gösterir. Yatay hücreler (Cx57-Cre 25), bipolar hücreler (Chx10-Cre 26; mGluR6-GFP 27), koni fotoreseptörleri (S- veya M-opsin-Cre 28), çubuk fotoreseptörleri (Nrl-Cre 29), Müller glia (Foxg1-Cre 26) ve perisitler (NG2-DsRed9) dahil olmak üzere diğer ana hücre tiplerinin benzer şekilde etiketlenmesi sağlanabilir. Transgenik fareler, RGC'lerin ayrı alt kümelerini etiketlemek için de mevcuttur (örneğin, αRGC'ler30 için KCNG4-Cre; ipRGC'ler için OPN4-Cre31; J-RGC'ler32 için JAM-B-CreER) ve amakrin hücreler (örneğin, starburst amacrine hücreleri26 için ChAT-Cre ve çeşitli amakrin hücre alt tipleri 3,34 için nöropeptid promotör sürücüleri). Viral vektörler, transgenik fareler yerine spesifik hücre popülasyonlarını hedeflemek için kullanılabilir. AAV2'nin her yerde bulunan bir CAG promotör elemanı ile intravitreal enjeksiyonları neredeyse sadece RGC'leri, amakrin hücreleri ve yatay hücreleri25'i etiketler. Modifiye edilmiş AAV2.7m8-Y444F kapsidin mühendislik ürünü bir mGluR6 promotör yapısı ile eşleştirilmesi, ON bipolar hücrelerin35 geniş bir şekilde etiketlenmesini sağlar. AAV'nin subretinal enjeksiyonları, fotoreseptörlerin zenginleşmesine yol açarken, serotip AAV2/5 en yüksek transdüksiyon verimliliğine sahiptir36. Glial fibriler asidik protein promotör elementleri ile eşleştirilen modifiye edilmiş bir AAV6 kapsid proteini olan Shh10, Müller glia37 için spesifik olarak gösterilmiştir.
Merkezi sinir sistemindeki hücreleri tamamen invaziv olmayan bir yaklaşımla gözlemleme yeteneği, hem nöral devrelerintemel özelliklerini 8 hem de nörodejenerasyon mekanizmalarını incelemek için kullanılabilir 3,4,5,6,38. Birçok kör edici hastalık retinadaki hücresel popülasyonları hedef alır ve farelerde in vivo görüntüleme yaklaşımları optik sinir hasarı 1,3,4, makula dejenerasyonu13, inme5, glokom 2,6 ve üveit 7'yi incelemek için kullanılmıştır. Ayrıca, Alzheimer hastalığı39, multipl skleroz40 ve Parkinson hastalığı41 dahil olmak üzere retinada birçok merkezi sinir sistemi nörodejeneratif durumu ortaya çıkmaktadır. Bu nedenle, retinanın in vivo görüntülenmesi için kolayca erişilebilen bu teknik, geniş bir nörodejeneratif durum kümesini incelemek için bir araç olarak uygulanabilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Körlüğü Önleme Araştırması Vakfı (P.R.W.'ye Kariyer Geliştirme Ödülü ve St. Louis'deki Washington Üniversitesi Tıp Fakültesi Oftalmoloji ve Görsel Bilimler Bölümü'ne sınırsız bir hibe), Ulusal Glokom Araştırması (BrightFocus Vakfı'nın bir programı) ve McDonnell Hücresel ve Moleküler Nörobiyoloji Merkezi'nden gelen hibelerle desteklenmiştir. Z.W., Kurumsal Ulusal Araştırma Hizmeti Ödülü T32 EY013360 tarafından desteklenmektedir. Bu çalışma aynı zamanda Washington Üniversitesi Tıp Fakültesi'ndeki Hope Center Viral Vectors Core tarafından da desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #1.5 coverslip | ThermoFisher | 152440 | Richard-Allan #1.5 24 mm x 40 mm |
| 50 mL glass syringe | Hamilton | 80950 | 22G cemented needle |
| Adeno-associated virus (AAV2) | Hope Center Viral Core | NA | |
| Anesthesia Air Pump | RWD Life Science | R510-30 | |
| Atropine | Sigma | A0132 | For pupil dilator solution |
| Basic Small Animal Anesthesia Device | RWD Life Science | R500IE | |
| Borosilicate glass capillary | Sutter | B150-86-10 | Outside diameter 1.50 mm, inside diameter 0.86 mm, length 10 cm |
| CFP/YFP filter cube | Chroma | custom | 480/40, 505 long pass, 535/30 |
| ChromoFlex - Two channel PMT detection unit | Scientifica | S-MPLG-1002 | |
| Circulating heating pump | Braintree Scientific | tp-700 | Set to 37 °C |
| Cling film | VWR | 10713-916 | |
| Compact Filter Holder | ThorLabs | DH1 | Holds coverslip over mouse eye |
| Cx3cr1-GFP transgenic mice (B6.129P2(Cg)-Cx3cr1tm1Litt/J) | The Jackson Laboratory | 005582 | |
| DAQ controller chassis | National Instruments | PXIe-1073 | |
| Data acquisition device | National Instruments | BNC-2090A | |
| Evans Blue dye | Fisher Scientific | AAA1677409 | |
| FPGA module with digitizer | National Instruments | NI-5734 | |
| Gas Evacuation Apparatus | RWD Life Science | R546W | |
| GenTeal Severe lubricant eye gel | Alcon | (from local pharmacy) | For use during imaging |
| GFP/Red filter cube | Chroma | custom | 535/30, 560 long pass, 605/70 |
| Heating pad | McKesson Medical and Surgical | 190147 | |
| HyperScope Launch Optics for use with Pockels Cell | Scientifica | S-MP-101080 | |
| HyperScope Main module | Scientifica | S-MP-100466 | |
| HyperScope Scan Path | Scientifica | S-MP-100406 | |
| HyperScope X galvo Module | Scientifica | MP-100443 | |
| ImageJ Fiji software | Freeware | ||
| Isoflurane | Patterson Veterinary | NDC 14043-704-06 | |
| Isoflurane gas filter cannister (active scavenging) | RWD Life Science | R510-31 | |
| Isoflurane gas filter cannister (passive scavenging) | RWD Life Science | R510-31S | |
| ketamine HCl (100 mg/mL) | Vedco | NDC 50989-161-06 | |
| M32 to M26 adapter | ThorLabs | M32M26S | |
| MaiTai GUI software | Spectra-Physics | NA | |
| MATLAB software | MathWorks | NA | R2015b |
| meloxicam (5 mg/mL) | Boehringer Ingelheim | NDC 0010-6013-01 | Analgesic |
| Micorscope Objective | Edmund Optics | 46-404 | Mitutoyo WE715042319 |
| micropipette puller | Sutter | Flaming/Brown Model P-97 | |
| Mineral oil | Fisher | BP2629-1 | |
| Mini bulldog hemostatic clamp | Fine Science Tools | 18053-28 | |
| Miniature EVA Tubing 0.02" ID, 0.06" OD | McMaster Carr | 1883T1 | |
| Miniature EVA Tubing 0.05" ID, 0.09" OD | McMaster Carr | 1883T4 | |
| Mouse head holder | Narishige | SGM-4 | |
| No. 5 Forceps | Fine Science Tools | 11251-10 | |
| Optic Posts 1/2" | ThorLabs | TR3-P5 | |
| Optical power meter kit | ThorLabs | PM100D | |
| pE-300 Ultra LLG Deivery | Scientifica | COO-LED3ULLGs | |
| Phenylephrine hydrochloride | Sigma | P6126 | For pupil dilator solution |
| Pockels cell | Conoptics | 350-80-02 | |
| Pockels cell amplifier | Conoptics | Model 302RM | |
| Proparacaine hydrochloride | Sigma | 1571001 | For eye immobilization |
| Red & Far Red short pass filter Cube | Chroma | custom | 560 short pass |
| Rotating 1/2" post clamp | ThorLabs | SWC | |
| ScanImage package | Vidrio Technologies | Freeware | Image acquisition software; Version 5.4.0 (2018); requires MATLAB |
| sodium chloride solution, sterile (0.9%) | Fresenius Kabi | NDC 63323-186-01 | |
| Stereomicroscope | Leica | S9 E | |
| Tabletop centrifuge | Oxford | Benchmate C8 | |
| Terramycin oxytetracycline/polymyxin B antibiotic ophthalmic ointment | Zoetisus | NA | For use after intravitreal injection |
| ThermoRack cooling system | Solid State Cooling Systems | ThermoRack 401 | Set to 20 °C |
| Ultrafast Ti:Sapphire laser | Spectra-Physics | Mai Tai DeepSee | |
| Vgat-Cre transgenic mice (Slc32a1tm2(cre)Lowl/J) | The Jackson Laboratory | 016962 | |
| VGlut2-Cre transgenic mice (Slc17a6tm2(cre)Lowl/J) | The Jackson Laboratory | 016963 | |
| VivoScope for In Vivo Imaging | Scientifica | S-MPVS-1200-00P | |
| White petrolatum-mineral oil lubricant eye ointment | Stye | NA | For use after imaging |
| xylazine HCl (20 mg/mL) | Akorn | NDC 59399-110-20 |
Referanslar
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Scientific Reports. 8 (1), 1490 (2018).
- Liu, H., Ding, C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose. Experimental and Therapeutic Medicine. 14 (3), 1953-1960 (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), 40352 (2012).
- Leung, C. K., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Investigative Ophthalmology & Visual Science. 49 (11), 4898-4902 (2008).
- Murata, H., et al. Imaging mouse retinal ganglion cells and their loss in vivo by a fundus camera in the normal and ischemia-reperfusion model. Investigative Ophthalmology & Visual Science. 49 (12), 5546-5552 (2008).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. Journal of Visualized Experiments. (99), e52731 (2015).
- Bremer, D., et al. Longitudinal Intravital Imaging of the Retina Reveals Long-term Dynamics of Immune Infiltration and Its Effects on the Glial Network in Experimental Autoimmune Uveoretinitis, without Evident Signs of Neuronal Dysfunction in the Ganglion Cell Layer. Frontiers in Immunology. 7, 642 (2016).
- Qin, Z., et al. Adaptive optics two-photon microscopy enables near-diffraction-limited and functional retinal imaging in vivo. Light: Science & Applications. 9, 79 (2020).
- Schallek, J., Geng, Y., Nguyen, H., Williams, D. R. Morphology and topography of retinal pericytes in the living mouse retina using in vivo adaptive optics imaging and ex vivo characterization. Investigative Ophthalmology & Visual Science. 54 (13), 8237-8250 (2013).
- Williams, D. R. Imaging single cells in the living retina. Vision Research. 51 (13), 1379-1396 (2011).
- Carroll, J., Neitz, M., Hofer, H., Neitz, J., Williams, D. R. Functional photoreceptor loss revealed with adaptive optics: an alternate cause of color blindness. Proceedings of the National Academy of Sciences of the United States of America. 101 (22), 8461-8466 (2004).
- Rossi, E. A., et al. Imaging retinal mosaics in the living eye. Eye. 25 (3), 301-308 (2011).
- Rossi, E. A., et al. In vivo imaging of retinal pigment epithelium cells in age related macular degeneration. Biomedical Optics Express. 4 (11), 2527-2539 (2013).
- Geng, Y., et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 3 (4), 715-734 (2012).
- Thestrup, T., et al. Optimized ratiometric calcium sensors for functional in vivo imaging of neurons and T lymphocytes. Nature Methods. 11 (2), 175-182 (2014).
- Takeda, A., et al. Microglia mediate non-cell-autonomous cell death of retinal ganglion cells. Glia. 66 (11), 2366-2384 (2018).
- Ikeda, W., Nakatani, T., Uemura, A. Cataract-preventing contact lens for in vivo imaging of mouse retina. Biotechniques. 65 (2), 101-104 (2018).
- Palczewska, G., Kern, T. S., Palczewski, K., Weber, B. H. F., Langmann, T. Noninvasive two-photon microscopy imaging of mouse retina and retinal pigment epithelium. Retinal Degeneration. Methods in Molecular Biology. 1834, 333-343 (2019).
- Wahl, D. J., Jian, Y., Bonora, S., Zawadzki, R. J., Sarunic, M. V. Wavefront sensorless adaptive optics fluorescence biomicroscope for in vivo retinal imaging in mice. Biomedical Optics Express. 7 (1), 1-12 (2016).
- Park, S. W., Kim, J. H., Park, W. J., Kim, J. H. Limbal approach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium. Journal of Visualized Experiments. (102), e53030 (2015).
- Biss, D. P., et al. In vivo fluorescent imaging of the mouse retina using adaptive optics. Optics Letters. 32 (6), 659-661 (2007).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A mouse model for laser-induced choroidal neovascularization. Journal of Visualized Experiments. (106), e53502 (2015).
- Palczewska, G., et al. Human infrared vision is triggered by two-photon chromophore isomerization. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5445-5454 (2014).
- Euler, T., et al. Eyecup scope--optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Archive-European Journal of Physiology. 457 (6), 1393-1414 (2009).
- Zhang, Y., et al. Elevating Growth Factor Responsiveness and Axon Regeneration by Modulating Presynaptic Inputs. Neuron. 103 (1), 39-51 (2019).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Akimoto, M., et al. Transgenic mice expressing Cre-recombinase specifically in M- or S-cone photoreceptors. Investigative Ophthalmology & Visual Science. 45 (1), 42-47 (2004).
- Brightman, D. S., Razafsky, D., Potter, C., Hodzic, D., Chen, S. Nrl-Cre transgenic mouse mediates loxP recombination in developing rod photoreceptors. Genesis. 54 (3), 129-135 (2016).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85 (6), 1244-1256 (2015).
- Ecker, J. L., et al. Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron. 67 (1), 49-60 (2010).
- Kim, I. J., Zhang, Y., Yamagata, M., Meister, M., Sanes, J. R. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452 (7186), 478-482 (2008).
- Akrouh, A., Kerschensteiner, D. Morphology and function of three VIP-expressing amacrine cell types in the mouse retina. Journal of Neurophysiology. 114 (4), 2431-2438 (2015).
- Zhu, Y., Xu, J., Hauswirth, W. W., DeVries, S. H. Genetically targeted binary labeling of retinal neurons. Journal of Neuroscience. 34 (23), 7845-7861 (2014).
- Lu, Q., et al. AAV-mediated transduction and targeting of retinal bipolar cells with improved mGluR6 promoters in rodents and primates. Gene Therapy. 23 (8-9), 680-689 (2016).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Research. 48 (3), 353-359 (2008).
- Yao, K., et al. Wnt regulates proliferation and neurogenic potential of Muller glial cells via a Lin28/let-7 miRNA-dependent pathway in adult mammalian retinas. Cell Reports. 17 (1), 165-178 (2016).
- Williams, P. R., et al. A recoverable state of axon injury persists for hours after spinal cord contusion in vivo. Nature Communications. 5, 5683 (2014).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's & Dementia. 10 (2), 135-142 (2014).
- Kerrison, J. B., Flynn, T., Green, W. R. Retinal pathologic changes in multiple sclerosis. Retina. 14 (5), 445-451 (1994).
- Sung, M. S., et al. Inner retinal thinning as a biomarker for cognitive impairment in de novo Parkinson's disease. Scientific Reports. 9 (1), 11832 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır