Method Article
경동공 이광자 마우스 망막의 생체 내 이미징
요약
생체 내 이미징은 건강 및 질병 생물학 연구를위한 강력한 도구입니다. 이 프로토콜은 표준 2 광자 현미경으로 마우스 망막의 경공 영상을 설명합니다. 또한 망막의 여러 세포 코호트를 형광으로 표지하는 다양한 생체 내 이미징 방법을 보여줍니다.
초록
망막은 환경의 빛 신호를 뇌로 전파되는 전기 신호로 변환합니다. 망막의 질병은 널리 퍼져 있으며 시각 장애와 실명을 유발합니다. 그러한 질병이 어떻게 진행되는지 이해하는 것은 새로운 치료법을 공식화하는 데 중요합니다. 질병의 동물 모델에서 생체 내 현미경은 신경 퇴행을 이해하는 강력한 도구이며 알츠하이머 병에서 뇌졸중에 이르는 상태의 치료를 향한 중요한 진전을 가져 왔습니다. 망막이 광학 접근법에 의해 본질적으로 접근 할 수있는 유일한 중추 신경계 구조라는 점을 감안할 때, 그것은 자연스럽게 생체 내 영상에 적합합니다. 그러나 수정체와 각막의 기본 광학은 효과적인 이미징 접근에 몇 가지 문제를 제시합니다.
이 프로토콜은 급성 및 만성 기간 이미징 실험 모두에 적용할 수 있는 세포 분해능에서 마우스 망막의 세포 코호트 및 구조의 생체 내 2광자 이미징 방법을 설명합니다. 망막 신경절 세포(RGC), 무축삭 세포, 소교세포 및 아데노 관련 바이러스(AAV) 벡터, 형질전환 마우스 및 무기 염료를 포함한 일련의 라벨링 기술을 사용한 혈관 이미징의 예를 제시합니다. 중요하게는, 이들 기술은 망막의 모든 세포 유형으로 확장되고, 관심있는 다른 세포 집단에 접근하기 위한 제안된 방법이 설명된다. 또한 디스플레이 및 정량화를 위한 수동 이미지 후처리를 위한 예제 전략도 자세히 설명되어 있습니다. 이러한 기술은 건강 및 질병의 망막 기능 연구에 직접 적용 할 수 있습니다.
서문
중추 신경계의 생체 내 시각화에는 일반적으로 두개골 얇아짐 및 유리창 또는 광학 릴레이 렌즈 설치와 같은 침습적 절차가 필요합니다. 망막은 기본적으로 환경으로부터 빛을 받기 때문에 침습적 준비 없이 직접 관찰할 수 있는 신경계의 유일한 구조입니다. 망막에 대한 광학 접근의 용이성은 중추 신경계를 연구하기위한 매력적인 모델 시스템입니다.
생쥐의 망막에 대한 라이브 형광 영상은 녹내장 1,2, 시신경 손상 1,3,4 및 뇌졸중5의 모델에서 RGC 사망뿐만 아니라 퇴행성 조건에서 소교 세포 활성화 6,7,8 및 혈관 구조 9의 변화를 추적하는 데 사용되었습니다. 내재적 신호는 또한 광수용체(10,11,12) 및 망막 색소 상피 세포(13)를 시각화하는데 사용될 수 있다. 망막의 생체 내 영상에 대한 많은 접근법은 안과 목적을 위해 특별히 설계된 고도로 전문화된 장치6 또는 각막 및 수정체 8,9,11,12,13,14의 기본 수차를 교정하기 위해 고도로 수정된 광학 시스템을 사용합니다.
본 프로토콜은 마우스 눈의 전방 광학을 부분적으로 보정하는 기본 방법을 활용하여 세포 분해능에서 망막 내의 형광 신호의 생체내 이미징에 대한 접근 방식을 보여줍니다. 이 전략은 뇌의 생체 내 이미징에 일반적으로 사용되는 다광자 현미경 설정에 대한 아주 작은 적응이 필요합니다. 이 접근 방식은 설정하기 쉽고 마우스는 스트레스가 거의 없기 때문에 급성 및 만성 기간 동안 타임 랩스 실험을 수행하는 데 도움이됩니다. 또한 RGC, 무축삭 세포, 미세아교세포 및 혈관계를 포함한 개별 망막 구성 요소를 표지하는 유전 및 유기 염료 기반 절차는 이 이미징 기술과 호환되며 망막 기능에 중요한 세포 유형 및 구조의 생체 내 관찰을 가능하게 합니다. 이러한 도구는 대부분의 다른 신경 세포 유형과 망막의 신경교 및 혈관 구성 요소를 표시하는 데 적용할 수 있습니다.
프로토콜
참고: 다음 절차는 세인트루이스에 있는 워싱턴 대학교의 기관 동물 관리 및 사용 위원회의 지침에 따라 수행되었습니다. 이 연구에 사용된 시약, 장비 및 동물에 대한 자세한 내용은 재료 표를 참조하십시오.
1. 아데노 관련 바이러스 주사
참고: 망막에서 특정 세포의 표지는 제한된 발현 패턴을 가진 Cre 형질전환 마우스 라인에서 수행할 수 있습니다. 이 섹션에서는 형광 단백질의 Cre 의존성 발현을 암호화하여 특정 망막 세포를 표지하는 AAV 벡터의 유리체내 전달에 대해 설명합니다. 4 주령부터 마우스 (수컷과 암컷)를 주사하십시오.
- 마이크로 피펫 바늘 준비
- 마이크로 피펫 풀러를 사용하여 붕규산 유리 모세관 바늘을 만듭니다. 마이크로 피펫 풀러에 유리 모세관을로드하고 램프 테스트를 수행하여 결과 값을 기록합니다. 램프 테스트에 사용된 유리 모세관은 폐기합니다.
- 다음 설정으로 마이크로피펫을 당깁니다: 열: 램프 테스트 값 빼기 10; 당기기: 55; 속도: 65; 시간: 120; 기압: 500; 당기기 시작 시 공기 시간: 20.
노트 풀러마다 설정을 조정해야 할 수 있습니다. - 해부 현미경에서 면도날을 사용하여 유리 팁이 테이퍼 섹션 끝에서 ~10mm 정도 힘을 받아 약간 편향되는 위치에서 당겨진 마이크로피펫의 끝을 자릅니다. 절단이 경 사진 팁을 생성하도록 날카로운 각도로 자릅니다. 무딘 팁은 버립니다.
- 주사기 준비
- 절단된 유리 마이크로피펫을 에틸 비닐 아세테이트(EVA) 플라스틱 튜브(내경 0.05", 외경 0.09")의 2cm 세그먼트에 맞춥니다. 이 튜브 세그먼트의 다른 쪽 끝을 20cm 길이의 EVA 튜브(내경 0.02", 외경 0.06")에 연결합니다.
- 22G 시멘트 바늘로 튜브를 50μL 유리 주사기에 연결합니다. 유리 주사기에서 플런저를 제거하고 25G 주사기 바늘을 사용하여 주사기와 연결된 튜브에 미네랄 오일을 다시 채 웁니다. 마이크로피펫 끝에 4mm의 공기 공간을 남겨 둡니다.
- AAV의 유리체 내 주사
- 생존 수술을 위한 제도적 프로토콜에 따라 멸균 수술용 장갑, 깨끗한 실험실 코트, 마스크, 멸균 필드 및 오토클레이브 기구를 사용하여 표준 무균 기술로 유리체내 주사를 수행합니다.
- -80°C에서 보관으로부터 AAV 벡터의 분취량을 제거하고 얼음 상에서 해동시킨다. 해동 후 2,000× g 에서 10초 동안 원심분리하여 기포를 제거합니다.
- 기관 동물 연구위원회의 마취 및 규제 물질 지침을 따르십시오. 30G 피하 주사 바늘을 사용하여 케타민/자일라진 칵테일(10mg/mL 케타민, 식염수 중 1mg/mL 자일라진, 마우스에 대한 유효 용량: 100mg/kg 케타민, 10mg/kg 자일라진)의 0.1mL/10g 체중 복강내(IP) 주사를 수행합니다. 마우스를 케이지로 되돌리고 마취가 효과를 발휘할 때까지 5분 동안 기다립니다.
- 30G 피하 주사 바늘을 사용하여 0.1mL / 10g 체중 멜 록시 캄 (0.9 % 염화나트륨 중 0.5mg / mL)의 피하 주사를 실시합니다.
- 꼬리와 발가락 꼬집음에 대한 각막 반사 및 금단 반사의 손실을 확인하여 마취 깊이를 테스트합니다. 꼬리와 발가락 철수 반사를 잃은 후에도 각막 반사가 지속되면 각 눈에 0.5 % 프로 파라카인 용액을 떨어 뜨리고 10 초 동안 기다리십시오.
- 실체 현미경 아래에 마우스를 옆으로 눕힙니다. 미니 불독 지혈 클램프를 사용하여 궤도보다 우월하고 열등한 피부를 잡고 내측 캔서스에 클램프를 고정하여 지구를 궤도 밖으로 부분적으로 옮깁니다.
- 유리 주사기에 연결된 절단 된 마이크로 피펫으로 윤부 뒤쪽 ~ 1-2mm의 측면 공막을 뚫습니다. 윤부 바로 뒤쪽에서 원주방향으로 이어지는 혈관계를 방해하지 마십시오. 공막에 수직 인 각도로 구멍을 뚫고 렌즈 손상을 피하기 위해 공막을 관통 한 직후 마이크로 피펫을 약간 수축시킵니다.
- 유리 주사기의 플런저를 사용하여 주사 용 유체 부피에 대략 해당하는 1-2 μL의 유리체 체액을 회수합니다. 눈에서 마이크로 피펫을 빼내고 제거 된 유리체 체액을 배출하십시오.
- 마이크로피펫 끝을 1-2μL의 AAV로 채우고 혼합을 피하기 위해 바이러스 벡터와 미네랄 오일 사이에 ~4mm의 공기 공간을 남겨 둡니다. 첫 번째 천공으로 생성 된 공막의 구멍에 마이크로 피펫을 삽입하고 유리 주사기의 플런저를 천천히 눌러 20-30 초 동안 바이러스 벡터를 주입합니다. 마이크로피펫 끝에서 바이러스 벡터의 유체 수준을 시각화하고 공기가 눈에 들어가기 전에 주입을 중지하도록 주의하십시오.
- 마이크로피펫을 같은 위치에 10초 동안 유지한 다음 마이크로피펫을 집어넣습니다. 불독 지혈 클램프를 제거하십시오.
- 옥시테트라사이클린/폴리믹신 B 항생제 안과 연고를 주사한 눈에 바르십시오. 마우스를 가열 패드에 놓고 마취 후 회복을 모니터링합니다 (3.4.3 참조).
- 마우스를 하우징으로 되돌리고 기관 지침에 따라 수술 후 관리를 수행합니다. 이미징 전에 형광단의 바이러스 매개 발현을 위해 2-3 주를 허용하십시오.
2. 현미경 설정
참고: 현미경 광 경로의 개략도는 그림 1에 나와 있습니다.
- "항상 켜짐" 장비: 이러한 기기는 조정 또는 유지 보수를 거치지 않는 한 항상 켜져 있어야 합니다. 레이저 냉각 시스템의 고온을 20.0°C로 설정합니다. 초고속 Ti:Sapphire 레이저의 주전원을 켜고 시스템 시작 프로세스가 완료될 때까지 시간을 두고 "레이저 활성화" 키를 "켜기" 위치로 돌립니다.
- 방출광 경로 구성
- 관심 형광단에 대한 적절한 다이크로익 및 대역 통과 필터 세트를 사용하여 샘플 파장에 대한 형광 방출 수집 경로를 구성합니다.
참고: 이 원고에서 Twitch2b 이미징은 505 롱 패스 다이크로익과 480/40 및 535/30 대역 통과 필터 쌍으로 구성된 필터 큐브를 사용했습니다. GFP는 525/50 및 605/70 대역 통과 필터가 있는 560 롱 패스 필터로 구성된 레드/그린 필터 큐브를 사용하여 이미징되었습니다. 에반스 블루는 560 단거리 통과 필터를 사용하여 이미징되었습니다. 방출 필터를 변경하면 방출광 경로가 광전자 증배관(PMT)을 손상시킬 수 있는 미광에 노출됩니다. PMT가 꺼져 있는지 확인하고 빛 노출이 PMT 기능에 부정적인 영향을 미칠 수 있으므로 수집 조명 경로를 수정하기 전에 실내 조명을 끄십시오.
- 관심 형광단에 대한 적절한 다이크로익 및 대역 통과 필터 세트를 사용하여 샘플 파장에 대한 형광 방출 수집 경로를 구성합니다.
- 이미지 수집 시작
알림: 2 광자 레이저에 직접 노출되면 위험하며, 특히 원적외선은 깜박임 반응을 유도하지 않으므로 눈에 위험합니다. 레이저가 광 경로를 따라 닫히도록 적절한 주의를 기울여야 하며, 사용자가 아이 피스를 통한 노출 또는 현미경 대물렌즈의 방출로부터 사용자를 보호하기 위해 안전 장치가 마련되어 있어야 합니다. 사용자는 레이저가 대물렌즈에서 방출되는 조건을 이해하고 이러한 위험에 노출되지 않도록 적절한 예방 조치를 취해야 합니다.- 데이터 수집 장치, 컴퓨터, Pockels 셀, 현미경 및 스테이지 컨트롤러, 기계식 셔터 컨트롤러 및 PMT 주전원을 켭니다. 이미지 획득 준비가 되고 미광으로부터 차폐될 때까지 PMT를 "비활성화" 상태로 유지합니다. 컴퓨터 및 이미지 수집 소프트웨어에서 레이저 제어 인터페이스를 엽니다. 컴퓨터 인터페이스에서 레이저를 켜고 모드 잠금을 확인하십시오.
- 원하는 레이저 파장을 설정합니다. 레이저 셔터를 열어 레이저 광이 Pockels Cell에 들어가는지 확인하고 레이저 출력이 안정화될 때까지 30분 동안 기다립니다.
- 대물렌즈에서 레이저 출력 측정 및 최대 레이저 백분율 설정
알림: 레이저 방사선은 전력 측정 중에 대물 렌즈에서 방출됩니다. 이미징 셔터를 활성화하기 전에 현미경 인클로저 커튼을 닫고 적절한 보안경을 착용하십시오. 초기 시스템 설치 시 레이저 출력을 측정하여 관심 있는 각 파장에 대한 출력 곡선을 설정하고 그 후 매월 여기 전력의 안정성을 확인합니다.- 광 파워 미터를 켜고 레이저 파장에 해당하는 측정 파장을 선택합니다. 광학 파워 미터 검출기를 현미경 스테이지에 놓고 X-Y 차원의 대물 렌즈 바로 아래로 움직입니다. Z 차원 전동 초점 드라이브를 사용하여 파워 미터 감지기가 대물 렌즈 아래 ~ 1mm가 될 때까지 대물 렌즈를 내립니다.
- 에피형광 조명에서 레이저로 현미경 여기 광 경로로 전환합니다. 기계식 셔터를 활성화합니다.
- 이미지 수집 소프트웨어에서 포인트 스캔을 시작하여 이미징 셔터를 열고 레이저를 광 파워 미터로 보냅니다. 스캐닝 소프트웨어에서 레이저 출력을 100%로 설정합니다. 가장 높은 레이저 출력 측정이 달성될 때까지 파워 미터 감지기의 XY 및 Z 위치를 최적화합니다.
- Pockels 셀에서 대물렌즈의 레이저 출력을 0.1%에서 100%까지 측정하고 10% 간격으로 측정합니다. 대물렌즈에서 45mW의 전력에 해당하는 Pockels 셀 백분율을 기록합니다. 이 백분율을 이미지 수집 소프트웨어의 최대 레이저 출력으로 설정합니다.
참고: 표적 조직에 눈에 띄는 손상이 없는 생체 내 마우스 망막 영상에서 관찰된 최고 전력은 영상 촬영 2주 후 조직학적 염색으로 분석한 바와 같이 45mW였습니다. 명백한 망막 손상은 대물렌즈에서 55mW로 이미징한 후 분명합니다. - 이미징 셔터를 비활성화하고 여기 광 경로를 에피형광으로 되돌립니다.
3. 이미지 획득을 위한 마우스 준비
- 이미징을 위한 마취 마우스
알림: 이소플루란에 대한 노출을 완화하기 위해 적절한 폐가스 청소를 확인하십시오. 마취 유도 챔버의 배기 포트가 수동 소기 가스 필터 캐니스터에 연결되어 있고 마우스 마취 노즈피스의 출구가 가스 배출 장치에서 제공하는 진공이 있는 능동 청소 가스 필터 캐니스터에 연결되어 있는지 확인하십시오. 교체를 위해 필터 캐니스터 무게를 모니터링하기 위한 제조업체의 지침을 따르십시오.- 1.3.3단계에서 위에서 설명한 대로 케타민/자일라진 칵테일을 사용하여 마우스를 마취합니다. 또는 마취 유지를 위해 이소플루란을 사용하는 경우 이소플루란 흡입을 통해 마취를 유도합니다(영상 세션 > 30분). 0.5L/min의 유량으로 실내 공기와 혼합된 5% 이소플루란으로 유도 챔버를 채우도록 작은 동물 마취 장치를 설정합니다. 마우스를 유도 챔버에 넣고 마우스가 마취될 때까지 15초 동안 기다립니다.
- 이소플루란 기화기를 0%로 전환하고 마취 흐름을 노즈피스로 향하게 합니다. 유도 챔버의 5초 "O2 플러시"를 수행한다. 유도 챔버에서 마우스를 꺼내 헤드 홀더 (섹션 3.3 참조)에 고정하고 노즈 피스를 부착합니다.
- 마취 유지를 위해 1% 이소플루란과 실내 공기의 혼합물을 0.5L/min의 유속으로 사용하십시오. 마취 전반에 걸쳐 5분 간격으로 호흡수를 모니터링하고 이소플루란 비율을 조정하여 ~60회 호흡/분의 호흡률을 유지합니다.
알림: 이러한 설정(% 이소플루란, 유속)은 케타민/자일라진 칵테일에 의해 유도된 마취 유지에도 사용할 수 있습니다.
- 동공 확장
- 물에 1 % w / v 아트로핀 및 2.5 % w / v 페닐에 프린 하이드로 클로라이드의 용액을 준비하십시오. 팽창기 용액을 빛으로부터 보호되는 실온에서 보관하십시오.
- 일회용 피펫 점안기를 사용하여 이미징 할 각 눈에 확장 용액을 한 방울 떨어 뜨립니다. 방 조명을 끄고 동공이 확장 될 때까지 5 분 정도 기다리십시오. 동공이 확장되면 보푸라기가없는 조직으로 확장 용액을 닦아냅니다.
알림: 확장기 용액이 콧구멍에 들어 가지 않도록하십시오. - 이미징 될 각 눈에 윤활제 아이 젤을 많이 떨어 뜨립니다. 두 눈을 모두 촬영해야 하는 경우 탈수를 방지하기 위해 비이미징 눈의 아이 젤 위에 작은 플라스틱 접착 필름 조각을 바르십시오. 한쪽 눈만 촬영하는 경우 이미징되지 않는 눈에 윤활제 눈 연고를 바르십시오.
- 이미징을 위한 포지셔닝 마우스
- 마우스를 이미징 헤드 홀더에 고정하려면 이어피스 막대가 수평 아래 60° 이상의 각도로 기울어질 때까지 헤드 홀더의 주 암을 돌립니다. 아래쪽 외이도 핀을 안쪽으로 확장 된 위치에 고정하고 위쪽 외이도 핀을 빼낸 위치에 고정합니다.
- 마우스가 바이트 바를 향하도록 한 상태에서 한쪽 귀를 확장된 하단 핀에 장착하고 핀을 외이도에 삽입합니다. 상부 외이도 핀을 고정하는 나사를 풀고 핀을 다른 외이도로 확장합니다. 나사를 조여 헤드를 고정합니다.
- 바이트 바를 마우스 머리 쪽으로 밉니다. 마우스의 머리를 부드럽게 들어 올린 다음 마우스의 상악 절치를 바이트 바의 구멍으로 내립니다. 마우스 헤드를 고정하기 위해 부드러운 힘으로 바이트 바를 집어넣고 나사를 조여 바이트 바 위치를 고정합니다.
- 이소플루란을 사용하는 경우 마우스의 앞니를 고정하기 전에 노즈피스를 슬롯을 통해 바이트 바에 밀어 넣습니다. 3.3.3단계와 같이 바이트 바 위치를 고정하고 조입니다. 윗면에 있는 두 개의 나사를 사용하여 노즈피스가 마우스의 코에 꼭 맞을 때까지 조이지만 주둥이가 조이지 않습니다.
- 헤드 홀더의 마우스를 대물렌즈 아래의 현미경 스테이지로 옮깁니다. 눈 동공이 광 경로와 나란히 똑바로 위로 향할 때까지 헤드 홀더의 주 팔을 돌립니다(그림 2).
- 컴팩트 필터 홀더에 #1.5 커버슬립을 놓고 홀더를 현미경 스테이지에 부착합니다. 커버슬립이 각막 바로 위에 수평으로 놓이도록 윤활제 아이 젤과 접촉하여 커버슬립을 눈 쪽으로 내립니다(그림 2). 커버 슬립이 각막에 닿지 않도록하십시오.
참고: 현미경에서 여기 광 경로가 에피형광으로 설정되어 있고 방출광 경로가 접안렌즈로 설정되어 있는지 확인하십시오. 에피형광 조명기를 가장 낮은 전력으로 켜고 조명기 셔터를 엽니다. 이미징되는 형광단에 해당하는 에피형광 조명기 파장과 형광 필터를 선택합니다. - 광시야 여기광이 각막을 완전히 덮을 때까지 스테이지 컨트롤과 전동 초점 드라이브를 사용하여 X-Y 차원에서 스테이지를 조종하고 Z 위치에서 대물렌즈를 조작합니다. 접안 렌즈를 통해 망막의 형광 세포나 구조에 초점이 맞춰질 때까지 스테이지의 Z 위치를 계속 조정합니다. 샘플 신호가 접안렌즈를 통해 개별 세포 또는 관심 구조를 해결하기에 충분하지 않은 경우 에피형광 조명기 전력을 높입니다.
참고: 망막을 찾는 데 문제가 있는 경우 홍채는 고정한 다음 망막 쪽으로 초점을 맞추는 고대비 랜드마크입니다. 이 단계를 통해 동공이 최대로 확장되었는지 확인할 수도 있습니다. - 마우스 렌즈로 축의 이미징 영역을 얻습니다. 초점면을 조정할 때 초점이 맞지 않는 빛의 확장 또는 수축만 발생할 때까지 헤드 홀더의 다양한 자유도를 사용하여 마우스의 각도를 조정합니다. 에피형광 조명기를 끄고 조명기 셔터를 닫습니다.
참고: Z 방향 초점면을 스크롤하는 동안 초점이 맞지 않는 빛의 상당한 XY 시차는 망막이 이미징 광 경로와 관련하여 축에 있지 않음을 나타냅니다.
4. 이광자 이미지 획득
- 이미지 설정 및 획득 파라미터
알림: 실내 조명을 끄고 방의 미광원을 덮으십시오. 에피형광 조명기가 꺼져 있고 조명기 셔터가 닫혀 있는지 확인합니다.- 여기 광 경로를 레이저로 전환하고 방출광 경로를 PMT로 전환합니다.
- 이미지 수집 소프트웨어에서 프레임 크기를 512 x 512로 설정하고 프레임 평균을 3으로 설정합니다. 슬라이스당 스텝을 -8μm로 설정합니다. z- 스테핑을 스택의 상단에서 시작하여 아래쪽으로 진행하도록 지정하여 광 수용체의 2 광자 레이저 활성화를 최소화합니다.
참고: 스텝 크기를 줄여 Z 해상도를 높이면서 이미징 시간을 늘릴 수 있지만 이 이미징 구성에서 세포 소마타를 해결하려면 8μm 스텝이면 충분합니다. - PMT를 켜고 활성화합니다. PMT 전압을 680V로 조정합니다. 여자 셔터를 활성화합니다.
알림: 전원이 공급되는 PMT는 가벼운 손상에 취약합니다. 에피형광 조명기가 꺼져 있고, 현미경 인클로저 커튼이 그려져 있고, 실내 조명이 꺼져 있는지 확인합니다. - 1% 레이저 출력으로 시작하여 표적 조직의 라이브 이미지 미리보기를 시작합니다. 디스플레이 밝기를 자동으로 조정하여 관심 있는 셀 또는 구조를 시각화합니다. 스캔 단계를 자동으로 조정합니다. 표적 조직이 어둡거나 불분명한 경우 45mW에 해당하는 2.4.4단계에서 설정한 한계를 초과하지 않고 구조가 보일 때까지 레이저 출력 백분율을 높입니다.
참고: 16비트 이미지의 경우 관심 있는 구조를 포함하는 Z 평면에서 밝기를 자동으로 조정할 때 ~1000의 표시 값은 샘플의 밝기가 충분함을 나타냅니다. - 현미경 스테이지를 X-Y 방향으로 움직여 원하는 이미징 영역의 중심을 잡은 다음 관심 구조에 초점이 맞춰진 Z 평면으로 이동합니다.
참고: 시신경두에 인접한 영상은 만성 영상 실험을 위한 명확한 랜드마크 역할을 할 수 있습니다. - 만성적인 타임랩스 실험인 경우 획득 컴퓨터에서 이전 이미지를 열고 동일한 관심 영역을 찾기 위한 참조로 사용합니다. 이미징 각도가 이전 이미지의 각도와 유사한지 확인하여 최소 시차로 동일한 세포 세트를 획득합니다.
참고: 이전 시점과 동일한 셀을 이미지화하려면 마우스 헤드 위치를 추가로 조정해야 할 수 있습니다(그림 3). - 관심 있는 최상위 및 최하위 Z 평면으로 이동하여 이미징 스택의 Z 한계를 설정하고 이미지를 획득합니다. 이미지 획득이 완료되면 PMT와 발광 셔터를 비활성화합니다. 발광광 경로를 다시 접안렌즈로 전환하고 여기 광 경로를 에피형광 조명으로 전환합니다. 현미경 스테이지에서 마우스를 제거합니다.
- 시스템 소프트웨어 및 하드웨어 종료
- 이미지 수집 소프트웨어를 종료합니다. 컴퓨터 인터페이스에서 레이저를 끕니다. 하드웨어를 역순으로 종료합니다("Always-On" 장비 제외).
- 마우스 복구
- 현미경 스테이지에서 헤드 홀더와 마우스를 제거합니다. 해당되는 경우 이소플루란 기화기를 0%로 설정합니다. 헤드 홀더에서 마우스를 제거합니다.
- 보푸라기가 없는 티슈로 윤활제 아이젤을 부드럽게 닦아내고 흰색 바셀린-미네랄 오일 윤활유 눈 연고를 양쪽 눈에 바릅니다. 마우스를 따뜻한 물 순환 가열 패드 (37 ° C로 설정)에 놓고 마우스에 계속 참석하고 마우스가 깨어나 보행 능력을 회복 할 때까지 호흡 속도를 모니터링합니다. 마우스를 하우징으로 되돌립니다.
- 해당되는 경우 유리체 내 주사 후 24 시간에 동물 활동 및 이환율을 평가하십시오. 연구가 완료되면 과량의 트리 브로 모 에탄올 (250mg / kg)로 마우스를 안락사시키고 망막 조직을 보존하기 위해 4 % 파라 포름 알데히드로 심근 관류를 수행합니다.
5. 이미지 처리 및 분석
- 다중 채널 데이터 디인터리브 및 병합
- 특정 이미지 획득 소프트웨어 프로그램은 멀티채널 이미지를 인터리브 형식으로 저장하므로, 피지(https://imagej.net/Fiji)와 같은 소프트웨어를 사용하여 .tif 이미지 파일을 열어 채널을 분리합니다.
- 피지의 이미지 메뉴에서 스택 | 도구 | 디인터리브. 이미지를 구성하는 채널 수를 입력하고 OK를 클릭합니다.
- 분리된 채널을 단일 파일로 병합하려면 이미지 | 색상 | 채널 병합. 디인터리브된 이미지 채널을 별도의 색상 채널에 배치하고 [확인] 을 클릭하여 다중 채널 합성 이미지를 만듭니다. 이 합성 이미지를 새 .tif 파일로 저장합니다.
- 다중 채널 이미지에서 형광 강도의 정량화
참고: 지정된 관심 영역(ROI) 내의 형광 강도는 피지를 사용하여 단일 이미지 평면에서 정량화할 수 있습니다. 비율계량 판독값의 정량화는 동일한 ROI 내에서 합성 이미지의 서로 다른 채널에서 형광 강도를 측정하여 달성할 수 있습니다. 만성 영상 실험의 경우 여기 또는 방출 비율 계량 출력을 기반으로 하는 바이오센서를 사용하는 것이 가장 좋습니다.- 피지에서는 분석 | 도구 | ROI 관리자. 피지에서 합성 이미지를 엽니다. 관심 있는 구조에 해당하는 z-슬라이스로 스크롤하고 선택 도구(예: 사각형 선택, 타원형 선택, 다각형 선택 )를 사용하여 ROI의 윤곽을 그립니다.
- 키보드에서 T를 눌러 각 선택 항목을 ROI 관리자에 추가합니다. ROI 선택이 완료되면 ROI 관리자에서 측정을 클릭하여 면적 및 평균 강도 값과 같은 ROI의 다양한 데이터를 기록합니다.
- 결과 창에 기록된 현재 선택한 채널의 측정값을 스프레드시트에 복사합니다. 합성 이미지 창에서 다음 채널로 전환하고 측정을 클릭하여 동일한 ROI 세트 내에서 해당 채널에 대한 측정값을 얻습니다. ROI 관리자 내에서 더보기 | 저장하고 ROI를 .zip 파일로 저장합니다.
- 디스플레이를 위한 최대 강도 투영
- 이미지 데이터의 표시를 만들려면 피지에서 Z-프로젝트 함수를 사용하십시오. 이미지 메뉴에서 스택 | Z 프로젝트. 관심 영역이 있는 프레임만 선택하여 배경을 줄입니다.
- PMT 샷 노이즈를 제거하려면 중앙값 필터 기능을 사용하십시오. 프로세스 메뉴에서 프로세스 | 필터 | 중앙값. 공간 세부 정보를 유지하려면 값 1.0을 선택합니다.
- 단일 셀에 초점을 맞춘 최대 강도 투영을 만들려면 관심 있는 셀에 해당하는 이미지 프레임만 선택하여 이 프로세스를 반복합니다.
참고: 이렇게 하면 셀룰러 아버를 해결하는 능력이 크게 향상될 수 있습니다(그림 4). 형광 강도 측정은 최대 강도 투영이 아닌 단일 이미지 평면에서 수행해야 합니다.
결과
다양한 형질전환, 바이러스 벡터 또는 무기 염료 표지 접근법을 사용하여 기본 다광자 현미경의 간단한 적응을 사용하여 생체 내에서 여러 망막 세포 유형 및 구조를 특이적으로 시각화할 수 있습니다. RGCs 및 무축삭 세포를 시각화하기 위해, VGlut2-Cre 및 VGat-Cre 형질전환 마우스는 각각 시안 및 황색 형광 단백질(각각 CFP 및 YFP) 및 트로포닌15의 Ca2+ 결합 도메인을 포함하는 세포질 형광 공명 에너지 전달(FRET) 기반Ca 2+ 센서인 Twitch2b를 암호화하는 Cre 의존성 AAV 발현 구조체의 유리체내 주사를 받았습니다. . VGlut2-Cre 마우스에서 RGC 체세포는 명확하게 식별 할 수 있으며 축삭의 근막이 종종 분명합니다 (그림 3).
축삭의 궤적과 혈관계의 부정적인 이미지는 만성 영상 실험에서 랜드 마크로 유용한 VGlut2-Cre 마우스에서 시신경 두를 식별하는 것을 매우 간단하게 만듭니다 (그림 3). 무축삭 세포는 RGC보다 덜 밝게 보이지만, 아마도 더 작은 소마 크기 및/또는 덜 효율적인 AAV 형질도입으로 인해 소마는 여전히 내부 핵층에서 쉽게 나타납니다. RGC와 달리 무축삭 세포 신경돌기는 내부 플렉시 폼 층에서 더 자주 관찰됩니다 (그림 4). 망막 미세아교세포는 Cx3cr1-GFP 트랜스제닉 마우스 라인6에서 이미지화될 수 있습니다. 미세아교세포는 혈관구조와 연결되어 타임랩스 이미징 실험에서 동일한 영역을 찾을 수 있습니다.
이 접근법은 미세 미세아교세포 과정의 역학, 단일 평면 이미지에서 더 나은 공간 해상도를 갖는 절차 또는 개별 세포에 초점을 맞춘 최대 강도 투영이 준비되는 경우 (그림 5)를 추적하는 데 사용할 수 있습니다. 마우스 렌즈를 통한 광학 수차로 인한 축 해상도가 낮기 때문에 z 차원의 미세한 세부 사항을 검사할 수 없습니다. 이 이미징 기술이 세포 미세 구조의 퇴행성 변화를 관찰 할 수 있는지 여부를 결정하기 위해, 1 μL의 50 mM N- 메틸 -D- 아스 파르 테이트 (NMDA)를 유리체에 주입하여 흥분 독성 병변을 유도했다. 주사 후 1일, 미세아교세포는 이전 보고16에 따라 짧은 과정 또는 아메보이드 형태를 나타냈다(그림 5). Cx3cr1-GFP 형질전환 라인의 세포는 형광 단백질 발현 카세트의 AAV 매개 전달 실험에서보다 세포 코호트에서 더 균일하고 완전한 형광 단백질 발현을 나타냈다는 점에 유의해야 합니다. 실험을 설계할 때 다양하고 희소한 라벨링과 완전하고 균일한 라벨링의 이점을 고려해야 합니다.
앞서 설명한바와 같이 망막 혈관구조를 표지하기 위해 8, 마우스를 영상화 30-60분 전에 200μL의 Evans blue 염료(멸균 식염수 중 20mg/mL)를 복강내 주사했습니다. 이로 인해 시신경 머리에서 나오는 혈관이 강력하게 표시되었습니다 (그림 6). 놀랍게도, 단일 주사의 형광 신호는 적어도 7 일 동안 지속되었습니다. 생체내 이미지의 치수를 추정하기 위해 두 가지 별개의 방법이 사용되었습니다. 먼저, 동일한 망막 영역을 생체 내에서 그리고 고정 후 컨포칼 현미경을 사용하여 평평한 망막 전체 마운트에서 이미지화했습니다(그림 7). 무작위 세포 쌍을 4개의 서로 다른 생체내 샘플에서 선택하고, 세포 쌍 사이의 실제 거리를 컨포칼 스캔에서 측정하고 생체 내 픽셀 거리와 일치시켜 1x 디지털 배율로 0.99μm의 평균 픽셀 크기를 얻었습니다. 생체 내 이미지와 컨포칼 전체 마운트 스캔을 연관시키는 유사한 방법을 사용하면 단일 머리 위치가 약 650mm2 의 망막 패치에 대한 이미징을 허용하는 것으로 나타났습니다.
하나의 비틀림 축을 따라 헤드 홀더를 재배치하면 2.2mm 길이의 망막의 선형 영역에 접근 할 수 있습니다 (도시되지 않음). 또한, 1 또는 2 μm 직경의 형광 마이크로스피어를 마우스의 눈에 주입하고, 그 직경을 10x 디지털 줌을 사용한 생체 내 이미지로부터 라인 스캔의 전폭 절반-최대치로 측정하였다. 이것은 약간 더 큰 픽셀 크기 추정치를 제공했지만 더 많은 분산을 보였습니다(그림 7). 전반적으로 생체 내 실험 완료 후 전체 마운트 샘플의 컨포칼 이미징은 각막 및 렌즈 특성의 분산이 샘플마다 이미지 스케일을 변경할 수 있기 때문에 개별 이미지에 스케일을 할당하는 가장 일관된 방법입니다.
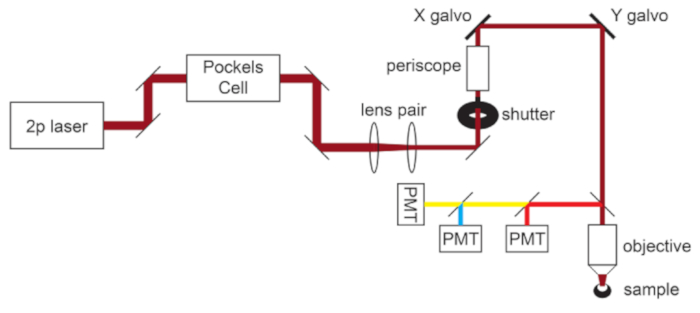
그림 1: 광 경로 회로도. 이 프로토콜에 사용되는 2광자 현미경의 기본 구성 요소는 레이저 출력을 조절하는 Pockels Cell, 현미경 대물렌즈의 후면 조리개와 일치하도록 레이저 빔 직경을 줄이는 렌즈 쌍, 빔 스티어링을 위한 한 쌍의 갈보 스캔 미러로 구성됩니다. 한 쌍의 스티어링 미러가 각 주요 광학 부품 앞에 있습니다. 초점은 대물 렌즈를 구동하는 모터에 의해 제어됩니다. 방출광 경로는 다이크로익 및 배리어 필터를 교체하여 다양한 형광단에 맞게 사용자 정의할 수 있습니다. 단역 통과 다이크로익 미러가 적색광을 첫 번째 PMT로 향하게 하고 적절한 대역 통과 필터와 쌍을 이루는 롱 패스 다이크로익 미러를 사용하여 청록색과 노란색 방출을 분리하는 청록색/노란색/적색 이미징을 위한 일반적인 설정이 표시됩니다. 약어 : PMT = 광전자 증배관. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 생체 내 이미징을 위한 마우스 위치 지정. 동공이있는 마우스를 광 경로가있는 축에 배치하기 위해 마취 된 마우스를 먼저 헤드 홀더에 고정하고 헤드를 회전시키고 각도를 맞추고 윤활제 아이 젤을 큰 방울로 눈에 놓고 마우스를 스테이지에 놓습니다. 커버슬립은 광 경로에 수직인 커버슬립 홀더에 장착되고 눈 쪽으로 내려갑니다. 커버 슬립은 각막이나 마우스 머리 (왼쪽)에 접촉해서는 안되며, 커버 슬립이 편향되면 분명합니다. 그러나 커버 슬립은 물방울 (오른쪽)의 허리를 피할 수있을만큼 충분히 가까워 야하는데, 이는 샘플에 확대 효과가 있기 때문입니다. 젤 이멀젼을 적용하고 커버슬립을 고정한 후 스테이지를 현미경 대물렌즈 바로 아래로 이동해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
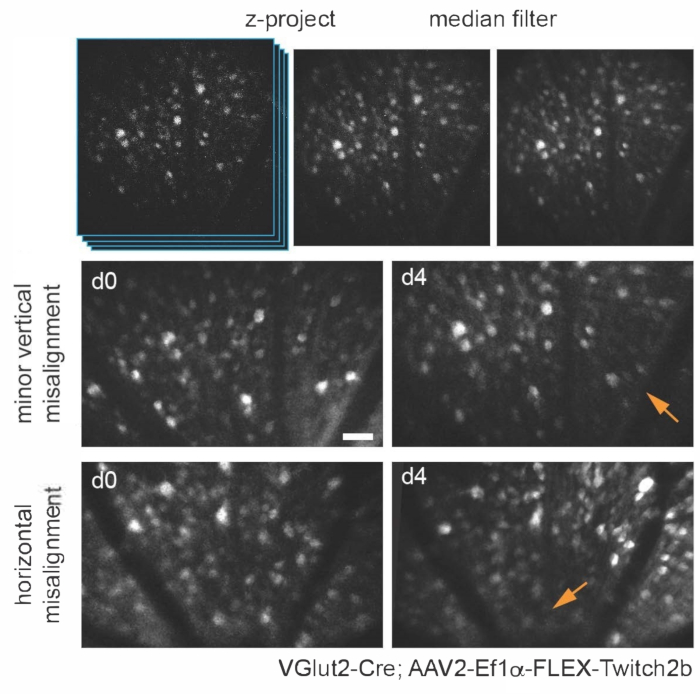
그림 3: 망막 신경절 세포 이미징. 이미지 표시를 위해 관심 셀이 포함된 z-평면을 사용한 최대 강도 투영이 생성되고 결과 이미지가 중앙값 필터링되어 PMT 샷 노이즈가 제거됩니다. VGlut2-Cre 형질전환 마우스에 AAV-EF1α-FLEX-Twitch2b를 주입하여 표지된 망막 신경절 세포의 두 가지 예, 구체적으로 CFP 신호를 나타낸다. 이미지는 4 일 간격으로 세션에서 획득되었으며 혈관 랜드 마크는 시신경 머리 근처의 동일한 영역으로 돌아가는 데 사용되었습니다. 시신경 헤드는 이미지의 아래쪽을 향합니다. 두 샘플 모두 방향에 약간의 차이가 있지만(강도가 감소한 영역은 화살표로 표시됨) 대부분의 세포는 두 시점에 모두 존재합니다. 스케일 바 = 약 50 μm. 약어 : PMT = 광전자 증배관; AAV = 아데노-관련 바이러스; EF1α = 신장 계수 -1 알파; FLEX = 플립 절제; VGlut2 = 소포성 글루타메이트 수송체 2; CFP = 시안 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
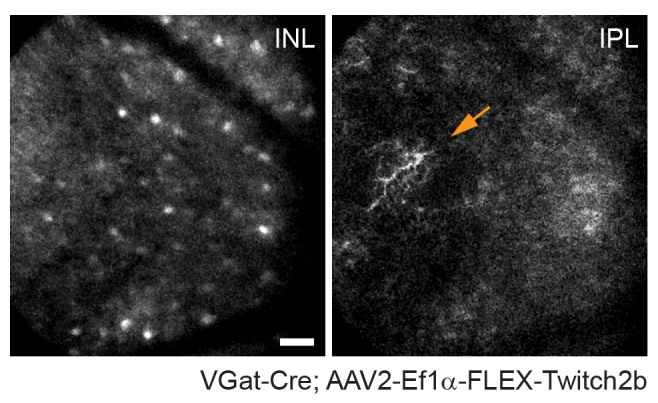
그림 4: 무축삭 세포 이미징. 무축삭 세포는 AAV-EF1α-FLEX-Twitch2b를 VGat-Cre 형질전환 마우스에 주입하여 표지하였다. Twitch 2b의 CFP 신호가 구체적으로 표시됩니다. 내부 핵층의 깊이에 초점을 맞춘 작은 최대 강도 투영은 무축삭 세포 체세포를 나타내고 내부 플렉시 폼에 초점을 맞추면 무축삭 세포 신경 돌기가 해결됩니다 (화살표). 시신경 머리는 이미지의 오른쪽을 향하고 있습니다. 스케일 바 = 약 50 μm. 약어: AAV = 아데노-관련 바이러스; EF1α = 신장 계수 -1 알파; FLEX = 플립 절제; VGat = 수포 감마 아미노부티르산 수송체; CFP = 시안 형광 단백질; INL = 내부 핵층; IPL = 내부 플렉시 폼 층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
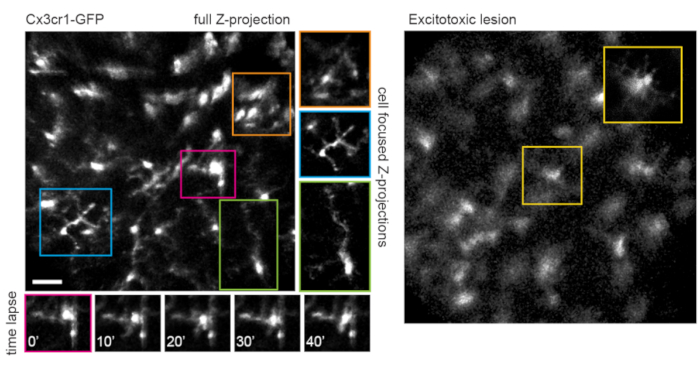
그림 5: 영상 미세아교세포. 마이크로아교세포를 표지하기 위해 형질전환 마우스 라인 Cx3cr1-GFP를 사용하였다. 전체 스캔 볼륨의 최대 강도 투영은 많은 미세아교세포를 보여주며, 일부는 해결할 수 있는 미세한 공정 세부 사항을 보여줍니다. 필드의 왼쪽 하단을 향한 셀은이 영역의 시차로 인해 오른쪽 상단으로 향하는 셀보다 최대 투영에서 왜곡이 적습니다. 관심 셀만 포함하는 최대 강도 투영은 이 시차(중앙, 해당 색상으로 박스형)를 크게 줄입니다. 또한, 이 이미징 전략은 미세 미세아교세포 공정 리모델링(하단 패널)의 역학을 문서화할 수 있습니다. 이에 비해 많은 미세아교세포는 50mM NMDA(오른쪽)의 유리체내 주사에 의한 흥분독성 병변 후 하루 만에 짧은 과정 또는 아메보이드 형태로 볼 수 있습니다. 스케일 바 = 약 50 μm. 약어: GFP = 녹색 형광 단백질; Cx3cr1 = Cx3 케모카인 수용체 1; NMDA = N- 메틸 -D- 아스 파르 테이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
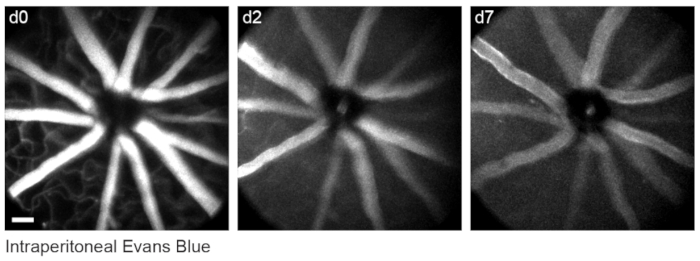
그림 6: 혈관 랜드마크 라벨링. 마우스는 첫 번째 이미징 세션 30-60분 전에 200μL의 20mg/mL Evans blue를 복강내 주사했습니다. 전체 두께 최대 강도 투영은 최소 7일 동안 지속된 망막 혈관계에서 지속적인 형광을 보여줍니다. 스케일 바 = 약 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
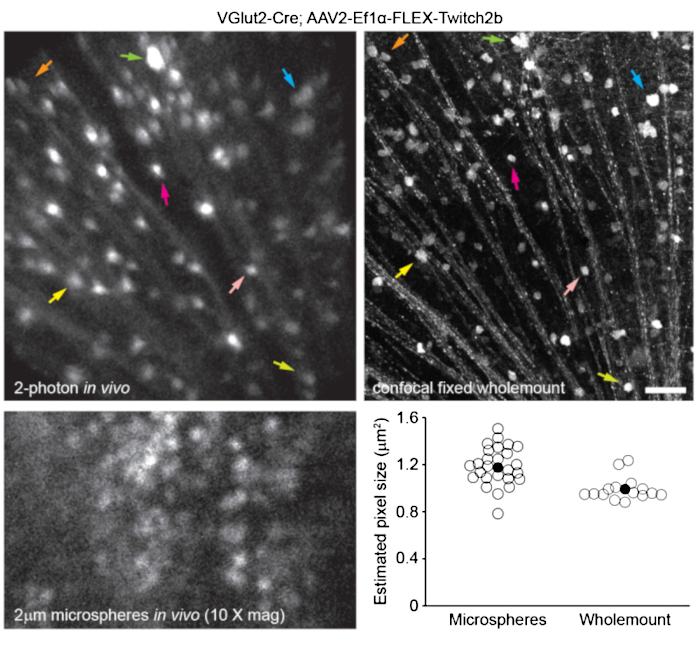
그림 7: 이미지 크기. VGlut2-Cre 형질전환 마우스에 AAV-EF1α-FLEX-Twitch2b를 주입하여 표지된 망막 신경절 세포를 생체 내에서 이미지화한 다음, 망막의 고정 및 전체산 준비 후 컨포칼 레이저 스캐닝 현미경으로 동일한 영역을 이미지화했습니다. 노란색 형광 단백질 채널은 둘 다에 대해 나타내었다. 컬러 화살표 쌍은 두 준비 (상단 패널)에서 동일한 셀을 나타냅니다. 유리체 내에 주입되고 생체 내에서 이미징된 직경 2μm 형광 마이크로스피어의 단일 평면 이미지(왼쪽 하단 패널). 마이크로스피어는 침전되지 않아 일정한 운동을 하여 축 방향 분해능을 측정하는 것이 불가능했습니다. 생체 내 형광 마이크로스피어의 전폭 절반 최대 측정 또는 그룹당 2-4개의 망막에서 가져온 상관 공초점 측정에서 계산된 픽셀 크기(오른쪽 아래). 스케일 바 = 50 μm. 약어: AAV = 아데노-관련 바이러스; EF1α = 신장 계수 -1 알파; FLEX = 플립 절제; VGlut2 = 소포성 글루타메이트 수송체 2. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
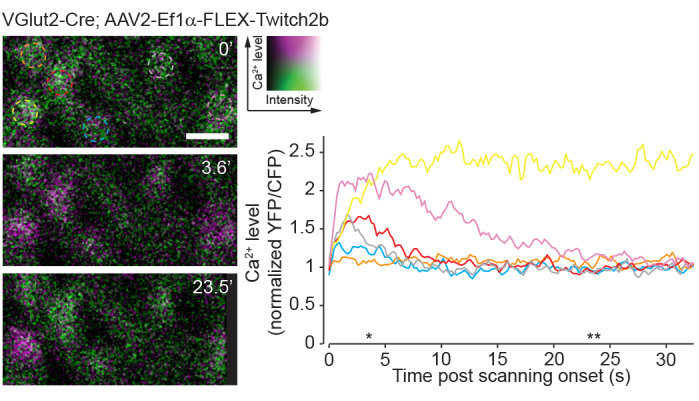
그림 8: 이광자 스캐닝에 의해 유도된 칼슘 활동. 망막 신경절 세포 VGlut2-Cre 형질전환 마우스에 AAV-EF1α-FLEX-Twitch2b를 주입하여 표지된 YFP는 의사 착색 마젠타 및 CFP 녹색이며 단일 평면에서 4.22Hz에서 시계열로 이미지화됩니다. 모든 RGC는 유사한 시작 YFP/CFP 비율을 가졌습니다. 대부분은 FRET 비율(주황색 셀 제외)의 증가로 응답했으며 하나는 시계열(노란색 셀) 전반에 걸쳐 높은 YFP/CFP 비율을 유지했습니다. YFP/CFP 비율은 첫 번째 프레임 평균으로 정규화되었으며 컬러 원은 컬러 트레이스와 일치합니다. 별표는 왼쪽에 대표 이미지가 표시된 시점을 나타냅니다. 스케일 바 = 20 μm. 약어: AAV = 아데노-관련 바이러스; EF1α = 신장 계수 -1 알파; FLEX = 플립 절제; VGlut2 = 소포성 글루타메이트 수송체 2; YFP = 황색 형광 단백질; CFP = 시안 형광 단백질; RGCs = 망막 신경절 세포; FRET = 형광 공명 에너지 전달. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본원에 기재된 이광자 영상화 절차는 마우스 망막의 종방향 생체내 영상화를 가능하게 한다. 동일한 망막 영역의 반복 가능한 이미지는 이소플루란 하에서 최대 6시간 이상의 연속적인 기간 동안 획득될 수 있다. 마우스는 동일한 이미징 영역을 찾기 위해 세포 및 혈관 랜드마크를 사용하여 다른 날에 이미징할 수도 있습니다(그림 3). 이러한 목적을 위해 커버 글라스와 결합 된 투명 겔 침지의 사용은 이전에 망막 하 주사를위한 망막의 시각화, 레이저 유도 망막 손상 모델 및 안저 영상20,21,22를 포함한 다양한 절차에 적용되었습니다.
눈의 해부학은 마우스 각막과 렌즈의 높은 광출력이 교정 없이 동공을 통한 직접 이미징을 방해하기 때문에 생체 내 이미징에 고유한 문제를 제시합니다. 몇몇 다른 생체내 영상화 방법은 마우스 눈의 전방 광학의 교정을 위해 평면-오목한 콘택트 렌즈의 사용에 의존한다 7,17,18,19. 각막의 광학 교정만으로 마우스 렌즈의 높은 광학 파워는 불가피한 양의 시차, 특히 주변 스캔 필드의 구조를 초래하여 다른 Z 평면에서 XY 차원의 스트레칭 및 병진 운동으로 나타납니다. X 및 Y 차원에서 이미지 시차 관련 왜곡을 최소화하려면 이미징 영역에서 망막에 대한 접선면이 현미경 광 경로에 수직이 되도록 마우스 눈의 방향을 지정하는 것이 중요합니다. 여기에 설명된 설정은 이 정렬을 달성하기 위해 눈의 각도를 정밀하게 조작하는 데 도움이 됩니다. 두 축을 따라 회전할 수 있는 조정 가능한 마우스 헤드 홀더를 사용하면 실험자가 시차를 최소화하기 위해 Z 차원을 스크롤할 때 눈의 각도를 쉽게 수동으로 조정할 수 있습니다. 이 기울기는 또한 망막의 더 넓은 영역을 이미징 할 수 있도록 동공의 필드 정지 효과를 우회합니다. 헤드 홀더의 구속은 또한 호흡으로 인한 운동 아티팩트를 크게 줄입니다.
연속 이미징 중에 불투명화로 인해 이미지 품질이 저하되므로 마우스 눈의 선명도를 유지하기 위해 주의해야 합니다. 이미징 중에 윤활제 젤을 자주 다시 바르고 각 이미징 세션 후에 연고를 바르면 눈이 건조해지고 혼탁이 발생하는 것을 방지하는 데 도움이 됩니다. 일부 각막 혼탁은 24-48 시간 후에 자발적으로 해결됩니다. 이 프로토콜에 기술된 바와 같이 투명 젤 및 커버 글라스의 사용은 콘택트 렌즈(7)와 유사한 이미지 품질 및 수차 보정을 제공하는 한편, 커버 글라스를 재정렬할 필요 없이 눈 각도의 보다 용이한 조정을 허용한다. 또한 젤은 눈에 지속적인 수분 공급을 제공하여 최대 몇 시간의 급성 영상 세션을 수행 할 수 있습니다. 마지막으로, 커버 글라스가 각막에 접촉하지 않기 때문에, 반복적인 이미징 세션에 대한 광학적 선명도를 감소시킬 수 있는 눈에 대한 자극을 최소화한다.
이 접근법의 한계는 광학 수차가 완전히 보정되지 않는다는 사실입니다. 이것은 무거운 시차로 인해 축 방향 분해능을 심각하게 감소시키는 반면, 소마의 정량적 측정은 단일 이미지 평면에서 얻을 수 있습니다. 망막 뉴런의 형광 신호 강도는 이 방법을 사용한 샘플 정렬에 따라 달라지기 때문에 여기 및 방출 비율 기반 센서는 다양한 이미징 세션에서 샘플을 만성적으로 비교하는 실험에 더 적합합니다. 시스템 수준에서 광학 수차를 교정하는 접근법은 망막 8,9,14,21에서 세포 하 해상도를 허용하는 적응 광학입니다. 그러나 적응형 광학을 구현하려면 고도로 전문화된 장비와 광범위한 전문 지식이 필요합니다.
생체 내 망막 영상에 대한 2 광자 접근법은 컨 포칼 현미경 또는 검안경6이다. 여기에 제시된 접근 방식은 광시야 또는 컨포칼 현미경으로 쉽게 변환할 수 있어야 합니다. 단일 광자 이미징은 아마도 더 견고하고 눈의 각막과 렌즈를 통해 효율적인 2 광자 효과를 달성하는 데 필요한 2 광자 레이저의 높은 에너지로 인해 망막 손상 위험이 적습니다. 2광자 레이저 손상을 방지하려면 이미징 실험 완료 후 전체 망막을 검사하고 이미징된 층의 세포 유형에 대한 면역 염색을 통해 최대 레이저 출력에 대한 임계값을 경험적으로 결정해야 합니다. 여기에 제시된 시스템에서 RGC는 pan-RGC 마커 인 Rbpms로 레이블이 지정되었으며 밀도는 최대 45mW 이미징 전력까지 정상인 반면 55mW는 RGC의 상당한 손실을 초래했습니다 (표시되지 않음).
단일-광자 영상화의 단점은 이러한 접근법이 이광자 영상(23)에 비해 망막의 고유 시각 회로를 매우 심하게 자극할 것이라는 사실이다. 망막 전체 마운트 또는 아이컵 준비를 사용한 이전 실험은 2광자 레이저 스캐닝이 대체로 일시적인 회로 활성화를 유도한다는 것을 보여주었습니다24. 여기에서 Ca 2+ 센서 Twitch2b를 사용한 RGC 활동의 이미징은 레이저 스캐닝의 시작이 대부분의 RGC에서 5-20초 동안 기준선으로 돌아가는 Ca2+ 상승을 유도한다는 것을 보여줍니다(그림 8). 이 프로토콜에서의 레이저 파워가 생체내 망막 광 반응(8)을 보고하는 이전 실험의 범위 내에 있다는 것을 감안할 때, 현재 기술된 방법은 망막에서의 회로 활성의 기록에 복종할 가능성이 높다. 이러한 고려 사항은 회로 활동의 영향을 받을 수 있는 실험에 중요합니다.
이 프로토콜은 두 가지 유형의 망막 뉴런, RGC와 무축삭 세포의 생체 내 이미징을 보여줍니다. 수평 세포 (Cx57-Cre 25), 양극성 세포 (Chx10-Cre 26; mGluR6-GFP 27), 원뿔 광 수용체 (S- 또는 M-옵신 -Cre 28), 막대 광 수용체 (Nrl-Cre 29), 뮐러 아교 세포 (Foxg1-Cre 26) 및 혈관 주위 세포 (NG2-DsRed9)를 포함한 다른 주요 세포 유형의 유사한 표지가 달성 될 수 있습니다. 트랜스제닉 마우스는 또한 RGC의 개별 서브세트를 표지하는데 이용가능하다 (예를 들어, αRGCs30에 대한 KCNG4-Cre; OPN4-Cre for ipRGCs31; J-RGCs 32) 및 무축삭 세포 (예를 들어, 성화상 무축삭 세포26에 대한 ChAT-Cre 및 다양한 무축삭 세포 아형에 대한 신경펩티드 프로모터 드라이버 3,34). 바이러스 벡터는 트랜스제닉 마우스 대신 특정 세포 집단을 표적으로 하는 데 사용할 수 있습니다. 유비쿼터스 CAG 프로모터 요소를 갖는 AAV2의 유리체내 주사는 거의 독점적으로 RGC, 무축삭 세포 및 수평 세포25를 표지한다. 변형된 AAV2.7m8-Y444F 캡시드를 조작된 mGluR6 프로모터 구축물과 페어링하는 것은 ON 양극성 세포(35)의 광범위한 표지를 허용한다. AAV의 망막 하 주사는 광 수용체의 농축을 유도하며, 혈청 형 AAV2 / 5는 가장 높은 형질 도입 효율을 갖는다36. 변형된 AAV6 캡시드 단백질인 Shh10은 신경교 섬유소 산성 단백질 프로모터 요소와 짝을 이루어 Müller glia37에 특이적으로 입증되었습니다.
완전히 비 침습적 인 접근법으로 중추 신경계의 세포를 관찰하는 능력은 신경 회로8의 기본 특성과 신경 퇴행 3,4,5,6,38의 메커니즘을 연구하는 데 사용될 수 있습니다. 많은 맹목 질환은 망막의 세포 집단을 표적으로 하며, 마우스의 생체 내 영상 접근법은 시신경 손상 1,3,4, 황반 변성13, 뇌졸중5, 녹내장 2,6 및 포도막염 7을 연구하는 데 사용되었습니다. 또한, 많은 중추 신경계 신경 퇴행성 상태가 알츠하이머 병39, 다발성 경화증40 및 파킨슨 병41을 포함하여 망막에서 나타납니다. 따라서, 망막의 생체내 영상화를 위해 쉽게 접근할 수 있는 이 기술은 광범위한 신경퇴행성 상태를 연구하기 위한 도구로서 적용될 수 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 실명 예방 연구 재단 (PRW에 대한 경력 개발 상 및 세인트 루이스의 워싱턴 대학교 의과 대학 안과 및 시각 과학과에 대한 무제한 보조금), 국립 DrDeramus Research (BrightFocus Foundation의 프로그램) 및 McDonnell Center for Cellular and Molecular Neurobiology의 보조금으로 지원되었습니다. Z.W.는 기관 국립 연구 서비스 상 T32 EY013360의 지원을 받습니다. 이 연구는 또한 워싱턴 대학교 의과 대학의 희망 센터 바이러스 벡터 코어의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| #1.5 coverslip | ThermoFisher | 152440 | Richard-Allan #1.5 24 mm x 40 mm |
| 50 mL glass syringe | Hamilton | 80950 | 22G cemented needle |
| Adeno-associated virus (AAV2) | Hope Center Viral Core | NA | |
| Anesthesia Air Pump | RWD Life Science | R510-30 | |
| Atropine | Sigma | A0132 | For pupil dilator solution |
| Basic Small Animal Anesthesia Device | RWD Life Science | R500IE | |
| Borosilicate glass capillary | Sutter | B150-86-10 | Outside diameter 1.50 mm, inside diameter 0.86 mm, length 10 cm |
| CFP/YFP filter cube | Chroma | custom | 480/40, 505 long pass, 535/30 |
| ChromoFlex - Two channel PMT detection unit | Scientifica | S-MPLG-1002 | |
| Circulating heating pump | Braintree Scientific | tp-700 | Set to 37 °C |
| Cling film | VWR | 10713-916 | |
| Compact Filter Holder | ThorLabs | DH1 | Holds coverslip over mouse eye |
| Cx3cr1-GFP transgenic mice (B6.129P2(Cg)-Cx3cr1tm1Litt/J) | The Jackson Laboratory | 005582 | |
| DAQ controller chassis | National Instruments | PXIe-1073 | |
| Data acquisition device | National Instruments | BNC-2090A | |
| Evans Blue dye | Fisher Scientific | AAA1677409 | |
| FPGA module with digitizer | National Instruments | NI-5734 | |
| Gas Evacuation Apparatus | RWD Life Science | R546W | |
| GenTeal Severe lubricant eye gel | Alcon | (from local pharmacy) | For use during imaging |
| GFP/Red filter cube | Chroma | custom | 535/30, 560 long pass, 605/70 |
| Heating pad | McKesson Medical and Surgical | 190147 | |
| HyperScope Launch Optics for use with Pockels Cell | Scientifica | S-MP-101080 | |
| HyperScope Main module | Scientifica | S-MP-100466 | |
| HyperScope Scan Path | Scientifica | S-MP-100406 | |
| HyperScope X galvo Module | Scientifica | MP-100443 | |
| ImageJ Fiji software | Freeware | ||
| Isoflurane | Patterson Veterinary | NDC 14043-704-06 | |
| Isoflurane gas filter cannister (active scavenging) | RWD Life Science | R510-31 | |
| Isoflurane gas filter cannister (passive scavenging) | RWD Life Science | R510-31S | |
| ketamine HCl (100 mg/mL) | Vedco | NDC 50989-161-06 | |
| M32 to M26 adapter | ThorLabs | M32M26S | |
| MaiTai GUI software | Spectra-Physics | NA | |
| MATLAB software | MathWorks | NA | R2015b |
| meloxicam (5 mg/mL) | Boehringer Ingelheim | NDC 0010-6013-01 | Analgesic |
| Micorscope Objective | Edmund Optics | 46-404 | Mitutoyo WE715042319 |
| micropipette puller | Sutter | Flaming/Brown Model P-97 | |
| Mineral oil | Fisher | BP2629-1 | |
| Mini bulldog hemostatic clamp | Fine Science Tools | 18053-28 | |
| Miniature EVA Tubing 0.02" ID, 0.06" OD | McMaster Carr | 1883T1 | |
| Miniature EVA Tubing 0.05" ID, 0.09" OD | McMaster Carr | 1883T4 | |
| Mouse head holder | Narishige | SGM-4 | |
| No. 5 Forceps | Fine Science Tools | 11251-10 | |
| Optic Posts 1/2" | ThorLabs | TR3-P5 | |
| Optical power meter kit | ThorLabs | PM100D | |
| pE-300 Ultra LLG Deivery | Scientifica | COO-LED3ULLGs | |
| Phenylephrine hydrochloride | Sigma | P6126 | For pupil dilator solution |
| Pockels cell | Conoptics | 350-80-02 | |
| Pockels cell amplifier | Conoptics | Model 302RM | |
| Proparacaine hydrochloride | Sigma | 1571001 | For eye immobilization |
| Red & Far Red short pass filter Cube | Chroma | custom | 560 short pass |
| Rotating 1/2" post clamp | ThorLabs | SWC | |
| ScanImage package | Vidrio Technologies | Freeware | Image acquisition software; Version 5.4.0 (2018); requires MATLAB |
| sodium chloride solution, sterile (0.9%) | Fresenius Kabi | NDC 63323-186-01 | |
| Stereomicroscope | Leica | S9 E | |
| Tabletop centrifuge | Oxford | Benchmate C8 | |
| Terramycin oxytetracycline/polymyxin B antibiotic ophthalmic ointment | Zoetisus | NA | For use after intravitreal injection |
| ThermoRack cooling system | Solid State Cooling Systems | ThermoRack 401 | Set to 20 °C |
| Ultrafast Ti:Sapphire laser | Spectra-Physics | Mai Tai DeepSee | |
| Vgat-Cre transgenic mice (Slc32a1tm2(cre)Lowl/J) | The Jackson Laboratory | 016962 | |
| VGlut2-Cre transgenic mice (Slc17a6tm2(cre)Lowl/J) | The Jackson Laboratory | 016963 | |
| VivoScope for In Vivo Imaging | Scientifica | S-MPVS-1200-00P | |
| White petrolatum-mineral oil lubricant eye ointment | Stye | NA | For use after imaging |
| xylazine HCl (20 mg/mL) | Akorn | NDC 59399-110-20 |
참고문헌
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Scientific Reports. 8 (1), 1490 (2018).
- Liu, H., Ding, C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose. Experimental and Therapeutic Medicine. 14 (3), 1953-1960 (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), 40352 (2012).
- Leung, C. K., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Investigative Ophthalmology & Visual Science. 49 (11), 4898-4902 (2008).
- Murata, H., et al. Imaging mouse retinal ganglion cells and their loss in vivo by a fundus camera in the normal and ischemia-reperfusion model. Investigative Ophthalmology & Visual Science. 49 (12), 5546-5552 (2008).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. Journal of Visualized Experiments. (99), e52731 (2015).
- Bremer, D., et al. Longitudinal Intravital Imaging of the Retina Reveals Long-term Dynamics of Immune Infiltration and Its Effects on the Glial Network in Experimental Autoimmune Uveoretinitis, without Evident Signs of Neuronal Dysfunction in the Ganglion Cell Layer. Frontiers in Immunology. 7, 642 (2016).
- Qin, Z., et al. Adaptive optics two-photon microscopy enables near-diffraction-limited and functional retinal imaging in vivo. Light: Science & Applications. 9, 79 (2020).
- Schallek, J., Geng, Y., Nguyen, H., Williams, D. R. Morphology and topography of retinal pericytes in the living mouse retina using in vivo adaptive optics imaging and ex vivo characterization. Investigative Ophthalmology & Visual Science. 54 (13), 8237-8250 (2013).
- Williams, D. R. Imaging single cells in the living retina. Vision Research. 51 (13), 1379-1396 (2011).
- Carroll, J., Neitz, M., Hofer, H., Neitz, J., Williams, D. R. Functional photoreceptor loss revealed with adaptive optics: an alternate cause of color blindness. Proceedings of the National Academy of Sciences of the United States of America. 101 (22), 8461-8466 (2004).
- Rossi, E. A., et al. Imaging retinal mosaics in the living eye. Eye. 25 (3), 301-308 (2011).
- Rossi, E. A., et al. In vivo imaging of retinal pigment epithelium cells in age related macular degeneration. Biomedical Optics Express. 4 (11), 2527-2539 (2013).
- Geng, Y., et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 3 (4), 715-734 (2012).
- Thestrup, T., et al. Optimized ratiometric calcium sensors for functional in vivo imaging of neurons and T lymphocytes. Nature Methods. 11 (2), 175-182 (2014).
- Takeda, A., et al. Microglia mediate non-cell-autonomous cell death of retinal ganglion cells. Glia. 66 (11), 2366-2384 (2018).
- Ikeda, W., Nakatani, T., Uemura, A. Cataract-preventing contact lens for in vivo imaging of mouse retina. Biotechniques. 65 (2), 101-104 (2018).
- Palczewska, G., Kern, T. S., Palczewski, K., Weber, B. H. F., Langmann, T. Noninvasive two-photon microscopy imaging of mouse retina and retinal pigment epithelium. Retinal Degeneration. Methods in Molecular Biology. 1834, 333-343 (2019).
- Wahl, D. J., Jian, Y., Bonora, S., Zawadzki, R. J., Sarunic, M. V. Wavefront sensorless adaptive optics fluorescence biomicroscope for in vivo retinal imaging in mice. Biomedical Optics Express. 7 (1), 1-12 (2016).
- Park, S. W., Kim, J. H., Park, W. J., Kim, J. H. Limbal approach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium. Journal of Visualized Experiments. (102), e53030 (2015).
- Biss, D. P., et al. In vivo fluorescent imaging of the mouse retina using adaptive optics. Optics Letters. 32 (6), 659-661 (2007).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A mouse model for laser-induced choroidal neovascularization. Journal of Visualized Experiments. (106), e53502 (2015).
- Palczewska, G., et al. Human infrared vision is triggered by two-photon chromophore isomerization. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5445-5454 (2014).
- Euler, T., et al. Eyecup scope--optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Archive-European Journal of Physiology. 457 (6), 1393-1414 (2009).
- Zhang, Y., et al. Elevating Growth Factor Responsiveness and Axon Regeneration by Modulating Presynaptic Inputs. Neuron. 103 (1), 39-51 (2019).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Akimoto, M., et al. Transgenic mice expressing Cre-recombinase specifically in M- or S-cone photoreceptors. Investigative Ophthalmology & Visual Science. 45 (1), 42-47 (2004).
- Brightman, D. S., Razafsky, D., Potter, C., Hodzic, D., Chen, S. Nrl-Cre transgenic mouse mediates loxP recombination in developing rod photoreceptors. Genesis. 54 (3), 129-135 (2016).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85 (6), 1244-1256 (2015).
- Ecker, J. L., et al. Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron. 67 (1), 49-60 (2010).
- Kim, I. J., Zhang, Y., Yamagata, M., Meister, M., Sanes, J. R. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452 (7186), 478-482 (2008).
- Akrouh, A., Kerschensteiner, D. Morphology and function of three VIP-expressing amacrine cell types in the mouse retina. Journal of Neurophysiology. 114 (4), 2431-2438 (2015).
- Zhu, Y., Xu, J., Hauswirth, W. W., DeVries, S. H. Genetically targeted binary labeling of retinal neurons. Journal of Neuroscience. 34 (23), 7845-7861 (2014).
- Lu, Q., et al. AAV-mediated transduction and targeting of retinal bipolar cells with improved mGluR6 promoters in rodents and primates. Gene Therapy. 23 (8-9), 680-689 (2016).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Research. 48 (3), 353-359 (2008).
- Yao, K., et al. Wnt regulates proliferation and neurogenic potential of Muller glial cells via a Lin28/let-7 miRNA-dependent pathway in adult mammalian retinas. Cell Reports. 17 (1), 165-178 (2016).
- Williams, P. R., et al. A recoverable state of axon injury persists for hours after spinal cord contusion in vivo. Nature Communications. 5, 5683 (2014).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's & Dementia. 10 (2), 135-142 (2014).
- Kerrison, J. B., Flynn, T., Green, W. R. Retinal pathologic changes in multiple sclerosis. Retina. 14 (5), 445-451 (1994).
- Sung, M. S., et al. Inner retinal thinning as a biomarker for cognitive impairment in de novo Parkinson's disease. Scientific Reports. 9 (1), 11832 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유