Method Article
経瞳孔二光子マウス網膜のin vivoイメージング
要約
in vivoイメージングは、健康と疾患における生物学の研究のための強力なツールです。このプロトコルは、標準的な2光子顕微鏡によるマウス網膜の経瞳孔イメージングについて説明しています。また、網膜の複数の細胞コホートを蛍光標識するためのさまざまなin vivoイメージング方法も示しています。
要約
網膜は、環境からの光信号を脳に伝播する電気信号に変換します。網膜の病気は蔓延しており、視覚障害や失明を引き起こします。このような疾患がどのように進行するかを理解することは、新しい治療法を策定するために重要です。疾患の動物モデルにおけるin vivo顕微鏡検査は、神経変性を理解するための強力なツールであり、アルツハイマー病から脳卒中に至るまでの状態の治療に向けて重要な進歩をもたらしました。網膜は、光学的アプローチによって本質的にアクセス可能な唯一の中枢神経系構造であることを考えると、当然、in vivoイメージングに適しています。ただし、レンズと角膜のネイティブ光学系は、効果的なイメージングアクセスにいくつかの課題を提示します。
このプロトコルは、マウス網膜の細胞コホートおよび構造を細胞分解能でin vivoで2光子イメージングする方法を概説しており、急性および慢性の両方のイメージング実験に適用できます。網膜神経節細胞(RGC)、アマクリン細胞、ミクログリア、およびアデノ随伴ウイルス(AAV)ベクター、トランスジェニックマウス、無機色素などの一連の標識技術を使用した血管イメージングの例を紹介します。重要なことに、これらの技術は網膜のすべての細胞型にまで及び、関心のある他の細胞集団にアクセスするための提案された方法が記載されている。また、表示と定量化のための手動画像後処理の戦略例についても詳しく説明します。これらの技術は、健康と病気における網膜機能の研究に直接適用できます。
概要
中枢神経系のin vivo可視化には、一般に、頭蓋骨の菲薄化やガラス窓や光リレーレンズの設置などの侵襲的な手順が必要です。網膜は、環境から自然に光を受け取るため、侵襲的な準備を必要とせずに直接観察できる神経系の唯一の構造です。網膜への光学的アクセスの容易さは、それを中枢神経系を研究するための魅力的なモデルシステムにします。
マウスの網膜のライブ蛍光イメージングは、緑内障1,2、視神経損傷1,3,4、脳卒中5のモデルにおけるRGC死、ならびに変性状態におけるミクログリア活性化6,7,8および血管系9の変化を追跡するために使用されています。内因性シグナルはまた、光受容体10、11、12および網膜色素上皮細胞13を視覚化するためにも使用することができる。網膜のin vivoイメージングへの多くのアプローチは、眼科目的のために特別に設計された高度に特殊化されたデバイス6または角膜および水晶体の本来の収差を補正するために高度に変更された光学システムのいずれかを使用する8、9、11、12、13、14。
本プロトコルは、マウス眼の前視系に対して部分的に補正する基本的な方法を利用して、細胞分解能での網膜における蛍光シグナルのインビボイメージングへのアプローチを実証する。この戦略では、脳のin vivoイメージングに一般的に使用される多光子顕微鏡のセットアップにごくわずかな適応が必要です。このアプローチはセットアップが簡単で、マウスにはほとんどストレスがかからないため、急性期間と慢性期間の両方でタイムラプス実験を行うのに役立ちます。さらに、RGC、アマクリン細胞、ミクログリア、血管系などの個々の網膜成分を標識する遺伝的および有機色素ベースの手順は、このイメージング技術と互換性があり、網膜機能に重要な細胞の種類と構造のin vivo観察を可能にします。これらのツールは、他のほとんどの神経細胞タイプ、ならびに網膜のグリアおよび血管成分を標識するために適合させることができる。
プロトコル
注:以下の手順は、セントルイスのワシントン大学の施設動物管理および使用委員会のガイドラインに準拠して実行されました。この研究で使用された試薬、機器、および動物の詳細については、 材料の表 を参照してください。
1.アデノ随伴ウイルス注射
注:網膜の特定の細胞の標識は、発現パターンが制限されたCreトランスジェニックマウス株で達成できます。このセクションでは、蛍光タンパク質のCre依存的発現をコードし、特異的網膜細胞を標識するAAVベクターの硝子体内送達について説明します。4週齢からマウス(雄と雌)を注射します。
- マイクロピペット針の準備
- マイクロピペットプーラーを使用して、ホウケイ酸ガラスキャピラリーニードルを作成します。マイクロピペットプーラーにガラスキャピラリーをロードし、ランプテストを実行して、結果の値を記録します。ランプテストに使用したガラスキャピラリーを廃棄します。
- 次の設定でマイクロピペットを引きます:熱:ランプテスト値マイナス10;プル:55;ベロシティ:65;時間:120;空気圧:500;プル開始時の放送時間:20。
注意 プラーごとに設定を調整する必要がある場合があります。 - 解剖顕微鏡で、かみそりの刃を使用して、ガラスの先端が力でわずかにたわむ位置(テーパー部分の端から~10 mm)で、引っ張られたマイクロピペットの先端を切り取ります。カットが斜めの先端を生成するように鋭角にカットします。鈍い先端を捨てます。
- 注射器の準備
- カットガラス製マイクロピペットを、酢酸エチル(EVA)プラスチックチューブ(内径0.05インチ、外径0.09インチ)の2cmセグメントに取り付けます。このチューブセグメントのもう一方の端を、長さ20cmのEVAチューブ(内径0.02インチ、外径0.06インチ)に接続します。
- チューブを22 Gのセメント針を備えた50 μLのガラスシリンジに接続します。ガラスシリンジからプランジャーを取り外し、25Gシリンジニードルを使用してシリンジと接続されたチューブをミネラルオイルで埋め戻します。マイクロピペットの先端に4mmのスペースを残します。
- AAVの硝子体内注射
- 生存手術のための施設プロトコルに従って、滅菌手術用手袋、清潔な白衣、マスク、滅菌フィールド、およびオートクレーブ滅菌器具を使用して、標準的な無菌技術で硝子体内注射を実行します。
- AAVベクターのアリコートを-80°Cで保存場所から除去し、氷上で解凍します。解凍後、2,000 × g で10秒間遠心分離し、気泡を取り除きます。
- 施設動物研究委員会の麻酔および規制物質のガイドラインに従ってください。.30 Gの皮下注射針を使用して、ケタミン/キシラジンカクテル(10 mg / mLケタミン、生理食塩水中1 mg / mLキシラジン、マウスへの有効用量:100 mg / kgケタミン、10 mg / kgキシラジン)の0.1 mL / 10 g体重腹腔内(IP)注射を行います。.マウスをケージに戻し、麻酔が有効になるまで5分間待ちます。
- 30 Gの皮下注射針を使用して、メロキシカムの0.1 mL / 10 g体重の皮下注射を行います(0.9%塩化ナトリウム溶液0.5 mg / mL)。.
- 角膜反射の喪失と尾とつま先のつまみへの離脱反射を確認することにより、麻酔の深さをテストします。尾とつま先の離脱反射を失った後も角膜反射が続く場合は、各眼に0.5%プロパラカイン溶液を滴下し、10秒間待ちます。.
- マウスを実体顕微鏡の下に横向きに置きます。ミニブルドッグ止血クランプを使用して、軌道より上下の皮膚をつかみ、クランプを内側のカンサスに固定して、地球を軌道から部分的に変位させます。
- 切断したマイクロピペットをガラスシリンジに接続し、縁筋の1~2 mm後方に外側強膜を穿刺します。辺縁のすぐ後方を円周方向に走る血管系を乱さないでください。強膜に垂直な角度で穿刺を行い、強膜を穿孔した直後にマイクロピペットをわずかに引っ込めて、レンズの損傷を防ぎます。
- ガラスシリンジのプランジャーを使用して、注射用の液体量にほぼ対応する1〜2μLの硝子体液を引き出します。マイクロピペットを目から引き出し、除去した硝子体液を排出します。
- マイクロピペットの先端に1〜2 μLのAAVを入れ、ウイルスベクターと鉱物油の間に~4 mmの空間を残して、混合を防ぎます。最初の穿刺によって作成された強膜の穴にマイクロピペットを挿入し、ガラスシリンジのプランジャーをゆっくりと押して、20〜30秒かけてウイルスベクターを注入します。マイクロピペットの先端でウイルスベクターの液面を可視化し、空気が目に入る前に注入を停止するように注意してください。
- マイクロピペットを同じ位置に10秒間保持してから、マイクロピペットを引っ込めます。ブルドッグ止血クランプを取り外します。
- オキシテトラサイクリン/ポリミキシンB抗生物質眼科用軟膏を注射した眼に塗布します。.マウスを加熱パッドの上に置き、麻酔からの回復を監視します(3.4.3を参照)。
- マウスをハウジングに戻し、施設のガイドラインに従って術後ケアを行います。イメージングの前に、蛍光色素のウイルス媒介発現に2〜3週間かかります。
2. 顕微鏡のセットアップ
注:顕微鏡の光路の概略図を 図1に示します。
- 「常時オン」の機器:これらの機器は、調整またはメンテナンスを受けない限り、常にオンのままにしておく必要があります。レーザー冷却システムの高温を20.0°Cに設定します。 超高速Ti:Sapphireレーザーの主電源をオンにし、システム起動プロセスの完了時間を確保し、「レーザーイネーブル」キーを「オン」の位置に回します。
- 発光光路構成
- 目的の蛍光色素に適した二色性フィルターセットとバンドパスフィルターセットを使用して、蛍光放出収集経路をサンプル波長に設定します。
注:この原稿では、Twitch2bイメージングは、505ロングパスダイクロイックと480/40および535/30バンドパスフィルターペアで構成されるフィルターキューブを使用しました。GFPは、525/50および605/70バンドパスフィルターを備えた560ロングパスフィルターで構成される赤/緑フィルターキューブを使用して画像化されました。エバンスブルーは、560ショートパスフィルターを使用して画像化されました。発光フィルターを変更すると、発光光路が迷走室内光にさらされ、光電子増倍管(PMT)が損傷する可能性があります。光の露出はPMT機能に悪影響を与える可能性があるため、PMTがオフになっていることを確認し、収集光パスを変更する前に部屋のライトをオフにします。
- 目的の蛍光色素に適した二色性フィルターセットとバンドパスフィルターセットを使用して、蛍光放出収集経路をサンプル波長に設定します。
- 画像取得の開始
注意: 2光子レーザーに直接さらすことは、遠赤色光がまばたき応答を誘発しないため、特に目に危険です。レーザーが光路に沿って閉じていることを確認するために適切な注意を払い、接眼レンズを介した曝露や顕微鏡対物レンズからの放出からユーザーを保護するためにフェイルセーフを配置する必要があります。ユーザーは、レーザーが対物レンズから放出される条件を理解し、そのような危険にさらされないように適切な予防措置を講じる必要があります。- データ収集デバイス、コンピューター、ポッケルスセル、顕微鏡およびステージコントローラー、メカニカルシャッターコントローラー、およびPMT主電源の電源を入れます。PMTは、画像取得の準備ができ、迷光から遮蔽されるまで「無効」状態に保ちます。コンピューターと画像取得ソフトウェアのレーザー制御インターフェースを開きます。コンピュータインターフェースからレーザーをオンにし、モードロックを確認します。
- 希望のレーザー波長を設定します。レーザーシャッターを開いてレーザー光がポッケルスセルに入っていることを確認し、レーザー出力が安定するまで30分待ちます。
- 対物レンズでのレーザー出力の測定と最大レーザーパーセンテージの設定
注意: レーザー放射は、パワー測定中に対物レンズから放射されます。イメージングシャッターを有効にする前に、顕微鏡エンクロージャカーテンを閉じ、適切な目の保護具を着用してください。システムの初期設置時にレーザー出力を測定して、対象波長ごとに出力曲線を確立し、その後毎月測定して励起電力の安定性を検証します。- 光パワーメータの電源を入れ、レーザー波長に対応する測定波長を選択します。光パワーメータ検出器を顕微鏡ステージに置き、X-Y寸法で対物レンズの真下に操作します。Z次元電動フォーカスドライブを使用して、パワーメーター検出器が対物レンズより~1mm下になるまで対物レンズを下げます。
- 落射蛍光照明から顕微鏡励起光路としてのレーザーに切り替えます。メカニカルシャッターを有効にします。
- 画像取得ソフトウェアで、ポイントスキャンを開始してイメージングシャッターを開き、レーザーを光パワーメーターに送信します。スキャンソフトウェアでレーザー出力を100%に設定します。最高のレーザー出力測定が得られるまで、パワーメータ検出器のX-YおよびZ位置を最適化します。
- ポッケルスセルで対物レンズのレーザー出力を0.1%から100%まで測定し、10%間隔で測定します。対物レンズでの45 mWの電力に対応するポッケルスセルの割合を記録します。このパーセンテージを画像取得ソフトウェアの最大レーザー出力として設定します。
注:標的組織に目に見える損傷を与えずにin vivoマウス網膜イメージングで観察された最高出力は、イメージングの2週間後に組織学的染色によってアッセイされた45mWでした。明らかな網膜損傷は、対物レンズで55 mWでイメージングした後に明らかです。 - イメージングシャッターを無効にし、励起光路を落射蛍光に戻します。
3. 画像取得用マウスの準備
- イメージング用麻酔マウス
注意: イソフルランへの曝露を軽減するために、適切な廃ガスの清掃を確認してください。麻酔導入室の排気口がパッシブ掃気ガスフィルターキャニスターに接続され、マウス麻酔ノーズピースの出口がガス排出装置によって提供される真空のアクティブ掃気ガスフィルターキャニスターに接続されていることを確認してください。交換のためにフィルターキャニスターの重量を監視するためのメーカーのガイドラインに従ってください。- 上記のステップ1.3.3で説明したように、ケタミン/キシラジンカクテルを使用してマウスを麻酔します。あるいは、麻酔の維持のためにイソフルランも使用する場合は、イソフルラン吸入を介して麻酔を誘発します(画像セッション>30分)。小動物麻酔装置を、0.5 L / minの流量で室内空気と混合した5%イソフルランで誘導チャンバーを満たすように設定します。マウスを誘導チャンバーに入れ、マウスが麻酔されるまで15秒待ちます。
- イソフルラン気化器を0%に切り替え、麻酔の流れをノーズピースに向けます。誘導チャンバーの5秒間の「O2 フラッシュ」を実行します。マウスを誘導チャンバーから取り出し、ヘッドホルダーに固定して(セクション3.3を参照)、ノーズピースを取り付けます。
- 麻酔の維持のために、1%イソフルランと室内空気の混合物を0.5 L / minの流量で使用します。.麻酔中は5分間隔で呼吸数を監視し、イソフルランの割合を調整して、呼吸数を~60呼吸/分に維持します。
注:これらの設定(%イソフルラン、流量)は、ケタミン/キシラジンカクテルによって誘発される麻酔の維持にも使用できます。
- 瞳孔拡張
- 1%w / vアトロピンと2.5%w / vフェニレフリン塩酸塩の溶液を水中に調製します。拡張器溶液は、光から保護された室温で保管してください。
- 使い捨てピペット点眼器を使用して、画像化する各目に拡張器溶液を一滴塗布します。部屋の明かりを消し、瞳孔が拡張するまで5分間待ちます。瞳孔が拡張したら、糸くずの出ない組織で拡張器溶液を吸い取ります。
注意: 拡張器溶液が鼻孔に入らないようにしてください。 - 画像化する各目に潤滑剤アイジェルを大量に塗布します。両目を画像化する場合は、脱水症を防ぐために、非画像眼のアイジェルの上にプラスチックの粘着フィルムの小片を塗布します。片方の目だけを画像化する場合は、画像化されない目に潤滑剤の眼軟膏を塗布します。
- イメージング用のポジショニングマウス
- マウスをイメージングヘッドホルダーに固定するには、イヤピースバーが水平より60°以上の角度で傾くまでヘッドホルダーのメインアームを回転させます。下外耳道ピンを内側に伸ばした位置に固定し、上耳道ピンを引き出した位置に固定します。
- マウスをバイトバーに向けて、片方の耳を伸ばした下部ピンに取り付け、ピンを外耳道に挿入します。上外耳道ピンを固定しているネジを緩め、ピンをもう一方の外耳道に伸ばします。ネジを締めてヘッドを固定します。
- バイトバーをマウスの頭に向かってスライドさせます。マウスの頭をそっと持ち上げてから、マウスの上顎切歯をバイトバーの穴に下げます。バイトバーを穏やかな力で引っ込めてマウスの頭を固定し、ネジを締めてバイトバーの位置を固定します。
- イソフルランを使用する場合は、マウスの切歯を固定する前に、ノーズピースをスロットからバイトバーにスライドさせます。.手順3.3.3のようにバイトバーの位置を固定して締めます。マウスの鼻にぴったりと収まるまで、上面の2本のネジを使用してノーズピースを締めますが、鼻を収縮させません。
- ヘッドホルダー内のマウスを対物レンズの下の顕微鏡ステージに移します。ヘッドホルダーのメインアームを、目の瞳孔が光路に沿ってまっすぐ上を向くまで回転させます(図2)。
- コンパクトなフィルターホルダーに#1.5カバーガラスを置き、ホルダーを顕微鏡ステージに取り付けます。カバーガラスを目に向かって下げ、カバースリップが角膜のすぐ上に水平になるように潤滑剤アイジェルを接触させます(図2)。カバーガラスが角膜に触れないようにしてください。
注意: 顕微鏡で、励起光路が落射蛍光に設定され、発光光路が接眼レンズに設定されていることを確認してください。落射蛍光イルミネーターを最低電力でオンにし、イルミネーターシャッターを開きます。イメージングする蛍光色素に対応する落射蛍光照明器の波長と蛍光フィルターを選択します。 - 広視野励起光が角膜を完全に覆うまで、ステージコントロールと電動フォーカスドライブを使用して、X-Y寸法でステージを操作し、Zポジションで対物レンズを操作します。接眼レンズを通して見て、網膜の蛍光細胞または構造が焦点が合うまで、ステージのZ位置を調整し続けます。サンプル信号が明るさが不十分で、接眼レンズを通して関心のある個々の細胞または構造を分解できない場合は、落射蛍光イルミネーターのパワーを上げます。
注意: 網膜の位置がわかりにくい場合、虹彩は高コントラストのランドマークであり、固定してから網膜に向かって焦点を合わせます。このステップでは、瞳孔が最大限に拡張していることを検証することもできます。 - マウスレンズで軸上のイメージング領域を取得します。焦点面を調整するときに、焦点が合っていない光の膨張または収縮のみが発生するまで、ヘッドホルダーのさまざまな自由度を使用してマウスの角度を調整します。落射蛍光イルミネーターの電源を切り、イルミネーターシャッターを閉じます。
注意: Z方向の焦点面をスクロールしている間の焦点が合っていない光の著しいX-Y視差は、網膜がイメージング光路に対して軸上にないことを示しています。
4. 2光子画像取得
- 画像のセットアップと取得パラメータ
注意: 部屋の照明をオフにし、部屋の迷光光源を覆います。落射蛍光イルミネーターがオフになっていて、イルミネーターシャッターが閉じていることを確認してください。- 励起光路をレーザーに切り替え、発光光路を光電子増倍管に切り替えます。
- 画像取得ソフトウェアで、フレームサイズを512 x 512、フレーム平均を3に設定します。スライスあたりのステップ数を -8 μm に設定します。zステッピングをスタックの一番上から開始して下に向かって進むように指定し、光受容体の2光子レーザー活性化を最小限に抑えます。
注:イメージング時間の増加を犠牲にして、ステップサイズを小さくしてZ分解能を上げることができますが、このイメージング構成で細胞体細胞を分解するには8μmステップで十分です。 - PMTをオンにして有効にします。 PMT電圧を680 Vに調整します。 励起シャッターを有効にします。
メモ: パワードPMTは軽い損傷を受けやすいです。落射蛍光照明がオフになっていて、顕微鏡エンクロージャーのカーテンが引かれ、部屋の照明がオフになっていることを確認します。 - 1%のレーザー出力から始めて、ターゲット組織のライブ画像プレビューを開始します。ディスプレイの明るさを自動調整して、目的のセルまたは構造を視覚化します。スキャンフェーズを自動調整します。ターゲット組織が薄暗いか不明瞭な場合は、2.4.4mWに対応するステップ45で設定された制限を超えることなく構造が見えるようになるまで、レーザー出力のパーセンテージを増やします。
注:16ビット画像の場合、関心のある構造を含むZ平面の明るさを自動調整するときの表示値が~1000の場合は、サンプルの十分な明るさを示します。 - 顕微鏡ステージをX-Y方向に操作して目的のイメージング領域の中心に配置し、関心のある構造に焦点を合わせたZ平面に移動します。
注:視神経乳頭に隣接するイメージングにより、慢性イメージング実験の明確なランドマークとして機能することができます。 - これが慢性的なタイムラプス実験である場合は、取得コンピューターで以前の画像を開き、それを参照として使用して、同じ関心領域を見つけます。イメージングの角度が前の画像の角度と類似していることを確認して、最小視差で同じセルセットを取得します。
注:前の時点と同じセルを画像化するには、マウスの頭の位置をさらに調整する必要があります(図3)。 - 対象の最上部と最下部のZ平面に移動してイメージングスタックのZ制限を設定し、画像を取得します。画像取得が完了したら、PMTと発光シャッターを無効にします。発光光路を接眼レンズに戻し、励起光経路を落射蛍光照明に切り替えます。顕微鏡ステージからマウスを取り外します。
- システムソフトウェアとハードウェアのシャットダウン
- 画像取得ソフトウェアを終了します。コンピュータインターフェースのレーザーをオフにします。「常時オン」機器を除き、逆の起動順序でハードウェアをシャットダウンします。
- マウスの回復
- ヘッドホルダーとマウスを顕微鏡ステージから取り外します。該当する場合は、イソフルラン気化器を0%に設定します。ヘッドホルダーからマウスを取り外します。
- 糸くずの出ないティッシュで潤滑剤アイジェルをそっと拭き取り、白いワセリン鉱油潤滑剤眼軟膏を両目に塗ります。マウスを温水循環加熱パッド(37°Cに設定)に置き、マウスが目覚めて歩行能力を取り戻すまで、マウスに注意を払い、呼吸数を監視し続けます。マウスをハウジングに戻します。
- 該当する場合は、硝子体内注射後24時間で動物の活動と罹患率を評価します。.研究が完了したら、トリブロモエタノール(250 mg / kg)の過剰摂取でマウスを安楽死させ、網膜組織を保存するために4%パラホルムアルデヒドで経心灌流を行います。.
5. 画像処理・解析
- マルチチャンネルデータのインターリーブ解除とマージ
- 特定の画像取得ソフトウェアプログラムはマルチチャンネル画像をインターリーブ形式で保存するため、フィジー(https://imagej.net/Fiji)などのソフトウェアを使用して.tif画像ファイルを開き、チャンネルを分離します。
- フィジーの 画像 メニューで、 スタック |ツール |インターリーブ解除。画像を構成するチャンネル数を入力し、[ OK]をクリックします。
- 分離したチャンネルを 1 つのファイルにマージするには、 画像 |カラー |チャンネルをマージします。インターリーブ解除した画像チャンネルを別々のカラーチャンネルに配置し、「 OK 」をクリックしてマルチチャンネル合成画像を作成します。この合成画像を新しい.tifファイルとして保存します。
- マルチチャンネル画像における蛍光強度の定量化
注:指定された関心領域(ROI)内の蛍光強度は、フィジーを使用して単一画像平面で定量化できます。レシオメトリック読み出しの定量化は、同じROI内の合成画像の異なるチャネルにおける蛍光強度を測定することによって達成することができる。慢性イメージング実験では、励起または発光レシオメトリック出力に基づくバイオセンサーを使用するのが最善です。- フィジーでは、 分析 |ツール |ROIマネージャー。フィジーで合成画像を開きます。目的の構造に対応する Z スライスまでスクロールし、選択ツール (四角形選択、楕円選択、ポリゴン 選択 など) を使用して ROI の概要を説明します。
- キーボードの T キーを押して、各選択項目を ROI マネージャに追加します。ROIの選択が完了したら、ROIマネージャーの[測定]をクリックして、面積や平均強度の値などのROIからのさまざまなデータを記録します。
- 結果ウィンドウに記録されている現在選択されているチャンネルの測定値をスプレッドシートにコピーします。コンポジット画像ウィンドウで次のチャンネルに切り替え、[測定]をクリックして、同じROIセット内のそのチャンネルの測定値を取得します。ROIマネージャー内で、[その他]に移動します|ROI を保存し、.zip ファイルとして保存します。
- ディスプレイ用の最大強度投影
- 画像データの表示を作成するには、フィジーのZプロジェクト関数を使用します。 [イメージ ] メニューで、[ スタック |Zプロジェクト。対象領域が存在するフレームのみを選択して、背景を縮小します。
- PMTショットノイズを除去したい場合は、 メディアンフィルタ機能を使用します。 [プロセス ] メニューで、[ プロセス |フィルター |中央値。空間の詳細を維持するには、値 1.0 を選択します。
- 単一セルに焦点を当てた最大強度の投影を作成するには、目的のセルに対応する画像フレームのみを選択して、このプロセスを繰り返します。
注:これにより、セルラーアーバーを解決する能力が大幅に向上します(図4)。蛍光強度の測定は、最大強度投影ではなく、単一画像平面で実行する必要があります。
結果
様々なトランスジェニック、ウイルスベクター、または無機色素標識アプローチを使用して、基本的な多光子顕微鏡の簡単な適応を使用して、in vivoでいくつかの網膜細胞タイプおよび構造を特異的に視覚化することができる。RGCおよびアマクリン細胞を可視化するために、VGlut2-CreおよびVGat-Creトランスジェニックマウスに、シアンおよび黄色の蛍光タンパク質(それぞれCFPおよびYFP)およびトロポニン15のCa2+結合ドメインを含む細胞質蛍光共鳴エネルギー移動(FRET)ベースのCa2+センサーであるTwitch2bをコードするCre依存性AAV発現コンストラクトの硝子体内注射をそれぞれ与えた。.VGlut2-Creマウスでは、RGC体細胞がはっきりと識別でき、軸索の束がしばしば明らかになります(図3)。
なお、軸索の軌跡と血管系のネガティブな画像は、VGlut2-Creマウスの視神経乳頭の同定を非常に容易にし、慢性イメージング実験のランドマークとして有用であることに留意すべきである(図3)。アマクリン細胞はRGCよりも明るくないように見えますが、おそらく体細胞のサイズが小さいか、AAV形質導入の効率が低いため、体細胞は内顆粒層で容易に明らかになります。RGCとは対照的に、アマクリン細胞神経突起は内叢状層でより頻繁に観察されます(図4)。網膜ミクログリアは、Cx3cr1-GFPトランスジェニックマウス株6で画像化することができる。ミクログリアは血管系と会合し、タイムラプスイメージング実験で同じ領域を見つけることを可能にします。
このアプローチは、微細なミクログリア突起のダイナミクスを追跡するために、単面画像でより優れた空間分解能を持つ手順、または個々の細胞に焦点を合わせた最大強度の投影を準備する場合に使用できます(図5)。マウスレンズを介した光学収差によって引き起こされる軸方向の解像度が低いため、z次元の細部を調べることができません。このイメージング技術が細胞の微細構造の変性変化を観察できるかどうかを決定するために、1μLの50 mM N-メチル-D-アスパラギン酸(NMDA)を硝子体に注入して興奮毒性病変を誘発しました。注射の1日後、ミクログリアは以前の報告に従って短いプロセスまたはアメーバ形態を示した(図5)。Cx3cr1-GFPトランスジェニック系統の細胞は、AAVを介した蛍光タンパク質発現カセットの送達を用いた実験よりも、細胞コホート全体でより均一で完全な蛍光タンパク質発現を示したことに留意すべきである。実験を設計する際には、多様でまばらな標識と完全で均一な標識の利点を考慮する必要があります。
前述のように網膜血管系を標識するために8、マウスに、イメージングの30〜60分前に200μLのエバンスブルー染料(滅菌生理食塩水中20 mg / mL)を腹腔内注射しました。これにより、視神経乳頭から発せられる血管の強力な標識が行われました(図6)。驚くべきことに、単回注射の蛍光シグナルは少なくとも7日間持続した。in vivo画像の寸法を推定するために、2つの異なる方法を使用した。まず、同じ網膜領域をin vivoで、そして共焦点顕微鏡を使用して平らにした網膜全体に固定した後に画像化しました(図7)。4つの異なるin vivoサンプルからランダムな細胞ペアを選択し、細胞ペア間の真の距離を共焦点スキャンで測定し、in vivoピクセル距離と一致させて、1倍デジタル倍率で0.99μmの平均ピクセルサイズを取得しました。in vivo画像を共焦点ホールマウントスキャンと相関させる同様の方法を使用すると、単一の頭部位置で約650 mm2 の網膜パッチにわたってイメージングが可能になることが明らかになりました。
1つのねじり軸に沿ったヘッドホルダーの再配置は、長さ2.2mmの網膜の線形領域へのアクセスを可能にすることができる(図示せず)。さらに、直径1または2μmの蛍光微小球をマウスの眼に注入し、その直径を10倍デジタルズームでin vivo画像からラインスキャンの全幅半値として測定した。これにより、推定ピクセルサイズがわずかに大きくなりましたが、分散が大きくなります(図7)。全体として、in vivo実験終了後のホールマウントサンプルの共焦点イメージングは、角膜とレンズの特性の違いがサンプルごとに画像のスケールを変える可能性があるため、個々の画像にスケールを割り当てるための最も一貫した方法です。
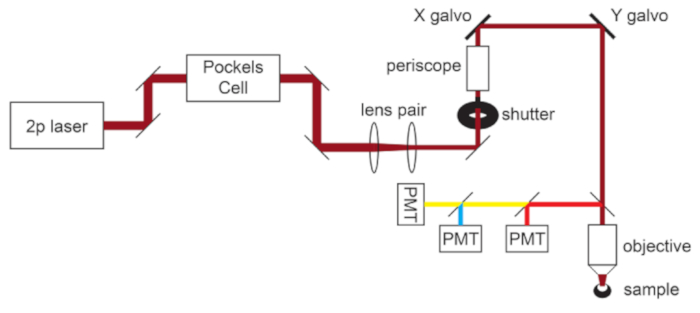
図1:光路回路図 このプロトコルで使用される2光子顕微鏡の基本コンポーネントは、レーザー出力を変調するポッケルスセル、顕微鏡対物レンズの背面開口部に合わせてレーザービーム直径を縮小するレンズペア、およびビームステアリング用のガルボスキャンミラーのペアで構成されています。一対のステアリングミラーは、各主要な光学部品の前に存在します。フォーカスは、対物レンズマウントを駆動するモーターによって制御されます。発光光路は、ダイクロイックフィルターとバリアフィルターを交換することで、さまざまな蛍光色素に合わせてカスタマイズできます。シアン/イエロー/レッドイメージングの一般的なセットアップが表示され、ショートパスダイクロイックミラーが赤色光を最初のPMTに向け、ロングパスダイクロイックミラーと適切なバンドパスフィルターを組み合わせてシアンと黄色の発光を分離します。略称:PMT =光電子増倍管。 この図の拡大版を表示するには、ここをクリックしてください。

図2:in vivoイメージングのためのマウスの位置決め。 瞳孔を光路の軸上に配置するために、麻酔をかけたマウスを最初にヘッドホルダーに拘束し、頭を回転させて角度を付け、潤滑剤アイジェルの大きな滴を目に置き、マウスをステージに置きます。カバーガラスは、光路に垂直なカバースリップホルダーに取り付けられ、目に向かって下げられます。カバーガラスは角膜やマウスの頭(左)に接触してはならず、カバーガラスがたわんでいると明らかになります。ただし、カバーガラスは、サンプルに拡大効果があるため、液滴の腰(右)を避けるのに十分な距離にする必要があります。ゲル浸漬を適用し、カバーガラスを固定した後、ステージを顕微鏡対物レンズの真下の所定の位置に移動する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
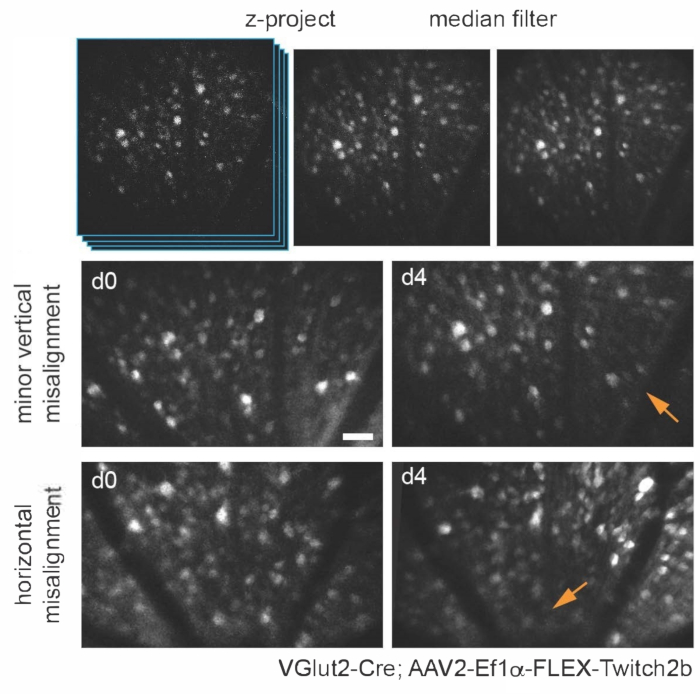
図3:網膜神経節細胞のイメージング。 画像表示では、対象のセルを含む Z 平面で最大強度の投影が作成され、結果の画像は中央値フィルタリングされて PMT ショット ノイズが除去されます。AAV-EF1α-FLEX-Twitch2bをVGlut2-Creトランスジェニックマウスに注射することによって標識した網膜神経節細胞の2つの例、具体的にはCFPシグナルが示されている。画像は4日間隔で取得され、血管のランドマークを使用して視神経乳頭の近くの同じ領域に戻りました。視神経乳頭は画像の下部に向けられています。どちらのサンプルも向きに多少のばらつきが見られますが(強度が低下した領域は矢印で示されています)、ほとんどのセルは両方の時点で存在します。スケールバー=約50μm。略語:PMT =光電子増倍管;AAV =アデノ随伴ウイルス;EF1α =伸長係数-1α;FLEX =フリップ切除;VGlut2 = 小胞性グルタミン酸トランスポーター2;CFP = シアン蛍光タンパク質。 この図の拡大版を表示するには、ここをクリックしてください。
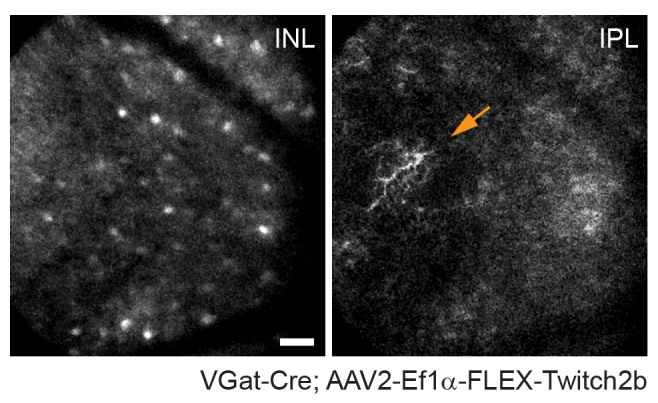
図4:アマクリン細胞のイメージング。 アマクリン細胞は、AAV-EF1α-FLEX-Twitch2bをVGat-Creトランスジェニックマウスに注射することによって標識した。Twitch 2bのCFP信号が具体的に示されています。内顆粒層の深さに焦点を当てた小さな最大強度の突起はアマクリン細胞体細胞を示し、一方、内叢状に焦点を合わせるとアマクリン細胞神経突起が分解されます(矢印)。視神経乳頭は画像の右側を向いています。スケールバー=約50μm。略語:AAV =アデノ随伴ウイルス;EF1α =伸長係数-1α;FLEX =フリップ切除;VGat =小胞ガンマアミノ酪酸トランスポーター;CFP = シアン蛍光タンパク質;INL =内顆粒層;IPL =内側の網状層。 この図の拡大版を表示するには、ここをクリックしてください。
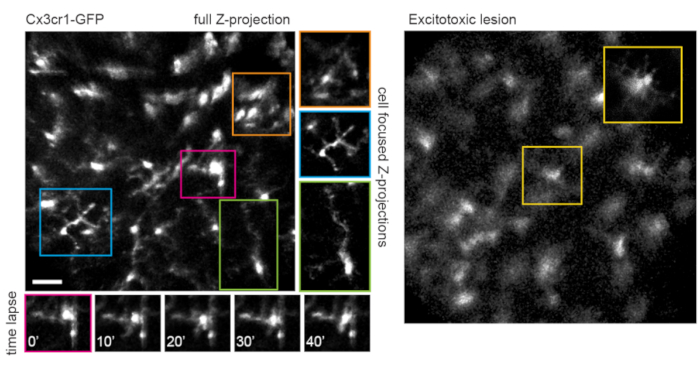
図5:ミクログリアのイメージング。 トランスジェニックマウス株Cx3cr1-GFPを用いてミクログリアを標識した。フルスキャンボリュームの最大強度投影は、多くのミクログリアを示し、一部は分解可能な微細なプロセスの詳細を示します。フィールドの左下に向かうセルは、この領域の視差のために、右上のセルよりも最大投影の歪みが少ないことに注意してください。対象のセルのみを含む最大強度の投影は、この視差を大幅に低下させます(中央、対応する色のボックス)。さらに、このイメージング戦略は、微細ミクログリアプロセスリモデリングのダイナミクスを文書化することができます(下のパネル)。比較すると、多くのミクログリアは、50 mM NMDAの硝子体内注射による興奮毒性病変の1日後に短い突起またはアメーバ形態で見ることができます(右)。スケールバー=約50μm。略語:GFP =緑色蛍光タンパク質;Cx3cr1 = Cx3ケモカイン受容体1;NMDA = N-メチル-D-アスパラギン酸。 この図の拡大版を表示するには、ここをクリックしてください。
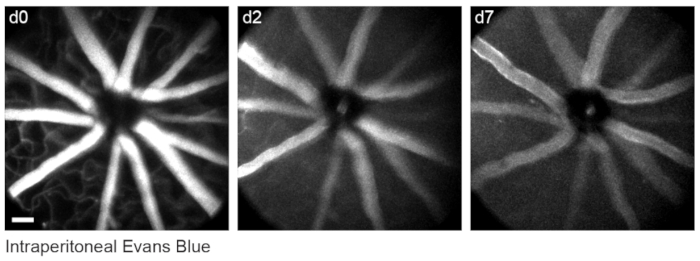
図6:血管ランドマークのラベル付け。 マウスに、最初のイメージングセッションの30〜60分前に、20 mg / mLのエバンスブルーの200 μLを腹腔内に注射しました。.全層最大強度投影は、少なくとも7日間持続した網膜血管系における持続的な蛍光を示しています。スケールバー=約50μm。 この図の拡大版を表示するには、ここをクリックしてください。
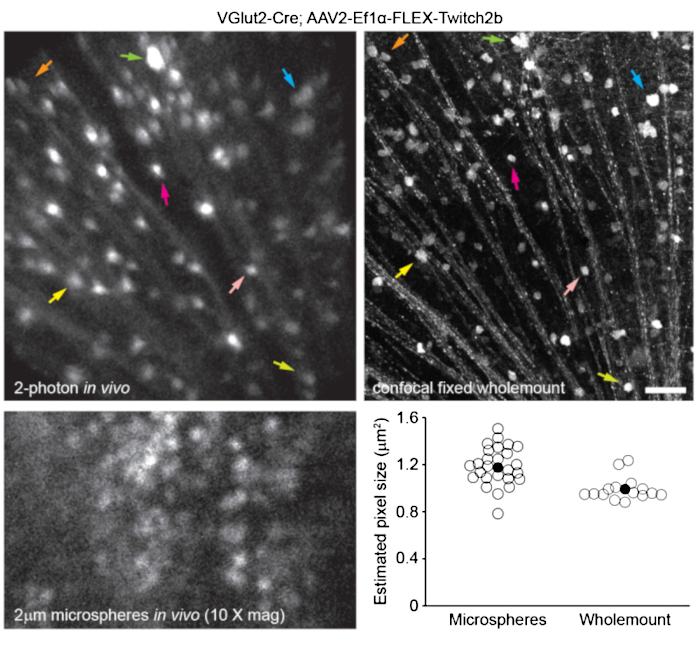
図7:画像のサイズ。 VGlut2-CreトランスジェニックマウスにAAV-EF1α-FLEX-Twitch2bを注射して標識した網膜神経節細胞をin vivoで画像化し、網膜の固定とホールマウント調製後に共焦点レーザー走査顕微鏡で同じ領域を画像化しました。黄色蛍光タンパク質チャネルが両方について示されている。色付きの矢印のペアは、両方の調製物(上のパネル)における同じ細胞を示す。直径2 μmの蛍光微小球を硝子体内に注入し、in vivoでイメージングした単面画像(左下パネル)。ミクロスフェアは沈降しなかったため、一定の動きがあり、軸方向の分解能の測定は不可能でした。in vivo蛍光ミクロスフェアの全幅半値測定、またはグループあたり2〜4個の網膜から取得した相関共焦点測定値から計算されたピクセルサイズ(右下)。スケールバー= 50μm。略語:AAV =アデノ随伴ウイルス;EF1α =伸長係数-1α;FLEX =フリップ切除;VGlut2 = 小胞性グルタミン酸トランスポーター 2. この図の拡大版を表示するには、ここをクリックしてください。
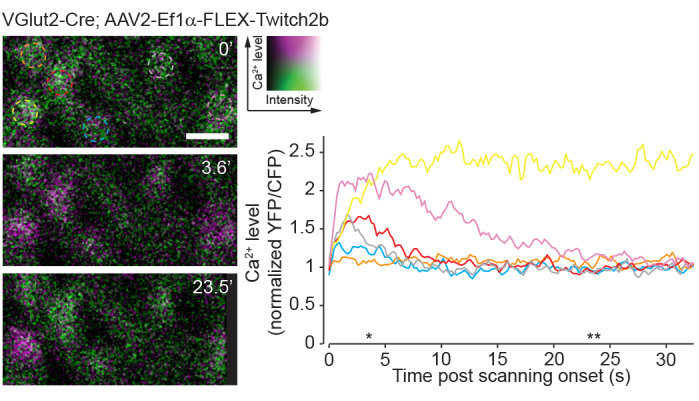
図8:2光子スキャンによって誘導されるカルシウム活性。 網膜神経節細胞をVGlut2-CreトランスジェニックマウスにAAV−EF1α−FLEX−Twitch2bを注射して標識し、YFPはマゼンタ色およびCFPグリーンに擬似着色され、4.22Hzで時系列として単一の平面で画像化された。すべてのRGCの開始YFP / CFP比は類似していました。FRET比の増加(オレンジ色のセルを除く)が最も多く、時系列を通じて高いYFP/CFP比を維持した(黄色のセル)が1つでした。YFP / CFP比は最初のフレーム平均に正規化され、色付きの円は色付きのトレースと一致します。アスタリスクは時点を示し、左側に代表的な画像が表示されます。スケールバー= 20μm。略語:AAV =アデノ随伴ウイルス;EF1α =伸長係数-1α;FLEX =フリップ切除;VGlut2 = 小胞性グルタミン酸トランスポーター2;YFP = 黄色蛍光タンパク質;CFP = シアン蛍光タンパク質;RGC =網膜神経節細胞;FRET = 蛍光共鳴エネルギー伝達。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本明細書に記載される二光子画像化手順は、マウス網膜の縦方向のインビボ画像化を可能にする。網膜の同じ領域の繰り返し可能な画像は、イソフルラン下で最大6時間以上の連続期間にわたって得ることができる。マウスは、細胞および血管のランドマークを使用して異なる日に画像化して、同じ画像領域を見つけることもできます(図3)。この目的のためのカバーガラスと組み合わせた透明なゲル浸漬の使用は、網膜下注射のための網膜の視覚化、レーザー誘発網膜損傷モデル、および眼底イメージングを含む一連の手順に以前に適用されてきた20、21、22。
眼の解剖学的構造は、マウスの角膜と水晶体の高い光パワーが矯正なしで瞳孔を通して直接イメージングを妨げるため、in vivoイメージングに特有の課題を提示します。いくつかの他のインビボ画像化方法は、マウス眼の前方光学系の矯正のための平凹コンタクトレンズの使用に依存している7、17、18、19。角膜での光学補正のみでは、マウスレンズの高い光パワーは、特に周辺スキャン場の構造の必然的な量の視差をもたらし、異なるZ平面でのX-Y次元での伸張および並進運動として現れる。X次元およびY次元における画像視差関連の歪みを最小限に抑えるには、撮像領域の網膜に対する接平面が顕微鏡の光路に対して垂直になるようにマウスの目を向けることが重要です。ここで説明するセットアップは、このアライメントを達成するために目の角度を正確に操作するのに役立ちます。2つの軸に沿って回転できる調整可能なマウスヘッドホルダーにより、実験者がZ次元をスクロールして視差を最小限に抑えるときに、目の角度を簡単に手動で調整できます。この傾斜はまた、瞳孔の電界停止効果を回避して、網膜のより広い領域を画像化できるようにします。ヘッドホルダーの拘束により、呼吸によって引き起こされるモーションアーチファクトも大幅に減少します。
連続撮影中の不透明化により画質が低下するため、マウスの目の鮮明さを維持するように注意する必要があります。イメージング中の潤滑剤ゲルの頻繁な再塗布、および各イメージングセッション後の軟膏塗布は、目の乾燥や不透明度の発生を防ぐのに役立ちます。一部の角膜混濁は、24〜48時間後に自然に解消します。このプロトコルに記載されているような透明ゲルおよびカバーガラスの使用は、コンタクトレンズ7と同様の画質および収差補正を提供する一方で、カバーガラスを再調整する必要なしに眼角の容易な調整を可能にする。さらに、ゲルは目に継続的な水分補給を提供し、最大数時間の急性イメージングセッションを実行することを可能にします。最後に、カバーガラスは角膜に接触しないため、眼への刺激が最小限に抑えられ、繰り返しのイメージングセッションで光学的透明度が低下する可能性があります。
このアプローチの限界は、光学収差が完全に補正されないという事実です。視差が重いため軸方向の分解能は大幅に低下しますが、体細胞の定量的測定値は単一画像平面で取得できます。網膜ニューロンの蛍光シグナル強度はこの方法によるサンプルアライメントに依存するため、励起および発光レシオメトリックベースのセンサーは、異なるイメージングセッション間でサンプルを慢性的に比較する実験により適していることに注意してください。システムレベルで光学収差を補正するアプローチは補償光学であり、これは網膜における細胞内分解能を可能にする8,9,14,21。ただし、補償光学を実装するには、高度に専門化された機器と広範な専門知識が必要です。
二光子in vivo網膜イメージングへの代替アプローチは、共焦点顕微鏡または検眼鏡検査です6。ここで紹介するアプローチは、広視野顕微鏡または共焦点顕微鏡に容易に変換できるはずです。単一光子イメージングはおそらくより堅牢であり、眼の角膜および水晶体を通して効率的な2光子効果を達成するために必要な2光子レーザーの高エネルギーのために網膜を損傷する危険性が低い。2光子レーザーの損傷を避けるために、最大レーザー出力の閾値は、イメージング実験の完了後に網膜全体を調べ、イメージングされた層の細胞タイプの免疫染色によって経験的に決定する必要があります。ここで紹介したシステムでは、RGCは汎RGCマーカーRbpmsでラベル付けされ、密度は最大45mWのイメージングパワーまで正常でしたが、55mWはRGCの大幅な損失を引き起こしました(図示せず)。
単一光子イメージングの欠点は、このアプローチが2光子イメージングと比較して網膜のネイティブ視覚回路を非常に強く刺激するという事実である23。網膜ホールマウントまたはアイカップ製剤を用いた以前の実験では、2光子レーザー走査が主に過渡的な回路活性化を誘発することが示されている24。ここで、Ca 2+センサーTwitch2bによるRGC活性のイメージングは、レーザースキャンの開始がCa2+上昇を誘発し、ほとんどのRGCで5〜20秒の間にベースラインに戻ることを示しています(図8)。このプロトコルにおけるレーザー出力が、インビボ網膜光応答8を報告する以前の実験の範囲内にあることを考えると、現在記載されている方法は、網膜における回路活性の記録に適している可能性が高い。このような考慮事項は、回路の活動によって影響を受ける可能性のある実験にとって重要です。
このプロトコルは、RGCとアマクリン細胞の2種類の網膜ニューロンのin vivoイメージングを実証します。水平細胞(Cx57-Cre 25)、双極性細胞(Chx10-Cre 26;mGluR6-GFP 27)、錐体光受容体(S-またはM-オプシン-Cre 28)、桿体光受容体(Nrl-Cre 29)、ミュラーグリア(Foxg1-Cre 26)、および周皮細胞(NG2-DsRed9)を含む他の主要な細胞タイプの同様の標識を達成することができる。トランスジェニックマウスは、RGCの個別のサブセットを標識するためにも利用可能です(例えば、αRGCのKCNG4-Cre30;OPN4-Cre for ipRGC31;J-RGCs32)およびアマクリン細胞(例えば、スターバーストアマクリン細胞26のためのChAT-Creおよび様々なアマクリン細胞サブタイプのための神経ペプチドプロモータードライバー3,34)。ウイルスベクターは、トランスジェニックマウスの代わりに特定の細胞集団を標的とするために使用することができる。ユビキタスCAGプロモーターエレメントを用いたAAV2の硝子体内注射は、RGC、アマクリン細胞および水平細胞をほぼ独占的に標識する25。修飾されたAAV2.7m8-Y444Fキャプシドを操作されたmGluR6プロモーターコンストラクトと組み合わせることで、ONバイポーラ細胞の幅広い標識が可能になります35。AAVの網膜下注射は光受容体の濃縮をもたらし、血清型AAV2 / 5は最も高い形質導入効率を有する36。修飾AAV6キャプシドタンパク質であるShh10は、グリア線維性酸性タンパク質プロモーター要素と対になっており、ミュラーグリア37に特異的であることが実証されています。
完全に非侵襲的なアプローチで中枢神経系の細胞を観察する能力は、神経回路8の基本特性と神経変性のメカニズムの両方を研究するために使用することができます3,4,5,6,38。多くの失明性疾患は網膜の細胞集団を標的としており、マウスでのin vivoイメージングアプローチは、視神経損傷1、3、4、黄斑変性症13、脳卒中5、緑内障2,6、およびブドウ膜炎7の研究に使用されています。さらに、アルツハイマー病39、多発性硬化症40、パーキンソン病41など、多くの中枢神経系の神経変性状態が網膜に現れます。したがって、網膜のin vivoイメージングのためのこの容易にアクセス可能な技術は、神経変性状態の広範なセットを研究するためのツールとして適用することができる。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、失明予防研究財団(PRWへのキャリア開発賞、セントルイスのワシントン大学医学部眼科および視覚科学科への無制限の助成金)、国立緑内障研究(ブライトフォーカス財団のプログラム)、およびマクドネル細胞分子神経生物学センターからの助成金によってサポートされました。Z.W.は、機関国家研究サービス賞T32 EY013360によってサポートされています。この研究は、ワシントン大学医学部のホープセンターウイルスベクターコアによってもサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| #1.5 coverslip | ThermoFisher | 152440 | Richard-Allan #1.5 24 mm x 40 mm |
| 50 mL glass syringe | Hamilton | 80950 | 22G cemented needle |
| Adeno-associated virus (AAV2) | Hope Center Viral Core | NA | |
| Anesthesia Air Pump | RWD Life Science | R510-30 | |
| Atropine | Sigma | A0132 | For pupil dilator solution |
| Basic Small Animal Anesthesia Device | RWD Life Science | R500IE | |
| Borosilicate glass capillary | Sutter | B150-86-10 | Outside diameter 1.50 mm, inside diameter 0.86 mm, length 10 cm |
| CFP/YFP filter cube | Chroma | custom | 480/40, 505 long pass, 535/30 |
| ChromoFlex - Two channel PMT detection unit | Scientifica | S-MPLG-1002 | |
| Circulating heating pump | Braintree Scientific | tp-700 | Set to 37 °C |
| Cling film | VWR | 10713-916 | |
| Compact Filter Holder | ThorLabs | DH1 | Holds coverslip over mouse eye |
| Cx3cr1-GFP transgenic mice (B6.129P2(Cg)-Cx3cr1tm1Litt/J) | The Jackson Laboratory | 005582 | |
| DAQ controller chassis | National Instruments | PXIe-1073 | |
| Data acquisition device | National Instruments | BNC-2090A | |
| Evans Blue dye | Fisher Scientific | AAA1677409 | |
| FPGA module with digitizer | National Instruments | NI-5734 | |
| Gas Evacuation Apparatus | RWD Life Science | R546W | |
| GenTeal Severe lubricant eye gel | Alcon | (from local pharmacy) | For use during imaging |
| GFP/Red filter cube | Chroma | custom | 535/30, 560 long pass, 605/70 |
| Heating pad | McKesson Medical and Surgical | 190147 | |
| HyperScope Launch Optics for use with Pockels Cell | Scientifica | S-MP-101080 | |
| HyperScope Main module | Scientifica | S-MP-100466 | |
| HyperScope Scan Path | Scientifica | S-MP-100406 | |
| HyperScope X galvo Module | Scientifica | MP-100443 | |
| ImageJ Fiji software | Freeware | ||
| Isoflurane | Patterson Veterinary | NDC 14043-704-06 | |
| Isoflurane gas filter cannister (active scavenging) | RWD Life Science | R510-31 | |
| Isoflurane gas filter cannister (passive scavenging) | RWD Life Science | R510-31S | |
| ketamine HCl (100 mg/mL) | Vedco | NDC 50989-161-06 | |
| M32 to M26 adapter | ThorLabs | M32M26S | |
| MaiTai GUI software | Spectra-Physics | NA | |
| MATLAB software | MathWorks | NA | R2015b |
| meloxicam (5 mg/mL) | Boehringer Ingelheim | NDC 0010-6013-01 | Analgesic |
| Micorscope Objective | Edmund Optics | 46-404 | Mitutoyo WE715042319 |
| micropipette puller | Sutter | Flaming/Brown Model P-97 | |
| Mineral oil | Fisher | BP2629-1 | |
| Mini bulldog hemostatic clamp | Fine Science Tools | 18053-28 | |
| Miniature EVA Tubing 0.02" ID, 0.06" OD | McMaster Carr | 1883T1 | |
| Miniature EVA Tubing 0.05" ID, 0.09" OD | McMaster Carr | 1883T4 | |
| Mouse head holder | Narishige | SGM-4 | |
| No. 5 Forceps | Fine Science Tools | 11251-10 | |
| Optic Posts 1/2" | ThorLabs | TR3-P5 | |
| Optical power meter kit | ThorLabs | PM100D | |
| pE-300 Ultra LLG Deivery | Scientifica | COO-LED3ULLGs | |
| Phenylephrine hydrochloride | Sigma | P6126 | For pupil dilator solution |
| Pockels cell | Conoptics | 350-80-02 | |
| Pockels cell amplifier | Conoptics | Model 302RM | |
| Proparacaine hydrochloride | Sigma | 1571001 | For eye immobilization |
| Red & Far Red short pass filter Cube | Chroma | custom | 560 short pass |
| Rotating 1/2" post clamp | ThorLabs | SWC | |
| ScanImage package | Vidrio Technologies | Freeware | Image acquisition software; Version 5.4.0 (2018); requires MATLAB |
| sodium chloride solution, sterile (0.9%) | Fresenius Kabi | NDC 63323-186-01 | |
| Stereomicroscope | Leica | S9 E | |
| Tabletop centrifuge | Oxford | Benchmate C8 | |
| Terramycin oxytetracycline/polymyxin B antibiotic ophthalmic ointment | Zoetisus | NA | For use after intravitreal injection |
| ThermoRack cooling system | Solid State Cooling Systems | ThermoRack 401 | Set to 20 °C |
| Ultrafast Ti:Sapphire laser | Spectra-Physics | Mai Tai DeepSee | |
| Vgat-Cre transgenic mice (Slc32a1tm2(cre)Lowl/J) | The Jackson Laboratory | 016962 | |
| VGlut2-Cre transgenic mice (Slc17a6tm2(cre)Lowl/J) | The Jackson Laboratory | 016963 | |
| VivoScope for In Vivo Imaging | Scientifica | S-MPVS-1200-00P | |
| White petrolatum-mineral oil lubricant eye ointment | Stye | NA | For use after imaging |
| xylazine HCl (20 mg/mL) | Akorn | NDC 59399-110-20 |
参考文献
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Scientific Reports. 8 (1), 1490 (2018).
- Liu, H., Ding, C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose. Experimental and Therapeutic Medicine. 14 (3), 1953-1960 (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), 40352 (2012).
- Leung, C. K., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Investigative Ophthalmology & Visual Science. 49 (11), 4898-4902 (2008).
- Murata, H., et al. Imaging mouse retinal ganglion cells and their loss in vivo by a fundus camera in the normal and ischemia-reperfusion model. Investigative Ophthalmology & Visual Science. 49 (12), 5546-5552 (2008).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. Journal of Visualized Experiments. (99), e52731 (2015).
- Bremer, D., et al. Longitudinal Intravital Imaging of the Retina Reveals Long-term Dynamics of Immune Infiltration and Its Effects on the Glial Network in Experimental Autoimmune Uveoretinitis, without Evident Signs of Neuronal Dysfunction in the Ganglion Cell Layer. Frontiers in Immunology. 7, 642 (2016).
- Qin, Z., et al. Adaptive optics two-photon microscopy enables near-diffraction-limited and functional retinal imaging in vivo. Light: Science & Applications. 9, 79 (2020).
- Schallek, J., Geng, Y., Nguyen, H., Williams, D. R. Morphology and topography of retinal pericytes in the living mouse retina using in vivo adaptive optics imaging and ex vivo characterization. Investigative Ophthalmology & Visual Science. 54 (13), 8237-8250 (2013).
- Williams, D. R. Imaging single cells in the living retina. Vision Research. 51 (13), 1379-1396 (2011).
- Carroll, J., Neitz, M., Hofer, H., Neitz, J., Williams, D. R. Functional photoreceptor loss revealed with adaptive optics: an alternate cause of color blindness. Proceedings of the National Academy of Sciences of the United States of America. 101 (22), 8461-8466 (2004).
- Rossi, E. A., et al. Imaging retinal mosaics in the living eye. Eye. 25 (3), 301-308 (2011).
- Rossi, E. A., et al. In vivo imaging of retinal pigment epithelium cells in age related macular degeneration. Biomedical Optics Express. 4 (11), 2527-2539 (2013).
- Geng, Y., et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 3 (4), 715-734 (2012).
- Thestrup, T., et al. Optimized ratiometric calcium sensors for functional in vivo imaging of neurons and T lymphocytes. Nature Methods. 11 (2), 175-182 (2014).
- Takeda, A., et al. Microglia mediate non-cell-autonomous cell death of retinal ganglion cells. Glia. 66 (11), 2366-2384 (2018).
- Ikeda, W., Nakatani, T., Uemura, A. Cataract-preventing contact lens for in vivo imaging of mouse retina. Biotechniques. 65 (2), 101-104 (2018).
- Palczewska, G., Kern, T. S., Palczewski, K., Weber, B. H. F., Langmann, T. Noninvasive two-photon microscopy imaging of mouse retina and retinal pigment epithelium. Retinal Degeneration. Methods in Molecular Biology. 1834, 333-343 (2019).
- Wahl, D. J., Jian, Y., Bonora, S., Zawadzki, R. J., Sarunic, M. V. Wavefront sensorless adaptive optics fluorescence biomicroscope for in vivo retinal imaging in mice. Biomedical Optics Express. 7 (1), 1-12 (2016).
- Park, S. W., Kim, J. H., Park, W. J., Kim, J. H. Limbal approach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium. Journal of Visualized Experiments. (102), e53030 (2015).
- Biss, D. P., et al. In vivo fluorescent imaging of the mouse retina using adaptive optics. Optics Letters. 32 (6), 659-661 (2007).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A mouse model for laser-induced choroidal neovascularization. Journal of Visualized Experiments. (106), e53502 (2015).
- Palczewska, G., et al. Human infrared vision is triggered by two-photon chromophore isomerization. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5445-5454 (2014).
- Euler, T., et al. Eyecup scope--optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Archive-European Journal of Physiology. 457 (6), 1393-1414 (2009).
- Zhang, Y., et al. Elevating Growth Factor Responsiveness and Axon Regeneration by Modulating Presynaptic Inputs. Neuron. 103 (1), 39-51 (2019).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Akimoto, M., et al. Transgenic mice expressing Cre-recombinase specifically in M- or S-cone photoreceptors. Investigative Ophthalmology & Visual Science. 45 (1), 42-47 (2004).
- Brightman, D. S., Razafsky, D., Potter, C., Hodzic, D., Chen, S. Nrl-Cre transgenic mouse mediates loxP recombination in developing rod photoreceptors. Genesis. 54 (3), 129-135 (2016).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85 (6), 1244-1256 (2015).
- Ecker, J. L., et al. Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron. 67 (1), 49-60 (2010).
- Kim, I. J., Zhang, Y., Yamagata, M., Meister, M., Sanes, J. R. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452 (7186), 478-482 (2008).
- Akrouh, A., Kerschensteiner, D. Morphology and function of three VIP-expressing amacrine cell types in the mouse retina. Journal of Neurophysiology. 114 (4), 2431-2438 (2015).
- Zhu, Y., Xu, J., Hauswirth, W. W., DeVries, S. H. Genetically targeted binary labeling of retinal neurons. Journal of Neuroscience. 34 (23), 7845-7861 (2014).
- Lu, Q., et al. AAV-mediated transduction and targeting of retinal bipolar cells with improved mGluR6 promoters in rodents and primates. Gene Therapy. 23 (8-9), 680-689 (2016).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Research. 48 (3), 353-359 (2008).
- Yao, K., et al. Wnt regulates proliferation and neurogenic potential of Muller glial cells via a Lin28/let-7 miRNA-dependent pathway in adult mammalian retinas. Cell Reports. 17 (1), 165-178 (2016).
- Williams, P. R., et al. A recoverable state of axon injury persists for hours after spinal cord contusion in vivo. Nature Communications. 5, 5683 (2014).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's & Dementia. 10 (2), 135-142 (2014).
- Kerrison, J. B., Flynn, T., Green, W. R. Retinal pathologic changes in multiple sclerosis. Retina. 14 (5), 445-451 (1994).
- Sung, M. S., et al. Inner retinal thinning as a biomarker for cognitive impairment in de novo Parkinson's disease. Scientific Reports. 9 (1), 11832 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved