Method Article
Транспупиллярная двухфотонная визуализация сетчатки мыши In vivo
В этой статье
Резюме
Визуализация in vivo является мощным инструментом для изучения биологии в области здравоохранения и болезней. Этот протокол описывает транспупиллярную визуализацию сетчатки мыши с помощью стандартного двухфотонного микроскопа. Он также демонстрирует различные методы vivoimaging для флуоресцентной маркировки нескольких клеточных когорт сетчатки.
Аннотация
Сетчатка преобразует световые сигналы из окружающей среды в электрические сигналы, которые распространяются на мозг. Заболевания сетчатки распространены и вызывают нарушения зрения и слепоту. Понимание того, как прогрессируют такие заболевания, имеет решающее значение для разработки новых методов лечения. Микроскопия in vivo на животных моделях заболеваний является мощным инструментом для понимания нейродегенерации и привела к важному прогрессу в лечении состояний, начиная от болезни Альцгеймера до инсульта. Учитывая, что сетчатка является единственной структурой центральной нервной системы, по своей природе доступной оптическими подходами, она, естественно, поддается визуализации in vivo. Тем не менее, нативная оптика линзы и роговицы представляет некоторые проблемы для эффективного доступа к изображениям.
В этом протоколе описываются методы двухфотонной визуализации in vivo клеточных когорт и структур в сетчатке мыши с клеточным разрешением, применимые как для экспериментов с визуализацией острой, так и для хронической продолжительности. В нем представлены примеры визуализации ганглиозных клеток сетчатки (RGC), амакриновых клеток, микроглиальной и сосудистой визуализации с использованием набора методов маркировки, включая векторы аденоассоциированного вируса (AAV), трансгенных мышей и неорганические красители. Важно отметить, что эти методы распространяются на все типы клеток сетчатки, и описаны предлагаемые методы доступа к другим интересующим клеточным популяциям. Также подробно приведены примеры стратегий постобработки изображений вручную для отображения и количественной оценки. Эти методы непосредственно применимы к исследованиям функции сетчатки в здоровье и болезнях.
Введение
Визуализация in vivo центральной нервной системы обычно требует инвазивных процедур, таких как истончение черепа и установка стеклянных окон или оптических релейных линз. Сетчатка является единственной структурой в нервной системе, которую можно непосредственно наблюдать без необходимости инвазивной подготовки, поскольку она изначально получает свет из окружающей среды. Легкость оптического доступа к сетчатке делает ее привлекательной модельной системой для изучения центральной нервной системы.
Живая флуоресцентная визуализация сетчатки у мышей использовалась для отслеживания смерти RGC в моделях глаукомы 1,2, повреждения зрительного нерва 1,3,4 и инсульта5, а также изменений в активации микроглии 6,7,8 и сосудистой системы9 в дегенеративных условиях. Внутренние сигналы также могут быть использованы для визуализации фоторецепторов 10,11,12 и пигментных эпителиальных клеток сетчатки13. Многие подходы к визуализации сетчатки in vivo используют либо узкоспециализированные устройства, специально разработанные для офтальмологических целей6, либо сильно модифицированные оптические системы для коррекции нативных аберраций роговицы и хрусталика 8,9,11,12,13,14.
Настоящий протокол демонстрирует подход к визуализации in vivo флуоресцентных сигналов в сетчатке с клеточным разрешением, используя базовый метод частичной коррекции передней оптики глаза мыши. Эта стратегия требует очень незначительных адаптаций к настройкам многофотонного микроскопа, которые обычно используются для визуализации мозга in vivo. Поскольку этот подход прост в настройке, и мыши находятся под небольшим стрессом, он способствует проведению покадровых экспериментов как в острых, так и в хронических периодах. Кроме того, генетические и органические процедуры на основе красителей, которые маркируют отдельные компоненты сетчатки, включая RGC, амакриновые клетки, микроглию и сосудистую систему, совместимы с этим методом визуализации и позволяют in vivo наблюдать типы клеток и структуры, критически важные для функции сетчатки. Эти инструменты могут быть адаптированы для маркировки большинства других типов нейронных клеток, а также глиальных и сосудистых компонентов сетчатки.
протокол
ПРИМЕЧАНИЕ: Следующая процедура была выполнена в соответствии с руководящими принципами Институционального комитета по уходу за животными и их использованию в Вашингтонском университете в Сент-Луисе. Смотрите Таблицу материалов для получения подробной информации о реагентах, оборудовании и животных, используемых в этом исследовании.
1. Инъекция аденоассоциированного вируса
ПРИМЕЧАНИЕ: Маркировка специфических клеток в сетчатке может быть выполнена в трансгенных линиях мыши Cre с ограниченными паттернами экспрессии. В этом разделе описывается интравитреальная доставка AAV-векторов, которые кодируют Cre-зависимую экспрессию флуоресцентного белка, таким образом маркируя специфические клетки сетчатки. Вводят мышам (самцам и самкам), начиная с 4-недельного возраста.
- Подготовка иглы микропипетки
- Используйте съемник микропипетки для создания боросиликатной стеклянной капиллярной иглы. Загрузите стеклянный капилляр в съемник микропипетки и выполните тест рампы, записав полученное значение. Выбросьте стеклянный капилляр, используемый для теста Рампы.
- Вытягивайте микропипетки со следующими настройками: тепло: Значение теста Рампы минус 10; тяга: 55; скорость: 65; время: 120; давление воздуха: 500; эфирное время в начале вытягивания: 20.
ПРИМЕЧАНИЕ Возможно, потребуется настроить параметры для разных съемников. - Под рассекающим микроскопом используйте лезвие бритвы, чтобы разрезать кончик вытянутой микропипетки в том месте, где кончик стекла слегка отклоняется под усилием, ~ 10 мм от конца конического сечения. Режьте под острым углом так, чтобы разрез производил скошенный наконечник. Отбросьте тупые кончики.
- Подготовка инъекционного шприца
- Поместите разрезанную стеклянную микропипетку в 2-сантиметровый сегмент пластиковой трубки этилэвинилацетата (EVA) (внутренний диаметр 0,05 дюйма, наружный диаметр 0,09 дюйма). Подключите другой конец этого сегмента трубки к трубе EVA длиной 20 см (внутренний диаметр 0,02 дюйма, наружный диаметр 0,06 дюйма).
- Подключите трубку к стеклянному шприцу объемом 50 мкл с помощью цементированной иглы весом 22 г. Снимите поршень со стеклянного шприца и засыпьте шприц и соедините трубку с минеральным маслом с помощью иглы шприца весом 25 г. Оставьте 4 мм воздушного пространства на кончике микропипетки.
- Интравитреальная инъекция AAV
- Выполняйте интравитреальную инъекцию стандартной асептической техникой, используя стерильные хирургические перчатки, чистый лабораторный халат, маску, стерильное поле и автоклавные инструменты в соответствии с институциональными протоколами для хирургии выживания.
- Удалите аликвоту вектора AAV из хранилища при -80 °C и оттаивайте на льду. После размораживания центрифугируют в течение 10 с при 2000 × г , чтобы удалить пузырьки воздуха.
- Следуйте рекомендациям по анестезии и контролируемым веществам институционального Комитета по исследованиям животных. Используя иглу для подкожных инъекций 30 г, выполните внутрибрюшинную инъекцию кетамина/ксилазина с массой тела 0,1 мл/10 г массы тела (10 мг/мл кетамина, 1 мг/мл ксилазина в физиологическом растворе, эффективная доза для мышей: 100 мг/кг кетамина, 10 мг/кг ксилазина). Верните мышь в клетку и дайте 5 минут, чтобы анестезия вступила в силу.
- Используя подкожную иглу 30 г, выполните подкожную инъекцию мелоксикама 0,1 мл / 10 г массы тела (0,5 мг / мл в 0,9% хлорида натрия).
- Проверьте глубину анестезии, подтвердив потерю рефлекса роговицы и рефлекса отмены на защемление хвоста и пальца ноги. Если рефлекс роговицы сохраняется после потери рефлекса отмены хвоста и пальца ноги, нанесите каплю 0,5% раствора пропаракаина на каждый глаз и подождите 10 с.
- Поместите мышь на бок под стереомикроскоп. Используйте гемостатический зажим мини-бульдога, чтобы захватить кожу выше и ниже орбиты, и закрепите зажим на медиальном кантусе, чтобы частично вытеснить земной шар с орбиты.
- Прокол боковой склеры с помощью вырезанной микропипетки, соединенной со стеклянным шприцем, ~1-2 мм сзади к лимбу. Избегайте нарушения сосудистой системы, которая проходит по окружности непосредственно позади лимбуса. Выполните прокол под углом, перпендикулярным склере, и слегка втяните микропипетку сразу после прокалывания склеры, чтобы избежать повреждения хрусталика.
- Используйте поршень стеклянного шприца для вывода 1-2 мкл стекловидного тела, что примерно соответствует объему жидкости, предназначенной для инъекций. Извлеките микропипетку из глаза и выбросьте удаленную стекловидную влагу.
- Заполните кончик микропипетки 1-2 мкл AAV, оставив ~ 4 мм воздушного пространства между вирусным вектором и минеральным маслом, чтобы избежать смешивания. Вставьте микропипетку в отверстие в склере, созданное первым проколом, и медленно нажмите на поршень стеклянного шприца, чтобы ввести вирусный вектор в течение 20-30 с. Визуализируйте уровень жидкости вирусного вектора в кончике микропипетки и будьте осторожны, чтобы прекратить инъекции до того, как какой-либо воздух попадет в глаз.
- Удерживайте микропипетку в одном и том же положении в течение 10 с, затем уберите микропипетку. Снимите с бульдога гемостатический зажим.
- Наносите окситетрациклин/полимиксин В антибиотиком офтальмологическую мазь на вводимый глаз. Поместите мышь на грелку и следите за ее восстановлением после анестезии (см. 3.4.3).
- Верните мышь в ее жилище и выполните послеоперационный уход в соответствии с институциональными рекомендациями. Дайте 2-3 недели для вирусно-опосредованной экспрессии флуорофоров перед визуализацией.
2. Настройка микроскопа
ПРИМЕЧАНИЕ: Схема светового пути микроскопа показана на рисунке 1.
- Оборудование "Always-On": Эти приборы должны всегда оставаться включенными, если они не подвергаются регулировке или техническому обслуживанию. Установите высокую температуру лазерной системы охлаждения на 20,0 °C. Включите основное питание сверхбыстрого ti:Sapphire лазера, дайте время для завершения процессов запуска системы и поверните клавишу «Laser Enable» в положение «On».
- Конфигурация траектории излучения света
- Настройте путь сбора флуоресцентного излучения для длин волн образца с помощью соответствующих дихроичных и полосовых фильтров для интересующих флуорофоров.
ПРИМЕЧАНИЕ: В этой рукописи в визуализации Twitch2b использовался куб фильтра, состоящий из 505 дихроичных и 480/40 и 535/30 полосовых пар фильтров. GFP был сфотографирован с использованием красного/зеленого куба фильтра, состоящего из 560 длиннопроходного фильтра с полосовыми фильтрами 525/50 и 605/70. Эванс Блю был сфотографирован с использованием фильтра 560 коротких проходов. Изменение эмиссионных фильтров подвергает путь излучения свету блуждающего комнатного света, который может повредить фотоумножительные трубки (PMT). Убедитесь, что PMT выключены, и выключите свет в комнате перед изменением траектории сбора света, так как воздействие света может негативно повлиять на функцию PMT.
- Настройте путь сбора флуоресцентного излучения для длин волн образца с помощью соответствующих дихроичных и полосовых фильтров для интересующих флуорофоров.
- Запуск сбора изображений
ПРИМЕЧАНИЕ: Прямое воздействие двухфотонного лазера опасно, особенно для глаза, так как дальний красный свет не вызовет реакцию моргания. Следует соблюдать надлежащую осторожность, чтобы гарантировать, что лазер закрыт вдоль светового пути, а отказоустойчивые средства на месте для защиты пользователя от воздействия через окуляры или излучения от объектива микроскопа. Пользователи должны понимать, при каких условиях лазер будет излучать объектив, и принимать надлежащие меры предосторожности, чтобы не подвергать себя таким опасностям.- Включите устройство сбора данных, компьютер, ячейку Pockels, микроскоп и контроллер сцены, механический контроллер затвора и основной источник питания PMT. Держите PMT в состоянии «Отключено» до тех пор, пока они не будут готовы к получению изображения и защищены от рассеянного света. Откройте интерфейс лазерного управления на компьютере и программное обеспечение для получения изображений. Включите лазер от интерфейса компьютера и обеспечьте блокировку режима.
- Установите нужную длину волны лазера. Убедитесь, что лазерный свет проникает в ячейку Pockels, открыв лазерный затвор, и дайте 30 минут для стабилизации мощности лазера.
- Измерение мощности лазера на объекте и установка максимального процента лазера
ПРИМЕЧАНИЕ: Лазерное излучение излучается объективом во время измерения мощности. Закройте занавеску корпуса микроскопа и наденьте соответствующую защиту глаз перед включением затвора. Измерьте мощность лазера во время первоначальной установки системы, чтобы установить кривую выходной мощности для каждой интересующей длины волны, и ежемесячно после этого, чтобы проверить стабильность мощности возбуждения.- Включите измеритель оптической мощности и выберите длину волны измерения, соответствующую длине волны лазера. Поместите детектор измерителя оптической мощности на ступень микроскопа и маневрируйте им непосредственно под объективом в измерениях X-Y. Используя Z-образный моторизованный привод фокусировки, опустите объектив до тех пор, пока детектор измерителя мощности не окажется примерно на 1 мм ниже объектива.
- Переключитесь с эпифлуоресцентного освещения на лазер в качестве светового пути возбуждения микроскопа. Включите механический затвор.
- В программном обеспечении для получения изображений запустите точечное сканирование, чтобы открыть затвор изображения, и отправьте лазер на измеритель оптической мощности. Установите мощность лазера на 100% в программном обеспечении сканирования. Оптимизируйте положения X-Y и Z детектора измерителя мощности до тех пор, пока не будет достигнуто максимальное измерение мощности лазера.
- Измерьте мощность лазера на объективе от 0,1% до 100% на ячейке Поккельса, проводя измерения с интервалом 10%. Запишите процент ячейки Pockels, соответствующий 45 мВт мощности на объекте. Установите этот процент в качестве максимальной мощности лазера в программном обеспечении для получения изображений.
ПРИМЕЧАНИЕ: Наибольшая мощность, наблюдаемая для визуализации сетчатки мышей in vivo без видимого повреждения ткани-мишени, составила 45 мВт, что было проанализировано гистологическим окрашиванием через две недели после визуализации. Очевидное повреждение сетчатки проявляется после визуализации с 55 мВт на объективе. - Отключите затвор изображения и верните световой путь возбуждения к эпифлуоресценции.
3. Подготовка мыши к получению изображения
- Анестезирующая мышь для визуализации
ПРИМЕЧАНИЕ: Обеспечить надлежащую очистку отработанных газов для смягчения воздействия изофлурана. Убедитесь, что выхлопное отверстие индукционной камеры анестезии подключено к пассивной канистре для фильтрации газа, а выходное отверстие носа анестезии мыши соединено с канистратором активного фильтра для очистки газа с вакуумом, обеспечиваемым аппаратом для откачки газа. Следуйте рекомендациям производителя по контролю веса канистры фильтра для замены.- Обезболить мышь с помощью коктейля кетамин/ксилазин, как описано выше на этапе 1.3.3. Альтернативно, индуцировать анестезию с помощью ингаляции изофлурана, если также использовать изофлуран для поддержания анестезии (сеанс визуализации > 30 мин). Установите устройство для анестезии мелких животных, чтобы заполнить индукционную камеру 5% изофлураном, смешанным с воздухом в помещении со скоростью потока 0,5 л/мин. Поместите мышь в индукционную камеру и дайте мыши 15 с, чтобы мышь стала анестезированной.
- Переключите испаритель изофлурана на 0% и направьте поток анестезии на носовую часть. Выполните 5-секундный «O2 смыв» индукционной камеры. Выньте мышь из индукционной камеры и закрепите ее в головном держателе (см. раздел 3.3), прикрепив носовую часть.
- Для поддержания анестезии используют смесь 1% изофлурана с комнатным воздухом со скоростью потока 0,5 л/мин. Контролируйте частоту дыхания с интервалом в 5 минут на протяжении всей анестезии, регулируя процентное содержание изофлурана для поддержания частоты дыхания ~ 60 вдохов / мин.
ПРИМЕЧАНИЕ: Эти настройки (% изофлурана, скорость потока) также могут быть использованы для поддержания анестезии, вызванной коктейлем кетамин/ксилазин.
- Расширение зрачка
- Готовят раствор 1% мас./об.атропина и 2,5% мас./об.фенилэфрина гидрохлорида в воде. Храните раствор расширителя при комнатной температуре, защищенной от света.
- Используя одноразовую пипетку для глаз, нанесите каплю раствора расширителя на каждый глаз, который будет изображен. Выключите свет в комнате и подождите 5 минут, пока зрачок расширится. Когда зрачок будет расширен, смойте раствор расширителя безворсовой тканью.
ПРИМЕЧАНИЕ: Убедитесь, что раствор расширителя не попадает в ноздри. - Нанесите большую каплю смазочного геля для глаз на каждый глаз, который будет изображен. Если оба глаза должны быть изображены, нанесите небольшой кусочек пластиковой пищевой пленки на глазной гель на глаз без визуализации, чтобы предотвратить обезвоживание. Если только визуализация одного глаза, нанесите смазочную глазную мазь на глаз, которая не будет изображена.
- Позиционирование мыши для создания изображений
- Чтобы закрепить мышь в держателе головки для визуализации, поверните основной рычаг держателя головы до тех пор, пока наушник не будет наклонен под углом 60° или более ниже горизонтали. Закрепите штифт нижнего слухового прохода в расширенном положении внутрь и штифт верхнего слухового прохода в отведенном положении.
- Повернув мышь лицом к стойке укуса, установите одно ухо на расширенный нижний штифт, вставив штифт в ушной канал. Ослабьте винт, закрепляющий штифт верхнего слухового прохода, и протяните штифт в другой ушной канал. Затяните винт, чтобы закрепить головку.
- Сдвиньте полоску укуса к голове мыши. Осторожно поднимите головку мыши, затем опустите верхнечелюстные резцы мыши в отверстие прикуса. Втяните штангу с мягкой силой, чтобы закрепить голову мыши, и закрепите положение прикуса, затянув винт.
- При использовании изофлурана проведите носовой частью через ее прорезь на стержень укуса, прежде чем закрепить резцы мыши. Закрепите и затяните положение прикуса, как на этапе 3.3.3. Затяните носовую часть с помощью двух винтов на верхней части лица, пока она плотно не прилегает к носу мыши, но не сжимает морду.
- Переместите мышь в держателе головы на ступень микроскопа под целью. Поверните основной рычаг держателя головы до тех пор, пока зрачок глаза не будет ориентирован прямо вверх, в соответствии с траекторией света (рисунок 2).
- Поместите крышку No1.5 в компактный фильтродержатель и прикрепите держатель к ступени микроскопа. Опустите покров по направлению к глазу, контактируя со смазочным гелем для глаз таким образом, чтобы крышка лежала горизонтально непосредственно над роговицей (рисунок 2). Убедитесь, что крышка не касается роговицы.
ПРИМЕЧАНИЕ: На микроскопе убедитесь, что путь света возбуждения установлен на эпифлюоресценцию, а путь излучения света установлен на окуляр. Включите эпифлуоресцентный осветитель с наименьшей мощностью и откройте затвор осветителя. Выберите длину волны эпифлуоресцентного осветителя и флуоресцентный фильтр, соответствующий изображаемому флуорофору. - Маневрируйте сценой в размерах X-Y и объективом в Z-положении с помощью управления ступенью и моторизованного привода фокусировки до тех пор, пока широкоугольный свет возбуждения полностью не покроет роговицу. Глядя через окуляр, продолжайте корректировать Z-положение ступени до тех пор, пока флуоресцентные клетки или структуры в сетчатке не попадут в фокус. Увеличьте мощность эпифлуоресцентного осветителя, если сигнал образца недостаточно яркий для разрешения отдельных клеток или структур, представляющих интерес, через окуляр.
ПРИМЕЧАНИЕ: Если у вас возникли проблемы с определением местоположения сетчатки, радужная оболочка является высококонтрастным ориентиром для закрепления, а затем фокусировки вниз к сетчатке. Этот шаг также позволит проверить, что зрачок максимально расширен. - Получите область изображения на оси с помощью объектива мыши. Отрегулируйте угол наклона мыши, используя различные степени свободы на держателе головы, пока при регулировке фокальной плоскости не произойдет только расширение или сжатие нефокусированного света. Выключите эпифлуоресцентный осветитель и закройте затвор осветителя.
ПРИМЕЧАНИЕ: Значительный параллакс X-Y рассеянного света при прокрутке через Фокальные плоскости Z-направления указывает на то, что сетчатка не находится на оси относительно светового пути изображения.
4. Получение двухфотонных изображений
- Параметры настройки и получения изображений
ПРИМЕЧАНИЕ: Выключите свет в комнате и закройте случайные источники света в комнате. Убедитесь, что эпифлуоресцентный осветитель выключен, а затвор осветителя закрыт.- Переключите путь света возбуждения на лазер и путь излучения света на PMT.
- В программном обеспечении для получения изображений установите размер кадра 512 x 512 и среднее значение кадра 3. Задайте для каждого фрагмента значение -8 мкм. Назначьте z-степпинг для начала в верхней части стека и продвижения вниз, сводя к минимуму двухфотонную лазерную активацию фоторецепторов.
ПРИМЕЧАНИЕ: Размер шага может быть уменьшен для увеличения Z-разрешения за счет увеличения времени визуализации, но 8 мкм шагов достаточно для разрешения клеточной соматы в этой конфигурации визуализации. - Включите и включите PMT. Отрегулируйте напряжение PMT до 680 В. Включите затвор возбуждения.
ПРИМЕЧАНИЕ: PmT с электроприводом подвержены световым повреждениям. Убедитесь, что эпифлуоресцентный осветитель выключен, занавеска корпуса микроскопа задернута, а свет в комнате выключен. - Начните предварительный просмотр живого изображения ткани-мишени, начиная с 1% мощности лазера. Автоматическая регулировка яркости дисплея для визуализации интересующих ячеек или структур. Автоматическая настройка фазы сканирования. Если ткань-мишень тусклая или неясная, увеличивайте процент мощности лазера до тех пор, пока структуры не станут видимыми, не превышая предела, установленного на шаге 2.4.4, соответствующего 45 мВт.
ПРИМЕЧАНИЕ: Для 16-битного изображения отображаемое значение ~1000 при автоматической регулировке яркости в Z-плоскости, содержащей интересующие структуры, указывает на достаточную яркость образца. - Маневрируйте ступенью микроскопа в направлении X-Y, чтобы сосредоточиться на желаемой области изображения, а затем перейдите к Z-плоскости с интересующими структурами в фокусе.
ПРИМЕЧАНИЕ: Визуализация, прилегающая к головке зрительного нерва, позволяет ему служить однозначным ориентиром для экспериментов с хронической визуализацией. - Если это хронический покадровый эксперимент, откройте предыдущее изображение на компьютере сбора и используйте его в качестве ссылки, чтобы найти ту же область интереса. Убедитесь, что угол изображения аналогичен углу предыдущих изображений, чтобы получить тот же набор клеток с минимальным параллаксом.
ПРИМЕЧАНИЕ: Для отображения тех же ячеек, что и в предыдущих точках времени, вероятно, потребуется дальнейшая корректировка положения головки мыши (рисунок 3). - Установите Z-пределы стека изображений, перейдя к самой верхней и самой нижней Z-плоскостям, представляющим интерес, и получите изображение. По завершении получения изображения отключите PMT и эмиссионный затвор. Переключите путь излучения света обратно на окуляр, а путь света возбуждения на эпифлуоресцентное освещение. Извлеките мышь из стадии микроскопа.
- Отключение системного программного и аппаратного обеспечения
- Закройте программное обеспечение для получения изображений. Выключите лазер в интерфейсе компьютера. Выключите оборудование в обратном порядке запуска, за исключением оборудования «Always-On».
- Восстановление мыши
- Снимите держатель головы и мышь со сцены микроскопа. Если применимо, установите испаритель изофлурана на 0%. Извлеките мышь из держателя головы.
- Аккуратно протрите смазочный гель для глаз без ворса и нанесите белую вазелиново-минеральную мазь для глаз на оба глаза. Поместите мышь на грелку с теплой водой (установленную при 37 ° C), продолжайте следить за мышью и следить за ее частотой дыхания, пока мышь не проснется и не восстановит амбулаторную способность. Верните мышь в корпус.
- Если применимо, оцените активность и заболеваемость животных через 24 ч после интравитреальной инъекции. По завершении исследования усыпляют мышь с передозировкой трибромэтанола (250 мг/кг) и выполняют транскардиальную перфузию с 4% параформальдегидом для сохранения ткани сетчатки.
5. Обработка и анализ изображений
- Объединение и объединение многоканальных данных
- Поскольку некоторые программы для сбора изображений хранят многоканальные изображения в чередующемся формате, откройте файл изображения .tif с помощью программного обеспечения, такого как Fiji (https://imagej.net/Fiji), чтобы разделить каналы.
- В меню Изображение Фиджи выберите Стеки | Инструменты | Деинтерлив. Введите количество каналов, составляющих изображение, и нажмите кнопку ОК.
- Чтобы объединить разделенные каналы в один файл, перейдите в раздел Изображение | Цвет | Объединение каналов. Поместите каналы изображения с расшифровкой в отдельные цветовые каналы и нажмите кнопку ОК , чтобы создать многоканальное составное изображение. Сохраните это составное изображение как новый файл .tif.
- Количественная оценка интенсивности флуоресценции в многоканальных изображениях
ПРИМЕЧАНИЕ: Интенсивность флуоресценции в определенных областях, представляющих интерес (ROI), может быть количественно определена в плоскостях с одним изображением с использованием Фиджи. Количественная оценка ратиометрических показаний может быть достигнута путем измерения интенсивности флуоресценции в разных каналах композитного изображения в пределах одной и той же рентабельности инвестиций. Для экспериментов с хронической визуализацией лучше всего использовать биосенсоры, основанные на возбуждении или эмиссии ратиометрических выходов.- На Фиджи перейдите в раздел Анализ | Инструменты | Менеджер по окупаемости инвестиций. Откройте составное изображение на Фиджи. Прокрутите до z-фрагмента, соответствующего интересующей структуре, и используйте инструменты «Выделение» (например, «Выделение прямоугольника», «Овальное выделение», «Многоугольник») для выравнивания roi.
- Нажмите клавишу T на клавиатуре, чтобы добавить каждый выбор в диспетчер окупаемости инвестиций. После завершения выбора ROI нажмите «Измерить» в менеджере ROI , чтобы записать различные данные из ROI, такие как значение Area и Mean Intensity.
- Скопируйте измерения для выбранного в данный момент канала, записанные в окне Результаты , в электронную таблицу. Переключитесь на следующий канал в окне составного изображения и нажмите « Измерить», чтобы получить измерения для этого канала в пределах того же набора ROI. В разделе Менеджер окупаемости инвестиций перейдите в раздел Дополнительно | Сохраните и сохраните ROI в виде файла .zip.
- Проекции максимальной интенсивности для отображения
- Для создания отображения данных изображения используйте функцию Z-project на Фиджи. В меню Изображение выберите Стек | Z проект. Выбирайте только те кадры, в которых присутствуют интересующие области, чтобы уменьшить фон.
- Если требуется удалить шум выстрела PMT, используйте функцию медианного фильтра. В меню Процесс выберите Процесс | Фильтры | Медиана. Выберите значение 1,0 для сохранения пространственных деталей.
- Чтобы создать проекции максимальной интенсивности, сфокусированные на отдельных ячейках, повторите этот процесс, выбрав только те кадры изображения, которые соответствуют интересующей ячейке.
ПРИМЕЧАНИЕ: Это может значительно улучшить способность разрешать клеточные беседки (рисунок 4). Измерения интенсивности флуоресценции должны проводиться в плоскостях с одним изображением, а не на проекциях максимальной интенсивности.
Результаты
Различные трансгенные, вирусные векторные или неорганические подходы к маркировке красителей могут быть использованы для специфической визуализации нескольких типов клеток и структур сетчатки in vivo с использованием простой адаптации базового многофотонного микроскопа. Для визуализации RGC и амакриновых клеток трансгенным мышам VGlut2-Cre и VGat-Cre, соответственно, была сделана интравитреальная инъекция Cre-зависимой конструкции экспрессии AAV, кодирующей Twitch2b, датчик Ca2+ на основе цитоплазматического флуоресцентного резонансного переноса энергии (FRET), который содержит голубые и желтые флуоресцентные белки (CFP и YFP, соответственно) и домен связывания Ca2+ тропонина15 . У мышей VGlut2-Cre сомы RGC хорошо различимы, а фасцикулы аксонов часто очевидны (рисунок 3).
Следует отметить, что траектория аксонов и негативное изображение сосудистой системы делает очень простым идентифицировать головку зрительного нерва у мышей VGlut2-Cre, что полезно в качестве ориентира в экспериментах по хронической визуализации (рисунок 3). Хотя амакриновые клетки кажутся менее яркими, чем RGC, возможно, из-за их меньшего размера сомы и / или менее эффективной трансдукции AAV, их сомы все еще легко проявляются во внутреннем ядерном слое. В отличие от RGC, нейриты амакриновых клеток чаще наблюдаются во внутренних плексиформных слоях (рисунок 4). Микроглия сетчатки может быть изображена в трансгенной мыши Cx3cr1-GFP линии6. Микроглия связывается с сосудистой системой, что позволяет найти одну и ту же область в экспериментах по покадровой визуализации.
Этот подход может быть использован для отслеживания динамики процессов тонкой микроглии, процедура, которая имеет лучшее пространственное разрешение на одноплоскостных изображениях, или если подготовлены проекции максимальной интенсивности, фокусирующиеся на отдельных клетках (рисунок 5). Плохое осевое разрешение, вызванное оптической аберрацией через линзу мыши, исключает исследование мелких деталей в z-измерении. Чтобы определить, может ли этот метод визуализации наблюдать дегенеративные изменения в клеточной ультраструктуре, 1 мкл 50 мМ N-метил-D-аспартата (NMDA) вводили в стекловидное тело, чтобы вызвать экситотоксическое поражение. Через день после инъекции микроглия продемонстрировала короткие процессы или морфологию амебоидов (рисунок 5) в соответствии с предыдущими отчетами16. Следует отметить, что клетки трансгенной линии Cx3cr1-GFP демонстрировали более однородную и полную флуоресцентную экспрессию белка в клеточной когорте, чем в экспериментах с AAV-опосредованной доставкой флуоресцентных кассет экспрессии белка. Преимущества разнообразной и разреженной по сравнению с полной и единообразной маркировкой следует учитывать при разработке экспериментов.
Чтобы маркировать сосудистую систему сетчатки, какописано ранее 8, мышам вводили внутрибрюшинно 200 мкл синего красителя Эванса (20 мг / мл в стерильном физиологическом растворе) за 30-60 минут до визуализации. Это привело к сильной маркировке кровеносных сосудов, исходящих из головки зрительного нерва (рисунок 6). Удивительно, но флуоресцентный сигнал одной инъекции сохранялся не менее семи дней. Для оценки размеров изображений in vivo использовались два различных метода. Во-первых, те же области сетчатки были изображены in vivo и после фиксации в уплощенных цельных горах сетчатки с помощью конфокальной микроскопии (рисунок 7). Случайные пары клеток были выбраны из четырех различных образцов in vivo, а истинное расстояние между парами клеток было измерено в конфокальном сканировании и сопоставлено с расстоянием пикселей in vivo для получения среднего размера пикселя 0,99 мкм с 1-кратным цифровым увеличением. Использование аналогичных методов, коррелирующих изображения in vivo с конфокальным сканированием цельного расстояния, показало, что одно положение головы позволяет получать изображения на участке сетчатки размером примерно 650мм2 мм.
Изменение положения держателя головы вдоль одной оси кручения может обеспечить доступ к линейной области сетчатки длиной 2,2 мм (не показано). Кроме того, флуоресцентные микросферы диаметром 1 или 2 мкм вводили в глаза мышей, и их диаметр измеряли как половину максимальной ширины линейного сканирования из изображений in vivo с 10-кратным цифровым зумом. Это дало немного большую оценку размера пикселя, но с большей дисперсией (рисунок 7). В целом, конфокальная визуализация цельных образцов после завершения экспериментов in vivo является наиболее последовательным методом присвоения масштаба отдельным изображениям, поскольку дисперсия свойств роговицы и линзы может изменить масштаб изображения от образца к образцу.
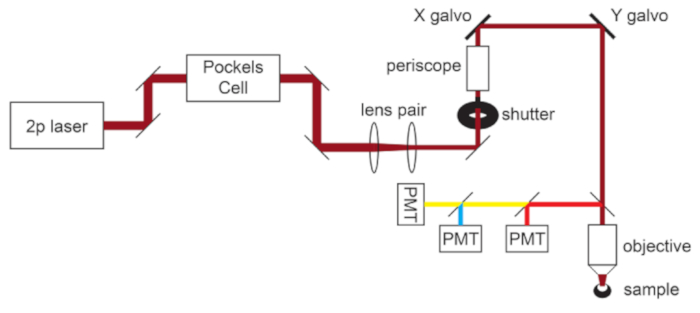
Рисунок 1: Схема светового пути. Основные компоненты двухфотонного микроскопа, используемого в этом протоколе, состоят из ячейки Поккельса для модуляции мощности лазера, пары линз для уменьшения диаметра лазерного луча в соответствии с задней диафрагмой объектива микроскопа и пары зеркал сканирования galvo для управления лучом. Пара рулевых зеркал присутствует перед каждым основным оптическим компонентом. Фокусировка управляется двигателем, который приводит в движение крепление объектива. Траектория излучения света может быть настроена для различных флуорофоров путем замены дихроичных и барьерных фильтров. Отображается общая настройка для голубого/желтого/красного изображения, в которой короткопроходное дихроичное зеркало направляет красный свет на первый PMT, а длиннопроходное дихроичное зеркало в паре с соответствующими полосовыми фильтрами используется для разделения голубого и желтого излучения. Аббревиатура: PMT = фотоумноживательная трубка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Позиционирование мышей для визуализации in vivo. Чтобы расположить мышь со зрачком на оси со световым контуром, обезболенную мышь сначала удерживают в держателе для головы, голову поворачивают и наклоняют, на глаз помещают большую каплю смазочного геля для глаз, а мышь помещают на сцену. Крышка устанавливается в держателе крышки, перпендикулярной световому тракту, и опускается вниз к глазу. Крышка не должна контактировать с роговицей или головкой мыши (слева), что будет видно, если крышка отклоняется. Тем не менее, крышка также должна быть достаточно близкой, чтобы избежать талии капли (справа), потому что это окажет демагнифицирующее действие на образец. После нанесения геля на погружение и закрепления крышки ступень следует переместить на место непосредственно под объектив микроскопа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
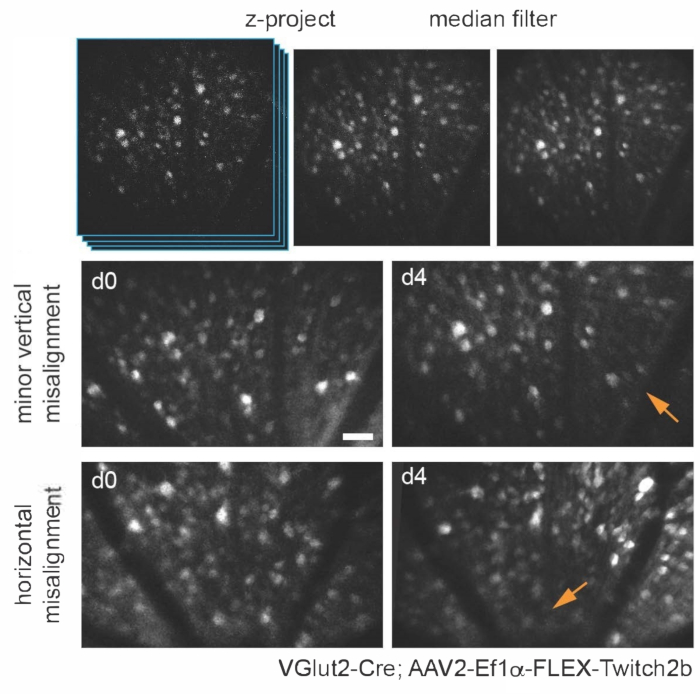
Рисунок 3: Визуализация ганглиозных клеток сетчатки. Для отображения изображения создаются проекции максимальной интенсивности с z-плоскостями, содержащими интересующие ячейки, а результирующие изображения фильтруются медиана для удаления шума выстрела PMT. Показаны два примера ганглиозных клеток сетчатки, меченных путем инъекции AAV-EF1α-FLEX-Twitch2b трансгенным мышам VGlut2-Cre, в частности сигнал CFP. Изображения были получены на сеансах с интервалом в четыре дня, и сосудистые ориентиры были использованы для возвращения в ту же область возле головки зрительного нерва. Головка зрительного нерва ориентирована к нижней части изображения. Хотя оба образца показывают некоторую дисперсию ориентации (области со сниженной интенсивностью обозначены стрелками), большинство клеток присутствуют в обеих точках времени. Шкала - приблизительно 50 мкм. Сокращения: PMT = фотоумножительная трубка; AAV = аденоассоциированный вирус; EF1α = коэффициент удлинения-1альфа; FLEX = флип-иссечение; VGlut2 = везикулярный транспортер глутамата 2; CFP = голубой флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
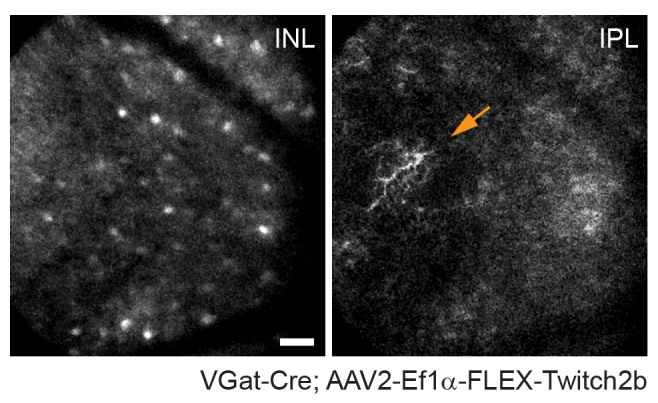
Рисунок 4: Визуализация амакриновых клеток. Амакриновые клетки были помечены путем инъекции AAV-EF1α-FLEX-Twitch2b трансгенным мышам VGat-Cre. Специально показан сигнал CFP Twitch 2b. Небольшие проекции максимальной интенсивности, сфокусированные на глубинах внутреннего ядерного слоя, указывают на сомы амакриновых клеток, в то время как фокусировка на внутреннем плексиформе разрешает нейриты амакриновых клеток (стрелка). Головка зрительного нерва ориентирована вправо от изображения. Шкала - приблизительно 50 мкм. Сокращения: AAV = аденоассоциированный вирус; EF1α = коэффициент удлинения-1альфа; FLEX = флип-иссечение; VGat = везикулярный транспортер гамма-аминомасляной кислоты; CFP = голубой флуоресцентный белок; INL = внутренний ядерный слой; IPL = внутренний плексиформный слой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
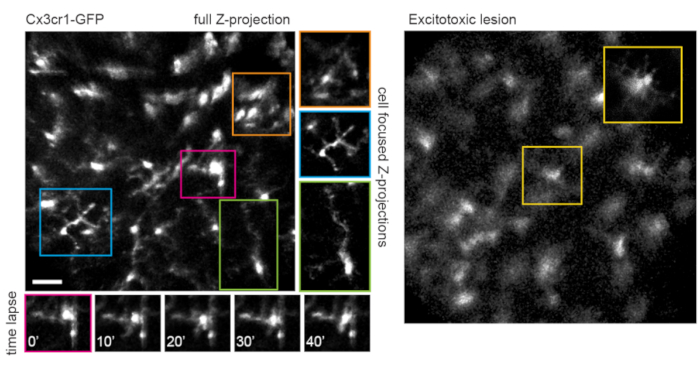
Рисунок 5: Визуализация микроглии. Трансгенная линия мышей Cx3cr1-GFP использовалась для маркировки микроглии. Проекция максимальной интенсивности полного объема сканирования показывает много микроглий, некоторые с мелкими деталями процесса, которые могут быть разрешены. Обратите внимание, что ячейки в левом нижнем углу поля имеют меньше искажений в максимальной проекции, чем ячейки в правом верхнем углу из-за параллакса в этой области. Проекции максимальной интенсивности, содержащие только интересующую ячейку, значительно уменьшают этот параллакс (центр, упакованный в соответствующие цвета). Кроме того, эта стратегия визуализации может документировать динамику ремоделирования процесса тонкой микроглии (нижние панели). Для сравнения, многие микроглии можно увидеть с короткими процессами или морфологией амебоидов через день после эксайтотоксического поражения путем интравитреальной инъекции 50 мМ NMDA (справа). Шкала - приблизительно 50 мкм. Сокращения: GFP = зеленый флуоресцентный белок; Cx3cr1 = хемокиновый рецептор Cx3 1; NMDA = N-метил-D-аспартат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
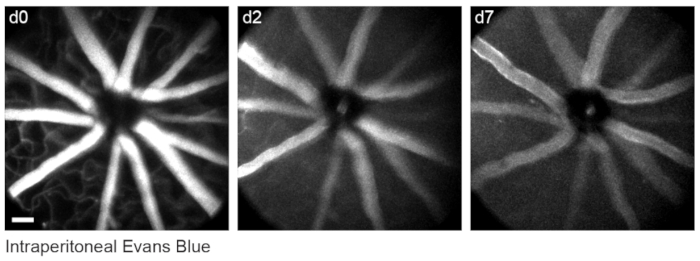
Рисунок 6: Маркировка сосудистых ориентиров. Мышам вводили 200 мкл 20 мг/мл эванс синего внутрибрюшинно за 30-60 мин до первого сеанса визуализации. Проекции максимальной интенсивности полной толщины демонстрируют длительную флуоресценцию в сосудистой системе сетчатки, которая сохранялась в течение не менее семи дней. Шкала = приблизительно 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
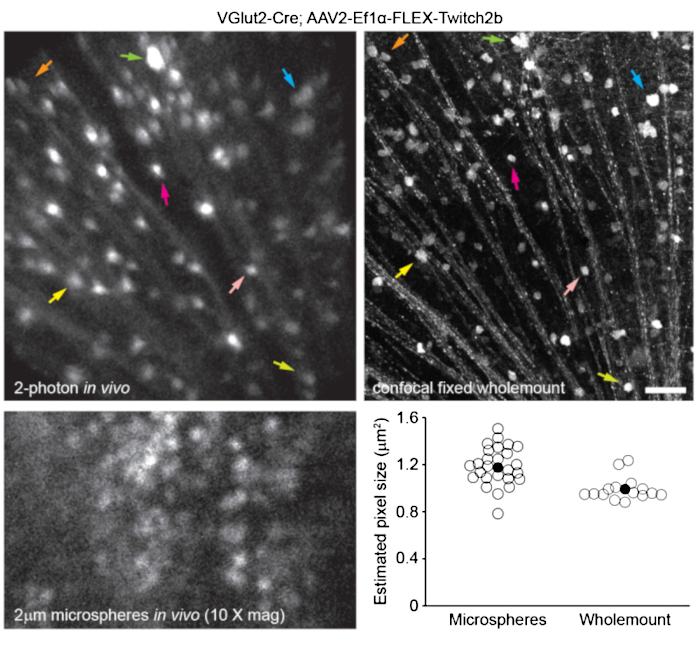
Рисунок 7: Размеры изображения. Ганглиозные клетки сетчатки, меченные инъекцией AAV-EF1α-FLEX-Twitch2b трансгенным мышам VGlut2-Cre, были изображены in vivo, и та же область затем была изображена конфокальной лазерной сканирующей микроскопией после фиксации и подготовки всего сустава сетчатки. Желтый флуоресцентный белковый канал показан для обоих. Цветные пары стрелок обозначают одну и ту же ячейку в обоих препаратах (верхние панели). Одноплоскостное изображение флуоресцентных микросфер диаметром 2 мкм, вводимое интравитреально и визуализированное in vivo (нижняя левая панель). Микросферы не оседали и, таким образом, находились в постоянном движении, что делало невозможным измерение осевого разрешения. Размеры пикселей, рассчитанные на основе полумаксимальных измерений флуоресцентных микросфер in vivo или коррелятивных конфокальных измерений, взятых из 2-4 сетчаток на группу (внизу справа). Шкала бара = 50 мкм. Сокращения: AAV = аденоассоциированный вирус; EF1α = коэффициент удлинения-1альфа; FLEX = флип-иссечение; VGlut2 = везикулярный транспортер глутамата 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
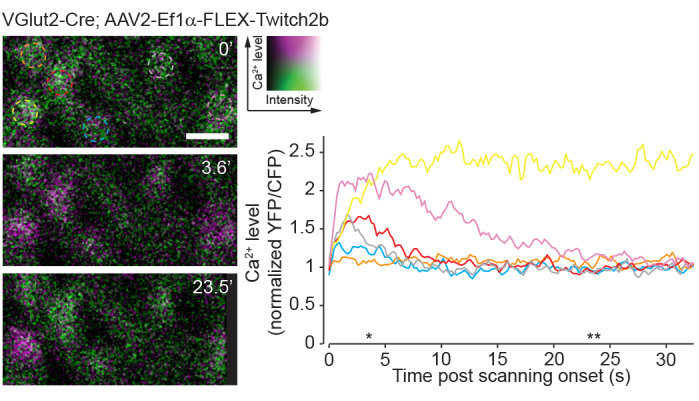
Рисунок 8: Активность кальция, индуцированная двухфотонным сканированием. Ганглиозные клетки сетчатки, меченные инъекцией AAV-EF1α-FLEX-Twitch2b трансгенным мышам VGlut2-Cre, YFP представляет собой псевдоцветный пурпурный и CFP зеленый, изображенный в одной плоскости в виде временного ряда при 4,22 Гц. Все RGC имели одинаковое начальное соотношение YFP/CFP. Большинство ответили увеличением соотношения FRET (исключая оранжевую ячейку), а один поддерживал высокое соотношение YFP / CFP на протяжении всего временного ряда (желтая ячейка). Соотношение YFP/CFP было нормализовано до среднего показателя первого кадра, а цветные круги совпадают с цветными следами. Звездочками обозначены точки времени с репрезентативными изображениями, отображаемыми слева. Шкала бар = 20 мкм. Сокращения: AAV = аденоассоциированный вирус; EF1α = коэффициент удлинения-1альфа; FLEX = флип-иссечение; VGlut2 = везикулярный транспортер глутамата 2; YFP = желтый флуоресцентный белок; CFP = голубой флуоресцентный белок; RGC = ганглиозные клетки сетчатки; FRET = флуоресцентный резонансный перенос энергии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Процедура двухфотонной визуализации, описанная в настоящем описании, позволяет проводить продольную визуализацию сетчатки мыши in vivo. Повторяемые изображения одной и той же области сетчатки могут быть получены в течение непрерывного периода до 6 и более ч под изофлураном. Мышь также может быть изображена в разные дни с использованием клеточных и сосудистых ориентиров, чтобы найти одну и ту же область изображения (рисунок 3). Использование прозрачного гелевого погружения в сочетании с покровным стеклом для этой цели ранее применялось к ряду процедур, включая визуализацию сетчатки для субретинальной инъекции, лазерно-индуцированные модели травмы сетчатки и визуализацию глазного дна 20,21,22.
Анатомия глаза представляет собой уникальные проблемы для визуализации in vivo, так как высокая оптическая мощность роговицы и хрусталика мыши препятствует прямой визуализации зрачка без коррекции. Несколько других методов визуализации in vivo основаны на использовании плоскоогнутой контактной линзы для коррекции передней оптики глаза мыши 7,17,18,19. При только оптической коррекции в роговице высокая оптическая мощность линзы мыши приводит к неизбежному количеству параллакса, особенно структур в периферийном поле сканирования, проявляясь в виде растяжения и поступательного движения в измерении X-Y в разных Z-плоскостях. Чтобы свести к минимуму искажения, связанные с параллаксом изображения, в измерениях X и Y крайне важно, чтобы глаз мыши был ориентирован таким образом, чтобы касательная плоскость к сетчатке в области визуализации была перпендикулярна световому пути микроскопа. Описанная здесь установка способствует точному манипулированию углом глаза для достижения этого выравнивания. Регулируемый держатель головки мыши, который позволяет вращаться вдоль двух осей, позволяет легко вручную регулировать угол наклона глаза, когда экспериментатор прокручивает Z-измерение, чтобы минимизировать параллакс. Этот наклон также обходит эффект остановки поля зрачка, чтобы позволить визуализировать большие области сетчатки. Удерживающая способность держателя головы также значительно уменьшает артефакты движения, вызванные дыханием.
Необходимо позаботиться о поддержании четкости глаза мыши, так как качество изображения ухудшится с помутнением во время непрерывной визуализации. Частое повторное нанесение смазочного геля во время визуализации и нанесение мази после каждого сеанса визуализации помогают предотвратить высыхание и развитие помутнения глаза. Некоторые помутнения роговицы спонтанно рассасываются через 24-48 ч. Использование прозрачного геля и покровного стекла, как описано в этом протоколе, обеспечивает такое же качество изображения и коррекцию аберрации, как и у контактных линз7, при этом позволяя легче регулировать угол наклона глаз без необходимости выравнивания защитного стекла. Кроме того, гель обеспечивает непрерывное увлажнение глаз, что позволяет выполнять сеансы острой визуализации продолжительностью до нескольких часов. Наконец, поскольку покровное стекло не контактирует с роговицей, оно вызывает минимальное раздражение глаз, что может снизить оптическую четкость для повторных сеансов визуализации.
Ограничением такого подхода является тот факт, что оптические аберрации не полностью корректируются. Хотя это значительно уменьшает осевое разрешение из-за тяжелого параллакса, количественные измерения сомы могут быть получены в плоскостях с одним изображением. Следует отметить, что, поскольку интенсивность флуоресцентного сигнала нейронов сетчатки зависит от выравнивания образца с помощью этого метода, датчики возбуждения и излучения на основе ратиметрического излучения более подходят для экспериментов, сравнивающих образцы хронически через различные сеансы визуализации. Подходом к коррекции оптических аберраций на системном уровне является адаптивная оптика, которая позволяет обеспечить субклеточное разрешение в сетчатке 8,9,14,21. Однако адаптивная оптика требует узкоспециализированного оборудования и обширного опыта для внедрения.
Альтернативными подходами к двухфотонной визуализации сетчатки in vivo являются конфокальная микроскопия или офтальмоскопия6. Представленный здесь подход должен быть легко переведен на широкоугольную или конфокальную микроскопию. Однофотонная визуализация, возможно, более надежна и представляет меньший риск повреждения сетчатки из-за высокой энергии двухфотонного лазера, необходимого для достижения эффективного двухфотонного эффекта через роговицу и хрусталик глаза. Чтобы избежать повреждения двухфотонным лазером, порог максимальной мощности лазера должен быть эмпирически определен путем изучения цельной сетчатки после завершения экспериментов по визуализации и иммуноокрашения типов клеток в изображенных слоях. В системе, представленной здесь, RGC были помечены маркером pan-RGC, Rbpms, и плотности были нормальными до мощности изображения 45 мВт, тогда как 55 мВт вызывали значительную потерю RGC (не показаны).
Недостатком однофотонной визуализации является тот факт, что этот подход будет очень сильно стимулировать нативные визуальные схемы сетчатки по сравнению с двухфотонной визуализацией23. Предыдущие эксперименты с использованием цельных маунтов сетчатки или препаратов наглазки показали, что двухфотонное лазерное сканирование вызывает активацию цепи, которая в значительной степени является преходящей24. Здесь визуализация активности RGC с помощью датчика Ca2+ Twitch2b показывает, что начало лазерного сканирования индуцирует подъемы Ca2+ , которые возвращаются к исходному уровню в течение 5-20 с в большинстве RGC (рисунок 8). Учитывая, что мощность лазера в этом протоколе находится в диапазоне предыдущих экспериментов, сообщающих in vivo о световом отклике сетчатки8, описанный в настоящее время метод, вероятно, поддается записи активности цепи в сетчатке. Такие соображения важны для экспериментов, на которые может влиять активность цепи.
Этот протокол демонстрирует визуализацию in vivo двух типов нейронов сетчатки, RGC и амакриновых клеток. Аналогичная маркировка других основных типов клеток может быть достигнута, включая горизонтальные клетки (Cx57-Cre25), биполярные клетки (Chx10-Cre26; mGluR6-GFP27), конусные фоторецепторы (S- или M-opsin-Cre28), палочковые фоторецепторы (Nrl-Cre29), глию Мюллера (Foxg1-Cre26) и перициты (NG2-DsRed9). Трансгенные мыши также доступны для маркировки дискретных подмножеств RGC (например, KCNG4-Cre для αRGCs30; OPN4-Cre для ipRGCs31; JAM-B-CreER для J-RGC32) и амакриновых клеток (например, ChAT-Cre для звездообразующих амакриновых клеток26 и нейропептидные промоторы для различных подтипов амакриновых клеток 3,34). Вирусные векторы могут быть использованы для нацеливания на конкретные клеточные популяции вместо трансгенных мышей. Интравитреальные инъекции AAV2 с вездесущим промоторным элементом CAG почти исключительно маркируют RGC, амакриновые клетки и горизонтальные клетки25. Сопряжение модифицированного капсида AAV2.7m8-Y444F с конструкцией промотора mGluR6 позволяет широко маркировать биполярные ячейкиON 35. Субретинальные инъекции AAV приводят к обогащению фоторецепторов, причем серотип AAV2/5 имеет самую высокую эффективность трансдукции36. Shh10, модифицированный капсидный белок AAV6, в паре с глиальными фибриллярными кислыми белковыми промоторными элементами, был продемонстрирован специфичным для глии Мюллера37.
Способность наблюдать за клетками центральной нервной системы при совершенно неинвазивном подходе может быть использована для изучения как основных свойств нейронных цепей8, так и механизмов нейродегенерации 3,4,5,6,38. Многие ослепляющие заболевания нацелены на клеточные популяции в сетчатке, и подходы к визуализации in vivo у мышей были использованы для изучения повреждения зрительного нерва 1,3,4, макулярной дегенерации13, инсульта 5, глаукомы 2,6 и увеита 7. Кроме того, многие нейродегенеративные состояния центральной нервной системы проявляются в сетчатке, включая болезнь Альцгеймера39, рассеянный склероз40 и болезнь Паркинсона41. Таким образом, этот легкодоступный метод визуализации сетчатки in vivo может быть применен в качестве инструмента для изучения широкого набора нейродегенеративных состояний.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами Фонда исследований для предотвращения слепоты (награда за развитие карьеры для P.R.W. и неограниченный грант для Департамента офтальмологии и визуальных наук в Медицинской школе Вашингтонского университета в Сент-Луисе), Национального исследования глаукомы (программа Фонда BrightFocus) и Центра клеточной и молекулярной нейробиологии Макдоннелла. Z.W. поддерживается премией Институциональной национальной исследовательской службы T32 EY013360. Эта работа также была поддержана Центром надежды вирусных векторов Core в Медицинской школе Вашингтонского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| #1.5 coverslip | ThermoFisher | 152440 | Richard-Allan #1.5 24 mm x 40 mm |
| 50 mL glass syringe | Hamilton | 80950 | 22G cemented needle |
| Adeno-associated virus (AAV2) | Hope Center Viral Core | NA | |
| Anesthesia Air Pump | RWD Life Science | R510-30 | |
| Atropine | Sigma | A0132 | For pupil dilator solution |
| Basic Small Animal Anesthesia Device | RWD Life Science | R500IE | |
| Borosilicate glass capillary | Sutter | B150-86-10 | Outside diameter 1.50 mm, inside diameter 0.86 mm, length 10 cm |
| CFP/YFP filter cube | Chroma | custom | 480/40, 505 long pass, 535/30 |
| ChromoFlex - Two channel PMT detection unit | Scientifica | S-MPLG-1002 | |
| Circulating heating pump | Braintree Scientific | tp-700 | Set to 37 °C |
| Cling film | VWR | 10713-916 | |
| Compact Filter Holder | ThorLabs | DH1 | Holds coverslip over mouse eye |
| Cx3cr1-GFP transgenic mice (B6.129P2(Cg)-Cx3cr1tm1Litt/J) | The Jackson Laboratory | 005582 | |
| DAQ controller chassis | National Instruments | PXIe-1073 | |
| Data acquisition device | National Instruments | BNC-2090A | |
| Evans Blue dye | Fisher Scientific | AAA1677409 | |
| FPGA module with digitizer | National Instruments | NI-5734 | |
| Gas Evacuation Apparatus | RWD Life Science | R546W | |
| GenTeal Severe lubricant eye gel | Alcon | (from local pharmacy) | For use during imaging |
| GFP/Red filter cube | Chroma | custom | 535/30, 560 long pass, 605/70 |
| Heating pad | McKesson Medical and Surgical | 190147 | |
| HyperScope Launch Optics for use with Pockels Cell | Scientifica | S-MP-101080 | |
| HyperScope Main module | Scientifica | S-MP-100466 | |
| HyperScope Scan Path | Scientifica | S-MP-100406 | |
| HyperScope X galvo Module | Scientifica | MP-100443 | |
| ImageJ Fiji software | Freeware | ||
| Isoflurane | Patterson Veterinary | NDC 14043-704-06 | |
| Isoflurane gas filter cannister (active scavenging) | RWD Life Science | R510-31 | |
| Isoflurane gas filter cannister (passive scavenging) | RWD Life Science | R510-31S | |
| ketamine HCl (100 mg/mL) | Vedco | NDC 50989-161-06 | |
| M32 to M26 adapter | ThorLabs | M32M26S | |
| MaiTai GUI software | Spectra-Physics | NA | |
| MATLAB software | MathWorks | NA | R2015b |
| meloxicam (5 mg/mL) | Boehringer Ingelheim | NDC 0010-6013-01 | Analgesic |
| Micorscope Objective | Edmund Optics | 46-404 | Mitutoyo WE715042319 |
| micropipette puller | Sutter | Flaming/Brown Model P-97 | |
| Mineral oil | Fisher | BP2629-1 | |
| Mini bulldog hemostatic clamp | Fine Science Tools | 18053-28 | |
| Miniature EVA Tubing 0.02" ID, 0.06" OD | McMaster Carr | 1883T1 | |
| Miniature EVA Tubing 0.05" ID, 0.09" OD | McMaster Carr | 1883T4 | |
| Mouse head holder | Narishige | SGM-4 | |
| No. 5 Forceps | Fine Science Tools | 11251-10 | |
| Optic Posts 1/2" | ThorLabs | TR3-P5 | |
| Optical power meter kit | ThorLabs | PM100D | |
| pE-300 Ultra LLG Deivery | Scientifica | COO-LED3ULLGs | |
| Phenylephrine hydrochloride | Sigma | P6126 | For pupil dilator solution |
| Pockels cell | Conoptics | 350-80-02 | |
| Pockels cell amplifier | Conoptics | Model 302RM | |
| Proparacaine hydrochloride | Sigma | 1571001 | For eye immobilization |
| Red & Far Red short pass filter Cube | Chroma | custom | 560 short pass |
| Rotating 1/2" post clamp | ThorLabs | SWC | |
| ScanImage package | Vidrio Technologies | Freeware | Image acquisition software; Version 5.4.0 (2018); requires MATLAB |
| sodium chloride solution, sterile (0.9%) | Fresenius Kabi | NDC 63323-186-01 | |
| Stereomicroscope | Leica | S9 E | |
| Tabletop centrifuge | Oxford | Benchmate C8 | |
| Terramycin oxytetracycline/polymyxin B antibiotic ophthalmic ointment | Zoetisus | NA | For use after intravitreal injection |
| ThermoRack cooling system | Solid State Cooling Systems | ThermoRack 401 | Set to 20 °C |
| Ultrafast Ti:Sapphire laser | Spectra-Physics | Mai Tai DeepSee | |
| Vgat-Cre transgenic mice (Slc32a1tm2(cre)Lowl/J) | The Jackson Laboratory | 016962 | |
| VGlut2-Cre transgenic mice (Slc17a6tm2(cre)Lowl/J) | The Jackson Laboratory | 016963 | |
| VivoScope for In Vivo Imaging | Scientifica | S-MPVS-1200-00P | |
| White petrolatum-mineral oil lubricant eye ointment | Stye | NA | For use after imaging |
| xylazine HCl (20 mg/mL) | Akorn | NDC 59399-110-20 |
Ссылки
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Scientific Reports. 8 (1), 1490 (2018).
- Liu, H., Ding, C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose. Experimental and Therapeutic Medicine. 14 (3), 1953-1960 (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), 40352 (2012).
- Leung, C. K., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Investigative Ophthalmology & Visual Science. 49 (11), 4898-4902 (2008).
- Murata, H., et al. Imaging mouse retinal ganglion cells and their loss in vivo by a fundus camera in the normal and ischemia-reperfusion model. Investigative Ophthalmology & Visual Science. 49 (12), 5546-5552 (2008).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. Journal of Visualized Experiments. (99), e52731 (2015).
- Bremer, D., et al. Longitudinal Intravital Imaging of the Retina Reveals Long-term Dynamics of Immune Infiltration and Its Effects on the Glial Network in Experimental Autoimmune Uveoretinitis, without Evident Signs of Neuronal Dysfunction in the Ganglion Cell Layer. Frontiers in Immunology. 7, 642 (2016).
- Qin, Z., et al. Adaptive optics two-photon microscopy enables near-diffraction-limited and functional retinal imaging in vivo. Light: Science & Applications. 9, 79 (2020).
- Schallek, J., Geng, Y., Nguyen, H., Williams, D. R. Morphology and topography of retinal pericytes in the living mouse retina using in vivo adaptive optics imaging and ex vivo characterization. Investigative Ophthalmology & Visual Science. 54 (13), 8237-8250 (2013).
- Williams, D. R. Imaging single cells in the living retina. Vision Research. 51 (13), 1379-1396 (2011).
- Carroll, J., Neitz, M., Hofer, H., Neitz, J., Williams, D. R. Functional photoreceptor loss revealed with adaptive optics: an alternate cause of color blindness. Proceedings of the National Academy of Sciences of the United States of America. 101 (22), 8461-8466 (2004).
- Rossi, E. A., et al. Imaging retinal mosaics in the living eye. Eye. 25 (3), 301-308 (2011).
- Rossi, E. A., et al. In vivo imaging of retinal pigment epithelium cells in age related macular degeneration. Biomedical Optics Express. 4 (11), 2527-2539 (2013).
- Geng, Y., et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 3 (4), 715-734 (2012).
- Thestrup, T., et al. Optimized ratiometric calcium sensors for functional in vivo imaging of neurons and T lymphocytes. Nature Methods. 11 (2), 175-182 (2014).
- Takeda, A., et al. Microglia mediate non-cell-autonomous cell death of retinal ganglion cells. Glia. 66 (11), 2366-2384 (2018).
- Ikeda, W., Nakatani, T., Uemura, A. Cataract-preventing contact lens for in vivo imaging of mouse retina. Biotechniques. 65 (2), 101-104 (2018).
- Palczewska, G., Kern, T. S., Palczewski, K., Weber, B. H. F., Langmann, T. Noninvasive two-photon microscopy imaging of mouse retina and retinal pigment epithelium. Retinal Degeneration. Methods in Molecular Biology. 1834, 333-343 (2019).
- Wahl, D. J., Jian, Y., Bonora, S., Zawadzki, R. J., Sarunic, M. V. Wavefront sensorless adaptive optics fluorescence biomicroscope for in vivo retinal imaging in mice. Biomedical Optics Express. 7 (1), 1-12 (2016).
- Park, S. W., Kim, J. H., Park, W. J., Kim, J. H. Limbal approach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium. Journal of Visualized Experiments. (102), e53030 (2015).
- Biss, D. P., et al. In vivo fluorescent imaging of the mouse retina using adaptive optics. Optics Letters. 32 (6), 659-661 (2007).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A mouse model for laser-induced choroidal neovascularization. Journal of Visualized Experiments. (106), e53502 (2015).
- Palczewska, G., et al. Human infrared vision is triggered by two-photon chromophore isomerization. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5445-5454 (2014).
- Euler, T., et al. Eyecup scope--optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Archive-European Journal of Physiology. 457 (6), 1393-1414 (2009).
- Zhang, Y., et al. Elevating Growth Factor Responsiveness and Axon Regeneration by Modulating Presynaptic Inputs. Neuron. 103 (1), 39-51 (2019).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Akimoto, M., et al. Transgenic mice expressing Cre-recombinase specifically in M- or S-cone photoreceptors. Investigative Ophthalmology & Visual Science. 45 (1), 42-47 (2004).
- Brightman, D. S., Razafsky, D., Potter, C., Hodzic, D., Chen, S. Nrl-Cre transgenic mouse mediates loxP recombination in developing rod photoreceptors. Genesis. 54 (3), 129-135 (2016).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85 (6), 1244-1256 (2015).
- Ecker, J. L., et al. Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron. 67 (1), 49-60 (2010).
- Kim, I. J., Zhang, Y., Yamagata, M., Meister, M., Sanes, J. R. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452 (7186), 478-482 (2008).
- Akrouh, A., Kerschensteiner, D. Morphology and function of three VIP-expressing amacrine cell types in the mouse retina. Journal of Neurophysiology. 114 (4), 2431-2438 (2015).
- Zhu, Y., Xu, J., Hauswirth, W. W., DeVries, S. H. Genetically targeted binary labeling of retinal neurons. Journal of Neuroscience. 34 (23), 7845-7861 (2014).
- Lu, Q., et al. AAV-mediated transduction and targeting of retinal bipolar cells with improved mGluR6 promoters in rodents and primates. Gene Therapy. 23 (8-9), 680-689 (2016).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Research. 48 (3), 353-359 (2008).
- Yao, K., et al. Wnt regulates proliferation and neurogenic potential of Muller glial cells via a Lin28/let-7 miRNA-dependent pathway in adult mammalian retinas. Cell Reports. 17 (1), 165-178 (2016).
- Williams, P. R., et al. A recoverable state of axon injury persists for hours after spinal cord contusion in vivo. Nature Communications. 5, 5683 (2014).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's & Dementia. 10 (2), 135-142 (2014).
- Kerrison, J. B., Flynn, T., Green, W. R. Retinal pathologic changes in multiple sclerosis. Retina. 14 (5), 445-451 (1994).
- Sung, M. S., et al. Inner retinal thinning as a biomarker for cognitive impairment in de novo Parkinson's disease. Scientific Reports. 9 (1), 11832 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены