Method Article
Imagem transpupilar de dois fótons in vivo da retina do rato
Neste Artigo
Resumo
A imagem in vivo é uma ferramenta poderosa para o estudo da biologia na saúde e na doença. Este protocolo descreve imagens transpupilares da retina de camundongos com um microscópio padrão de dois fótons. Também demonstra diferentes métodos de imagem in vivo para marcar fluorescentemente múltiplas coortes celulares da retina.
Resumo
A retina transforma sinais de luz do ambiente em sinais elétricos que são propagados para o cérebro. As doenças da retina são prevalentes e causam deficiência visual e cegueira. Entender como essas doenças progridem é fundamental para formular novos tratamentos. A microscopia in vivo em modelos animais de doença é uma ferramenta poderosa para a compreensão da neurodegeneração e levou a um progresso importante em direção a tratamentos de condições que vão desde a doença de Alzheimer até o acidente vascular cerebral. Dado que a retina é a única estrutura do sistema nervoso central inerentemente acessível por abordagens ópticas, ela naturalmente se presta a imagens in vivo. No entanto, a óptica nativa do cristalino e da córnea apresenta alguns desafios para o acesso efetivo à imagem.
Este protocolo descreve métodos para imagens in vivo de dois fótons de coortes e estruturas celulares na retina de camundongos em resolução celular, aplicáveis a experimentos de imagem de duração aguda e crônica. Ele apresenta exemplos de células ganglionares da retina (RGC), células amácrinas, microgliais e imagens vasculares usando um conjunto de técnicas de marcação, incluindo vetores de vírus adenoassociados (AAV), camundongos transgênicos e corantes inorgânicos. É importante ressaltar que essas técnicas se estendem a todos os tipos de células da retina, e os métodos sugeridos para acessar outras populações celulares de interesse são descritos. Também são detalhados exemplos de estratégias para pós-processamento manual de imagens para exibição e quantificação. Essas técnicas são diretamente aplicáveis aos estudos da função retiniana na saúde e na doença.
Introdução
A visualização in vivo do sistema nervoso central geralmente requer procedimentos invasivos, como afinamento do crânio e instalação de janelas de vidro ou lentes de relé óptico. A retina é a única estrutura do sistema nervoso que pode ser observada diretamente sem a necessidade de preparação invasiva, pois recebe nativamente luz do ambiente. A facilidade de acesso óptico à retina a torna um sistema modelo atraente para estudar o sistema nervoso central.
Imagens fluorescentes vivas da retina em camundongos têm sido usadas para rastrear a morte por RGC em modelos de glaucoma 1,2, lesão do nervo óptico 1,3,4 e acidente vascular cerebral5, bem como alterações na ativação microglial 6,7,8 e vasculatura9 em condições degenerativas. Sinais intrínsecos também podem ser utilizados para visualizar fotorreceptores 10,11,12 e células epiteliais pigmentares da retina 13. Muitas abordagens de imagens in vivo da retina utilizam dispositivos altamente especializados projetados especificamente para fins oftalmológicos6 ou sistemas ópticos altamente modificados para corrigir as aberrações nativas da córnea e do cristalino 8,9,11,12,13,14.
O presente protocolo demonstra uma abordagem à imagem in vivo de sinais fluorescentes na retina em resolução celular, utilizando um método básico de correção parcial da óptica anterior do olho do rato. Essa estratégia requer adaptações muito pequenas às configurações de microscópio multifóton que são comumente usadas para imagens in vivo do cérebro. Como essa abordagem é simples de configurar e os camundongos estão sob pouco estresse, é propício realizar experimentos de lapso de tempo ao longo de durações agudas e crônicas. Além disso, procedimentos genéticos e orgânicos baseados em corantes que rotulam componentes individuais da retina, incluindo RGCs, células amácrinas, micróglia e vasculatura, são compatíveis com essa técnica de imagem e permitem a observação in vivo de tipos e estruturas celulares críticas para a função da retina. Essas ferramentas podem ser adaptadas para rotular a maioria dos outros tipos de células neuronais, bem como componentes gliais e vasculares da retina.
Protocolo
NOTA: O procedimento a seguir foi realizado em conformidade com as diretrizes do Comitê Institucional de Cuidados e Uso de Animais da Universidade de Washington, em St. Louis. Consulte a Tabela de Materiais para obter detalhes sobre os reagentes, equipamentos e animais utilizados neste estudo.
1. Injeção de vírus adenoassociado
NOTA: A marcação de células específicas na retina pode ser realizada em linhagens de camundongos transgênicos Cre com padrões restritos de expressão. Esta seção descreve a entrega intravítrea de vetores AAV que codificam a expressão dependente de Cre de uma proteína fluorescente, marcando assim células específicas da retina. Injete ratos (machos e fêmeas), a partir das 4 semanas de idade.
- Preparação da agulha de micropipeta
- Use um extrator de micropipeta para criar uma agulha capilar de vidro borossilicato. Carregue um capilar de vidro no extrator de micropipeta e realize o teste de rampa, registrando o valor resultante. Descarte o capilar de vidro utilizado para o teste de rampa.
- Puxe micropipetas com as seguintes configurações: calor: Valor de teste de rampa menos 10; puxar: 55; velocidade: 65; tempo: 120; pressão de ar: 500; tempo de ar no início da tração: 20.
NOTA As configurações podem precisar ser ajustadas para puxadores diferentes. - Sob um microscópio de dissecação, use uma lâmina de barbear para cortar a ponta da micropipeta puxada no local onde a ponta de vidro se desvia ligeiramente sob força, ~ 10 mm do final da seção cônica. Corte em um ângulo agudo de tal forma que o corte produza uma ponta chanfrada. Descarte dicas contundentes.
- Preparação da seringa para injeção
- Encaixe uma micropipeta de vidro cortada em um segmento de 2 cm de tubo de plástico acetato de vinila etila (EVA) (0,05" de diâmetro interno, 0,09" de diâmetro externo). Conecte a outra extremidade deste segmento de tubulação a um comprimento de 20 cm de tubo EVA (0,02" diâmetro interno, 0,06" diâmetro externo).
- Ligue a tubulação a uma seringa de vidro de 50 μL com uma agulha cimentada de 22 G. Retire o êmbolo da seringa de vidro e encha a seringa e a tubulação conectada com óleo mineral usando uma agulha de seringa 25 G. Deixar espaço de ar de 4 mm na ponta da micropipeta.
- Injeção intravítrea de AAV
- Realizar injeção intravítrea com técnica asséptica padrão, utilizando luvas cirúrgicas estéreis, jaleco limpo, máscara, campo estéril e instrumentos autoclavados de acordo com protocolos institucionais para cirurgia de sobrevida.
- Remover uma alíquota do vetor AAV do armazenamento a -80 °C e descongelar no gelo. Após o descongelamento, centrifugar por 10 s a 2.000 × g para remover quaisquer bolhas de ar.
- Siga as diretrizes de anestesia e substâncias controladas da Comissão de Estudos em Animais institucional. Usando uma agulha hipodérmica de 30 G, realize uma injeção intraperitoneal (IP) de peso corporal de 0,1 mL/10 g de um coquetel de cetamina/xilazina (10 mg/mL de cetamina, 1 mg/mL de xilazina em solução salina, dose efetiva para camundongos: 100 mg/kg de cetamina, 10 mg/kg de xilazina). Devolva o rato à sua gaiola e aguarde 5 minutos para que a anestesia faça efeito.
- Usando uma agulha hipodérmica de 30 G, realizar uma injeção subcutânea de meloxicam de 0,1 mL/10 g de peso corporal (0,5 mg/mL em cloreto de sódio a 0,9%).
- Teste a profundidade da anestesia confirmando a perda do reflexo corneano e o reflexo de abstinência para a cauda e o dedo do pé. Se o reflexo corneano persistir após a perda do reflexo de retirada da cauda e do dedo do pé, aplique uma gota de solução de proparacaína a 0,5% em cada olho e aguarde 10 s.
- Coloque o rato de lado sob o estereomicroscópio. Use um mini grampo hemostático de buldogue para agarrar a pele superior e inferior à órbita e prenda o grampo no canto medial para deslocar parcialmente o globo para fora da órbita.
- Perfure a esclera lateral com a micropipeta cortada conectada à seringa de vidro, ~1-2 mm posterior ao limbo. Evite perturbar a vasculatura que corre circunferencialmente imediatamente posterior ao limbo. Realize a punção em um ângulo perpendicular à esclera e retraia ligeiramente a micropipeta imediatamente após perfurar a esclera para evitar danificar a lente.
- Use o êmbolo da seringa de vidro para retirar 1-2 μL de humor vítreo, correspondendo aproximadamente ao volume de fluido destinado à injeção. Retire a micropipeta do olho e ejete o humor vítreo removido.
- Encha a ponta da micropipeta com 1-2 μL de AAV, deixando ~4 mm de espaço aéreo entre o vetor viral e o óleo mineral para evitar a mistura. Insira a micropipeta no orifício na esclera criado pela primeira punção e pressione lentamente o êmbolo da seringa de vidro para injetar o vetor viral ao longo de 20-30 s. Visualize o nível de fluido do vetor viral na ponta da micropipeta e tenha cuidado para parar de injetar antes que qualquer ar entre no olho.
- Segure a micropipeta na mesma posição por 10 s e, em seguida, retraia a micropipeta. Remova a braçadeira hemostática do buldogue.
- Aplique pomada oftálmica antibiótica oxitetraciclina/polimixina B no olho injetado. Coloque o rato numa almofada de aquecimento e monitorize a sua recuperação da anestesia (ver 3.4.3).
- Devolva o rato ao seu alojamento e realize os cuidados pós-operatórios de acordo com as diretrizes institucionais. Aguarde 2-3 semanas para a expressão mediada por vírus de fluoróforos antes da imagem.
2. Configuração do microscópio
NOTA: Um esquema do caminho da luz do microscópio é mostrado na Figura 1.
- Equipamento "Always-On": Estes instrumentos devem permanecer sempre ligados, a menos que passem por ajuste ou manutenção. Ajuste a alta temperatura do sistema de resfriamento a laser para 20,0 °C. Ligue a alimentação principal do laser ultrarrápido Ti:Safira, dê tempo para a conclusão dos processos de inicialização do sistema e gire a tecla "Laser Enable" para a posição "On".
- Configuração do caminho da luz de emissão
- Configure o caminho de coleta de emissão de fluorescência para os comprimentos de onda da amostra usando conjuntos de filtros dicroicos e passa-banda apropriados para os fluoróforos de interesse.
NOTA: Neste manuscrito, a imagem do Twitch2b usou um cubo de filtro consistindo de um dicroico de passagem longa 505 e pares de filtros de passagem de banda 480/40 e 535/30. A GFP foi fotografada usando um cubo de filtro vermelho/verde constituído por um filtro passa-longa 560 com filtros passa-passo de banda 525/50 e 605/70. Evans Blue foi fotografado usando um filtro passa-curto 560. A mudança dos filtros de emissão expõe o caminho da luz de emissão à luz ambiente dispersa que pode danificar os tubos fotomultiplicadores (PMTs). Certifique-se de que os PMTs estejam desligados e desligue as luzes da sala antes de modificar o caminho da luz de coleta, pois a exposição à luz pode afetar negativamente a função PMT.
- Configure o caminho de coleta de emissão de fluorescência para os comprimentos de onda da amostra usando conjuntos de filtros dicroicos e passa-banda apropriados para os fluoróforos de interesse.
- Iniciando a aquisição de imagens
NOTA: A exposição direta ao laser de dois fótons é perigosa, especialmente para o olho, pois a luz vermelha distante não induzirá uma resposta de piscar. Deve-se tomar o devido cuidado para garantir que o laser seja fechado ao longo do caminho da luz e que haja falhas para proteger o usuário da exposição através das oculares ou das emissões da objetiva do microscópio. Os usuários devem entender em que condições o laser será emitido a partir do objetivo e tomar as devidas precauções para não se expor a tais perigos.- Ligue o dispositivo de aquisição de dados, o computador, a célula Pockels, o microscópio e o controlador de palco, o controlador mecânico do obturador e a alimentação principal do PMT. Mantenha os PMTs no estado "Desativado" até que estejam prontos para a aquisição de imagens e protegidos da luz dispersa. Abra a interface de controle a laser no computador e no software de aquisição de imagens. Ligue o laser a partir da interface do computador e certifique-se de bloqueio de modo.
- Defina o comprimento de onda do laser desejado. Certifique-se de que a luz laser está entrando na célula Pockels abrindo o obturador a laser e aguarde 30 minutos para que a energia do laser se estabilize.
- Medindo a potência do laser na objetiva e definindo a porcentagem máxima do laser
NOTA: A radiação laser é emitida pela lente objetiva durante a medição de potência. Feche a cortina do gabinete do microscópio e use a proteção ocular apropriada antes de ativar o obturador de imagem. Meça a potência do laser no momento da instalação inicial do sistema para estabelecer a curva de saída de potência para cada comprimento de onda de interesse e, posteriormente, mensalmente para verificar a estabilidade da potência de excitação.- Ligue o medidor de potência óptica e selecione o comprimento de onda de medição correspondente ao comprimento de onda do laser. Coloque o detector do medidor de potência óptica no estágio do microscópio e manobra-o diretamente sob a lente objetiva nas dimensões X-Y. Usando a unidade de foco motorizada de dimensão Z, abaixe a lente objetiva até que o detector do medidor de potência esteja ~ 1 mm abaixo da lente objetiva.
- Mude da iluminação de epifluorescência para o laser como o caminho da luz de excitação do microscópio. Ative o obturador mecânico.
- No software de aquisição de imagem, inicie uma varredura pontual para abrir o obturador de imagem e envie o laser para o medidor de potência óptica. Defina a potência do laser para 100% no software de digitalização. Otimize as posições X-Y e Z do detector do medidor de potência até que a maior medição de potência a laser seja alcançada.
- Meça a potência do laser na objetiva de 0,1% a 100% na Célula Pockels, fazendo medições em intervalos de 10%. Registre a porcentagem de célula de Pockels correspondente a 45 mW de potência no objetivo. Defina essa porcentagem como a potência máxima do laser no software de aquisição de imagens.
NOTA: A maior potência observada para imagens in vivo da retina de camundongos sem danos visíveis ao tecido alvo foi de 45 mW, conforme determinado pela coloração histológica duas semanas após a imagem. Danos óbvios na retina são evidentes após a imagem com 55 mW na objetiva. - Desative o obturador de imagem e retorne o caminho da luz de excitação para a epifluorescência.
3. Preparação do mouse para aquisição de imagens
- Anestesiar o rato para geração de imagens
NOTA: Garantir a eliminação adequada de gases residuais para mitigar a exposição ao isoflurano. Certifique-se de que a porta de exaustão da câmara de indução da anestesia esteja conectada a uma lata de filtro de gás de limpeza passiva e que a saída do nariz de anestesia do rato esteja conectada a um cannister de filtro de gás de limpeza ativo com vácuo fornecido por um aparelho de evacuação de gás. Siga as diretrizes do fabricante para monitorar o peso do recipiente do filtro para substituição.- Anestesiar o rato utilizando o cocktail de cetamina/xilazina, tal como descrito acima no passo 1.3.3. Alternativamente, induza a anestesia via inalação de isoflurano se também estiver usando isoflurano para manutenção da anestesia (sessão de imagem > 30 min). Ajuste o dispositivo de anestesia de pequenos animais para encher a câmara de indução com isoflurano a 5% misturado com ar ambiente a uma taxa de fluxo de 0,5 L/min. Coloque o rato na câmara de indução e permita que 15 s para o rato fique anestesiado.
- Mude o vaporizador de isoflurano para 0% e direcione o fluxo de anestesia para a peça nasal. Execute uma descarga "O2 " de 5 segundos da câmara de indução. Retire o rato da câmara de indução e fixe-o no suporte da cabeça (ver secção 3.3), fixando a peça nasal.
- Use uma mistura de isoflurano a 1% com ar ambiente a uma taxa de fluxo de 0,5 L/min para manutenção da anestesia. Monitore a frequência respiratória em intervalos de 5 minutos durante a anestesia, ajustando a porcentagem de isoflurano para manter uma frequência respiratória de ~60 respirações/min.
NOTA: Estas configurações (% de isoflurano, taxa de fluxo) também podem ser usadas para a manutenção da anestesia induzida pelo coquetel de cetamina/xilazina.
- Dilatação da pupila
- Preparar uma solução de 1% p/v de atropina e cloridrato de fenilefrina a 2,5% p/v em água. Conservar a solução dilatadora à temperatura ambiente protegida da luz.
- Usando um conta-gotas de pipeta descartável, aplique uma gota da solução dilatadora em cada olho que será fotografado. Desligue as luzes da sala e aguarde 5 minutos para que a pupila se dilate. Quando a pupila estiver dilatada, apague a solução dilatadora com tecido livre de fiapos.
NOTA: Certifique-se de que a solução dilatadora não entre nas narinas. - Aplique uma grande gota de gel lubrificante para os olhos em cada olho que será fotografado. Se ambos os olhos devem ser fotografados, aplique um pequeno pedaço de filme plástico aderente sobre o gel ocular no olho sem imagem para evitar a desidratação. Se apenas a imagem de um olho, aplique pomada ocular lubrificante para o olho que não será fotografado.
- Posicionamento do mouse para geração de imagens
- Para fixar o rato no suporte da cabeça de imagem, rode o braço principal do suporte da cabeça até que a barra do auricular esteja inclinada num ângulo igual ou superior a 60° abaixo da horizontal. Prenda o pino do canal auditivo inferior na posição estendida para dentro e o pino do canal auditivo superior na posição retirada.
- Com o mouse voltado para a barra de mordida, monte uma orelha no pino inferior estendido, inserindo o pino no canal auditivo. Solte o parafuso que prende o pino do canal auditivo superior e estenda o pino para o outro canal auditivo. Aperte o parafuso para prender a cabeça.
- Deslize a barra de mordida em direção à cabeça do mouse. Levante suavemente a cabeça do rato e, em seguida, abaixe os incisivos maxilares do rato para o orifício da barra de mordida. Retraia a barra de mordida com força suave para prender a cabeça do mouse e prenda a posição da barra de mordida apertando o parafuso.
- Se estiver usando isoflurano, deslize a peça nasal através de sua fenda na barra de mordida antes de fixar os incisivos do rato. Fixar e apertar a posição da barra de mordida como no passo 3.3.3. Aperte a peça nasal usando os dois parafusos em sua face superior até que ela se encaixe confortavelmente no nariz do mouse, mas não contraia o focinho.
- Transfira o rato, no suporte da cabeça, para a fase de microscópio por baixo da objetiva. Gire o braço principal do suporte de cabeça até que a pupila do olho esteja orientada para cima, de acordo com o caminho da luz (Figura 2).
- Coloque uma tampa #1.5 no suporte do filtro compacto e prenda o suporte ao estágio do microscópio. Abaixe a tampa em direção ao olho, entrando em contato com o gel de olho lubrificante, de modo que a tampa fique horizontalmente imediatamente acima da córnea (Figura 2). Certifique-se de que a tampa não toque na córnea.
NOTA: No microscópio, certifique-se de que o caminho da luz de excitação está definido para epifluorescência e o caminho da luz de emissão está definido como ocular. Ligue o iluminador de epifluorescência na potência mais baixa e abra o obturador do iluminador. Escolha o comprimento de onda do iluminador de epifluorescência e o filtro de fluorescência correspondentes ao fluoróforo que está sendo fotografado. - Manobrar o estágio nas dimensões X-Y e objetivar na posição Z usando o controle de palco e o acionamento de foco motorizado até que a luz de excitação de campo largo cubra totalmente a córnea. Olhando através da ocular, continue a ajustar a posição Z do estágio até que as células fluorescentes ou estruturas na retina entrem em foco. Aumente a potência do iluminador de epifluorescência se o sinal da amostra não for suficientemente brilhante para resolver células individuais ou estruturas de interesse através da ocular.
NOTA: Se tiver problemas para localizar a retina, a íris é um marco de alto contraste para ancorar e, em seguida, concentrar-se em direção à retina. Esta etapa também permitirá a verificação de que a pupila está maximamente dilatada. - Obtenha uma área de imagem no eixo com a lente do mouse. Ajuste o ângulo do mouse usando os vários graus de liberdade no suporte da cabeça até que ocorra apenas expansão ou contração da luz fora de foco ao ajustar o plano focal. Desligue o iluminador de epifluorescência e feche o obturador do iluminador.
NOTA: A paralaxe X-Y significativa da luz fora de foco durante a rolagem pelos planos focais da direção Z indica que a retina não está no eixo em relação ao caminho da luz de imagem.
4. Aquisição de imagem de dois fótons
- Configuração e parâmetros de aquisição de imagem
NOTA: Desligue as luzes do quarto e cubra as fontes de luz dispersas na sala. Certifique-se de que o iluminador de epifluorescência está desligado e se o obturador do iluminador está fechado.- Alterne o caminho da luz de excitação para o laser e o caminho da luz de emissão para os PMTs.
- No software de aquisição de imagens, defina um tamanho de quadro de 512 x 512 e uma média de quadros de 3. Defina as etapas por fatia como -8 μm. Designe o z-stepping para começar no topo da pilha e progredir para baixo, minimizando a ativação a laser de dois fótons dos fotorreceptores.
NOTA: O tamanho da etapa pode ser reduzido para aumentar a resolução Z a um custo de aumento do tempo de imagem, mas 8 μm de etapas são suficientes para resolver a somata celular nessa configuração de imagem. - Ligue e ative os PMTs. Ajuste a tensão PMT para 680 V. Ative o obturador de excitação.
NOTA: Os PMTs alimentados são suscetíveis a danos leves. Certifique-se de que o iluminador de epifluorescência está desligado, a cortina do gabinete do microscópio está desenhada e as luzes da sala estão apagadas. - Comece uma visualização de imagem ao vivo do tecido alvo, começando com 1% de potência do laser. Ajuste automaticamente o brilho da tela para visualizar as células ou estruturas de interesse. Ajuste automático da fase de digitalização. Se o tecido-alvo estiver fraco ou pouco claro, aumentar a percentagem de potência do laser até que as estruturas se tornem visíveis sem ultrapassar o limite estabelecido no passo 2.4.4 correspondente a 45 mW.
NOTA: Para uma imagem de 16 bits, um valor de exibição de ~1000 ao ajustar automaticamente o brilho em um plano Z contendo estruturas de interesse indica brilho suficiente da amostra. - Manobrar o estágio do microscópio na direção X-Y para se concentrar em uma área de imagem desejada e, em seguida, navegue até o plano Z com as estruturas de interesse em foco.
NOTA: A imagem adjacente à cabeça do nervo óptico permite que ela sirva como um marco inequívoco para experimentos de imagem crônica. - Se este for um experimento crônico de lapso de tempo, tenha uma imagem anterior aberta no computador de aquisição e use-a como referência para encontrar a mesma área de interesse. Certifique-se de que o ângulo de imagem é semelhante ao das imagens anteriores para adquirir o mesmo conjunto de células com paralaxe mínima.
NOTA: É provável que seja necessário um ajuste adicional da posição da cabeça do rato para criar imagens das mesmas células que nos pontos de tempo anteriores (Figura 3). - Defina os limites Z da pilha de imagens navegando para os planos Z mais altos e mais baixos de interesse e adquira a imagem. Após a conclusão da aquisição da imagem, desative os PMTs e o obturador de emissão. Mude o caminho da luz de emissão de volta para a ocular e o caminho da luz de excitação para a iluminação de epifluorescência. Remova o rato da fase de microscópio.
- Desligamento de software e hardware do sistema
- Saia do software de aquisição de imagens. Desligue o laser na interface do computador. Desligue o hardware em ordem de inicialização inversa, com exceção do equipamento "Always-On".
- Recuperação do mouse
- Remova o suporte da cabeça e o rato da fase do microscópio. Se aplicável, ajuste o vaporizador de isoflurano para 0%. Remova o mouse do suporte da cabeça.
- Limpe suavemente o gel lubrificante para os olhos com um tecido sem fiapos e aplique pomada ocular lubrificante de óleo mineral de petrolato branco em ambos os olhos. Coloque o rato na almofada de aquecimento de circulação de água morna (regulada a 37 °C), continue a cuidar do rato e a monitorizar a sua frequência respiratória até que o rato acorde e recupere a capacidade ambulatória. Retorne o mouse ao seu invólucro.
- Se aplicável, avaliar a atividade e a morbidade dos animais 24 horas após a injeção intravítrea. Após a conclusão do estudo, eutanasiar o rato com uma sobredosagem de tribromoetanol (250 mg/kg) e realizar perfusão transcárdica com paraformaldeído a 4% para preservar o tecido da retina.
5. Processamento e análise de imagens
- Desintercalar e mesclar dados multicanal
- Como certos programas de software de aquisição de imagens armazenam imagens multicanal em um formato intercalado, abra o arquivo de imagem .tif usando software, como Fiji (https://imagej.net/Fiji), para separar os canais.
- No menu Imagem de Fiji, selecione Pilhas | Ferramentas | Desintercalação. Insira o número de canais que compõem a imagem e clique em OK.
- Para mesclar os canais separados em um único arquivo, vá para Imagem | Cor | Mesclar canais. Coloque os canais de imagem desintercalados em canais de cores separados e clique em OK para criar a imagem composta multicanal. Salve essa imagem composta como um novo arquivo .tif.
- Quantificação da intensidade de fluorescência em imagens multicanais
NOTA: A intensidade de fluorescência dentro de regiões de interesse designadas (ROIs) pode ser quantificada em planos de imagem única usando Fiji. A quantificação de leituras ratiométricas pode ser alcançada medindo a intensidade de fluorescência em diferentes canais de uma imagem composta dentro do mesmo ROI. Para experimentos de imagem crônica, é melhor usar biossensores baseados em saídas métricas de excitação ou emissão.- Em Fiji, vá para Analisar | Ferramentas | Gerente de ROI. Abra a imagem composta em Fiji. Role até a fatia z correspondente à estrutura de interesse e use as ferramentas Seleção (como Seleção de retângulo, Seleção oval, Seleção de polígono) para delinear os ROIs.
- Pressione T no teclado para adicionar cada seleção ao ROI Manager. Após a conclusão da seleção do ROI, clique em Medir no Gerenciador de ROI para registrar vários dados dos ROIs, como Área e Valor de Intensidade Média.
- Copie as medidas do canal atualmente selecionado registradas na janela Resultados para uma planilha. Alterne para o próximo Canal na janela Imagem composta e clique em Medir para obter medições para esse canal dentro do mesmo conjunto de ROIs. Dentro do ROI Manager, vá para Mais | Salve e salve os ROIs como um arquivo .zip.
- Projeções de intensidade máxima para exibição
- Para criar exibições dos dados da imagem, use a função Z-project em Fiji. No menu Imagem , selecione Pilha | Projeto Z. Escolha apenas os quadros dentro dos quais as áreas de interesse estão presentes para reduzir o plano de fundo.
- Se a remoção do ruído de disparo PMT for desejada, use a função de filtro Mediana. No menu Processo, selecione Processo | Filtros | Mediana. Escolha um valor de 1,0 para manter os detalhes espaciais.
- Para criar projeções de intensidade máxima focadas em células únicas, repita esse processo escolhendo apenas os quadros de imagem que correspondem à célula de interesse.
NOTA: Isso pode melhorar muito a capacidade de resolver árvores celulares (Figura 4). As medições da intensidade de fluorescência devem ser realizadas em planos de imagem única e não em projeções de intensidade máxima.
Resultados
Várias abordagens transgênicas, vetoriais virais ou de marcação de corantes inorgânicos podem ser usadas para visualizar especificamente vários tipos e estruturas de células da retina in vivo usando uma adaptação simples de um microscópio multifóton básico. Para visualizar RGCs e células amácrinas, camundongos transgênicos VGlut2-Cre e VGat-Cre, respectivamente, receberam uma injeção intravítrea de um construto de expressão AAV dependente de Cre que codifica Twitch2b, um sensor Ca 2+ baseado em transferência de energia de ressonância de fluorescência citoplasmática (FRET) que contém proteínas fluorescentes ciano e amarela (CFP e YFP, respectivamente) e o domínio de ligação Ca2+ da troponina15 . Em camundongos VGlut2-Cre, os somas RGC são claramente discerníveis, e os fascículos dos axônios são frequentemente aparentes (Figura 3).
Deve-se notar que a trajetória dos axônios e a imagem negativa da vasculatura tornam muito simples identificar a cabeça do nervo óptico em camundongos VGlut2-Cre, o que é útil como um marco em experimentos crônicos de imagem (Figura 3). Embora as células amácrinas pareçam menos brilhantes do que as RGCs, possivelmente devido ao seu menor tamanho de soma e / ou transdução de AAV menos eficiente, seus somas ainda são prontamente aparentes na camada nuclear interna. Em contraste com os RGCs, os neurites de células amácrinas são mais frequentemente observados nas camadas plexiformes internas (Figura 4). A micróglia retiniana pode ser fotografada na linha6 transgênica de camundongos Cx3cr1-GFP. A micróglia associa-se à vasculatura, tornando possível encontrar a mesma região em experimentos de imagem de lapso de tempo.
Essa abordagem pode ser usada para rastrear a dinâmica de processos de micróglias finas, um procedimento que tem melhor resolução espacial em imagens de plano único, ou se projeções de intensidade máxima são preparadas com foco em células individuais (Figura 5). A baixa resolução axial causada pela aberração óptica através da lente do mouse impede o exame de detalhes finos na dimensão z. Para determinar se esta técnica de imagem pode observar alterações degenerativas na ultraestrutura celular, 1 μL de 50 mM de N-metil-D-aspartato (NMDA) foi injetado no vítreo para induzir lesão excitotóxica. Um dia após a injeção, a micróglia demonstrou processos curtos ou morfologia ameboide (Figura 5) de acordo com relatos anteriores16. Deve-se notar que as células da linhagem transgênica Cx3cr1-GFP exibiram expressão proteica fluorescente mais uniforme e completa em toda a coorte celular do que em experimentos com entrega mediada por AAV de fluorescentes de expressão proteica. Os benefícios de uma rotulagem variada e esparsa versus completa e uniforme devem ser considerados ao projetar experimentos.
Para marcar a vasculatura da retina como descrito anteriormente8, camundongos foram injetados por via intraperitoneal com 200 μL de corante azul de Evans (20 mg/mL em solução salina estéril) 30-60 min antes da imagem. Isso levou a uma forte marcação dos vasos sanguíneos que emanam da cabeça do nervo óptico (Figura 6). Surpreendentemente, o sinal fluorescente de uma única injeção persistiu por pelo menos sete dias. Dois métodos distintos foram utilizados para estimar as dimensões das imagens in vivo. Primeiramente, as mesmas regiões da retina foram fotografadas in vivo e após fixação em todo-achatadas da retina por microscopia confocal (Figura 7). Pares de células aleatórias foram selecionados a partir de quatro diferentes amostras in vivo, e a distância verdadeira entre os pares de células foi medida em varreduras confocais e combinada com a distância de pixels in vivo para obter um tamanho médio de pixel de 0,99 μm com ampliação digital de 1x. O uso de métodos semelhantes correlacionando imagens in vivo com varreduras confocais de montagem completa revelou que uma única posição da cabeça permite a obtenção de imagens sobre um pedaço de retina de aproximadamente 650 mm2 .
O reposicionamento do suporte da cabeça ao longo de um eixo de torção pode permitir o acesso a uma região linear da retina de 2,2 mm de comprimento (não mostrada). Além disso, microesferas fluorescentes de 1 ou 2 μm de diâmetro foram injetadas nos olhos de camundongos e seu diâmetro foi medido como meio máximo de largura total de varreduras de linha a partir de imagens in vivo com zoom digital de 10x. Isso deu uma estimativa de tamanho de pixel um pouco maior, mas com mais variância (Figura 7). No geral, a imagem confocal de amostras inteiras após a conclusão de experimentos in vivo é o método mais consistente para atribuir escala a imagens individuais, pois a variância nas propriedades da córnea e da lente pode alterar a escala de imagem de amostra para amostra.
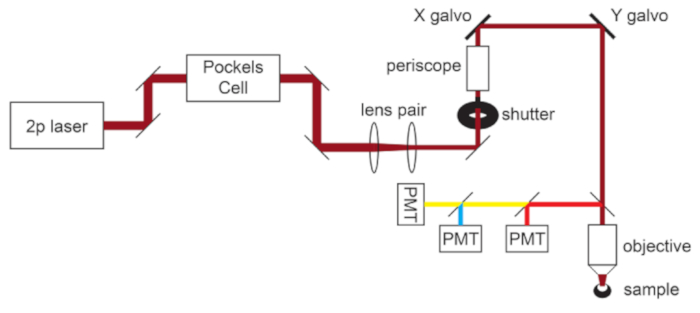
Figura 1: Esquema de caminho de luz. Os componentes básicos do microscópio de dois fótons usados neste protocolo consistem em uma célula de Pockels para modular a potência do laser, um par de lentes para reduzir o diâmetro do feixe de laser para corresponder à abertura traseira da objetiva do microscópio e um par de espelhos de varredura galvo para direção do feixe. Um par de espelhos de direção está presente antes de cada componente óptico principal. O foco é controlado por um motor que aciona a montagem objetiva. O caminho da luz de emissão pode ser personalizado para diferentes fluoróforos, trocando os filtros dicroicos e de barreira. Uma configuração geral para imagens ciano/amarelas/vermelhas é exibida na qual um espelho dicroico de passagem curta direciona a luz vermelha para o primeiro PMT, e um espelho dicroico de passagem longa emparelhado com filtros passa-banda apropriados é usado para separar as emissões ciano e amarela. Abreviação: PMT = tubo fotomultiplicador. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Posicionamento de camundongos para imagens in vivo. Para posicionar o mouse com a pupila no eixo com o caminho da luz, o rato anestesiado é primeiro contido em um suporte de cabeça, a cabeça é girada e angulada, uma grande gota de gel lubrificante para os olhos é colocada no olho e o mouse é colocado no palco. Uma tampa é montada no suporte da tampa perpendicular ao caminho da luz e abaixada em direção ao olho. A tampa não deve entrar em contato com a córnea ou a cabeça do rato (esquerda), o que será evidente se a tampa for desviada. No entanto, a folha de cobertura também deve estar perto o suficiente para evitar a cintura da gota (à direita), porque isso terá um efeito de desampliação na amostra. Depois de aplicar a imersão em gel e fixar a tampa, o estágio deve ser movido no lugar diretamente sob a objetiva do microscópio. Por favor, clique aqui para ver uma versão maior desta figura.
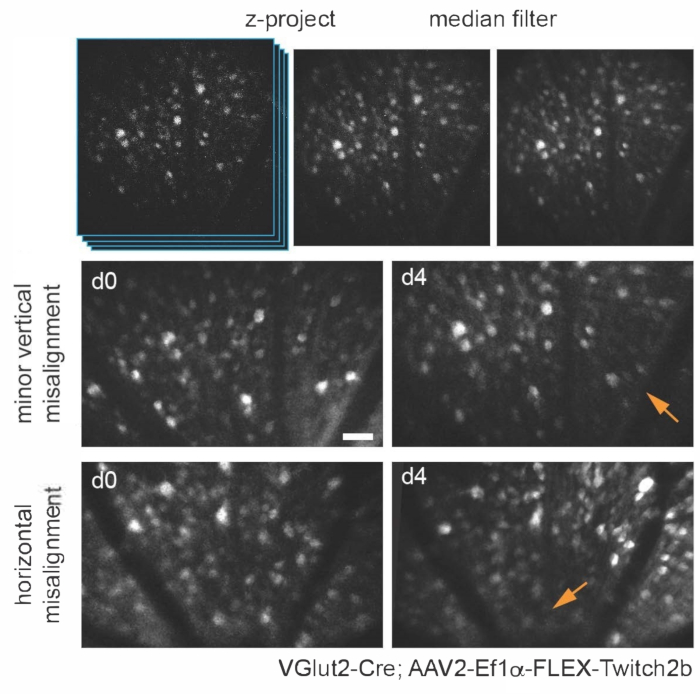
Figura 3: Imagem das células ganglionares da retina. Para exibição de imagens, projeções de intensidade máxima com os planos z contendo células de interesse são criadas e as imagens resultantes são filtradas pela mediana para remover o ruído de disparo PMT. Dois exemplos de células ganglionares da retina marcadas pela injeção de AAV-EF1α-FLEX-Twitch2b em camundongos transgênicos VGlut2-Cre são mostrados, especificamente o sinal CFP. As imagens foram adquiridas em sessões com quatro dias de intervalo, e marcos vasculares foram utilizados para retornar à mesma região próxima à cabeça do nervo óptico. A cabeça do nervo óptico é orientada para a parte inferior da imagem. Embora ambas as amostras apresentem alguma variância na orientação (regiões com intensidade diminuída são indicadas com setas), a maioria das células está presente em ambos os momentos. Barra de escala = aproximadamente 50 μm. Abreviaturas: PMT = tubo fotomultiplicador; AAV = vírus adenoassociado; EF1α = fator de alongamento-1alfa; FLEX = excisão por flip; VGlut2 = transportador vesicular de glutamato 2; CFP = proteína fluorescente ciano. Por favor, clique aqui para ver uma versão maior desta figura.
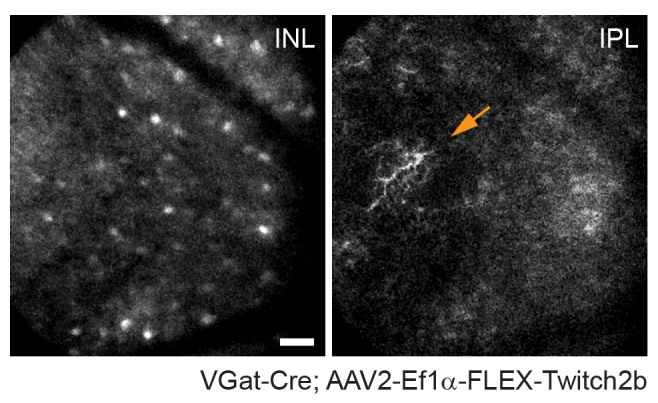
Figura 4: Imagem de células amácrinas. As células amácrinas foram marcadas injetando-se AAV-EF1α-FLEX-Twitch2b em camundongos transgênicos VGat-Cre. O sinal CFP do Twitch 2b é mostrado especificamente. Pequenas projeções de intensidade máxima focadas nas profundezas da camada nuclear interna indicam somas de células amácrinas, enquanto o foco no plexiforme interno resolve neurites de células amácrinas (seta). A cabeça do nervo óptico é orientada para a direita da imagem. Barra de escala = aproximadamente 50 μm. Abreviaturas: AAV = vírus adenoassociado; EF1α = fator de alongamento-1alfa; FLEX = excisão por flip; VGat = transportador vesicular de ácido gama aminobutírico; CFP = proteína fluorescente ciano; INL = camada nuclear interna; IPL = camada plexiforme interna. Por favor, clique aqui para ver uma versão maior desta figura.
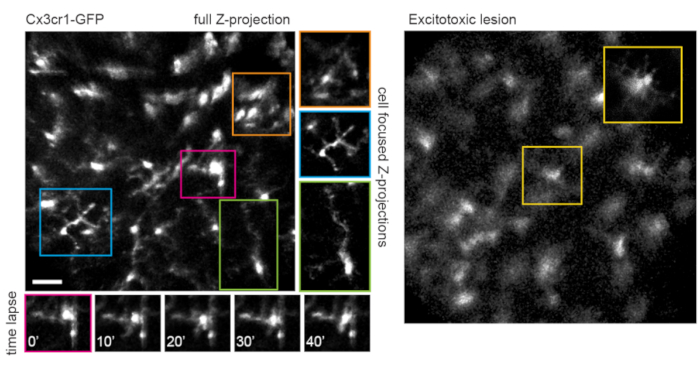
Figura 5: Microglia de imagem. A linhagem transgênica de camundongos Cx3cr1-GFP foi utilizada para marcar a micróglia. Uma projeção de intensidade máxima do volume total de varredura mostra muitas micróglias, algumas com detalhes finos do processo que podem ser resolvidos. Note-se que as células em direção ao canto inferior esquerdo do campo têm menos distorção na projeção máxima do que aquelas em direção ao canto superior direito devido à paralaxe nesta região. Projeções de intensidade máxima contendo apenas a célula de interesse reduzem significativamente essa paralaxe (centro, encaixotada nas cores correspondentes). Além disso, esta estratégia de imagem pode documentar a dinâmica do processo de remodelação da micróglia fina (painéis inferiores). Comparativamente, muitas micróglias podem ser observadas com processos curtos ou morfologia ameboide um dia após uma lesão excitotóxica por injeção intravítrea de NMDA de 50 mM (à direita). Barra de escala = aproximadamente 50 μm. Abreviaturas: GFP = proteína verde fluorescente; Cx3cr1 = receptor de quimiocina Cx3 1; NMDA = N-metil-D-aspartato. Por favor, clique aqui para ver uma versão maior desta figura.
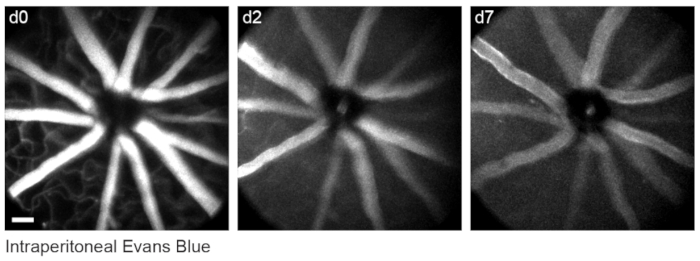
Figura 6: Rotulagem dos marcos vasculares. Os camundongos foram injetados com 200 μL de 20 mg/mL de azul de Evans por via intraperitoneal 30-60 min antes da primeira sessão de imagem. Projeções de intensidade máxima de espessura total demonstram fluorescência duradoura na vasculatura da retina que persistiu por pelo menos sete dias. Barra de escala = aproximadamente 50 μm. Clique aqui para ver uma versão maior desta figura.
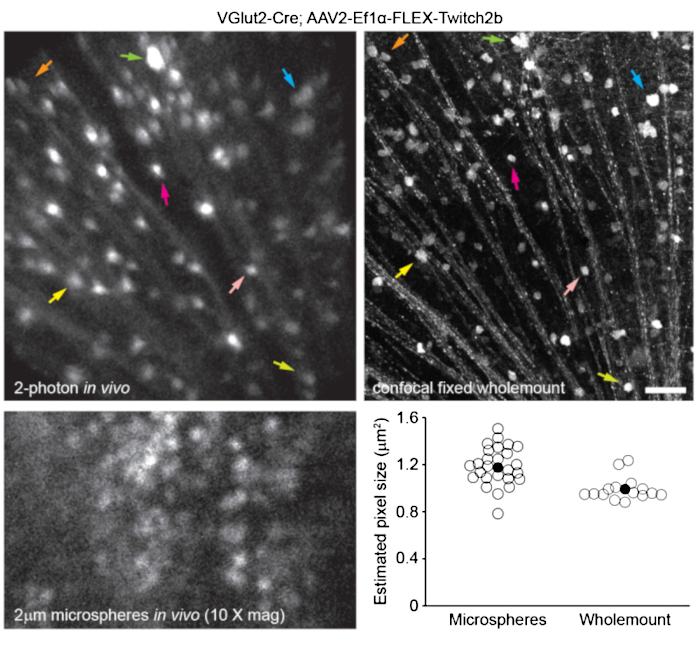
Figura 7: Dimensões da imagem. Células ganglionares da retina marcadas pela injeção de AAV-EF1α-FLEX-Twitch2b em camundongos transgênicos VGlut2-Cre foram fotografadas in vivo, e a mesma região foi então fotografada por microscopia confocal de varredura a laser após fixação e preparação integral da retina. O canal de proteína fluorescente amarela é mostrado para ambos. Pares de setas coloridas indicam a mesma célula em ambas as preparações (painéis superiores). Imagem de plano único de microesferas fluorescentes de 2 μm de diâmetro injetadas intravitalmente e fotografadas in vivo (painel inferior esquerdo). As microesferas não se assentaram e, portanto, estavam em constante movimento, impossibilitando a medição da resolução axial. Tamanhos de pixel calculados a partir de medições de largura total de meio máximo de microesferas fluorescentes in vivo ou medições confocais correlativas tomadas de 2-4 retinas por grupo (canto inferior direito). Barra de escala = 50 μm. Abreviaturas: AAV = vírus adenoassociado; EF1α = fator de alongamento-1alfa; FLEX = excisão por flip; VGlut2 = transportador vesicular de glutamato 2. Por favor, clique aqui para ver uma versão maior desta figura.
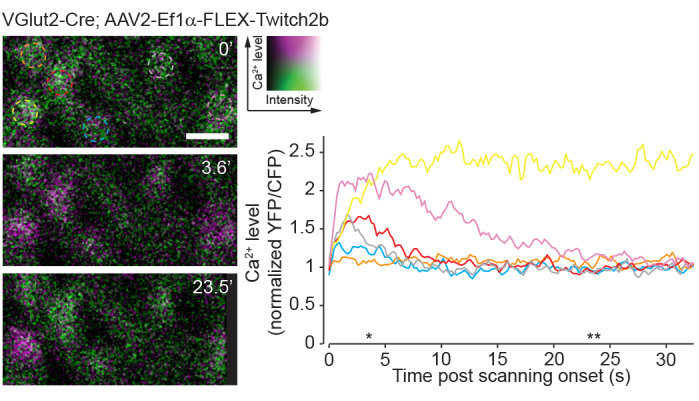
Figura 8: Atividade de cálcio induzida pela varredura de dois fótons. Células ganglionares da retina marcadas pela injeção de AAV-EF1α-FLEX-Twitch2b em camundongos transgênicos VGlut2-Cre, YFP é magenta pseudocolorido e CFP verde, fotografado em um único plano como uma série temporal a 4,22 Hz. Todos os RGCs apresentaram uma relação YFP/CFP inicial semelhante. A maioria respondeu com um aumento na relação FRET (excluindo a célula laranja), e um manteve uma alta relação YFP/CFP ao longo da série temporal (célula amarela). As relações YFP/CFP foram normalizadas para a média do primeiro quadro, e os círculos coloridos correspondem aos traços coloridos. Os asteriscos indicam pontos de tempo com imagens representativas exibidas à esquerda. Barra de escala = 20 μm. Abreviaturas: AAV = vírus adenoassociado; EF1α = fator de alongamento-1alfa; FLEX = excisão por flip; VGlut2 = transportador vesicular de glutamato 2; YFP = proteína fluorescente amarela; CFP = proteína fluorescente ciano; RGCs = células ganglionares da retina; FRET = transferência de energia de ressonância de fluorescência. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
O procedimento de imagem de dois fótons aqui descrito permite a imagem longitudinal in vivo da retina do rato. Imagens repetíveis da mesma região da retina podem ser obtidas por um período contínuo de até 6 ou mais h sob isoflurano. O camundongo também pode ser fotografado em dias diferentes usando marcos celulares e vasculares para localizar a mesma área de imagem (Figura 3). O uso de uma imersão em gel transparente combinada com vidro de cobertura para esse fim já foi aplicado a uma série de procedimentos, incluindo visualização da retina para injeção sub-retiniana, modelos de lesão retiniana induzida por laser e imagem de fundode olho 20,21,22.
A anatomia do olho apresenta desafios únicos para a imagem in vivo, já que o alto poder óptico da córnea e da lente do mouse impede a imagem direta através da pupila sem correção. Vários outros métodos de imagem in vivo contam com o uso de uma lente de contato plano-côncava para correção da óptica anterior do olho de camundongo 7,17,18,19. Com apenas correção óptica na córnea, o alto poder óptico da lente do mouse resulta em uma quantidade inevitável de paralaxe, particularmente de estruturas no campo de varredura periférico, manifestando-se como alongamento e movimento de translação na dimensão X-Y em diferentes planos Z. Para minimizar a distorção relacionada à paralaxe de imagem nas dimensões X e Y, é crucial que o olho do rato seja orientado de tal forma que o plano tangente à retina na área de imagem seja perpendicular ao caminho da luz do microscópio. A configuração descrita aqui é propícia à manipulação precisa do ângulo do olho para alcançar esse alinhamento. Um suporte ajustável da cabeça do mouse que permite a rotação ao longo de dois eixos permite ajustes manuais fáceis do ângulo do olho à medida que o experimentador percorre a dimensão Z para minimizar a paralaxe. Essa inclinação também contorna o efeito de parada de campo da pupila para permitir a imagem de áreas maiores da retina. A contenção do suporte da cabeça também reduz muito os artefatos de movimento causados pela respiração.
Deve-se tomar cuidado para manter a clareza do olho do rato, pois a qualidade da imagem se deteriorará com a opacificação durante a imagem contínua. A reaplicação frequente de gel lubrificante durante a imagem e a aplicação de pomada após cada sessão de imagem ajudam a evitar que o olho seque e desenvolva opacidades. Algumas opacidades corneanas se resolverão espontaneamente após 24-48 h. O uso de gel transparente e vidro de cobertura, conforme descrito neste protocolo, proporciona qualidade de imagem e correção de aberração semelhantes às de uma lente de contato7, ao mesmo tempo em que permite ajustes mais fáceis do ângulo dos olhos sem a necessidade de realinhar o vidro de cobertura. Além disso, o gel proporciona hidratação contínua ao olho, possibilitando a realização de sessões de imagem aguda de até várias horas. Finalmente, uma vez que o vidro da tampa não entra em contato com a córnea, causa irritação mínima no olho que pode reduzir a clareza óptica para sessões de imagem repetidas.
Uma limitação dessa abordagem é o fato de que as aberrações ópticas não são totalmente corrigidas. Embora isso diminua severamente a resolução axial devido à paralaxe pesada, as medições quantitativas do soma podem ser obtidas em planos de imagem única. Deve-se notar que, como a intensidade do sinal de fluorescência dos neurônios da retina depende do alinhamento da amostra com esse método, os sensores baseados em razão de excitação e emissão são mais apropriados para experimentos que comparam amostras cronicamente em diferentes sessões de imagem. Uma abordagem para corrigir aberrações ópticas no nível do sistema é a óptica adaptativa, que permite a resolução subcelular na retina 8,9,14,21. No entanto, a óptica adaptativa requer equipamentos altamente especializados e ampla experiência para implementar.
Abordagens alternativas para imagens de retina in vivo de dois fótons são a microscopia confocal ou a oftalmoscopia6. A abordagem aqui apresentada deve ser facilmente traduzível para microscopia de campo largo ou confocal. A imagem de fóton único é talvez mais robusta e representa menos risco de danificar a retina devido à alta energia do laser de dois fótons necessária para alcançar um efeito eficiente de dois fótons através da córnea e da lente do olho. Para evitar danos ao laser de dois fótons, o limiar para a potência máxima do laser deve ser determinado empiricamente examinando retinas inteiras após a conclusão de experimentos de imagem e imunocoloração para tipos de células nas camadas fotografadas. No sistema aqui apresentado, os RGCs foram rotulados com o marcador pan-RGC, Rbpms, e as densidades foram normais até 45 mW de potência de imagem, enquanto 55 mW causaram uma perda significativa de RGCs (não mostrado).
Uma desvantagem da imagem de fóton único é o fato de que essa abordagem estimulará fortemente os circuitos visuais nativos da retina em comparação com a imagem de dois fótons23. Experimentos anteriores usando montagens inteiras de retina ou preparações de óculos mostraram que a varredura a laser de dois fótons provoca uma ativação de circuito que é em grande parte transitória24. Aqui, a imagem da atividade do RGC com o sensor Ca 2+ Twitch2b mostra que o início da varredura a laser induz elevações de Ca 2+, que retornam à linha de base ao longo de5-20 s na maioria dos RGCs (Figura 8). Dado que a potência do laser neste protocolo está na faixa de experimentos anteriores relatando resposta à luz retiniana in vivo8, o método atualmente descrito é provavelmente passível de registros da atividade do circuito na retina. Tais considerações são importantes para experimentos que podem ser influenciados pela atividade do circuito.
Este protocolo demonstra imagens in vivo de dois tipos de neurônios da retina, RGCs e células amácrinas. Marcação semelhante de outros tipos de células principais pode ser alcançada, incluindo células horizontais (Cx57-Cre 25), células bipolares (Chx10-Cre 26; mGluR6-GFP 27), fotorreceptores de cone (S- ou M-opsin-Cre 28), fotorreceptores de bastonetes (Nrl-Cre 29), glia de Müller (Foxg1-Cre 26) e pericitos (NG2-DsRed9). Camundongos transgênicos também estão disponíveis para rotular subconjuntos discretos de RGCs (por exemplo, KCNG4-Cre para αRGCs30; OPN4-Cre para ipRGCs31; JAM-B-CreER para J-RGCs 32) e células amácrinas (por exemplo, ChAT-Cre para células amácrinasstarburst 26 e drivers promotores de neuropeptídeos para vários subtipos de células amácrinas 3,34). Vetores virais podem ser usados para atingir populações celulares específicas em vez de camundongos transgênicos. Injeções intravítreas de AAV2 com um elemento promotor CAG onipresente rotulam quase exclusivamente RGCs, células amácrinas e células horizontais25. O emparelhamento do capsídeo modificado AAV2.7m8-Y444F com uma construção promotora mGluR6 modificada permite uma ampla marcação das células bipolares ON35. As injeções sub-retinianas de AAV levam a um enriquecimento dos fotorreceptores, com o sorotipo AAV2/5 tendo a maior eficiência de transdução36. Shh10, uma proteína modificada do capsídeo AAV6, emparelhada com elementos promotores de proteína ácida fibrilar glial, demonstrou ser específica para a glia de Müller37.
A capacidade de observar células do sistema nervoso central com uma abordagem completamente não invasiva pode ser utilizada para estudar tanto as propriedades básicas dos circuitos neurais8, quanto os mecanismos de neurodegeneração 3,4,5,6,38. Muitas doenças cegantes têm como alvo populações celulares na retina, e abordagens de imagem in vivo em camundongos têm sido usadas para estudar lesão do nervo óptico 1,3,4, degeneração macular13, acidente vascular cerebral5, glaucoma 2,6 e uveíte7. Além disso, muitas condições neurodegenerativas do sistema nervoso central se manifestam na retina, incluindo a doença de Alzheimer39, a esclerose múltipla40 e a doença de Parkinson41. Portanto, esta técnica prontamente acessível para imagens in vivo da retina pode ser aplicada como uma ferramenta para estudar um amplo conjunto de condições neurodegenerativas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por doações da Research to Prevent Blindness Foundation (Career Development Award to P.R.W. e uma doação irrestrita ao Departamento de Oftalmologia e Ciências Visuais da Washington University School of Medicine em St. Louis), National Glaucoma Research (um programa da BrightFocus Foundation) e do McDonnell Center for Cellular and Molecular Neurobiology. Z.W. é apoiado por um Prêmio Institucional do Serviço Nacional de Pesquisa T32 EY013360. Este trabalho também foi apoiado pelo Hope Center Viral Vectors Core da Escola de Medicina da Universidade de Washington.
Materiais
| Name | Company | Catalog Number | Comments |
| #1.5 coverslip | ThermoFisher | 152440 | Richard-Allan #1.5 24 mm x 40 mm |
| 50 mL glass syringe | Hamilton | 80950 | 22G cemented needle |
| Adeno-associated virus (AAV2) | Hope Center Viral Core | NA | |
| Anesthesia Air Pump | RWD Life Science | R510-30 | |
| Atropine | Sigma | A0132 | For pupil dilator solution |
| Basic Small Animal Anesthesia Device | RWD Life Science | R500IE | |
| Borosilicate glass capillary | Sutter | B150-86-10 | Outside diameter 1.50 mm, inside diameter 0.86 mm, length 10 cm |
| CFP/YFP filter cube | Chroma | custom | 480/40, 505 long pass, 535/30 |
| ChromoFlex - Two channel PMT detection unit | Scientifica | S-MPLG-1002 | |
| Circulating heating pump | Braintree Scientific | tp-700 | Set to 37 °C |
| Cling film | VWR | 10713-916 | |
| Compact Filter Holder | ThorLabs | DH1 | Holds coverslip over mouse eye |
| Cx3cr1-GFP transgenic mice (B6.129P2(Cg)-Cx3cr1tm1Litt/J) | The Jackson Laboratory | 005582 | |
| DAQ controller chassis | National Instruments | PXIe-1073 | |
| Data acquisition device | National Instruments | BNC-2090A | |
| Evans Blue dye | Fisher Scientific | AAA1677409 | |
| FPGA module with digitizer | National Instruments | NI-5734 | |
| Gas Evacuation Apparatus | RWD Life Science | R546W | |
| GenTeal Severe lubricant eye gel | Alcon | (from local pharmacy) | For use during imaging |
| GFP/Red filter cube | Chroma | custom | 535/30, 560 long pass, 605/70 |
| Heating pad | McKesson Medical and Surgical | 190147 | |
| HyperScope Launch Optics for use with Pockels Cell | Scientifica | S-MP-101080 | |
| HyperScope Main module | Scientifica | S-MP-100466 | |
| HyperScope Scan Path | Scientifica | S-MP-100406 | |
| HyperScope X galvo Module | Scientifica | MP-100443 | |
| ImageJ Fiji software | Freeware | ||
| Isoflurane | Patterson Veterinary | NDC 14043-704-06 | |
| Isoflurane gas filter cannister (active scavenging) | RWD Life Science | R510-31 | |
| Isoflurane gas filter cannister (passive scavenging) | RWD Life Science | R510-31S | |
| ketamine HCl (100 mg/mL) | Vedco | NDC 50989-161-06 | |
| M32 to M26 adapter | ThorLabs | M32M26S | |
| MaiTai GUI software | Spectra-Physics | NA | |
| MATLAB software | MathWorks | NA | R2015b |
| meloxicam (5 mg/mL) | Boehringer Ingelheim | NDC 0010-6013-01 | Analgesic |
| Micorscope Objective | Edmund Optics | 46-404 | Mitutoyo WE715042319 |
| micropipette puller | Sutter | Flaming/Brown Model P-97 | |
| Mineral oil | Fisher | BP2629-1 | |
| Mini bulldog hemostatic clamp | Fine Science Tools | 18053-28 | |
| Miniature EVA Tubing 0.02" ID, 0.06" OD | McMaster Carr | 1883T1 | |
| Miniature EVA Tubing 0.05" ID, 0.09" OD | McMaster Carr | 1883T4 | |
| Mouse head holder | Narishige | SGM-4 | |
| No. 5 Forceps | Fine Science Tools | 11251-10 | |
| Optic Posts 1/2" | ThorLabs | TR3-P5 | |
| Optical power meter kit | ThorLabs | PM100D | |
| pE-300 Ultra LLG Deivery | Scientifica | COO-LED3ULLGs | |
| Phenylephrine hydrochloride | Sigma | P6126 | For pupil dilator solution |
| Pockels cell | Conoptics | 350-80-02 | |
| Pockels cell amplifier | Conoptics | Model 302RM | |
| Proparacaine hydrochloride | Sigma | 1571001 | For eye immobilization |
| Red & Far Red short pass filter Cube | Chroma | custom | 560 short pass |
| Rotating 1/2" post clamp | ThorLabs | SWC | |
| ScanImage package | Vidrio Technologies | Freeware | Image acquisition software; Version 5.4.0 (2018); requires MATLAB |
| sodium chloride solution, sterile (0.9%) | Fresenius Kabi | NDC 63323-186-01 | |
| Stereomicroscope | Leica | S9 E | |
| Tabletop centrifuge | Oxford | Benchmate C8 | |
| Terramycin oxytetracycline/polymyxin B antibiotic ophthalmic ointment | Zoetisus | NA | For use after intravitreal injection |
| ThermoRack cooling system | Solid State Cooling Systems | ThermoRack 401 | Set to 20 °C |
| Ultrafast Ti:Sapphire laser | Spectra-Physics | Mai Tai DeepSee | |
| Vgat-Cre transgenic mice (Slc32a1tm2(cre)Lowl/J) | The Jackson Laboratory | 016962 | |
| VGlut2-Cre transgenic mice (Slc17a6tm2(cre)Lowl/J) | The Jackson Laboratory | 016963 | |
| VivoScope for In Vivo Imaging | Scientifica | S-MPVS-1200-00P | |
| White petrolatum-mineral oil lubricant eye ointment | Stye | NA | For use after imaging |
| xylazine HCl (20 mg/mL) | Akorn | NDC 59399-110-20 |
Referências
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Scientific Reports. 8 (1), 1490 (2018).
- Liu, H., Ding, C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose. Experimental and Therapeutic Medicine. 14 (3), 1953-1960 (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), 40352 (2012).
- Leung, C. K., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Investigative Ophthalmology & Visual Science. 49 (11), 4898-4902 (2008).
- Murata, H., et al. Imaging mouse retinal ganglion cells and their loss in vivo by a fundus camera in the normal and ischemia-reperfusion model. Investigative Ophthalmology & Visual Science. 49 (12), 5546-5552 (2008).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. Journal of Visualized Experiments. (99), e52731 (2015).
- Bremer, D., et al. Longitudinal Intravital Imaging of the Retina Reveals Long-term Dynamics of Immune Infiltration and Its Effects on the Glial Network in Experimental Autoimmune Uveoretinitis, without Evident Signs of Neuronal Dysfunction in the Ganglion Cell Layer. Frontiers in Immunology. 7, 642 (2016).
- Qin, Z., et al. Adaptive optics two-photon microscopy enables near-diffraction-limited and functional retinal imaging in vivo. Light: Science & Applications. 9, 79 (2020).
- Schallek, J., Geng, Y., Nguyen, H., Williams, D. R. Morphology and topography of retinal pericytes in the living mouse retina using in vivo adaptive optics imaging and ex vivo characterization. Investigative Ophthalmology & Visual Science. 54 (13), 8237-8250 (2013).
- Williams, D. R. Imaging single cells in the living retina. Vision Research. 51 (13), 1379-1396 (2011).
- Carroll, J., Neitz, M., Hofer, H., Neitz, J., Williams, D. R. Functional photoreceptor loss revealed with adaptive optics: an alternate cause of color blindness. Proceedings of the National Academy of Sciences of the United States of America. 101 (22), 8461-8466 (2004).
- Rossi, E. A., et al. Imaging retinal mosaics in the living eye. Eye. 25 (3), 301-308 (2011).
- Rossi, E. A., et al. In vivo imaging of retinal pigment epithelium cells in age related macular degeneration. Biomedical Optics Express. 4 (11), 2527-2539 (2013).
- Geng, Y., et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 3 (4), 715-734 (2012).
- Thestrup, T., et al. Optimized ratiometric calcium sensors for functional in vivo imaging of neurons and T lymphocytes. Nature Methods. 11 (2), 175-182 (2014).
- Takeda, A., et al. Microglia mediate non-cell-autonomous cell death of retinal ganglion cells. Glia. 66 (11), 2366-2384 (2018).
- Ikeda, W., Nakatani, T., Uemura, A. Cataract-preventing contact lens for in vivo imaging of mouse retina. Biotechniques. 65 (2), 101-104 (2018).
- Palczewska, G., Kern, T. S., Palczewski, K., Weber, B. H. F., Langmann, T. Noninvasive two-photon microscopy imaging of mouse retina and retinal pigment epithelium. Retinal Degeneration. Methods in Molecular Biology. 1834, 333-343 (2019).
- Wahl, D. J., Jian, Y., Bonora, S., Zawadzki, R. J., Sarunic, M. V. Wavefront sensorless adaptive optics fluorescence biomicroscope for in vivo retinal imaging in mice. Biomedical Optics Express. 7 (1), 1-12 (2016).
- Park, S. W., Kim, J. H., Park, W. J., Kim, J. H. Limbal approach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium. Journal of Visualized Experiments. (102), e53030 (2015).
- Biss, D. P., et al. In vivo fluorescent imaging of the mouse retina using adaptive optics. Optics Letters. 32 (6), 659-661 (2007).
- Shah, R. S., Soetikno, B. T., Lajko, M., Fawzi, A. A. A mouse model for laser-induced choroidal neovascularization. Journal of Visualized Experiments. (106), e53502 (2015).
- Palczewska, G., et al. Human infrared vision is triggered by two-photon chromophore isomerization. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5445-5454 (2014).
- Euler, T., et al. Eyecup scope--optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Archive-European Journal of Physiology. 457 (6), 1393-1414 (2009).
- Zhang, Y., et al. Elevating Growth Factor Responsiveness and Axon Regeneration by Modulating Presynaptic Inputs. Neuron. 103 (1), 39-51 (2019).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Akimoto, M., et al. Transgenic mice expressing Cre-recombinase specifically in M- or S-cone photoreceptors. Investigative Ophthalmology & Visual Science. 45 (1), 42-47 (2004).
- Brightman, D. S., Razafsky, D., Potter, C., Hodzic, D., Chen, S. Nrl-Cre transgenic mouse mediates loxP recombination in developing rod photoreceptors. Genesis. 54 (3), 129-135 (2016).
- Duan, X., et al. Subtype-specific regeneration of retinal ganglion cells following axotomy: effects of osteopontin and mTOR signaling. Neuron. 85 (6), 1244-1256 (2015).
- Ecker, J. L., et al. Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron. 67 (1), 49-60 (2010).
- Kim, I. J., Zhang, Y., Yamagata, M., Meister, M., Sanes, J. R. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452 (7186), 478-482 (2008).
- Akrouh, A., Kerschensteiner, D. Morphology and function of three VIP-expressing amacrine cell types in the mouse retina. Journal of Neurophysiology. 114 (4), 2431-2438 (2015).
- Zhu, Y., Xu, J., Hauswirth, W. W., DeVries, S. H. Genetically targeted binary labeling of retinal neurons. Journal of Neuroscience. 34 (23), 7845-7861 (2014).
- Lu, Q., et al. AAV-mediated transduction and targeting of retinal bipolar cells with improved mGluR6 promoters in rodents and primates. Gene Therapy. 23 (8-9), 680-689 (2016).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Research. 48 (3), 353-359 (2008).
- Yao, K., et al. Wnt regulates proliferation and neurogenic potential of Muller glial cells via a Lin28/let-7 miRNA-dependent pathway in adult mammalian retinas. Cell Reports. 17 (1), 165-178 (2016).
- Williams, P. R., et al. A recoverable state of axon injury persists for hours after spinal cord contusion in vivo. Nature Communications. 5, 5683 (2014).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's & Dementia. 10 (2), 135-142 (2014).
- Kerrison, J. B., Flynn, T., Green, W. R. Retinal pathologic changes in multiple sclerosis. Retina. 14 (5), 445-451 (1994).
- Sung, M. S., et al. Inner retinal thinning as a biomarker for cognitive impairment in de novo Parkinson's disease. Scientific Reports. 9 (1), 11832 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados