Method Article
Fluorímetro miniatura de código abierto para monitorear las reacciones de amplificación de ácidos nucleicos isotérmicos en tiempo real en entornos de recursos limitados
* Estos autores han contribuido por igual
En este artículo
Resumen
Se proporcionan instrucciones detalladas para construir un fluorímetro modular de código abierto que sea compatible con muchos calentadores de bajo costo para realizar la amplificación cuantitativa de ácidos nucleicos cuantitativos en tiempo real.
Resumen
Los métodos tradicionales para detectar y cuantificar los ácidos nucleicos se basan en la reacción en cadena de la polimerasa (PCR) y requieren el uso de termocicladores costosos con detección integrada de fluorescencia de amplicones. Las tecnologías de amplificación de ácidos nucleicos isotérmicos eliminan la necesidad de ciclos térmicos; sin embargo, la detección de productos basada en fluorescencia todavía es necesaria para obtener resultados cuantitativos en tiempo real. Varios calentadores isotérmicos portátiles con detección de fluorescencia integrada ahora están disponibles comercialmente; sin embargo, el costo de estos dispositivos sigue siendo una barrera significativa para la adopción generalizada en entornos de recursos limitados. Aquí se describe un protocolo para el diseño y ensamblaje de un fluorímetro modular de bajo costo construido a partir de componentes listos para usar. Encerrado en una carcasa compacta impresa en 3D, el fluorímetro está diseñado para colocarse encima de un bloque de calor disponible comercialmente que sostiene un tubo de PCR. El fluorímetro descrito aquí fue optimizado para detectar el tinte del isotiocianato de la fluoresceína (FITC), pero el sistema se puede modificar para el uso con los tintes usados comúnmente como reporteros en reacciones en tiempo real de la amplificación del ácido nucleico. La aplicabilidad clínica del sistema se demuestra mediante la realización de la detección de ácidos nucleicos en tiempo real con dos tecnologías de amplificación isotérmica: la amplificación de la polimerasa recombinasa (RPA) para la detección de ADN de control positivo proporcionado en un kit comercial y la amplificación isotérmica mediada por bucle de transcripción inversa (RT-LAMP) para la detección de niveles clínicamente significativos de ARN del SARS-CoV-2.
Introducción
Las tecnologías de amplificación isotérmica son ampliamente utilizadas para la detección de ácidos nucleicos. En comparación con los enfoques tradicionales de PCR que requieren termociclado, la amplificación isotérmica permite que la amplificación de ácidos nucleicos se produzca a una sola temperatura, lo que permite un tiempo de respuesta más rápido y una mejor tolerancia de los inhibidores1,2. Otro beneficio clave de la amplificación isotérmica es la reducción de la complejidad de la instrumentación. La mayoría de las reacciones de amplificación isotérmica sólo requieren un bloque de calor y una modalidad de detección, ya sea la detección en tiempo real a través de la monitorización de la fluorescencia o la detección de puntos finales, por ejemplo, por flujo lateral o electroforesis en gel3,4. La detección de fluorescencia en tiempo real se logra a través de la detección de fluorescencia producida por colorantes intercalantes que se activan en presencia de ADN de doble cadena o sondas fluorescentes apagadas que se activan en presencia de secuencias específicas de ADN de doble cadena.
Si bien existen fluorímetros isotérmicos de sobremesa disponibles en el comercio, muchos carecen de personalización para la implementación de ensayos. Por ejemplo, muchos dispositivos requieren consumibles específicos o proporcionados por la empresa, recomiendan proveedores preferidos o utilizan software propietario para obtener resultados anunciados. La mayoría de estos sistemas cuestan más de $5,000 USD, lo que representa una barrera significativa para el uso generalizado en entornos de recursos limitados. Además, los usuarios en entornos de bajos recursos se enfrentan a desafíos para mantener equipos diseñados para entornos de altos recursos debido a las duras condiciones ambientales, las cadenas de suministro débiles para las piezas de repuesto y las herramientas especializadas necesarias para el mantenimiento y la reparación5. Para satisfacer esta necesidad, aquí se describe el diseño y montaje de un fluorímetro modular y de bajo costo construido a partir de componentes listos para usar encerrados en una carcasa compacta impresa en 3D(Figuras 1A-C)con dos configuraciones opcionales. La primera configuración de este dispositivo utiliza filtros de vidrio disponibles comercialmente y un espejo dicroico para bloquear el exceso de luz de fondo y tiene un costo total de montaje de $ 830 USD. Si bien estos filtros se utilizan comúnmente en sistemas de imágenes basados en fluorescencia, la sustitución de costosas láminas de filtro óptico de alto grado se ha demostrado previamente que permite la detección de ácidos nucleicos6. La segunda configuración del fluorímetro incorpora estos filtros económicos y reemplaza los espejos dicroicos con divisores de haz de φ1/2", reduciendo el costo total del sistema de $ 830 a $ 450 USD.
Las imágenes representativas del ensamblaje se muestran para la primera configuración en la Figura 1 y la Figura 2,pero las imágenes análogas para la segunda configuración se pueden encontrar en el Archivo Suplementario 6. Para evitar la necesidad de una alineación óptica especializada, el sistema óptico ha designado áreas para colocar cada componente óptico y se puede hacer con una impresora 3D de gama relativamente baja, lo que permite un uso generalizado del diseño. Las únicas diferencias en la construcción y el montaje para las dos configuraciones son los archivos utilizados para la impresión 3D y los componentes ópticos colocados en el gabinete. Las dimensiones externas de la carcasa impresa en 3D para ambos sistemas son las mismas. En el Cuadro 1se muestra una comparación de costes de los dos sistemas.
Como se muestra en la Figura 1A,para mantener un factor de forma pequeño, el fluorímetro consiste en ópticas de Φ1/2" (~12,5 mm), junto con iluminación compacta y detección que se colocan para medir la señal a través de la parte superior del tubo de PCR. El sistema de la Figura 1 está diseñado para detectar colorantes con longitudes de onda de excitación y emisión máximas cercanas a 490 nm y 525 nm, respectivamente, incluyendo FITC y colorantes estrechamente relacionados como SYBR y SYTO-9, que se utilizan comúnmente como reporteros en reacciones de amplificación de ácidos nucleicos en tiempo real7,8. La fuente de excitación, los filtros ópticos y el detector se pueden sustituir fácilmente por componentes compatibles con diferentes tintes fluorescentes según se desee. Las reacciones de amplificación de ácidos nucleicos se realizan típicamente en tubos de PCR, y el fluorímetro está diseñado para colocarse encima de cualquier bloque de calor disponible comercialmente que contenga tubos de PCR(Figura 1D)lo que permite el monitoreo en tiempo real de las reacciones isotérmicas. Los bloques de calor apropiados están disponibles en la mayoría de los laboratorios biomédicos y se pueden comprar por menos de $ 500 USD.
El uso de computadoras de placa única para proporcionar una alternativa de bajo costo en el punto de atención para controlar las tecnologías de imágenes se ha demostradopreviamente 9. A partir de ese trabajo, en este protocolo se utiliza una interfaz gráfica de usuario alimentada por computadora de placa única(Figura 1D)para facilitar el registro de datos en tiempo real y la visualización de resultados en el punto de atención, eliminando la necesidad de que una computadora portátil procese o visualice datos. Las mediciones de fluorescencia se transfirieron a través del protocolo I2C de los sensores de luz a un microcontrolador, y luego se pusieron a disposición de la computadora de placa única a través de la comunicación en serie. Las conexiones eléctricas para la iluminación y la transferencia de datos se proporcionaron a través de cableado simplificado y soldadura en placas de pan miniaturizadas, negando la necesidad de placas de circuito impreso (PCB) especializadas. El software necesario para ejecutar el fluorímetro está disponible a través de marcos de software de código abierto y el código necesario para ejecutar el dispositivo se proporciona en los archivos de codificación suplementarios. El fluorímetro completo se puede ensamblar por entre $ 450 a $ 830 USD, y los resultados muestran que proporciona mediciones de fluorescencia precisas y confiables para monitorear la amplificación isotérmica en tiempo real de los ácidos nucleicos.
Protocolo
1. Pasos de preparación: impresión 3D y soldadura
NOTA: El sistema óptico descrito en este protocolo está diseñado para un calentador de bloque seco estándar.
- Para crear la primera configuración, imprima en 3D los archivos CAD proporcionados como archivos suplementarios 1, 2 y 3 respectivamente:
- Para crear la segunda configuración, imprima en 3D los archivos CAD proporcionados como archivos suplementarios 3, 4 y 5,respectivamente:
NOTA: Estas piezas están diseñadas para imprimirse con soportes. En esta guía se utiliza un filamento negro de policarbonato que puede mantener su forma tras ser sometido a temperaturas de hasta 110 ºC. En general, se puede utilizar cualquier material que se pueda calentar a la temperatura de la reacción isotérmica deseada sin una deformación significativa. Para minimizar el efecto de los reflejos internos y la interferencia de la luz ambiental, se recomienda un material que sea negro u otro color oscuro. - Prepare los dos módulos de evaluación de sensores de luz a digital para la supervisión paralela de dos muestras. En una de las placas de prueba del sensor, retire la resistencia R4 y sumele un cable de puente desde la almohadilla derecha del área R4 en la PCB hasta la almohadilla superior en el área R1 en la PCB. Esto cambiará la dirección I2C del sensor, permitiendo así la medición simultánea de ambos sensores.
NOTA: El sensor utilizado consta de dos PCB: una placa adaptadora USB y una placa de prueba de sensor que contiene el sensor de luz; sólo se necesita la placa de prueba del sensor para este dispositivo. - Soldadura de cables a cada uno de los dos diodos emisores de luz (LED). Conecte un cable rojo (positivo) a la almohadilla etiquetada "1" en el LED y un cable negro (negativo) en la almohadilla etiquetada "2" en el LED. Aplique una capa delgada de adhesivo térmico en la parte posterior del LED, coloque el LED en la parte superior de una tapa final y espere hasta que el adhesivo térmico se cure. En el otro lado de la tapa final, agregue un disipador de calor.
NOTA: Al probar los LED antes de que se sellen en el gabinete, asegúrese de usar una protección ocular de bloqueo de luz azul adecuada. - Para crear la segunda configuración, corte dos círculos de 1/4 de pulgada de diámetro de una lámina de excitación azul y cuatro círculos de 1/4 de pulgada de diámetro de una lámina de emisión amarilla con tijeras o una cuchilla de afeitar.
- Presione un inserto en forma de hexadecimal M2.5 en cada uno de los cuatro agujeros en la parte inclinada de la parte 'LCD_Screen_Holder.stl'.
2. Montaje óptico
- Coloque un inserto roscado de 4-40 pulgadas de largo de 3/16 pulgadas en el orificio en la parte superior de la parte 'Optics_Enclosure_Bottom.stl'. Coloque un inserto roscado de 4-40 pulgadas de largo y 1/4 de pulgada en todos los demás orificios de la pieza impresa en 3D, como se muestra en la Figura 2A.
- Inserte la placa de prueba del sensor en la cavidad superior de la carcasa, con los cinco pines orientados hacia la parte superior y más cercanos al eje central del dispositivo. Asegure con un tornillo de 4-40 de 3/16 pulgadas de largo a través del orificio en la placa de prueba del sensor (Figura 2B).
- Coloque una de las lentes de distancia focal de 20 mm en la sección debajo de la placa de prueba del sensor con el lado convexo mirando hacia la parte inferior del dispositivo y lejos de la placa de prueba (Figura 2C).
- Para crear la primera configuración, coloque el filtro de paso largo en la siguiente sección debajo de la lente de distancia focal de 20 mm(Figura 2D)colocada en el paso anterior. Para crear la segunda configuración, coloque dos láminas de filtro de emisión amarillas en la sección debajo de la lente.
- Para crear la primera configuración, coloque el espejo dicroico en la sección diagonal cerca del centro del encajamiento mientras observa la orientación del filtro especificada por el fabricante (Figura 2E). Para crear la segunda configuración, coloque el divisor de haz en la sección diagonal. No se necesita una orientación específica para el divisor de haz.
- Coloque una segunda lente de distancia focal de 20 mm en la sección debajo del espejo dicroico (o divisor de haz, dependiendo de la configuración) con el lado convexo apuntando hacia la parte superior del dispositivo (Figura 2F).
- Para crear la primera configuración, coloque el filtro de excitación en la sección a la derecha del espejo dicroico, asegurándose de que la flecha apunte hacia el espejo dicroico (Figura 2G). Para crear la segunda configuración, coloque una lámina de filtro de excitación azul en la sección a la derecha del divisor de haz.
- Coloque la lente de distancia focal de 15 mm a la derecha del filtro de excitación con el lado convexo orientado hacia el espejo dicroico (Figura 2H).
- Coloque un LED en la sección restante de la impresión, con el LED orientado hacia el espejo dicroico (o divisor de haz, dependiendo de la configuración). Asegúrese de que los dos cables que conducen desde el LED se inserten en los canales empotrados para que la impresión se cierre herméticamente.
- Repita los pasos 2.3-2.9 para el otro lado de la pieza impresa en 3D (Figura 2I).
- Cierre el lado vacío de la impresión en la parte superior de la impresión con los componentes ópticos colocando las partes extruidas de la mitad superior del encaquete en las ranuras empotradas de la mitad inferior del encaemiento. Asegure las dos piezas impresas junto con tornillos de 4-40 de 3/8 pulgadas de largo (Figura 2J).
NOTA: Si las dos partes impresas no están completamente cerradas, la luz de excitación perdida puede escapar de la carcasa óptica. Asegúrese de que se use una protección ocular adecuada para bloquear la luz azul hasta que se logre un sellado adecuado. Vuelva a seseer el recinto hasta que no se escape ningún exceso de luz.
3. Electrónica y montaje de pantalla táctil
- Conecte las dos mini tablas de pan juntas y, a continuación, coloque el microcontrolador en una de las tablas de pan. Asegúrese de que el puerto microUSB del microcontrolador mira hacia afuera.
- Para conectar la modulación LED, conecte el pin CTL del controlador LED (+) a un pin digital del microcontrolador y el pin LED (-) del controlador LED a un pin GND del microcontrolador.
- Retire las cubiertas de plástico en la parte posterior de las tablas de pan. Presione el soporte adhesivo de las tablas de pan a la parte impresa en 3D para unir las tablas de pan combinadas al interior de la parte posterior de la parte impresa 'LCD_Screen_Holder.stl'.
- Asegure el soporte de la pantalla de cristal líquido (LCD) con las tablas de pan ensambladas en el interior de la carcasa óptica ensamblada en la sección 2 con tornillos de 4 a 40 de una pulgada de largo.
- Para conectar la fuente de alimentación del LED, conecte el pin del LED (+) del controlador del LED al cable positivo del primer LED. Conecte el cable negativo del primer LED al cable positivo del segundo LED en la placa de pan. Conecte el cable negativo del segundo LED al pin led (-) del controlador led.
Nota: El orden del primer o segundo LED es arbitrario. - Para conectar la fuente de alimentación del controlador LED, conecte los cables positivo y negativo de la fuente de alimentación de 10 V a los pines VIN+ y VIN del controlador LED, respectivamente. (Se utilizó un conector de barril a un adaptador de dos pines).
- Conecte la fuente de alimentación de la placa de prueba del sensor y la transferencia de datos. Sólo se utilizan cuatro pines en la placa de prueba del sensor: SCK, SDA, VDUT y GND. Tome un cable de puente hembra a macho de 4 pines y conecte esos pines en las placas de prueba del sensor de luz a digital a la mini placa de pan a través del espacio en la parte superior derecha de la impresión del soporte LCD.
- En la placa de navegación, asegúrese de que las conexiones entre los siguientes están en su lugar: el pin de 3,3 V del microcontrolador y el pin VDUT de ambas placas de prueba; el pin GND del microcontrolador y el pin GND de ambas placas de prueba; el pin analógico 4 (A4) del microcontrolador y el pin SDA de ambas placas de prueba; y el pin analógico 5 (A5) del microcontrolador y el pin SCK de ambas placas de prueba.
NOTA: Debido a que la comunicación I2C se utiliza para los sensores de luz, los pines SCK y SDA de ambos sensores se pueden enrutar a los mismos pines del microcontrolador. - Suba el ordenador de placa única al soporte de la pantalla LCD con cuatro tornillos M2.5. Asegúrese de que los puertos HDMI y del adaptador de corriente de la computadora de placa única estén orientados hacia arriba y que la computadora de placa única esté centrada en la parte impresa en 3D.
- Conecte la pantalla táctil a la computadora de placa única según las instrucciones de la pantalla táctil y, a continuación, conecte el puerto HDMI de la computadora de placa única al puerto HDMI de la pantalla táctil.
4. Instalación de software
- Instale y use el editor web para cargar el boceto personalizado "MiniFluorimeter_2Diode.ino" proporcionado en el Archivo de codificación suplementario 1 en el microcontrolador. Asegúrese de que la biblioteca "ClosedCube OPT3002" esté instalada mediante el Administrador de bibliotecas.
- Cambie la variable led_A_pin al número del pin digital utilizado en el paso 3.3 (sección de montaje de electrónica y pantalla táctil).
- Ajuste el número de milisegundos que el LED está encendido al adquirir mediciones de fluorescencia cambiando el valor de la variable ExposureTime. Ajuste el número de milisegundos entre las exposiciones del LED cambiando el valor de la variable led_A_Interval.
- Cambie la variable led_Power a un número entre cero y uno para ajustar el brillo de los LED durante las exposiciones. Cero da la cantidad máxima de brillo y uno da la menor cantidad de brillo.
- Active la capacidad de controlar la pantalla a través de la pantalla táctil siguiendo las instrucciones del fabricante proporcionadas con la pantalla de 3,5 pulgadas.
NOTA: Si se desea, la pantalla de 3,5 pulgadas se puede utilizar como un monitor sin capacidades de pantalla táctil, y un teclado y un ratón se pueden conectar a los puertos USB de la computadora de placa única para el control de la computadora de placa única. - Descargue el archivo "MiniFluorimeter_2Diode_GUI.py" del archivo de codificación suplementario 2 en una ubicación deseada en el equipo de placa única.
- Asegúrese de que una versión de trabajo de Python está instalada en el equipo de placa única. Python 3.7 se usó en el módulo de Python proporcionado, pero cualquier versión estable de Python se podía usar con los cambios apropiados en el script proporcionado. Instale las bibliotecas necesarias para el programa Python en el equipo de placa única.
- Cambie la variable measurement_time al período de tiempo deseado para tomar medidas. El programa finaliza la adquisición y se cierra una vez transcurrido el tiempo deseado. La GUI también permite que la adquisición se termine a través de un botón en la interfaz de usuario.
- Cambie la variable serialPort a la dirección serie del microcontrolador conectado.
5. Registro de datos de fluorescencia en tiempo real
- Encienda el bloque de calor comercial y permita que alcance la temperatura deseada.
- Enciéndase la computadora de placa única con una fuente de alimentación estándar de 5 V proporcionada con la mayoría de las compras de computadoras de placa única. Conecte la computadora de placa única al microcontrolador con un cable microUSB a USB.
- Con la pantalla táctil, abra el script de Python proporcionado. Cambie las variables measurement_time y serialPort a los valores deseados. Cambie la variable outputFilepath por el nombre del archivo de datos que genera el programa. Asegúrese de que el nombre de archivo termina en '.xlsx'.
- Coloque dos tubos de PCR que contengan las reacciones a controlar en el bloque de calor. Asegúrese de que la colocación de los tubos de PCR se alinee con los canales ópticos del fluorímetro una vez que se coloca en el bloque de calor.
- Coloque el fluorímetro encima del bloque de calor con los tubos de PCR centrados entre las cuatro clavijas que extruyen de cada canal óptico del fluorímetro. Para obtener mediciones óptimas, asegúrese de que el fluorímetro impreso en 3D esté conectado de forma segura a los pozos del bloque de calor.
- Conecte de forma segura el fluorímetro, conecte el adaptador de la fuente de alimentación para los LED.
- Utilice la pantalla táctil para iniciar el programa Python. Una interfaz gráfica de usuario (GUI) aparece en la pantalla LCD y mide la fluorescencia en tiempo real.
- Observe las mediciones de fluorescencia en tiempo real a lo largo del tiempo para ambos tubos de PCR que se muestran al usuario en la GUI.
- Una vez transcurrido el tiempo de experimento determinado por el usuario, cesa la adquisición. Vea las mediciones en el archivo de datos de salida guardado en la ubicación definida por el usuario. Para finalizar las mediciones antes de tiempo, haga clic en el botón con la etiqueta "Detener adquisición" en la interfaz de usuario.
Resultados
Una vez montado, el rendimiento del fluorímetro se puede validar midiendo la fluorescencia de una serie de dilución de colorante FITC. En la Figura 3A,se muestran las mediciones del tinte FITC a concentraciones de 0, 20, 40, 60 y 80 pg/μL preparado en 1x PBS en ambos canales de la primera configuración del fluorímetro. Cada muestra fue medida tres veces con una exposición del LED de 1,5 s en los intervalos de 20 s. Ambos canales del fluorímetro muestran una respuesta lineal a través del rango deseado.
La aplicabilidad clínica del fluorímetro se demostró aún más mediante el uso del sistema junto con un bloque de calor seco disponible en el comercio para realizar la amplificación con dos tecnologías de amplificación isotérmica: RPA y RT-LAMP.
La Figura 3B muestra el curso de tiempo restado basal de fluorescencia medido durante la amplificación a 39 °C de 50 μL de reacciones de control positivas y negativas de RPA en tiempo real para el ADN de control positivo del kit proporcionado en un kit comercial estándar y preparado según las instrucciones del fabricante. Las reacciones de RPA, que producen un nivel relativamente bajo de fluorescencia, se midieron utilizando la primera configuración del fluorímetro que logra una mejor supresión de la luz de excitación.
La Figura 3C demuestra la medición del curso del tiempo de un ensayo RT-LAMP personalizado a 65 °C utilizando los conjuntos de cebadores N2, E1 y As1e descritos por Zhang etal. 10,y Rabe y Cepko11. Las reacciones RT-LAMP producen una mayor cantidad de fluorescencia y se midieron utilizando la segunda configuración de fluorímetro de menor costo. Los oligonucleótidos fueron comprados y resuspended en almacenador intermediario 2x del TE en una concentración de 1 milímetro. Los oligos internos delanteros de la cartilla (FIP) y de la cartilla interna hacia atrás (BIP) fueron pedidos con la purificación líquida de la cromatografía de alto rendimiento. Cada juego de cebadores (N2, E1 y As1e) se combinó para hacer 1000 μL de una mezcla de 25x de la siguiente manera: 40 μL de FIP, 40 μL de BIP, 5 μL de F3, 5 μL de B3, 10 μL de LF, 10 μL de LB y 890 μL de tampón de 1x TE. Para ensamblar cada reacción RT-LAMP, se añadió 1 μL de cada juego de cebadores a 0,5 μL de colorante fluorescente 50x y 12,5 μL de mezcla maestra 2x y el volumen de reacción se elejó hasta 20 μL con agua libre de nucleasa según las instrucciones del fabricante. El control de ARN del SARS-CoV-2 se diluyó en serie en agua libre de nucleasa a concentraciones de 10, 100 o 1.000 copias por μL, y se añadieron 5 μL para un volumen total de reacción de 25 μL. El control sin objetivo (NTC) utilizado en todos los experimentos fue agua libre de nucleasa. Las reacciones RT-LAMP se superponen con 25 μL de aceite mineral de grado de biología molecular.
Las reacciones RPA y RT-LAMP se ensamblaron en dos pozos de una tira de PCR de 8 tubos de bajo perfil de 0,2 mL y se taparon con tapas planas ultracleares. Cada reacción RPA y RT-LAMP se ejecutó por triplicado. En todas las pruebas, el mini-fluorímetro cuantificó con éxito el aumento temporal de los niveles de fluorescencia asociados con la amplificación del ADN.
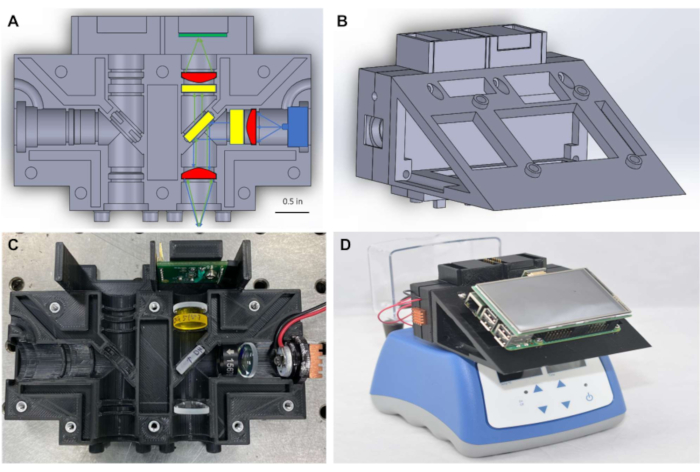
Figura 1:Carcasa óptica y fluorímetro miniatura montado sobre el bloque de calor. (A) Diagrama de la carcasa óptica que muestra los componentes ópticos colocados en un canal de detección. (B) Diagrama de la primera configuración del fluorímetro en miniatura después del montaje. (C)Fotografía de la carcasa óptica con componentes ópticos colocados en un canal de detección. (D) Fotografía del fluorímetro miniatura montado colocado en la parte superior de un bloque de calor disponible comercialmente. Haga clic aquí para ver una versión más amplia de esta figura.
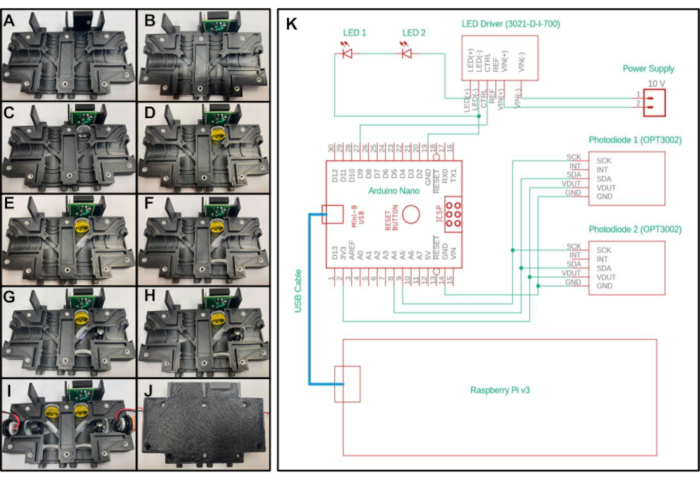
Figura 2:Diagrama de montaje y control eléctrico del fluorímetro en miniatura. A-J) Colocación paso a paso de los componentes ópticos en la carcasa óptica impresa en 3D para la primera configuración del sistema. (K) Diagrama eléctrico del fluorímetro en miniatura para ambas configuraciones. Haga clic aquí para ver una versión más amplia de esta figura.
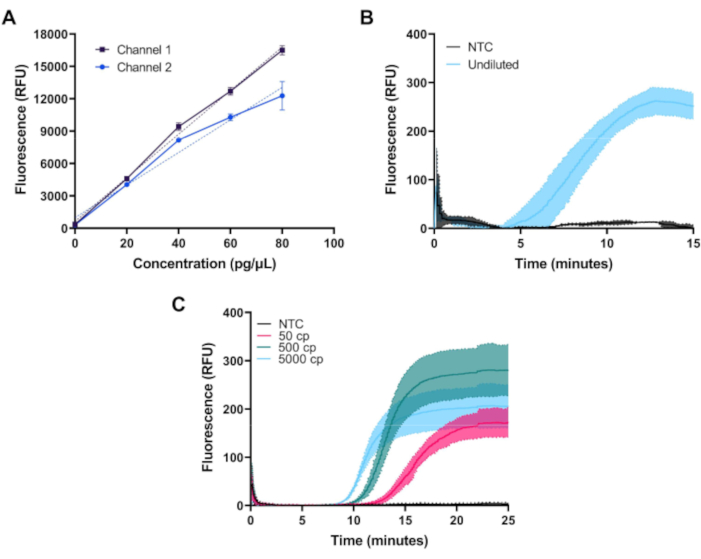
Figura 3:Mediciones representativas obtenidas con el fluorímetro en miniatura. (A) La fluorescencia medida frente a la concentración de colorante FITC en ambos canales muestra una respuesta lineal a través del rango dinámico deseado. (B)Fluorescencia en tiempo real vs tiempo para la amplificación isotérmica de los controles positivos y negativos de un kit disponible comercialmente. La amplificación se produce como se esperaba para el control positivo. (C)Fluorescencia en tiempo real vs tiempo para la amplificación isotérmica de 50, 500 y 5000 copias de ARN del SARS-CoV-2 y una muestra ntc de un ensayo RT-LAMP personalizado. La amplificación se produce como se esperaba cerca del límite de detección del ensayo. Haga clic aquí para ver una versión más amplia de esta figura.
| Sistema 1 | Sistema 2 | |||
| artículo | cantidad | Precio total (USD) | cantidad | Precio total (USD) |
| Componentes ópticos | ||||
| Lentes | 6 | 158.14 | 6 | 158.14 |
| Espejos | 2 | 244.56 | 2 | 60 |
| Filtros ópticos | 4 | 200 | 6 | 5 |
| subtotal | 602.7 | subtotal | 223.14 | |
| Iluminación y detección | ||||
| Leds | 2 | 72.62 | 2 | 72.62 |
| Controlador LED | 1 | 11.49 | 1 | 11.49 |
| fotodiodo | 2 | 50 | 2 | 50 |
| subtotal | 134.11 | subtotal | 134.11 | |
| Electrónica y Pantalla | ||||
| Arduino Nano | 1 | 20.7 | 1 | 20.7 |
| Raspberry Pi | 1 | 35 | 1 | 35 |
| Pantalla LCD | 1 | 25 | 1 | 25 |
| Mini pan de pan | 1 | 4 | 1 | 4 |
| Fuente de alimentación de 10V | 1 | 8.6 | 1 | 8.6 |
| subtotal | 93.3 | subtotal | 93.3 | |
| Costo total (USD) | 830.11 | 450.55 | ||
Tabla 1: Comparación de costos de las dos configuraciones del fluorímetro en miniatura.
Archivo suplementario 1: System1_Optics_Enclosure_Top.stl Haga clic aquí para descargar este archivo.
Archivo suplementario 2: System1_Optics_Enclosure_Bottom.stl, y haga clic aquí para descargar este archivo.
Archivo suplementario 3: LCD_Screen_Holder.stl Haga clic aquí para descargar este archivo.
Archivo suplementario 4: System2_Optics_Enclosure_Top.stl Haga clic aquí para descargar este archivo.
Archivo suplementario 5: System2_Optics_Enclosure_Bottom.stl, y haga clic aquí para descargar este archivo.
Archivo suplementario 6: System2_BuildInstructions.pdf Haga clic aquí para descargar este archivo.
Archivo de codificación suplementario 1: MiniFluorimeter_2Diode.ino Haga clic aquí para descargar este archivo de codificación.
Archivo de codificación suplementario 2: MiniFluorimeter_2Diode_GUI.py Haga clic aquí para descargar este archivo de codificación.
Discusión
Aquí se describe un fluorímetro de código abierto, de bajo costo, modular y portátil para la detección cuantitativa de fluorescencia de reacciones de amplificación isotérmica. Los proyectos de código abierto facilitan un mantenimiento rápido y económico con piezas de repuesto fácilmente disponibles y permiten a los usuarios la flexibilidad de adaptar el sistema a sus necesidades basándose en un diseño modular. Este protocolo describe el proceso de montaje de componentes mecánicos, ópticos y eléctricos, y la validación del rendimiento óptico. Además, se demostró la flexibilidad del fluorímetro para monitorear dos tipos diferentes de ensayos de amplificación isotérmica con requisitos de temperatura, volumen y fluorescencia significativamente diferentes, RPA exo y RT-LAMP. RPA se realiza a 39 °C en reacciones de 50 μL que utilizan una sonda etiquetada con FAM específica de la secuencia para la generación de fluorescencia, mientras que RT-LAMP se realiza a 65 °C en un volumen de reacción de 25 μL y utiliza un tinte intercalante para informar de la presencia del ADN amplificado. Debido a que las mediciones de fluorescencia se realizan a través de la parte superior de los tubos de PCR con tapas planas, el fluorímetro es capaz de detectar la fluorescencia de ambos volúmenes de ensayo, y los requisitos de calor solo están limitados por el bloque de calor comercial elegido. Además, la intensidad de fluorescencia producida en RT-LAMP es casi en el orden de magnitud mayor que la producida en RPA, debido a los métodos basados en colorante versus sonda de generación de señales de fluorescencia. Sin embargo, el rango dinámico del sensor óptico elegido puede detectar y cuantificar tanto las señales, y los algoritmos de resta de línea de base explican estas diferencias para producir lecturas de fluorescencia confiables.
Para facilitar la difusión de la tecnología y minimizar el costo potencial de mantenimiento, se empleó un diseño modular que es compatible con calentadores que están ampliamente disponibles en diferentes entornos. En el protocolo actual, un calentador común del bloque seco fue utilizado; el mismo diseño óptico y eléctrico se puede adaptar fácilmente para otros calentadores disponibles comercialmente. Si se va a utilizar otro calentador de bloque seco, se requerirán cambios mínimos en el diseño de la carcasa 3D. Específicamente, las clavijas inferiores de los archivos STL del gabinete óptico deben modificarse para garantizar una alineación adecuada con los pozos de otros bloques de calor comerciales. Si bien los gabinetes que se muestran en los ejemplos se imprimieron en una impresora 3D de gama relativamente baja (consulte la Tabla de materiales),se debe tener cuidado de garantizar que la resolución de la impresora y/o las tolerancias de impresión sean adecuadas para acomodar los componentes ópticos y las inserciones roscadas. En los archivos STL proporcionados, se agregó una tolerancia de 0.01-0.02 pulgadas a cada lado de los componentes ópticos en las direcciones radial y axial en función de las dimensiones especificadas por el fabricante. Esto garantiza que todos los componentes ópticos se ajusten de forma segura a la impresión y que el gabinete bloquee por completo el exceso de luz para que no entre o escape. Para garantizar un ajuste de prensa adecuado para las inserciones roscados, se restó una tolerancia similar de 0.01-0.02 pulgadas del diámetro proporcionado por el fabricante en el archivo CAD.
Las reacciones de RPA fueron supervisadas con éxito usando la primera configuración del fluorímetro, mientras que las reacciones de RT-LAMP se podían supervisar usando cualquier configuración. El rechazo mejorado de la luz perdida de la primera configuración era necesario supervisar los niveles bajos de la fluorescencia producidos por la punta de prueba fluorogenic en reacciones de RPA. En contraste, RT-LAMP utiliza un tinte intercalante para la generación de señales, lo que resulta en una mayor intensidad de fluorescencia que es compatible con el rango dinámico más bajo de la segunda configuración utilizando láminas de filtro fotográficas. Los usuarios deben seleccionar la configuración del fluorímetro que coincida con la señal de fluorescencia que genera el colorante intercalante de elementos o la sonda fluorógena de su ensayo.
Una limitación de este sistema es que la calefacción es proporcionada por un bloque de calor disponible comercialmente alimentado a través de una toma de corriente estándar. Este sistema podría seguir desarrollándose para su uso en zonas que carecen de acceso fiable a la electricidad mediante la incorporación de baterías portátiles y recargables, como muestran otros grupos12. Otra limitación es el rendimiento relativamente bajo del sistema, que permite la medición simultánea de fluorescencia de solo dos muestras a la vez. Se pueden colocar varias impresiones del gabinete encima del mismo bloque de calor para aumentar el rendimiento; sin embargo, el sensor de luz utilizado sólo tiene cuatro direcciones I2C únicas. Esto restringe el número máximo de muestras que se pueden medir simultáneamente a cuatro. Se necesita un sensor de luz diferente con un mayor número de direcciones I2C únicas para aumentar aún más el rendimiento.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Un agradecimiento especial a Chelsey Smith, Megan Chang, Emilie Newsham, Sai Paul y Christopher Goh por su ayuda con la preparación de la muestra. Los autores agradecen a Caroline Noxon por la revisión del manuscrito. El financiamiento para este trabajo fue proporcionado por el pueblo estadounidense por USAID a través de una beca de investigación de IAVI CCID 9204 bajo el premio AID-OAA-A16-00032 entre IAVI y USAID.
Materiales
| Name | Company | Catalog Number | Comments |
| 1/4-inch-long 4-40 threaded insert | McMaster-Carr | 90742A116 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 10v power supply | GlobTek, Inc. | WR9HU1800CCP-F(R6B) | AC/DC Wall Mount Adapter 10V 18W |
| 15 mm focal length lens | Thorlabs | LA 1074 | Two total are used for the fluorimeter. This lens is used to focus the LED illumination. |
| 1-inch-long 4-40 screws | McMaster-Carr | ||
| 20 mm focal length lens | Thorlabs | LA 1540 | Four total are used for the fluorimeter. |
| 2x WarmStart LAMP Master Mix | New England Biolabs, Inc | E1700 | Master mix was used to create the LAMP reactions shown in Figure 3C |
| 3.5” Touch Screen | Uctronics | BO10601 | |
| 3/16-inch-long 4-40 screw | McMaster-Carr | 90128A105 | |
| 3/16-inch-long 4-40 threaded insert | McMaster-Carr | 90742A115 | Used to secure the OPT3002 test board onto the 3D printed enclosure |
| 3/8-inch-long 4-40 screws | McMaster-Carr | 90128A108 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 3D printer filament | 3D Universe | UMNFC-PC285-BLACK | Black or another dark color preferred |
| 3D printer used | Ultimaker | Ultimaker 2+ | |
| 8-tube PCR strips | BioRad | #TLS0801 | |
| Advanced Mini Dry Block Heater | VWR International | 10153-320 | The following heat blocks are acceptable substitutes without the need for redesigning the optical assembly: 949VWMNLUS, 949VWMHLUS, and 949VWMHLEU |
| barrel jack to two-pin adapter | SparkFun Electronics | 1568-1238-ND | |
| Blue Excitation Filter Foil | LEE | LE071S | Selected for use with FITC - other fluorescent dyes may require different filters. |
| Blue LED - 460 nm | Mouser | LZ1-30DB00-0100 | Selected for use with FITC - other fluorescent dyes may require different parts |
| Dichroic Mirror | Thorlabs | DMLP505T | Selected for use with FITC - other fluorescent dyes may require different parts |
| Emission Filter | Edmunds Optics | OG-515 | Selected for use with FITC - other fluorescent dyes may require different parts. The arrow on the part points away from the illumination source. |
| Excitation Filter | Omega Filters | 490AESP | Selected for use with FITC - other fluorescent dyes may require different parts |
| LED Driver | LEDdynamics | 3021-D-I-700 | |
| M2.5 Hex Shaped insert | McMaster-Carr | 91292A009 | Used to secure the Raspberry Pi to the 3D printed LCD Screen Holder |
| Microcontroller | Arduino | Nano | |
| Mini Breadboard | Adafruit | 65 | |
| Molecular biology-grade mineral oil | Sigma Aldrich | 69794 | |
| OPT3002EVM - Light-to-Digital Sensor | Texas Instruments | OPT3002EVM: | Light-to-digital sensor used. Consists of two PCBs: a SM-USB_DIG board and the OPT3002 test board; only the OPT3002 test board is needed for this device. |
| Purchased oligonucleotides | Integrated DNA Technologies | ||
| RPA kit positive control DNA | TwistDx Limited | CONTROL01DNAE | |
| SARS-CoV-2 RNA Control | Twist Biosciences | MN908947.3 | |
| Single board computer | Raspberry Pi | Raspberry Pi 3 | |
| TwistAmp RPA exo kit | TwistDx Limited | TAEXO02KIT | |
| Ultraclear flat caps | BioRad | #TCS0803 | |
| Yellow Emmission Filter Foil | LEE | LE767S | Selected for use with FITC - other fluorescent dyes may require different parts |
Referencias
- Daher, R. K., Stewart, G., Boissinot, M., Bergeron, M. G. Recombinase polymerase amplification for diagnostic applications. Clinical Chemistry. 62 (7), 947-958 (2016).
- Yan, L., et al. Isothermal Amplified Detection of DNA and RNA. Molecular BioSystems. 10 (5), 970-1003 (2014).
- Giuffrida, M. C., Spoto, G. Integration of Isothermal Amplification Methods in Microfluidic Devices: Recent Advances. Biosensors and Bioelectronics. 90, 174-186 (2017).
- Gill, P., Ghaemi, A. Nucleic Acid Isothermal Amplification Technologies-A Review. Nucleosides, Nucleotides and Nucleic Acids. 27 (3), 224-243 (2008).
- Richards-Kortum, R., Oden, M. Devices for Low-Resource Health Care. Science. 342 (6162), 1055-1057 (2013).
- Katzmeier, F., et al. A Low-Cost Fluorescence Reader for in vitro Transcription and Nucleic Acid Detection with Cas13a. PLOS One. 14 (12), e0220091 (2019).
- Safavieh, M., et al. Emerging Loop-Mediated Isothermal Amplification-Based Microchip and Microdevice Technologies for Nucleic Acid Detection. ACS Biomaterials Science and Engineering. 2 (3), 278-294 (2016).
- Monis, P. T., Giglio, S., Saint, C. P. Comparison of SYTO9 and SYBR Green I for Real-Time Polymerase Chain Reaction and Investigation of the Effect of Dye concentration on Amplifcation and DNA Melting Curve Analysis. Analytical Biochemistry. 340 (1), 24-34 (2005).
- Parra, S., et al. Development of Low-Cost Point-of-Care Technologies for Cervical Cancer Prevention Based on a Single-Board Computer. IEEE Journal of Translational Engineering in Health and Medicine. 8 (4300210), (2020).
- Zhang, Y., et al. Enhancing Colorimetric Loop-Mediated Isothermal Amplification Speed and Sensitivity with Guanidine Chloride. Biotechniques. 69 (3), 178-185 (2020).
- Rabe, B. A., Cepko, C. SARS-CoV-2 Detection Using an Isothermal Amplification Reaction and a Rapid, Inexpensive Protocol for Sample Inactivation and Purification. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24450-24458 (2020).
- Snodgrass, R., et al. A Portable Device for Nucleic Acid Quantification Powered by Sunlight, a Flame or Electricity. Nature Biomedical Engineering. 2 (9), 657-665 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados