Method Article
Fluorimetro in miniatura open source per monitorare le reazioni di amplificazione dell'acido nucleico isotermico in tempo reale in impostazioni limitate alle risorse
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Istruzioni dettagliate sono fornite per costruire un fluorimetro modulare open source compatibile con molti riscaldatori a basso costo per eseguire l'amplificazione dell'acido nucleico isotermico quantitativo in tempo reale.
Abstract
I metodi tradizionali per rilevare e quantificare gli acidi nucleici si basano sulla reazione a catena della polimerasi (PCR) e richiedono l'uso di costosi termocicli con rilevamento integrato della fluorescenza delle ampliconi. Le tecnologie di amplificazione dell'acido nucleico isotermico eliminano la necessità di ciclo termico; tuttavia, il rilevamento dei prodotti basato sulla fluorescenza è ancora necessario per risultati quantitativi in tempo reale. Sono ora disponibili in commercio diversi riscaldatori isotermici portatili con rilevamento integrato della fluorescenza; tuttavia, il costo di questi dispositivi rimane un ostacolo significativo all'adozione diffusa in contesti limitati alle risorse. Qui è descritto un protocollo per la progettazione e l'assemblaggio di un fluorimetro modulare a basso costo costruito con componenti preconfezionati. Racchiuso in un alloggiamento compatto stampato in 3D, il fluorimetro è progettato per essere posizionato in cima a un blocco di calore disponibile in commercio che tiene un tubo PCR. Il fluorimetro qui descritto è stato ottimizzato per rilevare il colorante isotiocianato di fluoresceina (FITC), ma il sistema può essere modificato per l'uso con coloranti comunemente usati come reporter nelle reazioni di amplificazione dell'acido nucleico in tempo reale. L'applicabilità clinica del sistema è dimostrata eseguendo il rilevamento di acidi nucleici in tempo reale con due tecnologie di amplificazione isotermica: l'amplificazione della polimerasi ricombinante (RPA) per il rilevamento del DNA di controllo positivo fornito in un kit commerciale e l'amplificazione isotermica mediata da loop di trascrizione inversa (RT-LAMP) per il rilevamento di livelli clinicamente significativi di RNA SARS-CoV-2.
Introduzione
Le tecnologie di amplificazione isotermica sono ampiamente utilizzate per l'individuazione degli acidi nucleici. Rispetto ai tradizionali approcci PCR che richiedono il termociclismo, l'amplificazione isotermica consente l'amplificazione dell'acido nucleico a una singola temperatura, consentendo così tempi di risultati più rapidi e una migliore tolleranza degli inibitori1,2. Un altro vantaggio chiave dell'amplificazione isotermica è la ridotta complessità della strumentazione. La maggior parte delle reazioni di amplificazione isotermica richiede solo un blocco termico e una modalità di rilevamento- rilevamento in tempo reale tramite monitoraggio della fluorescenza o rilevamento degli endpoint, ad esempio per flusso laterale o elettroforesi del gel3,4. Il rilevamento della fluorescenza in tempo reale viene effettuato attraverso il rilevamento della fluorescenza prodotta da coloranti intercalanti che si attivano in presenza di DNA a doppio filamento o sonde fluorescenti tempre che si attivano in presenza di specifiche sequenze di DNA a doppio filamento.
Mentre esistono fluometri isotermici da banco disponibili in commercio, molti mancano di personalizzazione per l'implementazione del saggio. Ad esempio, molti dispositivi richiedono materiali di consumo specifici o forniti dall'azienda, consigliano fornitori preferiti o utilizzano software proprietario per ottenere risultati pubblicizzati. La maggior parte di questi sistemi costa oltre $ 5,000 USD, rappresentando una barriera significativa per un uso diffuso in impostazioni limitate alle risorse. Inoltre, gli utenti in contesti a basso costo devono affrontare sfide per mantenere le apparecchiature progettate per impostazioni ad alte risorse a causa delle difficili condizioni ambientali, delle deboli catene di approvvigionamento per i pezzi di ricambio e degli strumenti specializzati necessari per la manutenzione e lariparazione 5. Per rispondere a questa esigenza, qui descritto è la progettazione e l'assemblaggio di un fluorimetro modulare e a basso costo costruito con componenti fuori dagli scaffali racchiusi in un alloggiamento compatto stampato in 3D(Figure 1A-C)con due configurazioni opzionali. La prima configurazione di questo dispositivo utilizza filtri in vetro disponibili in commercio e uno specchio dicroico per bloccare la luce di fondo in eccesso e ha un costo totale di assemblaggio di $ 830 USD. Mentre questi filtri sono comunemente utilizzati nei sistemi di imaging basati sulla fluorescenza, la sostituzione di costose pellicole filtranti ottiche di alta qualità ha precedentemente dimostrato di consentire il rilevamento di acidinucleici 6. La seconda configurazione del fluorimetro incorpora questi filtri economici e sostituisce gli specchi dicroici con splitter a fascio da φ1/2", riducendo il costo complessivo del sistema da $ 830 a $ 450 USD.
Le immagini rappresentative dell'assembly vengono visualizzate per la prima configurazione nella figura 1 e nella figura 2, ma immagini analoghe per la seconda configurazione sono disponibili nel file supplementare 6. Per evitare la necessità di un allineamento ottico specializzato, il sistema ottico ha aree designate per posizionare ogni componente ottico e può essere realizzato con una stampante 3D relativamente di fascia bassa, consentendo un uso diffuso del design. Le uniche differenze nella costruzione e nell'assemblaggio per le due configurazioni sono i file utilizzati per la stampa 3D e i componenti ottici collocati nell'involucro. Le dimensioni esterne dell'involucro stampato in 3D per entrambi i sistemi sono le stesse. Un confronto dei costi dei due sistemi è riportato nella tabella 1.
Come mostrato nella figura 1A, per mantenere un piccolo fattore di forma, il fluorimetro è costituito da ottiche da Φ1/2" (~12,5 mm), accoppiate con illuminazione e rilevamento compatti posizionati per misurare il segnale attraverso la parte superiore del tubo PCR. Il sistema nella figura 1 è progettato per rilevare coloranti con picco di eccitazione e lunghezze d'onda di emissione vicino a 490 nm e 525 nm, rispettivamente, tra cui FITC e coloranti strettamente correlati come SYBR e SYTO-9, che sono comunemente usati come reporter nelle reazioni di amplificazione dell'acido nucleico intempo reale 7,8. La sorgente di eccitazione, i filtri ottici e il rivelatore possono essere facilmente sostituiti da componenti compatibili con diversi coloranti fluorescenti a piacere. Le reazioni di amplificazione dell'acido nucleico sono tipicamente eseguite in tubi PCR, e il fluorimetro è progettato per essere posizionato in cima a qualsiasi blocco di calore disponibile in commercio che contiene tubi PCR(Figura 1D)consentendo il monitoraggio in tempo reale delle reazioni isotermiche. Blocchi di calore appropriati sono disponibili nella maggior parte dei laboratori biomedici e possono essere acquistati per meno di $ 500 USD.
L'uso di computer a scheda singola per fornire un'alternativa a basso costo e punto di cura per il controllo delle tecnologie di imaging è stato precedentementedimostrato 9. Basandosi su questo lavoro, in questo protocollo viene utilizzata un'interfaccia utente grafica a scheda singola (Figura 1D) per facilitare la registrazione dei dati in tempo reale e la visualizzazione dei risultati nel punto di cura, eliminando la necessità per un computer portatile di elaborare o visualizzare i dati. Le misurazioni della fluorescenza sono state trasferiteattraverso il protocolloI 2 C dai sensori di luce a un microcontrollore, e quindi rese disponibili al computer a scheda singola attraverso la comunicazione seriale. I collegamenti elettrici per l'illuminazione e il trasferimento dei dati sono stati forniti attraverso cablaggi e saldature semplificati su breadboard miniaturizzati, negando la necessità di circuiti stampati specializzati (PCB). Il software necessario per eseguire il fluorimetro è disponibile tramite framework software open source e il codice necessario per eseguire il dispositivo è fornito nei file di codifica supplementari. Il fluorimetro completo può essere assemblato per un costo compreso tra $ 450 e $ 830 USD e i risultati mostrano che fornisce misurazioni della fluorescenza accurate e affidabili per monitorare l'amplificazione isotermica in tempo reale degli acidi nucleici.
Protocollo
1. Fasi di preparazione: stampa e saldatura 3D
NOTA: Il sistema ottico descritto in questo protocollo è progettato per un riscaldatore a blocchi secchi standard.
- Per creare la prima configurazione, stampare in 3D i file CAD forniti rispettivamente come file supplementari 1, 2 e 3:
- Per creare la seconda configurazione, stampare in 3D i file CAD forniti rispettivamente come File supplementari 3, 4 e 5:
NOTA: Queste parti sono progettate per essere stampate con supporti. In questa guida viene utilizzato un filamento di policarbonato nero che può mantenere la sua forma dopo essere stato sottoposto a temperature fino a 110 °C. In generale, è possibile utilizzare qualsiasi materiale che possa essere riscaldato alla temperatura della reazione isotermica desiderata senza deformazione significativa. Per ridurre al minimo l'effetto dei riflessi interni e delle interferenze della luce ambientale, si consiglia un materiale nero o un altro colore scuro. - Preparare i due moduli di valutazione dei sensori da luce a digitale per il monitoraggio parallelo di due campioni. Su una delle schede di prova del sensore, rimuovere il resistore R4 e saldare un filo jumper dal pad destro dell'area R4 sul PCB al pad superiore nell'area R1 sul PCB. Ciò cambierà l'indirizzo I2C del sensore, consentendo così la misurazione simultanea di entrambi i sensori.
NOTA: Il sensore utilizzato è costituito da due PCB: una scheda adattatore USB e una scheda di prova del sensore contenente il sensore di luce; solo la scheda di prova del sensore è necessaria per questo dispositivo. - Fili di saldatura a ciascuno dei due diodi emettitori di luce (LED). Collegare un filo rosso (positivo) al pad etichettato "1" sul LED e un filo nero (negativo) sul pad etichettato "2" sul LED. Applicare un sottile strato di adesivo termico sul retro del LED, posizionare il LED sulla parte superiore di un tappo finale e attendere che l'adesivo termico si curi. Dall'altro lato del tappo finale, aggiungere un dissipatore di calore.
NOTA: Quando si testano i LED prima che siano sigillati nell'involucro, assicurarsi di indossare una corretta protezione degli occhi che blocca la luce blu. - Per creare la seconda configurazione, tagliare due cerchi da 1/4 di diametro da un foglio di foglio di eccitazione blu e quattro cerchi di diametro di 1/4 di pollice da un foglio di foglio di emissione giallo con forbici o una lama di rasoio.
- Premere un inserto a forma esagonale M2.5 in ciascuno dei quattro fori sulla parte inclinata della parte 'LCD_Screen_Holder.stl'.
2. Assemblaggio ottico
- Posizionare un inserto filettato lungo 4-40 pollici nella parte superiore della parte "Optics_Enclosure_Bottom.stl". Posizionare un inserto filettato lungo 4-40 pollici in tutti gli altri fori della parte stampata in 3D, come illustrato nella figura 2A.
- Inserire la scheda di prova del sensore nella cavità superiore dell'alloggiamento, con i cinque perni rivolti verso la parte superiore e più vicini all'asse centrale del dispositivo. Fissare con una vite 4-40 lunga 3/16 pollici attraverso il foro sulla scheda di prova del sensore (Figura 2B).
- Posizionare uno degli obiettivi di lunghezza focale di 20 mm nella sezione sotto la scheda di prova del sensore con il lato convesso rivolto verso la parte inferiore del dispositivo e lontano dalla scheda di prova (Figura 2C).
- Per creare la prima configurazione, posizionare il filtro passa lungo nella sezione successiva sotto l'obiettivo di lunghezza focale di 20 mm (Figura 2D) posizionato nel passaggio precedente. Per creare la seconda configurazione, posizionare due fogli filtranti a emissione gialla nella sezione sotto l'obiettivo.
- Per creare la prima configurazione, posizionare lo specchio dicroico nella sezione diagonale vicino al centro della carcassa osservando l'orientamento del filtro specificato dal produttore (Figura 2E). Per creare la seconda configurazione, posizionare lo splitter del fascio nella sezione diagonale. Non è necessario alcun orientamento specifico per lo splitter del fascio.
- Posizionare una seconda lente di lunghezza focale di 20 mm nella sezione sotto lo specchio dicroico (o beam splitter, a seconda della configurazione) con il lato convesso rivolto verso la parte superiore del dispositivo(Figura 2F).
- Per creare la prima configurazione, posizionare il filtro di eccitazione nella sezione a destra dello specchio dicroico, assicurandosi che la freccia punti verso lo specchio dicroico (Figura 2G). Per creare la seconda configurazione, posizionare un foglio di filtro di eccitazione blu nella sezione a destra dello splitter del fascio.
- Posizionare l'obiettivo di lunghezza focale di 15 mm a destra del filtro di eccitazione con il lato convesso rivolto verso lo specchio dicroico (Figura 2H).
- Posizionare un LED nella sezione rimanente della stampa, con il LED rivolto verso lo specchio dicroico (o beam splitter, a seconda della configurazione). Assicurarsi che i due fili che conducono dal LED siano inseriti nei canali incassati in modo che la stampa si conchichi saldamente.
- Ripetere i passaggi da 2.3 a 2.9 per l'altro lato della parte stampata in 3D (Figura 2I).
- Chiudere il lato vuoto della stampa sopra la stampa con i componenti ottici posizionando le parti estruse della metà superiore della carcassa nelle scanalature incassate della metà inferiore della carcassa. Fissare le due parti stampate insieme a viti lunghe 4-40 da 3/8 pollici (Figura 2J).
NOTA: Se le due parti stampate non sono completamente chiuse, la luce di eccitazione vagante può fuoriuscire dall'alloggiamento ottico. Assicurarsi che la corretta protezione degli occhi che blocca la luce blu sia indossata fino a quando non si ottiene una tenuta adeguata. Risigillare l'involucro fino a quando non fuorievirà luce in eccesso.
3. Montaggio elettronico e touchscreen
- Collegare le due mini breadboard insieme, quindi posizionare il microcontrollore su una delle breadboard. Assicurarsi che la porta microUSB del microcontrollore sia rivolta verso l'esterno.
- Per collegare la modulazione LED, collegare il pin CTL del driver LED (+) a un pin digitale del microcontroller e il pin LED (-) del driver LED a un pin GND del microcontroller.
- Rimuovere le coperture di plastica sul retro delle breadboard. Premere il supporto adesivo dei breadboard alla parte stampata in 3D per attaccare i breadboard combinati all'interno della parte posteriore della parte stampata "LCD_Screen_Holder.stl".
- Fissare il portascicolo a cristalli liquidi (LCD) con le breadboard assemblate all'interno dell'involucro ottico assemblato nella sezione 2 con viti da 4-40 lunghe un pollice.
- Per collegare l'alimentatore a LED, collegare il pin LED (+) del driver LED al filo positivo del primo LED. Collegare il filo negativo del primo LED al filo positivo del secondo LED sulla breadboard. Collegare il filo negativo del secondo LED al pin LED (-) del driver LED.
NOTA: L'ordine del primo o del secondo LED è arbitrario. - Per collegare l'alimentatore del driver LED, collegare i fili positivi e negativi dell'alimentatore a 10 V rispettivamente ai pin VIN+ e VIN del driver LED. (È stato utilizzato un jack a botte per adattatore a due pin.
- Collegare l'alimentatore della scheda di prova del sensore e il trasferimento dei dati. Vengono utilizzati solo quattro pin sulla scheda di prova del sensore: SCK, SDA, VDUT e GND. Prendi un filo da femmina a maglione maschio a 4 pin e collega quei perni sulle schede di prova dei sensori da luce a digitale al mini breadboard attraverso lo spazio nella parte superiore destra della stampa del supporto LCD.
- Sul breadboard, assicurarsi che siano in atto collegamenti tra i seguenti: il perno da 3,3 V del microcontrollore e il pin VDUT di entrambe le schede di prova; il pin GND del microcontrollore e il pin GND di entrambe le schede di prova; il pin analogico 4 (A4) del microcontrollore e il pin SDA di entrambe le schede di prova; e il pin analogico 5 (A5) del microcontrollore e il pin SCK di entrambe le schede di prova.
NOTA: Poiché la comunicazione I2C viene utilizzata per i sensori di luce, i pin SCK e SDA di entrambi i sensori possono essere instradati agli stessi pin del microcontrollore. - Fissare il computer a scheda singola sul supporto dello schermo LCD con quattro viti M2.5. Assicurarsi che le porte HDMI e dell'adattatore di alimentazione del computer a scheda singola siano rivolta verso l'alto e che il computer a scheda singola sia centrato sulla parte stampata in 3D.
- Collegare il display touchscreen al computer a scheda singola secondo le istruzioni touchscreen, quindi collegare la porta HDMI del computer a scheda singola alla porta HDMI del touchscreen.
4. Installazione del software
- Installare e utilizzare l'editor Web per caricare lo schizzo personalizzato "MiniFluorimeter_2Diode.ino" fornito nel file di codifica supplementare 1 sul microcontroller. Assicurarsi che la libreria "ClosedCube OPT3002" sia installata utilizzando Gestione libreria.
- Modificare la led_A_pin al numero del pin digitale utilizzato nel passaggio 3.3 (sezione elettronica e assemblaggio touchscreen).
- Regolare il numero di millisecondi in cui il LED viene acceso quando si acquisiscono misurazioni della fluorescenza modificando il valore della variabile ExposureTime. Regolare il numero di millisecondi tra le esposizioni a LED modificando il valore della variabile led_A_Interval.
- Modificare la variabile led_Power un numero compreso tra zero e uno per regolare la luminosità dei LED durante le esposizioni. Zero dà la massima quantità di luminosità e si dà la più bassa quantità di luminosità.
- Attivare la possibilità di controllare il display tramite touchscreen seguendo le istruzioni del produttore fornite con il display da 3,5 pollici.
NOTA: se lo si desidera, lo schermo da 3,5 pollici può essere utilizzato come monitor senza funzionalità touchscreen e una tastiera e un mouse possono essere collegati alle porte USB del computer a scheda singola per il controllo del computer a scheda singola. - Scarica il file "MiniFluorimeter_2Diode_GUI.py" dal file di codifica supplementare 2 in una posizione desiderata sul computer a scheda singola.
- Assicurarsi che una versione funzionante di Python sia installata nel computer a scheda singola . Python 3.7 è stato utilizzato nel modulo Python fornito, ma qualsiasi versione python stabile poteva essere utilizzata con le modifiche appropriate allo script fornito. Installare le librerie necessarie per il programma Python sul computer a scheda singola.
- Modificare la variabile measurement_time al periodo di tempo desiderato per effettuare le misurazioni. Il programma termina l'acquisizione e si chiude dopo che è trascorso il tempo desiderato. La GUI consente inoltre di terminare l'acquisizione tramite un pulsante sull'interfaccia utente.
- Modificare la variabile serialPort nell'indirizzo seriale del microcontroller connesso.
5. Registrazione di dati di fluorescenza in tempo reale
- Accendere il blocco termico commerciale e consentirgli di raggiungere la temperatura desiderata.
- Alimenta il computer a scheda singola con un alimentatore standard a 5 V fornito con la maggior parte degli acquisti di computer a scheda singola. Collegare il computer a scheda singola al microcontroller con un cavo microUSB-USB.
- Utilizzando il touchscreen, apri lo script Python fornito. Modificare measurement_time variabili di data e serialPort in base ai valori desiderati. Modificare la variabile outputFilepath sul nome del file di dati generato dal programma. Assicurarsi che il nome del file termini in '.xlsx'.
- Posizionare due tubi PCR contenenti le reazioni da monitorare nel blocco termico. Assicurarsi che il posizionamento dei tubi PCR si allinei ai canali ottici del fluorimetro una volta posizionato sul blocco termico.
- Posizionare il fluometro in cima al blocco termico con i tubi PCR ici tra i quattro pioli che estrudeno da ciascun canale ottico del fluorimetro. Per misurazioni ottimali, assicurarsi che il fluorimetro stampato in 3D sia fissato saldamente nei pozzi del blocco termico.
- Collegare saldamente il fluorimetro, collegare l'adattatore di alimentazione per i LED.
- Usa il touchscreen per avviare il programma Python. Sullo schermo LCD viene visualizzata un'interfaccia utente grafica (GUI) che misura la fluorescenza in tempo reale.
- Osservare le misurazioni della fluorescenza in tempo reale nel tempo per entrambi i tubi PCR che vengono mostrati all'utente sulla GUI.
- Trascorso il tempo di esperimento determinato dall'utente, l'acquisizione cessa. Visualizzare le misure nel file di dati di output salvato nel percorso definito dall'utente. Per terminare le misurazioni in anticipo, fare clic sul pulsante con l'etichetta "Interrompi acquisizione" sull'interfaccia utente.
Risultati
Una volta assemblate, le prestazioni del fluorimetro possono essere convalidate misurando la fluorescenza da una serie di diluizioni di colorante FITC. Nella figura 3Avengono mostrate misurazioni del colorante FITC a concentrazioni di 0, 20, 40, 60 e 80 pg/μL preparate in 1x PBS su entrambi i canali della prima configurazione del fluorimetro. Ogni campione è stato misurato tre volte con un'esposizione a LED di 1,5 s a intervalli di 20 s. Entrambi i canali del fluorimetro mostrano una risposta lineare attraverso l'intervallo desiderato.
L'applicabilità clinica del fluorimetro è stata ulteriormente dimostrata utilizzando il sistema insieme a un blocco di calore secco disponibile in commercio per eseguire l'amplificazione con due tecnologie di amplificazione isotermica: RPA e RT-LAMP.
La figura 3B mostra il decorso del tempo di fluorescenza sottratto al basale misurato durante l'amplificazione a 39 °C di 50 μL di reazioni di controllo positive e negative RPA in tempo reale per il DNA di controllo positivo del kit fornito in un kit commerciale standard e preparato secondo le istruzioni del produttore. Le reazioni RPA, che producono un livello relativamente basso di fluorescenza, sono state misurate utilizzando la prima configurazione del fluorimetro che ottiene una migliore soppressione della luce di eccitazione.
La figura 3C illustra la misurazione del corso del tempo di un saggio RT-LAMP personalizzato a 65 °C utilizzando gli insiemi di primer N2, E1 e As1e descritti da Zhang et al10e Rabe e Cepko11. Le reazioni RT-LAMP producono una maggiore quantità di fluorescenza e sono state misurate utilizzando la seconda configurazione fluorimetrica a basso costo. Gli oligonucleotidi sono stati acquistati e rimosi in tampone 2x TE a una concentrazione di 1 mM. Gli oligi bip (Forward Inner Primer) e BIP (Backward Inner Primer) sono stati ordinati con purificazione della cromatografia liquida ad alte prestazioni. Ogni set di primer (N2, E1, e As1e) sono stati combinati per fare 1000 μL di una miscela 25x come segue: 40 μL di FIP, 40 μL di BIP, 5 μL di F3, 5 μL di B3, 10 μL di LF, 10 μL di LB e 890 μL di 1x TE buffer. Per assemblare ogni reazione RT-LAMP, 1 μL di ogni set di primer è stato aggiunto a 0,5 μL di colorante fluorescente 50x e 12,5 μL di mix master 2x e il volume di reazione è stato portato a 20 μL con acqua priva di nucleasi per istruzioni del produttore. Il controllo dell'RNA SARS-CoV-2 è stato diluito serialmente in acqua priva di nucleasi a concentrazioni di 10, 100 o 1.000 copie per μL, e sono stati aggiunti 5 μL per un volume totale di reazione di 25 μL. Il controllo senza bersaglio (NTC) utilizzato in tutti gli esperimenti era acqua priva di nucleasi. Le reazioni rt-LAMP sono state sovrapposte con 25 μL di olio minerale di grado biologia molecolare.
Le reazioni RPA e RT-LAMP sono state assemblate in due pozzi di una striscia PCR a 8 tubi a basso profilo da 0,2 ml e con cappucci piatti ultracleari. Ogni reazione RPA e RT-LAMP è stata eseguita in triplice copia. In tutti i test, il mini-fluorimetro ha quantificato con successo l'aumento temporale dei livelli di fluorescenza associati all'amplificazione del DNA.
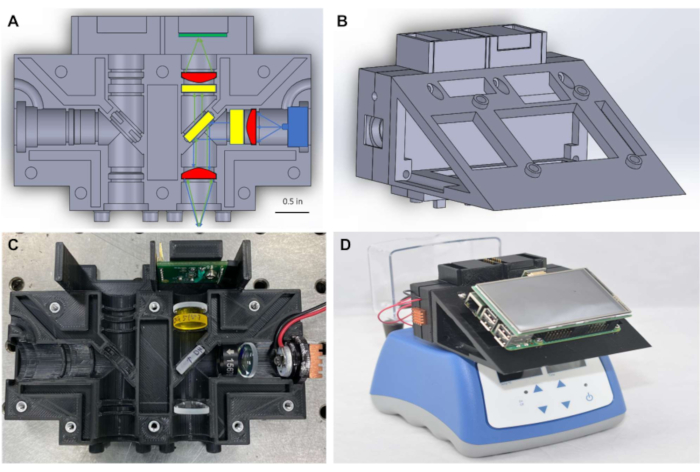
Figura 1: Alloggiamento ottico e fluorimetro miniaturi assemblato in cima al blocco termico. (A) Diagramma dell'alloggiamento ottico che mostra componenti ottici collocati in un unico canale di rivelazione. (B) Diagramma della prima configurazione del fluorimetro in miniatura dopo l'assemblaggio. (C) Fotografia dell'alloggiamento ottico con componenti ottici collocati in un unico canale di rilevamento. (D) Fotografia di fluorimetro in miniatura assemblato posto sopra un blocco termico disponibile in commercio. Clicca qui per visualizzare una versione più grande di questa figura.
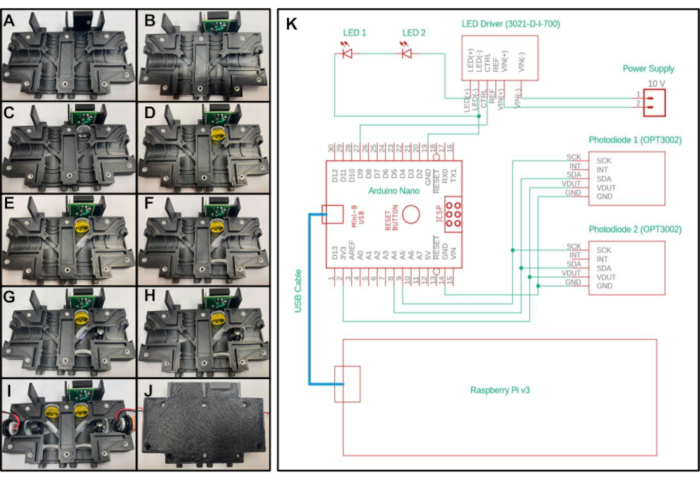
Figura 2: Schema di montaggio e controllo elettrico del fluorimetro in miniatura. A-J) Posizionamento passo-passo dei componenti ottici nell'alloggiamento ottico stampato in 3D per la prima configurazione del sistema. (K) Diagramma elettrico del fluorimetro in miniatura per entrambe le configurazioni. Clicca qui per visualizzare una versione più grande di questa figura.
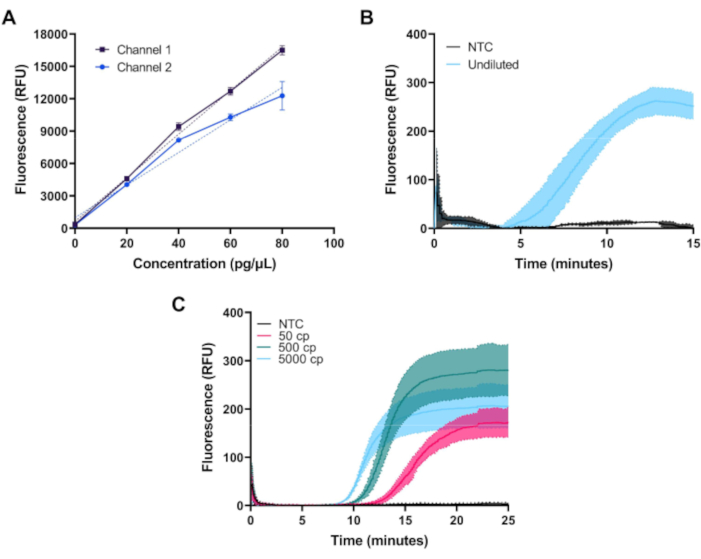
Figura 3: Misurazioni rappresentative ottenute con il fluorimetro in miniatura. (A) La fluorescenza misurata rispetto alla concentrazione di coloranti FITC in entrambi i canali mostra una risposta lineare attraverso l'intervallo dinamico desiderato. (B) Fluorescenza in tempo reale vs tempo per l'amplificazione isotermica dei controlli positivi e negativi di un kit disponibile in commercio. L'amplificazione avviene come previsto per il controllo positivo. (C) Fluorescenza in tempo reale vs tempo per amplificazione isotermica di 50, 500 e 5000 copie di RNA SARS-CoV-2 e un campione NTC da un saggio RT-LAMP personalizzato. L'amplificazione avviene come previsto vicino al limite di rivelazione del saggio. Clicca qui per visualizzare una versione più grande di questa figura.
| Sistema 1 | Sistema 2 | |||
| articolo | quantità | Prezzo totale (USD) | quantità | Prezzo totale (USD) |
| Componenti ottici | ||||
| Lenti | 6 | 158.14 | 6 | 158.14 |
| Specchi | 2 | 244.56 | 2 | 60 |
| Filtri ottici | 4 | 200 | 6 | 5 |
| subtotale | 602.7 | subtotale | 223.14 | |
| Illuminazione e rilevamento | ||||
| Led | 2 | 72.62 | 2 | 72.62 |
| LED Driver | 1 | 11.49 | 1 | 11.49 |
| fotodiodo | 2 | 50 | 2 | 50 |
| subtotale | 134.11 | subtotale | 134.11 | |
| Elettronica e display | ||||
| Arduino Nano | 1 | 20.7 | 1 | 20.7 |
| Raspberry Pi | 1 | 35 | 1 | 35 |
| Schermo LCD | 1 | 25 | 1 | 25 |
| Mini Breadboard | 1 | 4 | 1 | 4 |
| Alimentatore da 10V | 1 | 8.6 | 1 | 8.6 |
| subtotale | 93.3 | subtotale | 93.3 | |
| Costo totale (USD) | 830.11 | 450.55 | ||
Tabella 1: Confronto dei costi delle due configurazioni del fluorimetro in miniatura.
File supplementare 1: System1_Optics_Enclosure_Top.stl Fare clic qui per scaricare questo file.
File supplementare 2: System1_Optics_Enclosure_Bottom.stl, e fare clic qui per scaricare questo file.
File supplementare 3: LCD_Screen_Holder.stl Fare clic qui per scaricare questo file.
File supplementare 4: System2_Optics_Enclosure_Top.stl Fare clic qui per scaricare questo file.
File supplementare 5: System2_Optics_Enclosure_Bottom.stl, e fare clic qui per scaricare questo file.
File supplementare 6: System2_BuildInstructions.pdf Fare clic qui per scaricare questo file.
File di codifica supplementare 1: MiniFluorimeter_2Diode.ino Fare clic qui per scaricare questo file di codifica.
File di codifica supplementare 2: MiniFluorimeter_2Diode_GUI.py fare clic qui per scaricare questo file di codifica.
Discussione
Qui descritto è un fluorimetro open source, a basso costo, modulare e portatile per il rilevamento quantitativo della fluorescenza delle reazioni di amplificazione isotermica. I progetti open source facilitano una manutenzione rapida ed economica con parti di ricambio prontamente disponibili e consentono agli utenti la flessibilità di adattare il sistema alle loro esigenze in base al design modulare. Questo protocollo descrive il processo di assemblaggio di componenti meccanici, ottici ed elettrici e la convalida delle prestazioni ottiche. Inoltre, è stata dimostrata la flessibilità del fluorimetro per monitorare due diversi tipi di test di amplificazione isotermica con requisiti di temperatura, volume e fluorescenza significativamente diversi, Eso RPA e RT-LAMP. RPA viene eseguito a 39 °C in reazioni da 50 μL che utilizzano una sonda con tag FAM specifica della sequenza per la generazione di fluorescenza, mentre RT-LAMP viene eseguito a 65 °C in un volume di reazione di 25 μL e utilizza un colorante intercalante per segnalare la presenza del DNA amplificato. Poiché le misurazioni della fluorescenza vengono effettuate attraverso la parte superiore dei tubi PCR con tappi piatti, il fluorimetro è in grado di rilevare la fluorescenza da entrambi i volumi di dosaggio e i requisiti di calore sono limitati solo dal blocco di calore commerciale scelto. Inoltre, l'intensità di fluorescenza prodotta in RT-LAMP è quasi dell'ordine di grandezza maggiore di quella prodotta in RPA, a causa dei metodi basati su colorante contro sonda di generazione del segnale di fluorescenza. Tuttavia, l'intervallo dinamico del sensore ottico scelto può rilevare e quantificare sia i segnali, sia gli algoritmi di sottrazione di base tengono conto di queste differenze per produrre letture di fluorescenza affidabili.
Per facilitare la diffusione della tecnologia e ridurre al minimo i potenziali costi di manutenzione, è stato utilizzato un design modulare compatibile con i riscaldatori ampiamente disponibili in diverse impostazioni. Nel protocollo attuale, è stato utilizzato un riscaldatore a blocchi secchi comune; lo stesso design ottico ed elettrico può essere facilmente adattato per altri riscaldatori disponibili in commercio. Se si deve utilizzare un altro riscaldatore a blocchi asciutti, saranno necessarie modifiche minime nel design dell'alloggiamento 3D. In particolare, i pioli inferiori dei file STL dell'involucro ottico devono essere modificati per garantire il corretto allineamento con i pozzi di altri blocchi di calore commerciali. Mentre le custodie mostrate negli esempi sono state stampate su una stampante 3D di fascia relativamente bassa (vedi Tabella dei materiali),occorre fare attenzione a garantire che la risoluzione della stampante e/o le tolleranze di stampa siano adeguate per adattarsi ai componenti ottici e agli inserti filettati. Nei file STL forniti, su entrambi i lati dei componenti ottici nelle direzioni radiale e assiale è stata aggiunta una tolleranza di 0,01-0,02 pollici in base alle dimensioni specificate dal produttore. Ciò garantisce che tutti i componenti ottici si adattino saldamente all'interno della stampa e che l'involucro blocchi completamente l'ingresso o la fuga della luce in eccesso. Per garantire una corretta pressa per gli inserti filettati, una tolleranza simile di 0,01-0,02 pollici è stata sottratta dal diametro fornito dal produttore nel file CAD.
Le reazioni RPA sono state monitorate con successo utilizzando la prima configurazione fluorimetrica, mentre le reazioni RT-LAMP potevano essere monitorate utilizzando entrambe le configurazioni. Il miglioramento del rifiuto della luce vagante della prima configurazione è stato necessario per monitorare i bassi livelli di fluorescenza prodotti dalla sonda fluorogenica nelle reazioni RPA. Al contrario, RT-LAMP utilizza un colorante intercalante per la generazione del segnale, con conseguente maggiore intensità di fluorescenza compatibile con la gamma dinamica inferiore della seconda configurazione utilizzando fogli filtranti fotografici. Gli utenti devono selezionare la configurazione fluorimetrica che corrisponde al segnale di fluorescenza che genera colorante che genera elementi o sonda fluorogenica del loro saggio.
Una limitazione di questo sistema è che il riscaldamento è fornito da un blocco di calore disponibile in commercio alimentato attraverso una presa a parete standard. Questo sistema potrebbe essere ulteriormente sviluppato per l'uso in aree prive di accesso affidabile all'elettricità incorporando pacchi batteria portatili e ricaricabili, come dimostrato da altrigruppi 12. Un'altra limitazione è la velocità effettiva relativamente bassa del sistema, che consente la misurazione simultanea della fluorescenza di soli due campioni alla volta. Più stampe dell'involucro possono essere posizionate in cima allo stesso blocco termico per aumentare la produttività; tuttavia, il sensore di luce utilizzato ha solo quattro indirizzi I2C unici. Ciò limita a quattro il numero massimo di campioni che possono essere misurati contemporaneamente. È necessario un sensore di luce diverso con un numero maggiore di indirizzi I2C unici per aumentare ulteriormente la velocità effettiva.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Un ringraziamento speciale a Chelsey Smith, Megan Chang, Emilie Newsham, Sai Paul e Christopher Goh per la loro assistenza nella preparazione del campione. Gli autori ringraziano Caroline Noxon per la revisione del manoscritto. I finanziamenti per questo lavoro sono stati forniti dal popolo americano da USAID attraverso una sovvenzione di ricerca IAVI CCID 9204 nell'ambito del premio AID-OAA-A16-00032 tra IAVI e USAID.
Materiali
| Name | Company | Catalog Number | Comments |
| 1/4-inch-long 4-40 threaded insert | McMaster-Carr | 90742A116 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 10v power supply | GlobTek, Inc. | WR9HU1800CCP-F(R6B) | AC/DC Wall Mount Adapter 10V 18W |
| 15 mm focal length lens | Thorlabs | LA 1074 | Two total are used for the fluorimeter. This lens is used to focus the LED illumination. |
| 1-inch-long 4-40 screws | McMaster-Carr | ||
| 20 mm focal length lens | Thorlabs | LA 1540 | Four total are used for the fluorimeter. |
| 2x WarmStart LAMP Master Mix | New England Biolabs, Inc | E1700 | Master mix was used to create the LAMP reactions shown in Figure 3C |
| 3.5” Touch Screen | Uctronics | BO10601 | |
| 3/16-inch-long 4-40 screw | McMaster-Carr | 90128A105 | |
| 3/16-inch-long 4-40 threaded insert | McMaster-Carr | 90742A115 | Used to secure the OPT3002 test board onto the 3D printed enclosure |
| 3/8-inch-long 4-40 screws | McMaster-Carr | 90128A108 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 3D printer filament | 3D Universe | UMNFC-PC285-BLACK | Black or another dark color preferred |
| 3D printer used | Ultimaker | Ultimaker 2+ | |
| 8-tube PCR strips | BioRad | #TLS0801 | |
| Advanced Mini Dry Block Heater | VWR International | 10153-320 | The following heat blocks are acceptable substitutes without the need for redesigning the optical assembly: 949VWMNLUS, 949VWMHLUS, and 949VWMHLEU |
| barrel jack to two-pin adapter | SparkFun Electronics | 1568-1238-ND | |
| Blue Excitation Filter Foil | LEE | LE071S | Selected for use with FITC - other fluorescent dyes may require different filters. |
| Blue LED - 460 nm | Mouser | LZ1-30DB00-0100 | Selected for use with FITC - other fluorescent dyes may require different parts |
| Dichroic Mirror | Thorlabs | DMLP505T | Selected for use with FITC - other fluorescent dyes may require different parts |
| Emission Filter | Edmunds Optics | OG-515 | Selected for use with FITC - other fluorescent dyes may require different parts. The arrow on the part points away from the illumination source. |
| Excitation Filter | Omega Filters | 490AESP | Selected for use with FITC - other fluorescent dyes may require different parts |
| LED Driver | LEDdynamics | 3021-D-I-700 | |
| M2.5 Hex Shaped insert | McMaster-Carr | 91292A009 | Used to secure the Raspberry Pi to the 3D printed LCD Screen Holder |
| Microcontroller | Arduino | Nano | |
| Mini Breadboard | Adafruit | 65 | |
| Molecular biology-grade mineral oil | Sigma Aldrich | 69794 | |
| OPT3002EVM - Light-to-Digital Sensor | Texas Instruments | OPT3002EVM: | Light-to-digital sensor used. Consists of two PCBs: a SM-USB_DIG board and the OPT3002 test board; only the OPT3002 test board is needed for this device. |
| Purchased oligonucleotides | Integrated DNA Technologies | ||
| RPA kit positive control DNA | TwistDx Limited | CONTROL01DNAE | |
| SARS-CoV-2 RNA Control | Twist Biosciences | MN908947.3 | |
| Single board computer | Raspberry Pi | Raspberry Pi 3 | |
| TwistAmp RPA exo kit | TwistDx Limited | TAEXO02KIT | |
| Ultraclear flat caps | BioRad | #TCS0803 | |
| Yellow Emmission Filter Foil | LEE | LE767S | Selected for use with FITC - other fluorescent dyes may require different parts |
Riferimenti
- Daher, R. K., Stewart, G., Boissinot, M., Bergeron, M. G. Recombinase polymerase amplification for diagnostic applications. Clinical Chemistry. 62 (7), 947-958 (2016).
- Yan, L., et al. Isothermal Amplified Detection of DNA and RNA. Molecular BioSystems. 10 (5), 970-1003 (2014).
- Giuffrida, M. C., Spoto, G. Integration of Isothermal Amplification Methods in Microfluidic Devices: Recent Advances. Biosensors and Bioelectronics. 90, 174-186 (2017).
- Gill, P., Ghaemi, A. Nucleic Acid Isothermal Amplification Technologies-A Review. Nucleosides, Nucleotides and Nucleic Acids. 27 (3), 224-243 (2008).
- Richards-Kortum, R., Oden, M. Devices for Low-Resource Health Care. Science. 342 (6162), 1055-1057 (2013).
- Katzmeier, F., et al. A Low-Cost Fluorescence Reader for in vitro Transcription and Nucleic Acid Detection with Cas13a. PLOS One. 14 (12), e0220091 (2019).
- Safavieh, M., et al. Emerging Loop-Mediated Isothermal Amplification-Based Microchip and Microdevice Technologies for Nucleic Acid Detection. ACS Biomaterials Science and Engineering. 2 (3), 278-294 (2016).
- Monis, P. T., Giglio, S., Saint, C. P. Comparison of SYTO9 and SYBR Green I for Real-Time Polymerase Chain Reaction and Investigation of the Effect of Dye concentration on Amplifcation and DNA Melting Curve Analysis. Analytical Biochemistry. 340 (1), 24-34 (2005).
- Parra, S., et al. Development of Low-Cost Point-of-Care Technologies for Cervical Cancer Prevention Based on a Single-Board Computer. IEEE Journal of Translational Engineering in Health and Medicine. 8 (4300210), (2020).
- Zhang, Y., et al. Enhancing Colorimetric Loop-Mediated Isothermal Amplification Speed and Sensitivity with Guanidine Chloride. Biotechniques. 69 (3), 178-185 (2020).
- Rabe, B. A., Cepko, C. SARS-CoV-2 Detection Using an Isothermal Amplification Reaction and a Rapid, Inexpensive Protocol for Sample Inactivation and Purification. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24450-24458 (2020).
- Snodgrass, R., et al. A Portable Device for Nucleic Acid Quantification Powered by Sunlight, a Flame or Electricity. Nature Biomedical Engineering. 2 (9), 657-665 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon