Method Article
Fluorimètre miniature open source pour surveiller les réactions d’amplification des acides nucléiques isothermes en temps réel dans des environnements aux ressources limitées
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Des instructions détaillées sont fournies pour construire un fluorimètre modulaire open source compatible avec de nombreux appareils de chauffage à faible coût afin d’effectuer une amplification quantitative des acides nucléiques isothermes en temps réel.
Résumé
Les méthodes traditionnelles de détection et de quantification des acides nucléiques reposent sur la réaction en chaîne de la polymérase (PCR) et nécessitent l’utilisation de thermocycleurs coûteux avec détection par fluorescence intégrée des amplicons. Les technologies d’amplification des acides nucléiques isothermes éliminent le besoin de cycle thermique; cependant, la détection des produits basée sur la fluorescence est toujours nécessaire pour obtenir des résultats quantitatifs en temps réel. Plusieurs appareils de chauffage isothermes portatifs avec détection de fluorescence intégrée sont maintenant disponibles dans le commerce; cependant, le coût de ces appareils reste un obstacle important à l’adoption généralisée dans les environnements aux ressources limitées. Voici un protocole pour la conception et l’assemblage d’un fluorimètre modulaire à faible coût construit à partir de composants prêts à l’emploi. Enfermé dans un boîtier compact imprimé en 3D, le fluorimètre est conçu pour être placé au sommet d’un bloc thermique disponible dans le commerce contenant un tube PCR. Le fluorimètre décrit ici a été optimisé pour détecter le colorant isothiocyanate de fluorescéine (FITC), mais le système peut être modifié pour une utilisation avec des colorants couramment utilisés comme rapporteurs dans les réactions d’amplification des acides nucléiques en temps réel. L’applicabilité clinique du système est démontrée en effectuant la détection d’acides nucléiques en temps réel avec deux technologies d’amplification isotherme: l’amplification de la recombinase polymérase (RPA) pour la détection de l’ADN de contrôle positif fourni dans un kit commercial et l’amplification isotherme à médiation par boucle de transcription inverse (RT-LAMP) pour la détection de niveaux cliniquement significatifs d’ARN sars-CoV-2.
Introduction
Les technologies d’amplification isotherme sont largement utilisées pour la détection des acides nucléiques. Par rapport aux approches pcr traditionnelles qui nécessitent la thermocyclisme, l’amplification isotherme permet à l’amplification des acides nucléiques de se produire à une seule température, permettant ainsi un délai de résultats plus rapide et une meilleure tolérance des inhibiteurs1,2. Un autre avantage clé de l’amplification isotherme est la complexité réduite de l’instrumentation. La plupart des réactions d’amplification isotherme ne nécessitent qu’un bloc thermique et une modalité de détection- soit une détection en temps réel via la surveillance de la fluorescence, soit la détection des paramètres, par exemple par électrophorèse en flux latéral ou sur gel3,4. La détection de fluorescence en temps réel est réalisée par la détection de la fluorescence produite par des colorants intercalants qui s’activent en présence d’ADN double brin ou de sondes fluorescentes trempées qui s’activent en présence de séquences d’ADN double brin spécifiques.
Bien qu’il existe des fluorimètres isothermes de paillasse disponibles dans le commerce, beaucoup manquent de personnalisation pour la mise en œuvre des tests. Par exemple, de nombreux appareils nécessitent des consommables spécifiques ou fournis par l’entreprise, recommandent des fournisseurs préférés ou utilisent un logiciel propriétaire pour obtenir les résultats annoncés. La plupart de ces systèmes coûtent plus de 5 000 $ US, ce qui représente un obstacle important à une utilisation généralisée dans des environnements aux ressources limitées. En outre, les utilisateurs dans les milieux à faibles ressources sont confrontés à des défis pour maintenir l’équipement conçu pour les environnements à ressources élevées en raison de conditions environnementales difficiles, de chaînes d’approvisionnement faibles pour les pièces de rechange et d’outils spécialisés nécessaires à l’entretien et à la réparation5. Pour répondre à ce besoin, décrit ici la conception et l’assemblage d’un fluorimètre modulaire et à faible coût construit à partir de composants prêts à l’emploi enfermés dans un boîtier imprimé en 3D compact(figures 1A-C)avec deux configurations optionnelles. La première configuration de cet appareil utilise des filtres en verre disponibles dans le commerce et un miroir dichroïque pour bloquer l’excès de lumière de fond et a un coût total d’assemblage de 830 $ USD. Bien que ces filtres soient couramment utilisés dans les systèmes d’imagerie à base de fluorescence, il a déjà été démontré que le remplacement des feuilles de filtre optique de haute qualité coûteuses permet la détection des acides nucléiques6. La deuxième configuration du fluorimètre intègre ces filtres peu coûteux et remplace les miroirs dichroïques par des séparateurs de faisceaux φ1/2 « , réduisant le coût global du système de 830 $ à 450 $ USD.
Des images représentatives de l’ensemble sont représentées pour la première configuration de la figure 1 et de la figure 2,mais des images analogues pour la deuxième configuration peuvent être trouvées dans le fichier supplémentaire 6. Pour éviter le besoin d’un alignement optique spécialisé, le système optique a désigné des zones pour placer chaque composant optique et peut être fabriqué avec une imprimante 3D relativement bas de gamme, permettant une utilisation généralisée de la conception. Les seules différences de construction et d’assemblage pour les deux configurations sont les fichiers utilisés pour l’impression 3D et les composants optiques placés dans le boîtier. Les dimensions externes du boîtier imprimé en 3D pour les deux systèmes sont les mêmes. Une comparaison des coûts des deux systèmes est présentée dans le tableau 1.
Comme le montre la figure 1A,pour maintenir un petit facteur de forme, le fluorimètre se compose d’optiques Φ1/2 » (~12,5 mm), couplées à un éclairage et à une détection compacts qui sont placés pour mesurer le signal à travers le haut du tube PCR. Le système de la figure 1 est conçu pour détecter les colorants avec des longueurs d’onde d’excitation et d’émission de crête proches de 490 nm et 525 nm, respectivement, y compris fitc et colorants étroitement apparentés tels que SYBR et SYTO-9, qui sont couramment utilisés comme rapporteurs dans les réactions d’amplification des acides nucléiques en temps réel7,8. La source d’excitation, les filtres optiques et le détecteur peuvent facilement être substitués à des composants compatibles avec différents colorants fluorescents selon vos besoins. Les réactions d’amplification des acides nucléiques sont généralement effectuées dans des tubes pcr, et le fluorimètre est conçu pour être placé au-dessus de tout bloc thermique disponible dans le commerce qui contient des tubes PCR(figure 1D),ce qui permet une surveillance en temps réel des réactions isothermes. Des blocs chauffants appropriés sont disponibles dans la plupart des laboratoires biomédicaux et peuvent être achetés pour moins de 500 $ USD.
L’utilisation d’ordinateurs monoc carton pour fournir une solution de rechange peu coûteuse au point de service pour contrôler les technologies d’imagerie a déjà été démontrée9. S’appuyant sur ce travail, dans ce protocole, une interface utilisateur graphique monocise(Figure 1D)est utilisée pour faciliter l’enregistrement des données en temps réel et l’affichage des résultats au point de service, éliminant ainsi le besoin d’un ordinateur portable pour traiter ou visualiser les données. Les mesures de fluorescence ont été transférées via le protocole I2C des capteurs de lumière à un microcontrôleur, puis mises à la disposition de l’ordinateur monocréiste via une communication série. Les connexions électriques pour l’éclairage et le transfert de données ont été fournies par câblage et soudure simplifiés sur des planches à pain miniaturisées, ce qui a annulé le besoin de cartes de circuits imprimés (PCB) spécialisées. Le logiciel requis pour faire fonctionner le fluorimètre est disponible via des cadres logiciels open source et le code requis pour faire fonctionner l’appareil est fourni dans les fichiers de codage supplémentaires. Le fluorimètre complet peut être assemblé entre 450 $ et 830 $ USD, et les résultats montrent qu’il fournit des mesures de fluorescence précises et fiables pour surveiller l’amplification isotherme en temps réel des acides nucléiques.
Protocole
1. Étapes de préparation: impression 3D et soudure
REMARQUE: Le système optique décrit dans ce protocole est conçu pour un chauffe-bloc sec standard.
- Pour créer la première configuration, imprimez en 3D les fichiers CAO fournis en tant que fichiers supplémentaires 1, 2 et 3 respectivement :
- Pour créer la deuxième configuration, imprimez en 3D les fichiers CAO fournis en tant que fichiers supplémentaires 3, 4 et 5,respectivement :
REMARQUE: Ces pièces sont conçues pour être imprimées avec des supports. Dans ce guide, on utilise un filament de polycarbonate noir qui peut conserver sa forme après avoir été soumis à des températures allant jusqu’à 110 °C. En général, tout matériau pouvant être chauffé à la température de la réaction isotherme souhaitée sans déformation significative peut être utilisé. Pour minimiser l’effet des réflexions internes et des interférences de la lumière ambiante, un matériau noir ou d’une autre couleur sombre est recommandé. - Préparer les deux modules d’évaluation de capteur lumière-numérique pour la surveillance parallèle de deux échantillons. Sur l’une des cartes de test du capteur, retirez la résistance R4 et souder un fil de cavalier du pavé droit de la zone R4 sur le PCB jusqu’au tampon supérieur dans la zone R1 du PCB. Cela va changer l’adresse I2C du capteur, permettant ainsi la mesure simultanée des deux capteurs.
REMARQUE: Le capteur utilisé se compose de deux PCB: une carte adaptateur USB et une carte de test de capteur contenant le capteur de lumière; seule la carte de test du capteur est nécessaire pour cet appareil. - Fils de soudure à chacune des deux diodes électroluminescentes (LED). Connectez un fil rouge (positif) au pad étiqueté « 1 » sur la LED et un fil noir (négatif) sur le pad étiqueté « 2 » sur la LED. Appliquez une fine couche d’adhésif thermique à l’arrière de la LED, placez la LED sur le dessus d’un bouchon d’extrémité et attendez que l’adhésif thermique durcisse. De l’autre côté du bouchon d’extrémité, ajoutez un dissipateur de chaleur.
REMARQUE: Lorsque vous testez les voyants avant qu’ils ne soient scellés dans le boîtier, assurez-vous de porter une protection oculaire bloquant la lumière bleue appropriée. - Pour créer la deuxième configuration, coupez deux cercles de 1/4 de pouce de diamètre à partir d’une feuille de feuille d’excitation bleue et quatre cercles de 1/4 de pouce de diamètre à partir d’une feuille de feuille d’émission jaune avec des ciseaux ou une lame de rasoir.
- Appuyez sur un insert en forme d’hexagone M2.5 dans chacun des quatre trous de la partie inclinée de la partie « LCD_Screen_Holder.stl ».
2. Assemblage optique
- Placez un insert fileté de 3/16 de pouce de 4 à 40 de long dans le trou sur le dessus de la partie « Optics_Enclosure_Bottom.stl ». Placez un insert fileté de 4 à 40 de 1/4 de pouce de long dans tous les autres trous de la pièce imprimée en 3D, comme illustré à la Figure 2A.
- Insérez la carte de test du capteur dans la cavité supérieure du boîtier, avec les cinq broches tournées vers le haut et les plus proches de l’axe central de l’appareil. Fixez-vous à l’au moyen d’une vis de 3/16 de pouce de long de 4 à 40 à travers le trou de la carte d’essai du capteur(Figure 2B).
- Placer l’une des lentilles de distance focale de 20 mm dans la section située sous la carte d’essai du capteur, le côté convexe faisant face vers le bas de l’appareil et à l’écart de la carte d’essai(Figure 2C).
- Pour créer la première configuration, placez le filtre passe-long dans la section suivante sous l’objectif de distance focale de 20 mm(Figure 2D)placé à l’étape précédente. Pour créer la deuxième configuration, placez deux feuilles de filtre d’émission jaunes dans la section sous l’objectif.
- Pour créer la première configuration, placez le miroir dichroïque dans la section diagonale près du centre de l’enveloppe tout en observant l’orientation du filtre spécifiée par le fabricant(figure 2E). Pour créer la deuxième configuration, placez le séparateur de poutre dans la section diagonale. Aucune orientation spécifique n’est nécessaire pour le séparateur de faisceau.
- Placez une deuxième lentille de distance focale de 20 mm dans la section sous le miroir dichroïque (ou séparateur de faisceau, selon la configuration) avec le côté convexe pointant vers le haut de l’appareil(Figure 2F).
- Pour créer la première configuration, placez le filtre d’excitation dans la section à droite du miroir dichroïque, en vous assurant que la flèche pointe vers le miroir dichroïque(Figure 2G). Pour créer la deuxième configuration, placez une feuille de filtre d’excitation bleue dans la section à droite du séparateur de faisceau.
- Placer la lentille de distance focale de 15 mm à droite du filtre d’excitation, le côté convexe faisant face au miroir dichroïque(Figure 2H).
- Placez une LED dans la section restante de l’impression, avec la LED orientée vers le miroir dichroïque (ou séparateur de faisceau, selon la configuration). Assurez-vous que les deux fils menant de la LED sont insérés dans les canaux encastrés afin que l’impression se ferme hermétiquement.
- Répétez les étapes 2.3 à 2.9 pour l’autre face de la pièce imprimée en 3D(Figure 2I).
- Fermez le côté vide de l’impression sur le dessus de l’impression avec les composants optiques en plaçant les parties extrudées de la moitié supérieure de l’enveloppe dans les rainures encastrées de la moitié inférieure de l’enveloppe. Fixez les deux pièces imprimées ensemble avec des vis de 3/8 de pouce de long de 4 à 40(Figure 2J).
REMARQUE: Si les deux pièces imprimées ne sont pas complètement fermées, la lumière d’excitation parasite peut s’échapper du boîtier optique. Assurez-vous que la protection des yeux bloquant la lumière bleue est portée jusqu’à ce qu’un joint approprié soit atteint. Refermez l’enceinte jusqu’à ce qu’aucun excès de lumière ne s’échappe.
3. Assemblage électronique et écran tactile
- Connectez les deux mini planches à pain ensemble, puis placez le microcontrôleur sur l’une des planches à pain. Assurez-vous que le port microUSB du microcontrôleur est orienté vers l’extérieur.
- Pour connecter la modulation LED, connectez la broche CTL du pilote LED (+) à une broche numérique du microcontrôleur et la broche LED (-) du pilote LED à une broche GND du microcontrôleur.
- Retirez les couvercles en plastique à l’arrière des planches à pain. Appuyez sur le support adhésif des planches à pain sur la pièce imprimée en 3D pour fixer les planches à pain combinées à l’intérieur de la partie arrière de la partie imprimée « LCD_Screen_Holder.stl ».
- Fixez le support d’écran à cristaux liquides (LCD) avec les planches à pain assemblées à l’intérieur du boîtier optique assemblé dans la section 2 avec des vis d’un pouce de long de 4 à 40.
- Pour connecter le bloc d’alimentation LED, connectez la broche LED (+) du pilote LED au fil positif du premier voyant. Connectez le fil négatif de la première LED au fil positif de la deuxième LED sur la planche à pain. Connectez le fil négatif de la deuxième LED à la broche LED (-) du pilote LED.
REMARQUE: L’ordre de la première ou de la deuxième LED est arbitraire. - Pour connecter le bloc d’alimentation du pilote LED, connectez les fils positifs et négatifs de l’alimentation 10 V aux broches VIN+ et VIN du pilote LED, respectivement. (Un adaptateur jack à deux broches a été utilisé.)
- Connectez l’alimentation de la carte de test du capteur et le transfert de données. Seules quatre broches sur la carte de test du capteur sont utilisées : le SCK, le SDA, le VDUT et le GND. Prenez un fil de cavalier femelle à mâle à 4 broches et connectez ces broches sur les cartes de test de capteur de lumière à numérique à la mini planche à pain à travers l’espace en haut à droite de l’impression du support LCD.
- Sur la planche à pain, assurez-vous que les connexions entre les éléments suivants sont en place: la broche 3,3 V du microcontrôleur et la broche VDUT des deux cartes de test; la broche GND du microcontrôleur et la broche GND des deux cartes de test; la broche analogique 4 (A4) du microcontrôleur et la broche SDA des deux cartes de test; et la broche analogique 5 (A5) du microcontrôleur et la broche SCK des deux cartes de test.
REMARQUE: Étant donné que la communication I2C est utilisée pour les capteurs de lumière, les broches SCK et SDA des deux capteurs peuvent toutes deux être acheminées vers les mêmes broches du microcontrôleur. - Fixez l’ordinateur monoc carton sur le support de l’écran LCD à l’avec quatre vis M2.5. Assurez-vous que les ports HDMI et adaptateur secteur de l’ordinateur monocré et orienté vers le haut et que l’ordinateur monocré est centré sur la partie imprimée en 3D.
- Connectez l’écran tactile à l’ordinateur monocais, conformément aux instructions de l’écran tactile, puis connectez le port HDMI de l’ordinateur monoc carte au port HDMI de l’écran tactile.
4. Installation du logiciel
- Installez et utilisez l’éditeur Web pour télécharger l’esquisse personnalisée « MiniFluorimeter_2Diode.ino » fournie dans le fichier de codage supplémentaire 1 sur le microcontrôleur. Assurez-vous que la bibliothèque « ClosedCube OPT3002 » est installée à l’aide du Gestionnaire de bibliothèque.
- Remplacez la variable led_A_pin par le numéro de la broche numérique utilisée à l’étape 3.3 (section d’assemblage électronique et écran tactile).
- Ajustez le nombre de millisecondes pendant laquelle la LED est activée lors de l’acquisition de mesures de fluorescence en modifiant la valeur de la variable ExposureTime. Ajustez le nombre de millisecondes entre les expositions led en modifiant la valeur de la variable led_A_Interval.
- Modifiez la variable led_Power en un nombre compris entre zéro et un pour régler la luminosité des voyants pendant les expositions. Zéro donne la quantité maximale de luminosité et on donne la plus faible quantité de luminosité.
- Activez la possibilité de contrôler l’écran via l’écran tactile en suivant les instructions du fabricant fournies avec l’écran de 3,5 pouces.
REMARQUE: Si vous le souhaitez, l’écran de 3,5 pouces peut être utilisé comme un moniteur sans capacités d’écran tactile, et un clavier et une souris peuvent être connectés aux ports USB de l’ordinateur monoc carte pour le contrôle de l’ordinateur monocais. - Téléchargez le fichier « MiniFluorimeter_2Diode_GUI.py » à partir du fichier de codage supplémentaire 2 à l’emplacement souhaité sur l’ordinateur monoc carte.
- Assurez-vous qu’une version de travail de Python est installée sur l’ordinateur monoc carte. Python 3.7 a été utilisé dans le module Python fourni, mais toute version stable de Python pouvait être utilisée avec les modifications appropriées apportées au script fourni. Installez les bibliothèques nécessaires au programme Python sur l’ordinateur monoc carte.
- Modifiez la variable measurement_time à la durée souhaitée pour prendre des mesures. Le programme met fin à l’acquisition et se ferme une fois le temps souhaité écoulé. L’interface graphique permet également de terminer l’acquisition via un bouton de l’interface utilisateur.
- Remplacez la variable serialPort par l’adresse série du microcontrôleur connecté.
5. Enregistrement des données de fluorescence en temps réel
- Allumez le bloc thermique commercial et laissez-le atteindre la température souhaitée.
- Alimentez l’ordinateur monoc carte avec une alimentation standard de 5 V fournie avec la plupart des achats d’ordinateurs monoc carte. Connectez l’ordinateur monoc carte au microcontrôleur à l’avec un câble microUSB vers USB.
- À l’aide de l’écran tactile, ouvrez le script Python fourni. Remplacez les variables measurement_time et serialPort par les valeurs souhaitées. Remplacez la variable outputFilepath par le nom du fichier de données généré par le programme. Assurez-vous que le nom de fichier se termine par « .xlsx ».
- Placez deux tubes PCR contenant les réactions à surveiller dans le bloc thermique. Assurez-vous que le placement des tubes PCR s’aligne sur les canaux optiques du fluorimètre une fois qu’il est placé sur le bloc thermique.
- Placez le fluorimètre au-dessus du bloc thermique avec les tubes PCR centrés entre les quatre chevilles extrudant de chaque canal optique du fluorimètre. Pour des mesures optimales, assurez-vous que le fluorimètre imprimé en 3D est solidement fixé dans les puits du bloc de chaleur.
- Fixez solidement le fluorimètre, branchez l’adaptateur adaptateur secteur pour les LED.
- Utilisez l’écran tactile pour démarrer le programme Python. Une interface utilisateur graphique (GUI) apparaît sur l’écran LCD et mesure la fluorescence en temps réel.
- Observez les mesures de fluorescence en temps réel au fil du temps pour les deux tubes PCR qui sont montrés à l’utilisateur sur l’interface graphique.
- Une fois le temps d’expérience déterminé par l’utilisateur écoulé, l’acquisition cesse. Affichez les mesures dans le fichier de données en sortie enregistré dans l’emplacement défini par l’utilisateur. Pour terminer les mesures tôt, cliquez sur le bouton intitulé « Arrêter l’acquisition » sur l’interface utilisateur.
Résultats
Une fois assemblé, les performances du fluorimètre peuvent être validées en mesurant la fluorescence à partir d’une série de dilutions de colorant FITC. Sur la figure 3A,des mesures du colorant FITC à des concentrations de 0, 20, 40, 60 et 80 pg/μL préparées dans 1x PBS sur les deux canaux de la première configuration du fluorimètre sont représentées. Chaque échantillon a été mesuré trois fois avec une exposition aux DEL de 1,5 s à des intervalles de 20 s. Les deux canaux du fluorimètre montrent une réponse linéaire sur toute la plage souhaitée.
L’applicabilité clinique du fluorimètre a été encore démontrée en utilisant le système avec un bloc de chaleur sèche disponible dans le commerce pour effectuer l’amplification avec deux technologies d’amplification isotherme : RPA et RT-LAMP.
La figure 3B illustre l’évolution temporelle de la fluorescence soustrachée de base mesurée lors d’une amplification à 39 °C de 50 μL de réactions de contrôle positives et négatives RPA en temps réel pour l’ADN de contrôle positif du kit fourni dans un kit commercial standard et préparé conformément aux instructions du fabricant. Les réactions RPA, qui produisent un niveau de fluorescence relativement faible, ont été mesurées en utilisant la première configuration du fluorimètre qui permet une meilleure suppression de la lumière d’excitation.
La figure 3C illustre la mesure de la trajectoire temporelle d’un dosage RT-LAMP personnalisé à 65 °C en utilisant les ensembles d’amorces N2, E1 et As1e décrits par Zhang et al10,et Rabe et Cepko11. Les réactions RT-LAMP produisent une plus grande quantité de fluorescence et ont été mesurées à l’aide de la deuxième configuration de fluorimètre à moindre coût. Des oligonucléotides ont été achetés et réatsides dans un tampon 2x TE à une concentration de 1 mM. L’amorce interne avant (FIP) et l’amorce intérieure arrière (BIP) oligos ont été commandés avec la purification de chromatographie liquide haute performance. Chaque ensemble d’amorces (N2, E1 et As1e) a été combiné pour faire 1000 μL d’un mélange 25x comme suit : 40 μL de FIP, 40 μL de BIP, 5 μL de F3, 5 μL de B3, 10 μL de LF, 10 μL de LB et 890 μL de tampon 1x TE. Pour assembler chaque réaction RT-LAMP, 1 μL de chaque ensemble d’amorces a été ajouté à 0,5 μL de colorant fluorescent 50x et 12,5 μL de mélange maître 2x et le volume de réaction a été porté à 20 μL avec de l’eau sans nucléase selon les instructions du fabricant. Le contrôle de l’ARN du SARS-CoV-2 a été dilué en série dans de l’eau sans nucléase à des concentrations de 10, 100 ou 1 000 copies par μL, et 5 μL ont été ajoutés pour un volume de réaction total de 25 μL. Le témoin sans cible (NTC) utilisé dans toutes les expériences était l’eau sans nucléase. Les réactions RT-LAMP ont été superposées à 25 μL d’huile minérale de qualité biologie moléculaire.
Des réactions RPA et RT-LAMP ont été assemblées dans deux puits d’une bande de PCR à profil bas de 0,2 mL de 8 tubes et coiffées de bouchons plats ultraclairs. Chaque réaction RPA et RT-LAMP a été exécutée en trois exemplaires. Dans tous les tests, le mini-fluorimètre a quantifié avec succès l’augmentation temporelle des niveaux de fluorescence associés à l’amplification de l’ADN.
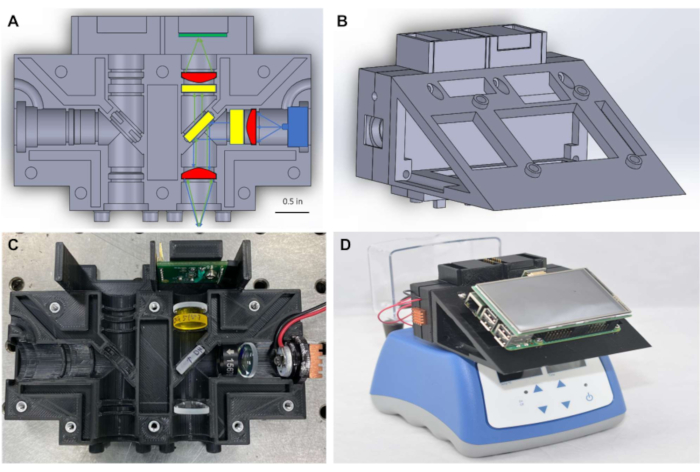
Figure 1: Boîtier optique et fluorimètre miniature assemblé au sommet d’un bloc thermique. (A)Schéma du boîtier optique montrant des composants optiques placés dans un canal de détection. (B) Schéma de la première configuration du fluorimètre miniature après assemblage. (C) Photographie du boîtier optique avec des composants optiques placés dans un canal de détection. (D) Photographie d’un fluorimètre miniature assemblé placé au-dessus d’un bloc thermique disponible dans le commerce. Veuillez cliquer ici pour voir une version plus grande de cette figure.
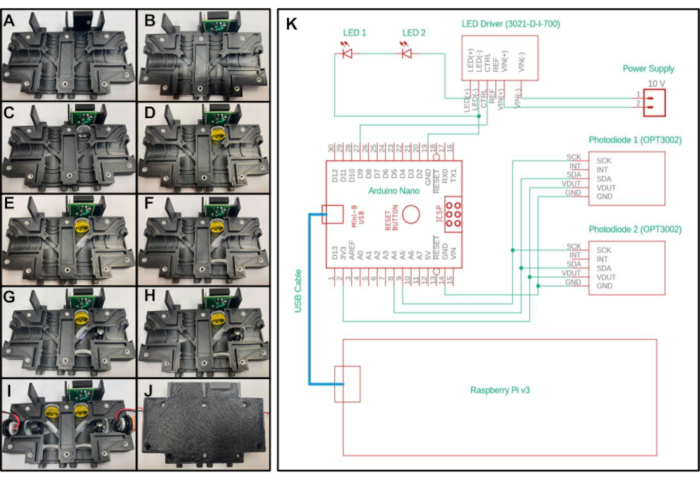
Figure 2: Schéma d’assemblage et de commande électrique du fluorimètre miniature. A-J) Placement étape par étape des composants optiques dans le boîtier optique imprimé en 3D pour la première configuration du système. (K) Schéma électrique du fluorimètre miniature pour les deux configurations. Veuillez cliquer ici pour voir une version plus grande de cette figure.
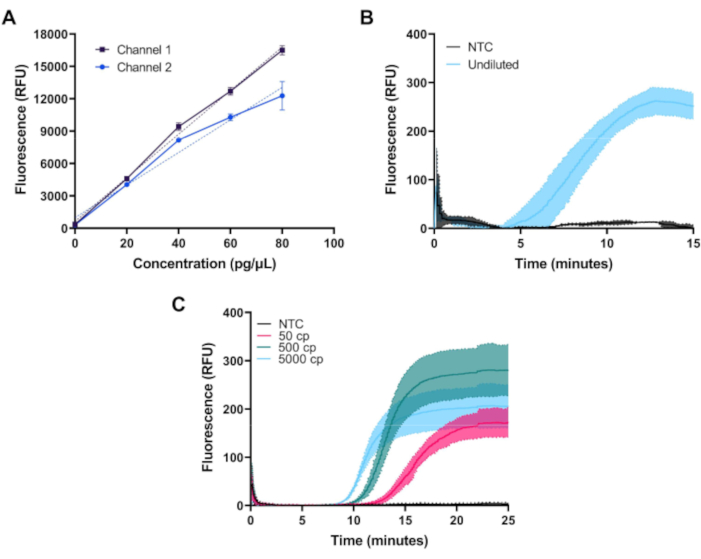
Figure 3: Mesures représentatives obtenues avec le fluorimètre miniature. (A)La fluorescence mesurée par rapport à la concentration de colorant FITC dans les deux canaux montre une réponse linéaire sur la plage dynamique souhaitée. (B) Fluorescence en temps réel vs temps pour l’amplification isotherme des contrôles positifs et négatifs d’un kit disponible dans le commerce. L’amplification se produit comme prévu pour le témoin positif. (C) Fluorescence en temps réel vs temps pour l’amplification isotherme de 50, 500 et 5000 copies d’ARN sars-CoV-2 et un échantillon NTC d’un test RT-LAMP personnalisé. L’amplification se produit comme prévu près de la limite de détection du test. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Système 1 | Système 2 | |||
| article | quantité | Prix total (USD) | quantité | Prix total (USD) |
| Composants optiques | ||||
| Lentilles | 6 | 158.14 | 6 | 158.14 |
| Miroirs | 2 | 244.56 | 2 | 60 |
| Filtres optiques | 4 | 200 | 6 | 5 |
| sous-total | 602.7 | sous-total | 223.14 | |
| Éclairage et détection | ||||
| Led | 2 | 72.62 | 2 | 72.62 |
| Pilote LED | 1 | 11.49 | 1 | 11.49 |
| photodiode | 2 | 50 | 2 | 50 |
| sous-total | 134.11 | sous-total | 134.11 | |
| Électronique et affichage | ||||
| Arduino Nano | 1 | 20.7 | 1 | 20.7 |
| Raspberry Pi | 1 | 35 | 1 | 35 |
| Ecran LCD | 1 | 25 | 1 | 25 |
| Mini Breadboard | 1 | 4 | 1 | 4 |
| Alimentation 10V | 1 | 8.6 | 1 | 8.6 |
| sous-total | 93.3 | sous-total | 93.3 | |
| Coût total (USD) | 830.11 | 450.55 | ||
Tableau 1 : Comparaison des coûts des deux configurations du fluorimètre miniature.
Fichier supplémentaire 1: System1_Optics_Enclosure_Top.stl Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2: System1_Optics_Enclosure_Bottom.stl, et S’il vous plaît cliquez ici pour télécharger ce fichier.
Fichier supplémentaire 3: LCD_Screen_Holder.stl Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 4: System2_Optics_Enclosure_Top.stl Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 5: System2_Optics_Enclosure_Bottom.stl, et S’il vous plaît cliquez ici pour télécharger ce fichier.
Dossier supplémentaire 6: System2_BuildInstructions.pdf Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 1: MiniFluorimeter_2Diode.ino Veuillez cliquer ici pour télécharger ce fichier de codage.
Fichier de codage supplémentaire 2: MiniFluorimeter_2Diode_GUI.py Veuillez cliquer ici pour télécharger ce fichier de codage.
Discussion
Décrit ici est un fluorimètre open-source, peu coûteux, modulaire, portable pour la détection quantitative de fluorescence des réactions d’amplification isotherme. Les projets open source facilitent une maintenance rapide et peu coûteuse avec des pièces de rechange facilement disponibles et offrent aux utilisateurs la flexibilité d’adapter le système à leurs besoins en fonction de la conception modulaire. Ce protocole décrit le processus d’assemblage de composants mécaniques, optiques et électriques, et de validation des performances optiques. En outre, la flexibilité du fluorimètre pour surveiller deux types différents d’essais d’amplification isotherme avec des exigences significativement différentes en matière de température, de volume et de fluorescence, RPA exo et RT-LAMP, a été démontrée. La RPA est réalisée à 39 °C dans des réactions de 50 μL qui utilisent une sonde marquée FAM spécifique à la séquence pour la génération de fluorescence, tandis que RT-LAMP est réalisée à 65 °C dans un volume de réaction de 25 μL et utilise un colorant intercalant pour signaler la présence de l’ADN amplifié. Étant donné que les mesures de fluorescence sont effectuées par le haut des tubes PCR avec des bouchons plats, le fluorimètre est capable de détecter la fluorescence à partir des deux volumes d’essai, et les besoins en chaleur ne sont limités que par le bloc thermique commercial choisi. En outre, l’intensité de fluorescence produite dans RT-LAMP est presque de l’ordre de grandeur supérieur à celle produite dans RPA, en raison des méthodes de génération de signaux de fluorescence basées sur le colorant par rapport à la sonde. Cependant, la plage dynamique du capteur optique choisi peut détecter et quantifier à la fois les signaux, et les algorithmes de soustraction de base tiennent compte de ces différences pour produire des lectures de fluorescence fiables.
Pour faciliter la diffusion de la technologie et minimiser les coûts d’entretien potentiels, une conception modulaire compatible avec les appareils de chauffage largement disponibles dans différents contextes a été utilisée. Dans le protocole actuel, un réchauffeur à bloc sec commun a été utilisé; la même conception optique et électrique peut être facilement adaptée à d’autres appareils de chauffage disponibles dans le commerce. Si un autre chauffe-bloc sec doit être utilisé, des changements minimes dans la conception du boîtier 3D seront nécessaires. Plus précisément, les chevilles inférieures des fichiers STL de l’enceinte optique doivent être modifiées pour assurer un alignement approprié avec les puits d’autres blocs thermiques commerciaux. Bien que les boîtiers présentés dans les exemples aient été imprimés sur une imprimante 3D relativement bas de gamme (voir la table des matériaux),il faut veiller à ce que la résolution de l’imprimante et/ou les tolérances d’impression soient adéquates pour accueillir les composants optiques et les inserts filetés. Dans les fichiers STL fournis, une tolérance de 0,01 à 0,02 pouce a été ajoutée de chaque côté des composants optiques dans les directions radiale et axiale en fonction des dimensions spécifiées par le fabricant. Cela garantit que tous les composants optiques s’intègrent bien dans l’impression et que le boîtier empêche complètement l’excès de lumière d’entrer ou de s’échapper. Pour assurer un ajustement approprié de la presse pour les inserts filetés, une tolérance similaire de 0,01 à 0,02 pouce a été soustraite du diamètre fourni par le fabricant dans le fichier CAO.
Les réactions RPA ont été surveillées avec succès à l’aide de la première configuration de fluorimètre, tandis que les réactions RT-LAMP ont pu être surveillées à l’aide de l’une ou l’autre configuration. Le rejet amélioré de la lumière parasite de la première configuration était nécessaire pour surveiller les niveaux bas de fluorescence produits par la sonde fluorogène dans des réactions de RPA. En revanche, RT-LAMP utilise un colorant intercalant pour la génération de signaux, ce qui entraîne une intensité de fluorescence plus élevée compatible avec la plage dynamique inférieure de la deuxième configuration utilisant des feuilles de filtre photographique. Les utilisateurs doivent sélectionner la configuration du fluorimètre qui correspond au colorant d’intercalation d’éléments générateurs de signaux de fluorescence ou à la sonde fluorogène de leur essai.
L’une des limites de ce système est que le chauffage est assuré par un bloc chauffant disponible dans le commerce alimenté par une prise murale standard. Ce système pourrait être développé pour être utilisé dans les zones dépourvues d’accès fiable à l’électricité en incorporant des blocs-batteries portables et rechargeables, comme le montrent d’autres groupes12. Une autre limitation est le débit relativement faible du système, qui permet de mesurer simultanément la fluorescence de seulement deux échantillons à la fois. Plusieurs impressions du boîtier peuvent être placées sur le même bloc thermique pour augmenter le débit; cependant, le capteur de lumière utilisé n’a que quatre adresses I2C uniques. Cela limite à quatre le nombre maximal d’échantillons pouvant être mesurés simultanément. Un capteur de lumière différent avec un plus grand nombre d’adresses I2C uniques est nécessaire pour augmenter encore le débit.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Un merci spécial à Chelsey Smith, Megan Chang, Emilie Newsham, Sai Paul et Christopher Goh pour leur aide dans la préparation des échantillons. Les auteurs remercient Caroline Noxon pour la révision du manuscrit. Le financement de ce travail a été fourni par le peuple américain par l’USAID par le biais d’une subvention de recherche IAVI CCID 9204 au titre du prix AID-OAA-A16-00032 entre l’IAVI et l’USAID.
matériels
| Name | Company | Catalog Number | Comments |
| 1/4-inch-long 4-40 threaded insert | McMaster-Carr | 90742A116 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 10v power supply | GlobTek, Inc. | WR9HU1800CCP-F(R6B) | AC/DC Wall Mount Adapter 10V 18W |
| 15 mm focal length lens | Thorlabs | LA 1074 | Two total are used for the fluorimeter. This lens is used to focus the LED illumination. |
| 1-inch-long 4-40 screws | McMaster-Carr | ||
| 20 mm focal length lens | Thorlabs | LA 1540 | Four total are used for the fluorimeter. |
| 2x WarmStart LAMP Master Mix | New England Biolabs, Inc | E1700 | Master mix was used to create the LAMP reactions shown in Figure 3C |
| 3.5” Touch Screen | Uctronics | BO10601 | |
| 3/16-inch-long 4-40 screw | McMaster-Carr | 90128A105 | |
| 3/16-inch-long 4-40 threaded insert | McMaster-Carr | 90742A115 | Used to secure the OPT3002 test board onto the 3D printed enclosure |
| 3/8-inch-long 4-40 screws | McMaster-Carr | 90128A108 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 3D printer filament | 3D Universe | UMNFC-PC285-BLACK | Black or another dark color preferred |
| 3D printer used | Ultimaker | Ultimaker 2+ | |
| 8-tube PCR strips | BioRad | #TLS0801 | |
| Advanced Mini Dry Block Heater | VWR International | 10153-320 | The following heat blocks are acceptable substitutes without the need for redesigning the optical assembly: 949VWMNLUS, 949VWMHLUS, and 949VWMHLEU |
| barrel jack to two-pin adapter | SparkFun Electronics | 1568-1238-ND | |
| Blue Excitation Filter Foil | LEE | LE071S | Selected for use with FITC - other fluorescent dyes may require different filters. |
| Blue LED - 460 nm | Mouser | LZ1-30DB00-0100 | Selected for use with FITC - other fluorescent dyes may require different parts |
| Dichroic Mirror | Thorlabs | DMLP505T | Selected for use with FITC - other fluorescent dyes may require different parts |
| Emission Filter | Edmunds Optics | OG-515 | Selected for use with FITC - other fluorescent dyes may require different parts. The arrow on the part points away from the illumination source. |
| Excitation Filter | Omega Filters | 490AESP | Selected for use with FITC - other fluorescent dyes may require different parts |
| LED Driver | LEDdynamics | 3021-D-I-700 | |
| M2.5 Hex Shaped insert | McMaster-Carr | 91292A009 | Used to secure the Raspberry Pi to the 3D printed LCD Screen Holder |
| Microcontroller | Arduino | Nano | |
| Mini Breadboard | Adafruit | 65 | |
| Molecular biology-grade mineral oil | Sigma Aldrich | 69794 | |
| OPT3002EVM - Light-to-Digital Sensor | Texas Instruments | OPT3002EVM: | Light-to-digital sensor used. Consists of two PCBs: a SM-USB_DIG board and the OPT3002 test board; only the OPT3002 test board is needed for this device. |
| Purchased oligonucleotides | Integrated DNA Technologies | ||
| RPA kit positive control DNA | TwistDx Limited | CONTROL01DNAE | |
| SARS-CoV-2 RNA Control | Twist Biosciences | MN908947.3 | |
| Single board computer | Raspberry Pi | Raspberry Pi 3 | |
| TwistAmp RPA exo kit | TwistDx Limited | TAEXO02KIT | |
| Ultraclear flat caps | BioRad | #TCS0803 | |
| Yellow Emmission Filter Foil | LEE | LE767S | Selected for use with FITC - other fluorescent dyes may require different parts |
Références
- Daher, R. K., Stewart, G., Boissinot, M., Bergeron, M. G. Recombinase polymerase amplification for diagnostic applications. Clinical Chemistry. 62 (7), 947-958 (2016).
- Yan, L., et al. Isothermal Amplified Detection of DNA and RNA. Molecular BioSystems. 10 (5), 970-1003 (2014).
- Giuffrida, M. C., Spoto, G. Integration of Isothermal Amplification Methods in Microfluidic Devices: Recent Advances. Biosensors and Bioelectronics. 90, 174-186 (2017).
- Gill, P., Ghaemi, A. Nucleic Acid Isothermal Amplification Technologies-A Review. Nucleosides, Nucleotides and Nucleic Acids. 27 (3), 224-243 (2008).
- Richards-Kortum, R., Oden, M. Devices for Low-Resource Health Care. Science. 342 (6162), 1055-1057 (2013).
- Katzmeier, F., et al. A Low-Cost Fluorescence Reader for in vitro Transcription and Nucleic Acid Detection with Cas13a. PLOS One. 14 (12), e0220091(2019).
- Safavieh, M., et al. Emerging Loop-Mediated Isothermal Amplification-Based Microchip and Microdevice Technologies for Nucleic Acid Detection. ACS Biomaterials Science and Engineering. 2 (3), 278-294 (2016).
- Monis, P. T., Giglio, S., Saint, C. P. Comparison of SYTO9 and SYBR Green I for Real-Time Polymerase Chain Reaction and Investigation of the Effect of Dye concentration on Amplifcation and DNA Melting Curve Analysis. Analytical Biochemistry. 340 (1), 24-34 (2005).
- Parra, S., et al. Development of Low-Cost Point-of-Care Technologies for Cervical Cancer Prevention Based on a Single-Board Computer. IEEE Journal of Translational Engineering in Health and Medicine. 8 (4300210), (2020).
- Zhang, Y., et al. Enhancing Colorimetric Loop-Mediated Isothermal Amplification Speed and Sensitivity with Guanidine Chloride. Biotechniques. 69 (3), 178-185 (2020).
- Rabe, B. A., Cepko, C. SARS-CoV-2 Detection Using an Isothermal Amplification Reaction and a Rapid, Inexpensive Protocol for Sample Inactivation and Purification. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24450-24458 (2020).
- Snodgrass, R., et al. A Portable Device for Nucleic Acid Quantification Powered by Sunlight, a Flame or Electricity. Nature Biomedical Engineering. 2 (9), 657-665 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon