Method Article
Open-Source-Miniaturfluorimeter zur Überwachung isothermer Nukleinsäureverstärkungsreaktionen in Echtzeit in ressourcenbegrenten Umgebungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Detaillierte Anweisungen werden bereitgestellt, um ein modulares Open-Source-Fluorimeter zu bauen, das mit vielen kostengünstigen Heizgeräten kompatibel ist, um eine quantitative isotherme Nukleinsäureamplifikation in Echtzeit durchzuführen.
Zusammenfassung
Herkömmliche Methoden zum Nachweis und zur Quantifizierung von Nukleinsäuren basieren auf der Polymerase-Kettenreaktion (PCR) und erfordern den Einsatz teurer Thermocycler mit integrierter Fluoreszenzdetektion von Ampliconen. Isotherme Nukleinsäure-Amplifikationstechnologien eliminieren die Notwendigkeit von thermischen Zyklen; Für quantitative Echtzeitergebnisse ist jedoch nach wie vor eine fluoreszenzbasierte Detektion von Produkten erforderlich. Mehrere tragbare isotherme Heizgeräte mit integrierter Fluoreszenzerkennung sind jetzt im Handel erhältlich; Die Kosten für diese Geräte sind jedoch nach wie vor ein erhebliches Hindernis für eine breite Akzeptanz in umgebungen mit begrenzten Ressourcen. Hier wird ein Protokoll für die Konstruktion und Montage eines modularen, kostengünstigen Fluorimeters beschrieben, das aus standardmäßigen Komponenten besteht. Das Fluorimeter ist in einem kompakten 3D-gedruckten Gehäuse untergebracht und so konzipiert, dass es auf einem handelsüblichen Wärmeblock mit einer PCR-Röhre platziert werden kann. Das hier beschriebene Fluorimeter wurde optimiert, um Fluoresceinisothiocyanat (FITC) -Farbstoff nachzuweisen, aber das System kann für die Verwendung mit Farbstoffen modifiziert werden, die üblicherweise als Reporter in Echtzeit-Nukleinsäureamplifikationsreaktionen verwendet werden. Die klinische Anwendbarkeit des Systems wird durch die Durchführung eines Echtzeit-Nukleinsäurenachweises mit zwei isothermen Amplifikationstechnologien nachgewiesen: Rekombinase-Polymerase-Amplifikation (RPA) zum Nachweis von Positivkontroll-DNA, die in einem kommerziellen Kit bereitgestellt wird, und Reverse-Transkriptionsschleifen-vermittelte isotherme Amplifikation (RT-LAMP) zum Nachweis klinisch bedeutsamer SARS-CoV-2-RNA-Spiegel.
Einleitung
Isotherme Amplifikationstechnologien werden häufig zum Nachweis von Nukleinsäuren eingesetzt. Im Vergleich zu herkömmlichen PCR-Ansätzen, die Thermocycling erfordern, ermöglicht die isotherme Amplifikation die Nukleinsäureamplifikation bei einer einzigen Temperatur, wodurch eine schnellere Zeit bis zu den Ergebnissen und eine bessere Toleranz der Inhibitoren1,2ermöglicht werden. Ein weiterer wesentlicher Vorteil der isothermen Verstärkung ist die reduzierte Komplexität der Instrumentierung. Die meisten isothermen Amplifikationsreaktionen erfordern nur einen Wärmeblock und eine Detektionsmodalität - entweder Echtzeitdetektion über Fluoreszenzüberwachung oder Endpunktdetektion, zum Beispiel durch Lateralfluss oder Gelelektrophorese3,4. Die Echtzeit-Fluoreszenzdetektion wird durch den Nachweis von Fluoreszenz erreicht, die durch die Interkalation von Farbstoffen erzeugt wird, die in Gegenwart von doppelsträngiger DNA oder abgeschreckten Fluoreszenzsonden aktiviert werden, die in Gegenwart spezifischer doppelsträngiger DNA-Sequenzen aktiviert werden.
Während kommerziell erhältliche isotherme Fluorimeter auf dem Tisch existieren, fehlt es vielen an Anpassungen für die Assay-Implementierung. Beispielsweise benötigen viele Geräte bestimmte oder vom Unternehmen bereitgestellte Verbrauchsmaterialien, empfehlen bevorzugte Anbieter oder verwenden proprietäre Software, um beworbene Ergebnisse zu erzielen. Die meisten dieser Systeme kosten über 5.000 USD, was ein erhebliches Hindernis für den weit verbreiteten Einsatz in ressourcenbegrenten Umgebungen darstellt. Darüber hinaus stehen Benutzer in ressourcenarmen Umgebungen vor der Herausforderung, Geräte zu warten, die für ressourcenreiche Umgebungen aufgrund rauer Umgebungsbedingungen, schwacher Lieferketten für Ersatzteile und spezialisierter Werkzeuge, die für Wartung und Reparatur erforderlich sind, ausgelegtsind 5. Um diesem Bedarf gerecht zu werden, wird hier das Design und die Montage eines modularen und kostengünstigen Fluorimeters beschrieben, das aus handelsüblichen Komponenten besteht, die in einem kompakten 3D-gedruckten Gehäuse (Abbildungen 1A-C) mit zwei optionalen Konfigurationen eingeschlossen sind. Die erste Konfiguration dieses Geräts verwendet handelsübliche Glasfilter und einen dichroitischen Spiegel, um überschüssiges Hintergrundlicht zu blockieren, und hat Gesamtkosten für die Montage von 830 USD. Während diese Filter häufig in fluoreszenzbasierten Bildgebungssystemen verwendet werden, wurde bereits gezeigt, dass der Ersatz teurer hochwertiger optischer Filterfolien den Nachweis von Nukleinsäure ermöglicht6. Die zweite Konfiguration des Fluorimeters enthält diese kostengünstigen Filter und ersetzt die dichroitischen Spiegel durch φ1/2 "-Strahlteiler, wodurch die Gesamtkosten des Systems von 830 usd auf 450 USD gesenkt werden.
Repräsentative Bilder der Baugruppe werden für die erste Konfiguration in Abbildung 1 und Abbildung 2gezeigt, aber analoge Bilder für die zweite Konfiguration finden Sie in Zusatzdatei 6. Um die Notwendigkeit einer speziellen optischen Ausrichtung zu vermeiden, verfügt das optische System über ausgewiesene Bereiche, in denen jede optische Komponente angeordnet werden kann, und kann mit einem relativ niedrigen 3D-Drucker hergestellt werden, was eine weit verbreitete Verwendung des Designs ermöglicht. Die einzigen Unterschiede in Konstruktion und Montage für die beiden Konfigurationen sind die für den 3D-Druck verwendeten Dateien und die optischen Komponenten, die im Gehäuse platziert sind. Die Außenmaße des 3D-gedruckten Gehäuses für beide Systeme sind gleich. Ein Kostenvergleich der beiden Systeme ist in Tabelle 1 dargestellt.
Wie in Abbildung 1Agezeigt, besteht das Fluorimeter zur Aufrechterhaltung eines kleinen Formfaktors aus Φ1/2" (~12,5 mm) Optiken, gekoppelt mit kompakter Beleuchtung und Detektion, die zur Messung des Signals durch die Oberseite der PCR-Röhre platziert werden. Das System in Abbildung 1 wurde entwickelt, um Farbstoffe mit Spitzenanregungs- und Emissionswellenlängen nahe 490 nm bzw. 525 nm nachzuweisen, einschließlich FITC und eng verwandter Farbstoffe wie SYBR und SYTO-9, die üblicherweise als Reporter in Echtzeit-Nukleinsäureverstärkungsreaktionen verwendet werden7,8. Die Anregungsquelle, die optischen Filter und der Detektor können leicht durch Komponenten ersetzt werden, die mit verschiedenen Fluoreszenzfarbstoffen kompatibel sind. Nukleinsäure-Amplifikationsreaktionen werden typischerweise in PCR-Röhrchen durchgeführt, und das Fluorimeter ist so konzipiert, dass es auf jedem kommerziell erhältlichen Wärmeblock platziert werden kann, der PCR-Röhrchen enthält(Abbildung 1D),was eine Echtzeitüberwachung isothermer Reaktionen ermöglicht. Entsprechende Wärmeblöcke sind in den meisten biomedizinischen Labors erhältlich und können für weniger als 500 USD erworben werden.
Die Verwendung von Einplatinencomputern zur Bereitstellung einer kostengünstigen Point-of-Care-Alternative zur Steuerung von Bildgebungstechnologien wurde bereits demonstriert9. Aufbauend auf dieser Arbeit wird in diesem Protokoll eine einplatinenbasierte computergestützte grafische Benutzeroberfläche (Abbildung 1D) verwendet, um die Echtzeit-Datenprotokollierung und -anzeige der Ergebnisse am Point of Care zu erleichtern, wodurch die Notwendigkeit für einen Laptop-Computer zur Verarbeitung oder Visualisierung von Daten entfällt. Fluoreszenzmessungen wurden über dasI2C-Protokoll von den Lichtsensoren auf einen Mikrocontroller übertragen und dann dem Einplatinencomputer durch serielle Kommunikation zur Verfügung gestellt. Elektrische Verbindungen für Beleuchtung und Datenübertragung wurden durch vereinfachte Verdrahtung und Löten auf miniaturisierten Steckplatinen bereitgestellt, wodurch die Notwendigkeit spezieller Leiterplatten (PCBs) entfiel. Die software, die zum Ausführen des Fluorimeters erforderlich ist, ist über Open-Source-Software-Frameworks verfügbar, und der zum Ausführen des Geräts erforderliche Code wird in den zusätzlichen Codierungsdateienbereitgestellt. Das komplette Fluorimeter kann für 450 bis 830 USD montiert werden, und die Ergebnisse zeigen, dass es genaue und zuverlässige Fluoreszenzmessungen zur Überwachung der isothermalen Amplifikation von Nukleinsäuren in Echtzeit liefert.
Protokoll
1. Vorbereitungsschritte: 3D-Druck und Löten
HINWEIS: Das in diesem Protokoll beschriebene optische System ist für eine Standard-Trockenblockheizung ausgelegt.
- Um die erste Konfiguration zu erstellen, drucken Sie die CAD-Dateien, die als Zusatzdateien 1, 2 und 3 bereitgestellt werden, in 3D:
- Um die zweite Konfiguration zu erstellen, drucken Sie die CAD-Dateien, die als Zusatzdateien 3, 4 und 5bereitgestellt werden, in 3D:
HINWEIS: Diese Teile sind so konzipiert, dass sie mit Stützen bedruckt werden können. In diesem Leitfaden wird ein schwarzes Polycarbonat-Filament verwendet, das seine Form nach Temperaturen von bis zu 110 °C beibehalten kann. Im Allgemeinen kann jedes Material verwendet werden, das ohne signifikante Verformung auf die Temperatur der gewünschten isothermen Reaktion erhitzt werden kann. Um die Auswirkungen von internen Reflexionen und Umgebungslichtinterferenzen zu minimieren, wird ein Material empfohlen, das schwarz oder eine andere dunkle Farbe ist. - Bereiten Sie die beiden Licht-Digital-Sensorauswertungsmodule für die parallele Überwachung von zwei Proben vor. Entfernen Sie auf einer der Sensortestplatinen den R4-Widerstand und löten Sie einen Jumperdraht vom rechten Pad des R4-Bereichs auf der Leiterplatte zum oberen Pad im R1-Bereich auf der Leiterplatte. Dadurch wird die I2C-Adresse des Sensors geändert, wodurch die gleichzeitige Messung beider Sensoren ermöglicht wird.
HINWEIS: Der verwendete Sensor besteht aus zwei Leiterplatten: einer USB-Adapterplatine und einer Sensortestplatine, die den Lichtsensor enthält; Für dieses Gerät wird nur die Sensortestplatine benötigt. - Lötdrähte zu jeder der beiden Leuchtdioden (LEDs). Verbinden Sie einen roten Draht (positiv) mit dem Pad mit der Bezeichnung "1" auf der LED und einen schwarzen Draht (negativ) auf dem Pad mit der Bezeichnung "2" auf der LED. Tragen Sie eine dünne Schicht Thermokleber auf die Rückseite der LED auf, legen Sie die LED auf die Oberseite einer Endkappe und warten Sie, bis der thermische Klebstoff aushärtet. Fügen Sie auf der anderen Seite der Endkappe einen Kühlkörper hinzu.
HINWEIS: Wenn Sie die LEDs testen, bevor sie im Gehäuse versiegelt werden, stellen Sie sicher, dass Sie einen geeigneten blauen Lichtschutz tragen, der die Augen blockiert. - Um die zweite Konfiguration zu erstellen, schneiden Sie zwei Kreise mit einem Durchmesser von 1/4 Zoll aus einer blauen Anregungsfolienfolie und vier Kreise mit einem Durchmesser von 1/4 Zoll aus einer gelben Emissionsfolienfolie mit einer Schere oder einer Rasierklinge.
- Drücken Sie einen M2.5-Sechskanteinsatz in jedes der vier Löcher auf dem schrägen Teil des Teils "LCD_Screen_Holder.stl".
2. Optische Montage
- Legen Sie einen 3/16 Zoll langen 4-40-Gewindeeinsatz in das Loch auf der Oberseite des Teils "Optics_Enclosure_Bottom.stl". Setzen Sie einen 1/4 Zoll langen 4-40-Gewindeeinsatz in alle anderen Löcher des 3D-gedruckten Teils ein, wie in Abbildung 2Adargestellt.
- Setzen Sie die Sensorprüfplatine in den oberen Hohlraum des Gehäuses ein, wobei die fünf Stifte nach oben und am nächsten zur Mittelachse des Geräts gerichtet sind. Mit einer 3/16 Zoll langen 4-40 Schraube durch das Loch auf der Sensorprüfplatine befestigen (Abbildung 2B).
- Platzieren Sie eines der Objektive mit einer Brennweite von 20 mm in dem Abschnitt unterhalb der Sensorprüfplatine mit der konvexen Seite zur Unterseite des Geräts und weg von der Testplatine (Abbildung 2C).
- Um die erste Konfiguration zu erstellen, platzieren Sie den Langpassfilter im nächsten Abschnitt unterhalb des 20-mm-Brennweitenobjektivs(Abbildung 2D),das im vorherigen Schritt platziert wurde. Um die zweite Konfiguration zu erstellen, legen Sie zwei gelbe Emissionsfilterfolien in den Abschnitt unterhalb der Linse.
- Um die erste Konfiguration zu erstellen, platzieren Sie den dichroitischen Spiegel in dem diagonalen Abschnitt in der Nähe der Mitte der Ummantelung, während Sie die vom Hersteller angegebene Filterorientierung beachten (Abbildung 2E). Um die zweite Konfiguration zu erstellen, platzieren Sie den Balkenteiler in den diagonalen Schnitt. Für den Strahlteiler ist keine spezifische Ausrichtung erforderlich.
- Legen Sie ein zweites Objektiv mit einer Brennweite von 20 mm in den Abschnitt unterhalb des dichroitischen Spiegels (oder Strahlteiler, je nach Konfiguration), wobei die konvexe Seite zur Oberseite des Geräts zeigt (Abbildung 2F).
- Um die erste Konfiguration zu erstellen, platzieren Sie den Anregungsfilter in dem Abschnitt rechts neben dem dichroitischen Spiegel und stellen Sie sicher, dass der Pfeil auf den dichroitischen Spiegel zeigt (Abbildung 2G). Um die zweite Konfiguration zu erstellen, legen Sie eine blaue Anregungsfilterfolie in den Abschnitt rechts neben dem Strahlteiler.
- Platzieren Sie das 15-mm-Brennweitenobjektiv rechts neben dem Anregungsfilter mit der konvexen Seite dem dichroitischen Spiegel zugewandt (Abbildung 2H).
- Setzen Sie eine LED in den verbleibenden Abschnitt des Drucks ein, wobei die LED zum dichroitischen Spiegel (oder Strahlteiler, je nach Konfiguration) zeigt. Stellen Sie sicher, dass die beiden Drähte, die von der LED führen, in die versenkten Kanäle eingeführt sind, damit der Druck fest schließt.
- Wiederholen Sie die Schritte 2.3 bis 2.9 für die andere Seite des 3D-gedruckten Teils (Abbildung 2I).
- Schließen Sie die leere Seite des Drucks oben auf dem Druck mit den optischen Komponenten, indem Sie die extrudierten Teile der oberen Hälfte der Ummantelung in die versenkten Rillen der unteren Hälfte der Ummantelung legen. Befestigen Sie die beiden gedruckten Teile zusammen mit 3/8 Zoll langen 4-40 Schrauben (Abbildung 2J).
HINWEIS: Wenn die beiden gedruckten Teile nicht vollständig geschlossen sind, kann Streuerregungslicht aus dem optischen Gehäuse entweichen. Stellen Sie sicher, dass der richtige blaue Licht blockierende Augenschutz getragen wird, bis eine ordnungsgemäße Abdichtung erreicht ist. Verschließen Sie das Gehäuse wieder, bis kein überschüssiges Licht austritt.
3. Elektronik und Touchscreen-Montage
- Verbinden Sie die beiden Mini-Steckplatinen miteinander, und legen Sie den Mikrocontroller dann auf eines der Steckbretter. Stellen Sie sicher, dass der microUSB-Port des Mikrocontrollers nach außen zeigt.
- Um die LED-Modulation anzuschließen, verbinden Sie den CTL-Pin des LED-Treibers (+) mit einem digitalen Pin des Mikrocontrollers und den LED-Pin (-) des LED-Treibers mit einem GND-Pin des Mikrocontrollers.
- Entfernen Sie die Kunststoffabdeckungen auf der Rückseite der Steckbretter. Drücken Sie die Kleberückseite der Steckbretter auf das 3D-gedruckte Teil, um die kombinierten Steckbretter an der Innenseite des hinteren Teils des gedruckten Teils "LCD_Screen_Holder.stl" zu befestigen.
- Befestigen Sie den LCD-Bildschirmhalter (Liquid Crystal Display) mit den montierten Steckplatinen im Inneren des optischen Gehäuses, das in Abschnitt 2 mit 4-40 Schrauben mit einem Zoll langen Schrauben montiert ist.
- Um das LED-Netzteil anzuschließen, schließen Sie den LED-Pin (+) des LED-Treibers an den positiven Draht der ersten LED an. Verbinden Sie den negativen Draht der ersten LED mit dem positiven Draht der zweiten LED auf der Steckplatine. Verbinden Sie den negativen Draht der zweiten LED mit dem LED-Pin (-) des LED-Treibers.
HINWEIS: Die Reihenfolge der ersten oder zweiten LED ist beliebig. - Um das LED-Treibernetzteil anzuschließen, schließen Sie die positiven und negativen Drähte des 10-V-Netzteils an die VIN+- bzw. VIN-Pins des LED-Treibers an. (Es wurde ein Zylinderbuchsen-auf-Zwei-Pin-Adapter verwendet.)
- Schließen Sie das Netzteil der Sensorprüfplatine und die Datenübertragung an. Es werden nur vier Pins auf der Sensortestplatine verwendet: SCK, SDA, VDUT und GND. Nehmen Sie ein 4-poliges Buchse-zu-Stecker-Jumper-Kabel und verbinden Sie diese Pins auf den Light-to-Digital-Sensor-Testplatinen über den Spalt oben rechts im LCD-Halterdruck mit dem Mini-Steckbrett.
- Stellen Sie auf der Steckplatine sicher, dass Verbindungen zwischen den folgenden Komponenten vorhanden sind: dem 3,3-V-Pin des Mikrocontrollers und dem VDUT-Pin beider Testplatinen; den GND-Pin des Mikrocontrollers und den GND-Pin beider Testplatinen; der analoge 4 (A4) Pin des Mikrocontrollers und der SDA-Pin beider Testplatinen; und der analoge 5 (A5) Pin des Mikrocontrollers und der SCK-Pin beider Testplatinen.
HINWEIS: Da für die Lichtsensoren die I2C-Kommunikation verwendet wird, können die SCK- und SDA-Pins beider Sensoren beide an die gleichen Pins des Mikrocontrollers geleitet werden. - Befestigen Sie den Einplatinencomputer mit vier M2,5-Schrauben auf dem LCD-Bildschirmhalter. Stellen Sie sicher, dass die HDMI- und Netzteilanschlüsse des Einplatinencomputers nach oben zeigen und der Einplatinencomputer auf dem 3D-gedruckten Teil zentriert ist.
- Schließen Sie das Touchscreen-Display gemäß den Touchscreen-Anweisungen an den Einplatinencomputer an, und schließen Sie dann den HDMI-Anschluss des Einplatinencomputers an den HDMI-Anschluss des Touchscreens an.
4. Software-Installation
- Installieren und verwenden Sie den Webeditor, um die benutzerdefinierte Skizze "MiniFluorimeter_2Diode.ino" in Supplemental Coding File 1 auf den Mikrocontroller hochzuladen. Stellen Sie sicher, dass die Bibliothek "ClosedCube OPT3002" mit dem Library Manager installiert ist.
- Ändern Sie die variable led_A_pin in die Nummer des digitalen Pins, der in Schritt 3.3 (Abschnitt Elektronik und Touchscreen-Montage) verwendet wird.
- Passen Sie die Anzahl der Millisekunden an, in denen die LED eingeschaltet ist, wenn Sie Fluoreszenzmessungen erfassen, indem Sie den Wert der variablen ExposureTime ändern. Passen Sie die Anzahl der Millisekunden zwischen led-Belichtungen an, indem Sie den Wert der variablen led_A_Interval ändern.
- Ändern Sie die variable led_Power auf eine Zahl zwischen Null und Eins, um die Helligkeit der LEDs während der Belichtung anzupassen. Null gibt die maximale Helligkeit und eins gibt die niedrigste Helligkeit an.
- Aktivieren Sie die Möglichkeit, das Display über einen Touchscreen zu steuern, indem Sie den Anweisungen des Herstellers folgen, die mit dem 3,5-Zoll-Display geliefert werden.
HINWEIS: Auf Wunsch kann der 3,5-Zoll-Bildschirm als Monitor ohne Touchscreen-Funktionen verwendet werden, und eine Tastatur und Maus können an die USB-Anschlüsse des Einplatinencomputers zur Steuerung des Einplatinencomputers angeschlossen werden. - Laden Sie die Datei "MiniFluorimeter_2Diode_GUI.py" aus Der Zusatzcodierungsdatei 2 an einen gewünschten Speicherort auf dem Einplatinencomputer herunter.
- Stellen Sie sicher, dass eine funktionierende Version von Python auf dem Einplatinencomputer installiert ist. Python 3.7 wurde im bereitgestellten Python-Modul verwendet, aber jede stabile Python-Version konnte mit entsprechenden Änderungen am bereitgestellten Skript verwendet werden. Installieren Sie die für das Python-Programm erforderlichen Bibliotheken auf dem Einplatinencomputer.
- Ändern Sie die Variable measurement_time auf die gewünschte Zeitspanndauer für Messungen. Das Programm beendet die Erfassung und schließt nach Ablauf der gewünschten Zeit. Die GUI ermöglicht auch das Ende der Erfassung über eine Schaltfläche auf der Benutzeroberfläche.
- Ändern Sie die Variable serialPort in die serielle Adresse des angeschlossenen Mikrocontrollers.
5. Aufzeichnung von Echtzeit-Fluoreszenzdaten
- Schalten Sie den kommerziellen Wärmeblock ein und lassen Sie ihn die gewünschte Temperatur erreichen.
- Versorgen Sie den Einplatinencomputer mit einem Standard-5-V-Netzteil, das bei den meisten Einplatinencomputerkäufen enthalten ist. Verbinden Sie den Einplatinencomputer mit einem microUSB-auf-USB-Kabel mit dem Mikrocontroller.
- Öffnen Sie über den Touchscreen das bereitgestellte Python-Skript. Ändern Sie die Variablen measurement_time und serialPort in die gewünschten Werte. Ändern Sie die Variable outputFilepath in den Namen der Datendatei, die das Programm generiert. Stellen Sie sicher, dass der Dateiname auf ".xlsx" endet.
- Legen Sie zwei PCR-Röhrchen mit den zu überwachenden Reaktionen in den Wärmeblock. Stellen Sie sicher, dass die Platzierung der PCR-Röhrchen mit den optischen Kanälen des Fluorimeters übereinstimmt, sobald es auf den Wärmeblock gelegt wird.
- Legen Sie das Fluorimeter auf den Wärmeblock, wobei die PCR-Röhrchen zwischen den vier Stiften zentriert sind, die aus jedem optischen Kanal des Fluorimeters extrudieren. Für optimale Messungen stellen Sie sicher, dass das 3D-gedruckte Fluorimeter sicher in den Vertiefungen des Wärmeblocks befestigt ist.
- Schließen Sie das Fluorimeter sicher an, stecken Sie das Netzteil für die LEDs ein.
- Verwenden Sie den Touchscreen, um das Python-Programm zu starten. Auf dem LCD-Bildschirm erscheint eine grafische Benutzeroberfläche (GUI), die die Echtzeitfluoreszenz misst.
- Beobachten Sie die Echtzeit-Fluoreszenzmessungen im Laufe der Zeit für beide PCR-Röhrchen, die dem Benutzer auf der GUI angezeigt werden.
- Nach Ablauf der vom Benutzer bestimmten Experimentierzeit hört die Erfassung auf. Zeigen Sie die Messungen in der Ausgabedatendatei an, die am benutzerdefinierten Speicherort gespeichert ist. Um die Messungen frühzeitig zu beenden, klicken Sie auf der Benutzeroberfläche auf die Schaltfläche "Erfassung stoppen".
Ergebnisse
Nach der Montage kann die Fluorimeterleistung durch Messung der Fluoreszenz aus einer Verdünnungsserie von FITC-Farbstoffen validiert werden. In Abbildung 3Asind Messungen von FITC-Farbstoff in Konzentrationen von 0, 20, 40, 60 und 80 pg/μL in 1x PBS auf beiden Kanälen der ersten Konfiguration des Fluorimeters dargestellt. Jede Probe wurde dreimal mit einer LED-Belichtung von 1,5 s in Abständen von 20 s gemessen. Beide Kanäle des Fluorimeters zeigen eine lineare Reaktion über den gewünschten Bereich.
Die klinische Anwendbarkeit des Fluorimeters wurde weiter demonstriert, indem das System zusammen mit einem kommerziell erhältlichen trockenen Wärmeblock verwendet wurde, um eine Amplifikation mit zwei isothermen Amplifikationstechnologien durchzuführen: RPA und RT-LAMP.
Abbildung 3B zeigt den baseline-subtrahierten Zeitverlauf der Fluoreszenz, gemessen während der 39 °C-Amplifikation von 50 μL Echtzeit-RPA-Positiv- und Negativkontrollreaktionen für Kit-Positivkontroll-DNA, die in einem kommerziellen Standard-Kit bereitgestellt und gemäß den Anweisungen des Herstellers vorbereitet wurde. RPA-Reaktionen, die eine relativ geringe Fluoreszenz erzeugen, wurden mit der ersten Konfiguration des Fluorimeters gemessen, die eine bessere Unterdrückung des Anregungslichts erreicht.
Abbildung 3C zeigt die Zeitverlaufsmessung eines benutzerdefinierten RT-LAMP-Assays bei 65 °C unter Verwendung der von Zhang et al 10 und Rabe undCepko 11beschriebenen Primersätze N2, E1 undAs1e. RT-LAMP-Reaktionen erzeugen eine größere Menge an Fluoreszenz und wurden mit der zweiten, kostengünstigeren Fluorimeterkonfiguration gemessen. Oligonukleotide wurden gekauft und in 2x TE-Puffer bei einer Konzentration von 1 mM resuspendiert. Forward Inner Primer (FIP) und Backward Inner Primer (BIP) Oligos wurden mit Hochleistungsflüssigkeitschromatographie-Reinigung bestellt. Jeder Primersatz (N2, E1 und As1e) wurde wie folgt kombiniert, um 1000 μL einer 25-fachen Mischung zu bilden: 40 μL FIP, 40 μL BIP, 5 μL F3, 5 μL B3, 10 μL LF, 10 μL LB und 890 μL 1x TE-Puffer. Um jede RT-LAMP-Reaktion zusammenzusetzen, wurde 1 μL jedes Primer-Sets zu 0,5 μL 50x Fluoreszenzfarbstoff und 12,5 μL 2x Master-Mix hinzugefügt und das Reaktionsvolumen mit nukleasefreiem Wasser gemäß Herstellerangaben auf 20 μL gebracht. Die SARS-CoV-2-RNA-Kontrolle wurde seriell in nukleasefreiem Wasser auf Konzentrationen von 10, 100 oder 1.000 Kopien pro μL verdünnt und 5 μL für ein Gesamtreaktionsvolumen von 25 μL zugegeben. Die in allen Experimenten verwendete No-Target-Kontrolle (NTC) war nukleasefreies Wasser. RT-LAMP-Reaktionen wurden mit 25 μL molekularbiologischem Mineralöl überlagert.
RPA- und RT-LAMP-Reaktionen wurden in zwei Vertiefungen eines 0,2 mL flachen 8-Rohr-PCR-Streifens montiert und mit ultraklaren Flachkappen verschlossen. Jede RPA- und RT-LAMP-Reaktion wurde in dreifacher Ausfertigung durchgeführt. In allen Tests quantifizierte das Mini-Fluorimeter erfolgreich den zeitlichen Anstieg der Fluoreszenzspiegel im Zusammenhang mit der DNA-Amplifikation.
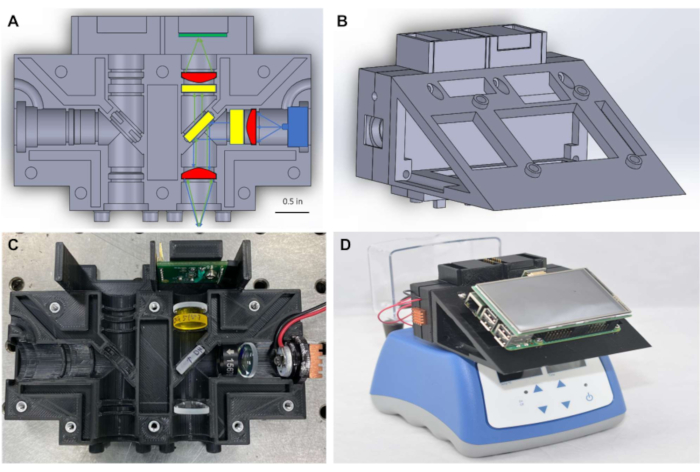
Abbildung 1: Optisches Gehäuse und montiertes Miniaturfluorimeter auf dem Wärmeblock. (A) Diagramm des optischen Gehäuses, das optische Komponenten zeigt, die in einem Detektionskanal platziert sind. (B) Diagramm der ersten Konfiguration des Miniaturfluorimeters nach der Montage. (C) Foto des optischen Gehäuses mit optischen Komponenten, die in einem Detektionskanal angeordnet sind. (D) Foto des montierten Miniaturfluorimeters, das auf einem handelsüblichen Wärmeblock platziert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
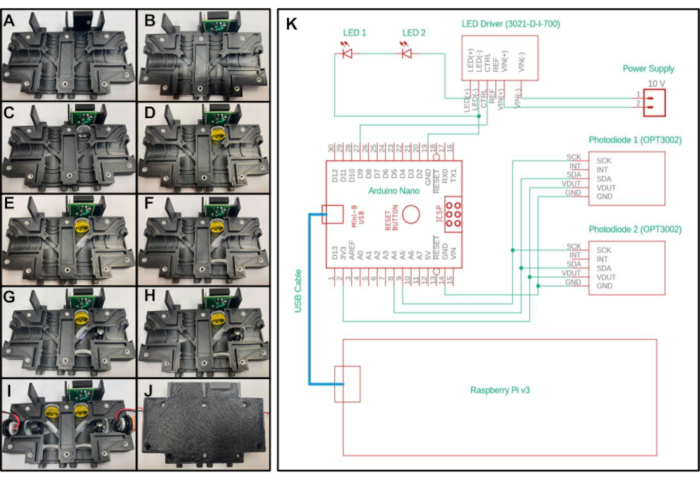
Abbildung 2: Montage- und elektrisches Steuerdiagramm des Miniaturfluorimeters. A-J) Schritt-für-Schritt-Platzierung der optischen Komponenten im 3D-gedruckten optischen Gehäuse für die erste Systemkonfiguration. (K) Elektrisches Diagramm des Miniaturfluorimeters für beide Konfigurationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
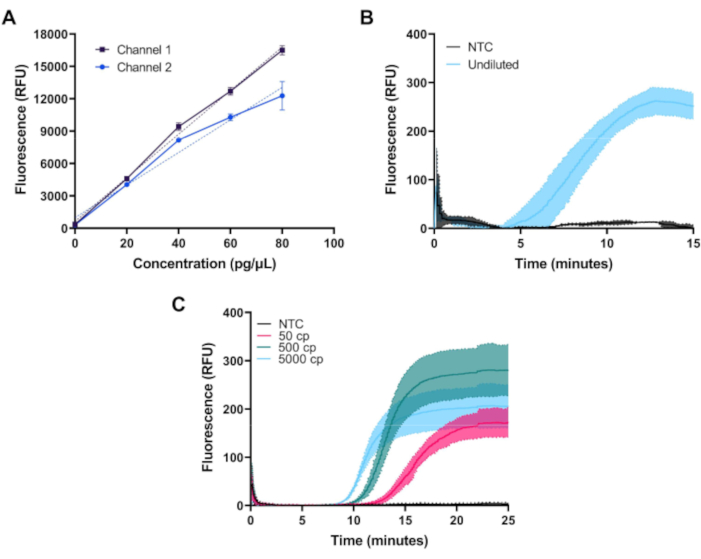
Abbildung 3: Repräsentative Messungen mit dem Miniaturfluorimeter. (A) Gemessene Fluoreszenz vs. FITC-Farbstoffkonzentration in beiden Kanälen zeigt eine lineare Reaktion über den gewünschten Dynamikbereich. (B) Echtzeitfluoreszenz vs. Zeit für die isotherme Verstärkung von Positiv- und Negativkontrollen eines handelsüblichen Kits. Die Verstärkung erfolgt wie für die Positivkontrolle erwartet. (C) Echtzeitfluoreszenz vs. Zeit für isotherme Amplifikation von 50, 500 und 5000 Kopien von SARS-CoV-2-RNA und einer NTC-Probe aus einem benutzerdefinierten RT-LAMP-Assay. Die Amplifikation erfolgt erwartungsgemäß nahe der Nachweisgrenze des Assays. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| System 1 | System 2 | |||
| Artikel | Menge | Gesamtpreis (USD) | Menge | Gesamtpreis (USD) |
| Optische Komponenten | ||||
| Linsen | 6 | 158.14 | 6 | 158.14 |
| Spiegel | 2 | 244.56 | 2 | 60 |
| Optische Filter | 4 | 200 | 6 | 5 |
| Zwischensumme | 602.7 | Zwischensumme | 223.14 | |
| Beleuchtung und Detektion | ||||
| Leds | 2 | 72.62 | 2 | 72.62 |
| LED-Treiber | 1 | 11.49 | 1 | 11.49 |
| Fotodiode | 2 | 50 | 2 | 50 |
| Zwischensumme | 134.11 | Zwischensumme | 134.11 | |
| Elektronik und Display | ||||
| Arduino Nano | 1 | 20.7 | 1 | 20.7 |
| Raspberry Pi | 1 | 35 | 1 | 35 |
| LCD-Bildschirm | 1 | 25 | 1 | 25 |
| Mini-Steckbrett | 1 | 4 | 1 | 4 |
| 10V Netzteil | 1 | 8.6 | 1 | 8.6 |
| Zwischensumme | 93.3 | Zwischensumme | 93.3 | |
| Gesamtkosten (USD) | 830.11 | 450.55 | ||
Tabelle 1: Kostenvergleich der beiden Konfigurationen des Miniaturfluorimeters.
Zusatzdatei 1: System1_Optics_Enclosure_Top.stl Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: System1_Optics_Enclosure_Bottom.stl, und Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatzdatei 3: LCD_Screen_Holder.stl Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatzdatei 4: System2_Optics_Enclosure_Top.stl Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 5: System2_Optics_Enclosure_Bottom.stl, und Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatzdatei 6: System2_BuildInstructions.pdf Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 1: MiniFluorimeter_2Diode.ino Bitte klicken Sie hier, um diese Codierungsdatei herunterzuladen.
Ergänzende Codierungsdatei 2: MiniFluorimeter_2Diode_GUI.py Bitte klicken Sie hier, um diese Codierungsdatei herunterzuladen.
Diskussion
Hier wird ein kostengünstiges, modulares, tragbares Open-Source-Fluorimeter zur quantitativen Fluoreszenzdetektion isothermer Amplifikationsreaktionen beschrieben. Open-Source-Projekte ermöglichen eine schnelle und kostengünstige Wartung mit leicht verfügbaren Ersatzteilen und ermöglichen Anwendern die Flexibilität, das System modular aufgebaut an ihre Bedürfnisse anzupassen. Dieses Protokoll beschreibt den Prozess der Montage mechanischer, optischer und elektrischer Komponenten und der Validierung der optischen Leistung. Darüber hinaus wurde die Flexibilität des Fluorimeters zur Überwachung von zwei verschiedenen Arten von isothermen Amplifikationsassays mit signifikant unterschiedlichen Temperatur-, Volumen- und Fluoreszenzanforderungen, RPA exo und RT-LAMP, demonstriert. RPA wird bei 39 °C in 50 μL-Reaktionen durchgeführt, die eine sequenzspezifische FAM-markierte Sonde zur Fluoreszenzerzeugung verwenden, während RT-LAMP bei 65 °C in einem Reaktionsvolumen von 25 μL durchgeführt wird und einen interkalierenden Farbstoff verwendet, um das Vorhandensein der amplifizierten DNA zu melden. Da Fluoreszenzmessungen durch die Oberseite von PCR-Röhrchen mit flachen Kappen durchgeführt werden, ist das Fluorimeter in der Lage, Fluoreszenz aus beiden Assay-Volumina zu detektieren, und der Wärmebedarf ist nur durch den gewählten kommerziellen Wärmeblock begrenzt. Darüber hinaus ist die in RT-LAMP erzeugte Fluoreszenzintensität aufgrund der farbstoff- versus sondenbasierten Methoden der Fluoreszenzsignalerzeugung fast um eine Größenordnung größer als die in RPA erzeugte. Der Dynamikbereich des gewählten optischen Sensors kann jedoch sowohl die Signale erkennen als auch quantifizieren, und Die Subtraktionsalgorithmen der Baseline berücksichtigen diese Unterschiede, um zuverlässige Fluoreszenzwerte zu erzeugen.
Um die Verbreitung der Technologie zu erleichtern und potenzielle Wartungskosten zu minimieren, wurde ein modulares Design verwendet, das mit Heizungen kompatibel ist, die in verschiedenen Umgebungen weit verbreitet sind. Im aktuellen Protokoll wurde eine übliche Trockenblockheizung verwendet; das gleiche optische und elektrische Design kann leicht für andere handelsübliche Heizungen angepasst werden. Soll eine weitere Trockenblockheizung verwendet werden, sind minimale Änderungen an der 3D-Gehäusekonstruktion erforderlich. Insbesondere müssen die unteren Stifte der STL-Dateien des optischen Gehäuses modifiziert werden, um eine ordnungsgemäße Ausrichtung mit den Vertiefungen anderer kommerzieller Wärmeblöcke zu gewährleisten. Während die in den Beispielen gezeigten Gehäuse auf einem relativ low-end 3D-Drucker gedruckt wurden (siehe Materialtabelle),sollte darauf geachtet werden, dass die Druckerauflösung und/oder die Drucktoleranzen ausreichend sind, um die optischen Komponenten und Gewindeeinsätze aufzunehmen. In den bereitgestellten STL-Dateien wurde eine Toleranz von 0,01-0,02 Zoll auf beiden Seiten der optischen Komponenten in radialer und axialer Richtung basierend auf den vom Hersteller angegebenen Abmessungen hinzugefügt. Dadurch wird sichergestellt, dass alle optischen Komponenten sicher in den Druck passen und dass das Gehäuse das Eindringen oder Entweichen von überschüssigem Licht vollständig verhindert. Um eine korrekte Presspassung für die Gewindeeinsätze zu gewährleisten, wurde eine ähnliche Toleranz von 0,01-0,02 Zoll vom herstellerspezifischen Durchmesser in der CAD-Datei abgezogen.
RPA-Reaktionen wurden mit der ersten Fluorimeterkonfiguration erfolgreich überwacht, während RT-LAMP-Reaktionen mit beiden Konfigurationen überwacht werden konnten. Die verbesserte Streulichtunterdrückung der ersten Konfiguration war notwendig, um die geringe Fluoreszenz zu überwachen, die von der fluorogenen Sonde bei RPA-Reaktionen erzeugt wurde. Im Gegensatz dazu verwendet RT-LAMP einen interkalierenden Farbstoff zur Signalerzeugung, was zu einer höheren Fluoreszenzintensität führt, die mit dem niedrigeren Dynamikbereich der zweiten Konfiguration mit fotografischen Filterfolien kompatibel ist. Benutzer sollten die Fluorimeterkonfiguration auswählen, die dem Fluoreszenzsignal entspricht, das elementinterkalierenden Farbstoff oder die fluorogene Sonde ihres Assays erzeugt.
Eine Einschränkung dieses Systems besteht darin, dass die Heizung durch einen handelsüblichen Wärmeblock erfolgt, der über eine Standard-Wandsteckdose gespeist wird. Dieses System könnte für den Einsatz in Gebieten ohne zuverlässigen Zugang zu Elektrizität weiterentwickelt werden, indem tragbare und wiederaufladbare Batteriepacks integriert werden, wie von anderen Gruppengezeigt 12gezeigt. Eine weitere Einschränkung ist der relativ geringe Durchsatz des Systems, der eine gleichzeitige Fluoreszenzmessung von nur zwei Proben gleichzeitig ermöglicht. Mehrere Drucke des Gehäuses können auf demselben Wärmeblock platziert werden, um den Durchsatz zu erhöhen. Der verwendete Lichtsensor hat jedoch nur vier eindeutige I2C-Adressen. Dadurch wird die maximale Anzahl der Proben, die gleichzeitig gemessen werden können, auf vier begrenzt. Ein anderer Lichtsensor mit einer größeren Anzahl eindeutiger I2C-Adressen wird benötigt, um den Durchsatz weiter zu erhöhen.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Besonderer Dank geht an Chelsey Smith, Megan Chang, Emilie Newsham, Sai Paul und Christopher Goh für ihre Unterstützung bei der Probenvorbereitung. Die Autoren danken Caroline Noxon für die Manuskriptrevision. Die Finanzierung dieser Arbeit wurde vom amerikanischen Volk von USAID durch einen IAVI-Forschungsstipendium CCID 9204 unter der Auszeichnung AID-OAA-A16-00032 zwischen IAVI und USAID zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1/4-inch-long 4-40 threaded insert | McMaster-Carr | 90742A116 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 10v power supply | GlobTek, Inc. | WR9HU1800CCP-F(R6B) | AC/DC Wall Mount Adapter 10V 18W |
| 15 mm focal length lens | Thorlabs | LA 1074 | Two total are used for the fluorimeter. This lens is used to focus the LED illumination. |
| 1-inch-long 4-40 screws | McMaster-Carr | ||
| 20 mm focal length lens | Thorlabs | LA 1540 | Four total are used for the fluorimeter. |
| 2x WarmStart LAMP Master Mix | New England Biolabs, Inc | E1700 | Master mix was used to create the LAMP reactions shown in Figure 3C |
| 3.5” Touch Screen | Uctronics | BO10601 | |
| 3/16-inch-long 4-40 screw | McMaster-Carr | 90128A105 | |
| 3/16-inch-long 4-40 threaded insert | McMaster-Carr | 90742A115 | Used to secure the OPT3002 test board onto the 3D printed enclosure |
| 3/8-inch-long 4-40 screws | McMaster-Carr | 90128A108 | Used to secure the two sides of the 3D printed optical enclosure together. |
| 3D printer filament | 3D Universe | UMNFC-PC285-BLACK | Black or another dark color preferred |
| 3D printer used | Ultimaker | Ultimaker 2+ | |
| 8-tube PCR strips | BioRad | #TLS0801 | |
| Advanced Mini Dry Block Heater | VWR International | 10153-320 | The following heat blocks are acceptable substitutes without the need for redesigning the optical assembly: 949VWMNLUS, 949VWMHLUS, and 949VWMHLEU |
| barrel jack to two-pin adapter | SparkFun Electronics | 1568-1238-ND | |
| Blue Excitation Filter Foil | LEE | LE071S | Selected for use with FITC - other fluorescent dyes may require different filters. |
| Blue LED - 460 nm | Mouser | LZ1-30DB00-0100 | Selected for use with FITC - other fluorescent dyes may require different parts |
| Dichroic Mirror | Thorlabs | DMLP505T | Selected for use with FITC - other fluorescent dyes may require different parts |
| Emission Filter | Edmunds Optics | OG-515 | Selected for use with FITC - other fluorescent dyes may require different parts. The arrow on the part points away from the illumination source. |
| Excitation Filter | Omega Filters | 490AESP | Selected for use with FITC - other fluorescent dyes may require different parts |
| LED Driver | LEDdynamics | 3021-D-I-700 | |
| M2.5 Hex Shaped insert | McMaster-Carr | 91292A009 | Used to secure the Raspberry Pi to the 3D printed LCD Screen Holder |
| Microcontroller | Arduino | Nano | |
| Mini Breadboard | Adafruit | 65 | |
| Molecular biology-grade mineral oil | Sigma Aldrich | 69794 | |
| OPT3002EVM - Light-to-Digital Sensor | Texas Instruments | OPT3002EVM: | Light-to-digital sensor used. Consists of two PCBs: a SM-USB_DIG board and the OPT3002 test board; only the OPT3002 test board is needed for this device. |
| Purchased oligonucleotides | Integrated DNA Technologies | ||
| RPA kit positive control DNA | TwistDx Limited | CONTROL01DNAE | |
| SARS-CoV-2 RNA Control | Twist Biosciences | MN908947.3 | |
| Single board computer | Raspberry Pi | Raspberry Pi 3 | |
| TwistAmp RPA exo kit | TwistDx Limited | TAEXO02KIT | |
| Ultraclear flat caps | BioRad | #TCS0803 | |
| Yellow Emmission Filter Foil | LEE | LE767S | Selected for use with FITC - other fluorescent dyes may require different parts |
Referenzen
- Daher, R. K., Stewart, G., Boissinot, M., Bergeron, M. G. Recombinase polymerase amplification for diagnostic applications. Clinical Chemistry. 62 (7), 947-958 (2016).
- Yan, L., et al. Isothermal Amplified Detection of DNA and RNA. Molecular BioSystems. 10 (5), 970-1003 (2014).
- Giuffrida, M. C., Spoto, G. Integration of Isothermal Amplification Methods in Microfluidic Devices: Recent Advances. Biosensors and Bioelectronics. 90, 174-186 (2017).
- Gill, P., Ghaemi, A. Nucleic Acid Isothermal Amplification Technologies-A Review. Nucleosides, Nucleotides and Nucleic Acids. 27 (3), 224-243 (2008).
- Richards-Kortum, R., Oden, M. Devices for Low-Resource Health Care. Science. 342 (6162), 1055-1057 (2013).
- Katzmeier, F., et al. A Low-Cost Fluorescence Reader for in vitro Transcription and Nucleic Acid Detection with Cas13a. PLOS One. 14 (12), e0220091(2019).
- Safavieh, M., et al. Emerging Loop-Mediated Isothermal Amplification-Based Microchip and Microdevice Technologies for Nucleic Acid Detection. ACS Biomaterials Science and Engineering. 2 (3), 278-294 (2016).
- Monis, P. T., Giglio, S., Saint, C. P. Comparison of SYTO9 and SYBR Green I for Real-Time Polymerase Chain Reaction and Investigation of the Effect of Dye concentration on Amplifcation and DNA Melting Curve Analysis. Analytical Biochemistry. 340 (1), 24-34 (2005).
- Parra, S., et al. Development of Low-Cost Point-of-Care Technologies for Cervical Cancer Prevention Based on a Single-Board Computer. IEEE Journal of Translational Engineering in Health and Medicine. 8 (4300210), (2020).
- Zhang, Y., et al. Enhancing Colorimetric Loop-Mediated Isothermal Amplification Speed and Sensitivity with Guanidine Chloride. Biotechniques. 69 (3), 178-185 (2020).
- Rabe, B. A., Cepko, C. SARS-CoV-2 Detection Using an Isothermal Amplification Reaction and a Rapid, Inexpensive Protocol for Sample Inactivation and Purification. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24450-24458 (2020).
- Snodgrass, R., et al. A Portable Device for Nucleic Acid Quantification Powered by Sunlight, a Flame or Electricity. Nature Biomedical Engineering. 2 (9), 657-665 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten