Method Article
Microscopía multifotónica intravital en tiempo real para visualizar ultrasonido enfocado y tratamientos de microburbujas para aumentar la permeabilidad de la barrera hematoencefálica
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe los procedimientos quirúrgicos y técnicos que permiten imágenes de fluorescencia multifotónica in vivo en tiempo real del cerebro del roedor durante los tratamientos de ultrasonido enfocado y microburbujas para aumentar la permeabilidad de la barrera hematoencefálica.
Resumen
La barrera hematoencefálica (BBB) es un desafío clave para la administración exitosa de medicamentos al cerebro. La exposición al ultrasonido en presencia de microburbujas ha surgido como un método eficaz para aumentar transitoria y localmente la permeabilidad del BBB, facilitando el transporte paracelular y transcelular de fármacos a través del BBB. Las imágenes de la vasculatura durante el tratamiento de ultrasonido-microburbuja proporcionarán información valiosa y novedosa sobre los mecanismos y la dinámica de los tratamientos de ultrasonido-microburbuja en el cerebro.
Aquí, presentamos un procedimiento experimental para la microscopía multifotónica intravital utilizando una ventana craneal alineada con un transductor de anillo y una lente de objetivo 20x. Esta configuración permite imágenes de alta resolución espacial y temporal del cerebro durante los tratamientos de microburbujas de ultrasonido. El acceso óptico al cerebro se obtiene a través de una ventana craneal de cráneo abierto. Brevemente, se extrae una pieza del cráneo de 3-4 mm de diámetro y se sella el área expuesta del cerebro con una funda de vidrio. Un transductor de anillo de 0,82 MHz, que está unido a una segunda cubierta de vidrio, está montado en la parte superior. La agarosa (1% p/v) se utiliza entre la cubierta del transductor y la cubierta que cubre la ventana craneal para evitar burbujas de aire, que impiden la propagación del ultrasonido. Cuando se toman procedimientos de cirugía estéril y medidas antiinflamatorias, los tratamientos de microburbujas de ultrasonido y las sesiones de imágenes se pueden realizar repetidamente durante varias semanas. Los conjugados de dextrano fluorescente se inyectan por vía intravenosa para visualizar la vasculatura y cuantificar los efectos inducidos por ultrasonido-microburbuja (por ejemplo, cinética de fugas, cambios vasculares). Este documento describe la colocación de la ventana craneal, la colocación del transductor de anillo, el procedimiento de imágenes, los pasos comunes de solución de problemas, así como las ventajas y limitaciones del método.
Introducción
Un desafío clave para tratar los trastornos neurológicos es la presencia de la barrera hematoencefálica (BBB). El BBB limita la entrada de moléculas hidrofílicas, cargadas, polares y grandes (> 400 Da) al parénquima cerebral1. Un método utilizado actualmente para administrar terapias a través de la BBB en el parénquima cerebral es el uso de inyecciones intracraneales estereotácticas2. Otros métodos menos invasivos en investigación se ven obstaculizados por la complejidad de las técnicas utilizadas, como el diseño de fármacos para la administración mediada por receptores a través de la BBB3, o están limitados en la precisión espacial de áreas objetivo, como las inyecciones intranasales4 o la administración de soluciones hiperosmóticas5.
El uso de ultrasonido junto con microburbujas inyectadas sistémicamente, un agente de contraste de ultrasonido, se ha desarrollado como un medio no invasivo para aumentar transitoriamente la permeabilidad del BBB6. Mediante el uso de un transductor enfocado7 o una matriz de transductores en fase orientables8,9, el ultrasonido se puede dirigir a áreas seleccionadas del cerebro con precisión de nivel milimétrico, minimizando los efectos fuera del objetivo. Los tratamientos de ultrasonido-microburbuja se pueden personalizar para la anatomía cerebral de cada sujeto mediante el uso de la guía de imágenes por resonancia magnética7,10,11,12,13,14 o marcos estereotácticos15. Además, el grado de aumento de la permeabilidad al BBB se puede controlar en tiempo real mediante el seguimiento de las emisiones acústicas de las microburbujas16,17,18. Los ensayos clínicos que investigan la seguridad y la viabilidad de los tratamientos con microburbujas de ultrasonido están actualmente en curso en todo el mundo (por ejemplo, ClinicalTrials.gov identificador NCT04118764).
Los tratamientos de BBB por ultrasonido y microburbuja generalmente se evalúan confirmando aumentos inducidos por el tratamiento en la permeabilidad de BBB, visualizados en imágenes de resonancia magnética mejoradas con contraste, o mediante extravasación de tinte en imágenes in vivo o histología ex vivo. Sin embargo, la mayoría de los análisis microscópicos se han realizado ex vivo, tras la finalización de los tratamientos de ultrasonido-microburbuja1,19, por lo que se pierden las respuestas biológicas dinámicas durante e inmediatamente después de la exposición a la ecografía. Las imágenes en tiempo real realizadas durante la exposición al ultrasonido pueden ayudar a comprender los mecanismos que impulsan los tratamientos de BBB de microburbujas de ultrasonido, así como las respuestas posteriores, lo que puede aumentar nuestra comprensión de sus aplicaciones terapéuticas. Además, el uso de ventanas craneales crónicas con técnicas de imagen in vivo permitiría a los estudios longitudinales evaluar aspectos temporales de los tratamientos de ultrasonido-microburbuja.
El objetivo de este protocolo es describir los procedimientos quirúrgicos y técnicos necesarios para realizar imágenes multifotónicas en tiempo real de tratamientos de ultrasonido-microburbuja para estudios agudos y crónicos en roedores (Figura 1). Esto se logra en dos partes: primero, para crear una ventana craneal para permitir imágenes in vivo, y segundo, para montar un transductor de anillo en la parte superior para permitir la sonicación y la imagen concurrentes. Las ventanas craneales han sido ampliamente utilizadas por neurocientíficos para la obtención de imágenes in vivo de acoplamiento neurovascular20, patogénesis β-amiloide21 y neuroinmunología22, entre otras. En este protocolo, se describen procedimientos quirúrgicos para crear ventanas craneales agudas (no recuperación) y crónicas (recuperación) en el cráneo del ratón y la rata. Las metodologías de ventana craneal, particularmente para experimentos crónicos, han sido bien documentadas23,24,25. Para ser coherente con la literatura existente, los términos "agudo" y "crónico" se utilizarán a lo largo de este protocolo. También se ha descrito previamente el diseño de transductores de anillo para imágenes in vivo26. A pesar de la disponibilidad de estas técnicas y los conocimientos que se pueden obtener de las imágenes en tiempo real de los tratamientos de microburbujas de ultrasonido, hay muy pocos laboratorios de investigación que hayan publicado con éxito literatura que utilice esta técnica26,27,28,29,30,31,32 . Como tal, en este protocolo, se describen los detalles quirúrgicos y técnicos de la realización de estos experimentos de microburbujas de ultrasonido en tiempo real. Si bien los parámetros de sonicación e imagen especificados se han optimizado para experimentos de BBB, también se pueden investigar otros efectos de la exposición ecográfica al cerebro, como la neuromodulación33,34, la monitorización de la placa β-amiloide31 y las respuestas de las células inmunes32, utilizando esta técnica.
Protocolo
Todos los siguientes procedimientos experimentales fueron aprobados y llevados a cabo de acuerdo con la Autoridad Noruega de Alimentos y Seguridad, el Comité de Cuidado Animal del Instituto de Investigación Sunnybrook y el Consejo Canadiense de Cuidado Animal.
1. Preparación del material
- Preparar los materiales necesarios para la cirugía de ventana craneal y los tratamientos de ultrasonido-microburbuja. Para las ventanas craneales crónicas, son necesarias herramientas y materiales esterilizados, un espacio quirúrgico estéril y la administración de medicamentos antes y después de la cirugía23,24,25.
- Preparación de transductores y cubiertas
- Compruebe la integridad física del transductor: busque grietas y abolladuras. Asegúrese de que los electrodos en la parte superior y lateral del transductor estén intactos.
- Deposite pegamento de cianoacrilato en un plato pequeño. Use un aplicador para extender una capa delgada de pegamento sobre la superficie del transductor.
- Coloque el transductor sobre la cubierta de vidrio. Presione firmemente hacia abajo durante 20-30 s.
NOTA: Se puede utilizar un molde impreso en 3D para facilitar la alineación de la cubierta de vidrio con el transductor de anillo, asegurando una presión firme y uniforme sobre la cubierta y el transductor de anillo (Figura 2). - Compruebe si hay burbujas entre el transductor y la cubierta. Si hay burbujas, retire el deslizamiento de la cubierta y repita el paso 1.2.3., ya que el aire impide la propagación del ultrasonido. Curar durante la noche a temperatura ambiente.
- Una vez adherido a una funda de vidrio, haga coincidir el transductor (Figura 3).
NOTA: Este protocolo utiliza un transductor de anillo de titanato de circonato de plomo fabricado internamente (diámetro exterior de 10 mm, espesor de 1,4 mm, altura de 1,2 mm)35, emparejado con una impedancia de 50 Ω y una carga de fase de 0 ° con un circuito de coincidencia personalizado. El transductor se acciona a 0,82 MHz en modo de espesor, produciendo un punto focal circular de aproximadamente 1 mm debajo de la cubierta. Se han caracterizado transductores de anillo de propiedades similares (10 mm de diámetro exterior, 1,5 mm de espesor, 1,1 mm de altura)26 y se han utilizado ampliamente para experimentos de microscopía multifotónica27,28,29,31,32,36.
- Reutilización del transductor y sustitución de la cubiertas
- Reemplace el cubrecosta si está agrietado o tiene escombros (por ejemplo, piel, pegamento) del experimento anterior. Para eliminar el coverslip, disuelva el pegamento sumergiendo el transductor y el coverslip en acetona durante 20 min.
NOTA: La acetona puede afectar la integridad del transductor y/o los electrodos. Consulte con el fabricante antes de continuar con este paso. - Compruebe si la acetona ha disuelto el pegamento tirando suavemente de la cubierta con fórceps. Verifique una vez cada 10 minutos para evitar la exposición prolongada a la acetona.
- Reemplace el cubrecosta si está agrietado o tiene escombros (por ejemplo, piel, pegamento) del experimento anterior. Para eliminar el coverslip, disuelva el pegamento sumergiendo el transductor y el coverslip en acetona durante 20 min.
2. Preparación animal
- Anestesiar al animal mediante el uso de una mezcla de aire medicinal, oxígeno e isoflurano en una cámara de inducción.
NOTA: Se ha reportado que el uso de oxígeno como gas portador afecta la vida media de las microburbujas37,38 y disminuye la magnitud de los aumentos inducidos por ultrasonido-microburbuja en la permeabilidad de BBB27, pero también puede reducir el riesgo de hipoxia y mortalidad39. Elija gases portadores en función de los objetivos del proyecto y el asesoramiento veterinario. También se pueden usar anestésicos inyectables como un cóctel de ketamina/xilazina; sin embargo, es más fácil controlar el plano de la anestesia y los niveles de oxígeno en la sangre cuando se usan anestésicos inhalables. - Comprobar que el animal ha conseguido un plano suficiente de anestesia mediante la realización de un pellizco en el dedo del pie. Pesar el animal para determinar la dosis de dextrano, microburbujas y medicamentos a administrar. Retire el pelaje de la cabeza del animal y colóquelo en un marco estereotáctico.
- Para experimentos agudos, se debe establecer el acceso a la circulación sistémica para las inyecciones de dextrano y microburbujas. Para lograr esto, inserte un catéter de 27 g en una vena de la cola.
NOTA: Si bien las inyecciones retroorbitales también son posibles, se recomiendan las venas de la cola debido al espacio de trabajo limitado en el área de la cabeza durante las imágenes multifotónicas. - Transfiera el animal al marco estereotáctico y cambie la anestesia al cono de la nariz. Mantenga la temperatura central del animal de 37 ° C utilizando una fuente de calor, como una almohadilla térmica o un guante lleno de agua tibia.
- Controle la temperatura animal mediante el uso de una sonda rectal y la fisiología animal mediante el uso de un oxímetro de pulso. Aplicar ungüento oftálmico. Inyectar analgésicos y/o antiinflamatorios apropiados antes de la cirugía (ver Tabla de Materiales).
- Antes de comenzar la cirugía de ventana craneal, verifique el plano de anestesia y la frecuencia cardíaca del animal, la saturación de O2 , la frecuencia respiratoria y la temperatura.
- Para comenzar la cirugía de la ventana craneal, retire el pelaje de la cabeza aplicando una crema depilatoria y / o usando cortacéspedes. Retire el pelaje de entre los ojos hasta la mitad anterior del cuello (Figura 4A).
NOTA: El contacto prolongado con la crema depilatoria quemará la piel. Para cirugías crónicas de ventanas craneales, lave el cuero cabelludo con toallitas alternas de betadina y 70% de EtOH después de la eliminación de la piel. Preparar el espacio quirúrgico para la cirugía estéril. La esterilidad debe mantenerse hasta el paso 2.15. - Para eliminar el cuero cabelludo, levante la piel entre los ojos con fórceps sostenidos en la mano no dominante, a lo largo de la sutura sagital. Usando tijeras curvas, retire la piel para exponer los huesos parietales (Figura 4B). Aplique una presión firme con un hisopo de algodón si hay sangrado del cráneo o el cuero cabelludo; el sangrado debe detenerse antes de avanzar al siguiente paso.
NOTA: Para cirugías agudas, la piel se puede empujar hacia atrás y adherirse al cráneo utilizando pegamento líquido de cianoacrilato o adhesivo tisular. - Retire el periostio que cubre la superficie externa del cráneo con hisopos de algodón.
- Usando un microscopio de operación (6-25x) y un taladro dental (rebaba de taladro de 0,5 mm, velocidad media), delinea un círculo en el hueso parietal para marcar la ubicación deseada de la ventana craneal en el cráneo (Figura 5). Evite la sutura sagital, lambda y bregma, ya que estas áreas son más delgadas y se superponen a vasos sanguíneos grandes.
NOTA: Para facilitar la perforación, se puede dibujar un contorno de la ventana craneal en el cráneo utilizando un marcador y una plantilla (Figura 5A). Para las ratas, puede ser más fácil perforar una ventana craneal rectangular, en lugar de circular. Debido al grosor del hueso del cráneo de la rata, use una broca de 0,7 mm para delinear la ventana craneal en el hueso compacto antes de usar una broca de 0,5 mm para completar el proceso de perforación. - Aplique una presión suave con la broca; la presión excesiva aumenta el riesgo de causar daño al tejido cerebral. Para evitar que el cráneo se sobrecaliente durante la perforación, gotee solución salina sobre el cráneo con una jeringa o aplique un trozo de esponja quirúrgica empapada en solución salina.
- Alterne entre perforar y enfriar el cráneo hasta que la isla ósea resultante se separe del resto del cráneo. Compruebe el progreso de la perforación aplicando una presión suave sobre la isla ósea con fórceps o la broca. Continúe perforando hasta que la isla ósea se separe del resto del cráneo.
NOTA: Las pequeñas grietas en las áreas más delgadas del cráneo son una buena indicación de que la perforación está casi completa. Intentar eliminar la isla ósea prematuramente puede hacer que pedazos de hueso penetren en el tejido cerebral, dañando la duramadre y causando inflamación y sangrado. - Retire la isla ósea usando un par de fórceps finos para agarrar los bordes, o la capa ósea compacta superior, de la isla ósea (Figura 6A). Asegúrese de que el cerebro se mantenga húmedo aplicando un trozo de esponja quirúrgica que haya sido pre-empapado en solución salina. Si se observa sangrado, coloque la esponja quirúrgica en la región que está sangrando. No continúe con el siguiente paso hasta que el sangrado haya cesado.
NOTA: Si el sangrado persiste después de 5 minutos, el animal no se puede utilizar para experimentos de imágenes multifotónicas. Para las ratas, puede ser necesario quitar la duramadre si es gruesa. Para quitar la duramadre, use un aumento alto en el microscopio de operación y un par de fórceps finos. - Para colocar una ventana craneal, tome una cubierta de vidrio con un par de fórceps, coloque una gota de solución salina en un lado y maniobra sobre el orificio en el cráneo. Asegúrese de que no haya burbujas de aire debajo de la cubierta.
NOTA: Use una funda de vidrio de 5 mm para ratones y 8 mm para ratas. Para las ratas, debido al grosor del hueso del cráneo, use una solución de agarosa en lugar de solución salina para llenar el espacio entre el cobertor y el cerebro. El transductor y su cubierta también se pueden adherir directamente sobre el cráneo, en lugar de usar una funda separada para la ventana craneal. Para esta opción, continúe con el paso 3.1. Consulte la Figura 1 para obtener más información. - Extienda una capa de pegamento de cianoacrilato alrededor del perímetro de la cubierta (Figura 6B) para unirla al cráneo. Asegúrese de que no haya pegamento debajo de la cubierta. Aplique presión sobre el cubrehojas para asegurarse de que el pegamento no entre en contacto con el cerebro.
- Una vez que el pegamento esté completamente seco, nivele la superficie del pegamento utilizando el taladro dental. Asegúrese de que todos los restos de pegamento se eliminen del área quirúrgica.
NOTA: Para ventanas craneales crónicas, inyecte los medicamentos postquirúrgicos necesarios (consulte la Tabla de materiales), proporcione ungüento para el cuidado de heridas y alimentos blandos, y recupere al animal bajo una lámpara de calor.
3. Colocación del transductor de anillo
- Prepare la solución de agarosa al 1% (p/v). En un vaso de precipitados pequeño o matraz Erlenmeyer, agregue 0,1 g de agarosa y 10 ml de PBS (1x) o solución salina. Hervir la solución hasta que la agarosa se haya disuelto completamente colocando el vaso de precipitados en una placa caliente o calentando la solución en un horno de microondas (30-45 s).
- Los pasos 3.2-3.5 son sensibles al tiempo ya que la solución de agarosa se enfría rápidamente. Retire ~ 0.5 ml de agarosa en una jeringa de 1 ml.
NOTA: Para proteger la integridad del cerebro, asegúrese de que la temperatura de la agarosa se aproxime a la temperatura corporal antes de su uso. - Deposite la agarosa generosamente en la cubierta de la ventana craneal.
NOTA: Si el tejido se blanquea, la temperatura de la agarosa era demasiado alta; el animal debe ser sacrificado. Si no hay una funda separada que cubra el cerebro (es decir, el transductor y su funda se colocan directamente sobre el cerebro, consulte el paso 2.14), entonces la agarosa debe depositarse en la superficie del cerebro en este paso. - Coloque el transductor sobre la ventana craneal (Figura 6C). Aplique una presión firme de tal manera que haya un mínimo de agarosa entre el transductor y la ventana craneal. Asegúrese de que el transductor esté centrado (plano XY) y paralelo (plano Z) a la ventana craneal, y que no haya burbujas de aire en la agarosa.
- Cuando la agarosa se haya enfriado a una consistencia similar a la gelatina, corte el exceso de agarosa de la circunferencia de la cubierta del transductor con una espátula o un bisturí. Asegúrese de que no haya burbujas de aire debajo de la cubierta del transductor.
- Usando una espátula, extienda una capa de pegamento de cianoacrilato sobre la circunferencia de la cubierta del transductor, extendiéndose hasta el cráneo, de modo que el transductor esté firmemente adherido al cráneo.
- Mantenga una presión firme sobre el transductor hasta que el pegamento se haya secado por completo (10-15 min).
4. Imágenes de microscopía multifotónica
- Coloque al animal debajo de la lente del objetivo (Figura 7A). Asegúrese de que la lente del objetivo esté centrada en el transductor de anillo y paralela al transductor (Figura 7B). Si se utiliza una lente de objetivo de inmersión en agua, llene el centro del transductor de anillo con agua desionizada y desgasificada.
NOTA: El agua desgasificada es importante para la propagación adecuada del ultrasonido. - Comience con la lente del objetivo en su posición más alta y luego baje lentamente la lente del objetivo hasta que esté dentro del transductor de anillo (Figura 7A, B). Asegúrese de que la lente del objetivo no colisione con el transductor o la cubierta.
NOTA: Alterne entre el ocular para verificar si la posición Z de la lente del objetivo está en el plano con la superficie del cerebro, y a ojo para asegurarse de que la lente del objetivo no choque con el transductor o el deslizamiento. Puede ser más fácil visualizar los vasos piales a través del ocular después de la inyección de dextrano fluorescente a través de la vena de la cola (Figura 7C). - Prepare el microscopio multifotónico para la obtención de imágenes.
NOTA: Este protocolo utiliza un microscopio multifotón vertical y una lente de objetivo 20-25x que tiene una distancia de trabajo de 2 mm, que es suficiente para enfocar más allá de la(s) funda(s), en el parénquima cerebral. - Preparar el dextrano. Agregue la cantidad adecuada de PBS al vial de dextrano, según las instrucciones del fabricante. Vórtice la solución de dextrano durante 1-3 minutos para asegurar que el polvo de dextrano esté completamente disuelto. Inyecte la solución de dextrano en la vena de la cola.
- Configuración de un escaneo de imágenes
- Usando los oculares, asegúrese de que la lente del objetivo sea paralela al cerebro. Incline el animal para corregir las desalineaciones XZ e YZ.
- Seleccione un campo de visión en un microscopio multifotónico. Configure una exploración XYZ antes de la exposición al ultrasonido para tener una imagen de referencia de la vasculatura antes de la exposición al ultrasonido.
NOTA: Los parámetros de imagen típicos son los siguientes: 300-800 μm de profundidad, 2-5 μm de tamaño de paso y pilas de tiempo de 10-20. Asegúrese de que la lente del objetivo no entre en contacto con el transductor o el cubrehojas en su punto más bajo durante la secuencia de imágenes.
5. Exposición al ultrasonido
- Asegúrese de que todos los cables BNC estén conectados correctamente (Figura 3).
- Configure un escaneo de imágenes XYZT que sea lo suficientemente largo como para capturar pilas de imágenes antes, durante y después de los tratamientos de microburbujas de ultrasonido.
- Prepare las microburbujas siguiendo las instrucciones del fabricante. Inyecte las microburbujas en la vena de la cola y comience a tomar imágenes.
NOTA: Las inyecciones de microburbujas se pueden realizar con una bomba de infusión para garantizar una velocidad de inyección constante y para permitir la inyección simultánea de microburbujas y la obtención de imágenes. Si se van a inyectar microburbujas durante la toma de imágenes, asegúrese de que se pueda acceder fácilmente a la vena de la cola sin exponer los detectores a la luz ambiental. - Comience la sonicación.
NOTA: Los parámetros típicos de sonicación son los siguientes: ciclos de 10 ms, índice mecánico de 0.2-0.4 y frecuencias de repetición de pulsos entre 1-4 Hz. Los parámetros de sonicación y microburbuja utilizados en estudios preclínicos de ultrasonido-microburbuja han sido ampliamente estudiados y están bien documentados en la literatura (por ejemplo, ver 40 para una revisión). - Continúe con las imágenes multifotónicas durante toda la duración de la sonicación y después del final de la sonicación. Sea observador de la extravasación de dextrano de los vasos sanguíneos, ya que esto es indicativo de aumentos en la permeabilidad de BBB.
NOTA: Si se detecta dextrano en el espacio extravascular, pero en la periferia del campo de visión, entonces puede haber vasos sanguíneos afectados fuera del campo de visión. Esto puede resultar de una desalineación del transductor con el enfoque de la lente del objetivo. En este escenario, es más fácil ajustar el campo de visión moviendo la lente del objetivo o reposicionando al animal, que realinear el transductor. - Una vez que se completan las imágenes, eutanasia al animal la dislocación cervical bajo anestesia profunda o asfixia por CO2 . Para las ventanas craneales crónicas, extienda una capa de cemento dental sobre el cráneo expuesto.
NOTA: Para las ventanas craneales crónicas, la piel que rodea la ventana se puede suturar, aunque esto no es necesario, debido a la eliminación del cuero cabelludo en el paso 2.8.
6. Análisis de imágenes
- Exportar pilas de imágenes.
- Analice imágenes con software de análisis de imágenes (por ejemplo, Olympus Fluoview, ImageJ/FIJI, Bitplane Imaris, ThermoFisher Scientific Amira) y/o herramientas de programación (por ejemplo, Python, MATLAB).
Resultados
Los tratamientos exitosos de ultrasonido-microburbuja se pueden detectar mediante la extravasación de dextrano fluorescente desde el espacio intravascular al extravascular (Figura 8), lo que indica un aumento en la permeabilidad de BBB. Dependiendo del campo de presión del transductor de anillo, los vasos piales y / o capilares se verán afectados.
Para evaluar los cambios vasculares inducidos por los tratamientos de ultrasonido-microburbuja, se puede medir el diámetro del vaso de interés antes, durante y después del tratamiento de ultrasonido-microburbuja (Figura 9). Esto se puede hacer manualmente en un software disponible comercialmente (por ejemplo, el software Olympus Fluoview). Durante la adquisición de imágenes, también se pueden utilizar inyecciones de dextrano en bolo y exploraciones de línea para evaluar el flujo sanguíneo30,41. Para evaluar la cinética de la fuga de dextrano como modelo representativo para la administración de fármacos, se puede evaluar la intensidad de la señal entre los espacios intra y extravascular utilizando herramientas como MATLAB26,27,29,41 (Figura 10).
Se puede lograr un procesamiento de imágenes adicional utilizando ImageJ / FIJI. ImageJ/FIJI es un software de código abierto que es compatible con MATLAB y es muy adecuado para realizar análisis comunes en el análisis de imágenes biológicas, como la medición de cambios vasculares, o la longitud o distancia entre objetos fluorescentes (por ejemplo, placas β-amiloide a los vasos sanguíneos). Las canalizaciones de procesamiento de imágenes creadas en ImageJ/FIJI se pueden automatizar escribiendo macros personalizadas.
Los análisis más complejos, como la segmentación 3D de los vasos sanguíneos y el seguimiento celular, se pueden lograr utilizando un software más avanzado y semiautomatizado (Figura 11). Después de la segmentación, se pueden realizar análisis más específicos, como clasificar los vasos sanguíneos como arteriolas, vénulas o capilares, en función del diámetro, la ramificación, los patrones de tortuosidad y la dirección del flujo42,43. También se han desarrollado algoritmos de aprendizaje automático para automatizar la segmentación de los vasos sanguíneos22,44.
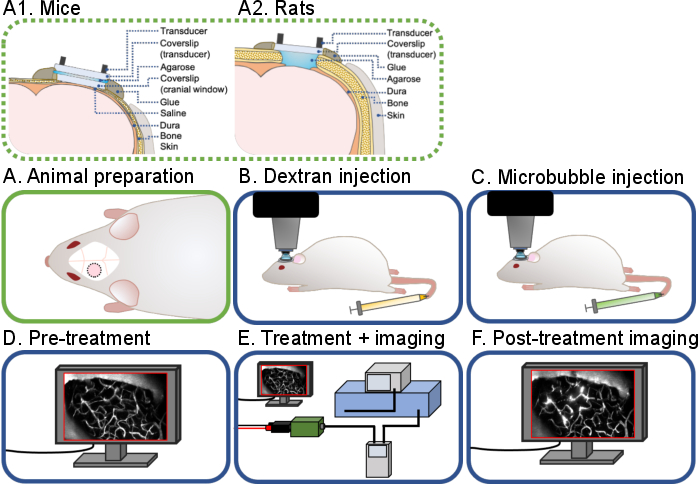
Figura 1: Flujo de trabajo general de experimentos cerebrales intravitales multifotónicos de ultrasonido-microburbuja. Se muestra un flujo de trabajo general de los experimentos cerebrales intravitales multifotónicos de ultrasonido-microburbuja descritos en este protocolo. Hay 6 pasos: (A) Preparación en animales para (A1) ratones y (A2) ratas, (B) Inyección de dextrano, (C) Inyección de microburbujas, (D) Imágenes previas al tratamiento, (E) Tratamiento e imágenes, (F) Imágenes posteriores al tratamiento y análisis de datos. Haga clic aquí para ver una versión más grande de esta figura.
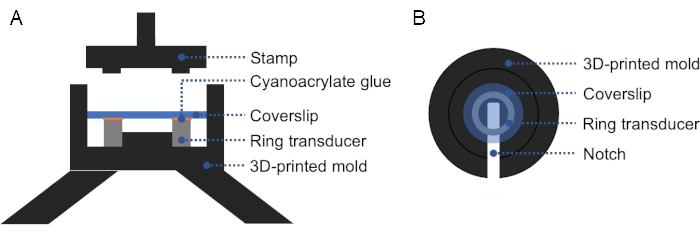
Figura 2: Sección transversal y vista superior del molde impreso en 3D. (A) Sección transversal del molde. Se aplica una capa delgada de pegamento de cianoacrilato en la superficie superior del transductor de anillo, y se coloca una cubierta en la parte superior. Se puede usar un sello para aplicar presión firme e incluso sobre el la cubierta y el transductor de anillo. (B) Vista superior del molde. Se puede agregar una muesca en el molde para facilitar la eliminación del transductor preparado. Haga clic aquí para ver una versión más grande de esta figura.
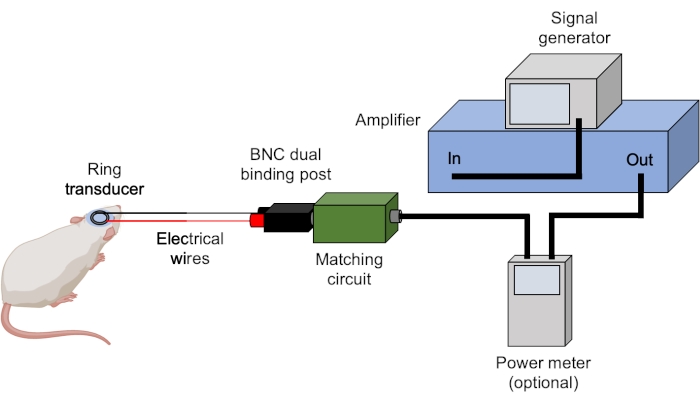
Figura 3: Configuración de ultrasonido. Se muestra el hardware típico para experimentos de ultrasonido. Los parámetros de ultrasonido son ajustados y activados por el generador de señal y amplificados por el amplificador. Se puede utilizar un medidor de potencia para registrar las potencias hacia adelante y reflejadas antes de enviar la señal a la caja correspondiente, que se empareja con el transductor. Todas las conexiones se logran utilizando cables BNC a menos que se indique lo contrario. Haga clic aquí para ver una versión más grande de esta figura.
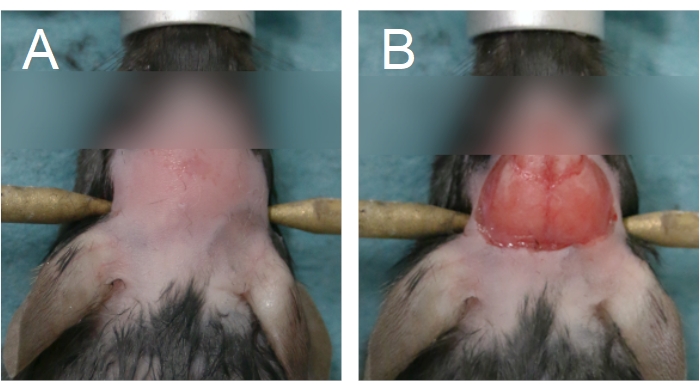
Figura 4: Área de extracción de piel y eliminación del cuero cabelludo. (A) La eliminación de pieles debe comenzar entre los ojos y extenderse hasta la mitad anterior del cuello. (B) La extirpación del cuero cabelludo debe ser suficiente para exponer los huesos parietales. El sangrado debe detenerse antes de continuar. Haga clic aquí para ver una versión más grande de esta figura.
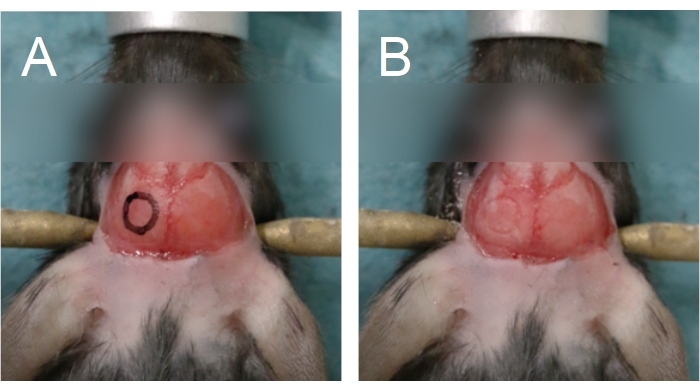
Figura 5: Contorno de la ventana craneal. La ventana craneal está situada en un hueso parietal. (A) Se puede dibujar un contorno de la ventana craneal en el cráneo para ayudar en el proceso de perforación. (B) El contorno de la ventana craneal se puede ver después de perforar a través del hueso compacto. Haga clic aquí para ver una versión más grande de esta figura.
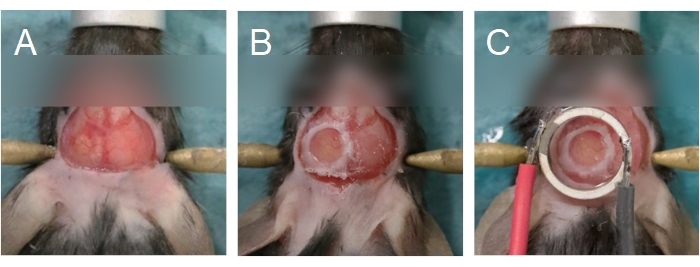
Figura 6: Alineación de la ventana craneal y del transductor. (A) La ventana craneal se crea en un hueso parietal. La isla ósea ha sido removida, exponiendo el cerebro debajo. (B) La ventana craneal está completa cuando se sella una funda de vidrio en el cráneo con pegamento de cianoacrilato. (C) El transductor está centrado en la ventana craneal y se adhiere con pegamento de cianoacrilato. Haga clic aquí para ver una versión más grande de esta figura.
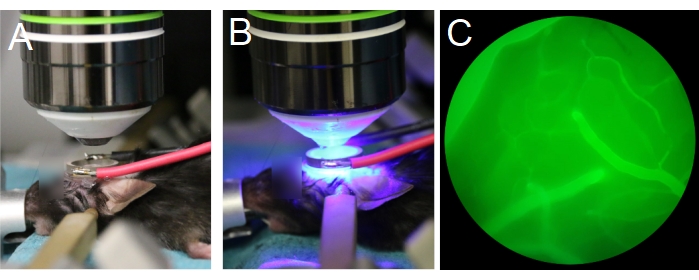
Figura 7: Posicionamiento de la lente y el transductor del objetivo. (A, B) La lente del objetivo está centrada en el transductor de anillo. (C) Los vasos sanguíneos llenos de dextrano fluorescente son visibles a través de los oculares, bajo epifluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
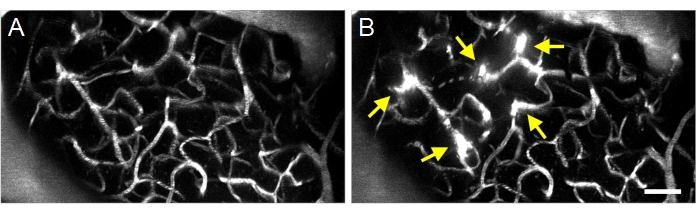
Figura 8: Imágenes multifotónicas de proyección máxima de aumentos inducidos por ultrasonido-microburbuja en la permeabilidad de BBB. Imágenes de máxima proyección de la vasculatura (A) antes y (B) después de los tratamientos de ultrasonido-microburbuja. Los tratamientos exitosos de ultrasonido-microburbuja se pueden confirmar observando aumentos en la permeabilidad de BBB después del tratamiento, visualizados como extravasación fluorescente de dextrano (flechas). Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
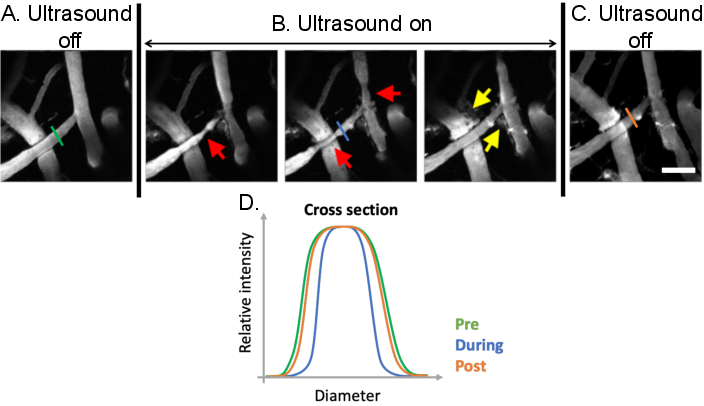
Figura 9: Análisis de la vasomodulación inducida por tratamientos de ultrasonido-microburbuja. Imágenes de máxima proyección de los vasos sanguíneos cerebrales antes, durante y después de los tratamientos de microburbujas de ultrasonido. Las microburbujas están presentes en todas las imágenes. En comparación con (A) las condiciones previas al tratamiento, se puede observar una vasomodulación clara (B) durante los tratamientos de microburbujas de ultrasonido (flechas rojas). Los aumentos mediados por microburbujas de ultrasonido en la permeabilidad de BBB también son evidentes después del tratamiento de la fuga de dextrano fluorescente del espacio intravascular al extravascular (flechas amarillas). (C) Cuando se apaga el ultrasonido, los diámetros vasculares vuelven a los tamaños basales previos al tratamiento. (D) Los cambios vasculares se pueden analizar trazando el diámetro del vaso de interés antes, durante y después del tratamiento con microburbujas ecográficas. Barra de escala: 100 μm. (Obra inédita). Haga clic aquí para ver una versión más grande de esta figura.
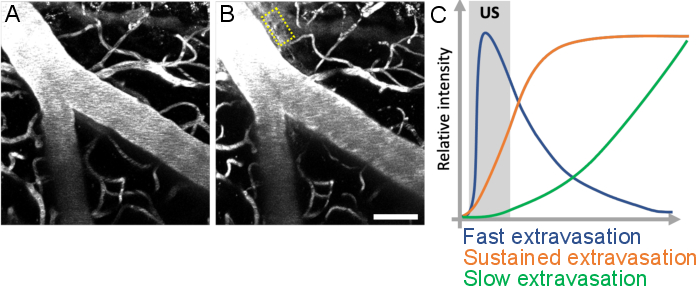
Figura 10: Análisis de la cinética de fugas tras tratamientos de ultrasonido-microburbuja. El aumento de la permeabilidad de BBB se visualiza como una fuga de dextrano fluorescente desde el espacio intravascular al extravascular. Los cambios en la permeabilidad de BBB son evidentes cuando se comparan las pilas de imágenes adquiridas (A) antes y (B) después de los tratamientos de microburbujas de ultrasonido. (C) La cinética de fugas se puede analizar mediante el seguimiento de la intensidad, el volumen y la velocidad del dextrano en los compartimentos extravasculares (rectángulo amarillo). Barra de escala: 50 μm. (Obra inédita.) Haga clic aquí para ver una versión más grande de esta figura.
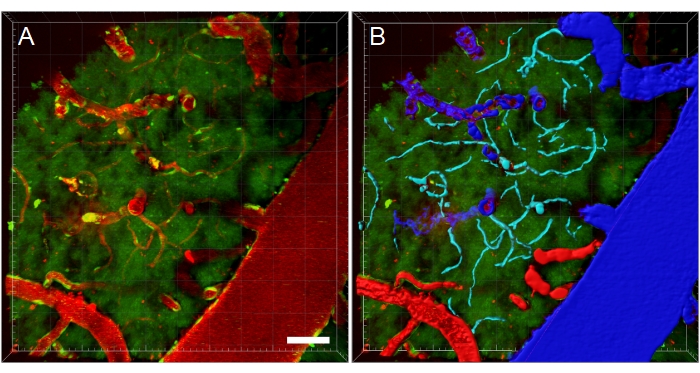
Figura 11: Segmentación de vasos sanguíneos de la pila XYZ de microscopía multifotónica. (A) Pila de profundidad (XYZ) de vasos sanguíneos en una rata EGFP transgénica. Los vasos sanguíneos se visualizan mediante inyección intravenosa de dextrano fluorescente Texas Red 70 kDa (rojo). El canal verde muestra células fluorescentes y autofluorescencia tisular. (B) Se crean reconstrucciones 3D de los vasos sanguíneos y luego se codifican por colores según el tipo de vaso sanguíneo para facilitar los análisis específicos del tipo. Las venas/vénulas son azules, las arterias/arteriolas son rojas y los capilares son cian. Barra de escala: 50 μm. Reconstrucciones creadas con Bitplane Imaris. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El monitoreo intravital de microscopía multifotónica del cerebro es una herramienta valiosa para estudiar las respuestas cerebrales durante la exposición al ultrasonido. Hasta donde sabemos, el protocolo descrito aquí es el único método para realizar imágenes de microscopía multifotónica del parénquima cerebral durante los tratamientos de ultrasonido-microburbuja. La creación de ventanas craneales y el uso de transductores de anillo permiten el monitoreo en tiempo real de las respuestas vasculares, celulares y otras respuestas posteriores a los tratamientos de ultrasonido-microburbuja a alta resolución espacial y temporal. Otros grupos han realizado imágenes de microscopía multifotónica tras la finalización de los tratamientos de ultrasonido-microburbuja, perdiendo así la respuesta en tiempo real del parénquima cerebral a los tratamientos19. El procedimiento descrito ofrece un mejor control temporal, lo que permite la recopilación de datos que pueden ayudar a iluminar los mecanismos agudos detrás de los tratamientos de ultrasonido-microburbuja. Los datos cuantitativos y cualitativos pueden extraerse y analizarse de las pilas de imágenes adquiridas, como la cinética de extravasación27,29,30, los cambios en el volumen de la placa β-amiloide31 y la dinámica celular32.
Se destacaron varios pasos de solución de problemas a lo largo del protocolo. Primero, se enfatizaron los pasos quirúrgicos que son particularmente susceptibles al error del operador, como el uso de agarosa durante la cirugía de la ventana craneal y la colocación del transductor. También se proporcionaron medidas para prevenir el malestar y la muerte de los animales, incluido el monitoreo de la fisiología animal durante la cirugía y el vórtice completo del dextrano antes de la inyección. En segundo lugar, también se destacaron las especificaciones físicas del transductor y la alineación de la lente del objetivo, el transductor y la ventana craneal. Las especificaciones del transductor de anillo y sus propiedades acústicas deben determinarse teniendo en cuenta la lente objetivo utilizada, así como el modelo animal. Específicamente, el diámetro interno del transductor de anillo debe ser lo suficientemente grande como para rodear la lente del objetivo, pero lo suficientemente pequeño como para montarse de forma segura en el cráneo del animal. Además, el área focal del transductor debe alinearse con el rango de la lente objetivo utilizada.
Un desafío común es que la ventana craneal y el transductor de anillo están en ángulo con respecto a la lente del objetivo. El centrado adecuado (XY) y la alineación (Z) de la lente del objetivo con la ventana craneal y el transductor aseguran que el área focal del transductor, y por lo tanto la región del tejido cerebral tratado, se alinee con el campo de visión de la imagen y reduzca el riesgo de colisión entre la lente del objetivo y el transductor durante la obtención de imágenes. La alineación se puede lograr ajustando la posición de la cabeza del animal y / o girando el marco estereotáctico en el que está fijado.
Los componentes del microscopio (por ejemplo, detectores, divisores de haz) y los parámetros de adquisición de imágenes deben seleccionarse en función del objetivo del estudio. Aquí, se utiliza una lente de objetivo con una distancia focal larga (> 2 mm) debido a la presencia de la(s) funda(s) y el transductor de anillo ubicado entre la lente del objetivo y el cerebro. También se recomienda un microscopio vertical, ya que permite más espacio para maniobrar al animal, particularmente para experimentos cerebrales. Para capturar la cinética de la fuga inducida por ultrasonido-microburbuja del tinte intravascular, una alta resolución temporal es favorable, que se puede lograr mediante el uso de un sistema de escaneo de resonancia. La combinación de esto con un sistema de detección de alta sensibilidad, como los detectores de fosfuro de arseniuro de galio (GaAsP), también dará como resultado imágenes más favorables.
El procedimiento experimental presentado tiene varias limitaciones. En primer lugar, el procedimiento quirúrgico es bastante invasivo y se ha informado que causa inflamación45, aunque la inflamación puede minimizarse46. Además, se observó que las respuestas inmunes inducidas por las cirugías de ventana craneal se resolvían a las 2-4 semanas después de la cirugía23,24,25. Además, el proceso de perforación, particularmente cuando se realiza con fuerza o velocidad excesivas, puede causar daño al tejido subyacente debido a la generación de calor, vibración y presión aplicada. También se ha observado que las cirugías de ventana craneal y las imágenes multifotónicas afectan la temperatura cerebral47. Estas limitaciones se pueden reducir hasta cierto punto a través de la creación cuidadosa de ventanas craneales prístinas, la recuperación adecuada de animales con ventanas craneales crónicas y el mantenimiento de la temperatura corporal normotérmica utilizando una fuente de calefacción con control de retroalimentación. En segundo lugar, la profundidad de la imagen está limitada por el microscopio y la lente del objetivo utilizados. Por ejemplo, el efecto del tratamiento con ultrasonido-microburbuja en estructuras cerebrales más profundas, como el hipocampo, no puede estudiarse sin medidas más invasivas, como la eliminación del tejido cortical suprayacente48, o el uso de microlentes junto con la penetración cortical49. El uso de una lente de objetivo con una larga distancia de trabajo podría resolver este problema hasta cierto punto, pero la penetración de la luz también está limitada a mayores profundidades.
Si bien las imágenes representativas de este protocolo se adquirieron de roedores de tipo salvaje, el procedimiento experimental presentado también se puede aplicar a animales transgénicos y modelos de enfermedades, como la enfermedad de Alzheimer31. Los experimentos ecográficos no relacionados con la modulación BBB, como la neuromodulación inducida por ultrasonido, también pueden ser monitorizados mediante este protocolo33,34. Otras posibles aplicaciones se pueden lograr mediante el uso de diferentes configuraciones de microscopio o detector, como el emparejamiento de un microscopio confocal con una cámara de ultra alta velocidad50. Si bien el fotoblanqueo y la fototoxicidad son comparativamente peores en los microscopios confocales debido al gran volumen de excitación, las imágenes de ultra alta velocidad pueden permitir la visualización de las interacciones células endoteliales capilares cerebrales-microburbujas con alta resolución temporal, lo que podría iluminar aún más los mecanismos que impulsan los tratamientos de ultrasonido-microburbuja BBB. Para concluir, el protocolo descrito proporciona un método para monitorear los efectos vasculares y celulares inducidos por los experimentos de BBB de ultrasonido-microburbuja en tiempo real, proporcionando una herramienta para determinar aún más los mecanismos que impulsan estos tratamientos, así como iluminar las respuestas posteriores del parénquima cerebral a los tratamientos de ultrasonido-microburbuja.
Divulgaciones
Charissa Poon, Melina Mühlenpfordt, Marieke Olsman y Catharina de Lange Davies no declaran conflictos de intereses financieros ni no financieros. Spiros Kotopoulis es un empleado a tiempo completo y posee acciones en EXACT Therapeutics AS, una compañía que desarrolla la administración de medicamentos mejorada por ultrasonido y microburbujas / grupos. Kullervo Hynynen es el fundador de FUS Instruments, del que recibe apoyo no relacionado con la investigación.
Agradecimientos
El alojamiento de los animales fue proporcionado por el Centro Básico de Medicina Comparada (CoMed, NTNU). La figura 3 se creó en BioRender.com. La grabación y edición de video fue realizada por Per Henning, webmaster de la Facultad de Ciencias Naturales de NTNU. El proyecto fue financiado por la Universidad Noruega de Ciencia y Tecnología (NTNU, Trondheim, Noruega), el Consejo de Investigación de Noruega (RCN 262228), los Institutos Canadienses de Investigación en Salud (FDN 154272), el Instituto Nacional de Salud (R01 EB003268) y la Cátedra Temerty en Investigación de Ultrasonido Enfocado en el Centro de Ciencias de la Salud Sunnybrook.
Materiales
| Name | Company | Catalog Number | Comments |
| Ring transducer placement | |||
| Agarose (powder) | Sigma-Aldrich | A9539 | |
| Beaker or Erlenmeyer flask (50 ml) | VWR | 213-0462 or 214-1130 | |
| Cyanoacrylate glue (gel) | Loctite | 1363589 | |
| Glass coverslips (13 mm) | Thermo Fisher Scientific | CB00130RA120MNT0 | Coverslip for ring transducer. |
| Hot plate or microwave | Corning | PC-400D | To heat agarose solution. |
| PBS (1X) | Sigma-Aldrich | P4417 | |
| Ring transducer | Custom-made | Custom-made | Custom-made. E.g. https://doi.org/10.1109/ULTSYM.2014.0518 |
| Rubber stopper | VWR | 217-0867 | |
| Animal preparation and drugs | |||
| Bupivacaine*A | Aspen | 169912 | Dose: 1 mg/kg, s.c., local anesthetic injected at incision site. |
| Buprenorphine*A | Indivior | 521634 | Dose mouse: 0.05-0.1 mg/kg, s.c., opioid, administer pre-surgery. |
| Buprenorphine*A | Indivior | 521634 | Dose rat: 0.01-0.05 mg/kg, s.c.. |
| Carprofen*C | Pfizer | DIN 02255693 | Dose: 5 mg/kg, s.c., NSAID, adminster post-surgery. |
| Depilatory cream | Veet | N/A | For complete fur removal after trimming. |
| Dexamethasone*C | Sandoz | DIN 00664227, 2301 | Dose: 3 mg/kg, i.m., corticosteroid, reduces cerebral edema, administer pre-surgery. |
| Enrofloxacin*C | Bayer | DIN: 02249243 | Dose: 5 mg/kg, i.p., antibiotic, administer post-surgery. |
| Fur clippers | Aesculap | 90200714 | Exacta/Isis. |
| Heating pad | Physitemp Instruments INC | HP-1M | |
| Isoflurane | Baxter | ESDG9623C | Dose: 3% induction, 1% maintenance; anesthetic. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose mouse: 2-3 mg/kg, s.c., NSAID, administer pre-surgery. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose rat: 1 mg/kg, s.c. |
| Pulse oximeter | STARR Life Sciences Corp | N/A | MouseOx. |
| Stereotaxic frame | Kopf | Kopf 900 | |
| Sterile ophthalmic ointment | Théa | 597562 | Viscotears. |
| Tail vein catheter (24 G) | BD Neoflon | 391350 | |
| * Discuss dosing and type of administration with veterinarian prior to use. A For acute window surgeries, C For chronic window surgeries. Dose for mice and rats are the same unless otherwise specified. | |||
| Material and equipment for cranial window placement | |||
| Alcohol swabs | BD | 326895 | |
| Curved fine surgical scissors | Fine Science Tools | 14002-12 | |
| Cotton or fibreless swabs | Chemtronics | CX50 | |
| Cyanoacrylate glue (gel) | Loctite | 1594457 (gel), 230992 (liquid) | If unavailable, liquid cyanoacrylate glue can be mixed with extra-fine acrylate powder. |
| Dental cement | Lang Dental | Jet Set-4 Denture Repair Package | |
| Dental micromotor hand drill | FOREDOM | K.1070-2 | High speed rotary micromotor kit with 2.35 mm collet. |
| Forceps | Fine Science Tools | 11152-10, 11370-40 | |
| Glass coverslips | Thermo Fisher Scientific | CB00050RA120MNT0 (5 mm) | Mouse cranial windows. |
| Glass coverslips | Thermo Fisher Scientific | CB00080RA120MNT0 (8 mm) | Rat cranial windows. |
| Micro drill burrs (0.5 mm) | Meisinger | HM71005 (0.5 mm) | |
| Micro drill burrs (0.7 mm) | Meisinger | HM71007 (0.7 mm) | |
| Stereo microscope | Nikon | SMZ645 | |
| Surgical gelatin sponge | Ethicon | MS0005 | |
| Vetbond Tissue adhesive | 3M | 1469SB | |
| Weigh boats / trays | VWR | 10803-148 | |
| * Autoclave drapes, tools, materials, and gowns, and use sterile surgical gloves, for chronic cranial window surgeries. | |||
| Multiphoton microscopy | |||
| 20x water immersion objective | Olympus | XLUMPLFLN20 XW | Numerical aperture 1.0, working distance 2.0 mm. |
| Fluorescent dextran (e.g. FITC 70 kDa) | Sigma Aldrich | 46945 | Recommended 10 kDa-2 MDa. |
| MaiTai DeepSee Ti:Sapphire laser oscillator | Spectra-Physics | N/A | |
| SliceScope microscope | Scientifica | N/A | |
| Ultrasound treatment | |||
| 50 dB RF Amplifier | E&I | 2100L | |
| Matching circuit | Custom-made | Custom-made | Custom-made. |
| Microbubbles | Bracco Imaging | N/A | SonoVue (Bracco Imaging, Europe). Dose 1 ml/kg. |
| Microbubbles | Lantheus | N/A | Definity (Lantheus Medical Imaging, North America). Dose 0.02-0.04 ml/kg. |
| Signal generator | Agilent Technologies | 33500B |
Referencias
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Kalladka, D., et al. Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 388 (10046), 787-796 (2016).
- Pardridge, W. M. The blood-brain barrier: Bottleneck in brain drug development. the journal of the American Society for Experimental NeuroTherapeutics. 2 (1), 12 (2005).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Advanced Drug Delivery Reviews. 64 (7), 614-628 (2012).
- Nagy, Z., Pappius, H. M., Mathieson, G., Hüttner, I. Opening of tight junctions in cerebral endothelium. I. Effect of hyperosmolar mannitol infused through the internal carotid artery. The Journal of Comparative Neurology. 185 (3), 569-578 (1979).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220 (3), 640-646 (2001).
- Burgess, A., et al. Alzheimer disease in a mouse model: MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior. Radiology. 273 (3), 736-745 (2014).
- Abrahao, A., et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using MR-guided focused ultrasound. Nature Communications. 10 (1), 4373 (2019).
- Hynynen, K., Jones, R. M. Image-guided ultrasound phased arrays are a disruptive technology for non-invasive therapy. Physics in Medicine and Biology. 61 (17), 206-248 (2016).
- Burgess, A., et al. Targeted delivery of neural stem cells to the brain using MRI-guided focused ultrasound to disrupt the blood-brain barrier. PLoS One. 6 (11), 27877 (2011).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- Downs, M. E., et al. Long-term safety of repeated blood-brain barrier opening via focused ultrasound with microbubbles in non-human primates performing a cognitive task. PLOS One. 10 (5), 0125911 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103-112 (2019).
- Bing, C., et al. Transcranial opening of the blood-brain barrier in targeted regions using a stereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2, 13 (2014).
- O'Reilly, M. A., Hynynen, K. Blood-brain barrier: Real-time feedback-controlled focused ultrasound disruption by using an acoustic emissions-based controller. Radiology. 263 (1), 96-106 (2012).
- Jones, R. M., Deng, L., Leung, K., McMahon, D., O'Reilly, M. A., Hynynen, K. Three-dimensional transcranial microbubble imaging for guiding volumetric ultrasound-mediated blood-brain barrier opening. Theranostics. 8 (11), 2909-2926 (2018).
- Jones, R. M., McMahon, D., Hynynen, K. Ultrafast three-dimensional microbubble imaging in vivo predicts tissue damage volume distributions during nonthermal brain ablation. Theranostics. 10 (16), 7211-7230 (2020).
- Arvanitis, C. D., et al. Mechanisms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption. Proceedings of the National Academy of Sciences. 115 (37), 8717-8726 (2018).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. 33, (2012).
- McCarter, J. F., et al. Clustering of plaques contributes to plaque growth in a mouse model of Alzheimer's disease. Acta Neuropathologica. 126 (2), 179-188 (2013).
- Cruz Hernández, J. C., et al. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer's disease mouse models. Nature Neuroscience. 22 (3), 413-420 (2019).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Cao, V. Y., et al. In vivo two-photon imaging of experience-dependent molecular changes in cortical neurons. Journal of Visualized Experiments. (71), e50148 (2013).
- Nhan, T., Burgess, A., Hynynen, K. Transducer design and characterization for dorsal-based ultrasound exposure and two-photon imaging of in vivo blood-brain barrier disruption in a rat model. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 60 (7), 1376-1385 (2013).
- Cho, E. E., Drazic, J., Ganguly, M., Stefanovic, B., Hynynen, K. Two-photon fluorescence microscopy study of cerebrovascular dynamics in ultrasound-induced blood-brain barrier opening. Journal of Cerebral Blood Flow & Metabolism. 31 (9), 1852-1862 (2011).
- Burgess, A., Nhan, T., Moffatt, C., Klibanov, A. L., Hynynen, K. Analysis of focused ultrasound-induced blood-brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248 (2014).
- Nhan, T., et al. Drug delivery to the brain by focused ultrasound induced blood-brain barrier disruption: Quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy. Journal of Controlled Release. 172 (1), 274-280 (2013).
- Nhan, T., Burgess, A., Lilge, L., Hynynen, K. Modeling localized delivery of Doxorubicin to the brain following focused ultrasound enhanced blood-brain barrier permeability. Physics in Medicine and Biology. 59 (20), 5987-6004 (2014).
- Poon, C. T., et al. Time course of focused ultrasound effects on β-amyloid plaque pathology in the TgCRND8 mouse model of Alzheimer's disease. Scientific Reports. 8 (1), 14061 (2018).
- Poon, C., Pellow, C., Hynynen, K. Neutrophil recruitment and leukocyte response following focused ultrasound and microbubble mediated blood-brain barrier treatments. Theranostics. 11 (4), 1655-1671 (2021).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Chu, P. -. C., et al. Neuromodulation accompanying focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 5 (1), 15477 (2015).
- Yddal, T., Kotopoulis, S., Gilja, O. H., Cochran, S., Postema, M. . Transparent glass-windowed ultrasound transducers. , 2079-2082 (2014).
- Santos, M. A., Goertz, D. E., Hynynen, K. Focused ultrasound hyperthermia mediated drug delivery using thermosensitive liposomes and visualized with in vivo two-photon microscopy. Theranostics. 7 (10), 2718-2731 (2017).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Molecular Imaging and Biology. 14 (1), 40-46 (2012).
- Baum, J. A. The carrier gas in anaesthesia: Nitrous oxide/oxygen, medical air/oxygen and pure oxygen. Current Opinion in Anaesthesiology. 17 (6), 513-516 (2004).
- Poon, C., McMahon, D., Hynynen, K. Noninvasive and targeted delivery of therapeutics to the brain using focused ultrasound. Neuropharmacology. , 20-37 (2017).
- Joo, I. L., et al. Early neurovascular dysfunction in a transgenic rat model of Alzheimer's disease. Scientific Reports. 7, 46427 (2017).
- Dorr, A., et al. Amyloid-β-dependent compromise of microvascular structure and function in a model of Alzheimer's disease. Brain: A Journal of Neurology. 135, 3039-3050 (2012).
- Kim, T. N., et al. Line-scanning particle image velocimetry: An optical approach for quantifying a wide range of blood flow speeds in live animals. PLOS One. 7 (6), 38590 (2012).
- Teikari, P., Santos, M., Poon, C., Hynynen, K. Deep learning convolutional networks for multiphoton microscopy vasculature segmentation. arXiv. , (2016).
- Denes, A., et al. Surgical manipulation compromises leukocyte mobilization responses and inflammation after experimental cerebral ischemia in mice. Frontiers in Neuroscience. 7, 00271 (2014).
- Koletar, M. M., Dorr, A., Brown, M. E., McLaurin, J., Stefanovic, B. Refinement of a chronic cranial window implant in the rat for longitudinal in vivo two-photon fluorescence microscopy of neurovascular function. Scientific Reports. 9 (1), 5499 (2019).
- Podgorski, K., Ranganathan, G. Brain heating induced by near-infrared lasers during multiphoton microscopy. Journal of Neurophysiology. 116 (3), 1012-1023 (2016).
- Ulivi, A. F., et al. Longitudinal two-photon imaging of dorsal hippocampal CA1 in live mice. Journal of Visualized Experiments: JoVE. (148), e59598 (2019).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Beekers, I., et al. Combined confocal microscope and Brandaris 128 ultra-high-speed camera. Ultrasound in Medicine & Biology. 45 (9), 2575-2582 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados