Method Article
实时活体内多光子显微镜可可视化聚焦超声和微气泡处理,以提高血脑屏障通透性
* 这些作者具有相同的贡献
摘要
该协议描述了在聚焦超声和微气泡治疗期间能够对啮齿动物大脑进行实时 体内 多光子荧光成像的外科和技术程序,以增加血脑屏障通透性。
摘要
血脑屏障(BBB)是成功将药物输送到大脑的关键挑战。在微气泡存在下进行超声暴露已成为一种有效的方法,可以短暂和局部地增加BBB的通透性,促进药物通过BBB的细胞旁和转运。在超声微气泡治疗期间对脉管系统进行成像将为大脑中超声微气泡治疗的机制和动力学提供有价值和新颖的见解。
在这里,我们提出了一种使用与环形换能器和20倍物镜对齐的颅窗进行活体内多光子显微镜检查的实验程序。这种设置可以在超声微气泡治疗期间对大脑进行高空间和时间分辨率成像。通过开放的颅骨颅窗获得对大脑的光学访问。简而言之,取出一块直径为3-4毫米的颅骨,并用玻璃盖玻片密封大脑的暴露区域。一个0.82 MHz环形传感器安装在顶部,该传感器连接到第二个玻璃盖玻片上。琼脂糖(1%w / v)用于换能器的盖玻片和覆盖颅窗的盖玻片之间,以防止气泡阻碍超声传播。当采取无菌手术程序和抗炎措施时,可以在几周内反复进行超声微泡治疗和成像会议。静脉注射荧光葡聚糖偶联物以可视化脉管系统并量化超声微气泡诱导的影响(例如,渗漏动力学、血管变化)。本文介绍了颅窗放置、环形换能器放置、成像程序、常见故障排除步骤以及该方法的优点和局限性。
引言
治疗神经系统疾病的一个关键挑战是血脑屏障(BBB)的存在。BBB限制亲水性,带电性,极性和大(>400 Da)分子进入脑实质1。目前用于将治疗药物通过BBB输送到脑实质的一种方法是使用立体定向颅内注射2。其他正在研究的侵入性较小的方法受到所用技术复杂性的阻碍,例如设计用于通过BBB3的受体介导递送的药物,或者在靶向区域的空间精度方面受到限制,例如鼻内注射4 或给予高渗溶液5。
超声与全身注射的微气泡(一种超声造影剂)结合使用已被开发为一种无创手段,可以短暂地增加BBB6的通透性。通过使用聚焦换能器7或可操纵的换能器相控阵8,9,超声可以以毫米级精度靶向大脑中的选定区域,从而最大限度地减少脱靶效应。超声微泡治疗可以通过使用磁共振成像引导7,10,11,12,13,14或立体定向框架15来定制每个受试者的大脑解剖结构。此外,通过监测微气泡的声发射,可以实时控制BBB渗透率的增加程度16,17,18。目前正在全球范围内进行临床试验,研究超声微气泡治疗的安全性和可行性(例如,ClinicalTrials.gov 标识符NCT04118764)。
超声微气泡 BBB 治疗通常通过确认治疗诱导的 BBB 通透性增加、在造影剂增强磁共振成像中可视化,或通过体内成像或离体组织学中的染料外渗来评估。然而,大多数显微镜分析是在超声微气泡处理完成后在体外进行的11,19,从而错过了超声暴露期间和之后的动态生物反应。在超声暴露期间进行的实时成像可能有助于了解驱动超声微气泡BBB治疗以及下游反应的机制,这可能会增加我们对其治疗应用的理解。此外,使用具有体内成像技术的慢性颅窗将使纵向研究能够评估超声微气泡治疗的时间方面。
该协议的目标是描述对啮齿动物的急性和慢性研究进行超声微泡治疗的实时多光子成像所需的外科和技术程序(图1)。这分两部分实现:首先,创建颅窗以实现体内成像,其次,在顶部安装环形换能器以实现并行超声处理和成像。颅窗已被神经科学家广泛用于神经血管偶联20、β淀粉样蛋白发病机制21和神经免疫学22等的体内成像。在该协议中,描述了在小鼠和大鼠颅骨中产生急性(非恢复)和慢性(恢复)颅窗的外科手术。颅窗方法,特别是用于慢性实验的方法,已经得到了充分的记录23,24,25。为了与现有文献保持一致,术语"急性"和"慢性"将在整个协议中使用。用于体内成像的环形传感器的设计也已在前面进行了描述26。尽管这些技术的可用性以及从超声微气泡治疗的实时成像中获得的见解,但很少有研究实验室使用这种技术成功发表文献26,27,28,29,30,31,32.因此,在该协议中,描述了进行这些实时超声微气泡实验的手术和技术细节。虽然指定的超声处理和成像参数已针对BBB实验进行了优化,但也可以使用该技术研究超声暴露于大脑的其他影响,例如神经调节33,34,β淀粉样蛋白斑块监测31和免疫细胞反应32。
研究方案
以下所有实验程序均由挪威食品和安全局,Sunnybrook研究所动物护理委员会和加拿大动物护理委员会批准并按照其进行。
1. 材料准备
- 准备颅窗手术和超声微泡治疗所需的材料。对于慢性颅窗,消毒工具和材料,无菌手术空间以及手术前和手术后药物管理是必要的23,24,25。
- 探头和盖玻片制备
- 检查探头的物理完整性:寻找裂缝和凹痕。确保探头顶部和侧面的电极完好无损。
- 将氰基丙烯酸酯胶水沉积到一个小盘子中。使用涂药器将一层薄薄的胶水铺在探头表面上。
- 将传感器放在玻璃盖玻片上。用力向下按压20-30秒。
注:3D打印模具可用于促进玻璃盖玻片与环形传感器的对齐,确保盖玻片和环形传感器上的牢固和均匀的压力(图2)。 - 检查探头和盖玻片之间是否有气泡。如果有气泡,请取下盖玻片并重复步骤1.2.3,因为空气会阻碍超声波的传播。在室温下固化过夜。
- 一旦粘附在玻璃盖玻片上,请匹配探头(图3)。
注:本协议使用内部制造的锆钛酸铅环形探头(外径 10 mm,厚度 1.4 mm,高度 1.2 mm)35,与 50 Ω阻抗和 0° 相位负载匹配,并具有自定义匹配电路。在厚度模式下,探头以0.82 MHz驱动,在盖玻片下方约1 mm处产生一个圆形焦点。具有相似性质(外径10 mm,厚度1.5 mm,高度1.1 mm)的环形探头已被表征26 ,并广泛用于多光子显微镜实验27,28,29,31,32,36。
- 传感器重复使用和盖玻片更换
- 如果盖玻片破裂或有先前实验的碎屑(例如毛皮、胶水),请更换盖玻片。要除去盖玻片,请将探头和盖玻片浸入丙酮中20分钟来溶解胶水。
注:丙酮可能会影响探头和/或电极的完整性。在继续执行此步骤之前,请与制造商联系。 - 用镊子轻轻拉动盖玻片,检查丙酮是否溶解了胶水。每10分钟检查一次,以避免长时间暴露于丙酮。
- 如果盖玻片破裂或有先前实验的碎屑(例如毛皮、胶水),请更换盖玻片。要除去盖玻片,请将探头和盖玻片浸入丙酮中20分钟来溶解胶水。
2. 动物准备
- 在诱导室中使用医用空气,氧气和异氟醚的混合物麻醉动物。
注:据报道,使用氧气作为载气会影响微气泡的半衰期37,38 ,并降低超声微气泡引起的BBB通透性增加的程度27,但也可能降低缺氧和死亡的风险39。根据项目目标和兽医建议选择载气。也可以使用可注射的麻醉剂,如氯胺酮/木肼嗪鸡尾酒;然而,使用可吸入麻醉剂时,更容易控制麻醉平面和血氧水平。 - 通过进行脚趾捏合,检查动物是否达到了足够的麻醉水平。称量动物以确定葡聚糖,微气泡和药物的剂量。从动物头部取下皮毛,将动物放在立体定向框架上。
- 对于急性实验,必须为葡聚糖和微泡注射建立进入体循环的机会。为此,将27g导管插入尾静脉。
注意:虽然也可以进行眶后注射,但由于多光子成像期间头部区域的工作空间有限,因此建议使用尾静脉。 - 将动物转移到立体定向框架上,并将麻醉切换到鼻锥。使用热源(例如加热垫或装满温水的手套)将动物的核心温度保持在37°C。
- 使用直肠探头监测动物体温,使用脉搏血氧仪监测动物生理学。涂抹眼科软膏。注射适当的术前镇痛药和/或抗炎药( 材料表)。
- 在开始颅窗手术之前,检查麻醉平面和动物的心率,O2 饱和度,呼吸频率和温度。
- 要开始颅窗手术,请通过涂抹脱毛膏和/或使用毛皮剪去除头部的皮毛。去除眼睛之间到颈部前半部分的皮毛(图4A)。
注意:长时间接触脱毛霜会灼伤皮肤。对于慢性颅窗手术,在去除毛皮后,用倍他定和70%EtOH交替擦拭头皮。为无菌手术准备手术空间。无菌必须保持到步骤2.15。 - 要去除头皮,请使用非惯用手握住的镊子沿着矢状缝合线抬起眼睛之间的皮肤。使用弯曲的剪刀,去除皮肤以暴露顶骨(图4B)。如果颅骨或头皮出血,用棉签按压;在进入下一步之前,必须停止出血。
注意:对于急性手术,皮肤可以向后推并使用液体氰基丙烯酸酯胶水或组织粘合剂粘附在颅骨上。 - 用棉签去除覆盖颅骨外表面的骨膜。
- 使用手术显微镜(6-25x)和牙钻(0.5mm钻头毛刺,中速),在顶骨上勾勒出一个圆圈,以标记颅骨上颅窗的所需位置(图5)。避免使用矢状缝合线、lambda 和胸腺,因为这些区域较薄并覆盖大血管。
注意:为了便于钻孔,可以使用标记和模板将颅窗的轮廓绘制到颅骨上(图5A)。对于大鼠来说,钻一个矩形而不是圆形的颅窗可能更容易。由于大鼠颅骨的厚度,在使用0.5毫米钻头完成钻孔过程之前,使用0.7毫米钻头勾勒出致密骨中的颅窗轮廓。 - 用钻头轻轻按压;压力过大会增加对脑组织造成损害的风险。为了防止颅骨在钻孔过程中过热,请使用注射器将生理盐水滴到颅骨上,或涂上一块浸泡在生理盐水中的手术海绵。
- 在钻孔和冷却颅骨之间交替,直到得到的骨岛与颅骨的其余部分分离。通过使用镊子或钻头对骨岛施加轻柔的压力来检查钻孔进度。继续钻孔,直到骨岛与颅骨的其余部分分离。
注意:颅骨最薄区域的小裂缝表明钻孔几乎完成。试图过早地切除骨岛会导致骨片渗透到脑组织中,损坏硬脑膜并引起炎症和出血。 - 使用一对细镊子抓住骨岛的边缘或上部致密骨层,去除骨岛(图6A)。通过涂抹一块预先浸泡在盐水中的手术海绵来确保大脑保持湿润。如果观察到出血,将手术海绵放在出血的区域。在出血停止之前,不要继续下一步。
注意:如果出血在5分钟后持续存在,则动物不能用于多光子成像实验。对于大鼠,如果硬脑膜很厚,可能需要将其取出。要去除硬脑膜,请在操作显微镜和一对细镊子上使用高放大倍率。 - 要放置颅窗,请拿起带有一对镊子的玻璃盖玻片,将一滴盐水滴到一侧,然后将其操纵在颅骨上的孔上。确保盖玻片下没有气泡。
注意:小鼠使用5毫米玻璃盖玻片,大鼠使用8毫米玻璃盖玻片。对于大鼠,由于颅骨的厚度,使用琼脂糖溶液代替盐水来填充盖玻片和大脑之间的空间。换能器及其盖玻片也可以直接粘附在颅骨上,而不是使用单独的盖玻片作为颅窗。对于此选项,请继续执行步骤 3.1。有关详细信息,请参阅 图 1 。 - 在盖玻片的周边铺上一层氰基丙烯酸酯胶(图6B)以将其附着在颅骨上。确保盖玻片下没有胶水。在盖玻片上施加压力,以确保胶水不会与大脑接触。
- 一旦胶水完全干燥,使用牙钻将胶水表面均匀。确保从手术区域清除所有胶水碎屑。
注意:对于慢性颅窗,注射必要的术后药物(见材料表),提供用于伤口护理的软膏和软食,并在加热灯下恢复动物。
3. 环形传感器的放置
- 准备1%(w / v)琼脂糖溶液。在小烧杯或锥形瓶中,加入0.1克琼脂糖和10毫升PBS(1x)或盐水。通过将烧杯放在电炉上或在微波炉中加热溶液(30-45秒),煮沸溶液直到琼脂糖完全溶解。
- 步骤3.2-3.5对时间敏感,因为琼脂糖溶液冷却迅速。将约 0.5 mL 琼脂糖倒入 1 mL 注射器中。
注意:为了保护大脑的完整性,请确保琼脂糖的温度在使用前接近体温。 - 将琼脂糖自由地沉积在颅窗的盖玻片上。
注意:如果组织变白,琼脂糖的温度太高;动物必须被安乐死。如果没有单独的盖玻片覆盖大脑(即,换能器及其盖玻片直接放置在大脑上,参见步骤2.14),那么琼脂糖应该在该步骤中沉积到大脑表面。 - 将换能器放在颅窗上(图6C)。施加牢固的压力,使换能器和颅窗之间的琼脂糖最少。确保换能器居中(XY平面)和平行(Z平面)到颅窗,并且琼脂糖中没有气泡。
- 当琼脂糖冷却到果冻状稠度时,使用刮刀或手术刀从换能器盖玻片的周长中切除多余的琼脂糖。确保探头盖板下方没有气泡。
- 使用刮刀,将一层氰基丙烯酸酯胶涂在换能器盖玻片的周长上,延伸到颅骨,使换能器牢固地粘附在头骨上。
- 保持探头上的牢固压力,直到胶水完全干燥(10-15分钟)。
4. 多光子显微镜成像
- 将动物置于物镜下(图7A)。确保物镜在环形换能器中居中,并与换能器平行(图7B)。如果使用水浸物镜,请在环形探头的中心填充去离子和脱气水。
注意:脱气水对于适当的超声传播很重要。 - 从物镜处于最高位置开始,然后慢慢降低物镜,直到它进入环形换能器内(图7A,B)。确保物镜不会与换能器或盖玻片碰撞。
注意:在目镜之间交替检查物镜的Z位置是否与大脑表面同平面,并通过眼睛检查以确保物镜不会与换能器或盖玻片碰撞。通过尾静脉注射荧光葡聚糖后,通过目镜更容易观察皮囊(图7C)。 - 准备多光子显微镜进行成像。
注意:该协议使用直立式多光子显微镜和20-25倍物镜,其工作距离为2 mm,足以聚焦到盖玻片之外,进入脑实质。 - 准备葡聚糖。按照制造商的说明,将适量的PBS添加到葡聚糖小瓶中。涡旋葡聚糖溶液1-3分钟,以确保葡聚糖粉末完全溶解。将葡聚糖溶液注入尾静脉。
- 设置图像扫描
- 使用目镜,确保物镜与大脑平行。倾斜动物以校正XZ和YZ不对中。
- 在多光子显微镜中选择视场。在超声暴露之前设置 XYZ 扫描,以便在超声暴露之前获得脉管系统的基线图像。
注:典型成像参数如下:深度300-800 μm,步长为2-5 μm,时间栈为10-20。确保物镜在成像过程中不会与探头或盖玻片在最低点接触。
5. 超声波暴露
- 确保所有BNC电缆均已正确连接(图3)。
- 设置一个 XYZT 图像扫描,该扫描的长度足以在超声微气泡处理之前、期间和之后捕获图像堆栈。
- 按照制造商的说明准备微气泡。将微气泡注入尾静脉并开始成像。
注意:微气泡注射可以使用输液泵进行,以确保一致的注射速率,并实现同时进行微气泡注射和成像。如果要在成像过程中注入微气泡,请确保尾静脉可以轻松进入,而无需将探测器暴露在环境光下。 - 开始超声处理。
注:典型的超声处理参数如下:10 ms 周期,机械指数为 0.2-0.4,脉冲重复频率在 1-4 Hz 之间。临床前超声-微气泡研究中使用的超声和微气泡参数已得到广泛研究,并在文献中有充分的记录(例如,参见 40 的综述)。 - 在整个超声处理期间和超声处理结束后继续多光子成像。注意血管中的葡聚糖外渗,因为这表明BBB通透性增加。
注意:如果在血管外空间检测到葡聚糖,但在视野的外围,则在视野之外可能存在受影响的血管。这可能是由于换能器与物镜焦点未对准造成的。在这种情况下,通过移动物镜或重新定位动物来调整视野比重新调整换能器更容易。 - 一旦影像学检查完成,在深度麻醉或CO2 窒息下对动物颈椎脱位实施安乐死。对于慢性颅窗,将一层牙胶铺在暴露的颅骨上。
注意:对于慢性颅窗,由于步骤2.8中切除头皮,可以缝合窗户周围的皮肤,尽管这不是必需的。
6. 图像分析
- 导出图像堆栈。
- 使用图像分析软件(例如,奥林巴斯Fluoview,ImageJ / FIJI,Bitplane Imaris,ThermoFisher Scientific Amira)和/或编程工具(例如Python,MATLAB)分析图像。
结果
成功的超声微气泡治疗可以通过荧光葡聚糖从血管内到血管外腔的外渗来检测(图8),表明BBB通透性增加。根据环形传感器的压力场,椎管和/或毛细管将受到影响。
为了评估超声微气泡处理引起的血管变化,可以在超声微气泡处理之前,期间和之后测量目标血管的直径(图9)。这可以在市售软件(例如,奥林巴斯Fluoview软件)中手动完成。在图像采集期间,推注葡聚糖注射和线扫描也可用于评估血流量30,41。为了评估右旋糖泄漏作为药物递送的代表性模型的动力学,可以使用MATLAB26,27,29,41等工具评估血管内和血管外间隙之间的信号强度(图10)。
可以使用ImageJ / FIJI实现进一步的图像处理。ImageJ / FIJI是一款与MATLAB兼容的开源软件,非常适合在生物图像分析中进行常见分析,例如测量血管变化或荧光物体之间的长度或距离(例如,β淀粉样蛋白斑块到血管)。在 ImageJ/FIJI 中创建的图像处理管道可以通过编写自定义宏来自动化。
更复杂的分析,如血管的3D分割和细胞追踪,可以使用更先进的半自动化软件来实现(图11)。分割后,可以进行更具体的分析,例如根据直径,分支,曲折模式和流动方向将血管分类为小动脉,小静脉或毛细血管42,43。机器学习算法也被开发出来,以自动化血管分割22,44。
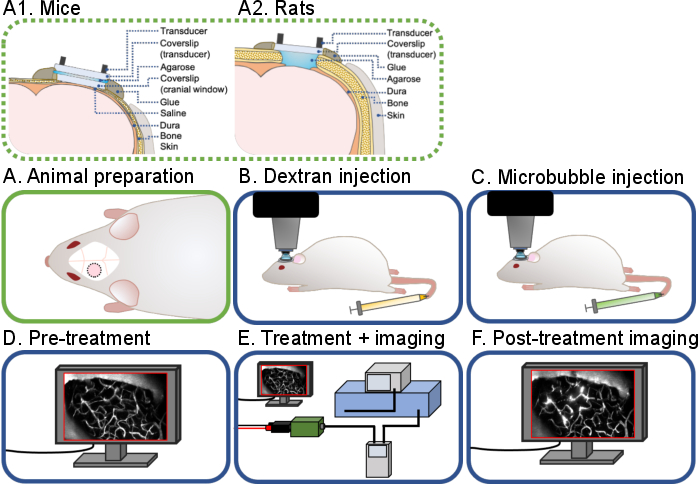
图1:活体内多光子超声-微气泡脑实验的一般工作流程。显示了该协议中描述的活体内多光子超声 - 微气泡脑实验的一般工作流程。有6个步骤:(A)(A)小鼠和(A2)大鼠的动物制剂,(B)葡聚糖注射液,(C)微气泡注射液,(D)预处理成像,(E)处理和成像,(F)治疗后成像和数据分析。请点击此处查看此图的放大版本。
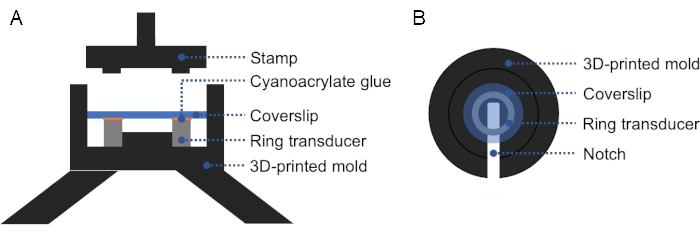
图2:3D打印模具的横截面和顶视图。在环形探头的顶面上涂上一层薄薄的氰基丙烯酸酯胶,并在顶部放置盖玻片。可以使用印章对盖玻片和环形传感器施加牢固甚至的压力。(B)模具的俯视图。可以在模具中添加一个凹口,以方便去除准备好的传感器。请点击此处查看此图的放大版本。
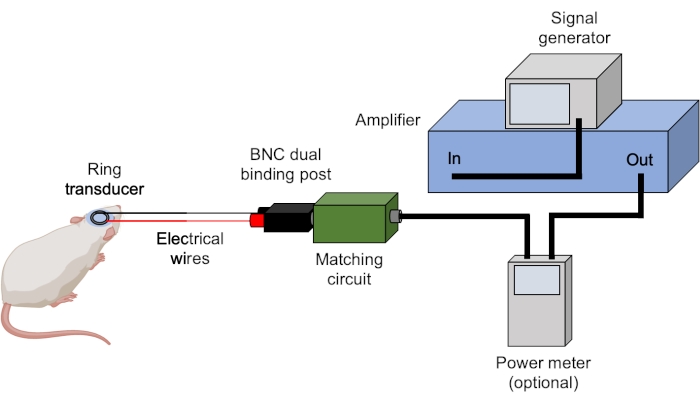
图3:超声设置。 图中显示了用于超声实验的典型硬件。超声波参数由信号发生器设置和触发,并由放大器放大。功率计可用于在将信号发送到匹配盒(与传感器匹配)之前记录正向和反射功率。除非另有说明,否则所有连接均使用BNC电缆实现。 请点击此处查看此图的放大版本。
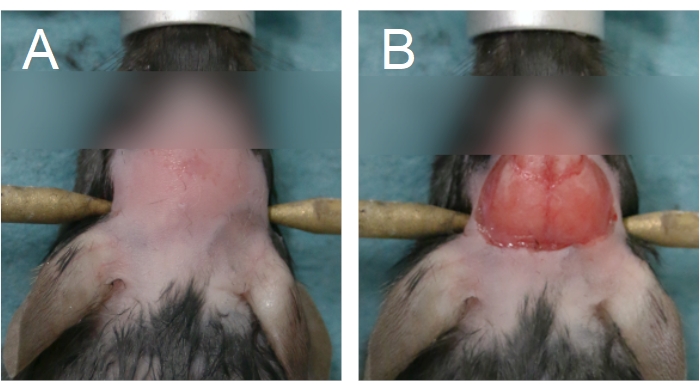
图 4:去除毛皮和去除头皮的区域。 (A) 毛皮去除应从眼睛之间开始,一直延伸到颈部前半部分。(B)去除头皮应足以暴露顶骨。在继续之前必须停止出血。 请点击此处查看此图的放大版本。
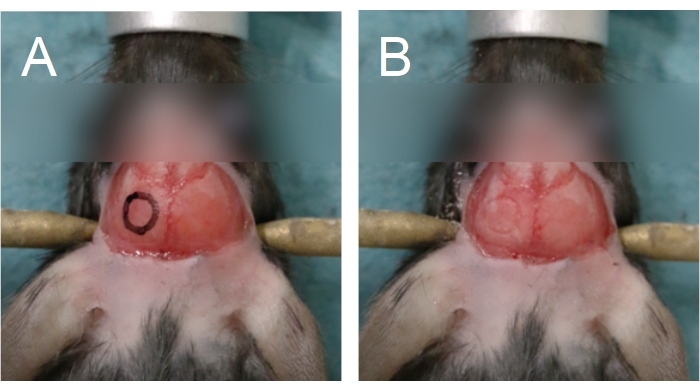
图5:颅窗轮廓。 颅窗位于顶骨上。(A)颅窗的轮廓可以绘制到颅骨上,以帮助钻孔过程。(B)在钻穿致密的骨头后可以看到颅窗的轮廓。 请点击此处查看此图的放大版本。
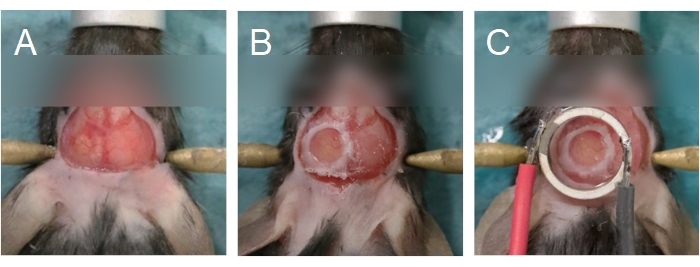
图 6:颅窗和换能器对齐。 (A) 颅窗是在顶骨上创建的。骨岛已被移除,露出下面的大脑。(B)当使用氰基丙烯酸酯胶将玻璃盖玻片密封在颅骨上时,颅窗是完整的。(C)换能器以颅窗为中心,并使用氰基丙烯酸酯胶粘附。 请点击此处查看此图的放大版本。
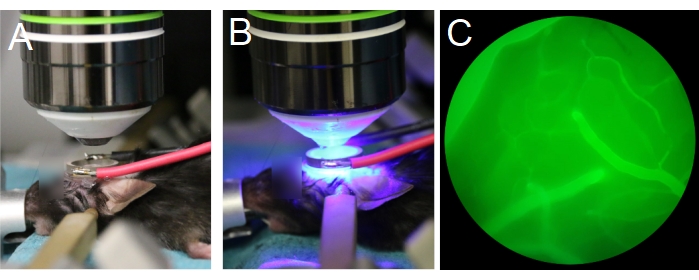
图 7:物镜和换能器的定位。 (A,B) 物镜以环形换能器为中心。(C)在落射荧光下,通过目镜可以看到充满荧光葡聚糖的血管。 请点击此处查看此图的放大版本。
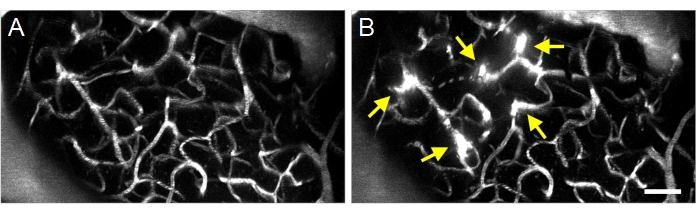
图8:超声微气泡的最大投影多光子图像诱导BBB通透性增加。超声微气泡治疗前和(B)脉管系统的最大投影图像。成功的超声微气泡治疗可以通过观察治疗后BBB通透性的增加来确认,可视化为荧光葡聚糖外渗(箭头)。比例尺:50 μm。请单击此处查看此图的放大版本。
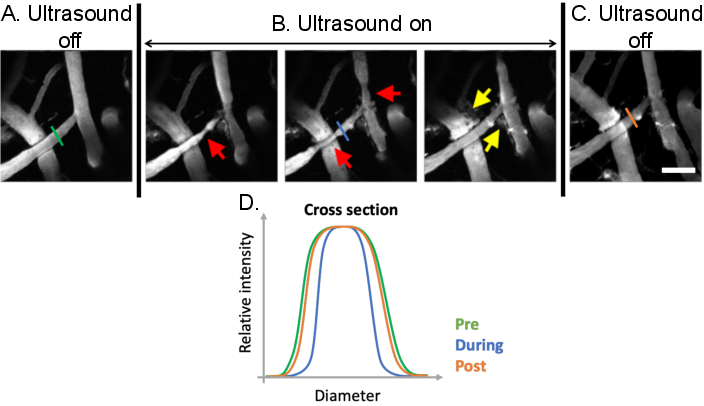
图9:超声微泡治疗诱导的血管舒缩分析。 超声微泡治疗之前、期间和之后大脑血管的最大投影图像。微气泡存在于所有图像中。与(A)预处理条件相比,在超声微泡治疗期间可以观察到明显的血管舒缩(B)(红色箭头)。超声微气泡介导的BBB通透性增加在从血管内到血管外腔的荧光葡聚糖泄漏(黄色箭头)后也很明显。(C)当超声波关闭时,血管直径恢复到治疗前的基线大小。(D)通过绘制超声微气泡治疗前、中、后目标血管的直径,可以分析血管变化。比例尺:100μm(未发表的作品)。 请点击此处查看此图的放大版本。
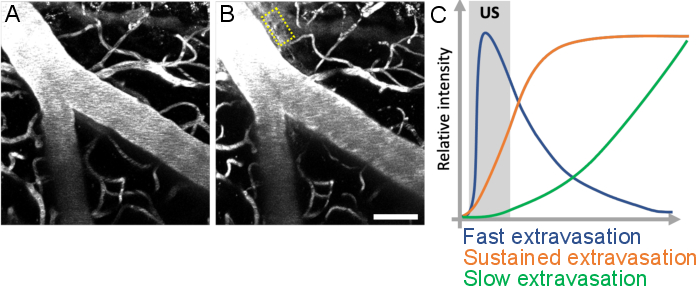
图10:超声微气泡处理后的泄漏动力学分析。BBB通透性的增加被可视化为荧光葡聚糖从血管内泄漏到血管外空间。当比较超声微气泡处理之前和(B)之后获得的图像堆栈时,BBB渗透率的变化是显而易见的。(C)通过跟踪血管外室(黄色矩形)中葡聚糖的强度,体积和速度,可以分析泄漏动力学。比例尺:50 μm.(未发表的作品。请点击此处查看此图的放大版本。
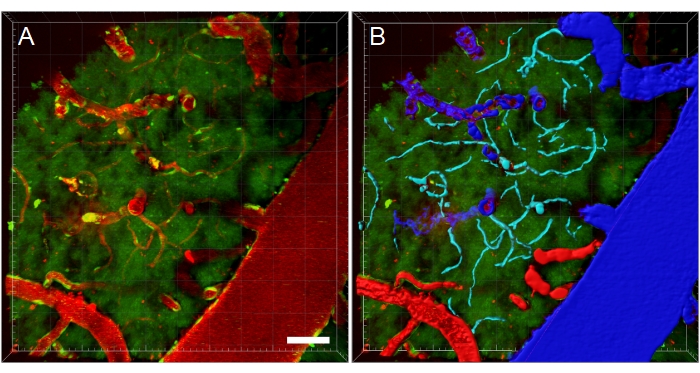
图11:多光子显微镜XYZ堆栈的血管分割(A)转基因EGFP大鼠血管的深度(XYZ)堆栈。通过静脉注射荧光德州红70 kDa葡聚糖(红色)来观察血管。绿色通道显示荧光细胞和组织自发荧光。(B)创建血管的3D重建,然后根据血管类型进行颜色编码,以方便进行特定类型的分析。静脉/小静脉为蓝色,动脉/小动脉为红色,毛细血管为青色。比例尺:50 μm。使用Bitplane Imaris创建的重建。请点击此处查看此图的放大版本。
讨论
活体多光子显微镜监测大脑是研究超声暴露期间大脑反应的宝贵工具。据我们所知,这里描述的方案是在超声微气泡治疗期间对脑实质进行多光子显微镜成像的唯一方法。颅窗的创建和环形换能器的使用允许以高空间和时间分辨率实时监测血管,细胞和其他下游对超声微气泡治疗的反应。其他小组在超声微气泡治疗完成后进行了多光子显微镜成像,从而错过了脑实质对治疗的实时反应19。所描述的程序提供了改进的时间控制,允许收集可能有助于阐明超声微气泡治疗背后的急性机制的数据。可以从采集的图像堆栈中提取和分析定量和定性数据,例如外渗动力学27,29,30,β淀粉样蛋白斑块体积的变化31和细胞动力学32。
在整个协议中突出显示了几个故障排除步骤。首先,强调了特别容易出现操作失误的手术步骤,例如在颅窗手术期间使用琼脂糖和放置换能器。还提供了预防动物不适和死亡的步骤,包括在手术期间监测动物生理学,并在注射前彻底涡旋葡聚糖。其次,还强调了换能器的物理规格,以及物镜,换能器和颅窗的对准。环形换能器的规格及其声学特性必须根据所使用的物镜和动物模型来确定。具体而言,环形换能器的内径必须足够大以包围物镜,但又必须足够小,以便牢固地安装在动物的头骨上。此外,换能器的焦点区域必须与所用物镜的范围一致。
一个常见的挑战是颅窗和环形换能器相对于物镜的角度。物镜与颅窗和换能器的正确对中(XY)和对准(Z)可确保换能器的焦点区域以及治疗脑组织的区域与成像视野对齐,并降低成像过程中物镜和换能器之间碰撞的风险。通过调整动物的头部位置和/或旋转固定动物的立体定向框架,可以实现对齐。
应根据研究目的选择显微镜组件(例如,探测器、分束器)和图像采集参数。在这里,由于存在位于物镜和大脑之间的盖玻片和环形换能器,因此使用了长焦距(>2 mm)的物镜。还建议使用正置显微镜,因为它可以留出更多的空间来操纵动物,特别是对于大脑实验。为了捕获超声微气泡引起的血管内染料泄漏的动力学,有利于高时间分辨率,这可以通过使用共振扫描系统来实现。将其与高灵敏度检测系统(如砷化镓磷化物(GaAsP)探测器)相结合,也将获得更有利的图像。
所提出的实验过程有几个局限性。首先,外科手术是相当侵入性的,并且据报道会引起炎症45,尽管炎症可以最小化46。此外,经颅窗手术诱导的免疫反应在手术后2-4周消退23,24,25。此外,钻孔过程,特别是当以过大的力或速度进行时,由于产生的热量,振动和施加的压力,可能会对下层组织造成损害。颅窗手术和多光子成像也被观察到会影响脑温47。通过精心创建原始的颅窗,适当恢复具有慢性颅窗的动物以及使用具有反馈控制的加热源维持正常体温,可以在一定程度上减少这些限制。其次,成像深度受所用显微镜和物镜的限制。例如,如果没有更多的侵入性措施,例如去除覆盖的皮质组织48,或者结合使用微透镜与皮质渗透49,就无法研究超声微气泡治疗在更深部大脑结构(如海马体)中的效果。使用工作距离较长的物镜可以在一定程度上解决此问题,但光穿透在更深处也受到限制。
虽然该协议的代表性图像是从野生型啮齿动物获得的,但所提出的实验程序也可以应用于转基因动物和疾病模型,例如阿尔茨海默病31。与BBB调节无关的超声实验,例如超声诱导的神经调节,也可以使用该协议进行监测33,34。其他可能的应用可以通过使用不同的显微镜或探测器设置来实现,例如将共聚焦显微镜与超高速相机配对50。虽然由于激发体积大,共聚焦显微镜中的光漂白和光毒性相对较差,但超高速成像可以以高时间分辨率可视化脑毛细血管内皮细胞 - 微气泡相互作用,这可以进一步阐明驱动超声 - 微气泡BBB治疗的机制。总而言之,所描述的方案提供了一种实时监测超声微泡BBB实验诱导的血管和细胞效应的方法,提供了一种工具来进一步确定驱动这些治疗的机制,以及阐明脑实质对超声微气泡治疗的下游反应。
披露声明
Charissa Poon,Melina Mühlenpfordt,Marieke Olsman和Catharina de Lange Davies宣布没有财务或非财务竞争利益冲突。Spiros Kotopoulis是一名全职员工,拥有EXACT Therapeutics AS的股份,该公司开发超声波和微气泡/集群增强药物递送。Kullervo Hynynen是FUS Instruments的创始人,他从中获得了非研究相关的支持。
致谢
动物的住房由比较医学核心设施(CoMed,NTNU)提供。图 3 是在 BioRender.com 中创建的。视频录制和编辑由NTNU自然科学学院的网站管理员Per Henning完成。该项目由挪威科技大学(挪威特隆赫姆NTNU),挪威研究委员会(RCN 262228),加拿大卫生研究院(FDN 154272),国家卫生研究院(R01 EB003268)和Sunnybrook健康科学中心聚焦超声研究的Temerty主席资助。
材料
| Name | Company | Catalog Number | Comments |
| Ring transducer placement | |||
| Agarose (powder) | Sigma-Aldrich | A9539 | |
| Beaker or Erlenmeyer flask (50 ml) | VWR | 213-0462 or 214-1130 | |
| Cyanoacrylate glue (gel) | Loctite | 1363589 | |
| Glass coverslips (13 mm) | Thermo Fisher Scientific | CB00130RA120MNT0 | Coverslip for ring transducer. |
| Hot plate or microwave | Corning | PC-400D | To heat agarose solution. |
| PBS (1X) | Sigma-Aldrich | P4417 | |
| Ring transducer | Custom-made | Custom-made | Custom-made. E.g. https://doi.org/10.1109/ULTSYM.2014.0518 |
| Rubber stopper | VWR | 217-0867 | |
| Animal preparation and drugs | |||
| Bupivacaine*A | Aspen | 169912 | Dose: 1 mg/kg, s.c., local anesthetic injected at incision site. |
| Buprenorphine*A | Indivior | 521634 | Dose mouse: 0.05-0.1 mg/kg, s.c., opioid, administer pre-surgery. |
| Buprenorphine*A | Indivior | 521634 | Dose rat: 0.01-0.05 mg/kg, s.c.. |
| Carprofen*C | Pfizer | DIN 02255693 | Dose: 5 mg/kg, s.c., NSAID, adminster post-surgery. |
| Depilatory cream | Veet | N/A | For complete fur removal after trimming. |
| Dexamethasone*C | Sandoz | DIN 00664227, 2301 | Dose: 3 mg/kg, i.m., corticosteroid, reduces cerebral edema, administer pre-surgery. |
| Enrofloxacin*C | Bayer | DIN: 02249243 | Dose: 5 mg/kg, i.p., antibiotic, administer post-surgery. |
| Fur clippers | Aesculap | 90200714 | Exacta/Isis. |
| Heating pad | Physitemp Instruments INC | HP-1M | |
| Isoflurane | Baxter | ESDG9623C | Dose: 3% induction, 1% maintenance; anesthetic. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose mouse: 2-3 mg/kg, s.c., NSAID, administer pre-surgery. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose rat: 1 mg/kg, s.c. |
| Pulse oximeter | STARR Life Sciences Corp | N/A | MouseOx. |
| Stereotaxic frame | Kopf | Kopf 900 | |
| Sterile ophthalmic ointment | Théa | 597562 | Viscotears. |
| Tail vein catheter (24 G) | BD Neoflon | 391350 | |
| * Discuss dosing and type of administration with veterinarian prior to use. A For acute window surgeries, C For chronic window surgeries. Dose for mice and rats are the same unless otherwise specified. | |||
| Material and equipment for cranial window placement | |||
| Alcohol swabs | BD | 326895 | |
| Curved fine surgical scissors | Fine Science Tools | 14002-12 | |
| Cotton or fibreless swabs | Chemtronics | CX50 | |
| Cyanoacrylate glue (gel) | Loctite | 1594457 (gel), 230992 (liquid) | If unavailable, liquid cyanoacrylate glue can be mixed with extra-fine acrylate powder. |
| Dental cement | Lang Dental | Jet Set-4 Denture Repair Package | |
| Dental micromotor hand drill | FOREDOM | K.1070-2 | High speed rotary micromotor kit with 2.35 mm collet. |
| Forceps | Fine Science Tools | 11152-10, 11370-40 | |
| Glass coverslips | Thermo Fisher Scientific | CB00050RA120MNT0 (5 mm) | Mouse cranial windows. |
| Glass coverslips | Thermo Fisher Scientific | CB00080RA120MNT0 (8 mm) | Rat cranial windows. |
| Micro drill burrs (0.5 mm) | Meisinger | HM71005 (0.5 mm) | |
| Micro drill burrs (0.7 mm) | Meisinger | HM71007 (0.7 mm) | |
| Stereo microscope | Nikon | SMZ645 | |
| Surgical gelatin sponge | Ethicon | MS0005 | |
| Vetbond Tissue adhesive | 3M | 1469SB | |
| Weigh boats / trays | VWR | 10803-148 | |
| * Autoclave drapes, tools, materials, and gowns, and use sterile surgical gloves, for chronic cranial window surgeries. | |||
| Multiphoton microscopy | |||
| 20x water immersion objective | Olympus | XLUMPLFLN20 XW | Numerical aperture 1.0, working distance 2.0 mm. |
| Fluorescent dextran (e.g. FITC 70 kDa) | Sigma Aldrich | 46945 | Recommended 10 kDa-2 MDa. |
| MaiTai DeepSee Ti:Sapphire laser oscillator | Spectra-Physics | N/A | |
| SliceScope microscope | Scientifica | N/A | |
| Ultrasound treatment | |||
| 50 dB RF Amplifier | E&I | 2100L | |
| Matching circuit | Custom-made | Custom-made | Custom-made. |
| Microbubbles | Bracco Imaging | N/A | SonoVue (Bracco Imaging, Europe). Dose 1 ml/kg. |
| Microbubbles | Lantheus | N/A | Definity (Lantheus Medical Imaging, North America). Dose 0.02-0.04 ml/kg. |
| Signal generator | Agilent Technologies | 33500B |
参考文献
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Kalladka, D., et al. Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 388 (10046), 787-796 (2016).
- Pardridge, W. M. The blood-brain barrier: Bottleneck in brain drug development. the journal of the American Society for Experimental NeuroTherapeutics. 2 (1), 12 (2005).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Advanced Drug Delivery Reviews. 64 (7), 614-628 (2012).
- Nagy, Z., Pappius, H. M., Mathieson, G., Hüttner, I. Opening of tight junctions in cerebral endothelium. I. Effect of hyperosmolar mannitol infused through the internal carotid artery. The Journal of Comparative Neurology. 185 (3), 569-578 (1979).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220 (3), 640-646 (2001).
- Burgess, A., et al. Alzheimer disease in a mouse model: MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior. Radiology. 273 (3), 736-745 (2014).
- Abrahao, A., et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using MR-guided focused ultrasound. Nature Communications. 10 (1), 4373 (2019).
- Hynynen, K., Jones, R. M. Image-guided ultrasound phased arrays are a disruptive technology for non-invasive therapy. Physics in Medicine and Biology. 61 (17), 206-248 (2016).
- Burgess, A., et al. Targeted delivery of neural stem cells to the brain using MRI-guided focused ultrasound to disrupt the blood-brain barrier. PLoS One. 6 (11), 27877 (2011).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- Downs, M. E., et al. Long-term safety of repeated blood-brain barrier opening via focused ultrasound with microbubbles in non-human primates performing a cognitive task. PLOS One. 10 (5), 0125911 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103-112 (2019).
- Bing, C., et al. Transcranial opening of the blood-brain barrier in targeted regions using a stereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2, 13 (2014).
- O'Reilly, M. A., Hynynen, K. Blood-brain barrier: Real-time feedback-controlled focused ultrasound disruption by using an acoustic emissions-based controller. Radiology. 263 (1), 96-106 (2012).
- Jones, R. M., Deng, L., Leung, K., McMahon, D., O'Reilly, M. A., Hynynen, K. Three-dimensional transcranial microbubble imaging for guiding volumetric ultrasound-mediated blood-brain barrier opening. Theranostics. 8 (11), 2909-2926 (2018).
- Jones, R. M., McMahon, D., Hynynen, K. Ultrafast three-dimensional microbubble imaging in vivo predicts tissue damage volume distributions during nonthermal brain ablation. Theranostics. 10 (16), 7211-7230 (2020).
- Arvanitis, C. D., et al. Mechanisms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption. Proceedings of the National Academy of Sciences. 115 (37), 8717-8726 (2018).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. 33, (2012).
- McCarter, J. F., et al. Clustering of plaques contributes to plaque growth in a mouse model of Alzheimer's disease. Acta Neuropathologica. 126 (2), 179-188 (2013).
- Cruz Hernández, J. C., et al. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer's disease mouse models. Nature Neuroscience. 22 (3), 413-420 (2019).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Cao, V. Y., et al. In vivo two-photon imaging of experience-dependent molecular changes in cortical neurons. Journal of Visualized Experiments. (71), e50148 (2013).
- Nhan, T., Burgess, A., Hynynen, K. Transducer design and characterization for dorsal-based ultrasound exposure and two-photon imaging of in vivo blood-brain barrier disruption in a rat model. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 60 (7), 1376-1385 (2013).
- Cho, E. E., Drazic, J., Ganguly, M., Stefanovic, B., Hynynen, K. Two-photon fluorescence microscopy study of cerebrovascular dynamics in ultrasound-induced blood-brain barrier opening. Journal of Cerebral Blood Flow & Metabolism. 31 (9), 1852-1862 (2011).
- Burgess, A., Nhan, T., Moffatt, C., Klibanov, A. L., Hynynen, K. Analysis of focused ultrasound-induced blood-brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248 (2014).
- Nhan, T., et al. Drug delivery to the brain by focused ultrasound induced blood-brain barrier disruption: Quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy. Journal of Controlled Release. 172 (1), 274-280 (2013).
- Nhan, T., Burgess, A., Lilge, L., Hynynen, K. Modeling localized delivery of Doxorubicin to the brain following focused ultrasound enhanced blood-brain barrier permeability. Physics in Medicine and Biology. 59 (20), 5987-6004 (2014).
- Poon, C. T., et al. Time course of focused ultrasound effects on β-amyloid plaque pathology in the TgCRND8 mouse model of Alzheimer's disease. Scientific Reports. 8 (1), 14061 (2018).
- Poon, C., Pellow, C., Hynynen, K. Neutrophil recruitment and leukocyte response following focused ultrasound and microbubble mediated blood-brain barrier treatments. Theranostics. 11 (4), 1655-1671 (2021).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Chu, P. -. C., et al. Neuromodulation accompanying focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 5 (1), 15477 (2015).
- Yddal, T., Kotopoulis, S., Gilja, O. H., Cochran, S., Postema, M. . Transparent glass-windowed ultrasound transducers. , 2079-2082 (2014).
- Santos, M. A., Goertz, D. E., Hynynen, K. Focused ultrasound hyperthermia mediated drug delivery using thermosensitive liposomes and visualized with in vivo two-photon microscopy. Theranostics. 7 (10), 2718-2731 (2017).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Molecular Imaging and Biology. 14 (1), 40-46 (2012).
- Baum, J. A. The carrier gas in anaesthesia: Nitrous oxide/oxygen, medical air/oxygen and pure oxygen. Current Opinion in Anaesthesiology. 17 (6), 513-516 (2004).
- Poon, C., McMahon, D., Hynynen, K. Noninvasive and targeted delivery of therapeutics to the brain using focused ultrasound. Neuropharmacology. , 20-37 (2017).
- Joo, I. L., et al. Early neurovascular dysfunction in a transgenic rat model of Alzheimer's disease. Scientific Reports. 7, 46427 (2017).
- Dorr, A., et al. Amyloid-β-dependent compromise of microvascular structure and function in a model of Alzheimer's disease. Brain: A Journal of Neurology. 135, 3039-3050 (2012).
- Kim, T. N., et al. Line-scanning particle image velocimetry: An optical approach for quantifying a wide range of blood flow speeds in live animals. PLOS One. 7 (6), 38590 (2012).
- Teikari, P., Santos, M., Poon, C., Hynynen, K. Deep learning convolutional networks for multiphoton microscopy vasculature segmentation. arXiv. , (2016).
- Denes, A., et al. Surgical manipulation compromises leukocyte mobilization responses and inflammation after experimental cerebral ischemia in mice. Frontiers in Neuroscience. 7, 00271 (2014).
- Koletar, M. M., Dorr, A., Brown, M. E., McLaurin, J., Stefanovic, B. Refinement of a chronic cranial window implant in the rat for longitudinal in vivo two-photon fluorescence microscopy of neurovascular function. Scientific Reports. 9 (1), 5499 (2019).
- Podgorski, K., Ranganathan, G. Brain heating induced by near-infrared lasers during multiphoton microscopy. Journal of Neurophysiology. 116 (3), 1012-1023 (2016).
- Ulivi, A. F., et al. Longitudinal two-photon imaging of dorsal hippocampal CA1 in live mice. Journal of Visualized Experiments: JoVE. (148), e59598 (2019).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Beekers, I., et al. Combined confocal microscope and Brandaris 128 ultra-high-speed camera. Ultrasound in Medicine & Biology. 45 (9), 2575-2582 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。