Method Article
Microscopia Multifotol Intravital em Tempo Real para visualizar tratamentos focados de ultrassom e microbolhas para aumentar a permeabilidade da barreira hematoencefálica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve os procedimentos cirúrgicos e técnicos que permitem imagens de fluorescência multifotona em tempo real do cérebro de roedores durante tratamentos de ultrassom e microbolhas focados para aumentar a permeabilidade da barreira hematoencefálica.
Resumo
A barreira hemencefálica (BBB) é um desafio fundamental para o sucesso da entrega de drogas ao cérebro. A exposição ao ultrassom na presença de microbolhas tem emergido como um método eficaz para aumentar transitoriamente e localmente a permeabilidade do BBB, facilitando o transporte para-e transcelular de drogas em todo o BBB. A imagem da vasculatura durante o tratamento de ultrassom-microbolhas fornecerá insights valiosos e novos sobre os mecanismos e dinâmicas dos tratamentos de ultrassom-microbolhas no cérebro.
Aqui, apresentamos um procedimento experimental para microscopia multifotílica intravital usando uma janela craniana alinhada com um transdutor de anel e uma lente objetiva de 20x. Esta configuração permite imagens de alta resolução espacial e temporal do cérebro durante tratamentos de microbolhas de ultrassom. O acesso óptico ao cérebro é obtido através de uma janela craniana de crânio aberto. Resumidamente, um pedaço de 3-4 mm de diâmetro do crânio é removido, e a área exposta do cérebro é selada com uma mancha de vidro. Um transdutor de anel de 0,82 MHz, que é anexado a uma segunda mancha de vidro, é montado em cima. Agarose (1% c/v) é usado entre o deslizamento de tampa do transdutor e o deslizamento de tampa que cobre a janela craniana para evitar bolhas de ar, que impedem a propagação do ultrassom. Quando procedimentos cirúrgicos estéreis e medidas anti-inflamatórias são tomadas, tratamentos de ultrassom-microbolhas e sessões de imagem podem ser realizados repetidamente ao longo de várias semanas. Os conjugados fluorescentes do dextran são injetados por via intravenosa para visualizar a vasculatura e quantificar os efeitos induzidos por ultrassom-microbolhas (por exemplo, cinética de vazamento, alterações vasculares). Este artigo descreve a colocação da janela craniana, colocação do transdutor de anel, procedimento de imagem, etapas comuns de solução de problemas, bem como vantagens e limitações do método.
Introdução
Um dos principais desafios para o tratamento de distúrbios neurológicos é a presença da barreira hemencefálica (BBB). O BBB limita moléculas hidrofílicas, carregadas, polares e grandes (> 400 Da) de entrar no cérebro parenchyma1. Um método usado atualmente para fornecer terapêutica através do BBB no parnchyma cerebral é usar injeções intracranianas estereotáticas2. Outros métodos menos invasivos em investigação são dificultados pela complexidade das técnicas utilizadas, como o desenho de medicamentos para entrega mediada por receptores em todo o BBB3, ou são limitados na precisão espacial de áreas alvo, como injeções intranasais4 ou administração de soluções hiperosmóticas5.
O uso de ultrassom em conjunto com microbolhas injetadas sistemicamente, um agente de contraste de ultrassom, tem sido desenvolvido como meio não invasivo para aumentar transitoriamente a permeabilidade do BBB6. Usando um transdutor 7 focado ou uma matriz de transdutores em fases direcionadas8,9, o ultrassom pode ser direcionado para áreas selecionadas no cérebro com precisão de nível milimétrico, minimizando efeitos fora do alvo. Os tratamentos de microbolhas de ultrassom podem ser personalizados para a anatomia cerebral de cada sujeito usando orientações de ressonância magnética7,10,11,12,13,14 ou quadros estereotáticos15. Além disso, a extensão do aumento da permeabilidade do BBB pode ser controlada em tempo real, monitorando as emissões acústicas de microbolhas16,17,18. Ensaios clínicos que investigam a segurança e a viabilidade dos tratamentos de ultrassom-microbolhas estão atualmente em andamento em todo o mundo (por exemplo, ClinicalTrials.gov identificador NCT041118764).
Os tratamentos BBB de ultrassom são tipicamente avaliados pela confirmação do tratamento induzido aumentos na permeabilidade do BBB, visualizados em ressonância magnética aprimorada em contraste, ou por extravasação de corante em imagem in vivo ou histologia ex vivo. No entanto, a maioria das análises microscópicas foram realizadas ex vivo, após a conclusão dos tratamentos de ultrassom-microbolhas11,19, perdendo assim as respostas biológicas dinâmicas durante, e imediatamente após a exposição ao ultrassom. Imagens em tempo real realizadas durante a exposição ao ultrassom podem ajudar na compreensão dos mecanismos que conduzem os tratamentos BBB de ultrassom e respostas a jusante, o que pode aumentar nossa compreensão de suas aplicações terapêuticas. Além disso, o uso de janelas cranianas crônicas com técnicas de imagem in vivo permitiria a estudos longitudinais avaliarem aspectos temporais dos tratamentos de ultrassom-microbolhas.
O objetivo deste protocolo é descrever os procedimentos cirúrgicos e técnicos necessários para a realização de imagens multifotonas em tempo real de tratamentos de ultrassom-microbolhas para estudos agudos e crônicos em roedores (Figura 1). Isso é conseguido em duas partes: primeiro, criar uma janela craniana para permitir a imagem in vivo, e segundo, montar um transdutor de anel na parte superior para permitir a sonicação e a imagem simultâneas. As janelas cranianas têm sido amplamente utilizadas por neurocientistas para imagens in vivo de acoplamento neurovascular20, β-amilóide pathogenesis21, neuroimunologia22, entre outros. Neste protocolo, são descritos procedimentos cirúrgicos para a criação de janelas cranianas agudas (não recuperação) e crônicas (recuperação) no crânio do rato e do rato. As metodologias das janelas cranianas, particularmente para experimentos crônicos, foram bem documentadas23,24,25. Para ser coerente com a literatura existente, os termos "agudo" e 'crônico' serão utilizados ao longo deste protocolo. O design de transdutores de anel para imagens in vivo também foi descrito anteriormente26. Apesar da disponibilidade dessas técnicas e dos insights que podem ser obtidos a partir de imagens em tempo real de tratamentos de ultrassom-microbolhas, há muito poucos laboratórios de pesquisa que publicaram com sucesso a literatura usando essa técnica26,27,28,29,30,31,32 . Como tal, neste protocolo, são descritos os detalhes cirúrgicos e técnicos da realização desses experimentos de ultrassom-microbolhas em tempo real. Embora os parâmetros de sônica e imagem especificados tenham sido otimizados para experimentos BBB, outros efeitos da exposição ao ultrassom ao cérebro, como neuromodulação33,34, monitoramento de placas β-amilóide31 e respostas de células imunes32, também podem ser investigados usando essa técnica.
Protocolo
Todos os procedimentos experimentais a seguir foram aprovados e conduzidos de acordo com a Autoridade Norueguesa de Alimentos e Segurança, o Comitê de Cuidados com Animais do Sunnybrook Research Institute e o Conselho Canadense de Cuidados com Animais.
1. Preparação do material
- Prepare os materiais necessários para a cirurgia da janela craniana e os tratamentos de microbolhas de ultrassom. Para janelas cranianas crônicas, ferramentas e materiais esterilizados, um espaço cirúrgico estéril e administração de medicamentos pré e pós-cirurgia são necessários23,24,25.
- Preparação de transdutor e deslizamento de tampas
- Verifique a integridade física do transdutor: procure por rachaduras e amassados. Certifique-se de que os eletrodos na parte superior e lateral do transdutor estão intactos.
- Deposite cola cianoacrilato em um prato pequeno. Use um aplicador para espalhar uma fina camada de cola na superfície do transdutor.
- Coloque o transdutor na tampa do vidro. Pressione firmemente para 20-30 s.
NOTA: Um molde impresso em 3D pode ser usado para facilitar o alinhamento da tampa de vidro com o transdutor do anel, garantindo firme e até mesmo pressão sobre o deslizamento de tampas e transdutor de anel (Figura 2). - Verifique se há bolhas entre o transdutor e o deslizamento de tampas. Se houver bolhas, retire a tampa e repita a partir do passo 1.2.3., pois o ar impede a propagação do ultrassom. Cura durante a noite à temperatura ambiente.
- Uma vez aderido a uma mancha de vidro, combine com o transdutor (Figura 3).
NOTA: Este protocolo utiliza um transdutor de anel de titanto de chumbo fabricado internamente (10 mm de diâmetro externo, 1,4 mm de espessura, 1,2 mm de altura)35, combinado com uma impedância de 50 Ω e carga de fase 0° com um circuito de correspondência personalizado. O transdutor é acionado a 0,82 MHz no modo de espessura, produzindo um ponto focal circular aproximadamente 1 mm abaixo do deslizamento de tampas. Transdutores de anel de propriedades similares (10 mm de diâmetro externo, 1,5 mm de espessura, 1,1 mm de altura) foram caracterizados26 e utilizados extensivamente para experimentos de microscopia multifotônio27,28,29,31,32,36.
- Reutilização de transdutor e substituição de deslizamento de tampas
- Substitua o deslizamento se estiver rachado ou tiver detritos (por exemplo, pelos, cola) do experimento anterior. Para remover o deslizamento, dissolva a cola submergindo o transdutor e cubra o acetona por 20 minutos.
NOTA: A acetona pode afetar a integridade do transdutor e/ou eletrodos. Verifique com o fabricante antes de prosseguir com esta etapa. - Verifique se a acetona dissolveu a cola puxando suavemente o deslizamento com fórceps. Verifique uma vez a cada 10 minutos para evitar exposição prolongada de acetona.
- Substitua o deslizamento se estiver rachado ou tiver detritos (por exemplo, pelos, cola) do experimento anterior. Para remover o deslizamento, dissolva a cola submergindo o transdutor e cubra o acetona por 20 minutos.
2. Preparação animal
- Anestesiar o animal usando uma mistura de ar médico, oxigênio e isoflurano em uma câmara de indução.
NOTA: O uso de oxigênio como gás transportador tem sido relatado para afetar a meia-vida dos microbolhas37,38 e diminuir a magnitude do ultrassom-microbola induzido aumentos na permeabilidade BBB27, mas também pode reduzir o risco de hipóxia e mortalidade39. Escolha gases portadores com base nos objetivos do projeto e conselhos veterinários. Anestésicos injetáveis, como um coquetel de cetamina/xilazina, também podem ser usados; no entanto, é mais fácil controlar o plano de anestesia e níveis de oxigênio no sangue ao usar anestésicos inaláveis. - Verifique se o animal alcançou um plano suficiente de anestesia realizando uma beliscação no dedo do sol. Pese o animal para determinar a dosagem do Dextran, microbolhas e medicamentos para administrar. Retire a pele da cabeça do animal e coloque o animal em uma moldura estereotática.
- Para experimentos agudos, o acesso à circulação sistêmica deve ser estabelecido para injeções de dextran e microbolhas. Para isso, insira um cateter de 27 g em uma veia traseira.
NOTA: Embora as injeções retro-orbitais também sejam possíveis, as veias da cauda são recomendadas devido ao espaço de trabalho limitado na área da cabeça durante a imagem multifotona. - Transfira o animal para o quadro estereotático e troque a anestesia para o cone do nariz. Mantenha a temperatura do núcleo do animal de 37 °C usando uma fonte de calor, como uma almofada de aquecimento ou uma luva cheia de água morna.
- Monitore a temperatura animal usando uma sonda retal e fisiologia animal usando um oxímetro de pulso. Aplique pomada oftálmica. Injete medicamentos analgésicos pré-cirúrgicos adequados e/ou anti-inflamatórios (ver Tabela de Materiais).
- Antes de iniciar a cirurgia da janela craniana, verifique o plano de anestesia e a frequência cardíaca do animal, saturação O2 , frequência respiratória e temperatura.
- Para começar a cirurgia da janela craniana, remova a pele na cabeça aplicando um creme depilatório e/ou usando cortadores de pele. Remova a pele entre os olhos para a metade anterior do pescoço (Figura 4A).
NOTA: O contato prolongado com o creme depilatório queimará a pele. Para cirurgias crônicas de janela craniana, lave o couro cabeludo com lenços alternados de betadina e 70% EtOH após a remoção da pele. Prepare o espaço cirúrgico para cirurgia estéril. A esterilidade deve ser mantida até o passo 2.15. - Para remover o couro cabeludo, levante a pele entre os olhos usando fórceps na mão não dominante, ao longo da sutura sagital. Utilizando uma tesoura curva, remova a pele para expor os ossos parietal (Figura 4B). Aplique pressão firme com um cotonete se houver sangramento do crânio ou couro cabeludo; sangramento deve ser parado antes de progredir para o próximo passo.
NOTA: Para cirurgias agudas, a pele pode ser empurrada para trás e aderida ao crânio usando cola cianoacrila líquida ou adesivo de tecido. - Remova o periosteum que cobre a superfície externa do crânio usando cotonetes de algodão.
- Utilizando um microscópio operacional (6-25x) e uma broca dentária (rebarba de broca de 0,5 mm, velocidade média), delineie um círculo sobre o osso parietal para marcar a localização desejada da janela craniana no crânio (Figura 5). Evite a sutura sagital, lambda e bregma, pois essas áreas são mais finas e sobrepõem grandes vasos sanguíneos.
NOTA: Para facilitar a perfuração, um contorno da janela craniana pode ser desenhado no crânio usando um marcador e estêncil (Figura 5A). Para ratos, pode ser mais fácil perfurar um retangular, em vez de uma janela circular e craniana. Devido à espessura do osso do crânio do rato, use uma broca de 0,7 mm para delinear a janela craniana no osso compacto antes de usar uma broca de 0,5 mm para completar o processo de perfuração. - Aplique pressão suave com a broca; pressão excessiva aumenta o risco de causar danos ao tecido cerebral. Para evitar que o crânio superaqueça durante a perfuração, goteque soro fisiológico no crânio usando uma seringa, ou aplique um pedaço de esponja cirúrgica embebido em soro fisiológico.
- Alternar entre perfurar e resfriar o crânio até que a ilha óssea resultante se separe do resto do crânio. Verifique o progresso da perfuração aplicando pressão suave na ilha óssea usando fórceps ou a broca. Continue perfurando até que a ilha óssea se separe do resto do crânio.
NOTA: Pequenas rachaduras nas áreas mais finas do crânio são uma boa indicação de que a perfuração está quase completa. Tentar remover a ilha óssea prematuramente pode fazer com que pedaços de osso penetrem no tecido cerebral, danificando a dura e causando inflamação e sangramento. - Remova a ilha óssea usando um par de fórceps finos para agarrar as bordas, ou a camada óssea compacta superior, da ilha óssea (Figura 6A). Certifique-se de que o cérebro é mantido úmido aplicando um pedaço de esponja cirúrgica que foi pré-encharcado em soro fisiológico. Se for observado sangramento, coloque a esponja cirúrgica na região que está sangrando. Não prossiga para o próximo passo até que o sangramento tenha cessado.
NOTA: Se o sangramento persistir após 5 minutos, o animal não pode ser usado para experimentos de imagem multifotono. Para ratos, pode ser necessário remover a dura se ela for grossa. Para remover a duraza, use alta ampliação no microscópio operacional e um par de fórceps finos. - Para colocar uma janela craniana, pegue uma mancha de vidro com um par de fórceps, coloque uma gota de soro fisiológico em um lado, e manobrá-lo sobre o buraco no crânio. Certifique-se de que não há bolhas de ar sob a mancha de cobertura.
NOTA: Use uma tampa de vidro de 5 mm para ratos e 8 mm para ratos. Para ratos, devido à espessura do osso do crânio, use uma solução agarose em vez de soro fisiológico para preencher o espaço entre a mancha de cobertura e o cérebro. O transdutor e seu deslizamento também podem ser aderidos diretamente ao crânio, em vez de usar um deslizamento de cobertura separado para a janela craniana. Para esta opção, proceda à etapa 3.1. Consulte a Figura 1 para obter detalhes. - Espalhe uma camada de cola cianoacrilato ao redor do perímetro do deslizamento (Figura 6B) para anexá-lo ao crânio. Certifique-se de que não há cola sob a mancha de cobertura. Aplique pressão na tampa para garantir que a cola não entre em contato com o cérebro.
- Uma vez que a cola esteja completamente seca, mesmo fora da superfície da cola usando a broca dentária. Certifique-se de que todos os detritos de cola sejam removidos da área cirúrgica.
NOTA: Para janelas cranianas crônicas, injete as drogas pós-cirúrgicas necessárias (ver Tabela de Materiais), forneça pomada para cuidados com feridas e alimentos macios e recupere o animal sob uma lâmpada de calor.
3. Colocação do transdutor de anel
- Prepare a solução de 1% (w/v) agarose. Em um pequeno béquer ou frasco erlenmeyer, adicione 0,1 g de agarose e 10 mL de PBS (1x) ou soro fisiológico. Ferva a solução até que a agarose tenha totalmente dissolvida colocando o béquer em uma placa de aquecimento ou aquecendo a solução em um forno micro-ondas (30-45 s).
- As etapas 3.2-3.5 são sensíveis ao tempo à medida que a solução agarose esfria rapidamente. Retire ~ 0,5 mL de agarose em uma seringa de 1 mL.
NOTA: Para proteger a integridade do cérebro, certifique-se de que a temperatura da recuperação aproxima a temperatura corporal antes do uso. - Deposite a agarose liberalmente na tampa da janela craniana.
NOTA: Se o tecido branqueia, a temperatura da agarose era muito alta; o animal deve ser eutanizado. Se não houver uma mancha de cobertura separada cobrindo o cérebro (ou seja, o transdutor e seu deslizamento de cobertura são colocados diretamente no cérebro, veja o passo 2.14), então a ágarose deve ser depositada na superfície do cérebro nesta etapa. - Coloque o transdutor sobre a janela craniana (Figura 6C). Aplique pressão firme para que haja agarose mínima entre o transdutor e a janela craniana. Certifique-se de que o transdutor está centrado (XY-plane) e paralelo (Z-plane) para a janela craniana, e que não há bolhas de ar na ágarose.
- Quando a agarose tiver esfriado para uma consistência semelhante a gelatina, corte o excesso de agarose da circunferência do deslizamento de tampa do transdutor usando uma espátula ou bisturi. Certifique-se de que não há bolhas de ar sob o deslizamento de cobertura do transdutor.
- Usando uma espátula, espalhe uma camada de cola cianoacrilato sobre a circunferência da mancha de cobertura do transdutor, estendendo-se ao crânio, de tal forma que o transdutor seja firmemente aderido ao crânio.
- Mantenha a pressão firme sobre o transdutor até que a cola esteja completamente seca (10-15 min).
4. Imagem de microscopia multifotúr
- Posicione o animal sob a lente objetiva (Figura 7A). Certifique-se de que a lente objetiva está centrada no transdutor do anel e paralelamente ao transdutor (Figura 7B). Se for usada uma lente objetiva de imersão na água, encha o centro do transdutor do anel com água desionizada e desgaseada.
NOTA: A água desgasejada é importante para a propagação adequada do ultrassom. - Comece com a lente objetiva em sua posição mais alta e, em seguida, baixe lentamente a lente objetiva até que esteja dentro do transdutor do anel (Figura 7A, B). Certifique-se de que a lente objetiva não colida com o transdutor ou deslizamento de tampa.
NOTA: Alternar entre a ocular para verificar se a posição Z da lente objetiva está em plano com a superfície do cérebro, e olho para garantir que a lente objetiva não colida com o transdutor ou deslizamento de tampa. Pode ser mais fácil visualizar os vasos pial através da ocular após a injeção de dextran fluorescente através da veia da cauda (Figura 7C). - Prepare o microscópio multifoton para imagens.
NOTA: Este protocolo usa um microscópio multifotol vertical e uma lente objetiva de 20-25x que tem uma distância de trabalho de 2 mm, o que é suficiente para se concentrar além do deslizamento de tampas, no parenchyma cerebral. - Prepare o dextran. Adicione a quantidade adequada de PBS ao frasco de dextran, de acordo com as instruções do fabricante. Vórtice a solução de dextran por 1-3 min para garantir que o pó de dextran seja totalmente dissolvido. Injete a solução dextran na veia traseira.
- Configurando uma varredura de imagem
- Usando as oculares, certifique-se de que a lente objetiva é paralela ao cérebro. Incline o animal para corrigir para desalinhamentos XZ e YZ.
- Selecione um campo de exibição em um microscópio multifotônio. Configure um exame XYZ antes da exposição ao ultrassom para ter uma imagem básica da vasculatura antes da exposição ao ultrassom.
NOTA: Os parâmetros típicos de imagem são os seguintes: 300-800 μm de profundidade, 2-5 μm de tamanho de passo e pilhas de tempo de 10-20. Certifique-se de que a lente objetiva não entre em contato com o transdutor ou cubra o seu ponto mais baixo durante a sequência de imagem.
5. Exposição ao ultrassom
- Certifique-se de que todos os cabos BNC estejam conectados corretamente (Figura 3).
- Configure uma varredura de imagem XYZT suficientemente longa para capturar pilhas de imagens antes, durante e depois dos tratamentos de microbolhas de ultrassom.
- Prepare as microbolhas seguindo as instruções do fabricante. Injete os microbolhas na veia da cauda e comece a fazer imagens.
NOTA: As injeções de microbolhas podem ser feitas com uma bomba de infusão para garantir uma taxa de injeção consistente e para permitir a injeção e a imagem simultâneas de microbolhas. Se os microcompletos forem injetados durante a imagem, certifique-se de que a veia traseira possa ser facilmente acessada sem expor os detectores à luz ambiente. - Comece a sônicação.
NOTA: Os parâmetros típicos de sônica são os seguintes: ciclos de 10 ms, índice mecânico de 0,2-0,4 e frequências de repetição de pulso entre 1-4 Hz. Os parâmetros de sonicação e microbolhas utilizados em estudos pré-clínicos de ultrassom-microbolhas foram extensivamente estudados e estão bem documentados na literatura (por exemplo, ver 40 para uma revisão). - Continue com imagens multifotográficas durante toda a duração da sônica e após o fim da sônicação. Fique atento à extravasação do Dextran dos vasos sanguíneos, pois isso indica um indicativo de aumentos na permeabilidade do BBB.
NOTA: Se o Dextran for detectado no espaço extravascular, mas na periferia do campo de visão, então pode haver vasos sanguíneos afetados fora do campo de visão. Isso pode resultar do desalinhamento do transdutor com o foco da lente objetiva. Nesse cenário, é mais fácil ajustar o campo de visão movendo a lente objetiva ou reposicionando o animal, do que realinhar o transdutor. - Uma vez concluída a imagem, eutanize a luxação cervical animal sob anestesia profunda ou asfixia por CO2 . Para janelas cranianas crônicas, espalhe uma camada de cimento dental no crânio exposto.
NOTA: Para janelas cranianas crônicas, a pele ao redor da janela pode ser suturada, embora isso não seja necessário, devido à remoção do couro cabeludo na etapa 2.8.
6. Análise de imagem
- Exportar pilhas de imagens.
- Analise imagens com software de análise de imagem (por exemplo, Olympus Fluoview, ImageJ/FIJI, Bitplane Imaris, ThermoFisher Scientific Amira) e/ou ferramentas de programação (por exemplo, Python, MATLAB).
Resultados
Tratamentos de ultrassom-microbolhas bem sucedidos podem ser detectados pela extravasação de dextran fluorescente do intravascular ao espaço extravascular (Figura 8), indicando um aumento na permeabilidade bbb. Dependendo do campo de pressão do transdutor do anel, vasos de pial e/ou capilares serão afetados.
Para avaliar as alterações vasculares induzidas por tratamentos de ultrassom-microbolhas, o diâmetro do vaso de interesse pode ser medido antes, durante e após o tratamento de ultrassom-microbolhas (Figura 9). Isso pode ser feito manualmente em um software comercialmente disponível (por exemplo, software Olympus Fluoview). Durante a aquisição de imagens, injeções de bolus dextran e tomografias de linha também podem ser usadas para avaliar o fluxo sanguíneo30,41. Para avaliar a cinética do vazamento do Dextran como modelo representativo para a entrega de medicamentos, a intensidade do sinal entre os espaços intra e extravascular pode ser avaliada utilizando ferramentas como MATLAB26,27,29,41 (Figura 10).
Mais processamento de imagem pode ser alcançado usando ImageJ/FIJI. ImageJ/FIJI é um software de código aberto compatível com o MATLAB e é adequado para realizar análises comuns na análise de imagens biológicas, como medir alterações vasculares, ou os comprimentos ou distância entre objetos fluorescentes (por exemplo, placas β-amilóides aos vasos sanguíneos). Os pipelines de processamento de imagem criados no ImageJ/FIJI podem ser automatizados por meio da escrita de macros personalizadas.
Análises mais complexas, como segmentação 3D de vasos sanguíneos e rastreamento celular, podem ser obtidas usando softwares semi-automatizados mais avançados (Figura 11). Após a segmentação, podem ser realizadas análises mais específicas, como classificar os vasos sanguíneos como arterioles, venules ou capilares, com base no diâmetro, ramificação, padrões de tortuosidade e direção de fluxo42,43. Algoritmos de aprendizagem de máquina também foram desenvolvidos para automatizar a segmentação dos vasos sanguíneos22,44.
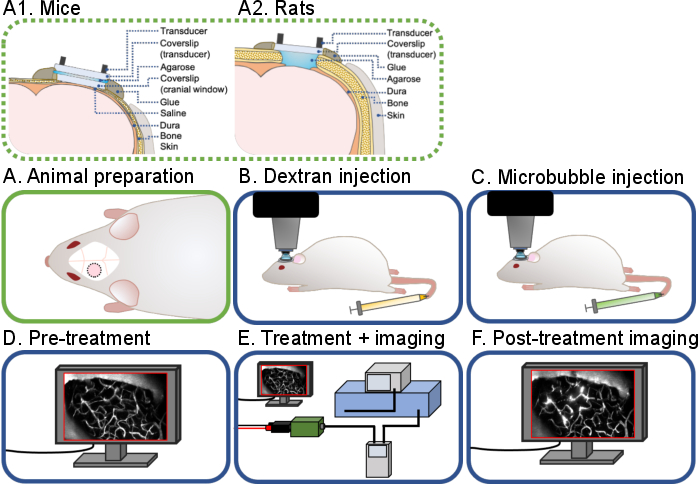
Figura 1: Fluxo de trabalho geral de experimentos cerebrais multifotol multifol de ultrassom-microbolhas. Um fluxo de trabalho geral dos experimentos cerebrais multifotol multifotônios descritos neste protocolo é mostrado. Existem 6 etapas: (A) Preparação animal para (A1) ratos e (A2) ratos, (B) injeção de Dextran, (C) Injeção de microbolhas, (D) Imagem pré-tratamento, (E) Tratamento e imagem, (F) Imagem pós-tratamento e análise de dados. Clique aqui para ver uma versão maior desta figura.
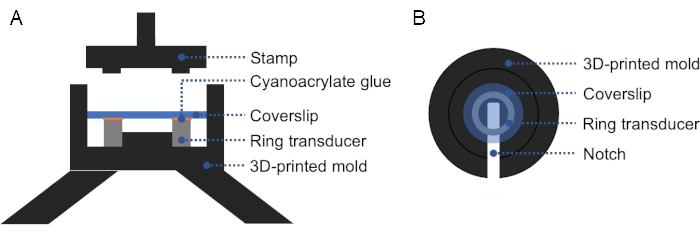
Figura 2: Seção transversal e vista superior do molde impresso em 3D. (A) Seção transversal do molde. Uma fina camada de cola cianoacrilato é aplicada na superfície superior do transdutor do anel, e uma mancha de cobertura é colocada em cima. Um selo pode ser usado para aplicar firme, até mesmo pressão sobre o deslizamento de tampas e transdutor de anel. (B) Vista superior do molde. Um entalhe pode ser adicionado no molde para facilitar a remoção do transdutor preparado. Clique aqui para ver uma versão maior desta figura.
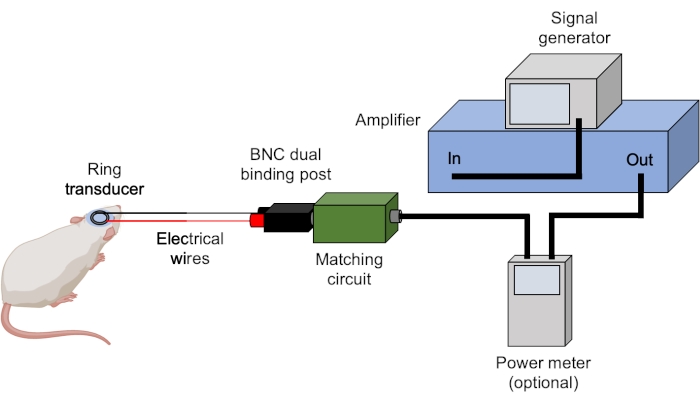
Figura 3: Configuração de ultrassom. São mostrados hardwares típicos para experimentos de ultrassom. Os parâmetros de ultrassom são definidos e acionados pelo gerador de sinal e amplificados pelo amplificador. Um medidor de potência pode ser usado para registrar poderes avançados e refletidos antes de enviar o sinal para a caixa correspondente, que é compatível com o transdutor. Todas as conexões são obtidas usando cabos BNC, a menos que seja indicado o contrário. Clique aqui para ver uma versão maior desta figura.
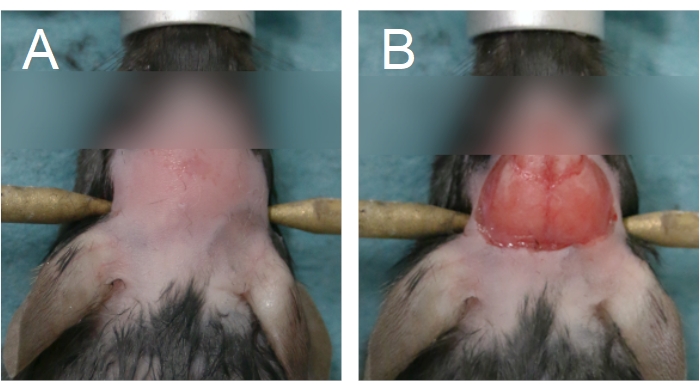
Figura 4: Área de remoção de pele e remoção do couro cabeludo. (A) A remoção da pele deve começar entre os olhos e estender-se até a metade anterior do pescoço. (B) A remoção do couro cabeludo deve ser suficiente para expor os ossos parietais. O sangramento deve ser interrompido antes de prosseguir. Clique aqui para ver uma versão maior desta figura.
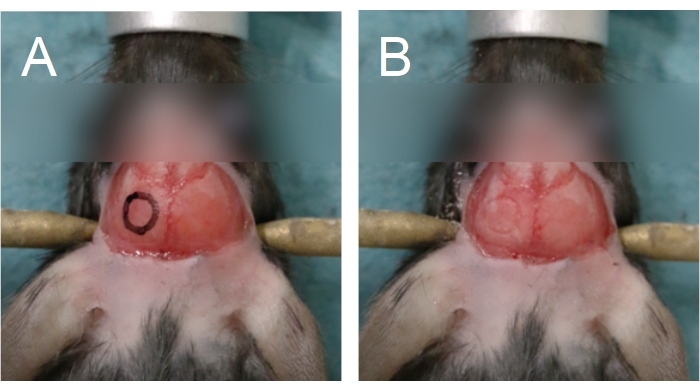
Figura 5: Contorno da janela craniana. A janela craniana está situada em um osso parietal. (A) Um contorno da janela craniana pode ser desenhado sobre o crânio para auxiliar no processo de perfuração. (B) O contorno da janela craniana pode ser visto após a perfuração através do osso compacto. Clique aqui para ver uma versão maior desta figura.
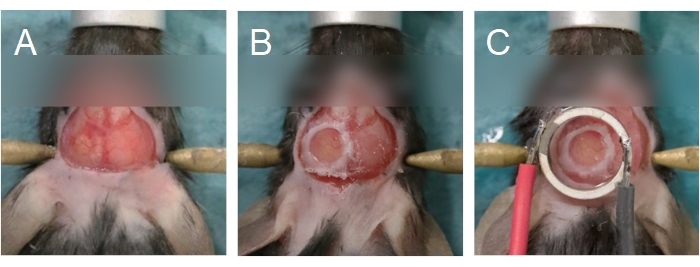
Figura 6: Alinhamento da janela craniana e transdutor. (A) A janela craniana é criada em um osso parietal. A ilha óssea foi removida, expondo o cérebro por baixo. (B) A janela craniana está completa quando uma mancha de vidro é selada no crânio usando cola cianoacrilato. (C) O transdutor é centrado na janela craniana e aderido usando cola cianoacrilato. Clique aqui para ver uma versão maior desta figura.
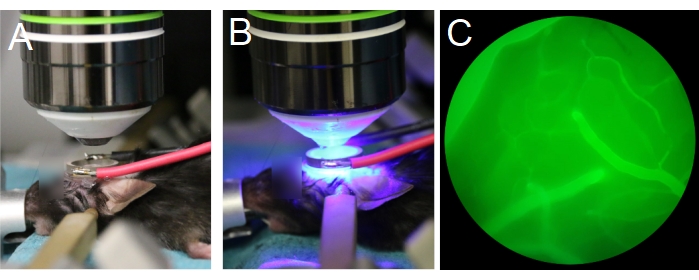
Figura 7: Posicionamento de lente objetiva e transdutor. (A,B) A lente objetiva está centrada no transdutor do anel. (C) Os vasos sanguíneos preenchidos com dextran fluorescente são visíveis através das oculares, sob epifluorescência. Clique aqui para ver uma versão maior desta figura.
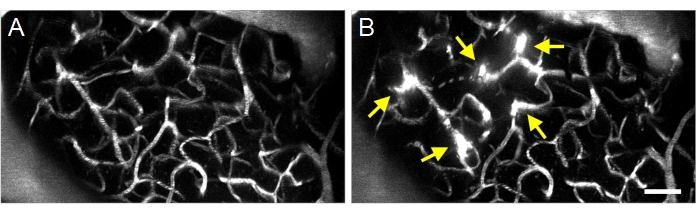
Figura 8: Projeção máxima imagens multifotonas de ultrassom-microbola induzida aumentos na permeabilidade BBB. Imagens máximas de projeção de vasculatura (A) antes e (B) após tratamentos de ultrassom-microbolhas. Tratamentos bem-sucedidos de ultrassom-microbolhas podem ser confirmados observando aumentos na permeabilidade bbb após o tratamento, visualizados como extravasação fluorescente dextran (setas). Barra de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
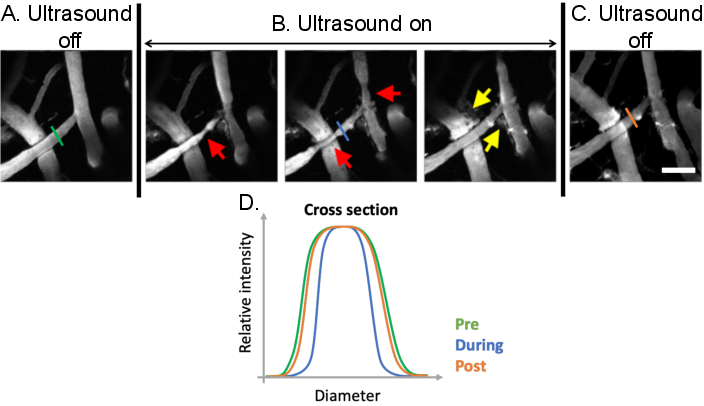
Figura 9: Análise da vasomodulação induzida por tratamentos de ultrassom-microbolhas. Imagens máximas de projeção de vasos sanguíneos cerebrais antes, durante e depois de tratamentos de microbolhas de ultrassom. Microbolhas estão presentes em todas as imagens. Em comparação com (A) condições de pré-tratamento, pode-se observar vasomodulação clara (B) durante tratamentos de microbolhas de ultrassom (setas vermelhas). Os aumentos mediados por ultrassom na permeabilidade do BBB também são evidentes após o tratamento do vazamento do dextran fluorescente do intravascular ao espaço extravascular (setas amarelas). (C) Quando o ultrassom é desligado, os diâmetros vasculares retornam ao pré-tratamento, tamanhos de linha de base. (D) Alterações vasculares podem ser analisadas plotando o diâmetro do vaso de interesse antes, durante e após o tratamento de microbolhas de ultrassom. Barra de escala: 100 μm. (Trabalho inédito). Clique aqui para ver uma versão maior desta figura.
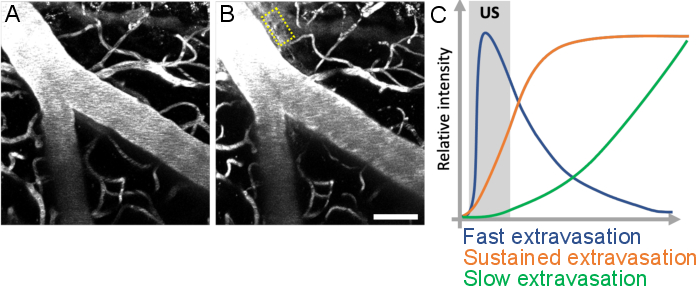
Figura 10: Análise da cinética de vazamento após tratamentos de ultrassom-microbolhas. O aumento da permeabilidade do BBB é visualizado como vazamento de dextran fluorescente do intravascular ao espaço extravascular. Alterações na permeabilidade do BBB são evidentes ao comparar pilhas de imagens adquiridas (A) antes e (B) após tratamentos de microbolhas de ultrassom. (C) A cinética de vazamento pode ser analisada rastreando a intensidade, volume e velocidade do dextran em compartimentos extravasculares (retângulo amarelo). Barra de escala: 50 μm. (Trabalho inédito.) Clique aqui para ver uma versão maior desta figura.
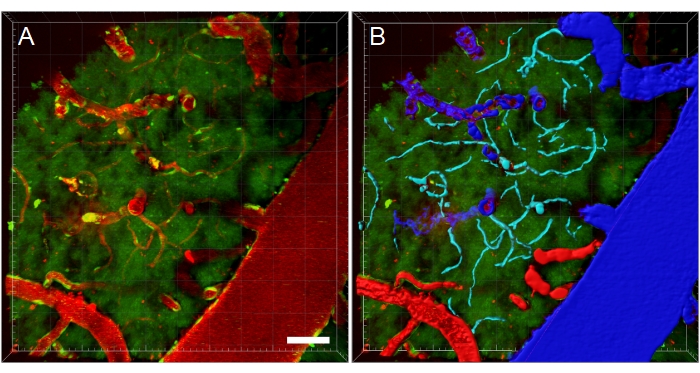
Figura 11: Segmentação dos vasos sanguíneos da pilha de microscopia multifotírica XYZ. (A) Pilha de vasos sanguíneos (XYZ) em um rato EGFP transgênico. Os vasos sanguíneos são visualizados através de injeção intravenosa de fluorescente Texas Red 70 kDa dextran (vermelho). O canal verde mostra células fluorescentes e autofluorescência tecidual. (B) Reconstruções 3D dos vasos sanguíneos são criadas e, em seguida, codificadas por cores de acordo com o tipo de vaso sanguíneo para facilitar análises específicas do tipo. Veia/venules são azuis, artérias/artérias são vermelhas e capilares são cianos. Barra de escala: 50 μm. Reconstruções criadas usando Bitplane Imaris. Clique aqui para ver uma versão maior desta figura.
Discussão
O monitoramento de microscopia multifotônio intravital do cérebro é uma ferramenta valiosa para estudar as respostas cerebrais durante a exposição ao ultrassom. Para nosso conhecimento, o protocolo descrito aqui é o único método de realização de imagens multifotonas de microscopia do parênquim cerebral durante tratamentos de ultrassom-microbolhas. A criação de janelas cranianas e o uso de transdutores de anel permitem o monitoramento em tempo real de respostas vasculares, celulares e outras respostas a jusante a tratamentos de ultrassom-microbolhas em alta resolução espacial e temporal. Outros grupos realizaram imagens de microscopia multifotílica após a conclusão dos tratamentos de ultrassom-microbolhas, perdendo assim a resposta em tempo real do parenchyma cerebral aos tratamentos19. O procedimento descrito oferece um melhor controle temporal, permitindo a coleta de dados que podem ajudar a iluminar os mecanismos agudos por trás dos tratamentos de ultrassom-microbolhas. Dados quantitativos e qualitativos podem ser extraídos e analisados a partir das pilhas de imagens adquiridas, como cinética de extravasão27,29,30, alterações no volume de placa β-amilóide31 e dinâmica celular32.
Várias etapas de solução de problemas foram destacadas ao longo do protocolo. Em primeiro lugar, foram enfatizadas etapas cirúrgicas particularmente suscetíveis ao erro do operador, como o uso de agarose durante a cirurgia da janela craniana e a colocação do transdutor. Também foram fornecidas medidas para prevenir o desconforto animal e a morte, incluindo o monitoramento da fisiologia animal durante a cirurgia, e o vórtice do dextran antes da injeção. Em segundo lugar, também foram destacadas as especificações físicas do transdutor e o alinhamento da lente objetiva, transdutor e janela craniana. As especificações do transdutor do anel e suas propriedades acústicas devem ser determinadas em consideração à lente objetiva utilizada, bem como ao modelo animal. Especificamente, o diâmetro interno do transdutor do anel deve ser grande o suficiente para cercar a lente objetiva, mas pequeno o suficiente para ser montado com segurança no crânio do animal. Além disso, a área focal do transdutor deve estar alinhada com a gama da lente objetiva utilizada.
Um desafio comum é que a janela craniana e o transdutor do anel são angulares em relação à lente objetiva. O centro adequado (XY) e o alinhamento (Z) da lente objetiva com a janela craniana e o transdutor garantem que a área focal do transdutor, e assim a região do tecido cerebral tratado, se alinhe com o campo de visão de imagem e reduz o risco de colisão entre a lente objetiva e o transdutor durante a imagem. O alinhamento pode ser alcançado ajustando a posição da cabeça do animal e/ou girando o quadro estereotático em que está fixado.
Os componentes do microscópio (por exemplo, detectores, divisores de feixe) e parâmetros de aquisição de imagens devem ser selecionados com base no objetivo do estudo. Aqui, uma lente objetiva com uma longa distância focal (> 2 mm) é usada devido à presença do deslizamento de tampas e transdutor de anel localizado entre a lente objetiva e o cérebro. Um microscópio vertical também é recomendado, pois permite mais espaço para manobrar o animal, particularmente para experimentos cerebrais. Para capturar a cinética do vazamento induzido por ultrassom-microbolhas do corante intravascular, uma alta resolução temporal é favorável, o que pode ser alcançado usando um sistema de ressonância digitalização. Combinar isso com um sistema de detecção de alta sensibilidade, como detectores de fosfato de arsênio de gálio (GaAsP), também resultará em imagens mais favoráveis.
O procedimento experimental apresentado tem várias limitações. Primeiro, o procedimento cirúrgico é bastante invasivo, e tem sido relatado para causar inflamação45, embora a inflamação possa ser minimizada46. Além disso, as respostas imunes induzidas por cirurgias de janela craniana foram observadas para resolver em 2-4 semanas após a cirurgia23,24,25. Além disso, o processo de perfuração, particularmente quando conduzido com força ou velocidade excessiva, pode causar danos ao tecido subjacente devido à geração de calor, vibração e pressão aplicada. Cirurgias de janelas cranianas e imagens multifoton também foram observadas para afetar a temperatura cerebral47. Essas limitações podem ser reduzidas até certo ponto através da criação cuidadosa de janelas cranianas intocadas, recuperação adequada de animais com janelas cranianas crônicas e manutenção da temperatura corporal normoérmica usando uma fonte de aquecimento com controle de feedback. Em segundo lugar, a profundidade de imagem é limitada pelo microscópio e lente objetiva utilizada. Por exemplo, o efeito do tratamento de ultrassom-microbolhas em estruturas cerebrais mais profundas, como o hipocampo, não pode ser estudado sem medidas mais invasivas, como a remoção de tecido cortical excessiva48, ou o uso de microlenses em conjunto com a penetração cortical49. Usar uma lente objetiva com uma longa distância de trabalho poderia resolver esse problema até certo ponto, mas a penetração de luz também é limitada em profundidades maiores.
Embora as imagens representativas deste protocolo tenham sido adquiridas a partir de roedores do tipo selvagem, o procedimento experimental apresentado também pode ser aplicado a animais transgênicos e modelos de doenças, como a doença de Alzheimer31. Experimentos de ultrassom não relacionados à modulação bbb, como neuromodulação induzida por ultrassom, também podem ser monitorados usando este protocolo33,34. Outras aplicações possíveis podem ser alcançadas usando diferentes configurações de microscópio ou detector, como emparelhar um microscópio confocal com uma câmera de ultra-alta velocidade50. Embora a fotobólica e a fototoxicidade sejam comparativamente piores nos microscópios confocal devido ao grande volume de excitação, imagens de ultra-alta velocidade podem permitir a visualização de interações endoteliais de células endoteliais cerebrais com alta resolução temporal, o que poderia iluminar ainda mais os mecanismos que conduzem os tratamentos BBB de ultrassom. Para concluir, o protocolo descrito fornece um método para monitorar os efeitos vasculares e celulares induzidos por experimentos BBB de ultrassom em tempo real, fornecendo uma ferramenta para determinar ainda mais os mecanismos que conduzem esses tratamentos, bem como iluminar as respostas a jusante do parênquim cerebral para tratamentos de ultrassom-microbolhas.
Divulgações
Charissa Poon, Melina Mühlenpfordt, Marieke Olsman e Catharina de Lange Davies declaram que não há conflitos financeiros ou não financeiros concorrentes de interesse. Spiros Kotopoulis é um funcionário em tempo integral e possui ações na EXACT Therapeutics AS, uma empresa que desenvolve ultrassom e microbolhas/cluster aprimorado entrega de medicamentos. Kullervo Hynynen é o fundador da FUS Instruments, da qual recebe apoio não relacionado à pesquisa.
Agradecimentos
A habitação dos animais foi fornecida pela Unidade do Núcleo de Medicina Comparada (CoMed, NTNU). A Figura 3 foi criada em BioRender.com. A gravação e edição de vídeo foi feita por Per Henning, webmaster da Faculdade de Ciências Naturais da NTNU. O projeto foi financiado pela Universidade Norueguesa de Ciência e Tecnologia (NTNU, Trondheim, Noruega), Conselho de Pesquisa da Noruega (RCN 262228), Instituto Canadense de Pesquisa em Saúde (FDN 154272), Instituto Nacional de Saúde (R01 EB003268) e o Presidente Temerty em Pesquisa de Ultrassom Focado no Sunnybrook Health Sciences Centre.
Materiais
| Name | Company | Catalog Number | Comments |
| Ring transducer placement | |||
| Agarose (powder) | Sigma-Aldrich | A9539 | |
| Beaker or Erlenmeyer flask (50 ml) | VWR | 213-0462 or 214-1130 | |
| Cyanoacrylate glue (gel) | Loctite | 1363589 | |
| Glass coverslips (13 mm) | Thermo Fisher Scientific | CB00130RA120MNT0 | Coverslip for ring transducer. |
| Hot plate or microwave | Corning | PC-400D | To heat agarose solution. |
| PBS (1X) | Sigma-Aldrich | P4417 | |
| Ring transducer | Custom-made | Custom-made | Custom-made. E.g. https://doi.org/10.1109/ULTSYM.2014.0518 |
| Rubber stopper | VWR | 217-0867 | |
| Animal preparation and drugs | |||
| Bupivacaine*A | Aspen | 169912 | Dose: 1 mg/kg, s.c., local anesthetic injected at incision site. |
| Buprenorphine*A | Indivior | 521634 | Dose mouse: 0.05-0.1 mg/kg, s.c., opioid, administer pre-surgery. |
| Buprenorphine*A | Indivior | 521634 | Dose rat: 0.01-0.05 mg/kg, s.c.. |
| Carprofen*C | Pfizer | DIN 02255693 | Dose: 5 mg/kg, s.c., NSAID, adminster post-surgery. |
| Depilatory cream | Veet | N/A | For complete fur removal after trimming. |
| Dexamethasone*C | Sandoz | DIN 00664227, 2301 | Dose: 3 mg/kg, i.m., corticosteroid, reduces cerebral edema, administer pre-surgery. |
| Enrofloxacin*C | Bayer | DIN: 02249243 | Dose: 5 mg/kg, i.p., antibiotic, administer post-surgery. |
| Fur clippers | Aesculap | 90200714 | Exacta/Isis. |
| Heating pad | Physitemp Instruments INC | HP-1M | |
| Isoflurane | Baxter | ESDG9623C | Dose: 3% induction, 1% maintenance; anesthetic. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose mouse: 2-3 mg/kg, s.c., NSAID, administer pre-surgery. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose rat: 1 mg/kg, s.c. |
| Pulse oximeter | STARR Life Sciences Corp | N/A | MouseOx. |
| Stereotaxic frame | Kopf | Kopf 900 | |
| Sterile ophthalmic ointment | Théa | 597562 | Viscotears. |
| Tail vein catheter (24 G) | BD Neoflon | 391350 | |
| * Discuss dosing and type of administration with veterinarian prior to use. A For acute window surgeries, C For chronic window surgeries. Dose for mice and rats are the same unless otherwise specified. | |||
| Material and equipment for cranial window placement | |||
| Alcohol swabs | BD | 326895 | |
| Curved fine surgical scissors | Fine Science Tools | 14002-12 | |
| Cotton or fibreless swabs | Chemtronics | CX50 | |
| Cyanoacrylate glue (gel) | Loctite | 1594457 (gel), 230992 (liquid) | If unavailable, liquid cyanoacrylate glue can be mixed with extra-fine acrylate powder. |
| Dental cement | Lang Dental | Jet Set-4 Denture Repair Package | |
| Dental micromotor hand drill | FOREDOM | K.1070-2 | High speed rotary micromotor kit with 2.35 mm collet. |
| Forceps | Fine Science Tools | 11152-10, 11370-40 | |
| Glass coverslips | Thermo Fisher Scientific | CB00050RA120MNT0 (5 mm) | Mouse cranial windows. |
| Glass coverslips | Thermo Fisher Scientific | CB00080RA120MNT0 (8 mm) | Rat cranial windows. |
| Micro drill burrs (0.5 mm) | Meisinger | HM71005 (0.5 mm) | |
| Micro drill burrs (0.7 mm) | Meisinger | HM71007 (0.7 mm) | |
| Stereo microscope | Nikon | SMZ645 | |
| Surgical gelatin sponge | Ethicon | MS0005 | |
| Vetbond Tissue adhesive | 3M | 1469SB | |
| Weigh boats / trays | VWR | 10803-148 | |
| * Autoclave drapes, tools, materials, and gowns, and use sterile surgical gloves, for chronic cranial window surgeries. | |||
| Multiphoton microscopy | |||
| 20x water immersion objective | Olympus | XLUMPLFLN20 XW | Numerical aperture 1.0, working distance 2.0 mm. |
| Fluorescent dextran (e.g. FITC 70 kDa) | Sigma Aldrich | 46945 | Recommended 10 kDa-2 MDa. |
| MaiTai DeepSee Ti:Sapphire laser oscillator | Spectra-Physics | N/A | |
| SliceScope microscope | Scientifica | N/A | |
| Ultrasound treatment | |||
| 50 dB RF Amplifier | E&I | 2100L | |
| Matching circuit | Custom-made | Custom-made | Custom-made. |
| Microbubbles | Bracco Imaging | N/A | SonoVue (Bracco Imaging, Europe). Dose 1 ml/kg. |
| Microbubbles | Lantheus | N/A | Definity (Lantheus Medical Imaging, North America). Dose 0.02-0.04 ml/kg. |
| Signal generator | Agilent Technologies | 33500B |
Referências
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Kalladka, D., et al. Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 388 (10046), 787-796 (2016).
- Pardridge, W. M. The blood-brain barrier: Bottleneck in brain drug development. the journal of the American Society for Experimental NeuroTherapeutics. 2 (1), 12 (2005).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Advanced Drug Delivery Reviews. 64 (7), 614-628 (2012).
- Nagy, Z., Pappius, H. M., Mathieson, G., Hüttner, I. Opening of tight junctions in cerebral endothelium. I. Effect of hyperosmolar mannitol infused through the internal carotid artery. The Journal of Comparative Neurology. 185 (3), 569-578 (1979).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220 (3), 640-646 (2001).
- Burgess, A., et al. Alzheimer disease in a mouse model: MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior. Radiology. 273 (3), 736-745 (2014).
- Abrahao, A., et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using MR-guided focused ultrasound. Nature Communications. 10 (1), 4373 (2019).
- Hynynen, K., Jones, R. M. Image-guided ultrasound phased arrays are a disruptive technology for non-invasive therapy. Physics in Medicine and Biology. 61 (17), 206-248 (2016).
- Burgess, A., et al. Targeted delivery of neural stem cells to the brain using MRI-guided focused ultrasound to disrupt the blood-brain barrier. PLoS One. 6 (11), 27877 (2011).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- Downs, M. E., et al. Long-term safety of repeated blood-brain barrier opening via focused ultrasound with microbubbles in non-human primates performing a cognitive task. PLOS One. 10 (5), 0125911 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103-112 (2019).
- Bing, C., et al. Transcranial opening of the blood-brain barrier in targeted regions using a stereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2, 13 (2014).
- O'Reilly, M. A., Hynynen, K. Blood-brain barrier: Real-time feedback-controlled focused ultrasound disruption by using an acoustic emissions-based controller. Radiology. 263 (1), 96-106 (2012).
- Jones, R. M., Deng, L., Leung, K., McMahon, D., O'Reilly, M. A., Hynynen, K. Three-dimensional transcranial microbubble imaging for guiding volumetric ultrasound-mediated blood-brain barrier opening. Theranostics. 8 (11), 2909-2926 (2018).
- Jones, R. M., McMahon, D., Hynynen, K. Ultrafast three-dimensional microbubble imaging in vivo predicts tissue damage volume distributions during nonthermal brain ablation. Theranostics. 10 (16), 7211-7230 (2020).
- Arvanitis, C. D., et al. Mechanisms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption. Proceedings of the National Academy of Sciences. 115 (37), 8717-8726 (2018).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. 33, (2012).
- McCarter, J. F., et al. Clustering of plaques contributes to plaque growth in a mouse model of Alzheimer's disease. Acta Neuropathologica. 126 (2), 179-188 (2013).
- Cruz Hernández, J. C., et al. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer's disease mouse models. Nature Neuroscience. 22 (3), 413-420 (2019).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Cao, V. Y., et al. In vivo two-photon imaging of experience-dependent molecular changes in cortical neurons. Journal of Visualized Experiments. (71), e50148 (2013).
- Nhan, T., Burgess, A., Hynynen, K. Transducer design and characterization for dorsal-based ultrasound exposure and two-photon imaging of in vivo blood-brain barrier disruption in a rat model. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 60 (7), 1376-1385 (2013).
- Cho, E. E., Drazic, J., Ganguly, M., Stefanovic, B., Hynynen, K. Two-photon fluorescence microscopy study of cerebrovascular dynamics in ultrasound-induced blood-brain barrier opening. Journal of Cerebral Blood Flow & Metabolism. 31 (9), 1852-1862 (2011).
- Burgess, A., Nhan, T., Moffatt, C., Klibanov, A. L., Hynynen, K. Analysis of focused ultrasound-induced blood-brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248 (2014).
- Nhan, T., et al. Drug delivery to the brain by focused ultrasound induced blood-brain barrier disruption: Quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy. Journal of Controlled Release. 172 (1), 274-280 (2013).
- Nhan, T., Burgess, A., Lilge, L., Hynynen, K. Modeling localized delivery of Doxorubicin to the brain following focused ultrasound enhanced blood-brain barrier permeability. Physics in Medicine and Biology. 59 (20), 5987-6004 (2014).
- Poon, C. T., et al. Time course of focused ultrasound effects on β-amyloid plaque pathology in the TgCRND8 mouse model of Alzheimer's disease. Scientific Reports. 8 (1), 14061 (2018).
- Poon, C., Pellow, C., Hynynen, K. Neutrophil recruitment and leukocyte response following focused ultrasound and microbubble mediated blood-brain barrier treatments. Theranostics. 11 (4), 1655-1671 (2021).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Chu, P. -. C., et al. Neuromodulation accompanying focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 5 (1), 15477 (2015).
- Yddal, T., Kotopoulis, S., Gilja, O. H., Cochran, S., Postema, M. . Transparent glass-windowed ultrasound transducers. , 2079-2082 (2014).
- Santos, M. A., Goertz, D. E., Hynynen, K. Focused ultrasound hyperthermia mediated drug delivery using thermosensitive liposomes and visualized with in vivo two-photon microscopy. Theranostics. 7 (10), 2718-2731 (2017).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Molecular Imaging and Biology. 14 (1), 40-46 (2012).
- Baum, J. A. The carrier gas in anaesthesia: Nitrous oxide/oxygen, medical air/oxygen and pure oxygen. Current Opinion in Anaesthesiology. 17 (6), 513-516 (2004).
- Poon, C., McMahon, D., Hynynen, K. Noninvasive and targeted delivery of therapeutics to the brain using focused ultrasound. Neuropharmacology. , 20-37 (2017).
- Joo, I. L., et al. Early neurovascular dysfunction in a transgenic rat model of Alzheimer's disease. Scientific Reports. 7, 46427 (2017).
- Dorr, A., et al. Amyloid-β-dependent compromise of microvascular structure and function in a model of Alzheimer's disease. Brain: A Journal of Neurology. 135, 3039-3050 (2012).
- Kim, T. N., et al. Line-scanning particle image velocimetry: An optical approach for quantifying a wide range of blood flow speeds in live animals. PLOS One. 7 (6), 38590 (2012).
- Teikari, P., Santos, M., Poon, C., Hynynen, K. Deep learning convolutional networks for multiphoton microscopy vasculature segmentation. arXiv. , (2016).
- Denes, A., et al. Surgical manipulation compromises leukocyte mobilization responses and inflammation after experimental cerebral ischemia in mice. Frontiers in Neuroscience. 7, 00271 (2014).
- Koletar, M. M., Dorr, A., Brown, M. E., McLaurin, J., Stefanovic, B. Refinement of a chronic cranial window implant in the rat for longitudinal in vivo two-photon fluorescence microscopy of neurovascular function. Scientific Reports. 9 (1), 5499 (2019).
- Podgorski, K., Ranganathan, G. Brain heating induced by near-infrared lasers during multiphoton microscopy. Journal of Neurophysiology. 116 (3), 1012-1023 (2016).
- Ulivi, A. F., et al. Longitudinal two-photon imaging of dorsal hippocampal CA1 in live mice. Journal of Visualized Experiments: JoVE. (148), e59598 (2019).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Beekers, I., et al. Combined confocal microscope and Brandaris 128 ultra-high-speed camera. Ultrasound in Medicine & Biology. 45 (9), 2575-2582 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados