Method Article
Microscopie multiphotonique intravitale en temps réel pour visualiser les traitements par ultrasons focalisés et par microbulles afin d’augmenter la perméabilité de la barrière hémato-encéphalique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit les procédures chirurgicales et techniques qui permettent l’imagerie en temps réel in vivo par fluorescence multiphotonique du cerveau des rongeurs pendant les traitements par ultrasons focalisés et par microbulles afin d’augmenter la perméabilité de la barrière hémato-encéphalique.
Résumé
La barrière hémato-encéphalique (BHE) est un défi clé pour la livraison réussie de médicaments au cerveau. L’exposition aux ultrasons en présence de microbulles est apparue comme une méthode efficace pour augmenter transitoirement et localement la perméabilité du BHE, facilitant ainsi le transport para- et transcellulaire des médicaments à travers le BHE. L’imagerie de la vascularisation pendant le traitement par microbulles échographiques fournira des informations précieuses et nouvelles sur les mécanismes et la dynamique des traitements ultrasonores-microbulles dans le cerveau.
Nous présentons ici une procédure expérimentale pour la microscopie multiphotonique intravitale utilisant une fenêtre crânienne alignée avec un transducteur annulaire et un objectif 20x. Cette configuration permet une imagerie du cerveau à haute résolution spatiale et temporelle pendant les traitements par microbulles échographiques. L’accès optique au cerveau est obtenu via une fenêtre crânienne ouverte du crâne. En bref, un morceau de crâne de 3 à 4 mm de diamètre est retiré et la zone exposée du cerveau est scellée avec un couvercle en verre. Un transducteur annulaire de 0,82 MHz, qui est fixé à un deuxième couvercle en verre, est monté sur le dessus. L’agarose (1 % p/v) est utilisée entre le couvercle du transducteur et le couvercle recouvrant la fenêtre crânienne pour empêcher les bulles d’air qui entravent la propagation des ultrasons. Lorsque des procédures chirurgicales stériles et des mesures anti-inflammatoires sont prises, des traitements par microbulles échographiques et des séances d’imagerie peuvent être effectués à plusieurs reprises pendant plusieurs semaines. Les conjugués de dextran fluorescents sont injectés par voie intraveineuse pour visualiser le système vasculaire et quantifier les effets induits par les ultrasons et les microbulles (p. ex., cinétique des fuites, changements vasculaires). Cet article décrit le placement de la fenêtre crânienne, le placement du transducteur annulaire, la procédure d’imagerie, les étapes de dépannage courantes, ainsi que les avantages et les limites de la méthode.
Introduction
Un défi clé pour traiter les troubles neurologiques est la présence de la barrière hémato-encéphalique (BHE). Le BBB empêche les molécules hydrophiles, chargées, polaires et de grande taille (> 400 Da) d’entrer dans le parenchyme cérébral1. Une méthode actuellement utilisée pour administrer des traitements à travers le BBB dans le parenchyme cérébral consiste à utiliser des injections intracrâniennes stéréotaxiques2. D’autres méthodes moins invasives à l’étude sont entravées par la complexité des techniques utilisées, telles que la conception de médicaments pour l’administration médiée par les récepteurs à travers le BBB3, ou sont limitées dans la précision spatiale des zones ciblées, telles que les injections intranasales4 ou l’administration de solutions hyperosmotiques5.
L’utilisation d’ultrasons en conjonction avec des microbulles injectées de manière systémique, un agent de contraste à ultrasons, a été développée comme un moyen non invasif d’augmenter transitoirement la perméabilité du BBB6. En utilisant un transducteur focalisé7 ou un réseau de transducteurs phasés orientables8,9, les ultrasons peuvent être ciblés sur des zones sélectionnées du cerveau avec une précision millimétrique, minimisant ainsi les effets hors cible. Les traitements par microbulles par ultrasons peuvent être adaptés à l’anatomie cérébrale de chaque sujet en utilisant le guidage par imagerie par résonance magnétique7,10,11,12,13,14 ou des cadres stéréotaxiques15. En outre, l’étendue de l’augmentation de la perméabilité au BBB peut être contrôlée en temps réel en surveillant les émissions acoustiques des microbulles16,17,18. Des essais cliniques portant sur l’innocuité et la faisabilité des traitements par ultrasons-microbulles sont actuellement en cours dans le monde entier (p. ex., identificateur ClinicalTrials.gov NCT04118764).
Les traitements BBB à microbulles échographiques sont généralement évalués en confirmant les augmentations induites par le traitement de la perméabilité à la BHE, visualisées dans l’imagerie par résonance magnétique améliorée par contraste, ou par extravasation de colorant dans l’imagerie in vivo ou l’histologie ex vivo. Cependant, la plupart des analyses microscopiques ont été effectuées ex vivo, après l’achèvement des traitements par microbulles à ultrasons11,19, manquant ainsi les réponses biologiques dynamiques pendant et immédiatement après l’exposition aux ultrasons. L’imagerie en temps réel réalisée pendant l’exposition aux ultrasons peut aider à comprendre les mécanismes à l’origine des traitements de BBB à microbulles échographiques ainsi que les réponses en aval, ce qui peut améliorer notre compréhension de ses applications thérapeutiques. En outre, l’utilisation de fenêtres crâniennes chroniques avec des techniques d’imagerie in vivo permettrait des études longitudinales pour évaluer les aspects temporels des traitements par ultrasons et microbulles.
L’objectif de ce protocole est de décrire les procédures chirurgicales et techniques nécessaires pour effectuer une imagerie multiphotonique en temps réel des traitements par ultrasons et microbulles pour les études aiguës et chroniques chez les rongeurs (Figure 1). Ceci est réalisé en deux parties: premièrement, pour créer une fenêtre crânienne pour permettre l’imagerie in vivo, et deuxièmement, pour monter un transducteur annulaire sur le dessus pour permettre la sonication et l’imagerie simultanées. Les fenêtres crâniennes ont été largement utilisées par les neuroscientifiques pour l’imagerie in vivo du couplage neurovasculaire20, la pathogenèse β-amyloïde21 et la neuroimmunologie22, entre autres. Dans ce protocole, les procédures chirurgicales pour créer des fenêtres crâniennes aiguës (non-récupération) et chroniques (récupération) dans le crâne de souris et de rat sont décrites. Les méthodologies de fenêtre crânienne, en particulier pour les expériences chroniques, ont été bien documentées23,24,25. Pour être cohérent avec la littérature existante, les termes « aigu » et « chronique » seront utilisés tout au long de ce protocole. La conception de transducteurs annulaires pour l’imagerie in vivo a également été décrite précédemment26. Malgré la disponibilité de ces techniques et les connaissances qui peuvent être obtenues grâce à l’imagerie en temps réel des traitements par ultrasons et microbulles, très peu de laboratoires de recherche ont publié avec succès de la littérature utilisant cette technique26,27,28,29,30,31,32 . En tant que tel, dans ce protocole, les détails chirurgicaux et techniques de la réalisation de ces expériences échographiques-microbulles en temps réel sont décrits. Bien que les paramètres de sonication et d’imagerie spécifiés aient été optimisés pour les expériences de BHE, d’autres effets de l’exposition aux ultrasons sur le cerveau, tels que la neuromodulation33,34, la surveillance de la plaque β-amyloïde31 et les réponses des cellules immunitaires32, peuvent également être étudiés à l’aide de cette technique.
Protocole
Toutes les procédures expérimentales suivantes ont été approuvées et menées conformément à l’Autorité norvégienne de salubrité des aliments, au Comité des soins aux animaux de l’Institut de recherche Sunnybrook et au Conseil canadien sur les soins aux animaux.
1. Préparation du matériel
- Préparez le matériel nécessaire pour la chirurgie de la fenêtre crânienne et les traitements par microbulles à ultrasons. Pour les fenêtres crâniennes chroniques, des outils et des matériaux stérilisés, un espace chirurgical stérile et l’administration de médicaments avant et après la chirurgie sont nécessaires23,24,25.
- Préparation du transducteur et du couvercle
- Vérifiez l’intégrité physique du transducteur : recherchez les fissures et les bosses. Assurez-vous que les électrodes sur le dessus et le côté du transducteur sont intactes.
- Déposez de la colle cyanoacrylate dans un petit plat. Utilisez un applicateur pour étaler une fine couche de colle sur la surface du transducteur.
- Placez le transducteur sur le couvercle en verre. Appuyez fermement pendant 20-30 s.
REMARQUE: Un moule imprimé en 3D peut être utilisé pour faciliter l’alignement du couvercle en verre avec le transducteur annulaire, assurant une pression ferme et uniforme sur le couvercle et le transducteur annulaire (Figure 2). - Vérifiez s’il y a des bulles entre le transducteur et le couvercle. S’il y a des bulles, retirez le couvercle et répétez l’étape 1.2.3., car l’air empêche la propagation des ultrasons. Durcir toute la nuit à température ambiante.
- Une fois collé à un couvercle en verre, faites correspondre le transducteur (Figure 3).
REMARQUE: Ce protocole utilise un transducteur à anneau de titanate de zirconate de plomb fabriqué en interne (diamètre extérieur de 10 mm, épaisseur de 1,4 mm, hauteur de 1,2 mm)35, adapté à une impédance de 50 Ω et à une charge de phase de 0 ° avec un circuit d’adaptation personnalisé. Le transducteur est entraîné à 0,82 MHz en mode épaisseur, produisant un point focal circulaire à environ 1 mm sous le couvercle. Des transducteurs annulaires de propriétés similaires (diamètre extérieur de 10 mm, épaisseur de 1,5 mm, hauteur de 1,1 mm) ont été caractérisés26 et largement utilisés pour des expériences de microscopie multiphotonique27,28,29,31,32,36.
- Réutilisation du transducteur et remplacement du couvercle
- Remplacez le couvercle s’il est fissuré ou s’il contient des débris (p. ex. fourrure, colle) de l’expérience précédente. Pour retirer le couvercle, dissoudre la colle en immergeant le transducteur et le couvercle dans de l’acétone pendant 20 min.
REMARQUE: L’acétone peut affecter l’intégrité du transducteur et / ou des électrodes. Vérifiez auprès du fabricant avant de procéder à cette étape. - Vérifiez si l’acétone a dissous la colle en tirant doucement sur le couvercle avec une pince. Vérifiez une fois toutes les 10 minutes pour éviter une exposition prolongée à l’acétone.
- Remplacez le couvercle s’il est fissuré ou s’il contient des débris (p. ex. fourrure, colle) de l’expérience précédente. Pour retirer le couvercle, dissoudre la colle en immergeant le transducteur et le couvercle dans de l’acétone pendant 20 min.
2. Préparation des animaux
- Anesthésiez l’animal en utilisant un mélange d’air médical, d’oxygène et d’isoflurane dans une chambre d’induction.
REMARQUE: Il a été rapporté que l’utilisation de l’oxygène comme gaz porteur affecte la demi-vie des microbulles37,38 et diminue l’ampleur des augmentations de la perméabilité à la BHE induites par les ultrasons et les microbulles27, mais peut également réduire le risque d’hypoxie et de mortalité39. Choisissez les gaz porteurs en fonction des objectifs du projet et des conseils du vétérinaire. Des anesthésiques injectables tels qu’un cocktail kétamine/xylazine peuvent également être utilisés; cependant, il est plus facile de contrôler le plan d’anesthésie et les niveaux d’oxygène dans le sang lors de l’utilisation d’anesthésiques inhalables. - Vérifiez que l’animal a atteint un plan d’anesthésie suffisant en effectuant un pincement des orteils. Peser l’animal pour déterminer la dose de dextran, de microbulles et de médicaments à administrer. Retirez la fourrure de la tête de l’animal et placez-le sur un cadre stéréotaxique.
- Pour les expériences aiguës, l’accès à la circulation systémique doit être établi pour les injections de dextran et de microbulles. Pour ce faire, insérez un cathéter de 27 g dans une veine caudale.
REMARQUE: Bien que les injections rétro-orbitales soient également possibles, les veines caudales sont recommandées en raison de l’espace de travail limité dans la zone de la tête lors de l’imagerie multiphotonique. - Transférez l’animal sur le cadre stéréotaxique et passez l’anesthésie au cône du nez. Maintenez la température centrale de l’animal de 37 °C à l’aide d’une source de chaleur, comme un coussin chauffant ou un gant rempli d’eau tiède.
- Surveillez la température animale à l’aide d’une sonde rectale et la physiologie animale à l’aide d’un oxymètre de pouls. Appliquer une pommade ophtalmique. Injecter des analgésiques et/ou des anti-inflammatoires préopératoires appropriés (voir le tableau des matériaux).
- Avant de commencer la chirurgie de la fenêtre crânienne, vérifiez le plan de l’anesthésie et la fréquence cardiaque de l’animal, la saturation en O2 , la fréquence respiratoire et la température.
- Pour commencer la chirurgie de la fenêtre crânienne, enlevez la fourrure sur la tête en appliquant une crème dépilatoire et / ou en utilisant des tondeuses à fourrure. Retirez la fourrure entre les yeux et la moitié antérieure du cou (figure 4A).
REMARQUE: Un contact prolongé avec la crème dépilatoire brûlera la peau. Pour les chirurgies chroniques des fenêtres crâniennes, lavez le cuir chevelu avec des lingettes alternées de bétadine et 70% d’EtOH après l’enlèvement de la fourrure. Préparer l’espace chirurgical pour la chirurgie stérile. La stérilité doit être maintenue jusqu’à l’étape 2.15. - Pour enlever le cuir chevelu, soulevez la peau entre les yeux à l’aide d’une pince tenue dans la main non dominante, le long de la suture sagittale. À l’aide de ciseaux incurvés, retirez la peau pour exposer les os pariétaux (figure 4B). Appliquez une pression ferme avec un coton-tige s’il y a des saignements du crâne ou du cuir chevelu; le saignement doit être arrêté avant de passer à l’étape suivante.
REMARQUE: Pour les chirurgies aiguës, la peau peut être repoussée et collée au crâne à l’aide de colle cyanoacrylate liquide ou d’adhésif tissulaire. - Retirez le périoste qui recouvre la surface externe du crâne à l’aide de cotons-tiges.
- À l’aide d’un microscope opératoire (6-25x) et d’une perceuse dentaire (bavure de forage de 0,5 mm, vitesse moyenne), tracez un cercle sur l’os pariétal pour marquer l’emplacement souhaité de la fenêtre crânienne sur le crâne (Figure 5). Évitez la suture sagittale, le lambda et le bregma, car ces zones sont plus minces et recouvrent de gros vaisseaux sanguins.
REMARQUE : Pour faciliter le forage, un contour de la fenêtre crânienne peut être dessiné sur le crâne à l’aide d’un marqueur et d’un pochoir (figure 5A). Pour les rats, il peut être plus facile de percer une fenêtre rectangulaire au lieu d’une fenêtre crânienne circulaire. En raison de l’épaisseur de l’os du crâne de rat, utilisez un foret de 0,7 mm pour délimiter la fenêtre crânienne de l’os compact avant d’utiliser un foret de 0,5 mm pour terminer le processus de forage. - Appliquer une légère pression avec le foret; une pression excessive augmente le risque de causer des dommages aux tissus cérébraux. Pour éviter que le crâne ne surchauffe pendant le forage, égouttez une solution saline sur le crâne à l’aide d’une seringue ou appliquez un morceau d’éponge chirurgicale imbibé d’une solution saline.
- Alternez entre le forage et le refroidissement du crâne jusqu’à ce que l’îlot osseux résultant se sépare du reste du crâne. Vérifiez la progression du forage en appliquant une légère pression sur l’îlot osseux à l’aide d’une pince ou du foret. Continuez à forer jusqu’à ce que l’îlot osseux se sépare du reste du crâne.
REMARQUE: De petites fissures dans les zones les plus minces du crâne sont une bonne indication que le forage est presque terminé. Tenter d’enlever l’îlot osseux prématurément peut provoquer la pénétration de morceaux d’os dans le tissu cérébral, endommageant la dure-mère et provoquant une inflammation et des saignements. - Retirez l’îlot osseux à l’aide d’une paire de pinces fines pour saisir les bords, ou la couche osseuse compacte supérieure, de l’îlot osseux (Figure 6A). Assurez-vous que le cerveau est maintenu humide en appliquant un morceau d’éponge chirurgicale qui a été pré-trempé dans une solution saline. Si un saignement est observé, placez l’éponge chirurgicale sur la région qui saigne. Ne passez pas à l’étape suivante tant que le saignement n’a pas cessé.
REMARQUE: Si le saignement persiste après 5 minutes, l’animal ne peut pas être utilisé pour des expériences d’imagerie multiphotonique. Pour les rats, il peut être nécessaire d’enlever la dure-mère si elle est épaisse. Pour retirer la dure-mère, utilisez un grossissement élevé sur le microscope opératoire et une paire de pinces fines. - Pour placer une fenêtre crânienne, prenez un couvercle en verre avec une paire de pinces, placez une goutte de solution saline sur un côté et manœuvrez-la sur le trou dans le crâne. Assurez-vous qu’il n’y a pas de bulles d’air sous le couvercle.
REMARQUE: Utilisez un couvercle en verre de 5 mm pour les souris et de 8 mm pour les rats. Pour les rats, en raison de l’épaisseur de l’os du crâne, utilisez une solution d’agarose au lieu d’une solution saline pour remplir l’espace entre la lèvre de couverture et le cerveau. Le transducteur et son couvercle peuvent également être collés directement sur le crâne, au lieu d’utiliser un couvercle séparé pour la fenêtre crânienne. Pour cette option, passez à l’étape 3.1. Reportez-vous à la Figure 1 pour plus de détails. - Étalez une couche de colle cyanoacrylate autour du périmètre de la couverture (Figure 6B) pour l’attacher au crâne. Assurez-vous qu’il n’y a pas de colle sous le couvercle. Appliquez une pression sur le couvercle pour vous assurer que la colle n’entre pas en contact avec le cerveau.
- Une fois que la colle est complètement sèche, égalisez la surface de la colle à l’aide de la perceuse dentaire. Assurez-vous que tous les débris de colle sont retirés de la zone chirurgicale.
REMARQUE: Pour les fenêtres crâniennes chroniques, injectez les médicaments post-chirurgicaux nécessaires (voir la table des matériaux), fournissez une pommade pour le soin des plaies et les aliments mous, et récupérez l’animal sous une lampe chauffante.
3. Placement du transducteur annulaire
- Préparer la solution d’agarose à 1 % (p/v). Dans un petit bécher ou une fiole d’Erlenmeyer, ajouter 0,1 g d’agarose et 10 mL de PBS (1x) ou de solution saline. Faire bouillir la solution jusqu’à ce que l’agarose soit complètement dissoute en plaçant le bécher sur une plaque chauffante ou en chauffant la solution dans un four à micro-ondes (30-45 s).
- Les étapes 3.2 à 3.5 sont sensibles au temps car la solution d’agarose refroidit rapidement. Prélever ~ 0,5 mL d’agarose dans une seringue de 1 mL.
REMARQUE: Pour protéger l’intégrité du cerveau, assurez-vous que la température de l’agarose se rapproche de la température corporelle avant utilisation. - Déposez généreusement l’agarose sur le couvercle de la fenêtre crânienne.
REMARQUE: Si le tissu blanchit, la température de l’agarose était trop élevée; l’animal doit être euthanasié. S’il n’y a pas de couvercle séparé couvrant le cerveau (c.-à-d. que le transducteur et son couvercle sont placés directement sur le cerveau, voir l’étape 2.14), l’agarose doit être déposée à la surface du cerveau à cette étape. - Placez le transducteur au-dessus de la fenêtre crânienne (Figure 6C). Appliquez une pression ferme telle qu’il y ait un minimum d’agarose entre le transducteur et la fenêtre crânienne. Assurez-vous que le transducteur est centré (plan XY) et parallèle (plan Z) à la fenêtre crânienne, et qu’il n’y a pas de bulles d’air dans l’agarose.
- Lorsque l’agarose a refroidi à une consistance semblable à celle du jello, coupez l’excès d’agarose de la circonférence du couvercle du transducteur à l’aide d’une spatule ou d’un scalpel. Assurez-vous qu’il n’y a pas de bulles d’air sous le couvercle du transducteur.
- À l’aide d’une spatule, étalez une couche de colle cyanoacrylate sur la circonférence de la glissière du transducteur, s’étendant jusqu’au crâne, de sorte que le transducteur soit fermement adhéré au crâne.
- Maintenez une pression ferme sur le transducteur jusqu’à ce que la colle ait complètement séché (10-15 min).
4. Imagerie par microscopie multiphotonique
- Placez l’animal sous la lentille de l’objectif (Figure 7A). Assurez-vous que la lentille de l’objectif est centrée dans le transducteur annulaire et parallèle au transducteur (Figure 7B). Si une lentille d’objectif à immersion dans l’eau est utilisée, remplissez le centre du transducteur annulaire avec de l’eau désionisée et dégazée.
REMARQUE: L’eau dégazée est importante pour une bonne propagation des ultrasons. - Commencez avec l’objectif dans sa position la plus haute, puis abaissez lentement l’objectif jusqu’à ce qu’il soit dans le transducteur annulaire (Figure 7A, B). Assurez-vous que l’objectif n’entre pas en collision avec le transducteur ou le couvercle.
REMARQUE: Alternez entre l’oculaire pour vérifier si la position Z de la lentille de l’objectif est dans le plan avec la surface du cerveau, et à l’œil pour vous assurer que la lentille de l’objectif n’entre pas en collision avec le transducteur ou le couvercle. Il peut être plus facile de visualiser les vaisseaux piaux à travers l’oculaire après l’injection de dextran fluorescent dans la veine caudale (Figure 7C). - Préparez le microscope multiphotonique pour l’imagerie.
REMARQUE: Ce protocole utilise un microscope multiphoton vertical et un objectif 20-25x qui a une distance de travail de 2 mm, ce qui est suffisant pour faire la mise au point au-delà de la ou des couvertures, dans le parenchyme cérébral. - Préparez le dextran. Ajouter la quantité appropriée de PBS au flacon de dextran, conformément aux instructions du fabricant. Vortex la solution de dextran pendant 1-3 min pour s’assurer que la poudre de dextran est complètement dissoute. Injecter la solution de dextran dans la veine caudale.
- Configuration d’une numérisation d’image
- À l’aide des oculaires, assurez-vous que la lentille de l’objectif est parallèle au cerveau. Inclinez l’animal pour corriger les désalignements XZ et YZ.
- Sélectionnez un champ de vision dans un microscope multiphotonique. Configurez un scanner XYZ avant l’exposition aux ultrasons pour avoir une image de base du système vasculaire avant l’exposition aux ultrasons.
REMARQUE: Les paramètres d’imagerie typiques sont les suivants: 300-800 μm de profondeur, 2-5 μm de taille de pas et 10-20 piles de temps. Assurez-vous que la lentille de l’objectif n’entre pas en contact avec le transducteur ou le couvercle à son point le plus bas pendant la séquence d’imagerie.
5. Exposition aux ultrasons
- Assurez-vous que tous les câbles BNC sont correctement connectés (Figure 3).
- Configurez un scan d’image XYZT suffisamment long pour capturer des piles d’images avant, pendant et après les traitements à microbulles échographiques.
- Préparez les microbulles en suivant les instructions du fabricant. Injectez les microbulles dans la veine caudale et commencez l’imagerie.
REMARQUE: Les injections de microbulles peuvent être effectuées avec une pompe à perfusion pour assurer un taux d’injection constant et pour permettre l’injection et l’imagerie simultanées de microbulles. Si des microbulles doivent être injectées pendant l’imagerie, assurez-vous que la veine caudale est facilement accessible sans exposer les détecteurs à la lumière ambiante. - Commencez la sonication.
REMARQUE: Les paramètres de sonication typiques sont les suivants: cycles de 10 ms, indice mécanique de 0,2-0,4 et fréquences de répétition d’impulsions entre 1 et 4 Hz. Les paramètres de sonication et de microbulles utilisés dans les études précliniques échographiques-microbulles ont été largement étudiés et sont bien documentés dans la littérature (par exemple, voir 40 pour une revue). - Poursuivre l’imagerie multiphotonique pendant toute la durée de la sonication et après la fin de la sonication. Soyez attentif à l’extravasation de la dextrane des vaisseaux sanguins, car cela indique une augmentation de la perméabilité à la BHE.
REMARQUE: Si le dextran est détecté dans l’espace extravasculaire, mais à la périphérie du champ de vision, il peut y avoir des vaisseaux sanguins affectés en dehors du champ de vision. Cela peut résulter d’un mauvais alignement du transducteur avec la mise au point de l’objectif. Dans ce scénario, il est plus facile d’ajuster le champ de vision en déplaçant la lentille de l’objectif ou en repositionnant l’animal, que de réaligner le transducteur. - Une fois l’imagerie terminée, euthanasier la luxation cervicale de l’animal sous anesthésie profonde ou asphyxie au CO2 . Pour les fenêtres crâniennes chroniques, étalez une couche de ciment dentaire sur le crâne exposé.
REMARQUE: Pour les fenêtres crâniennes chroniques, la peau entourant la fenêtre peut être suturée, bien que cela ne soit pas nécessaire, en raison de l’ablation du cuir chevelu à l’étape 2.8.
6. Analyse d’images
- Exporter des piles d’images.
- Analysez des images avec un logiciel d’analyse d’images (par exemple, Olympus Fluoview, ImageJ/FIJI, Bitplane Imaris, ThermoFisher Scientific Amira) et/ou des outils de programmation (par exemple, Python, MATLAB).
Résultats
Les traitements échographiques-microbulles réussis peuvent être détectés par l’extravasation du dextran fluorescent de l’espace intravasculaire à l’espace extravasculaire (Figure 8), indiquant une augmentation de la perméabilité au BBB. Selon le champ de pression du transducteur annulaire, les vaisseaux piaux et/ou les capillaires seront affectés.
Pour évaluer les changements vasculaires induits par les traitements par microbulles à ultrasons, le diamètre du vaisseau d’intérêt peut être mesuré avant, pendant et après le traitement par microbulles échographiques (figure 9). Cela peut être fait manuellement dans un logiciel disponible dans le commerce (par exemple, le logiciel Olympus Fluoview). Lors de l’acquisition d’images, des injections de bolus dextran et des balayages linéaires peuvent également être utilisés pour évaluer le flux sanguin30,41. Pour évaluer la cinétique des fuites de dextran en tant que modèle représentatif de l’administration de médicaments, l’intensité du signal entre les espaces intra et extravasculaires peut être évaluée à l’aide d’outils tels que MATLAB26,27,29,41 (Figure 10).
Un traitement d’image supplémentaire peut être réalisé à l’aide d’ImageJ/FIJI. ImageJ/FIJI est un logiciel open source compatible avec MATLAB et bien adapté pour effectuer des analyses courantes dans l’analyse d’images biologiques, telles que la mesure des changements vasculaires, ou la longueur ou la distance entre les objets fluorescents (par exemple, les plaques β-amyloïdes aux vaisseaux sanguins). Les pipelines de traitement d’image créés dans ImageJ/FIJI peuvent être automatisés en écrivant des macros personnalisées.
Des analyses plus complexes, telles que la segmentation 3D des vaisseaux sanguins et le suivi cellulaire, peuvent être réalisées à l’aide d’un logiciel semi-automatisé plus avancé (Figure 11). Après la segmentation, des analyses plus spécifiques peuvent être effectuées, telles que la classification des vaisseaux sanguins en tant qu’artérioles, veinules ou capillaires, en fonction du diamètre, de la ramification, des modèles de tortuosité et de la direction de l’écoulement42,43. Des algorithmes d’apprentissage automatique ont également été développés pour automatiser la segmentation des vaisseaux sanguins22,44.
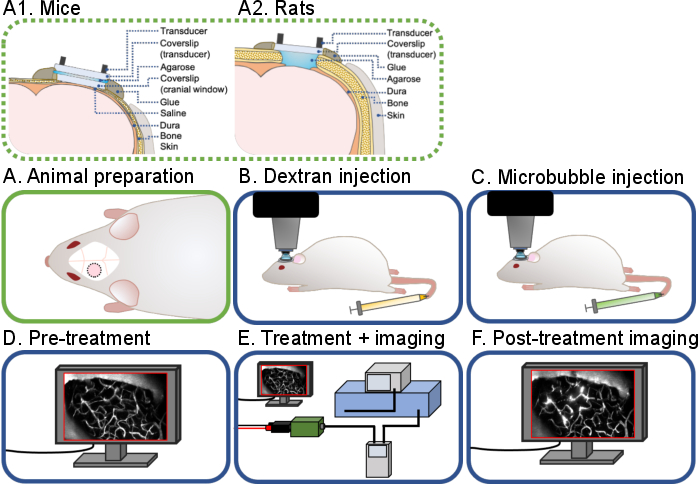
Figure 1 : Flux de travail général des expériences cérébrales intravitales multiphotoniques à ultrasons et microbulles. Un flux de travail général des expériences cérébrales intravitales multiphotoniques à ultrasons et microbulles décrites dans ce protocole est montré. Il y a 6 étapes: (A) Préparation animale pour (A1) souris et (A2) rats, (B) injection de Dextran, (C) Injection de microbulles, (D) Imagerie prétraitemente, (E) Traitement et imagerie, (F) Imagerie post-traitement et analyse des données. Veuillez cliquer ici pour voir une version agrandie de cette figure.
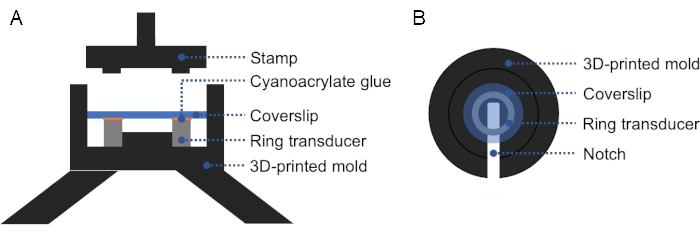
Figure 2 : Coupe et vue de dessus du moule imprimé en 3D. (A) Coupe transversale du moule. Une fine couche de colle cyanoacrylate est appliquée sur la surface supérieure du transducteur annulaire et un couvercle est placé sur le dessus. Un tampon peut être utilisé pour appliquer une pression ferme et uniforme sur le couvercle et le transducteur annulaire. (B) Vue de dessus du moule. Une encoche peut être ajoutée dans le moule pour faciliter le retrait du transducteur préparé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
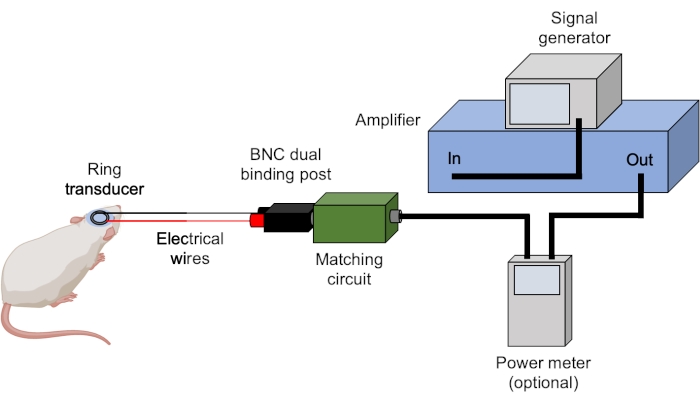
Figure 3 : Configuration des ultrasons. Le matériel typique pour les expériences d’échographie est montré. Les paramètres ultrasonores sont réglés et déclenchés par le générateur de signaux et amplifiés par l’amplificateur. Un capteur de puissance peut être utilisé pour enregistrer les puissances avant et réfléchies avant d’envoyer le signal à la boîte correspondante, qui est adaptée au transducteur. Toutes les connexions sont réalisées à l’aide de câbles BNC, sauf indication contraire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
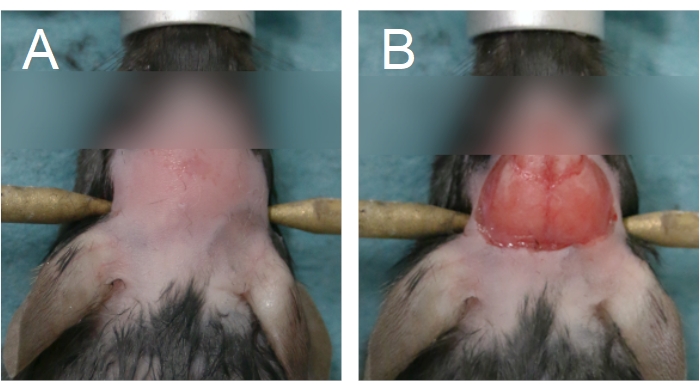
Figure 4 : Zone d’enlèvement de la fourrure et du cuir chevelu. (A) L’enlèvement de la fourrure doit commencer entre les yeux et s’étendre jusqu’à la moitié antérieure du cou. (B) L’ablation du cuir chevelu doit être suffisante pour exposer les os pariétaux. Le saignement doit être arrêté avant de continuer. Veuillez cliquer ici pour voir une version agrandie de cette figure.
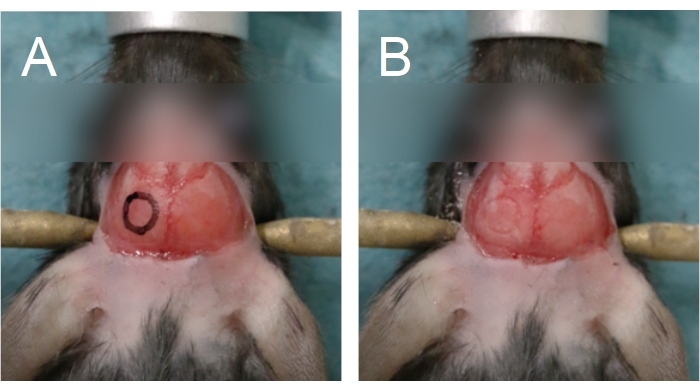
Figure 5 : Contour de la fenêtre crânienne. La fenêtre crânienne est située sur un os pariétal. (A) Un contour de la fenêtre crânienne peut être dessiné sur le crâne pour faciliter le processus de forage. (B) Le contour de la fenêtre crânienne peut être vu après le forage à travers l’os compact. Veuillez cliquer ici pour voir une version agrandie de cette figure.
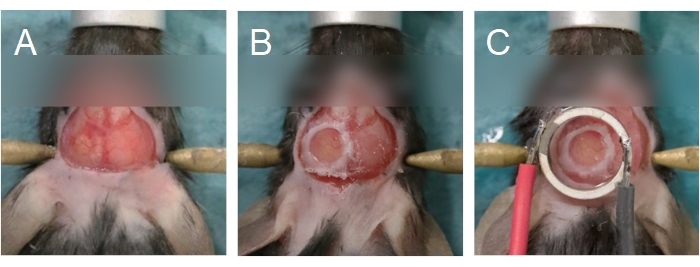
Figure 6 : Alignement de la fenêtre crânienne et du transducteur. (A) La fenêtre crânienne est créée sur un os pariétal. L’îlot osseux a été enlevé, exposant le cerveau en dessous. (B) La fenêtre crânienne est complète lorsqu’un couvercle en verre est scellé sur le crâne à l’aide de colle cyanoacrylate. (C) Le transducteur est centré sur la fenêtre crânienne et adhéré à l’aide de colle cyanoacrylate. Veuillez cliquer ici pour voir une version agrandie de cette figure.
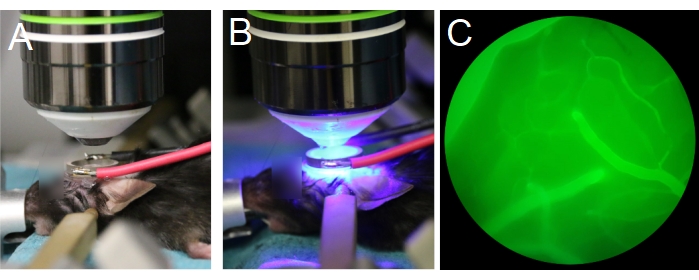
Figure 7 : Positionnement de l’objectif et du transducteur. (A,B) L’objectif est centré sur le transducteur annulaire. (C) Les vaisseaux sanguins remplis de dextran fluorescent sont visibles à travers les oculaires, sous épifluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
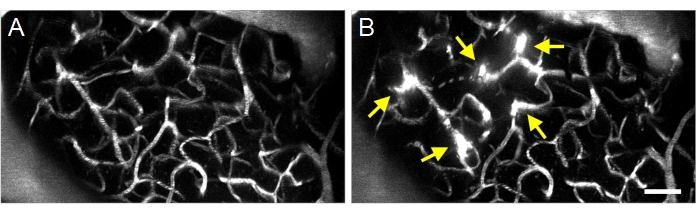
Figure 8 : Projection maximale d’images multiphotoniques d’augmentations de la perméabilité induite par des microbulles à ultrasons. Images de projection maximale de la vascularisation (A) avant et (B) après les traitements par ultrasons-microbulles. Les traitements échographiques-microbulles réussis peuvent être confirmés en observant une augmentation de la perméabilité à la BHE après le traitement, visualisée sous forme d’extravasation fluorescente de la dextrane (flèches). Barre d’échelle : 50 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
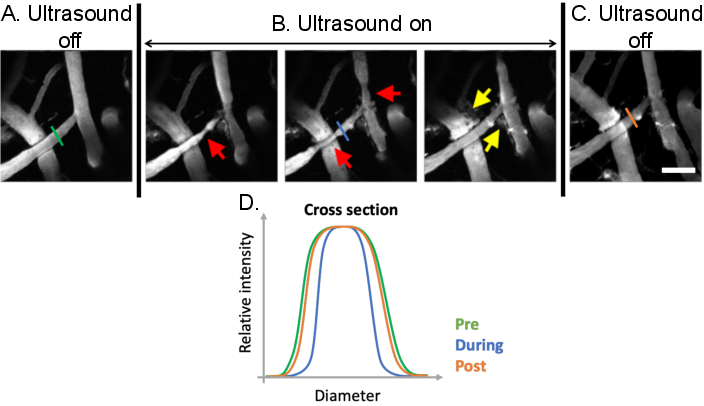
Figure 9 : Analyse de la vasomodulation induite par les traitements par ultrasons-microbulles. Images de projection maximale des vaisseaux sanguins cérébraux avant, pendant et après les traitements par microbulles échographiques. Des microbulles sont présentes dans toutes les images. Par rapport aux conditions de prétraitement (A), une vasomodulation claire peut être observée (B) lors de traitements par microbulles échographiques (flèches rouges). Les augmentations de la perméabilité à la BHE médiées par les ultrasons et les microbulles sont également évidentes après le traitement de la fuite de dextran fluorescent de l’espace intravasculaire vers l’espace extravasculaire (flèches jaunes). (C) Lorsque l’échographie est désactivée, les diamètres vasculaires reviennent aux tailles de base du prétraitement. (D) Les changements vasculaires peuvent être analysés en traçant le diamètre du vaisseau d’intérêt avant, pendant et après le traitement par microbulles échographiques. Barre d’échelle : 100 μm. (Œuvre inédite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
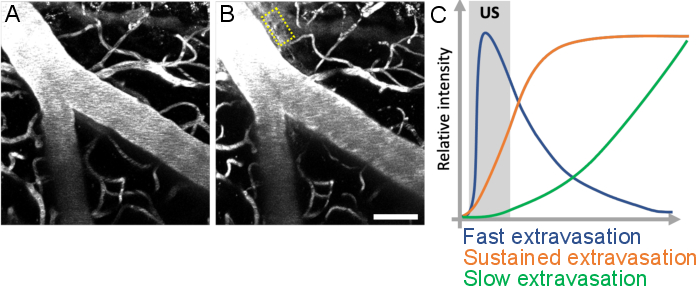
Figure 10 : Analyse de la cinétique des fuites après des traitements par microbulles par ultrasons. L’augmentation de la perméabilité au BBB est visualisée comme une fuite de dextran fluorescent de l’espace intravasculaire vers l’espace extravasculaire. Les changements dans la perméabilité à la BHE sont évidents lorsque l’on compare les piles d’images acquises (A) avant et (B) après les traitements par microbulles échographiques. (C) La cinétique de fuite peut être analysée en suivant l’intensité, le volume et la vitesse du dextran dans des compartiments extravasculaires (rectangle jaune). Barre d’échelle : 50 μm. (Œuvre inédite.) Veuillez cliquer ici pour voir une version agrandie de cette figure.
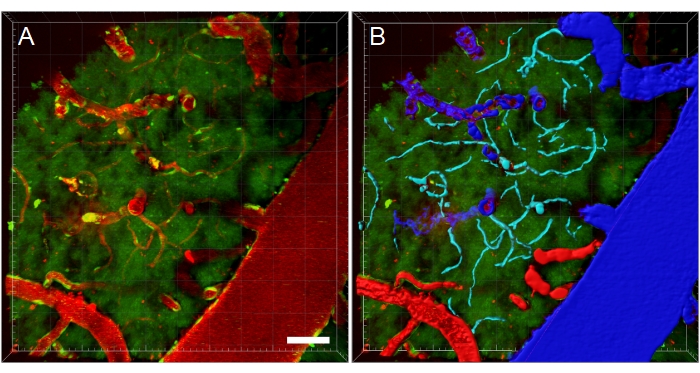
Figure 11 : Segmentation des vaisseaux sanguins de la pile XYZ de microscopie multiphotonique. (A) Profondeur (XYZ) pile de vaisseaux sanguins chez un rat EGFP transgénique. Les vaisseaux sanguins sont visualisés par injection intraveineuse de texas red fluorescent 70 kDa dextran (rouge). Le canal vert montre les cellules fluorescentes et l’autofluorescence tissulaire. (B) Des reconstructions 3D des vaisseaux sanguins sont créées, puis codées par couleur en fonction du type de vaisseau sanguin pour faciliter les analyses spécifiques au type. Les veines/veinules sont bleues, les artères/artérioles sont rouges et les capillaires sont cyan. Barre d’échelle: 50 μm. Reconstructions créées à l’aide de Bitplane Imaris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La surveillance intravitale du cerveau par microscopie multiphotonique est un outil précieux pour étudier les réponses cérébrales lors de l’exposition aux ultrasons. À notre connaissance, le protocole décrit ici est la seule méthode d’imagerie par microscopie multiphotonique du parenchyme cérébral lors de traitements échographiques-microbulles. La création de fenêtres crâniennes et l’utilisation de transducteurs annulaires permettent de surveiller en temps réel les réponses vasculaires, cellulaires et autres réponses en aval aux traitements ultrasonores-microbulles à haute résolution spatiale et temporelle. D’autres groupes ont effectué une imagerie par microscopie multiphotonique après l’achèvement des traitements par microbulles par ultrasons, manquant ainsi la réponse en temps réel du parenchyme cérébral aux traitements19. La procédure décrite offre un meilleur contrôle temporel, permettant la collecte de données qui peuvent aider à éclairer les mécanismes aigus derrière les traitements à ultrasons et à microbulles. Des données quantitatives et qualitatives peuvent être extraites et analysées à partir des piles d’images acquises, telles que la cinétique d’extravasation27,29,30, les changements dans le volume de la plaque β-amyloïde31 et la dynamique cellulaire32.
Plusieurs étapes de dépannage ont été mises en évidence tout au long du protocole. Tout d’abord, les étapes chirurgicales particulièrement sensibles à l’erreur de l’opérateur ont été soulignées, telles que l’utilisation de l’agarose lors de la chirurgie de la fenêtre crânienne et la mise en place du transducteur. Des mesures visant à prévenir l’inconfort et la mort des animaux ont également été fournies, notamment la surveillance de la physiologie animale pendant la chirurgie et le vortex complet du dextran avant l’injection. Deuxièmement, les spécifications physiques du transducteur et l’alignement de la lentille de l’objectif, du transducteur et de la fenêtre crânienne ont également été mis en évidence. Les spécifications du transducteur annulaire et ses propriétés acoustiques doivent être déterminées en tenant compte de la lentille d’objectif utilisée ainsi que du modèle animal. Plus précisément, le diamètre intérieur du transducteur annulaire doit être assez grand pour entourer la lentille de l’objectif, mais suffisamment petit pour être monté solidement sur le crâne de l’animal. De plus, la zone focale du transducteur doit s’aligner sur la portée de l’objectif utilisé.
Un défi courant est que la fenêtre crânienne et le transducteur annulaire sont inclinés par rapport à l’objectif. Un centrage approprié (XY) et un alignement (Z) de la lentille de l’objectif avec la fenêtre crânienne et le transducteur garantissent que la zone focale du transducteur, et donc la région du tissu cérébral traité, s’aligne sur le champ de vision d’imagerie et réduit le risque de collision entre la lentille de l’objectif et le transducteur pendant l’imagerie. L’alignement peut être réalisé en ajustant la position de la tête de l’animal et/ou en faisant pivoter le cadre stéréotaxique dans lequel il est fixé.
Les composants du microscope (p. ex., détecteurs, séparateurs de faisceau) et les paramètres d’acquisition d’images doivent être choisis en fonction de l’objectif de l’étude. Ici, un objectif avec une longue distance focale (> 2 mm) est utilisé en raison de la présence du ou des couvercles et du transducteur annulaire situé entre l’objectif et le cerveau. Un microscope vertical est également recommandé car il permet plus d’espace pour manœuvrer l’animal, en particulier pour les expériences cérébrales. Pour capturer la cinétique de la fuite induite par ultrasons-microbulles du colorant intravasculaire, une résolution temporelle élevée est favorable, ce qui peut être obtenu en utilisant un système de balayage par résonance. La combinaison de cela avec un système de détection à haute sensibilité, tel que les détecteurs de phosphure d’arséniure de gallium (GaAsP), donnera également des images plus favorables.
La procédure expérimentale présentée présente plusieurs limites. Tout d’abord, l’intervention chirurgicale est assez invasive et il a été rapporté qu’elle provoque une inflammation45, bien que l’inflammation puisse être minimisée46. De plus, les réponses immunitaires induites par les chirurgies de la fenêtre crânienne ont été observées pour disparaître de 2 à 4 semaines après la chirurgie23,24,25. En outre, le processus de forage, en particulier lorsqu’il est mené avec une force ou une vitesse excessive, peut endommager les tissus sous-jacents en raison de la génération de chaleur, de vibrations et de pression appliquée. On a également observé que les chirurgies de fenêtre crânienne et l’imagerie multiphotonique affectaient la température du cerveau47. Ces limitations peuvent être réduites dans une certaine mesure grâce à la création minutieuse de fenêtres crâniennes immaculées, à la récupération appropriée des animaux ayant des fenêtres crâniennes chroniques et au maintien de la température corporelle normotherme à l’aide d’une source de chauffage avec contrôle de rétroaction. Deuxièmement, la profondeur d’imagerie est limitée par le microscope et la lentille d’objectif utilisés. Par exemple, l’effet du traitement par microbulles à ultrasons dans les structures cérébrales plus profondes, telles que l’hippocampe, ne peut être étudié sans mesures plus invasives, telles que l’élimination du tissu cortical sus-jacent48 ou l’utilisation de microlentilles en conjonction avec la pénétration corticale49. L’utilisation d’un objectif avec une longue distance de travail pourrait résoudre ce problème dans une certaine mesure, mais la pénétration de la lumière est également limitée à de plus grandes profondeurs.
Bien que les images représentatives de ce protocole aient été acquises auprès de rongeurs de type sauvage, la procédure expérimentale présentée peut également être appliquée à des animaux transgéniques et à des modèles de maladies, tels que la maladie d’Alzheimer31. Les expériences échographiques non liées à la modulation BBB, telles que la neuromodulation induite par ultrasons, peuvent également être surveillées à l’aide de ce protocole33,34. D’autres applications possibles peuvent être réalisées en utilisant différentes configurations de microscope ou de détecteur, telles que l’appariement d’un microscope confocal avec une caméra ultra-haute vitesse50. Alors que le photoblanchiment et la phototoxicité sont comparativement pires dans les microscopes confocaux en raison du grand volume d’excitation, l’imagerie à ultra-haute vitesse peut permettre de visualiser les interactions cellules endothéliales-microbulles capillaires cérébrales avec une résolution temporelle élevée, ce qui pourrait éclairer davantage les mécanismes à l’origine des traitements BBB ultrasonore-microbulle. Pour conclure, le protocole décrit fournit une méthode pour surveiller les effets vasculaires et cellulaires induits par les expériences de BBB à microbulles à ultrasons en temps réel, fournissant un outil pour déterminer davantage les mécanismes à l’origine de ces traitements, ainsi que pour éclairer les réponses en aval du parenchyme cérébral aux traitements par ultrasons-microbulles.
Déclarations de divulgation
Charissa Poon, Melina Mühlenpfordt, Marieke Olsman et Catharina de Lange Davies ne déclarent aucun conflit d’intérêts financier ou non financier concurrent. Spiros Kotopoulis est un employé à temps plein et détient des actions dans EXACT Therapeutics AS, une société développant des ultrasons et une administration améliorée de médicaments par microbulles / grappes. Kullervo Hynynen est le fondateur de FUS Instruments, dont il reçoit un soutien non lié à la recherche.
Remerciements
Le logement des animaux a été fourni par le Centre de médecine comparée (CoMed, NTNU). La figure 3 a été créée en BioRender.com. L’enregistrement et le montage vidéo ont été réalisés par Per Henning, webmaster à la Faculté des sciences naturelles de NTNU. Le projet a été financé par l’Université norvégienne des sciences et de la technologie (NTNU, Trondheim, Norvège), le Conseil de recherches de Norvège (RCN 262228), les Instituts de recherche en santé du Canada (FDN 154272), l’Institut national de la santé (R01 EB003268) et la Chaire Temerty en recherche ciblée sur les ultrasons au Sunnybrook Health Sciences Centre.
matériels
| Name | Company | Catalog Number | Comments |
| Ring transducer placement | |||
| Agarose (powder) | Sigma-Aldrich | A9539 | |
| Beaker or Erlenmeyer flask (50 ml) | VWR | 213-0462 or 214-1130 | |
| Cyanoacrylate glue (gel) | Loctite | 1363589 | |
| Glass coverslips (13 mm) | Thermo Fisher Scientific | CB00130RA120MNT0 | Coverslip for ring transducer. |
| Hot plate or microwave | Corning | PC-400D | To heat agarose solution. |
| PBS (1X) | Sigma-Aldrich | P4417 | |
| Ring transducer | Custom-made | Custom-made | Custom-made. E.g. https://doi.org/10.1109/ULTSYM.2014.0518 |
| Rubber stopper | VWR | 217-0867 | |
| Animal preparation and drugs | |||
| Bupivacaine*A | Aspen | 169912 | Dose: 1 mg/kg, s.c., local anesthetic injected at incision site. |
| Buprenorphine*A | Indivior | 521634 | Dose mouse: 0.05-0.1 mg/kg, s.c., opioid, administer pre-surgery. |
| Buprenorphine*A | Indivior | 521634 | Dose rat: 0.01-0.05 mg/kg, s.c.. |
| Carprofen*C | Pfizer | DIN 02255693 | Dose: 5 mg/kg, s.c., NSAID, adminster post-surgery. |
| Depilatory cream | Veet | N/A | For complete fur removal after trimming. |
| Dexamethasone*C | Sandoz | DIN 00664227, 2301 | Dose: 3 mg/kg, i.m., corticosteroid, reduces cerebral edema, administer pre-surgery. |
| Enrofloxacin*C | Bayer | DIN: 02249243 | Dose: 5 mg/kg, i.p., antibiotic, administer post-surgery. |
| Fur clippers | Aesculap | 90200714 | Exacta/Isis. |
| Heating pad | Physitemp Instruments INC | HP-1M | |
| Isoflurane | Baxter | ESDG9623C | Dose: 3% induction, 1% maintenance; anesthetic. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose mouse: 2-3 mg/kg, s.c., NSAID, administer pre-surgery. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose rat: 1 mg/kg, s.c. |
| Pulse oximeter | STARR Life Sciences Corp | N/A | MouseOx. |
| Stereotaxic frame | Kopf | Kopf 900 | |
| Sterile ophthalmic ointment | Théa | 597562 | Viscotears. |
| Tail vein catheter (24 G) | BD Neoflon | 391350 | |
| * Discuss dosing and type of administration with veterinarian prior to use. A For acute window surgeries, C For chronic window surgeries. Dose for mice and rats are the same unless otherwise specified. | |||
| Material and equipment for cranial window placement | |||
| Alcohol swabs | BD | 326895 | |
| Curved fine surgical scissors | Fine Science Tools | 14002-12 | |
| Cotton or fibreless swabs | Chemtronics | CX50 | |
| Cyanoacrylate glue (gel) | Loctite | 1594457 (gel), 230992 (liquid) | If unavailable, liquid cyanoacrylate glue can be mixed with extra-fine acrylate powder. |
| Dental cement | Lang Dental | Jet Set-4 Denture Repair Package | |
| Dental micromotor hand drill | FOREDOM | K.1070-2 | High speed rotary micromotor kit with 2.35 mm collet. |
| Forceps | Fine Science Tools | 11152-10, 11370-40 | |
| Glass coverslips | Thermo Fisher Scientific | CB00050RA120MNT0 (5 mm) | Mouse cranial windows. |
| Glass coverslips | Thermo Fisher Scientific | CB00080RA120MNT0 (8 mm) | Rat cranial windows. |
| Micro drill burrs (0.5 mm) | Meisinger | HM71005 (0.5 mm) | |
| Micro drill burrs (0.7 mm) | Meisinger | HM71007 (0.7 mm) | |
| Stereo microscope | Nikon | SMZ645 | |
| Surgical gelatin sponge | Ethicon | MS0005 | |
| Vetbond Tissue adhesive | 3M | 1469SB | |
| Weigh boats / trays | VWR | 10803-148 | |
| * Autoclave drapes, tools, materials, and gowns, and use sterile surgical gloves, for chronic cranial window surgeries. | |||
| Multiphoton microscopy | |||
| 20x water immersion objective | Olympus | XLUMPLFLN20 XW | Numerical aperture 1.0, working distance 2.0 mm. |
| Fluorescent dextran (e.g. FITC 70 kDa) | Sigma Aldrich | 46945 | Recommended 10 kDa-2 MDa. |
| MaiTai DeepSee Ti:Sapphire laser oscillator | Spectra-Physics | N/A | |
| SliceScope microscope | Scientifica | N/A | |
| Ultrasound treatment | |||
| 50 dB RF Amplifier | E&I | 2100L | |
| Matching circuit | Custom-made | Custom-made | Custom-made. |
| Microbubbles | Bracco Imaging | N/A | SonoVue (Bracco Imaging, Europe). Dose 1 ml/kg. |
| Microbubbles | Lantheus | N/A | Definity (Lantheus Medical Imaging, North America). Dose 0.02-0.04 ml/kg. |
| Signal generator | Agilent Technologies | 33500B |
Références
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Kalladka, D., et al. Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 388 (10046), 787-796 (2016).
- Pardridge, W. M. The blood-brain barrier: Bottleneck in brain drug development. the journal of the American Society for Experimental NeuroTherapeutics. 2 (1), 12 (2005).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Advanced Drug Delivery Reviews. 64 (7), 614-628 (2012).
- Nagy, Z., Pappius, H. M., Mathieson, G., Hüttner, I. Opening of tight junctions in cerebral endothelium. I. Effect of hyperosmolar mannitol infused through the internal carotid artery. The Journal of Comparative Neurology. 185 (3), 569-578 (1979).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220 (3), 640-646 (2001).
- Burgess, A., et al. Alzheimer disease in a mouse model: MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior. Radiology. 273 (3), 736-745 (2014).
- Abrahao, A., et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using MR-guided focused ultrasound. Nature Communications. 10 (1), 4373 (2019).
- Hynynen, K., Jones, R. M. Image-guided ultrasound phased arrays are a disruptive technology for non-invasive therapy. Physics in Medicine and Biology. 61 (17), 206-248 (2016).
- Burgess, A., et al. Targeted delivery of neural stem cells to the brain using MRI-guided focused ultrasound to disrupt the blood-brain barrier. PLoS One. 6 (11), 27877 (2011).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- Downs, M. E., et al. Long-term safety of repeated blood-brain barrier opening via focused ultrasound with microbubbles in non-human primates performing a cognitive task. PLOS One. 10 (5), 0125911 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103-112 (2019).
- Bing, C., et al. Transcranial opening of the blood-brain barrier in targeted regions using a stereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2, 13 (2014).
- O'Reilly, M. A., Hynynen, K. Blood-brain barrier: Real-time feedback-controlled focused ultrasound disruption by using an acoustic emissions-based controller. Radiology. 263 (1), 96-106 (2012).
- Jones, R. M., Deng, L., Leung, K., McMahon, D., O'Reilly, M. A., Hynynen, K. Three-dimensional transcranial microbubble imaging for guiding volumetric ultrasound-mediated blood-brain barrier opening. Theranostics. 8 (11), 2909-2926 (2018).
- Jones, R. M., McMahon, D., Hynynen, K. Ultrafast three-dimensional microbubble imaging in vivo predicts tissue damage volume distributions during nonthermal brain ablation. Theranostics. 10 (16), 7211-7230 (2020).
- Arvanitis, C. D., et al. Mechanisms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption. Proceedings of the National Academy of Sciences. 115 (37), 8717-8726 (2018).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. 33, (2012).
- McCarter, J. F., et al. Clustering of plaques contributes to plaque growth in a mouse model of Alzheimer's disease. Acta Neuropathologica. 126 (2), 179-188 (2013).
- Cruz Hernández, J. C., et al. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer's disease mouse models. Nature Neuroscience. 22 (3), 413-420 (2019).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Cao, V. Y., et al. In vivo two-photon imaging of experience-dependent molecular changes in cortical neurons. Journal of Visualized Experiments. (71), e50148 (2013).
- Nhan, T., Burgess, A., Hynynen, K. Transducer design and characterization for dorsal-based ultrasound exposure and two-photon imaging of in vivo blood-brain barrier disruption in a rat model. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 60 (7), 1376-1385 (2013).
- Cho, E. E., Drazic, J., Ganguly, M., Stefanovic, B., Hynynen, K. Two-photon fluorescence microscopy study of cerebrovascular dynamics in ultrasound-induced blood-brain barrier opening. Journal of Cerebral Blood Flow & Metabolism. 31 (9), 1852-1862 (2011).
- Burgess, A., Nhan, T., Moffatt, C., Klibanov, A. L., Hynynen, K. Analysis of focused ultrasound-induced blood-brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248 (2014).
- Nhan, T., et al. Drug delivery to the brain by focused ultrasound induced blood-brain barrier disruption: Quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy. Journal of Controlled Release. 172 (1), 274-280 (2013).
- Nhan, T., Burgess, A., Lilge, L., Hynynen, K. Modeling localized delivery of Doxorubicin to the brain following focused ultrasound enhanced blood-brain barrier permeability. Physics in Medicine and Biology. 59 (20), 5987-6004 (2014).
- Poon, C. T., et al. Time course of focused ultrasound effects on β-amyloid plaque pathology in the TgCRND8 mouse model of Alzheimer's disease. Scientific Reports. 8 (1), 14061 (2018).
- Poon, C., Pellow, C., Hynynen, K. Neutrophil recruitment and leukocyte response following focused ultrasound and microbubble mediated blood-brain barrier treatments. Theranostics. 11 (4), 1655-1671 (2021).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Chu, P. -. C., et al. Neuromodulation accompanying focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 5 (1), 15477 (2015).
- Yddal, T., Kotopoulis, S., Gilja, O. H., Cochran, S., Postema, M. . Transparent glass-windowed ultrasound transducers. , 2079-2082 (2014).
- Santos, M. A., Goertz, D. E., Hynynen, K. Focused ultrasound hyperthermia mediated drug delivery using thermosensitive liposomes and visualized with in vivo two-photon microscopy. Theranostics. 7 (10), 2718-2731 (2017).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Molecular Imaging and Biology. 14 (1), 40-46 (2012).
- Baum, J. A. The carrier gas in anaesthesia: Nitrous oxide/oxygen, medical air/oxygen and pure oxygen. Current Opinion in Anaesthesiology. 17 (6), 513-516 (2004).
- Poon, C., McMahon, D., Hynynen, K. Noninvasive and targeted delivery of therapeutics to the brain using focused ultrasound. Neuropharmacology. , 20-37 (2017).
- Joo, I. L., et al. Early neurovascular dysfunction in a transgenic rat model of Alzheimer's disease. Scientific Reports. 7, 46427 (2017).
- Dorr, A., et al. Amyloid-β-dependent compromise of microvascular structure and function in a model of Alzheimer's disease. Brain: A Journal of Neurology. 135, 3039-3050 (2012).
- Kim, T. N., et al. Line-scanning particle image velocimetry: An optical approach for quantifying a wide range of blood flow speeds in live animals. PLOS One. 7 (6), 38590 (2012).
- Teikari, P., Santos, M., Poon, C., Hynynen, K. Deep learning convolutional networks for multiphoton microscopy vasculature segmentation. arXiv. , (2016).
- Denes, A., et al. Surgical manipulation compromises leukocyte mobilization responses and inflammation after experimental cerebral ischemia in mice. Frontiers in Neuroscience. 7, 00271 (2014).
- Koletar, M. M., Dorr, A., Brown, M. E., McLaurin, J., Stefanovic, B. Refinement of a chronic cranial window implant in the rat for longitudinal in vivo two-photon fluorescence microscopy of neurovascular function. Scientific Reports. 9 (1), 5499 (2019).
- Podgorski, K., Ranganathan, G. Brain heating induced by near-infrared lasers during multiphoton microscopy. Journal of Neurophysiology. 116 (3), 1012-1023 (2016).
- Ulivi, A. F., et al. Longitudinal two-photon imaging of dorsal hippocampal CA1 in live mice. Journal of Visualized Experiments: JoVE. (148), e59598 (2019).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Beekers, I., et al. Combined confocal microscope and Brandaris 128 ultra-high-speed camera. Ultrasound in Medicine & Biology. 45 (9), 2575-2582 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon