Method Article
Прижизненная многофотонная микроскопия в режиме реального времени для визуализации сфокусированного ультразвука и микропузырьковых процедур для повышения проницаемости гематоэнцефалического барьера
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает хирургические и технические процедуры, которые позволяют в режиме реального времени in vivo многофотонную флуоресцентную визуализацию мозга грызунов во время сфокусированного ультразвука и микропузырьков для повышения проницаемости гематоэнцефалического барьера.
Аннотация
Гематоэнцефалический барьер (ГЭБ) является ключевой проблемой для успешной доставки лекарств в мозг. Ультразвуковое воздействие в присутствии микропузырьков стало эффективным методом временного и локального повышения проницаемости ГЭБ, облегчая пара- и трансклеточный транспорт лекарств через ГЭБ. Визуализация сосудистой системы во время ультразвуково-микропузырного лечения даст ценную и новую информацию о механизмах и динамике ультразвуково-микропузырьковых процедур в головном мозге.
Здесь мы представляем экспериментальную процедуру прижизненной многофотонной микроскопии с использованием краниального окна, выровненного с кольцевым преобразователем и объективом 20x. Эта настройка позволяет получать изображения мозга с высоким пространственным и временным разрешением во время ультразвуково-микропузырьковых процедур. Оптический доступ к мозгу осуществляется через черепно-мозговое окно с открытым черепом. Вкратце, кусок черепа диаметром 3-4 мм удаляется, а открытая область мозга запечатывается стеклянной крышкой. Кольцевой преобразователь 0,82 МГц, который прикреплен ко второму стеклянному чехлу, установлен сверху. Агароза (1% мас./об.) используется между крышкой датчика и крышкой, покрывающей краниальное окно, для предотвращения пузырьков воздуха, которые препятствуют распространению ультразвука. Когда проводятся стерильные хирургические процедуры и противовоспалительные меры, ультразвуково-микропузырьковые процедуры и сеансы визуализации могут выполняться повторно в течение нескольких недель. Флуоресцентные конъюгаты декстрана вводят внутривенно для визуализации сосудистой системы и количественной оценки ультразвуковых микропузырьковых эффектов (например, кинетика утечки, сосудистые изменения). В этой статье описывается размещение краниального окна, размещение кольцевого преобразователя, процедура визуализации, общие этапы устранения неполадок, а также преимущества и ограничения метода.
Введение
Ключевой проблемой для лечения неврологических расстройств является наличие гематоэнцефалического барьера (ГЭБ). ГЭБ ограничивает попадание гидрофильных, заряженных, полярных и крупных (> 400 Да) молекул в паренхиму мозга1. Одним из методов, используемых в настоящее время для доставки терапевтических средств через ГЭБ в паренхиму мозга, является использование стереотаксических внутричерепных инъекций2. Другие менее инвазивные исследуемые методы затруднены сложностью используемых методов, таких как разработка лекарств для опосредованной рецепторами доставки через ГЭБ3, или ограничены в пространственной точности целевых областей, таких как интраназальные инъекции4 или введение гиперосмотических растворов5.
Использование ультразвука в сочетании с системно вводимыми микропузырьками, ультразвуковым контрастным веществом, было разработано в качестве неинвазивного средства для временного повышения проницаемости ГЭБ6. Используя сфокусированный преобразователь7 или управляемую фазированную решетку преобразователей8,9, ультразвук может быть нацелен на выбранные области мозга с точностью до миллиметрового уровня, сводя к минимуму нецелевые эффекты. Ультразвуковые микропузырьковые процедуры могут быть настроены на анатомию мозга каждого субъекта с использованием магнитно-резонансной томографии 7,10,11,12,13,14 или стереотаксических кадров15. Кроме того, степень увеличения проницаемости ГЭБ можно контролировать в режиме реального времени путем мониторинга акустического излучения от микропузырьков16,17,18. Клинические испытания, изучающие безопасность и осуществимость ультразвуково-микропузырьковых методов лечения, в настоящее время проводятся во всем мире (например, ClinicalTrials.gov идентификатор NCT04118764).
Ультразвуковые микропузырьковые методы лечения ГЭБ обычно оцениваются путем подтверждения вызванного лечением увеличения проницаемости ГЭБ, визуализируется в магнитно-резонансной томографии с контрастным усилением или путем экстравазации красителя в визуализации in vivo или гистологии ex vivo. Тем не менее, большинство микроскопических анализов были выполнены ex vivo после завершения ультразвуковой микропузырьковой обработки11,19, что привело к отсутствию динамических биологических реакций во время и сразу после ультразвукового воздействия. Визуализация в режиме реального времени, проводимая во время ультразвукового воздействия, может помочь в понимании механизмов, приводящих к лечению ультразвукового микропузырька ГЭБ, а также последующих реакций, что может улучшить наше понимание его терапевтического применения. Кроме того, использование хронических черепных окон с методами визуализации in vivo позволит продольным исследованиям оценить временные аспекты ультразвуково-микропузырьковых процедур.
Целью данного протокола является описание хирургических и технических процедур, необходимых для проведения многофотонной визуализации ультразвукового микропузырькового лечения в режиме реального времени для острых и хронических исследований на грызунах (рисунок 1). Это достигается в двух частях: во-первых, для создания краниального окна для обеспечения визуализации in vivo, а во-вторых, для установки кольцевого преобразователя сверху для обеспечения одновременной обработки ультразвуком и визуализации. Черепные окна широко используются нейробиологами для визуализации in vivo нейроваскулярной связи20, β-амилоидного патогенеза21 и нейроиммунологии22, среди прочих. В этом протоколе описаны хирургические процедуры создания острых (невосстановительных) и хронических (восстановительных) черепных окон в черепе мыши и крысы. Методологии краниальных окон, особенно для хронических экспериментов, были хорошо задокументированы23,24,25. В соответствии с существующей литературой термины «острый» и «хронический» будут использоваться во всем этом протоколе. Конструкция кольцевых преобразователей для визуализации in vivo также была ранее описана26. Несмотря на доступность этих методов и понимание, которое может быть получено из визуализации в режиме реального времени ультразвуковых микропузырьковых методов лечения, существует очень мало исследовательских лабораторий, которые успешно опубликовали литературу с использованием этого метода26,27,28,29,30,31,32 . Таким образом, в этом протоколе описываются хирургические и технические детали проведения этих ультразвуковых микропузырьковых экспериментов в режиме реального времени. В то время как указанные параметры обработки ультразвуком и визуализации были оптимизированы для экспериментов с ГЭБ, другие эффекты ультразвукового воздействия на мозг, такие как нейромодуляция33,34, мониторинг β-амилоидных бляшек31 и реакции иммунных клеток32, также могут быть исследованы с использованием этого метода.
протокол
Все следующие экспериментальные процедуры были одобрены и проведены в соответствии с Норвежским управлением по пищевым продуктам и безопасности, Комитетом по уходу за животными Научно-исследовательского института Саннибрука и Канадским советом по уходу за животными.
1. Подготовка материала
- Подготовьте материалы, необходимые для хирургии черепного окна и ультразвуковой микропузырьковой обработки. Для хронических черепных окон необходимы стерилизованные инструменты и материалы, стерильное хирургическое пространство, а также пред- и послеоперационное введение препарата23,24,25.
- Подготовка преобразователя и крышки
- Проверьте физическую целостность датчика: ищите трещины и вмятины. Убедитесь, что электроды в верхней и боковой части датчика неповреждены.
- Нанесите цианоакрилатный клей в небольшую посуду. Используйте аппликатор, чтобы нанести тонкий слой клея на поверхность датчика.
- Поместите датчик на стеклянную крышку. Плотно прижмите в течение 20-30 с.
ПРИМЕЧАНИЕ: 3D-печатная форма может быть использована для облегчения выравнивания стеклянной крышки с кольцевым преобразователем, обеспечивая твердое и равномерное давление на крышку и кольцевой преобразователь (рисунок 2). - Проверьте наличие пузырьков между датчиком и крышкой. Если есть пузырьки, снимите крышку и повторите шаг 1.2.3., так как воздух препятствует распространению ультразвука. Вылечить на ночь при комнатной температуре.
- После приклеивания к стеклянной крышке сопоставьте датчик (рисунок 3).
ПРИМЕЧАНИЕ: В этом протоколе используется кольцевой преобразователь титаната свинца цирконата собственного производства (наружный диаметр 10 мм, толщина 1,4 мм, высота 1,2 мм)35, соответствующий импедансу 50 Ω и фазовой нагрузке 0° с помощью специальной схемы согласования. Преобразователь приводится в действие на частоте 0,82 МГц в режиме толщины, создавая круглое фокальное пятно примерно на 1 мм ниже крышки. Охарактеризованы кольцевые преобразователи с аналогичными свойствами (наружный диаметр 10 мм, толщина 1,5 мм, высота 1,1 мм)26 и широко использовались для экспериментов по многофотонной микроскопии27,28,29,31,32,36.
- Повторное использование датчика и замена крышки
- Замените крышку, если она треснула или имеет мусор (например, мех, клей) от предыдущего эксперимента. Чтобы удалить крышку, растворите клей, погрузив датчик и крышку в ацетон на 20 минут.
ПРИМЕЧАНИЕ: Ацетон может влиять на целостность преобразователя и/или электродов. Проконсультируйтесь с производителем, прежде чем приступить к этому шагу. - Проверьте, растворил ли ацетон клей, осторожно потянув за крышку щипцами. Проверяйте один раз в 10 минут, чтобы избежать длительного воздействия ацетона.
- Замените крышку, если она треснула или имеет мусор (например, мех, клей) от предыдущего эксперимента. Чтобы удалить крышку, растворите клей, погрузив датчик и крышку в ацетон на 20 минут.
2. Подготовка животных
- Обезболить животное, используя смесь медицинского воздуха, кислорода и изофлунана в индукционной камере.
ПРИМЕЧАНИЕ: Сообщалось, что использование кислорода в качестве газа-носителя влияет на период полураспада микропузырьков37,38 и уменьшает величину увеличения проницаемости ГЭБ27, вызванного ультразвуковым микропузырем27, но может также снизить риск гипоксии и смертности39. Выбирайте газы-носители на основе целей проекта и рекомендаций ветеринара. Инъекционные анестетики, такие как коктейль кетамина/ксилазина, также могут быть использованы; однако легче контролировать плоскость анестезии и уровень кислорода в крови при использовании ингаляционных анестетиков. - Убедитесь, что животное достигло достаточной плоскости анестезии, выполнив щипку пальца ноги. Взвесьте животное, чтобы определить дозировку декстрана, микропузырьков и препаратов для введения. Снимите мех с головы животного и поместите животное в стереотаксическую рамку.
- Для острых экспериментов необходимо установить доступ к системному кровообращению для инъекций декстрана и микропузырьков. Чтобы достичь этого, вставьте катетер весом 27 г в хвостовую вену.
ПРИМЕЧАНИЕ: Хотя ретроорбитальные инъекции также возможны, хвостовые вены рекомендуются из-за ограниченного рабочего пространства в области головы во время многофотонной визуализации. - Перенесите животное на стереотаксическую рамку и переключите анестезию на носовой конус. Поддерживайте температуру ядра животного 37 ° C с помощью источника тепла, такого как грелка или перчатка, наполненная теплой водой.
- Контролируйте температуру животных с помощью ректального зонда, а физиологию животных с помощью пульсоксиметра. Применяют офтальмологическую мазь. Вводят соответствующие предоперационные обезболивающие и/или противовоспалительные препараты (см. Таблицу материалов).
- Перед началом операции на черепном окне проверьте плоскость анестезии и частоту сердечных сокращений животного, насыщение O2 , частоту дыхания и температуру.
- Чтобы начать операцию на черепном окне, удалите мех на голове, нанеся крем для депиляции и / или используя кусачки для меха. Удалите мех между глазами в переднюю половину шеи (рисунок 4А).
ПРИМЕЧАНИЕ: Длительный контакт с кремом для депиляции обожжет кожу. При хронических операциях на окне черепа мойте кожу головы чередующимися салфетками бетадина и 70% EtOH после удаления меха. Подготовьте хирургическое пространство для стерильной хирургии. Стерильность должна сохраняться до Шага 2.15. - Чтобы удалить кожу головы, поднимите кожу между глазами с помощью щипцов, проводимых в недоминирующей руке, вдоль сагиттального шва. Используя изогнутые ножницы, удалите кожу, чтобы обнажить теменные кости (рисунок 4B). Нанесите твердое давление ватным тампоном, если есть кровотечение из черепа или кожи головы; кровотечение должно быть остановлено, прежде чем перейти к следующему шагу.
ПРИМЕЧАНИЕ: Для острых операций кожа может быть отодвинута назад и приклеена к черепу с помощью жидкого цианоакрилатного клея или тканевого клея. - Удалите надкостницу, покрывающую внешнюю поверхность черепа, с помощью ватных тампонов.
- С помощью операционного микроскопа (6-25x) и бормашины (0,5 мм бурильщика, средняя скорость) наметьте круг на теменной кости, чтобы отметить желаемое расположение черепного окна на черепе (рисунок 5). Избегайте сагиттального шва, лямбды и брегмы, так как эти области тоньше и накладываются на крупные кровеносные сосуды.
ПРИМЕЧАНИЕ: Для облегчения сверления контур краниального окна может быть нанесен на череп с помощью маркера и трафарета (рисунок 5А). Крысам может быть проще просверлить прямоугольное, а не круглое краниальное окно. Из-за толщины кости черепа крысы используйте сверло 0,7 мм, чтобы очертить краниальное окно в компактной кости, прежде чем использовать сверло 0,5 мм для завершения процесса сверления. - Приложите мягкое давление с помощью сверла; чрезмерное давление увеличивает риск повреждения мозговой ткани. Чтобы предотвратить перегрев черепа во время сверления, капните физиологический раствор на череп с помощью шприца или нанесите кусок хирургической губки, пропитанный физиологическим раствором.
- Чередуйте сверление и охлаждение черепа до тех пор, пока полученный костяной остров не отделится от остальной части черепа. Проверьте ход бурения, оказав мягкое давление на костный остров с помощью щипцов или сверла. Продолжайте сверление до тех пор, пока костный остров не отделится от остальной части черепа.
ПРИМЕЧАНИЕ: Небольшие трещины в самых тонких областях черепа являются хорошим показателем того, что сверление почти завершено. Попытка удалить костный остров преждевременно может привести к тому, что кусочки кости проникнут в ткани мозга, повреждая твердую мозговую оболочку и вызывая воспаление и кровотечение. - Удалите костный остров, используя пару тонких щипцов, чтобы захватить края или верхний компактный костный слой костного острова (рисунок 6A). Убедитесь, что мозг остается влажным, применяя кусок хирургической губки, который был предварительно пропитан физиологическим раствором. Если наблюдается кровотечение, поместите хирургическую губку на область, которая кровоточит. Не переходите к следующему шагу, пока кровотечение не прекратится.
ПРИМЕЧАНИЕ: Если кровотечение сохраняется через 5 минут, животное не может быть использовано для экспериментов с многофотонной визуализацией. Для крыс может потребоваться удалить твердую мозговую оболочку, если она толстая. Чтобы удалить твердую мозговую оболочку, используйте большое увеличение на рабочем микроскопе и пару тонких щипцов. - Чтобы поместить краниальное окно, возьмите стеклянную крышку с парой щипцов, поместите каплю физиологического раствора на одну сторону и маневрируйте ею над отверстием в черепе. Убедитесь, что под крышкой нет пузырьков воздуха.
ПРИМЕЧАНИЕ: Используйте стеклянную крышку 5 мм для мышей и 8 мм для крыс. Для крыс, из-за толщины кости черепа, используйте раствор агарозы вместо физиологического раствора, чтобы заполнить пространство между покровом и мозгом. Датчик и его крышка также могут быть прикреплены непосредственно к черепу, вместо использования отдельного чехла для краниального окна. Для этого параметра перейдите к шагу 3.1. Подробности см. на рисунке 1 . - Распределите слой цианоакрилатного клея по периметру покровного листа (рисунок 6B), чтобы прикрепить его к черепу. Убедитесь, что под крышкой нет клея. Надавите на крышку, чтобы убедиться, что клей не вступает в контакт с мозгом.
- Как только клей полностью высохнет, выровняйте поверхность клея с помощью бормашины. Убедитесь, что все остатки клея удалены из хирургической области.
ПРИМЕЧАНИЕ: Для хронических черепных окон вводят необходимые послеоперационные препараты (см. Таблицу материалов), предоставляют мазь для ухода за ранами и мягкой пищей, а также восстанавливают животное под тепловой лампой.
3. Размещение кольцевого преобразователя
- Готовят 1% (мас./об.) раствор агарозы. В небольшой стакан или колбу Эрленмейера добавить 0,1 г агарозы и 10 мл PBS (1x) или физиологического раствора. Кипятите раствор до полного растворения агарозы, поместив стакан на конфорку или нагрев раствор в микроволновой печи (30-45 с).
- Шаги 3.2-3.5 чувствительны ко времени, так как раствор агарозы быстро охлаждается. Вывести ~ 0,5 мл агарозы в шприц объемом 1 мл.
ПРИМЕЧАНИЕ: Чтобы защитить целостность мозга, убедитесь, что температура агарозы приближается к температуре тела перед использованием. - Обильно нанесите агарозу на крышку черепного окна.
ПРИМЕЧАНИЕ: Если ткань бланширует, температура агарозы была слишком высокой; животное должно быть усыплено. Если нет отдельного покрова, покрывающего мозг (т.е. преобразователь и его крышка помещаются непосредственно в мозг, см. шаг 2.14), то агароза должна быть отложена на поверхности мозга на этом этапе. - Поместите преобразователь над краниальным окном (рисунок 6C). Применяйте твердое давление таким образом, чтобы между преобразователем и краниальным окном была минимальная агароза. Убедитесь, что преобразователь центрирован (XY-плоскость) и параллельен (Z-плоскость) черепному окну, и что в агарозе нет пузырьков воздуха.
- Когда агароза остынет до желеобразной консистенции, отрежьте избыток агарозы с окружности крышки датчика с помощью шпателя или скальпеля. Убедитесь, что под крышкой датчика нет пузырьков воздуха.
- С помощью шпателя распределите слой цианоакрилатного клея по окружности покровного листа преобразователя, простирающегося до черепа, так, чтобы преобразователь прочно прилипал к черепу.
- Поддерживайте сильное давление на датчик до полного высыхания клея (10-15 мин).
4. Многофотонная микроскопическая визуализация
- Расположите животное под объективом (рисунок 7А). Убедитесь, что объектив центрирован в кольцевом преобразователе и параллельен преобразователю (рисунок 7B). Если используется объектив с погружением в воду, заполните центр кольцевого преобразователя деионизированной и дегазированной водой.
ПРИМЕЧАНИЕ: Дегазированная вода важна для правильного распространения ультразвука. - Начните с объектива в его самом высоком положении, а затем медленно опустите объектив, пока он не окажется внутри кольцевого преобразователя (рисунок 7A, B). Убедитесь, что объектив не сталкивается с датчиком или крышкой.
ПРИМЕЧАНИЕ: Чередуйте окуляр, чтобы проверить, находится ли Z-положение объектива в плоскости с поверхностью мозга, и глазом, чтобы убедиться, что объектив не сталкивается с преобразователем или крышкой. Может быть легче визуализировать пиальные сосуды через окуляр после инъекции флуоресцентного декстрана через хвостовую вену (рисунок 7C). - Подготовьте многофотонный микроскоп к визуализации.
ПРИМЕЧАНИЕ: Этот протокол использует вертикальный многофотонный микроскоп и объектив 20-25x, который имеет рабочее расстояние 2 мм, что достаточно для фокусировки за пределами покровного листа (ов), в паренхиму мозга. - Приготовьте декстран. Добавьте соответствующее количество PBS во флакон декстрана в соответствии с инструкциями производителя. Вращайте раствор декстрана в течение 1-3 мин, чтобы убедиться, что порошок декстрана полностью растворен. Ввести раствор декстрана в хвостовую вену.
- Настройка сканирования изображений
- Используя окуляры, убедитесь, что объектив находится параллельно мозгу. Наклоните животное, чтобы исправить перекосы XZ и YZ.
- Выберите поле зрения в многофотонном микроскопе. Настройте сканирование XYZ перед ультразвуковым воздействием, чтобы получить базовое изображение сосудистой системы перед ультразвуковым воздействием.
ПРИМЕЧАНИЕ: Типичные параметры визуализации следующие: глубина 300-800 мкм, шаг 2-5 мкм и 10-20 временных стеков. Убедитесь, что объектив не вступает в контакт с датчиком или крышкой в самой низкой точке во время последовательности визуализации.
5. Ультразвуковое облучение
- Убедитесь, что все кабели BNC подключены правильно (рисунок 3).
- Настройте сканирование изображений XYZT, которое будет достаточно длинным, чтобы захватить стеки изображений до, во время и после ультразвуковой микропузырьковой обработки.
- Подготовьте микропузырьки, следуя инструкциям производителя. Введите микропузырьки в хвостовую вену и начните визуализацию.
ПРИМЕЧАНИЕ: Микропузырьковые инъекции могут быть выполнены с помощью инфузионного насоса для обеспечения постоянной скорости впрыска и обеспечения одновременной инъекции микропузырька и визуализации. Если микропузырьки должны быть введены во время визуализации, убедитесь, что хвостовая жила может быть легко доступна, не подвергая детекторы воздействию окружающего света. - Начните обработку ультразвуком.
ПРИМЕЧАНИЕ: Типичные параметры обработки ультразвуком следующие: циклы 10 мс, механический индекс 0,2-0,4 и частоты повторения импульсов между 1-4 Гц. Параметры ультразвуковой обработки и микропузырьков, используемые в доклинических ультразвуковых микропузырьковых исследованиях, были широко изучены и хорошо документированы в литературе (например, см. 40 для обзора). - Продолжайте многофотонную визуализацию в течение всего периода обработки ультразвуком и после окончания обработки ультразвуком. Будьте внимательны к экстравазации декстрана из кровеносных сосудов, так как это свидетельствует об увеличении проницаемости ГЭБ.
ПРИМЕЧАНИЕ: Если декстран обнаружен во внесосудистом пространстве, но на периферии поля зрения, то могут быть поражены кровеносные сосуды вне поля зрения. Это может быть результатом смещения датчика с фокусом объектива. В этом сценарии легче отрегулировать поле зрения, переместив объектив или изменив положение животного, чем перестроить преобразователь. - Как только визуализация будет завершена, усыпьте вывих шейки матки животного под глубокой анестезией или асфиксией CO2 . Для хронических черепных окон нанесите слой зубного цемента на открытый череп.
ПРИМЕЧАНИЕ: Для хронических черепных окон кожа, окружающая окно, может быть зашита, хотя это не обязательно, из-за удаления кожи головы на шаге 2.8.
6. Анализ изображений
- Экспорт стеков изображений.
- Анализируйте изображения с помощью программного обеспечения для анализа изображений (например, Olympus Fluoview, ImageJ/FIJI, Bitplane Imaris, ThermoFisher Scientific Amira) и/или инструментов программирования (например, Python, MATLAB).
Результаты
Успешные ультразвуковые микропузырьковые процедуры могут быть обнаружены по экстравазации флуоресцентного декстрана из внутрисосудистого во внесососудистое пространство (рисунок 8), что указывает на увеличение проницаемости ГЭБ. В зависимости от поля давления кольцевого преобразователя будут затронуты пиальные сосуды и/или капилляры.
Для оценки сосудистых изменений, вызванных ультразвуковыми микропузырьками, диаметр интересующего сосуда может быть измерен до, во время и после ультразвуковой микропузырьковой обработки (рисунок 9). Это можно сделать вручную в коммерчески доступном программном обеспечении (например, программном обеспечении Olympus Fluoview). Во время получения изображения болюсные инъекции декстрана и линейное сканирование также могут быть использованы для оценки кровотока30,41. Для оценки кинетики утечки декстрана в качестве репрезентативной модели доставки лекарственного средства интенсивность сигнала между внутрисосудистым и внесосудистым пространствами может быть оценена с использованием таких инструментов, как MATLAB26,27,29,41 (рисунок 10).
Дальнейшая обработка изображений может быть достигнута с помощью ImageJ/FIJI. ImageJ/FIJI - это программное обеспечение с открытым исходным кодом, которое совместимо с MATLAB и хорошо подходит для проведения общих анализов в анализе биологических изображений, таких как измерение сосудистых изменений или длины или расстояния между флуоресцентными объектами (например, β-амилоидными бляшками до кровеносных сосудов). Конвейеры обработки изображений, созданные в ImageJ/FIJI, могут быть автоматизированы путем написания пользовательских макросов.
Более сложные анализы, такие как 3D-сегментация кровеносных сосудов и отслеживание клеток, могут быть достигнуты с использованием более продвинутого, полуавтоматического программного обеспечения (рисунок 11). После сегментации могут быть проведены более конкретные анализы, такие как классификация кровеносных сосудов как артериол, венул или капилляров, на основе диаметра, ветвления, паттернов извилистости и направления потока42,43. Алгоритмы машинного обучения также были разработаны для автоматизации сегментации кровеносных сосудов22,44.
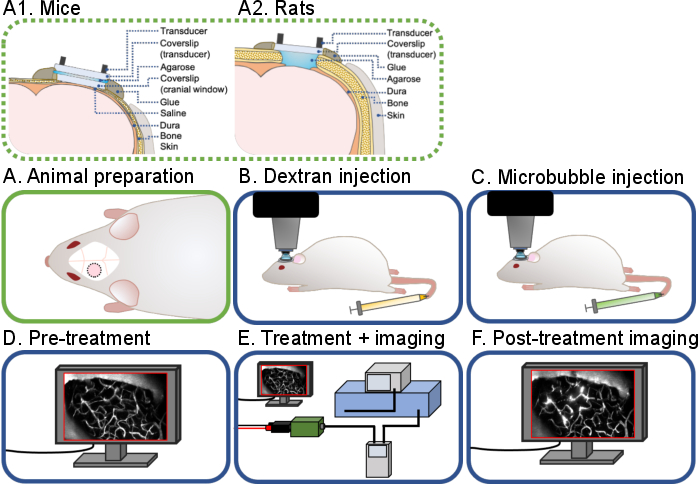
Рисунок 1: Общий рабочий процесс прижизненных многофотонных ультразвуково-микропузырьковых экспериментов мозга. Показан общий рабочий процесс прижизненных многофотонных ультразвуково-микропузырьковых экспериментов мозга, описанных в данном протоколе. Существует 6 этапов: (A) подготовка животных для (A1) мышей и (A2) крыс, (B) инъекция Декстрана, (C) инъекция микропузырька, (D) визуализация перед лечением, (E) лечение и визуализация, (F) визуализация после лечения и анализ данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
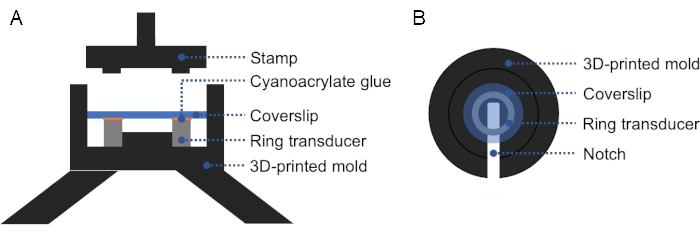
Рисунок 2: Поперечное сечение и вид сверху 3D-печатной формы. (A) Поперечное сечение пресс-формы. На верхнюю поверхность кольцевого преобразователя наносится тонкий слой цианоакрилатного клея, а сверху укладывается крышка. Штамп может использоваться для нанесения твердого, равномерного давления на крышку и кольцевой преобразователь. (B) Вид сверху пресс-формы. Выемка может быть добавлена в форму для облегчения удаления подготовленного преобразователя. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
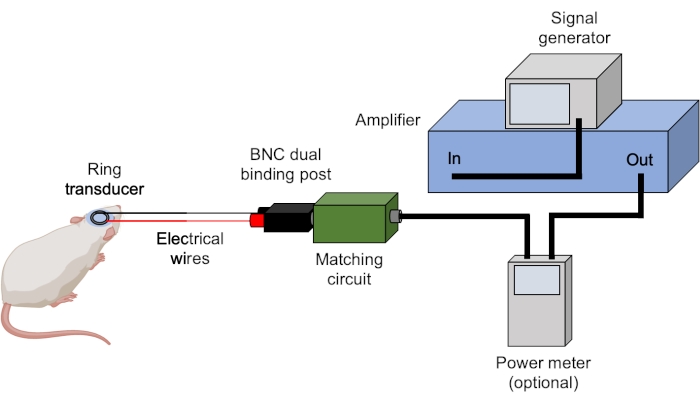
Рисунок 3: Настройка ультразвука. Показана типичная аппаратура для ультразвуковых экспериментов. Ультразвуковые параметры устанавливаются и запускаются генератором сигналов и усиливаются усилителем. Измеритель мощности может использоваться для записи прямых и отраженных мощностей перед отправкой сигнала в соответствующую коробку, которая сопоставляется с преобразователем. Все соединения достигаются с помощью кабелей BNC, если не указано иное. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
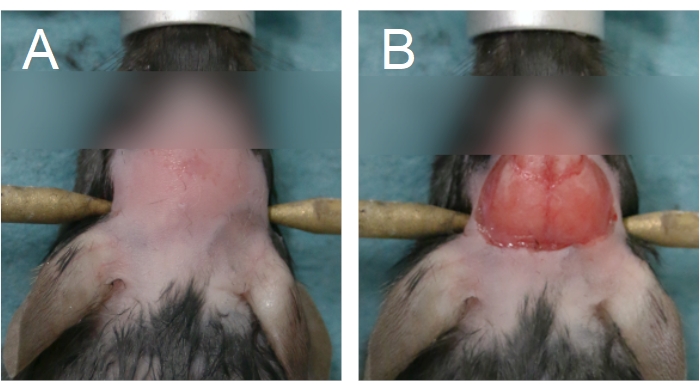
Рисунок 4: Область удаления меха и кожи головы. (А) Удаление меха должно начинаться между глазами и расширяться до передней половины шеи. (B) Удаление кожи головы должно быть достаточным для обнажения теменных костей. Кровотечение должно быть остановлено, прежде чем продолжить. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
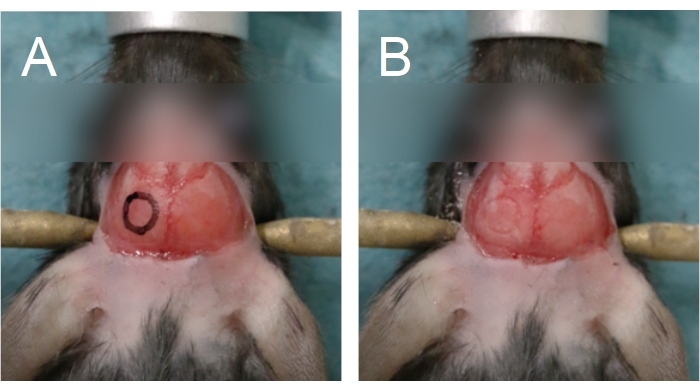
Рисунок 5: Контур краниального окна. Краниальное окно расположено на теменной кости. (A) Контур краниального окна может быть нарисован на черепе, чтобы помочь в процессе бурения. (B) Контур краниального окна можно увидеть после сверления через компактную кость. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
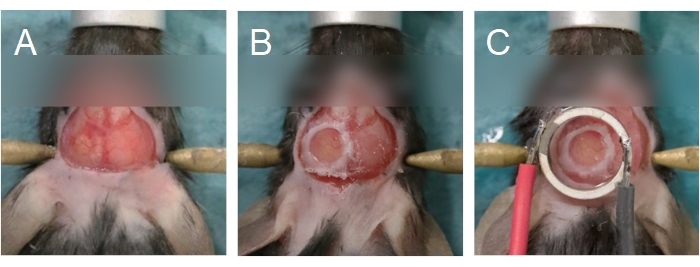
Рисунок 6: Выравнивание краниального окна и преобразователя. (A) Краниальное окно создается на теменной кости. Костяной остров был удален, обнажая мозг под ним. (B) Краниальное окно является полным, когда стеклянная крышка запечатана на череп с помощью цианоакрилатного клея. (C) Датчик центрируется к краниальному окну и приклеивается с использованием цианоакрилатного клея. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
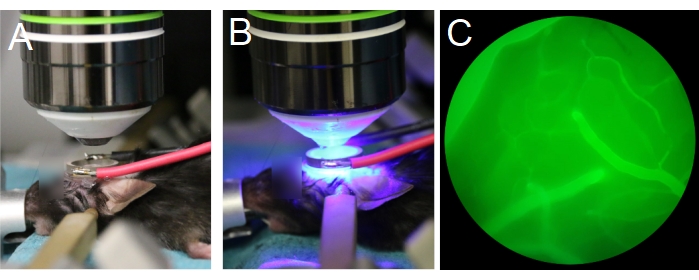
Рисунок 7: Позиционирование объектива и преобразователя. (A,B) Объектив центрирован на кольцевом преобразователе. (C) Кровеносные сосуды, заполненные флуоресцентным декстраном, видны через окуляры под эпифлуоресценцией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
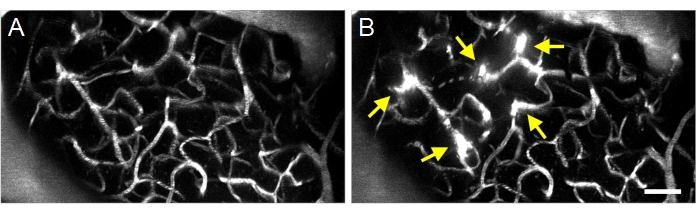
Рисунок 8: Максимальная проекция многофотонных изображений ультразвуково-микропузырьковых, индуцированных увеличением проницаемости ГЭБ. Максимальные проекционные изображения сосудистой системы (А) до и (В) после ультразвуковых микропузырьковых процедур. Успешные ультразвуковые микропузырьковые процедуры могут быть подтверждены путем наблюдения за увеличением проницаемости ГЭБ после лечения, визуализируемого как флуоресцентная экстравазация декстрана (стрелки). Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
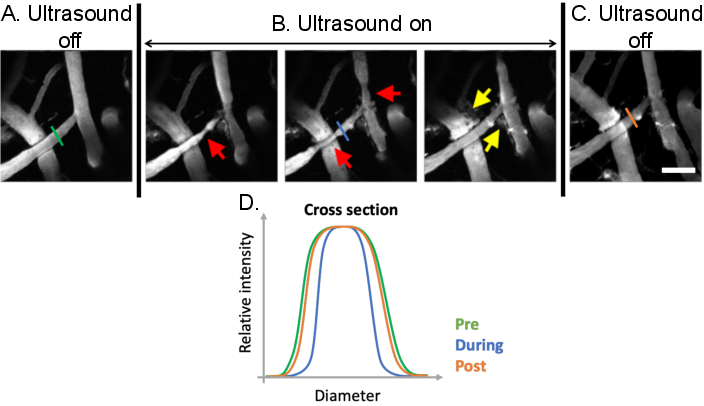
Рисунок 9: Анализ вазомодуляции, индуцированной ультразвуковыми микропузырьками. Максимальные проекционные изображения сосудов головного мозга до, во время и после ультразвуковых микропузырьковых процедур. Микропузырьки присутствуют на всех изображениях. По сравнению с (А) предлечебными состояниями, четкая вазомодуляция может наблюдаться (В) во время ультразвуковых микропузырьковых процедур (красные стрелки). Ультразвуково-микропузырьковые опосредованные повышения проницаемости ГЭБ также проявляются после лечения от утечки флуоресцентного декстрана из внутрисосудистого во внесососудистое пространство (желтые стрелки). (C) Когда ультразвук выключен, диаметры сосудов возвращаются к исходным размерам до лечения. (D) Сосудистые изменения могут быть проанализированы путем построения диаметра интересующего сосуда до, во время и после ультразвуковой микропузырьковой обработки. Шкала: 100 мкм. (Неопубликованная работа). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
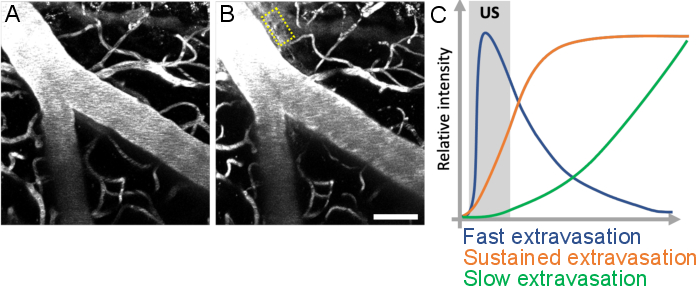
Рисунок 10: Анализ кинетики утечки после ультразвуковой микропузырьковой обработки. Повышение проницаемости ГЭБ визуализируется как утечка флуоресцентного декстрана из внутрисосудистого во внесосудистое пространство. Изменения проницаемости ГЭБ очевидны при сравнении стеков изображений, полученных (А) до и (В) после ультразвуковой микропузырьковой обработки. (C) Кинетика утечки может быть проанализирована путем отслеживания интенсивности, объема и скорости декстрана во внесосудистых компартментах (желтый прямоугольник). Шкала: 50 мкм. (Неопубликованная работа.) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
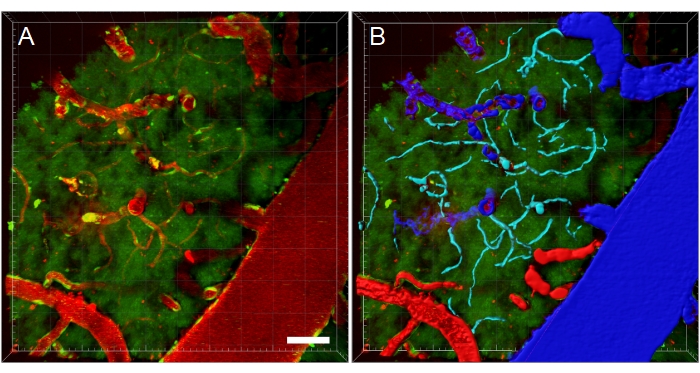
Рисунок 11: Сегментация кровеносных сосудов многофотонной микроскопии XYZ stack. (A) Глубина (XYZ) стек кровеносных сосудов у трансгенной EGFP крысы. Кровеносные сосуды визуализируются с помощью внутривенной инъекции флуоресцентного техасского красного декстрана 70 кДа (красный). Зеленый канал показывает флуоресцентные клетки и тканевую аутофлуоресценцию. (B) Создаются 3D-реконструкции кровеносных сосудов, а затем цветовая кодировка в соответствии с типом кровеносного сосуда для облегчения анализа по типу. Вены / венулы синие, артерии / артериолы красные, а капилляры голубые. Шкала: 50 мкм. Реконструкции, созданные с помощью Bitplane Imaris. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Мониторинг прижизненной многофотонной микроскопии головного мозга является ценным инструментом для изучения реакций мозга во время ультразвукового воздействия. Насколько нам известно, описанный здесь протокол является единственным методом проведения многофотонной микроскопической визуализации паренхимы головного мозга во время ультразвуково-микропузырьковых процедур. Создание краниальных окон и использование кольцевых преобразователей позволяют в режиме реального времени контролировать сосудистые, клеточные и другие последующие реакции на ультразвуковые микропузырьковые процедуры с высоким пространственным и временным разрешением. Другие группы выполнили многофотонную микроскопическую визуализацию после завершения ультразвуково-микропузырьковых процедур, тем самым пропуская реакцию паренхимы головного мозга в реальном времени на лечение19. Описанная процедура предлагает улучшенный временной контроль, позволяя собирать данные, которые могут помочь осветить острые механизмы, лежащие в основе ультразвукового микропузырькового лечения. Количественные и качественные данные могут быть извлечены и проанализированы из стеков полученных изображений, таких как кинетика экстравазации27,29,30, изменения объема β-амилоидной бляшки31 и динамика клеток32.
В протоколе было выделено несколько шагов по устранению неполадок. Во-первых, были подчеркнуты хирургические этапы, которые особенно подвержены ошибкам оператора, такие как использование агарозы во время операции на черепном окне и размещение датчика. Также были предложены меры по предотвращению дискомфорта и смерти животных, включая мониторинг физиологии животных во время операции и тщательное вихрь декстрана перед инъекцией. Во-вторых, были также выделены физические характеристики преобразователя и выравнивание объектива, преобразователя и краниального окна. Технические характеристики кольцевого преобразователя и его акустические свойства должны определяться с учетом используемой линзы объектива, а также животной модели. В частности, внутренний диаметр кольцевого преобразователя должен быть достаточно большим, чтобы окружать объектив, но достаточно маленьким, чтобы надежно закрепиться на черепе животного. Кроме того, фокусная область преобразователя должна совпадать с диапазоном используемой объектива.
Общая проблема заключается в том, что краниальное окно и кольцевой преобразователь расположены под углом относительно объектива. Правильное центрирование (XY) и выравнивание (Z) объектива с краниальным окном и преобразователем гарантирует, что фокальная область преобразователя и, следовательно, область обработанной ткани мозга выравнивается с полем зрения изображения и снижает риск столкновения между объективом и преобразователем во время визуализации. Выравнивание может быть достигнуто путем регулировки положения головы животного и/или путем вращения стереотаксической рамки, в которой оно зафиксировано.
Компоненты микроскопа (например, детекторы, светоделители) и параметры получения изображения должны быть выбраны на основе цели исследования. Здесь используется объектив с длинным фокусным расстоянием (> 2 мм) из-за наличия покровного(ых) и кольцевого преобразователя, расположенного между объективом и мозгом. Также рекомендуется вертикальный микроскоп, поскольку он дает больше пространства для маневрирования животного, особенно для экспериментов с мозгом. Для захвата кинетики ультразвуковой микропузырьки, вызванной утечкой внутрисосудистого красителя, благоприятно высокое временное разрешение, которое может быть достигнуто с помощью системы резонансного сканирования. Сочетание этого с высокочувствительной системой обнаружения, такой как детекторы фосфида арсенида галлия (GaAsP), также приведет к более благоприятным изображениям.
Представленная экспериментальная процедура имеет ряд ограничений. Во-первых, хирургическая процедура является довольно инвазивной и, как сообщается, вызывает воспаление45, хотя воспаление может быть сведено к минимуму46. Кроме того, иммунные реакции, вызванные операциями на черепных окнах, разрешались через 2-4 недели после операции23,24,25. Кроме того, процесс бурения, особенно когда он проводится с чрезмерной силой или скоростью, может привести к повреждению подлежащей ткани из-за генерации тепла, вибрации и давления. Также наблюдалось, что операции на краниальном окне и многофотонная визуализация влияют на температуру мозга47. Эти ограничения могут быть уменьшены в некоторой степени за счет тщательного создания нетронутых черепных окон, правильного восстановления животных с хроническими краниальными окнами и поддержания нормотермической температуры тела с использованием источника нагрева с обратной связью. Во-вторых, глубина изображения ограничена используемым микроскопом и объективом. Например, эффект ультразвукового микропузырького лечения в более глубоких структурах мозга, таких как гиппокамп, не может быть изучен без более инвазивных мер, таких как удаление вышележащей кортикальной ткани48 или использование микролинз в сочетании с кортикальным проникновением49. Использование объектива с большим рабочим расстоянием может в некоторой степени решить эту проблему, но проникновение света также ограничено на больших глубинах.
В то время как репрезентативные изображения этого протокола были получены от грызунов дикого типа, представленная экспериментальная процедура также может быть применена к трансгенным животным и моделям заболеваний, таким как болезнь Альцгеймера31. Ультразвуковые эксперименты, не связанные с модуляцией ГЭБ, такие как ультразвуковая нейромодуляция, также могут контролироваться с использованием этого протокола33,34. Другие возможные применения могут быть достигнуты путем использования различных настроек микроскопа или детектора, таких как сопряжение конфокального микроскопа со сверхскоростной камерой50. В то время как фотоотбеливание и фототоксичность сравнительно хуже в конфокальных микроскопах из-за большого объема возбуждения, сверхскоростная визуализация может позволить визуализировать капиллярные эндотелиальные клеточно-микропузырьковые взаимодействия головного мозга с высоким временным разрешением, что может дополнительно осветить механизмы, управляющие ультразвуковым микропузырьковым лечением BBB. В заключение, описанный протокол предоставляет метод мониторинга сосудистых и клеточных эффектов, индуцированных ультразвуковыми экспериментами с микропузырьками ГЭБ в режиме реального времени, предоставляя инструмент для дальнейшего определения механизмов, приводящих к этим методам лечения, а также освещая последующие реакции паренхимы мозга на ультразвуковые микропузырьковые процедуры.
Раскрытие информации
Чарисса Пун, Мелина Мюленпфордт, Мариеке Олсман и Катарина де Ланге Дэвис не заявляют о финансовых или нефинансовых конкурирующих конфликтах интересов. Спирос Котопулис является штатным сотрудником и владеет акциями EXACT Therapeutics AS, компании, занимающейся разработкой ультразвуковых и микропузырьковых / кластерных улучшенных лекарств. Куллерво Хининнен является основателем FUS Instruments, от которой он получает поддержку, не связанную с исследованиями.
Благодарности
Содержание животных было обеспечено Центром сравнительной медицины (CoMed, NTNU). Рисунок 3 был создан в BioRender.com. Записью и редактированием видео занимался Пер Хеннинг, веб-мастер факультета естественных наук НТНУ. Проект финансировался Норвежским университетом науки и технологии (NTNU, Тронхейм, Норвегия), Исследовательским советом Норвегии (RCN 262228), Канадскими институтами исследований в области здравоохранения (FDN 154272), Национальным институтом здравоохранения (R01 EB003268) и кафедрой целенаправленных ультразвуковых исследований Темерти в Центре медицинских наук Саннибрука.
Материалы
| Name | Company | Catalog Number | Comments |
| Ring transducer placement | |||
| Agarose (powder) | Sigma-Aldrich | A9539 | |
| Beaker or Erlenmeyer flask (50 ml) | VWR | 213-0462 or 214-1130 | |
| Cyanoacrylate glue (gel) | Loctite | 1363589 | |
| Glass coverslips (13 mm) | Thermo Fisher Scientific | CB00130RA120MNT0 | Coverslip for ring transducer. |
| Hot plate or microwave | Corning | PC-400D | To heat agarose solution. |
| PBS (1X) | Sigma-Aldrich | P4417 | |
| Ring transducer | Custom-made | Custom-made | Custom-made. E.g. https://doi.org/10.1109/ULTSYM.2014.0518 |
| Rubber stopper | VWR | 217-0867 | |
| Animal preparation and drugs | |||
| Bupivacaine*A | Aspen | 169912 | Dose: 1 mg/kg, s.c., local anesthetic injected at incision site. |
| Buprenorphine*A | Indivior | 521634 | Dose mouse: 0.05-0.1 mg/kg, s.c., opioid, administer pre-surgery. |
| Buprenorphine*A | Indivior | 521634 | Dose rat: 0.01-0.05 mg/kg, s.c.. |
| Carprofen*C | Pfizer | DIN 02255693 | Dose: 5 mg/kg, s.c., NSAID, adminster post-surgery. |
| Depilatory cream | Veet | N/A | For complete fur removal after trimming. |
| Dexamethasone*C | Sandoz | DIN 00664227, 2301 | Dose: 3 mg/kg, i.m., corticosteroid, reduces cerebral edema, administer pre-surgery. |
| Enrofloxacin*C | Bayer | DIN: 02249243 | Dose: 5 mg/kg, i.p., antibiotic, administer post-surgery. |
| Fur clippers | Aesculap | 90200714 | Exacta/Isis. |
| Heating pad | Physitemp Instruments INC | HP-1M | |
| Isoflurane | Baxter | ESDG9623C | Dose: 3% induction, 1% maintenance; anesthetic. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose mouse: 2-3 mg/kg, s.c., NSAID, administer pre-surgery. |
| Meloxicam*A | Boehringer Ingelheim Vetmedica GmbH | 25388 | Dose rat: 1 mg/kg, s.c. |
| Pulse oximeter | STARR Life Sciences Corp | N/A | MouseOx. |
| Stereotaxic frame | Kopf | Kopf 900 | |
| Sterile ophthalmic ointment | Théa | 597562 | Viscotears. |
| Tail vein catheter (24 G) | BD Neoflon | 391350 | |
| * Discuss dosing and type of administration with veterinarian prior to use. A For acute window surgeries, C For chronic window surgeries. Dose for mice and rats are the same unless otherwise specified. | |||
| Material and equipment for cranial window placement | |||
| Alcohol swabs | BD | 326895 | |
| Curved fine surgical scissors | Fine Science Tools | 14002-12 | |
| Cotton or fibreless swabs | Chemtronics | CX50 | |
| Cyanoacrylate glue (gel) | Loctite | 1594457 (gel), 230992 (liquid) | If unavailable, liquid cyanoacrylate glue can be mixed with extra-fine acrylate powder. |
| Dental cement | Lang Dental | Jet Set-4 Denture Repair Package | |
| Dental micromotor hand drill | FOREDOM | K.1070-2 | High speed rotary micromotor kit with 2.35 mm collet. |
| Forceps | Fine Science Tools | 11152-10, 11370-40 | |
| Glass coverslips | Thermo Fisher Scientific | CB00050RA120MNT0 (5 mm) | Mouse cranial windows. |
| Glass coverslips | Thermo Fisher Scientific | CB00080RA120MNT0 (8 mm) | Rat cranial windows. |
| Micro drill burrs (0.5 mm) | Meisinger | HM71005 (0.5 mm) | |
| Micro drill burrs (0.7 mm) | Meisinger | HM71007 (0.7 mm) | |
| Stereo microscope | Nikon | SMZ645 | |
| Surgical gelatin sponge | Ethicon | MS0005 | |
| Vetbond Tissue adhesive | 3M | 1469SB | |
| Weigh boats / trays | VWR | 10803-148 | |
| * Autoclave drapes, tools, materials, and gowns, and use sterile surgical gloves, for chronic cranial window surgeries. | |||
| Multiphoton microscopy | |||
| 20x water immersion objective | Olympus | XLUMPLFLN20 XW | Numerical aperture 1.0, working distance 2.0 mm. |
| Fluorescent dextran (e.g. FITC 70 kDa) | Sigma Aldrich | 46945 | Recommended 10 kDa-2 MDa. |
| MaiTai DeepSee Ti:Sapphire laser oscillator | Spectra-Physics | N/A | |
| SliceScope microscope | Scientifica | N/A | |
| Ultrasound treatment | |||
| 50 dB RF Amplifier | E&I | 2100L | |
| Matching circuit | Custom-made | Custom-made | Custom-made. |
| Microbubbles | Bracco Imaging | N/A | SonoVue (Bracco Imaging, Europe). Dose 1 ml/kg. |
| Microbubbles | Lantheus | N/A | Definity (Lantheus Medical Imaging, North America). Dose 0.02-0.04 ml/kg. |
| Signal generator | Agilent Technologies | 33500B |
Ссылки
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Kalladka, D., et al. Human neural stem cells in patients with chronic ischaemic stroke (PISCES): a phase 1, first-in-man study. Lancet. 388 (10046), 787-796 (2016).
- Pardridge, W. M. The blood-brain barrier: Bottleneck in brain drug development. the journal of the American Society for Experimental NeuroTherapeutics. 2 (1), 12 (2005).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Advanced Drug Delivery Reviews. 64 (7), 614-628 (2012).
- Nagy, Z., Pappius, H. M., Mathieson, G., Hüttner, I. Opening of tight junctions in cerebral endothelium. I. Effect of hyperosmolar mannitol infused through the internal carotid artery. The Journal of Comparative Neurology. 185 (3), 569-578 (1979).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220 (3), 640-646 (2001).
- Burgess, A., et al. Alzheimer disease in a mouse model: MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior. Radiology. 273 (3), 736-745 (2014).
- Abrahao, A., et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using MR-guided focused ultrasound. Nature Communications. 10 (1), 4373 (2019).
- Hynynen, K., Jones, R. M. Image-guided ultrasound phased arrays are a disruptive technology for non-invasive therapy. Physics in Medicine and Biology. 61 (17), 206-248 (2016).
- Burgess, A., et al. Targeted delivery of neural stem cells to the brain using MRI-guided focused ultrasound to disrupt the blood-brain barrier. PLoS One. 6 (11), 27877 (2011).
- McDannold, N., Arvanitis, C. D., Vykhodtseva, N., Livingstone, M. S. Temporary disruption of the blood-brain barrier by use of ultrasound and microbubbles: Safety and efficacy evaluation in rhesus macaques. Cancer Research. 72 (14), 3652-3663 (2012).
- Downs, M. E., et al. Long-term safety of repeated blood-brain barrier opening via focused ultrasound with microbubbles in non-human primates performing a cognitive task. PLOS One. 10 (5), 0125911 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103-112 (2019).
- Bing, C., et al. Transcranial opening of the blood-brain barrier in targeted regions using a stereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2, 13 (2014).
- O'Reilly, M. A., Hynynen, K. Blood-brain barrier: Real-time feedback-controlled focused ultrasound disruption by using an acoustic emissions-based controller. Radiology. 263 (1), 96-106 (2012).
- Jones, R. M., Deng, L., Leung, K., McMahon, D., O'Reilly, M. A., Hynynen, K. Three-dimensional transcranial microbubble imaging for guiding volumetric ultrasound-mediated blood-brain barrier opening. Theranostics. 8 (11), 2909-2926 (2018).
- Jones, R. M., McMahon, D., Hynynen, K. Ultrafast three-dimensional microbubble imaging in vivo predicts tissue damage volume distributions during nonthermal brain ablation. Theranostics. 10 (16), 7211-7230 (2020).
- Arvanitis, C. D., et al. Mechanisms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption. Proceedings of the National Academy of Sciences. 115 (37), 8717-8726 (2018).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. 33, (2012).
- McCarter, J. F., et al. Clustering of plaques contributes to plaque growth in a mouse model of Alzheimer's disease. Acta Neuropathologica. 126 (2), 179-188 (2013).
- Cruz Hernández, J. C., et al. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer's disease mouse models. Nature Neuroscience. 22 (3), 413-420 (2019).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Cao, V. Y., et al. In vivo two-photon imaging of experience-dependent molecular changes in cortical neurons. Journal of Visualized Experiments. (71), e50148 (2013).
- Nhan, T., Burgess, A., Hynynen, K. Transducer design and characterization for dorsal-based ultrasound exposure and two-photon imaging of in vivo blood-brain barrier disruption in a rat model. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 60 (7), 1376-1385 (2013).
- Cho, E. E., Drazic, J., Ganguly, M., Stefanovic, B., Hynynen, K. Two-photon fluorescence microscopy study of cerebrovascular dynamics in ultrasound-induced blood-brain barrier opening. Journal of Cerebral Blood Flow & Metabolism. 31 (9), 1852-1862 (2011).
- Burgess, A., Nhan, T., Moffatt, C., Klibanov, A. L., Hynynen, K. Analysis of focused ultrasound-induced blood-brain barrier permeability in a mouse model of Alzheimer's disease using two-photon microscopy. Journal of Controlled Release. 192, 243-248 (2014).
- Nhan, T., et al. Drug delivery to the brain by focused ultrasound induced blood-brain barrier disruption: Quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy. Journal of Controlled Release. 172 (1), 274-280 (2013).
- Nhan, T., Burgess, A., Lilge, L., Hynynen, K. Modeling localized delivery of Doxorubicin to the brain following focused ultrasound enhanced blood-brain barrier permeability. Physics in Medicine and Biology. 59 (20), 5987-6004 (2014).
- Poon, C. T., et al. Time course of focused ultrasound effects on β-amyloid plaque pathology in the TgCRND8 mouse model of Alzheimer's disease. Scientific Reports. 8 (1), 14061 (2018).
- Poon, C., Pellow, C., Hynynen, K. Neutrophil recruitment and leukocyte response following focused ultrasound and microbubble mediated blood-brain barrier treatments. Theranostics. 11 (4), 1655-1671 (2021).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Chu, P. -. C., et al. Neuromodulation accompanying focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 5 (1), 15477 (2015).
- Yddal, T., Kotopoulis, S., Gilja, O. H., Cochran, S., Postema, M. . Transparent glass-windowed ultrasound transducers. , 2079-2082 (2014).
- Santos, M. A., Goertz, D. E., Hynynen, K. Focused ultrasound hyperthermia mediated drug delivery using thermosensitive liposomes and visualized with in vivo two-photon microscopy. Theranostics. 7 (10), 2718-2731 (2017).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Molecular Imaging and Biology. 14 (1), 40-46 (2012).
- Baum, J. A. The carrier gas in anaesthesia: Nitrous oxide/oxygen, medical air/oxygen and pure oxygen. Current Opinion in Anaesthesiology. 17 (6), 513-516 (2004).
- Poon, C., McMahon, D., Hynynen, K. Noninvasive and targeted delivery of therapeutics to the brain using focused ultrasound. Neuropharmacology. , 20-37 (2017).
- Joo, I. L., et al. Early neurovascular dysfunction in a transgenic rat model of Alzheimer's disease. Scientific Reports. 7, 46427 (2017).
- Dorr, A., et al. Amyloid-β-dependent compromise of microvascular structure and function in a model of Alzheimer's disease. Brain: A Journal of Neurology. 135, 3039-3050 (2012).
- Kim, T. N., et al. Line-scanning particle image velocimetry: An optical approach for quantifying a wide range of blood flow speeds in live animals. PLOS One. 7 (6), 38590 (2012).
- Teikari, P., Santos, M., Poon, C., Hynynen, K. Deep learning convolutional networks for multiphoton microscopy vasculature segmentation. arXiv. , (2016).
- Denes, A., et al. Surgical manipulation compromises leukocyte mobilization responses and inflammation after experimental cerebral ischemia in mice. Frontiers in Neuroscience. 7, 00271 (2014).
- Koletar, M. M., Dorr, A., Brown, M. E., McLaurin, J., Stefanovic, B. Refinement of a chronic cranial window implant in the rat for longitudinal in vivo two-photon fluorescence microscopy of neurovascular function. Scientific Reports. 9 (1), 5499 (2019).
- Podgorski, K., Ranganathan, G. Brain heating induced by near-infrared lasers during multiphoton microscopy. Journal of Neurophysiology. 116 (3), 1012-1023 (2016).
- Ulivi, A. F., et al. Longitudinal two-photon imaging of dorsal hippocampal CA1 in live mice. Journal of Visualized Experiments: JoVE. (148), e59598 (2019).
- Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., Webb, W. W. In vivo multiphoton microscopy of deep brain tissue. Journal of Neurophysiology. 91 (4), 1908-1912 (2004).
- Beekers, I., et al. Combined confocal microscope and Brandaris 128 ultra-high-speed camera. Ultrasound in Medicine & Biology. 45 (9), 2575-2582 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены