Method Article
Método de expansión celular Natural Killer (NK) y CAR-NK utilizando línea de células B modificada con IL-21 unida a la membrana
En este artículo
Resumen
Aquí, presentamos un método para expandir el asesino natural de sangre periférica (PBNK), las células NK de los tejidos hepáticos y las células NK del receptor de antígeno quimérico (CAR) derivadas de células mononucleares de sangre periférica (PBMC) o sangre del cordón umbilical (CB). Este protocolo demuestra la expansión de las células NK y CAR-NK utilizando células alimentadoras 221-mIL-21, además de la pureza optimizada de las células NK expandidas.
Resumen
La terapia de células inmunitarias modificadas con receptores de antígenos quiméricos (CAR) se ha convertido en un tratamiento emergente para cánceres y enfermedades infecciosas. La inmunoterapia basada en NK, particularmente las células CAR-NK, es uno de los desarrollos "listos para usar" más prometedores sin toxicidad grave que ponga en peligro la vida. Sin embargo, el cuello de botella para desarrollar una terapia CAR-NK exitosa es lograr un número suficiente de células CAR-NK no exhaustivas, de larga vida y "listas para usar" de un tercero. Aquí, desarrollamos un nuevo método de expansión CAR-NK utilizando una línea de células B transformada por el virus de Epstein-Barr (EBV) que expresa una forma de membrana genéticamente modificada de interleucina-21 (IL-21). En este protocolo, se proporcionan procedimientos paso a paso para expandir las células NK y CAR-NK de la sangre del cordón umbilical y la sangre periférica, así como los tejidos de órganos sólidos. Este trabajo mejorará significativamente el desarrollo clínico de la inmunoterapia CAR-NK.
Introducción
Las células asesinas naturales (NK) son un subconjunto importante de linfocitos que expresan CD56 y carecen de expresión del marcador de células T, CD3 1,2. Las células NK convencionales se clasifican como células inmunes innatas responsables de la inmunovigilancia de las células infectadas por virus y las células cancerosas. A diferencia de las células T, las células NK reconocen células infectadas o malignas utilizando CD16 u otros receptores activadores y no requieren la formación de un complejo entre péptidos de antígeno y moléculas de clase I del complejo mayor de histocompatibilidad (MHC) 3,4. Investigaciones clínicas recientes con células NK receptoras de antígeno quimérico (CAR) para tratar cánceres CD19 positivos recidivantes o refractarios (linfoma no Hodgkin o leucemia linfocítica crónica [LLC])) mostraron las excelentes ventajas de seguridad de las células CAR-NK5. Por ejemplo, la infusión de células CAR-NK se asocia con enfermedad mínima o insignificante de injerto contra huésped (EICH), neurotoxicidad, cardiotoxicidad y síndrome de liberación de citoquinas (SRC)6,7,8,9,10. Sin embargo, los métodos convencionales para expandir las células NK humanas mostraron fenotipos exhaustivos con fuerte destrucción fratricida y escasez de telómeros, lo que presenta un gran desafío para obtener un número adecuado de células NK funcionales para la inmunoterapia adoptiva11.
Para superar estos desafíos, se desarrolló un método para expandir las células NK primarias directamente de células mononucleares de sangre periférica no fraccionadas (PBMC) o sangre del cordón umbilical (CB) utilizando una línea celular 721.221 (en adelante, 221) irradiada y genéticamente modificada, una línea celular linfoblastoide B humana con baja expresión de moléculas MHC clase I3. Estudios previos mostraron la importancia de IL-21 en la expansión de las células NK; por lo tanto, se desarrolló una IL-21 genéticamente modificada unida a la membrana que expresa una versión de la línea celular 721.221 (a partir de ahora, 221-mIL-21) 11,12,13,14,15. Los resultados mostraron que las células NK primarias expandidas con células alimentadoras de 221 mIL-21 se expandieron a un promedio de >40,000 veces con una alta pureza persistente de células NK durante aproximadamente 2-3 semanas. Se puede encontrar información adicional sobre la aplicación de este protocolo en Yang et al.16.
Este protocolo tiene como objetivo demostrar el procedimiento paso a paso de la nueva expansión de PBNK, CBNK, NK derivado de tejidos y células CAR-NK ex vivo.
Protocolo
El trabajo relacionado con los tejidos humanos y la sangre en este protocolo sigue las pautas de la Junta de Revisión Institucional (IRB) de la Universidad de Rutgers.
1. Expansión de células NK de los tejidos hepáticos (Día 0), como se muestra en la Figura 1.
NOTA: El número inicial de células y la viabilidad están fuertemente correlacionados con el tiempo transcurrido desde la extracción del órgano y la cantidad inicial de muestra de tejido. Sin embargo, si los tejidos se colocan en 30 ml de solución salina equilibrada de Hank (HBSS) y se mantienen en hielo o en el refrigerador a 4 ° C durante la noche, las células NK aún se pueden expandir a alta pureza y viabilidad hasta 24 h después.
- Identificar áreas de tejido viables para obtener linfocitos de tejidos y secciones utilizando equipos quirúrgicos estériles.
- Coloque los tejidos en 30 ml de HBSS (sin calcio o magnesio) y manténgalos en hielo hasta que estén listos para prepararse para el aislamiento.
- Pique el tejido en cubos de <0,5 cm usando hojas de afeitar estériles o tijeras y pinzas dentro de un gabinete de bioseguridad.
- Prepare una solución 1x colagenasa IV (1 mg/ml) diluyendo un stock 10x en HBSS (10x colagenasa IV: 10 mg/ml o ~200 U/mL).
- Coloque las piezas de tejido picadas en los tubos disociadores de tejido. Llene los tubos con no más de 4 g de tejido y sumerja las piezas de tejido en ~ 10 ml de 1x colagenasa IV.
NOTA: No se recomienda el uso de DNasa I, ya que puede disminuir ligeramente la viabilidad y el rendimiento de NK. Consulte la Tabla de materiales para conocer los tubos disociadores de tejidos específicos utilizados. - Coloque los tubos disociadores de tejido en un disociador de tejido y mezcle a 37 °C para picar bien el tejido.
NOTA: Para el tejido hepático, esto puede tomar más de 30 minutos. Para más tejido friable, alrededor de 15 minutos puede ser suficiente. Consulte la Tabla de materiales para conocer los tubos disociadores de tejidos específicos y el disociador de tejido utilizado. - Retire los tubos disociadores de tejido y triture a través del filtro de células de nylon de 40 μm utilizando el backend de una jeringa de 5 ml. Recoge el eluyente y desecha los fragmentos grandes no digeridos.
- Girar el eluyente a 400 x g durante 5 min a temperatura ambiente. Aspirar el sobrenadante.
- Resuspenda los gránulos celulares en sílice recubierta con polivinilpirrolidona (PVP) al 30% para eliminar las células grasas que de otro modo contaminarían la fracción final de linfocitos.
- Para preparar 1x sílice recubierta de PVP, use una dilución 9:1 de sílice recubierta de PVP en 10x PBS.
NOTA: Consulte la Tabla de materiales para la sílice recubierta de PVP específica utilizada. - Para preparar sílice recubierta de PVP al 30%, diluya 1x sílice recubierta de PVP con PBS / HBSS.
- Para preparar 1x sílice recubierta de PVP, use una dilución 9:1 de sílice recubierta de PVP en 10x PBS.
- Girar el pellet de la celda a 400 x g durante 5 min a temperatura ambiente. Aspirar el sobrenadante.
- Resuspender el pellet celular en 9 mL de medio R-10.
NOTA: Consulte la Tabla de materiales para la composición de los medios R-10 - Coloque cuidadosamente la suspensión celular sobre 4 ml de Ficoll o medios de separación de linfocitos para separar los linfocitos de los glóbulos rojos y las células polimorfonucleares.
- Separar las capas centrifugando a 400 x g durante 23 min a temperatura ambiente con la aceleración y los frenos apagados o en el ajuste más bajo. Decantar cuidadosamente la capa media-superior y cosechar la interfase que contiene linfocitos infiltrantes de tejido.
- Enjuague las células con 10 ml de medio y proceda al recuento celular, citometría de flujo, alícuota y congelación de células, o protocolo de expansión NK primaria.
2. Expansión primaria de células NK a partir de PBMC (o CB o tejidos de órganos) (Día 0), como se muestra en la Figura 2.
- Descongele el PBMC congelado y las células alimentadoras congeladas e irradiadas en un baño maría a 37 °C.
- Lave las células PBMC y 100 células 221-mIL-21 irradiadas con rayos gamma (irradiadas con Gy) por centrifugación a 400 x g durante 5 min con 10 ml de medios R-10 por separado.
- Ahorre 1 x 106 células de PBMC para citometría de flujo.
NOTA: La pureza inicial de la célula NK es un factor importante en el cálculo de la tasa de expansión de la célula NK. - Resuspender las células en 1 ml de medio R-10. Cuente las celdas usando Trypan Blue.
- Mezcle 5x 10 6 celdas de PBMC con 10 x 10 6 celdas de 100 células 221-mIL-21 irradiadas con Gy en una placa especial de6 pocillos (ver Tabla de materiales).
- Agregue 30 ml de medios R-10 suplementados con IL-2 humana (200 U/ml) e IL-15 humana (5 ng/ml) (ver Tabla de materiales).
- Incubar la placa especial de 6 pocillos a 37 °C con 5% deCO2.
- Reemplace los medios con medios R-10 suplementados con IL-2 humana (200 U/mL) e IL-15 humana (5 ng/mL) para mantener las células NK cada 3-4 días.
NOTA: Mantenga menos de 20 x 106 celdas por pocillo para una mayor expansión en cada cambio de medios. Para obtener la mejor viabilidad, asegúrese de que el número total de células en cada pocillo no exceda de 100 x 106 celdas. - Registre el número total de células, la viabilidad y realice la citometría de flujo cada 3-4 días para calcular la tasa de expansión de las células NK.
3. Fijación de células 293T (Día 2), como se muestra en la Figura 2.
- Dividir 1,8 x 106 293T células en 11 ml de medio D-10 por placa de 100 mm tratada.
NOTA: Consulte la Tabla de materiales para la composición de los medios D-10 - Incubar células 293T a 37 °C con 5% deCO2.
4. Transfección retroviral (Día 3)
- En un tubo de 1,7 ml, mezclar 470 μL de medio sérico reducido con 30 μL de reactivo de transfección.
NOTA: Consulte la Tabla de materiales para conocer los medios séricos reducidos específicos y el reactivo de transfección utilizados. - En un tubo separado de 1,7 ml, agregue 2,5 μg de plásmido pRDF, 3,75 μg de plásmido Pegpam3 y 2,5 μg de construcción CAR en vector SFG en el medio sérico reducido para que el volumen final sea de 500 μL.
- Mezcle las soluciones en los pasos 4.1 y 4.2 gotas.
- Incubar el tubo a temperatura ambiente durante 15 min.
- Agregue 1 ml de la mezcla desde el paso 4.4 hasta la placa celular 293T el día 1 de manera gota.
- Incubar la(s) placa(s) a 37 °C con 5% de CO2 durante 48-72 h.
5. Recubrimiento de placas de retronectina (Día 3)
- Diluir la proteína retronectina con solución salina tamponada con fosfato (PBS) hasta una concentración final de 50-100 μg/mL.
- Agregue 500 μL de retronectina diluida en cada pocillo de una placa de 24 pocillos no tratada (5 pocillos por construcción CAR). Sellar la placa con parafilm e incubar la placa a 4 °C durante la noche.
6. Transducción (Día 4)
- Centrifugar la placa de retronectina a 2103 x g durante 30 min a 4 °C. Deseche el sobrenadante.
- Bloquear cada pocillo de la placa de 24 pocillos con 1 ml de medio R-10.
- Incubar la placa a 37 °C con 5% deCO2 durante 1 h.
- Precaliente la centrífuga a 32 °C mientras se bloquea la placa de retronectina.
- Recoger el sobrenadante del retrovirus filtrando las células 293T transfectadas utilizando un filtro de 0,45 μm.
- Alícuota 2 ml del sobrenadante de retrovirus filtrado en cada pocillo.
- Centrifugar la placa de 24 pocillos a 2103 x g durante 2 h a 32 °C.
- Durante la centrifugación en placa, recolecte las células PBNK expandidas del Día 0 y cuente las células con Trypan Blue.
NOTA: Continúe expandiendo las células PBNK agregando medios R-10 suplementados con IL-2 (200 U/mL) e IL-15 (5 ng/mL). - Diluir las células PBNK expandidas con medios R-10 suplementados con IL-2 (200 U/ml) e IL-15 (5 ng/ml) a 2,5 x 10 5-5 x 105 células/ml (0,5 x 106-1 x 106 células por pocillo).
NOTA: Registre el número total de células, la viabilidad y guarde 5 x 105 células PBNK expandidas para citometría de flujo, ya que estos valores son importantes para determinar la tasa de expansión de células NK. - Después de la centrifugación, aspirar parcialmente el sobrenadante de retrovirus de cada pocillo.
NOTA: No aspirar completamente, es decir, dejar aproximadamente 100 μL de sobrenadante de retrovirus por pocillo, ya que esto disminuirá la eficiencia de transducción. - Alícuota 2 ml de células PBNK expandidas diluidas desde la etapa 6.8 hasta cada pocillo.
- Centrifugar la placa a 600 x g durante 10 min a 32 °C. Incubar la placa a 37 °C con 5% de CO2 durante 48-72 h.
NOTA: No parafilme la placa.
7. Recolección de células CAR-NK (Día 6 o 7), como se muestra en la Figura 2.
- Recoja suavemente las células de la placa de 24 pocillos y transfiera las células a un tubo de centrífuga de 50 ml
NOTA: Trate de no generar burbujas, ya que esto resultará en una disminución de la viabilidad celular. - Centrifugar el tubo a 400 x g durante 5 min.
- Resuspender el pellet con 1 ml de medio R-10 y contar las células con Trypan Blue.
NOTA: Guarde 5 x 105 células para citometría de flujo para determinar la eficiencia de transducción. - Transfiera las células resuspendidas a una placa especial de 6 pocillos que contenga 30 ml de medios R-10 suplementados con IL-2 (200 U/ml) e IL-15 (5 ng/ml).
- Incubar la placa especial de 6 pocillos a 37 °C con 5% deCO2.
- Reemplace los medios R-10 suplementados con IL-2 (200 U/mL) e IL-15 (5 ng/mL) para mantener las células NK cada 3 a 4 días.
NOTA: Mantenga menos de 20 x 106 celdas por pocillo para una mayor expansión en cada cambio. Para obtener la mejor viabilidad, asegúrese de que el número total de células en cada pocillo no exceda de 100 x 106 celdas. - Registre el número total de células, la viabilidad y realice la citometría de flujo cada 3-4 días para calcular la tasa de expansión de las células NK.
- Utilice las células para ensayos in vitro o in vivo apropiados.
NOTA: Las células PBNK expandidas ex vivo y CAR-NK se pueden cultivar en una incubadora a 37 °C durante aproximadamente 4 semanas. - Examine el número y la pureza de las células NK en el día 7, día 11, día 14, día 18 y día 21 mediante citometría de flujo.
Resultados
En la Figura 1 y la Figura 2 se muestra un flujo de trabajo esquemático del aislamiento de células NK infiltrantes de tejido y la expansión de células PBNK utilizando la metodología de células alimentadoras 221-mIL-21. Las células PBNK expandidas se recolectaron cada 3 o 4 días para citometría de flujo para determinar la pureza de las células NK al teñir las células con CD56 antihumano y CD3 antihumano. El experimento se repitió utilizando dos donantes diferentes para mostrar la reproducibilidad del sistema de expansión (Figura 3). Se demostró que las células PBNK expandidas en 221-mIL-21 se expanden casi 5 × 104 pliegues (Figura 3A). Además, la pureza de la célula NK se mantuvo en gran medida, alrededor del 85% durante la expansión de 21 días (Figura 3B). Usando el sistema de expansión de células de alimentación de 221 mIL-21, la pureza de la célula NK osciló consistentemente entre 85% -95%, independientemente de los donantes (datos no mostrados). Para demostrar la robustez del sistema de expansión 221-mIL-21, se tiñeron PBMCs para anti-CD56 y anti-CD3 antes de la expansión, que mostró una pureza celular de 7.09% para las células NK y un alto porcentaje de células T (Figura 4A). Las PBMC se cocultivaron con 221-mIL-21 para expandir las células NK; la pureza de NK se comprobó antes de la transducción de CAR-NK el día 4 (Figura 4A). Se recolectaron células CAR-NK y se tiñeron para anti-CD56, anti-CD3 y anti-hIgG(H+L) F(ab')2, que mostraron una alta población de células NK (86,9% el día 7) y una alta eficiencia de transducción de CAR de aproximadamente el 70% (Figura 4). También se observaron mayores eficiencias de transducción (hasta el 95%) utilizando el sistema de empaquetado de retrovirus. En conjunto, estos datos muestran que las células alimentadoras de 221-mIL-21 podrían expandir con éxito las células NK y preservar la pureza de las células NK ex vivo.
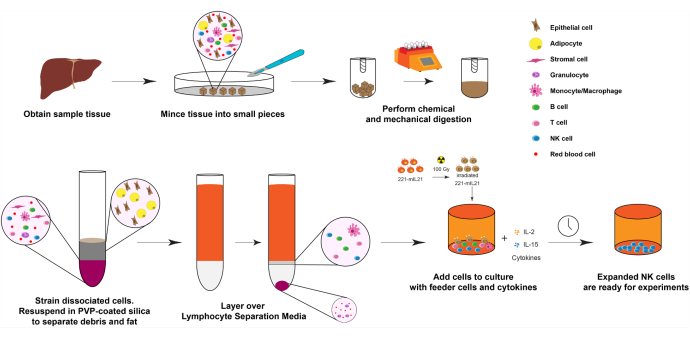
Figura 1: Diagrama de expansión de células NK a partir de muestras sólidas de órganos humanos. Brevemente, las muestras de hígado humano obtenidas se cortan en pequeños cubos para la digestión mecánica. Las células disociadas se aíslan utilizando sílice recubierta de PVP y medios de separación de linfocitos. Además, las células NK se expanden utilizando el protocolo de expansión descrito en la Figura 2. Haga clic aquí para ver una versión más grande de esta figura.
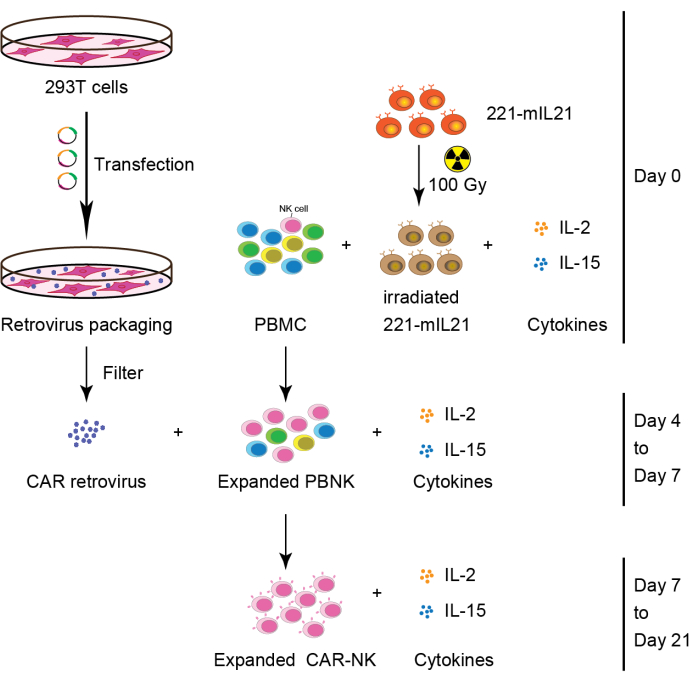
Figura 2: Flujo de trabajo esquemático de la generación de células CAR-NK a partir de PBMC. Brevemente, las células alimentadoras de 221-mIL21 se irradiaron a 100 Gy antes del cocultivo con PBMC suplementadas con IL-2 e IL-15 el día 0. Paralelamente, las células 293T se transfectaron con el sistema de empaquetamiento de retrovirus para producir retrovirus CAR que luego se transdució a las células PBNK expandidas en presencia de IL-2 e IL-15. Las células CAR-NK primarias se cosecharon el día 7 y continuaron la expansión durante 21 días. Esta figura ha sido modificada de Yang et al.16. Haga clic aquí para ver una versión más grande de esta figura.
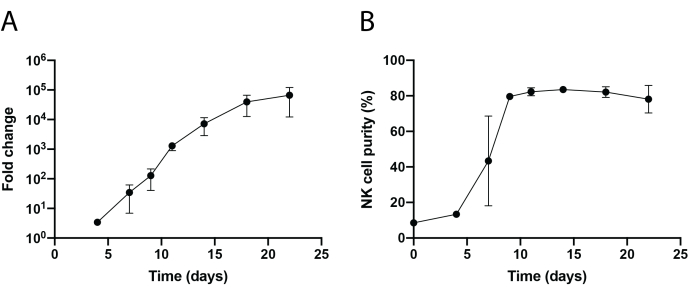
Figura 3: Expansión dinámica de lapso de tiempo de las células PBNK. (A) Expansión del pliegue de PBNK durante un curso de tiempo de 22 días. Las células se tiñeron con anti-CD56 y anti-CD3 en los días indicados para citometría de flujo. El número total de células NK se determinó multiplicando la pureza de las células NK por el número total de células. La tasa de expansión se generó de la siguiente manera: (Número de células NK)Tn/(Número de células NK)T0, donde Número de células NK = (porcentaje de pureza de células NK) × (número total de células), T 0 es el número de células NK en el momento día0, y Tn es el número de células NK en el momento día n. (B) Pureza de las células NK durante un curso de tiempo de 22 días. La expansión de células NK se repitió dos veces con dos donantes diferentes. Las barras de error representan ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
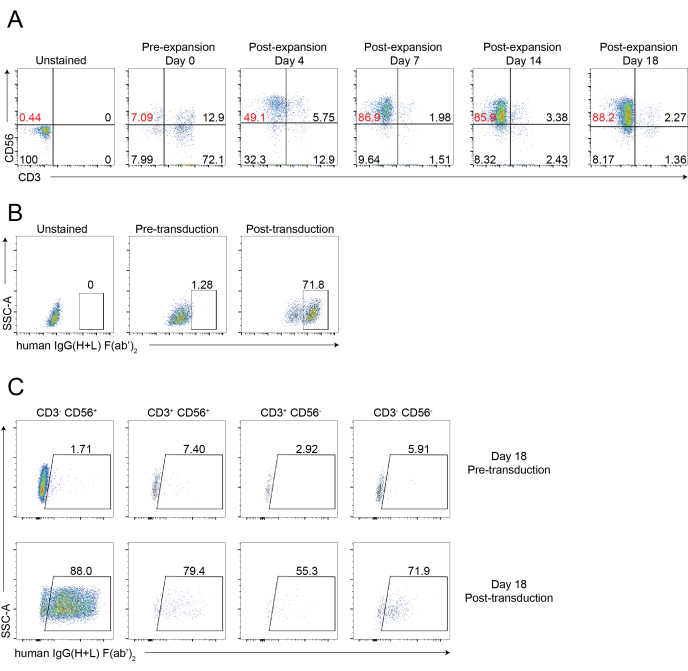
Figura 4: Análisis citométrico de flujo representativo de células CAR-NK. (A) Diagramas de puntos representativos que muestran el lapso de tiempo dinámico de la pureza de las células NK de las células CAR-NK durante un curso de 18 días. El análisis de citometría de flujo se evaluó teñiendo las células con anti-CD56 y anti-CD3 en los puntos temporales indicados. El día 0 indica la preexpansión de PBNK. El día 4 indica la post-expansión de PBNK y la pre-transducción de células CAR-NK. El día 7 indica la post-transducción de células CAR-NK. (B) Diagramas de puntos representativos que muestran la eficiencia de transducción de las células CAR-NK utilizando el sistema de empaquetado de retrovirus. Las células se tiñeron con anti-CD56, anti-CD3 y anti-hIgG(H+L) F(ab')2 para citometría de flujo. (C) Diagramas de puntos representativos que muestran la expresión de CAR en varios subconjuntos, incluidos CD56 + CD3-, CD56-CD3 +, CD56 + CD3 + y CD56-CD3- el día 18. Las células se tiñeron con anti-CD56, anti-CD3 y anti-hIgG(H+L) F(ab')2 (indicando expresión de CAR) para citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La mayoría de los productos CAR-NK actuales en ensayos clínicos utilizan líneas celulares NK17, como NK-92, una línea celular aislada de un paciente con linfoma no Hodgkin 18, NK-92MI, línea celular NK-92 independiente de IL-219, y NKL, aislado de un paciente con linfocitos granulares grandes20, ya que estas líneas celulares son fácilmente proliferativas para productos "listos para usar". Sin embargo, estas líneas celulares, por ejemplo, las células NK-92, tienen eficacias clínicas marginales y expansión in vivo , ya que requieren irradiación antes de la infusión, limitando así su proliferación y citotoxicidad in vivo21. Dadas estas razones, actualmente se están explorando varias estrategias para expandir las células NK primarias de varias fuentes, incluyendo sangre periférica, CB, médula ósea (BM), células madre embrionarias humanas (HSC), células madre pluripotentes inducidas (iPSCs) y tejidos tumorales21,22,23. Por ejemplo, las células NK se pueden expandir ex vivo usando interleucinas incluyendo IL-15, IL-18 e IL-21. Las líneas celulares linfoblastoides, como las células K562 o las líneas celulares linfoblastoides transformadas por el virus de Epstein-Barr, como las células 721.221, también se utilizan para la expansión de células NK16. Sin embargo, las estrategias mencionadas a menudo generan un número insuficiente de células NK para una transferencia adoptiva de inmunoterapia CAR-NK22,24. Para ayudar a resolver el problema, el estudio aquí muestra un protocolo para una expansión de células NK ex vivo utilizando una línea celular transformada genéticamente por EBV, células alimentadoras de 221-mIL-21.
La metodología de expansión que utiliza células alimentadoras de 221-mIL-21 que se muestra en este protocolo está optimizada para expandir las células NK con una tasa de expansión de al menos 10 a 100 veces mayor que otras líneas celulares de leucemia, incluidas las membranas HL-60 y OCl-AML3 que expresan IL-21, K562 y K652-mIL21 que expresan el ligando OX4022,24,25. La expresión de CAR también se evalúa durante aproximadamente 2 semanas ex vivo. Más significativamente, la estrategia de expansión de células alimentadoras 221-mIL-21 se puede aplicar para expandir células NK de diversas fuentes, incluidas PBMC, CB y órganos sólidos como el hígado, sin un paso inicial de enriquecimiento de NK. Aunque el sistema alimentador 221-mIL-21 no depende tanto del donante como las líneas celulares de alimentación antes mencionadas, no es completamente independiente de los donantes. En promedio, el sistema de expansión 221-mIL-21 puede alcanzar el 90% de pureza de la célula NK con un alto número de células NK, con aproximadamente el <5% de contaminación de células T el día 14 después de la expansión. Por lo tanto, para eliminar las posibilidades de contaminación de células T, es necesario aislar las células NK de las muestras obtenidas antes de la expansión ex vivo o utilizar un sistema de selección CD3 + para eliminar las células T después de una expansión ex vivo.
Una de las críticas en el uso de un sistema de expansión de células NK es que las células alimentadoras pueden no haber sido completamente erradicadas después de la expansión o antes de una transfusión, lo que puede poseer importantes preocupaciones regulatorias; Por lo tanto, la erradicación completa de las células alimentadoras antes de una transfusión es crucial. Sin embargo, los ensayos clínicos recientes de CAR-NK en los que se utilizaron células alimentadoras K562-mIL21-4-1BBL para la expansión de células CBNK ex vivo 24,25 no mostraron complicaciones preocupantes. Además, nuestros datos preliminares mostraron una disminución gradual de la población irradiada de 221-mIL-21 a medida que avanzaba la expansión (datos no mostrados). Sin embargo, se requieren estudios más extensos para que este método de expansión se implemente en un entorno clínico. En conjunto, el sistema de expansión 221-mIL-21 ayuda a resolver el desafío de expandir las células CAR-NK primarias y, por lo tanto, contribuirá significativamente al uso más amplio de la inmunoterapia basada en células CAR-NK en el futuro cercano.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Nos gustaría agradecer a los miembros del laboratorio Liu (Dr. Hsiang-chi Tseng, Dr. Xuening Wang y Dr. Chih-Hsiung Chen) por sus comentarios sobre los manuscritos. Nos gustaría agradecer al Dr. Gianpietro Dotti por los vectores SFG y al Dr. Eric Long por las 721.221 células. Este trabajo fue apoyado en parte por HL125018 (D. Liu), AI124769 (D. Liu), AI129594 (D. Liu), AI130197 (D. Liu) y Rutgers-Health Advance Funding (programa NIH REACH), U01HL150852 (R. Panettieri, S. Libutti y R. Pasqualini), S10OD025182 (D. Liu) y Rutgers University-New Jersey Medical School Startup funding for D. Liu Laboratory.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
Referencias
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados