Method Article
使用膜结合IL-21修饰B细胞系的自然杀伤(NK)和CAR-NK细胞扩增方法
摘要
在这里,我们提出了一种扩增外周血自然杀伤(PBNK),来自肝组织的NK细胞以及源自外周血单核细胞(PBMC)或脐带血(CB)的嵌合抗原受体(CAR)-NK细胞的方法。该协议展示了使用221-mIL-21饲养层细胞的NK和CAR-NK细胞的扩增,以及扩增的NK细胞的优化纯度。
摘要
嵌合抗原受体(CAR)修饰的免疫细胞疗法已成为癌症和传染病的新兴治疗方法。基于NK的免疫疗法,特别是CAR-NK细胞,是最有前途的"现成"开发之一,没有严重的危及生命的毒性。然而,开发成功的CAR-NK疗法的瓶颈是从第三方获得足够数量的非详尽,长寿命,"现成"CAR-NK细胞。在这里,我们开发了一种新的CAR-NK扩增方法,使用Epstein-Barr病毒-(EBV)转化的B细胞系表达白细胞介素-21(IL-21)的转基因膜形式。在该协议中,提供了分步程序以从脐带血和外周血以及实体器官组织中扩增NK和CAR-NK细胞。这项工作将显著增强CAR-NK免疫疗法的临床发展。
引言
自然杀伤(NK)细胞是表达CD56且缺乏T细胞标志物CD31,2表达的淋巴细胞的重要亚群。常规NK细胞被归类为先天免疫细胞,负责对病毒感染细胞和癌细胞进行免疫监视。与T细胞不同,NK细胞使用CD16或其他活化受体识别感染或恶性细胞,并且不需要在抗原肽和主要组织相容性复合物(MHC)I类分子3,4之间形成复合物。最近使用嵌合抗原受体(CAR)-NK细胞治疗复发或难治性CD19阳性癌症(非霍奇金淋巴瘤或慢性淋巴细胞白血病[CLL])的临床研究表明CAR-NK细胞具有突出的安全性优势5。例如,CAR-NK细胞输注与微小或可忽略不计的移植物抗宿主病(GVHD)、神经毒性、心脏毒性和细胞因子释放综合征(CRS)有关6,7,8,9,10。然而,扩增人NK细胞的传统方法显示出具有强自相残杀伤和端粒短缺的详尽表型,这对获得足够数量的功能性NK细胞用于过继免疫治疗提出了重大挑战11。
为了克服这些挑战,开发了一种使用辐照和基因工程721.221(以下简称221)细胞系直接从普通外周血单核细胞(PBMC)或脐带血(CB)扩增原代NK细胞的方法,这是一种MHC I类分子低表达的人B淋巴母细胞系3。先前的研究表明IL-21在NK细胞扩增中的重要性;因此,开发了表达721.221细胞系版本(从现在开始,221-mIL-21)的基因工程膜结合IL-2111,12,13,14,15。结果表明,221-mIL-21饲养层细胞扩增的原代NK细胞扩增至平均>40,000倍,持续高NK细胞纯度约2-3周。有关该协议应用的其他信息可以在Yang等人16中找到。
该协议旨在证明PBNK,CBNK,组织来源NK和CAR-NK细胞离 体新扩增的逐步程序。
研究方案
本协议中的人体组织和血液相关工作遵循罗格斯大学机构审查委员会(IRB)的指导方针
1.来自肝组织的NK细胞扩增(第0天),如图1所示。
注意:初始细胞数量和活力与器官切除后的时间和初始组织样本量密切相关。然而,如果将组织置于30mL的Hank平衡盐溶液(HBSS)中,并在冰上或4°C的冰箱中过夜,NK细胞仍然可以在高纯度和活力下扩增至24小时。
- 使用无菌手术设备确定活组织区域,从组织和切片中获取淋巴细胞。
- 将组织放入 30 mL HBSS(不含钙或镁)中并保持在冰上,直到准备好准备分离。
- 在生物安全柜内使用无菌剃须刀片或剪刀和镊子将组织切成 <0.5 厘米的立方体。
- 通过在 HBSS 中稀释 10 倍原液(10 x 胶原酶 IV:10 mg/mL 或 ~200 U/mL)制备 1x 胶原酶 IV 溶液 (1 mg/mL)。
- 将切碎的组织碎片放入组织解离管中。用不超过 4 g 的组织填充试管,并将组织碎片浸入 ~10 mL 的 1x 胶原酶 IV 中。
注意:不建议使用DNase I,因为它可能会略微降低NK的活力和产量。请参阅 材料表 ,了解所使用的特定组织解离管。 - 将组织解离管放入组织解离器中,并在37°C下混合以彻底切碎组织。
注意:对于肝组织,这可能需要30分钟以上。对于更易碎的组织,大约 15 分钟可能就足够了。请参阅 材料表 ,了解特定的组织解离管和所使用的组织解离剂。 - 取出组织解离管,并使用 5 mL 注射器的后端通过 40 μm 尼龙细胞过滤器研磨。收集淋洗液并丢弃大的未消化片段。
- 在室温下以400× g 旋转淋洗液5分钟。吸出上清液。
- 将细胞沉淀重悬于30%聚乙烯吡咯烷酮(PVP)涂层的二氧化硅中,以去除脂肪细胞,否则脂肪细胞会污染最终淋巴细胞部分。
- 要制备 1x PVP 涂层二氧化硅,请在 10x PBS 中使用 9:1 稀释的 PVP 涂层二氧化硅。
注意:请参阅 材料表 ,了解所使用的特定 PVP 涂层二氧化硅。 - 要制备 30% PVP 涂层二氧化硅,请用 PBS/HBSS 稀释 1x PVP 涂层二氧化硅。
- 要制备 1x PVP 涂层二氧化硅,请在 10x PBS 中使用 9:1 稀释的 PVP 涂层二氧化硅。
- 在室温下以400× g 旋转细胞沉淀5分钟。吸出上清液。
- 将细胞沉淀重悬于 9 mL 的 R-10 培养基中。
注:有关 R-10 介质的组成,请参阅材料表 - 小心地将细胞悬液分层在 4 mL 的 Ficoll 或淋巴细胞分离培养基上,以将淋巴细胞与红细胞和多形核细胞分离。
- 通过在室温下以400 x g 离心23分钟来分离层,同时关闭加速和制动器或以最低设置。小心地倒出中上层并收获含有组织浸润淋巴细胞的间期。
- 用 10 mL 培养基冲洗细胞,然后进行细胞计数、流式细胞术、细胞等分和冷冻或原代 NK 扩增方案。
2.来自PBMC(或CB或器官组织)的原代NK细胞扩增(第0天),如图 2所示。
- 在37°C水浴中解冻冷冻的PBMC和冷冻的辐照饲养层细胞。
- 分别用 10 mL R-10 培养基以 400 x g 离心 5 分钟,洗涤 PBMC 和 100 伽马辐照(Gy 辐照)221-mIL-21 细胞。
- 保存 1 x 10 6 个PBMC 细胞用于流式细胞术。
注意:初始NK细胞纯度是计算NK细胞扩增率的重要因素。 - 将细胞重悬于 1 mL 的 R-10 培养基中。使用台盼蓝计数细胞。
- 在特殊的6孔板中将5x 10 6细胞的PBMC与10 x 106细胞的100 Gy辐照221-mIL-21细胞混合(参见材料表)。
- 加入 30 mL 补充人 IL-2 (200 U/mL) 和人 IL-15 (5 ng/mL) 的 R-10 培养基(参见 材料表)。
- 将特殊的6孔板在37°C与5%CO2孵育。
- 用补充人IL-2(200U / mL)和人IL-15(5ng / mL)的R-10培养基替换培养基,以每3-4天维持一次NK细胞。
注意:保持每孔小于20 x 106 个细胞,以便在每次更换培养基时进一步扩增。为获得最佳活力,请确保每个孔中的总细胞数不超过100 x 106 个细胞。 - 记录细胞总数,活力,每3-4天进行一次流式细胞术以计算NK细胞扩增率。
3.附着293T细胞(第2天),如图 2所示。
- 在每个处理的 100 mm 板中将 1.8 x 106 293T 细胞拆分在 11 mL D-10 培养基中。
注:有关 D-10 介质的组成,请参阅材料表 - 在37°C下用5%CO2孵育293T细胞。
4. 逆转录病毒转染(第3天)
- 在 1.7 mL 管中,将 470 μL 还原血清培养基与 30 μL 转染试剂混合。
注意:有关所使用的特定还原血清培养基和转染试剂,请参阅 材料表 。 - 在单独的 1.7 mL 管中,将 2.5 μg pRDF 质粒、3.75 μg Pegpam3 质粒和 2.5 μg CAR 构建体加入还原的血清培养基中,使最终体积为 500 μL。
- 滴加步骤4.1和4.2中的溶液。
- 将试管在室温下孵育15分钟。
- 在第1天以滴加方式将步骤4.4中的1mL混合物加入293T细胞板中。
- 将板在37°C下用5%CO2 孵育48-72小时。
5. 瑞连蛋白平板包衣(第3天)
- 用磷酸盐缓冲盐水 (PBS) 稀释 retronectin 蛋白至终浓度为 50-100 μg/mL。
- 将 500 μL 稀释的 retronectin 加入未处理的 24 孔板的每个孔中(每个 CAR 构建体 5 个孔)。使用封口膜密封板,并将板在4°C孵育过夜。
6. 转导(第4天)
- 在4°C下以2103× g 离心再生连蛋白板30分钟。 弃去上清液。
- 用 1 mL R-10 培养基封闭 24 孔板的每个孔。
- 将板在37°C与5%CO2 孵育1小时。
- 将离心机预热至32°C,同时封闭再生连蛋白板。
- 通过使用0.45μm过滤器过滤转染的293T细胞来收集逆转录病毒上清液。
- 将 2 mL 过滤后的逆转录病毒上清液等分到每个孔中。
- 将24孔板在32°C下以2103× g 离心2小时。
- 在板离心过程中,从第 0 天收集扩增的 PBNK 细胞并使用台盼蓝对细胞进行计数。
注意:通过添加补充有IL-2(200 U / mL)和IL-15(5 ng / mL)的R-10培养基继续扩增PBNK细胞。 - 用补充有 IL-2 (200 U/mL) 和 IL-15 (5 ng/mL) 的 R-10 培养基稀释膨胀的 PBNK 细胞至 2.5 x 10 5-5 x 10 5 个细胞/mL(每孔0.5 x 106-1 x 10 6 个细胞)。
注意:记录总细胞数,活力,并保存5 x 105 个扩增的PBNK细胞用于流式细胞术,因为这些值对于确定NK细胞扩增速率很重要。 - 离心后,从每个孔中部分吸出逆转录病毒上清液。
注意:不要完全吸出,即每孔留下约100μL逆转录病毒上清液,因为这会降低转导效率。 - 将步骤6.8中稀释的PBNK细胞中的2 mL等分到每个孔中。
- 将板在32°C下以600× g 离心10分钟。 将板在37°C下用5%CO2 孵育48-72小时。
注意:请勿对板进行封口膜处理。
7. CAR-NK细胞收集(第6天或第7天),如图 2所示。
- 轻轻收集 24 孔板中的细胞,并将细胞转移到 50 mL 离心管中
注意:尽量不要产生气泡,因为这会导致细胞活力下降。 - 将试管以400× g 离心5分钟。
- 用 1 mL R-10 培养基重悬沉淀,并使用台盼蓝计数细胞。
注意:保存5 x 105 个细胞用于流式细胞术以确定转导效率。 - 将重悬的细胞转移到含有 30 mL 补充有 IL-2 (200 U/mL) 和 IL-15 (5 ng/mL) 的 R-10 培养基的特殊 6 孔板中。
- 将特殊的6孔板在37°C与5%CO2孵育。
- 更换补充有 IL-2 (200 U/mL) 和 IL-15 (5 ng/mL) 的 R-10 培养基,以维持每 3 - 4 天一次的 NK 细胞。
注意:保持每孔小于20 x 106 个细胞,以便在每次更改时进一步扩增。为获得最佳活力,请确保每个孔中的总细胞数不超过100 x 106 个细胞。 - 记录细胞总数、活力,每3-4天进行一次流式细胞术,以计算NK细胞扩增率。
- 使用细胞进行适当的 体外 或 体内 测定。
注意: 离体 扩增的PBNK和CAR-NK细胞可以在37°C培养箱中培养约4周。 - 通过流式细胞术在第7天,第11天,第14天,第18天和第21天检查NK细胞数量和纯度。
结果
图 1 和图 2 显示了使用 221-mIL-21 饲养层细胞方法进行组织浸润 NK 细胞分离和 PBNK 细胞扩增的示意图工作流程。每3或4天收集扩增的PBNK细胞进行流式细胞术,通过用抗人CD56和抗人CD3染色细胞来确定NK细胞纯度。使用两个不同的供体重复实验,以显示扩增系统的可重复性(图3)。显示扩增221-mIL-21的PBNK细胞扩增近5×104倍(图3A)。此外,NK细胞纯度得到高度维持,在整个21天扩增过程中约为85%(图3B)。使用221-mIL-21饲养层细胞扩增系统,NK细胞纯度始终在85%-95%之间,与供体无关(数据未显示)。为了证明221-mIL-21扩增系统的稳健性,在扩增前对PBMC进行了抗CD56和抗CD3染色,结果显示NK细胞的细胞纯度为7.09%,T细胞的纯度为高百分比(图4A)。PBMC与221-mIL-21共培养以扩增NK细胞;在第4天CAR-NK转导之前检查NK纯度(图4A)。收集CAR-NK细胞并染色抗CD56,抗CD3和抗hIgG(H + L)F(ab')2,其显示高NK细胞群(第7天为86.9%)和约70%的高CAR转导效率(图4)。使用逆转录病毒包装系统也观察到更高的转导效率(高达95%)。总之,这些数据表明,221-mIL-21饲养层细胞可以成功地扩增NK细胞并保持NK细胞离体的纯度。
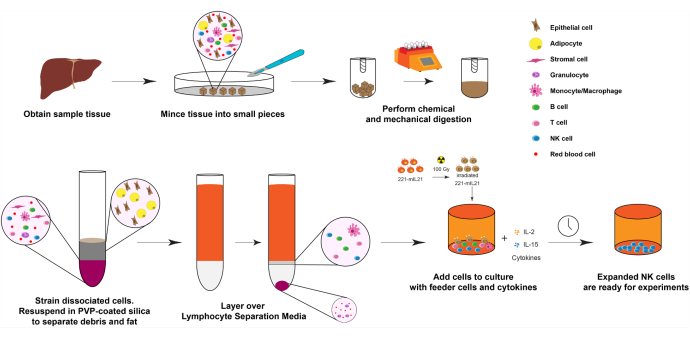
图1:固体人体器官样本的NK细胞扩增图。 简而言之,将获得的人肝脏样本切成小立方体进行机械消化。然后使用PVP包被的二氧化硅和淋巴细胞分离介质分离解离细胞。此外,NK细胞使用图2中描述的扩增方案进行扩增。请点击此处查看此图的大图。
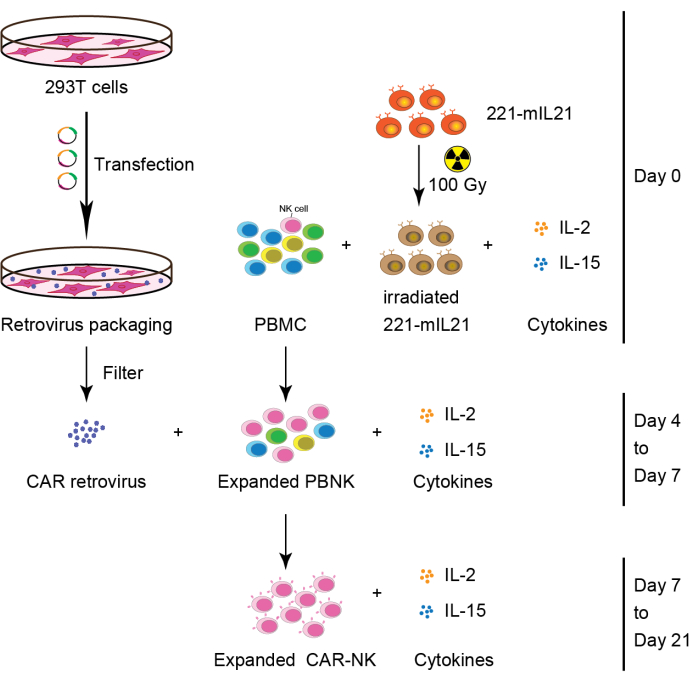
图 2:从 PBMC 生成 CAR-NK 细胞的示意图工作流程。 简而言之,在第0天与补充有IL-2和IL-15的PBMC共培养之前,将221-mIL21饲养层细胞以100Gy照射。同时,用逆转录病毒包装系统转染293T细胞以产生CAR逆转录病毒,然后在IL-2和IL-15存在下转导到扩增的PBNK细胞中。在第7天收获原代CAR-NK细胞并继续扩增21天。这个数字是从Yang等人16修改而来的。 请点击此处查看此图的大图。
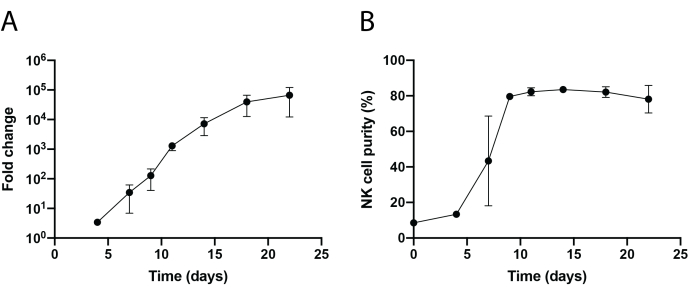
图3:PBNK细胞的动态延时扩增 。 (A)PBNK在22天时间过程中的倍数扩张。在指定的日期用抗CD56和抗CD3染色细胞进行流式细胞术。NK细胞的总数是通过将NK细胞纯度乘以细胞总数来确定的。扩增速率生成如下:(NK细胞数)Tn/(NK细胞数)T0,其中NK细胞数=(NK细胞纯度百分比)×(细胞总数),T0 是时间日0的NK细胞数,Tn是时间日n的NK细胞数。 (B)22天时间过程中的NK细胞纯度。用两个不同的供体重复NK细胞扩增两次。误差线表示± SEM。 请点击此处查看此图的大图。
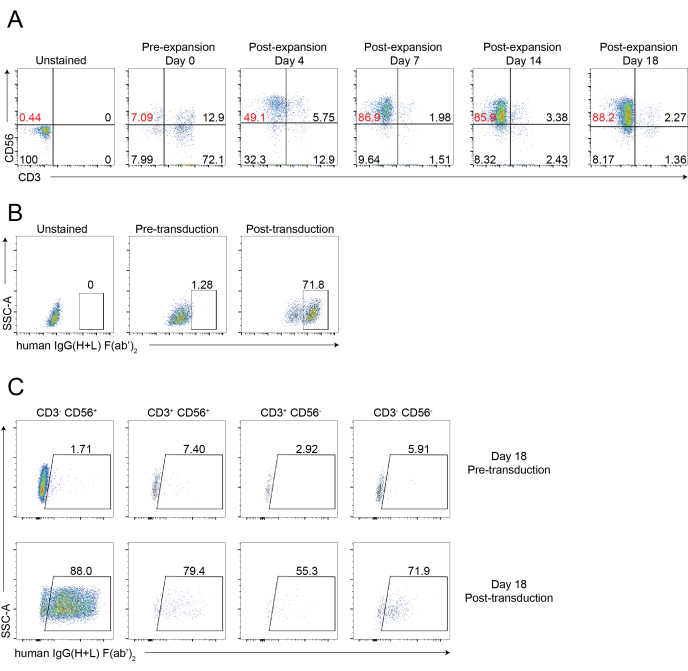
图4:CAR-NK细胞的代表性流式细胞术分析。 (A)代表性点图,显示CAR-NK细胞在18天疗程中NK细胞纯度的动态延时。通过在指定的时间点用抗CD56和抗CD3染色细胞来评估流式细胞术分析。第 0 天表示 PBNK 的预扩增。第4天表明PBNK扩增后和CAR-NK细胞预转导。第7天表明CAR-NK细胞的转导后。(B)使用逆转录病毒包装系统显示CAR-NK细胞转导效率的代表性点图。用抗CD56、抗CD3和抗hIgG(H+L)F(ab')2染色细胞进行流式细胞术。(C) 代表性点图显示各种子集中的 CAR 表达,包括第 18 天的 CD56+CD3-、CD56-CD3+、CD56+CD3+ 和 CD56-CD3-。细胞用抗CD56、抗CD3和抗hIgG(H+L)F(ab')2(指示CAR表达)染色,用于流式细胞术。请点击此处查看此图的大图。
讨论
目前临床试验中的大多数CAR-NK产品都利用NK细胞系17,例如NK-92,一种从非霍奇金淋巴瘤患者18中分离的细胞系,NK-92MI,IL-2独立NK-92细胞系19和NKL,从大颗粒淋巴细胞患者20中分离出来,因为这些细胞系很容易增殖为"现成"产品。然而,这些细胞系,例如NK-92细胞,具有边际临床有效性和体内扩增,因为它们需要在输注前进行照射,从而限制了它们在体内的增殖和细胞毒性21。鉴于这些原因,目前正在探索各种策略,以扩增来自多个来源的原代NK细胞,包括外周血,CB,骨髓(BM),人类胚胎干细胞(HSC),诱导多能干细胞(iPSCs)和肿瘤组织21,22,23。例如,NK细胞可以使用包括IL-15,IL-18和IL-21在内的白细胞进行体外扩增。淋巴母细胞系(如K562细胞)或EB病毒转化的淋巴母细胞系(如721.221细胞)也用于NK细胞扩增16。然而,上述策略通常产生不足数量的NK细胞用于CAR-NK免疫疗法的过继转移22,24。为了帮助解决这个问题,这里的研究显示了使用转基因EBV转化细胞系221-mIL-21饲养层细胞进行离体NK细胞扩增的方案。
使用本协议中显示的221-mIL-21饲养层细胞的扩增方法经过优化,以扩增速率至少比其他白血病细胞系高10至100倍的NK细胞,包括表达表达OX40配体的HL-60和OCl-AML3膜IL-21,K562和K652-mIL21配体22,24,25。CAR表达也在体外评估约2周。更重要的是,221-mIL-21饲养层细胞扩增策略可用于扩增来自各种来源的NK细胞,包括PBMC,CB和肝脏等实体器官,而无需初始NK富集步骤。尽管221-mIL-21饲养层系统不像上述饲养层细胞系那样依赖于供体,但它并非完全独立于供体。平均而言,221-mIL-21扩增系统在高NK细胞数量下可以达到90%的NK细胞纯度,在扩增后第14天约有<5%的T细胞污染。因此,为了消除T细胞污染的可能性,有必要在离体扩增之前从获得的样品中分离NK细胞,或者在离体扩增后使用CD3+选择系统消除T细胞。
使用NK细胞扩增系统的批评之一是,饲养层细胞在扩增后或输血之前可能尚未完全根除,这可能具有重大的监管问题;因此,在输血前完全根除饲养层细胞至关重要。然而,最近的CAR-NK临床试验中使用K562-mIL21-4-1BBL饲养层细胞进行 离体 CBNK细胞扩增24,25,没有 显示出令人担忧的并发症。此外,我们的初步数据显示,随着扩张的进展,辐照的221-mIL-21种群逐渐减少(数据未显示)。然而,为了在临床环境中实施这种扩展方法,需要进行更广泛的研究。总的来说,221-mIL-21扩增系统有助于解决扩增原代CAR-NK细胞的挑战,因此将在不久的将来为基于CAR-NK细胞的免疫疗法的更广泛使用做出重大贡献。
披露声明
作者声明没有竞争利益。
致谢
我们要感谢刘实验室的成员(曾祥祺博士、王雪宁博士和陈志雄博士)对手稿的评论。我们要感谢Gianpietro Dotti博士提供的SFG载体和Eric Long博士提供的721.221细胞。这项工作得到了HL125018(D. Liu),AI124769(D. Liu),AI129594(D. Liu),AI130197(D. Liu)和Rutgers-Health Advance Funding(NIH REACH计划),U01HL150852(R. Panettieri,S. Libutti和R. Pasqualini),S10OD025182(D. Liu)和罗格斯大学 - 新泽西医学院D. Liu实验室的启动资金的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
参考文献
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。