Method Article
Metodo di espansione cellulare Natural Killer (NK) e CAR-NK utilizzando la linea cellulare B modificata Membrane Bound-IL-21-Modified
In questo articolo
Riepilogo
Qui, presentiamo un metodo per espandere il natural killer del sangue periferico (PBNK), le cellule NK dai tessuti epatici e le cellule del recettore dell'antigene chimerico (CAR)-NK derivate da cellule mononucleate del sangue periferico (PBMC) o sangue del cordone ombelicale (CB). Questo protocollo dimostra l'espansione delle celle NK e CAR-NK utilizzando celle di alimentazione 221-mIL-21 oltre alla purezza ottimizzata delle celle NK espanse.
Abstract
La terapia con cellule immunitarie modificate dal recettore dell'antigene chimerico (CAR) è diventata un trattamento emergente per i tumori e le malattie infettive. L'immunoterapia basata su NK, in particolare le cellule CAR-NK, è uno dei più promettenti sviluppi "pronti all'uso" senza gravi tossicità potenzialmente letali. Tuttavia, il collo di bottiglia per lo sviluppo di una terapia CAR-NK di successo è il raggiungimento di un numero sufficiente di cellule CAR-NK non esaustive, di lunga durata, "pronte all'uso" da una terza parte. Qui, abbiamo sviluppato un nuovo metodo di espansione CAR-NK utilizzando una linea cellulare B trasformata dal virus di Epstein-Barr (EBV) che esprime una forma di membrana geneticamente modificata di interleuchina-21 (IL-21). In questo protocollo, vengono fornite procedure passo-passo per espandere le cellule NK e CAR-NK dal sangue del cordone ombelicale e dal sangue periferico, nonché dai tessuti degli organi solidi. Questo lavoro migliorerà significativamente lo sviluppo clinico dell'immunoterapia CAR-NK.
Introduzione
Le cellule natural killer (NK) sono un importante sottogruppo di linfociti che esprimono CD56 e mancano di espressione del marcatore delle cellule T, CD3 1,2. Le cellule NK convenzionali sono classificate come cellule immunitarie innate responsabili dell'immunosorveglianza delle cellule viralmente infette e delle cellule cancerose. A differenza delle cellule T, le cellule NK riconoscono le cellule infette o maligne utilizzando CD16 o altri recettori attivanti e non richiedono la formazione di un complesso tra peptidi dell'antigene e molecole di classe I del complesso maggiore di istocompatibilità (MHC) 3,4. Recenti indagini cliniche che utilizzano cellule CAR)-NK del recettore dell'antigene chimerico per il trattamento di tumori CD19-positivi recidivanti o refrattari (linfoma non-Hodgkin o leucemia linfatica cronica [LLC]) hanno mostrato gli eccezionali vantaggi di sicurezza delle cellule CAR-NK5. Ad esempio, l'infusione di cellule CAR-NK è associata a malattia minima o trascurabile del trapianto contro l'ospite (GVHD), neurotossicità, cardiotossicità e sindrome da rilascio di citochine (CRS)6,7,8,9,10. Tuttavia, i metodi convenzionali per espandere le cellule NK umane hanno mostrato fenotipi esaustivi con forte uccisione fratricida e carenza di telomeri, che rappresenta una grande sfida nell'ottenere un numero adeguato di cellule NK funzionali per l'immunoterapia adottiva11.
Per superare queste sfide, è stato sviluppato un metodo per espandere le cellule NK primarie direttamente dalle cellule mononucleate del sangue periferico non frazionate (PBMC) o dal sangue del cordone ombelicale (CB) utilizzando una linea cellulare irradiata e geneticamente modificata 721.221 (di seguito, 221), una linea cellulare umana di linfoblastoide B con bassa espressione di molecole MHC di classe I3. Studi precedenti hanno dimostrato l'importanza di IL-21 nell'espansione delle cellule NK; pertanto, è stata sviluppata una IL-21 geneticamente modificata legata alla membrana che esprime una versione della linea cellulare 721.221 (a partire da ora, 221-mIL-21) 11,12,13,14,15. I risultati hanno mostrato che 221-mIL-21 cellule NK primarie espanse con cellule di alimentazione sono state espanse a una media di >40.000 volte con un'elevata purezza delle cellule NK persistente per circa 2-3 settimane. Ulteriori informazioni riguardanti l'applicazione di questo protocollo possono essere trovate in Yang et al.16.
Questo protocollo mira a dimostrare la procedura passo-passo della nuova espansione di cellule PBNK, CBNK, NK derivate dai tessuti e CAR-NK ex vivo.
Protocollo
I tessuti umani e il lavoro correlato al sangue in questo protocollo seguono le linee guida del Rutgers University Institutional Review Board (IRB)
1. Espansione delle cellule NK dai tessuti epatici (Giorno 0), come mostrato nella Figura 1.
NOTA: Il numero iniziale di cellule e la vitalità sono fortemente correlati con il tempo trascorso dalla rimozione dell'organo e la quantità iniziale del campione di tessuto. Tuttavia, se i tessuti vengono posti in 30 ml di soluzione salina bilanciata di Hank (HBSS) e conservati su ghiaccio o in frigorifero a 4 °C durante la notte, le cellule NK possono ancora essere espanse ad alta purezza e vitalità fino a 24 ore dopo.
- Identificare le aree di tessuto vitale per ottenere linfociti da tessuti e sezioni utilizzando attrezzature chirurgiche sterili.
- Mettere i fazzoletti in 30 ml di HBSS (senza calcio o magnesio) e tenerli in ghiaccio fino al momento di prepararsi per l'isolamento.
- Tritare il tessuto in cubi di <0,5 cm usando lamette sterili o forbici e pinze all'interno di un armadio di biosicurezza.
- Preparare una soluzione 1x collagenasi IV (1 mg/ml) diluendo uno stock 10x in HBSS (10x collagenasi IV: 10 mg/mL o ~200 U/mL).
- Posizionare i pezzi di tessuto tritato nei tubi del dissociatore tissutale. Riempire i tubi con non più di 4 g di tessuto e immergere i pezzi di tessuto in ~ 10 ml di 1x collagenasi IV.
NOTA: L'uso di DNasi I non è raccomandato in quanto potrebbe ridurre leggermente la vitalità e la resa di NK. Si prega di fare riferimento alla tabella dei materiali per i tubi dissociatori tissutali specifici utilizzati. - Inserire i tubi del dissociatore tissutale in un dissociatore tissutale e frullare a 37 °C per tritare accuratamente il tessuto.
NOTA: Per il tessuto epatico, questo può richiedere più di 30 minuti. Per più tessuto friabile, circa 15 minuti possono essere sufficienti. Fare riferimento alla tabella dei materiali per i tubi dissociatori tissutali specifici e il dissociatore tissutale utilizzato. - Rimuovere i tubi del dissociatore tissutale e triturare attraverso un filtro a cellule di nylon da 40 μm utilizzando il backend di una siringa da 5 ml. Raccogliere l'eluente e scartare i grandi frammenti non digeriti.
- Girare l'eluente a 400 x g per 5 minuti a temperatura ambiente. Aspira il surnatante.
- Risospendere i pellet cellulari in silice rivestita di polivinilpirrolidone (PVP) al 30% per rimuovere le cellule adipose che altrimenti contaminerebbero la frazione linfocitaria finale.
- Per preparare 1x silice rivestita PVP, utilizzare la diluizione 9:1 di silice rivestita PVP in 10x PBS.
NOTA: Fare riferimento alla tabella dei materiali per la silice rivestita PVP specifica. - Per preparare il 30% di silice rivestita in PVP, diluire 1x silice rivestita di PVP con PBS/HBSS.
- Per preparare 1x silice rivestita PVP, utilizzare la diluizione 9:1 di silice rivestita PVP in 10x PBS.
- Girare il pellet cellulare a 400 x g per 5 minuti a temperatura ambiente. Aspira il surnatante.
- Risospendere il pellet cellulare in 9 mL di terreno R-10.
NOTA: Fare riferimento alla tabella dei materiali per la composizione dei supporti R-10 - Sovrapporre con cautela la sospensione cellulare su 4 ml di Ficoll o mezzi di separazione dei linfociti per separare i linfociti dai globuli rossi e dalle cellule polimorfonucleate.
- Separare gli strati centrifugando a 400 x g per 23 minuti a temperatura ambiente con l'accelerazione e i freni spenti o con l'impostazione più bassa. Decantare accuratamente lo strato medio-superiore e raccogliere l'interfase contenente linfociti infiltranti i tessuti.
- Risciacquare le cellule con 10 ml di terreno e procedere al conteggio delle cellule, alla citometria a flusso, all'aliquotazione e al congelamento delle cellule o al protocollo di espansione NK primario.
2. Espansione primaria delle cellule NK da PBMC (o CB o tessuti d'organo) (Giorno 0), come mostrato in Figura 2.
- Scongelare il PBMC congelato e le celle di alimentazione congelate e irradiate in un bagno d'acqua a 37 °C.
- Lavare separatamente la PBMC e 100 celle 221-mIL-21 irradiate con raggi gamma (irradiate con Gy) a 400 x g per 5 minuti con 10 ml di terreno R-10.
- Salvare 1 x 106 cellule di PBMC per la citometria a flusso.
NOTA: La purezza iniziale delle cellule NK è un fattore importante nel calcolo del tasso di espansione delle cellule NK. - Risospendere le cellule in 1 mL di terreno R-10. Conta le celle usando Trypan Blue.
- Mescolare 5x 10 6 celle di PBMC con 10 x 10 6 celle di 100 celle 221-mIL-21 irradiate con Gy in una speciale piastra a6 pozzetti (vedi Tabella dei materiali).
- Aggiungere 30 mL di terreno R-10 integrato con IL-2 umano (200 U/mL) e IL-15 umano (5 ng/mL) (vedere Tabella dei materiali).
- Incubare la speciale piastra a 6 pozzetti a 37 °C con il 5% di CO2.
- Sostituire il terreno con terreni R-10 integrati con IL-2 umano (200 U / mL) e IL-15 umano (5 ng / mL) per mantenere le cellule NK ogni 3-4 giorni.
NOTA: mantenere meno di 20 x 106 celle per pozzetto per un'ulteriore espansione ad ogni cambio di supporto. Per la migliore vitalità, assicurarsi che il numero totale di celle in ciascun pozzetto non superi 100 x 106 celle. - Registrare il numero totale di cellule, la vitalità ed eseguire la citometria a flusso ogni 3-4 giorni per calcolare il tasso di espansione delle cellule NK.
3. Attaccamento di cellule 293T (Giorno 2), come mostrato in Figura 2.
- Dividere 1,8 x 106 293T celle in 11 ml di supporto D-10 per piastra trattata da 100 mm.
NOTA: Fare riferimento alla tabella dei materiali per la composizione dei supporti D-10 - Incubare cellule 293T a 37 °C con il 5% di CO2.
4. Trasfezione di retrovirus (giorno 3)
- In una provetta da 1,7 ml, mescolare 470 μL di terreno sierico ridotto con 30 μL di reagente di trasfezione.
NOTA: Fare riferimento alla Tabella dei Materiali per i mezzi sierici ridotti specifici e il reagente di trasfezione utilizzati. - In una provetta separata da 1,7 ml, aggiungere 2,5 μg di plasmide pRDF, 3,75 μg di plasmide Pegpam3 e 2,5 μg di costrutto CAR in vettore SFG nel mezzo sierico ridotto in modo che il volume finale sia di 500 μL.
- Mescolare le soluzioni nei passaggi 4.1 e 4.2 a goccia.
- Incubare il tubo a temperatura ambiente per 15 minuti.
- Aggiungere 1 mL della miscela dal punto 4.4 alla piastra cellulare 293T il giorno 1 in modo goccia.
- Incubare la(e) piastre(e) a 37 °C con 5% di CO2 per 48-72 ore.
5. Rivestimento della piastra Retronectin (Giorno 3)
- Diluire la proteina retronectina con soluzione salina tamponata fosfato (PBS) ad una concentrazione finale di 50-100 μg/ml.
- Aggiungere 500 μL di retronectina diluita in ciascun pozzetto di una piastra a 24 pozzetti non trattata (5 pozzetti per costrutto CAR). Sigillare la piastra con parafilm e incubare la piastra a 4 °C durante la notte.
6. Trasduzione (Giorno 4)
- Centrifugare la piastra retronectina a 2103 x g per 30 minuti a 4 °C. Scartare il surnatante.
- Bloccare ciascun pozzetto della piastra a 24 pozzetti con 1 mL di terreno R-10.
- Incubare la piastra a 37 °C con 5% di CO2 per 1 ora.
- Preriscaldare la centrifuga a 32 °C mentre la piastra di retronectina viene bloccata.
- Raccogliere il supernatante retrovirus filtrando le cellule 293T trasfettate utilizzando un filtro da 0,45 μm.
- Aliquot 2 mL del retrovirus supernatante filtrato in ciascun pozzetto.
- Centrifugare la piastra a 24 pozzetti a 2103 x g per 2 ore a 32 °C.
- Durante la centrifugazione a piastre, raccogliere le celle PBNK espanse dal giorno 0 e contare le celle utilizzando Trypan Blue.
NOTA: Continuare ad espandere le celle PBNK aggiungendo mezzi R-10 integrati con IL-2 (200 U/mL) e IL-15 (5 ng/mL). - Diluire le celle PBNK espanse con mezzi R-10 integrati con IL-2 (200 U/mL) e IL-15 (5 ng/mL) a 2,5 x 10 5-5 x 10 5 cellule/ml (0,5 x 10 6-1 x 106 cellule per pozzetto).
NOTA: Registrare il numero totale di cellule, la vitalità e salvare 5 x 105 cellule PBNK espanse per la citometria a flusso poiché questi valori sono importanti nel determinare il tasso di espansione delle cellule NK. - Dopo la centrifugazione, aspirare parzialmente il retrovirus supernatante da ciascun pozzetto.
NOTA: Non aspirare completamente, cioè lasciare circa 100 μL di supernatante retrovirus per pozzetto, poiché ciò diminuirà l'efficienza di trasduzione. - Aliquot 2 mL delle celle PBNK espanse diluite dal punto 6.8 a ciascun pozzetto.
- Centrifugare la piastra a 600 x g per 10 minuti a 32 °C. Incubare la piastra a 37 °C con 5% di CO2 per 48-72 ore.
NOTA: Non parafilmare la piastra.
7. Raccolta delle celle CAR-NK (giorno 6 o 7), come mostrato nella Figura 2.
- Raccogliere delicatamente le cellule dalla piastra a 24 pozzetti e trasferire le celle in una provetta da centrifuga da 50 mL
NOTA: Cerca di non generare bolle, poiché ciò comporterà una diminuzione della vitalità cellulare. - Centrifugare il tubo a 400 x g per 5 min.
- Risospendere il pellet con 1 mL di terreno R-10 e contare le cellule usando Trypan Blue.
NOTA: Salvare 5 x 105 cellule per la citometria a flusso per determinare l'efficienza di trasduzione. - Trasferire le celle risospese in una speciale piastra a 6 pozzetti contenente 30 ml di mezzo R-10 integrato con IL-2 (200 U/mL) e IL-15 (5 ng/mL).
- Incubare la speciale piastra a 6 pozzetti a 37 °C con il 5% di CO2.
- Sostituire i mezzi R-10 integrati con IL-2 (200 U/mL) e IL-15 (5 ng/mL) per mantenere le cellule NK ogni 3 - 4 giorni.
NOTA: Mantenere meno di 20 x 106 celle per pozzetto per un'ulteriore espansione ad ogni modifica. Per la migliore vitalità, assicurarsi che il numero totale di celle in ciascun pozzetto non superi 100 x 106 celle. - Registrare il numero totale di cellule, la vitalità ed eseguire la citometria a flusso ogni 3-4 giorni per calcolare il tasso di espansione delle cellule NK.
- Utilizzare le cellule per appropriati test in vitro o in vivo .
NOTA: Le cellule PBNK espanse ex vivo e CAR-NK possono essere coltivate in un incubatore a 37 °C per circa 4 settimane. - Esaminare il numero e la purezza delle cellule NK al giorno 7, giorno 11, giorno 14, giorno 18 e giorno 21 mediante citometria a flusso.
Risultati
Un flusso di lavoro schematico dell'isolamento delle cellule NK infiltranti il tessuto e dell'espansione delle cellule PBNK utilizzando la metodologia delle cellule feeder 221-mIL-21 è mostrato nella Figura 1 e nella Figura 2. Le cellule PBNK espanse sono state raccolte ogni 3 o 4 giorni per la citometria a flusso per determinare la purezza delle cellule NK colorando le cellule con CD56 anti-umano e CD3 anti-umano. L'esperimento è stato ripetuto utilizzando due diversi donatori per mostrare la riproducibilità del sistema di espansione (Figura 3). È stato dimostrato che le cellule PBNK espanse di 221-mIL-21 si espandono di quasi 5 × 104 volte (Figura 3A). Inoltre, la purezza delle cellule NK è stata altamente mantenuta, circa l'85% durante l'espansione di 21 giorni (Figura 3B). Utilizzando il sistema di espansione della cella di alimentazione 221-mIL-21, la purezza delle cellule NK variava costantemente tra l'85% e il 95%, indipendentemente dai donatori (dati non mostrati). Per dimostrare la robustezza del sistema di espansione 221-mIL-21, le PBMC sono state colorate per anti-CD56 e anti-CD3 prima dell'espansione, che ha mostrato una purezza cellulare del 7,09% per le cellule NK e un'alta percentuale di cellule T (Figura 4A). Le PBMC sono state cocoltivate con 221-mIL-21 per espandere le cellule NK; la purezza di NK è stata controllata prima della trasduzione CAR-NK il giorno 4 (Figura 4A). Le cellule CAR-NK sono state raccolte e colorate per anti-CD56, anti-CD3 e anti-hIgG(H+L) F(ab')2, che hanno mostrato un'elevata popolazione di cellule NK (86,9 % al Giorno 7) e un'elevata efficienza di trasduzione CAR di circa il 70% (Figura 4). Efficienze di trasduzione più elevate (fino al 95%) sono state osservate anche utilizzando il sistema di confezionamento dei retrovirus. Complessivamente, questi dati mostrano che le celle alimentatrici 221-mIL-21 potrebbero espandere con successo le cellule NK e preservare la purezza delle cellule NK ex vivo.
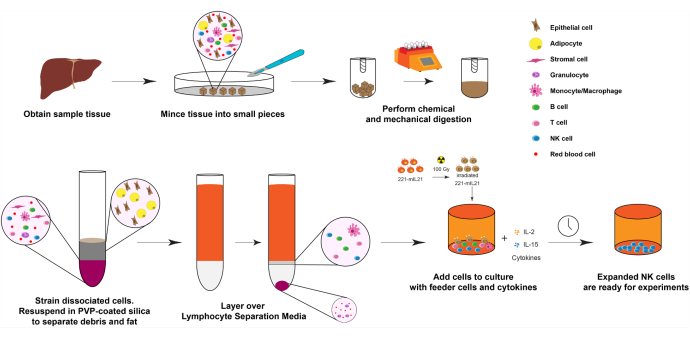
Figura 1: Diagramma dell'espansione delle cellule NK da campioni di organi umani solidi. In breve, i campioni di fegato umano ottenuti vengono tritati in piccoli cubetti per la digestione meccanica. Le cellule dissociate vengono quindi isolate utilizzando silice rivestita PVP e mezzi di separazione dei linfociti. Inoltre, le celle NK vengono espanse utilizzando il protocollo di espansione descritto nella Figura 2. Fare clic qui per visualizzare una versione ingrandita di questa figura.
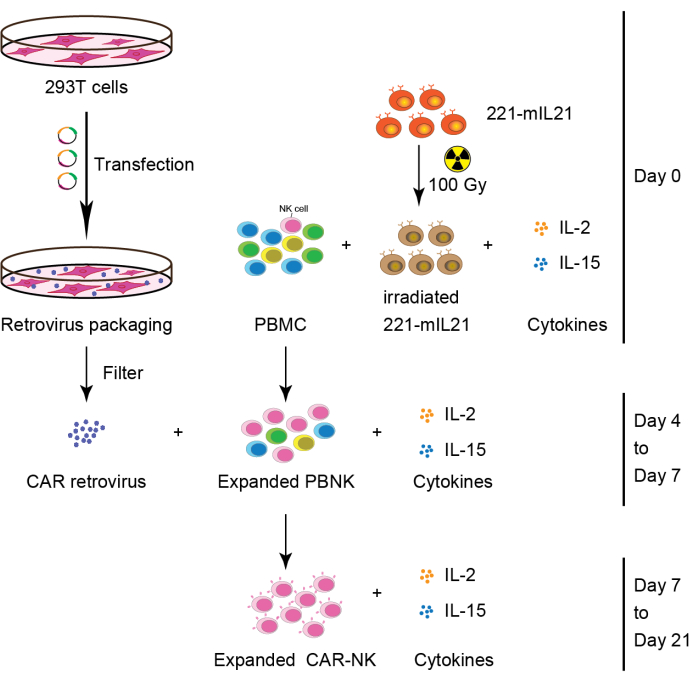
Figura 2: Flusso di lavoro schematico della generazione di celle CAR-NK da PBMC. In breve, le celle di alimentazione 221-mIL21 sono state irradiate a 100 Gy prima di cocoltura con PBMC integrate con IL-2 e IL-15 il giorno 0. In parallelo, le cellule 293T sono state trasfettate con il sistema di impacchettamento del retrovirus per produrre retrovirus CAR che è stato poi trasdotto nelle cellule PBNK espanse in presenza di IL-2 e IL-15. Le cellule primarie CAR-NK sono state raccolte il giorno 7 e hanno continuato l'espansione per 21 giorni. Questa cifra è stata modificata da Yang et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
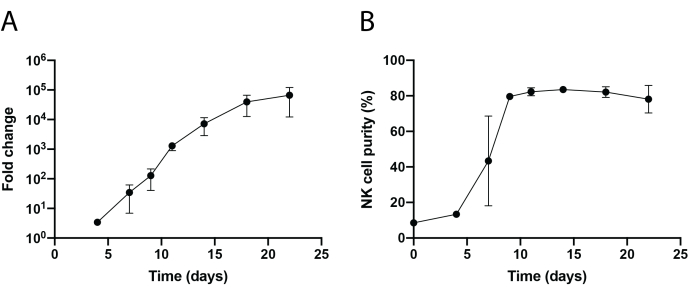
Figura 3: Espansione dinamica time-lapsed delle celle PBNK. (A) Espansione di fold di PBNK durante un corso di 22 giorni. Le cellule sono state colorate con anti-CD56 e anti-CD3 nei giorni indicati per la citometria a flusso. Il numero totale di cellule NK è stato determinato moltiplicando la purezza delle cellule NK per il numero totale di cellule. Il tasso di espansione è stato generato come segue: (Numero di cellule NK)Tn/(Numero di cellule NK)T0, dove Numero di cellule NK = (percentuale di purezza delle cellule NK) × (numero totale di celle), T 0 è il numero di cellule NK al giorno0 e Tn è il numero di cellule NK al giorno n. (B) Purezza delle cellule NK durante un corso di 22 giorni. L'espansione delle cellule NK è stata ripetuta due volte con due donatori diversi. Le barre di errore rappresentano ± SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
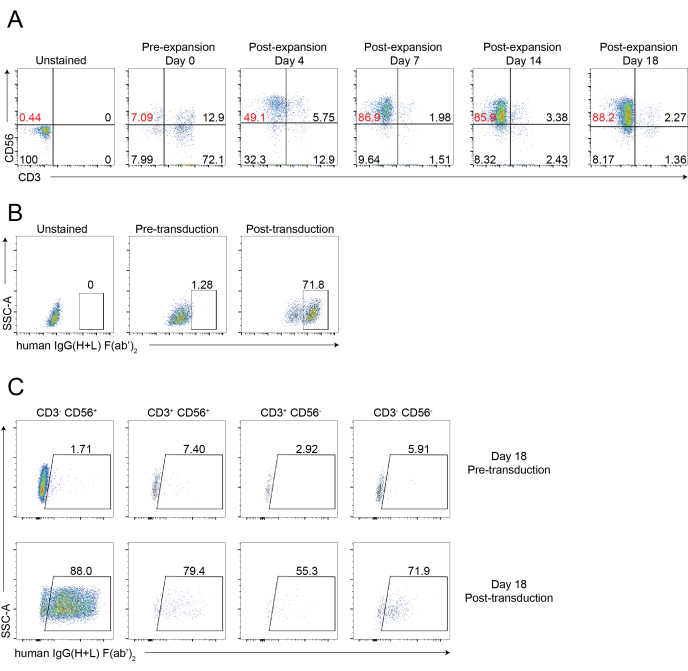
Figura 4: Analisi citometrica a flusso rappresentativa delle cellule CAR-NK. (A) Grafici a punti rappresentativi che mostrano il time-lapse dinamico della purezza delle cellule NK delle cellule CAR-NK durante un corso di 18 giorni. L'analisi della citometria a flusso è stata valutata colorando le cellule con anti-CD56 e anti-CD3 nei punti temporali indicati. Il giorno 0 indica la pre-espansione del PBNK. Il giorno 4 indica la post-espansione della PBNK e la pre-trasduzione delle cellule CAR-NK. Il giorno 7 indica la post-trasduzione delle cellule CAR-NK. (B) Grafici a punti rappresentativi che mostrano l'efficienza di trasduzione delle cellule CAR-NK utilizzando il sistema di impacchettamento dei retrovirus. Le cellule sono state colorate con anti-CD56, anti-CD3 e anti-hIgG(H+L) F(ab')2 per la citometria a flusso. (C) Grafici a punti rappresentativi che mostrano l'espressione CAR in vari sottoinsiemi, tra cui CD56+CD3-, CD56-CD3+, CD56+CD3+ e CD56-CD3- il giorno 18. Le cellule sono state colorate con anti-CD56, anti-CD3 e anti-hIgG(H+L) F(ab')2 (che indica l'espressione di CAR) per la citometria a flusso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
La maggior parte degli attuali prodotti CAR-NK negli studi clinici utilizza linee cellulari NK 17, come NK-92, una linea cellulare isolata da un paziente con linfoma non-Hodgkin18, NK-92MI, IL-2 indipendente linea cellulare NK-9219 e NKL, isolata da un grande paziente linfocitario granulare20, poiché queste linee cellulari sono facilmente proliferative per prodotti "pronti all'uso". Tuttavia, queste linee cellulari, ad esempio le cellule NK-92, hanno efficacia clinica marginale ed espansione in vivo, poiché richiedono irradiazione prima dell'infusione, limitando così la loro proliferazione e citotossicità in vivo21. Date queste ragioni, sono attualmente in fase di studio varie strategie per espandere le cellule NK primarie da diverse fonti, tra cui sangue periferico, CB, midollo osseo (BM), cellule staminali embrionali umane (HSC), cellule staminali pluripotenti indotte (iPSC) e tessuti tumorali21,22,23. Ad esempio, le cellule NK possono essere espanse ex vivo usando interleuchine tra cui IL-15, IL-18 e IL-21. Le linee cellulari linfoblastoidi come le cellule K562 o le linee cellulari linfoblastoidi trasformate dal virus di Epstein-Barr come le cellule 721.221, sono utilizzate anche per l'espansione delle cellule NK16. Tuttavia, le suddette strategie spesso generano un numero insufficiente di cellule NK per un trasferimento adottivo dell'immunoterapia CAR-NK22,24. Per aiutare a risolvere il problema, lo studio qui mostra un protocollo per un'espansione ex vivo delle cellule NK utilizzando una linea cellulare geneticamente modificata trasformata da EBV, cellule alimentatrici 221-mIL-21.
La metodologia di espansione che utilizza cellule feeder 221-mIL-21 mostrata in questo protocollo è ottimizzata per espandere le cellule NK con un tasso di espansione da almeno 10 a 100 volte superiore rispetto ad altre linee cellulari leucemiche, tra cui HL-60 e OCl-AML3 che esprimono la membrana IL-21, K562 e K652-mIL21 che esprimono il ligando OX4022,24,25. Anche l'espressione di CAR viene valutata per circa 2 settimane ex vivo. Più significativamente, la strategia di espansione delle cellule alimentatrici 221-mIL-21 può essere applicata per espandere le cellule NK da varie fonti, tra cui PBMC, CB e organi solidi come il fegato, senza una fase iniziale di arricchimento NK. Sebbene il sistema di alimentazione 221-mIL-21 non sia dipendente dal donatore come le suddette linee cellulari di alimentazione, non è completamente indipendente dai donatori. In media, il sistema di espansione 221-mIL-21 può raggiungere il 90% della purezza delle cellule NK con un elevato numero di cellule NK, con circa il <5% di contaminazione delle cellule T il giorno 14 dopo l'espansione. Pertanto, per eliminare le possibilità di contaminazione delle cellule T, è necessario isolare le cellule NK dai campioni ottenuti prima dell'espansione ex vivo o utilizzare un sistema di selezione CD3+ per eliminare le cellule T dopo un'espansione ex vivo.
Una delle critiche nell'utilizzo di un sistema di espansione delle cellule NK è che le cellule di alimentazione potrebbero non essere state completamente sradicate dopo l'espansione o prima di una trasfusione, il che potrebbe avere significativi problemi normativi; Pertanto, l'eradicazione completa delle cellule nutritrici prima di una trasfusione è fondamentale. Tuttavia, recenti studi clinici CAR-NK in cui sono state utilizzate cellule di alimentazione K562-mIL21-4-1BBL per l'espansione ex vivo delle cellule CBNK24,25 non hanno mostrato complicazioni preoccupanti. Inoltre, i nostri dati preliminari hanno mostrato una graduale diminuzione della popolazione irradiata di 221-mIL-21 man mano che l'espansione progrediva (dati non mostrati). Tuttavia, sono necessari studi più approfonditi affinché questo metodo di espansione possa essere implementato in un contesto clinico. Collettivamente, il sistema di espansione 221-mIL-21 aiuta a risolvere la sfida dell'espansione delle cellule primarie CAR-NK e quindi contribuirà in modo significativo all'uso più ampio dell'immunoterapia basata sulle cellule CAR-NK nel prossimo futuro.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Vorremmo ringraziare i membri del laboratorio Liu (Dr. Hsiang-chi Tseng, Dr. Xuening Wang e Dr. Chih-Hsiung Chen) per i loro commenti sui manoscritti. Si ringrazia il Dr. Gianpietro Dotti per i vettori SFG e il Dr. Eric Long per le 721.221 cellule. Questo lavoro è stato supportato in parte da HL125018 (D. Liu), AI124769 (D. Liu), AI129594 (D. Liu), AI130197 (D. Liu) e Rutgers-Health Advance Funding (programma NIH REACH), U01HL150852 (R. Panettieri, S. Libutti e R. Pasqualini), S10OD025182 (D. Liu) e Rutgers University-New Jersey Medical School Startup funding for D. Liu Laboratory.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
Riferimenti
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon