Method Article
멤브레인 결합-IL-21-변형 B 세포주를 이용한 자연살해(NK) 및 CAR-NK 세포 확장 방법
요약
여기에서는 말초혈액자연살해(PBNK), 간 조직으로부터 NK세포, 말초혈액단핵세포(PBMC) 또는 제대혈(CB)에서 유래한 키메라 항원 수용체(CAR)-NK세포를 확장시키는 방법을 제시한다. 이 프로토콜은 확장된 NK 세포의 최적화된 순도 외에도 221-mIL-21 영양세포를 사용하는 NK 및 CAR-NK 세포의 확장을 보여줍니다.
초록
키메라 항원 수용체(CAR) 변형 면역 세포 요법은 암 및 전염병에 대한 새로운 치료법이 되었습니다. NK 기반 면역 요법, 특히 CAR-NK 세포는 생명을 위협하는 심각한 독성이없는 가장 유망한 '기성품'개발 중 하나입니다. 그러나 성공적인 CAR-NK 치료법 개발의 병목 현상은 제3자로부터 충분한 수의 완전하지 않고 수명이 긴 '기성품' CAR-NK 세포를 달성하는 것입니다. 여기에서는 유전자 변형 막 형태의 인터루킨-21(IL-21)을 발현하는 엡스타인-바 바이러스-(EBV) 형질전환 B 세포주를 이용한 새로운 CAR-NK 확장 방법을 개발했습니다. 이 프로토콜에서는 제대혈 및 말초 혈액뿐만 아니라 고형 장기 조직으로부터 NK 및 CAR-NK 세포를 확장하기위한 단계별 절차가 제공됩니다. 이 연구는 CAR-NK 면역 요법의 임상 개발을 크게 향상시킬 것입니다.
서문
자연 살해 (NK) 세포는 CD56을 발현하고 T 세포 마커 인 CD3 1,2의 발현이 부족한 림프구의 중요한 하위 집합입니다. 기존의 NK 세포는 바이러스에 감염된 세포와 암세포의 면역 감시를 담당하는 선천성 면역 세포로 분류됩니다. NK 세포는 T 세포와 달리 CD16 또는 기타 활성화 수용체를 사용하여 감염 또는 악성 세포를 인식하며 항원 펩타이드와 주요 조직 적합성 복합체 (MHC) 클래스 I 분자 3,4 사이에 복합체를 형성 할 필요가 없습니다. 재발성 또는 불응성 CD19 양성 암(비호지킨 림프종 또는 만성 림프구성 백혈병[CLL])을 치료하기 위해 키메라 항원 수용체(CAR)-NK 세포를 사용한 최근 임상 조사는 CAR-NK세포의 뛰어난 안전성 이점을 보여주었습니다5. 예를 들어, CAR-NK 세포 주입은 이식편 대 숙주 질환 (GVHD), 신경 독성, 심장 독성 및 사이토 카인 방출 증후군 (CRS) 6,7,8,9,10과 관련이 있습니다. 그러나 인간 NK 세포를 확장하는 기존의 방법은 강한 동족 사멸 및 텔로미어 부족을 가진 철저한 표현형을 보여 주었고, 이는 입양면역 요법을 위한 적절한 수의 기능적 NK 세포를 얻는 데 큰 도전을 제시합니다11.
이러한 과제를 극복하기 위해, MHC 클래스I 분자의 발현이 낮은 인간 B-림프모세포제 세포주인 721.221(이하 221) 세포주인 방사선 조사 및 유전자 조작 세포주를 사용하여 분획되지 않은 말초혈액 단핵세포(PBMC) 또는 제대혈(CB)로부터 1차 NK 세포를 직접 확장하는 방법이 개발되었습니다. 이전 연구에서는 NK 세포 확장에서 IL-21의 중요성을 보여주었습니다. 따라서, 721.221 세포주의 버전을 발현하는 유전자 조작된 막 결합 IL-21 (현재부터, 221-mIL-21)이 11,12,13,14,15로 개발되었다. 그 결과, 221-mIL-21 영양세포가 확장된 1차 NK 세포는 약 2-3주 동안 높은 NK 세포 순도를 유지하면서 평균 >40,000배로 확장되는 것으로 나타났다. 이 프로토콜의 적용에 관한 추가 정보는 Yang et al.16에서 찾을 수 있습니다.
이 프로토콜은 PBNK, CBNK, 조직 유래 NK 및 CAR-NK 세포의 생체 외 확장의 단계별 절차를 입증하는 것을 목표로 합니다.
프로토콜
이 프로토콜의 인체 조직 및 혈액 관련 작업은 Rutgers University Institutional Review Board (IRB)의 지침을 따릅니다.
1. 도 1과 같이 간 조직으로부터의 NK 세포 확장(Day 0).
참고: 초기 세포 수와 생존력은 장기 제거 이후 시간 및 초기 조직 샘플 양과 밀접한 관련이 있습니다. 그러나 조직을 행크 밸런스드 소금 용액 (HBSS) 30mL에 넣고 얼음이나 냉장고에서 밤새 4 ° C로 보관하면 NK 세포는 최대 24 시간 후에도 고순도와 생존력으로 확장 될 수 있습니다.
- 멸균 수술 장비를 사용하여 조직 및 절편에서 림프구를 얻기 위해 생존 가능한 조직 영역을 식별합니다.
- HBSS 30mL(칼슘 또는 마그네슘 제외)에 조직을 넣고 격리를 준비할 준비가 될 때까지 얼음 위에 두십시오.
- 생물 안전 캐비닛 내부의 멸균 면도날 또는 가위와 집게를 사용하여 조직을 <0.5cm 입방체로 만듭니다.
- HBSS에서 10x 스톡을 희석하여 1x 콜라게나제 IV 용액(10mg/mL)을 준비합니다(10x 콜라게나제 IV: 10mg/mL 또는 ~200U/mL).
- 다진 조직 조각을 조직 해리 튜브에 넣습니다. 튜브에 4g 이하의 조직을 채우고 조직 조각을 ~10mL의 1x 콜라게나제 IV에 담그십시오.
참고: DNase I을 사용하면 NK 생존력과 수율이 약간 감소할 수 있으므로 사용하지 않는 것이 좋습니다. 사용되는 특정 조직 해리 튜브에 대한 재료 표를 참조하십시오. - 조직 해리기 튜브를 조직 해리기에 넣고 37°C에서 혼합하여 조직을 완전히 다집니다.
알림: 간 조직의 경우 30분 이상 걸릴 수 있습니다. 더 부서지기 쉬운 조직의 경우 약 15분이면 충분할 수 있습니다. 특정 조직 해리기 튜브 및 사용된 조직 해리기에 대한 재료 표를 참조하십시오. - 조직 해리기 튜브를 제거하고 5mL 주사기의 백엔드를 사용하여 40μm 나일론 세포 스트레이너를 통해 분쇄합니다. 용리액을 수집하고 소화되지 않은 큰 조각을 버립니다.
- 실온에서 5분 동안 400 x g 의 용리액을 회전시킵니다. 상청액을 흡인하십시오.
- 세포 펠릿을 30% 폴리비닐피롤리돈(PVP) 코팅 실리카에 재현탁하여 최종 림프구 분획을 오염시킬 지방 세포를 제거합니다.
- 1x PVP 코팅 실리카를 제조하려면 10x PBS에서 PVP 코팅 실리카를 9:1 희석하여 사용하십시오.
알림: 사용된 특정 PVP 코팅 실리카에 대한 재료 표를 참조하십시오. - 30% PVP 코팅 실리카를 제조하려면 1x PVP 코팅 실리카를 PBS/HBSS로 희석합니다.
- 1x PVP 코팅 실리카를 제조하려면 10x PBS에서 PVP 코팅 실리카를 9:1 희석하여 사용하십시오.
- 실온에서 5분 동안 400 x g 에서 셀 펠릿을 회전시킵니다. 상청액을 흡인하십시오.
- 9mL의 R-10 배지에 세포 펠릿을 재현탁합니다.
참고 : R-10 매체의 구성에 대해서는 재료 표를 참조하십시오. - 4mL의 Ficoll 또는 림프구 분리 배지에 세포 현탁액을 조심스럽게 층층화하여 적혈구 및 다형 핵 세포에서 림프구를 분리합니다.
- 가속 및 브레이크를 끈 상태에서 실온에서 23분 동안 400 x g 에서 23분 동안 원심분리하거나 가장 낮은 설정에서 층을 분리합니다. 조심스럽게 상부 - 중간 층을 따라 내고 조직 침윤 림프구를 포함하는 간기를 수확하십시오.
- 10mL의 배지로 세포를 헹구고 세포 계수, 유세포 분석, 세포의 분취 및 동결 또는 1차 NK 확장 프로토콜을 진행합니다.
2. 그림 2와 같이 PBMC(또는 CB 또는 장기 조직)로부터의 1차 NK 세포 확장(Day 0).
- 동결된 PBMC를 동결시키고, 조사된 지지세포를 37°C 수조에서 해동시킨다.
- PBMC 및 100 감마선 조사된(Gy-irradiated) 221-mIL-21 세포를 400 x g 에서 5분 동안 원심분리하여 10 mL의 R-10 배지로 별도로 세척하였다.
- 유동 세포분석을 위한 PBMC의 1 x 106 세포를 저장하십시오.
참고: 초기 NK 세포 순도는 NK 세포 확장률을 계산하는 데 중요한 요소입니다. - 1mL의 R-10 배지에 세포를 재현탁합니다. 트리판 블루를 사용하여 세포를 세십시오.
- 특별한 6 웰 플레이트에 있는 100 Gy 조사된 221-mIL-21 세포의 10 x 10 6 세포와 PBMC의 5x 106 세포를 섞으십시오 (물자의 표를 보십시오).
- 인간 IL-2 (200 U / mL) 및 인간 IL-15 (5 ng / mL)가 보충 된 R-10 배지 30 mL를 추가합니다 ( 재료 표 참조).
- 특수 6-웰 플레이트를 37°C에서 5%CO2로 배양한다.
- 3-4일마다 NK 세포를 유지하기 위해 인간 IL-2(200U/mL) 및 인간 IL-15(5ng/mL)가 보충된 R-10 배지로 배지를 교체합니다.
알림: 각 배지 교체 시 추가 확장을 위해 웰당 20 x 106 셀 미만으로 유지하십시오. 최상의 생존력을 위해, 각 웰의 총 세포 수가 100 x 106 세포를 초과하지 않도록하십시오. - 총 세포 수, 생존율을 기록하고 3-4일 간격으로 유세포 분석을 수행하여 NK 세포 확장률을 계산하였다.
3. 그림 2와 같이 293T 세포의 부착(Day 2).
- 처리된 100mm 플레이트당 11mL의 D-10 배지에서 1.8 x 106 293T 세포를 분할합니다.
참고: D-10 매체의 구성에 대해서는 재료 표를 참조하십시오. - 293T 세포를 37°C에서 5%CO2로 배양한다.
4. 레트로바이러스 형질감염(3일차)
- 1.7mL 튜브에 470μL의 환원된 혈청 배지와 30μL의 형질주입 시약을 혼합합니다.
참고: 사용된 특정 환원 혈청 배지 및 형질주입 시약에 대해서는 재료 표를 참조하십시오. - 별도의 1.7mL 튜브에서 SFG 벡터의 pRDF 플라스미드 2.5μg, Pegpam3 플라스미드 3.75μg 및 CAR 구축물 2.5μg을 환원된 혈청 배지에 추가하여 최종 부피가 500μL가 되도록 합니다.
- 4.1단계와 4.2단계의 용액을 적가하여 혼합합니다.
- 튜브를 실온에서 15분 동안 배양합니다.
- 단계 4.4의 혼합물 1 mL를 1일째에 293T 세포 플레이트에 적가한다.
- 플레이트를 37°C에서 5% CO2로 48-72시간 동안 배양합니다.
5. 레트로넥틴 플레이트 코팅 (3일차)
- 레트로넥틴 단백질을 인산염 완충 식염수(PBS)로 최종 농도 50-100μg/mL로 희석합니다.
- 희석된 레트로넥틴 500μL를 미처리 24-웰 플레이트(CAR 구축물당 5웰)의 각 웰에 첨가한다. 파라필름을 사용하여 플레이트를 밀봉하고 플레이트를 4°C에서 밤새 인큐베이션한다.
6. 형질 도입 (4 일차)
- 레트로넥틴 플레이트를 2103 x g 에서 4°C에서 30분 동안 원심분리한다. 상청액을 폐기하십시오.
- 24웰 플레이트의 각 웰을 1mL의 R-10 배지로 차단합니다.
- 플레이트를 5%CO2 와 함께 37°C에서 1시간 동안 인큐베이션한다.
- 레트로넥틴 플레이트가 차단되는 동안 원심분리기를 32°C로 예열합니다.
- 0.45 μm 필터를 사용하여 형질감염된 293T 세포를 여과하여 레트로바이러스 상청액을 수집한다.
- 여과된 레트로바이러스 상청액 2 mL를 각 웰에 분취한다.
- 24웰 플레이트를 2103 x g 에서 32°C에서 2시간 동안 원심분리합니다.
- 플레이트 원심분리 동안, 0일째부터 확장된 PBNK 세포를 수집하고 트리판 블루를 사용하여 세포를 계수한다.
참고: IL-10(200U/mL) 및 IL-200(5ng/mL)가 보충된 R-15 배지를 추가하여 PBNK 세포를 계속 확장합니다. - IL-2 (200 U/mL) 및 IL-15 (5 ng/mL)로 보충된 R-10 배지로 확장된 PBNK 세포를 2.5 x 10 5-5 x 10 5 세포/mL(0.5 x 10 6-1 x 10웰당6 세포)로 희석합니다.
참고: 총 세포 수, 생존율을 기록하고, 유세포분석을 위해 5 x 105 개의 확장된 PBNK 세포를 저장하면 이러한 값이 NK 세포 확장 속도를 결정하는 데 중요하므로 유세포분석을 합니다. - 원심분리 후, 각 웰로부터 레트로바이러스 상청액을 부분적으로 흡인한다.
참고: 완전히 흡인하지 마십시오, 즉 우물당 약 100μL의 레트로바이러스 상청액을 남겨두면 형질도입 효율이 감소할 수 있습니다. - 단계 6.8에서 희석된 확장된 PBNK 세포 2 mL를 각 웰에 분취한다.
- 플레이트를 600 x g에서 32°C에서 10분 동안 원심분리합니다. 플레이트를 5% CO2와 함께 37°C에서 48-72시간 동안 인큐베이션한다.
알림: 플레이트를 파라필름으로 필름하지 마십시오.
7. 그림 2와 같이 CAR-NK 세포 수집(6일 또는 7일차).
- 24웰 플레이트에서 세포를 부드럽게 수집하고 세포를 50mL 원심분리 튜브로 옮깁니다.
알림: 거품을 생성하면 세포 생존력이 감소하므로 거품을 생성하지 마십시오. - 튜브를 400 x g 에서 5분 동안 원심분리합니다.
- 1mL의 R-10 배지로 펠릿을 재현탁하고 Trypan Blue를 사용하여 세포를 계수합니다.
참고: 형질도입 효율을 결정하기 위해 유세포분석을 위해 5 x 105 세포를 저장합니다. - 재현탁된 세포를 IL-2(200U/mL) 및 IL-15(5ng/mL)가 보충된 R-10 배지 30mL가 들어 있는 특수 6웰 플레이트로 옮깁니다.
- 특수 6-웰 플레이트를 37°C에서 5%CO2로 배양한다.
- IL-2 (200 U / mL) 및 IL-15 (5 ng / mL)가 보충 된 R-10 배지를 교체하여 3-4 일마다 NK 세포를 유지하십시오.
참고: 각 변경 시 추가 확장을 위해 웰당 20 x 106 셀 미만을 유지하십시오. 최상의 생존력을 위해, 각 웰의 총 세포 수가 100 x 106 세포를 초과하지 않도록하십시오. - 총 세포 수, 생존율을 기록하고, 3-4일마다 유세포 분석을 수행하여 NK 세포 확장률을 계산하였다.
- 적절한 시험관 내 또는 생체내 분석을 위해 세포를 사용한다.
참고: 생체외 확장 PBNK 및 CAR-NK 세포는 약 4주 동안 37°C 인큐베이터에서 배양될 수 있습니다. - NK 세포수 및 순도를 유세포 분석기로 7일째, 11일째, 14일째, 18일째 및 21일째에 조사하였다.
결과
221-mIL-21 영양세포 방법론을 사용한 조직 침윤 NK 세포 분리 및 PBNK 세포 확장의 개략적인 워크플로우가 그림 1 및 그림 2에 나와 있습니다. 확장된 PBNK 세포를 유세포 분석을 위해 3일 또는 4일마다 채취하여 세포를 항인간 CD56 및 항인간 CD3로 염색하여 NK 세포 순도를 확인하였다. 팽창 시스템의 재현성을 보여주기 위해 두 개의 다른 공여체를 사용하여 실험을 반복했습니다(그림 3). 221-mIL-21에 의해 확장된 PBNK 세포는 거의 5 × 104 배 확장되는 것으로 나타났다 (도 3A). 또한, NK 세포 순도는 21일 확장 기간 동안 약 85%로 높게 유지되었습니다 (그림 3B). 221-mIL-21 영양세포 확장 시스템을 사용하여 NK 세포 순도는 공여자와 무관하게 85%-95% 사이에서 일관되게 범위를 유지했습니다(데이터는 표시되지 않음). 221-mIL-21 확장 시스템의 견고성을 입증하기 위해, PBMCs는 확장 전에 항-CD56 및 항-CD3에 대해 염색되었고, 이는 NK 세포에 대해 7.09%의 세포 순도 및 높은 비율의 T 세포를 나타냈다(도 4A). PBMCs는 NK 세포를 확장시키기 위해 221-mIL-21과 공동 배양되었다; NK 순도를 4일째에 CAR-NK 형질도입 전에 확인하였다(도 4A). CAR-NK 세포를 채취하여 항-CD56, 항-CD3 및 항-hIgG(H+L) F(ab')2에 대해 염색한 결과, 높은 NK 세포 집단(7일째 86.9%)과 약 70%의 높은 CAR 형질도입 효율을 보였다(그림 4). 더 높은 형질 도입 효율 (최대 95 %)도 레트로 바이러스 패키징 시스템을 사용하여 관찰되었습니다. 전체적으로 이러한 데이터는 221-mIL-21 영양세포가 NK 세포를 성공적으로 확장하고 생체 외 NK 세포 순도를 보존할 수 있음을 보여줍니다.
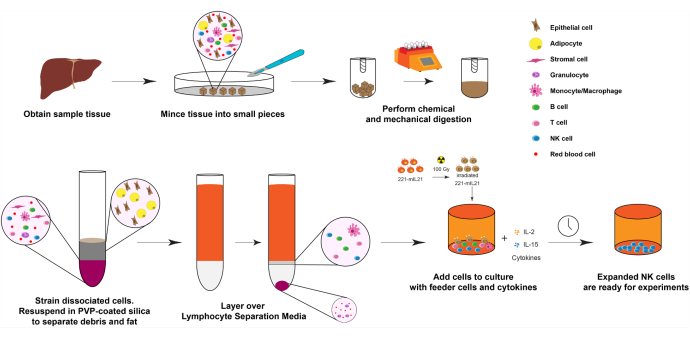
그림 1: 고형 인간 장기 샘플의 NK 세포 확장 다이어그램. 간단히 말해서, 얻어진 인간 간 샘플은 기계적 소화를 위해 작은 입방체로 다진다. 해리 된 세포는 PVP 코팅 실리카 및 림프구 분리 배지를 사용하여 분리됩니다. 또한, NK 세포는 도 2에 기재된 확장 프로토콜을 이용하여 확장된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
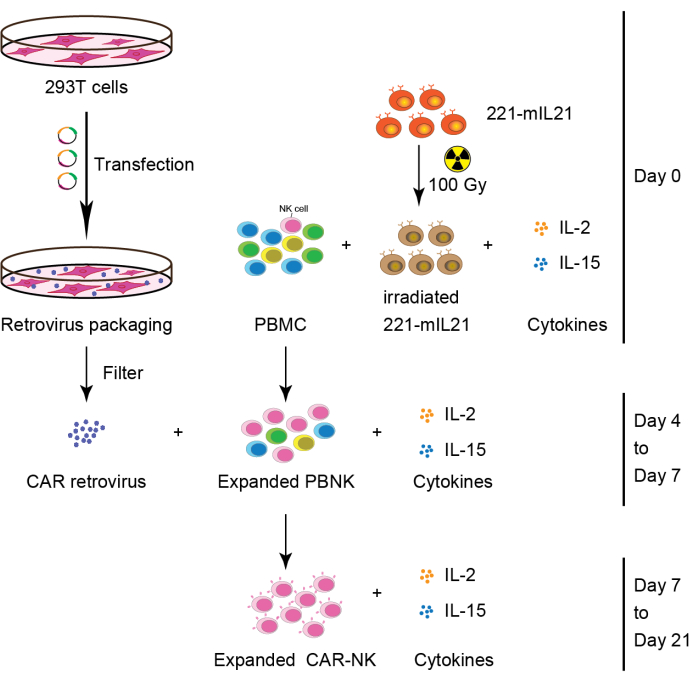
그림 2: PBMC에서 CAR-NK 세포 생성의 개략적인 워크플로우. 간략하게, 221-mIL21 영양세포 세포를 0일째에 IL-2 및 IL-15가 보충된 PBMC와 함께 배양하기 전에 100 Gy에서 조사하였다. 병행하여, 293T 세포를 레트로바이러스 패키징 시스템으로 형질감염시켜 CAR 레트로바이러스를 생산한 다음, IL-2 및 IL-15의 존재하에 확장된 PBNK 세포 내로 형질도입하였다. 1차 CAR-NK 세포는 7일째에 수확하고 21일 동안 계속 확장하였다. 이 수치는 Yang et al.16에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
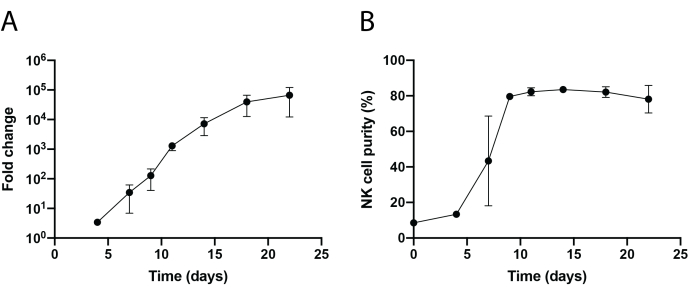
그림 3: PBNK 셀의 동적 시간 경과 확장. (A) 22일 코스 동안 PBNK의 배 확장. 세포를 유동 세포분석을 위해 지시된 날에 항-CD56 및 항-CD3으로 염색하였다. NK 세포의 총 수는 전체 세포 수에 NK 세포 순도를 곱하여 결정하였다. 팽창률은 다음과 같이 생성되었다: (NK 세포의 수)Tn/(NK 세포의 수)T0, 여기서 NK 세포의 수 = (NK 세포 순도의 백분율) × (총 세포 수),T0는 시간 0일에서의 NK 세포의 수이고, Tn은 시간 n일의 NK 세포의 수이다. (B) 22일 시간 과정 동안의 NK 세포 순도. NK 세포 확장은 서로 다른 2명의 공여자와 함께 2회 반복하였다. 오차 막대는 SEM± 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
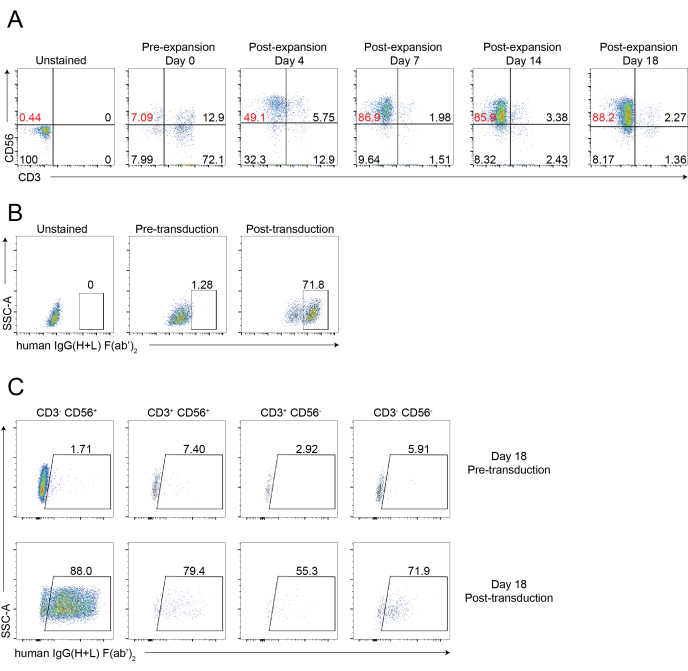
그림 4: CAR-NK 세포의 대표적인 유세포 분석 (A) 18일 과정 동안 CAR-NK 세포의 NK 세포 순도의 동적 시간 경과를 보여주는 대표적인 점도표. 유동 세포분석 분석은 지시된 시점에서 세포를 항-CD56 및 항-CD3으로 염색함으로써 평가하였다. 0일차는 PBNK의 사전 확장을 나타냅니다. 4일째는 PBNK의 확장 후 및 CAR-NK 세포의 사전 형질도입을 나타낸다. 7일째는 CAR-NK 세포의 형질도입 후를 나타낸다. (B) 레트로바이러스 패키징 시스템을 이용한 CAR-NK 세포의 형질도입 효율을 보여주는 대표적인 점도표. 세포를 유세포분석을 위해 항-CD56, 항-CD3 및 항-hIgG(H+L) F(ab')2로 염색하였다. (C) 18일째에 CD56+CD3-, CD56-CD3+, CD56+CD3+ 및 CD56-CD3-를 포함한 다양한 하위 집합에서 CAR 발현을 보여주는 대표적인 점도표. 세포를 유세포분석을 위해 항-CD56, 항-CD3 및 항-hIgG(H+L) F(ab')2 (CAR 발현을 나타냄)로 염색하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
현재 임상시험에 있는 대부분의 CAR-NK 제품은 비호지킨 림프종 환자18로부터 분리된 세포주인 NK-92, NK-92MI, IL-2 비의존적 NK-92 세포주 19, 대형 과립 림프구 환자20으로부터 분리된 NKL과 같은 NK 세포주17을 활용하는데, 이는 이들 세포주가 '기성품' 제품에 대해 쉽게 증식하기 때문입니다. 그러나, 이들 세포주, 예를 들어, NK-92 세포는 주입 전에 방사선 조사를 필요로 하기 때문에, 한계적인 임상 효율성 및 생체내 확장을 가지며, 따라서 생체내21에서의 이들의 증식 및 세포독성을 제한한다. 이러한 이유로 말초 혈액, CB, 골수 (BM), 인간 배아 줄기 세포 (HSC), 유도 만능 줄기 세포 (iPSC) 및 종양 조직21,22,23을 포함한 여러 출처에서 1 차 NK 세포를 확장하기위한 다양한 전략이 현재 연구되고 있습니다. 예를 들어, NK 세포는 IL-15, IL-18 및 IL-21을 포함하는 인터루킨을 사용하여 생체 외에서 확장 될 수 있습니다. K562 세포 또는 엡스타인-바 바이러스와 같은 림프 모세포양 세포주 721.221 세포와 같은 림프 모세포는 NK 세포 확장16에도 사용됩니다. 그러나 앞서 언급 한 전략은 종종 CAR-NK 면역 요법의 입양 전달을위한 NK 세포 수가 충분하지 않습니다22,24. 이 문제를 해결하는 데 도움이 되도록 이 연구는 유전자 변형 EBV 형질전환 세포주인 221-mIL-21 영양세포를 사용한 생체 외 NK 세포 확장을 위한 프로토콜을 보여줍니다.
이 프로토콜에 나타난 221-mIL-21 영양세포를 이용한 확장 방법론은 OX40 리간드 22,24,25를 발현하는 막 IL-21, K562 및 K652-mIL21을 발현하는 HL-60 및 OCl-AML3을 포함한 다른 백혈병 세포주보다 최소 10 내지 100배 높은 확장 속도로 NK 세포를 확장하도록 최적화되어 있다. CAR 발현은 또한 생체외 약 2주 동안 평가된다. 더 중요한 것은 221-mIL-21 영양세포 확장 전략이 초기 NK 농축 단계 없이 PBMC, CB 및 간과 같은 고형 기관을 포함한 다양한 출처에서 NK 세포를 확장하는 데 적용될 수 있다는 것입니다. 221-mIL-21 피더 시스템은 전술한 피더 세포주만큼 공여자 의존적이지는 않지만, 공여체와 완전히 독립적이지는 않다. 평균적으로 221-mIL-21 확장 시스템은 높은 NK 세포 수로 NK 세포 순도의 90%를 달성할 수 있으며, 확장 후 14일째에 T 세포 오염의 약 <5%가 발생합니다. 따라서, T 세포 오염 가능성을 제거하기 위해서는 생체 외 확장 전에 수득한 시료로부터 NK 세포를 분리하거나 CD3+ 선택 시스템을 사용하여 생체 외 확장 후 T 세포를 제거해야 한다.
NK 세포 확장 시스템을 사용할 때의 비판 중 하나는 확장 후 또는 수혈 전에 영양세포가 완전히 박멸되지 않았을 수 있으며, 이는 상당한 규제 문제를 가질 수 있다는 것입니다. 따라서 수혈 전에 영양 세포를 완전히 박멸하는 것이 중요합니다. 그러나 K562-mIL21-4-1BBL 영양세포를 생체 외 CBNK 세포 확장24,25에 사용한 최근의 CAR-NK 임상 시험에서는 합병증에 대한 우려가 없었습니다. 또한, 우리의 예비 데이터는 확장이 진행됨에 따라 조사 된 221-mIL-21 개체군의 점진적인 감소를 보여주었습니다 (데이터는 표시되지 않음). 그러나이 확장 방법이 임상 환경에서 구현되기 위해서는 더 광범위한 연구가 필요합니다. 종합적으로, 221-mIL-21 확장 시스템은 일차 CAR-NK 세포 확장 문제를 해결하는 데 도움이 되므로 가까운 장래에 CAR-NK 세포 기반 면역 요법의 광범위한 사용에 크게 기여할 것입니다.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
우리는 Liu 연구소 구성원 (Hsiang-chi Tseng 박사, Xuning Wang 박사 및 Chih-Hsiung Chen 박사)에게 원고에 대한 의견에 감사드립니다. SFG 벡터에 대한 Gianpietro Dotti 박사와 721.221 세포에 대한 Eric Long 박사에게 감사드립니다. 이 작업은 HL125018 (D. Liu), AI124769 (D. Liu), AI129594 (D. Liu), AI130197 (D. Liu) 및 Rutgers-Health Advance Funding (NIH REACH 프로그램), U01HL150852 (R. Panettieri, S. Libutti 및 R. Pasqualini), S10OD025182 (D. Liu) 및 D. Liu Laboratory를위한 Rutgers University-New Jersey Medical School Startup Funding에서 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
참고문헌
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유