Method Article
TUEUR NATUREL (NK) ET PROCÉDÉ D’EXPANSION CELLULAIRE CAR-NK UTILISANT UNE LIGNÉE CELLULAIRE B MODIFIÉE PAR UNE LIGNÉE CELLULAIRE B LIÉE À LA MEMBRANE
Dans cet article
Résumé
Ici, nous présentons une méthode pour développer le tueur naturel du sang périphérique (PBNK), les cellules NK des tissus hépatiques et les cellules du récepteur antigénique chimérique (CAR)-NK dérivées de cellules mononucléaires du sang périphérique (PBMC) ou du sang de cordon (CB). Ce protocole démontre l’expansion des cellules NK et CAR-NK à l’aide de cellules nourricières 221-mIL-21 en plus de la pureté optimisée des cellules NK expansées.
Résumé
La thérapie cellulaire immunitaire modifiée par le récepteur antigénique chimérique (CAR) est devenue un traitement émergent pour les cancers et les maladies infectieuses. L’immunothérapie à base de NK, en particulier les cellules CAR-NK, est l’un des développements « prêts à l’emploi » les plus prometteurs sans toxicité grave mettant la vie en danger. Cependant, le goulot d’étranglement pour le développement d’une thérapie CAR-NK réussie est d’obtenir un nombre suffisant de cellules CAR-NK non exhaustives, à longue durée de vie et « prêtes à l’emploi » d’un tiers. Ici, nous avons développé une nouvelle méthode d’expansion CAR-NK en utilisant une lignée de cellules B transformées par le virus d’Epstein-Barr (EBV) exprimant une forme membranaire génétiquement modifiée de l’interleukine-21 (IL-21). Dans ce protocole, des procédures étape par étape sont fournies pour développer les cellules NK et CAR-NK du sang de cordon et du sang périphérique, ainsi que des tissus d’organes solides. Ces travaux amélioreront considérablement le développement clinique de l’immunothérapie CAR-NK.
Introduction
Les cellules tueuses naturelles (NK) sont un sous-ensemble important de lymphocytes qui expriment CD56 et n’expriment pas le marqueur des lymphocytes T, CD3 1,2. Les cellules NK conventionnelles sont classées comme cellules immunitaires innées responsables de l’immunosurveillance des cellules infectées par le virus et des cellules cancéreuses. Contrairement aux lymphocytes T, les lymphocytes NK reconnaissent les cellules infectées ou malignes à l’aide de CD16 ou d’autres récepteurs activateurs et ne nécessitent pas la formation d’un complexe entre les peptides antigéniques et les molécules du complexe majeur d’histocompatibilité (CMH) de classeI 3,4. Des études cliniques récentes utilisant des cellules CAR-NK à récepteur antigénique chimérique (CAR) pour traiter les cancers CD19 positifs en rechute ou réfractaires (lymphome non hodgkinien ou leucémie lymphoïde chronique [LLC]) ont montré les avantages exceptionnels en matière de sécurité des cellules CAR-NK5. Par exemple, la perfusion de cellules CAR-NK est associée à une maladie du greffon contre l’hôte (GVH), à une neurotoxicité, à une cardiotoxicité et à un syndrome de libération de cytokines (SRC)6,7,8,9,10. Cependant, les méthodes conventionnelles pour développer les cellules NK humaines ont montré des phénotypes exhaustifs avec une forte destruction fratricide et une pénurie de télomères, ce qui présente un défi majeur pour obtenir un nombre adéquat de cellules NK fonctionnelles pour l’immunothérapie adoptive11.
Pour surmonter ces défis, une méthode a été développée pour développer les cellules NK primaires directement à partir de cellules mononucléées du sang périphérique non fractionné (PBMC) ou de sang de cordon (CB) en utilisant une lignée cellulaire irradiée et génétiquement modifiée 721.221 (ci-après, 221), une lignée cellulaire humaine de lymphoblastoïdes B avec une faible expression de molécules de classe I du CMH3. Des études antérieures ont montré l’importance de l’IL-21 dans l’expansion des cellules NK; par conséquent, une IL-21 membranaire génétiquement modifiée exprimant une version de la lignée cellulaire 721.221 (à partir de maintenant, 221-mIL-21) a été développée 11,12,13,14,15. Les résultats ont montré que les cellules NK primaires expansées par 221 mIL-21 ont été étendues à une moyenne de 40 000 fois > avec une pureté élevée persistante des cellules NK pendant environ 2-3 semaines. Des renseignements supplémentaires concernant l’application de ce protocole se trouvent dans Yang et coll.16.
Ce protocole vise à démontrer la procédure étape par étape de la nouvelle expansion des cellules PBNK, CBNK, NK dérivées de tissus et CAR-NK ex vivo.
Protocole
Les travaux liés aux tissus humains et au sang dans ce protocole suivent les directives du Rutgers University Institutional Review Board (IRB)
1. Expansion des cellules NK à partir des tissus hépatiques (jour 0), comme le montre la figure 1.
REMARQUE : Le nombre initial de cellules et la viabilité sont fortement corrélés avec le temps écoulé depuis le prélèvement de l’organe et la quantité initiale d’échantillon de tissu. Cependant, si les tissus sont placés dans 30 ml de solution saline équilibrée de Hank (HBSS) et conservés sur de la glace ou au réfrigérateur à 4 °C pendant la nuit, les cellules NK peuvent encore être dilatées avec une pureté et une viabilité élevées jusqu’à 24 heures plus tard.
- Identifier les zones tissulaires viables pour obtenir des lymphocytes à partir de tissus et de coupes à l’aide d’un équipement chirurgical stérile.
- Placer les mouchoirs dans 30 mL de HBSS (sans calcium ou magnésium) et garder sur la glace jusqu’à ce qu’ils soient prêts à se préparer à l’isolement.
- Hacher le mouchoir en cubes de <0,5 cm à l’aide de lames de rasoir ou de ciseaux et de pinces stériles à l’intérieur d’une armoire de biosécurité.
- Préparer une solution de collagénase IV 1x (1 mg/mL) en diluant un stock 10x dans HBSS (10x Collagénase IV : 10 mg/mL ou ~200 U/mL).
- Placez les morceaux de tissu haché dans les tubes dissociateurs tissulaires. Remplissez les tubes avec pas plus de 4 g de tissu et immergez les morceaux de tissu dans ~10 mL de 1x collagénase IV.
REMARQUE: L’utilisation de DNase I n’est pas recommandée car elle peut légèrement diminuer la viabilité et le rendement de NK. Veuillez consulter le tableau des matériaux pour connaître les tubes dissociateurs tissulaires spécifiques utilisés. - Placer les tubes dissociateurs tissulaires dans un dissociateur tissulaire et mélanger à 37 °C pour hacher soigneusement le tissu.
REMARQUE: Pour le tissu hépatique, cela peut prendre plus de 30 minutes. Pour les tissus plus friables, environ 15 minutes peuvent suffire. Veuillez consulter le tableau des matériaux pour connaître les tubes dissociateurs tissulaires spécifiques et le dissociateur tissulaire utilisé. - Retirer les tubes dissociateurs tissulaires et triturer à travers une crépine à cellules en nylon de 40 μm à l’aide de l’extrémité arrière d’une seringue de 5 mL. Ramassez l’éluant et jetez les gros fragments non digérés.
- Faire tourner l’éluant à 400 x g pendant 5 min à température ambiante. Aspirer le surnageant.
- Remettez les granulés cellulaires en suspension dans de la silice enrobée de polyvinylpyrrolidone (PVP) à 30 % pour éliminer les cellules graisseuses qui contamineraient autrement la fraction lymphocytaire finale.
- Pour préparer 1x silice enrobée de PVP, utilisez une dilution 9:1 de silice enrobée de PVP dans 10x PBS.
REMARQUE : Reportez-vous au tableau des matériaux pour connaître la silice enrobée de PVP utilisée. - Pour préparer 30% de silice enrobée de PVP, diluez 1x silice enduite de PVP avec PBS / HBSS.
- Pour préparer 1x silice enrobée de PVP, utilisez une dilution 9:1 de silice enrobée de PVP dans 10x PBS.
- Faire tourner la pastille de la cellule à 400 x g pendant 5 min à température ambiante. Aspirer le surnageant.
- Remettez en suspension la pastille de la cellule dans 9 mL de milieu R-10.
REMARQUE : Consulter le tableau des matériaux pour connaître la composition des milieux R-10. - Déposer soigneusement la suspension cellulaire sur 4 mL de milieu de séparation Ficoll ou lymphocytaire pour séparer les lymphocytes des globules rouges et des cellules polymorphonucléaires.
- Séparer les couches en centrifugeant à 400 x g pendant 23 min à température ambiante avec l’accélération et freiner ou au réglage le plus bas. Décanter soigneusement la couche moyenne supérieure et récolter l’interphase contenant les lymphocytes infiltrant les tissus.
- Rincer les cellules avec 10 mL de milieu et procéder au comptage cellulaire, à la cytométrie en flux, à l’aliquote et à la congélation des cellules, ou au protocole d’expansion primaire de NK.
2. Expansion primaire des cellules NK à partir des PBMC (ou CB ou tissus organiques) (Jour 0), comme le montre la figure 2.
- Décongeler la PBMC congelée et les cellules d’alimentation irradiées congelées dans un bain-marie à 37 °C.
- Laver séparément les cellules PBMC et 100 cellules gamma-irradiées (irradiées par Gy) par centrifugation à 400 x g pendant 5 min avec 10 ml de milieu R-10.
- Économisez 1 x 106 cellules de PBMC pour la cytométrie en flux.
REMARQUE: La pureté initiale des cellules NK est un facteur important dans le calcul du taux d’expansion des cellules NK. - Remettez les cellules en suspension dans 1 mL de milieu R-10. Comptez les cellules à l’aide de Trypan Blue.
- Mélanger 5 x 10 6 cellules de PBMC avec 10 x 10 6 cellules de 100 cellules 221-mIL-21 irradiées par Gy dans une plaque spéciale à6 puits (voir le tableau des matériaux).
- Ajouter 30 mL de milieu R-10 additionnés d’IL-2 humaine (200 U/mL) et d’IL-15 humaine (5 ng/mL) (voir le tableau des matières).
- Incuber la plaque spéciale à 6 puits à 37 °C avec 5% de CO2.
- Remplacez le milieu par un milieu R-10 complété par de l’IL-2 humaine (200 U/mL) et de l’IL-15 humaine (5 ng/mL) pour maintenir les cellules NK tous les 3-4 jours.
REMARQUE: Maintenir moins de 20 x 106 cellules par puits pour une expansion ultérieure à chaque changement de milieu. Pour une meilleure viabilité, assurez-vous que le nombre total de cellules dans chaque puits ne dépasse pas 100 x 106 cellules. - Enregistrez le nombre total de cellules, la viabilité et effectuez une cytométrie en flux tous les 3-4 jours pour calculer le taux d’expansion des cellules NK.
3. Fixation de cellules 293T (jour 2), comme le montre la figure 2.
- Fractionner 1,8 x 106 293T dans 11 mL de milieu D-10 par plaque traitée de 100 mm.
REMARQUE : Consulter le tableau des matériaux pour connaître la composition des supports D-10. - Incuber les cellules 293T à 37 °C avec 5% de CO2.
4. Transfection rétrovirale (Jour 3)
- Dans un tube de 1,7 mL, mélanger 470 μL de milieu sérique réduit avec 30 μL de réactif de transfection.
REMARQUE : Consulter le tableau des matériaux pour connaître les milieux sériques réduits et le réactif de transfection utilisés. - Dans un tube séparé de 1,7 mL, ajouter 2,5 μg de plasmide pRDF, 3,75 μg de plasmide Pegpam3 et 2,5 μg de construction CAR dans le vecteur SFG dans le milieu sérique réduit de sorte que le volume final soit de 500 μL.
- Mélangez les solutions aux étapes 4.1 et 4.2 par goutte.
- Incuber le tube à température ambiante pendant 15 min.
- Ajouter 1 mL du mélange de l’étape 4.4 à la plaque cellulaire 293T le jour 1 de manière goutte à goutte.
- Incuber la (les) plaque(s) à 37 °C avec 5% de CO2 pendant 48-72 h.
5. Revêtement de plaque de rétronectine (Jour 3)
- Diluer la protéine de rétronectine avec de la solution saline tamponnée au phosphate (PBS) jusqu’à une concentration finale de 50 à 100 μg/mL.
- Ajouter 500 μL de rétronectine diluée dans chaque puits d’une plaque non traitée de 24 puits (5 puits par construction CAR). Sceller la plaque à l’aide d’un parafilm et incuber la plaque à 4 °C pendant une nuit.
6. Transduction (Jour 4)
- Centrifuger la plaque de rétronectine à 2103 x g pendant 30 min à 4 °C. Jetez le surnageant.
- Bloquer chaque puits de la plaque de 24 puits avec 1 mL de milieu R-10.
- Incuber la plaque à 37 °C avec 5% de CO2 pendant 1 h.
- Préchauffer la centrifugeuse à 32 °C pendant que la plaque de rétronectine est bloquée.
- Recueillir le surnageant rétroviral en filtrant les cellules 293T transfectées à l’aide d’un filtre de 0,45 μm.
- Aliquote 2 mL du surnageant rétroviral filtré dans chaque puits.
- Centrifuger la plaque de 24 puits à 2103 x g pendant 2 h à 32 °C.
- Pendant la centrifugation sur plaque, collectez les cellules PBNK expansées du jour 0 et comptez les cellules à l’aide de Trypan Blue.
REMARQUE: Continuez à étendre les cellules PBNK en ajoutant des milieux R-10 complétés par IL-2 (200 U/mL) et IL-15 (5 ng/mL). - Diluer les cellules PBNK expansées avec un milieu R-10 supplémenté en IL-2 (200 U/mL) et IL-15 (5 ng/mL) à 2,5 x 10 5-5 x 10 5 cellules/mL (0,5 x 106-1 x 10 6 cellules par puits).
REMARQUE: Enregistrez le nombre total de cellules, la viabilité et enregistrez 5 x 105 cellules PBNK expansées pour la cytométrie en flux, car ces valeurs sont importantes pour déterminer le taux d’expansion des cellules NK. - Après centrifugation, aspirer partiellement le surnageant rétroviral de chaque puits.
REMARQUE : Ne pas aspirer complètement, c’est-à-dire laisser environ 100 μL de surnageant rétroviral par puits, car cela diminuerait l’efficacité de la transduction. - Aliquote 2 mL des cellules PBNK expansées diluées de l’étape 6.8 à chaque puits.
- Centrifuger la plaque à 600 x g pendant 10 min à 32 °C. Incuber la plaque à 37 °C avec 5% de CO2 pendant 48-72 h.
NOTE: Ne parafilmez pas la plaque.
7. Collecte de cellules CAR-NK (Jour 6 ou 7), comme le montre la figure 2.
- Recueillir doucement les cellules de la plaque de 24 puits et transférer les cellules dans un tube centrifuge de 50 ml
REMARQUE: Essayez de ne pas générer de bulles, car cela entraînerait une diminution de la viabilité cellulaire. - Centrifuger le tube à 400 x g pendant 5 min.
- Remettez la pastille en suspension avec 1 mL de milieu R-10 et comptez les cellules à l’aide de Trypan Blue.
REMARQUE: Enregistrez 5 x 105 cellules pour la cytométrie en flux afin de déterminer l’efficacité de la transduction. - Transférer les cellules remises en suspension dans une plaque spéciale à 6 puits contenant 30 mL de milieu R-10 complété par de l’IL-2 (200 U/mL) et de l’IL-15 (5 ng/mL).
- Incuber la plaque spéciale à 6 puits à 37 °C avec 5% de CO2.
- Remplacer les milieux R-10 complétés par de l’IL-2 (200 U/mL) et de l’IL-15 (5 ng/mL) pour maintenir les cellules NK tous les 3 à 4 jours.
REMARQUE : Maintenir moins de 20 x 106 cellules par puits pour une expansion ultérieure à chaque changement. Pour une meilleure viabilité, assurez-vous que le nombre total de cellules dans chaque puits ne dépasse pas 100 x 106 cellules. - Enregistrez le nombre total de cellules, la viabilité et effectuez une cytométrie en flux tous les 3-4 jours pour calculer le taux d’expansion des cellules NK.
- Utiliser les cellules pour des essais in vitro ou in vivo appropriés.
REMARQUE: Les cellules PBNK expansées ex vivo et CAR-NK peuvent être cultivées dans un incubateur à 37 ° C pendant environ 4 semaines. - Examinez le nombre et la pureté des cellules NK au jour 7, au jour 11, au jour 14, au jour 18 et au jour 21 par cytométrie en flux.
Résultats
Un flux de travail schématique de l’isolement des cellules NK infiltrant les tissus et de l’expansion des cellules PBNK à l’aide de la méthodologie des cellules nourricières 221-mIL-21 est illustré à la figure 1 et à la figure 2. Des cellules PBNK expansées ont été collectées tous les 3 ou 4 jours pour la cytométrie en flux afin de déterminer la pureté des cellules NK en colorant les cellules avec du CD56 anti-humain et du CD3 anti-humain. L’expérience a été répétée en utilisant deux donneurs différents pour montrer la reproductibilité du système d’expansion (Figure 3). Il a été démontré que les cellules PBNK expansées de 221 mIL-21 se développaient de près de 5 × 104 fois (Figure 3A). De plus, la pureté des cellules NK a été fortement maintenue, environ 85% tout au long de l’expansion de 21 jours (Figure 3B). En utilisant le système d’expansion des cellules nourricières 221-mIL-21, la pureté des cellules NK variait constamment entre 85% et 95%, indépendamment des donneurs (données non présentées). Pour démontrer la robustesse du système d’expansion 221-mIL-21, les PBMC ont été colorés pour l’anti-CD56 et l’anti-CD3 avant l’expansion, ce qui a montré une pureté cellulaire de 7,09% pour les cellules NK et un pourcentage élevé de cellules T (Figure 4A). Les PBMC ont été cocultivés avec du 221-mIL-21 pour développer les cellules NK ; la pureté du NK a été vérifiée avant la transduction CAR-NK le jour 4 (figure 4A). Les cellules CAR-NK ont été collectées et colorées pour les anticorps anti-CD56, anti-CD3 et anti-HIgG(H+L) F(ab')2, qui ont montré une population élevée de cellules NK (86,9 % au jour 7) et une efficacité de transduction CAR élevée d’environ 70% (Figure 4). Des rendements de transduction plus élevés (jusqu’à 95%) ont également été observés en utilisant le système d’emballage du rétrovirus. Dans l’ensemble, ces données montrent que les cellules nourricières 221-mIL-21 pourraient développer avec succès les cellules NK et préserver la pureté des cellules NK ex vivo.
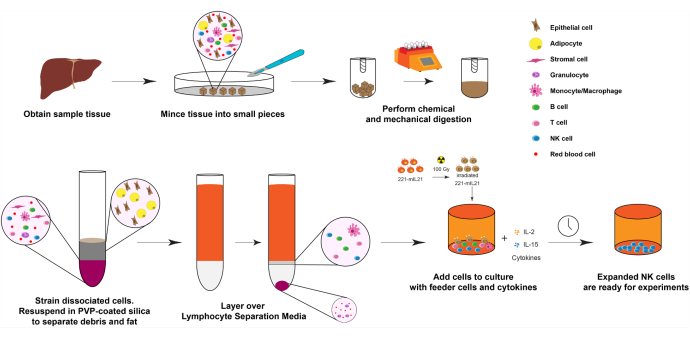
Figure 1 : Diagramme de l’expansion des cellules NK à partir d’échantillons d’organes humains solides. En bref, les échantillons de foie humain obtenus sont hachés en petits cubes pour la digestion mécanique. Les cellules dissociées sont ensuite isolées à l’aide de silice recouverte de PVP et de milieux de séparation lymphocytaires. De plus, les cellules NK sont développées à l’aide du protocole d’expansion décrit à la figure 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
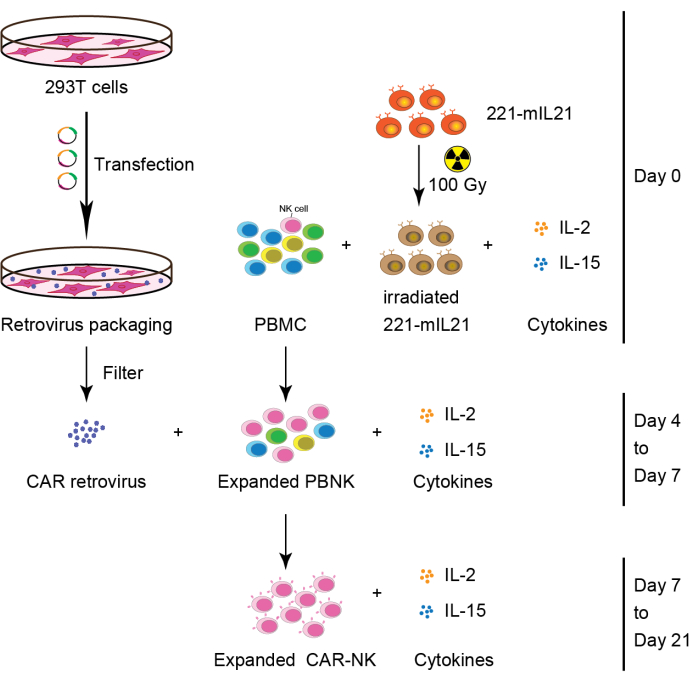
Figure 2 : Flux de travail schématique de la génération de cellules CAR-NK à partir de PBMC. Brièvement, les cellules nourricières de 221 mIL21 ont été irradiées à 100 Gy avant la coculture avec des PBMC supplémentés en IL-2 et IL-15 le jour 0. En parallèle, les cellules 293T ont été transfectées avec le système d’emballage du rétrovirus pour produire le rétrovirus CAR qui a ensuite été transduit dans les cellules PBNK expansées en présence d’IL-2 et d’IL-15. Les cellules CAR-NK primaires ont été récoltées le jour 7 et leur expansion s’est poursuivie pendant 21 jours. Ce chiffre a été modifié à partir de Yang et al.16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
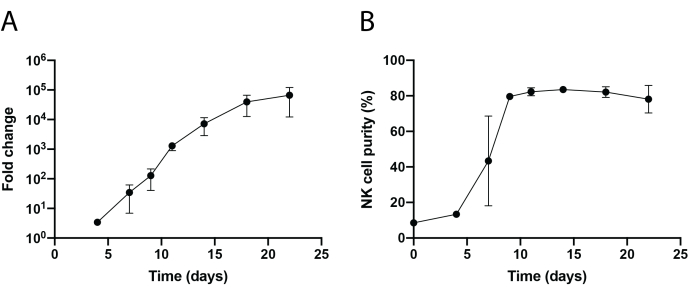
Figure 3 : Expansion dynamique accélérée des cellules PBNK. (A) Expansion du pli du PBNK au cours d’un cours de 22 jours. Les cellules ont été colorées avec anti-CD56 et anti-CD3 aux jours indiqués pour la cytométrie en flux. Le nombre total de cellules NK a été déterminé en multipliant la pureté des cellules NK par le nombre total de cellules. Le taux d’expansion a été généré comme suit : (Nombre de cellules NK)Tn/(Nombre de cellules NK)T0, où Nombre de cellules NK = (pourcentage de pureté des cellules NK) × (nombre total de cellules), T 0 est le nombre de cellules NK au temps jour0, et Tn est le nombre de cellules NK au temps jour n. (B) Pureté des cellules NK au cours d’une période de 22 jours. L’expansion des cellules NK a été répétée deux fois avec deux donneurs différents. Les barres d’erreur représentent ± SEM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
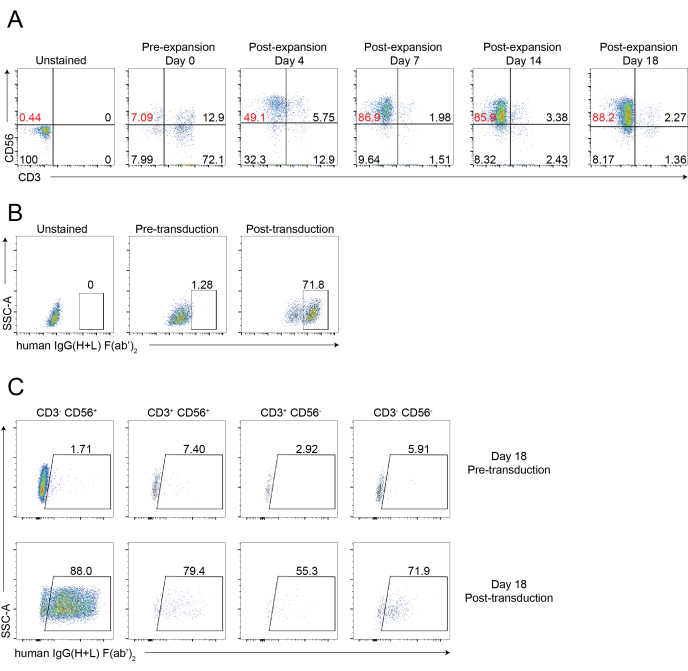
Figure 4 : Analyse cytométrique en flux représentatif des cellules CAR-NK. (A) Graphiques à points représentatifs montrant le laps de temps dynamique de la pureté des cellules NK des cellules CAR-NK au cours d’un cours de 18 jours. L’analyse par cytométrie de flux a été évaluée en colorant les cellules avec des anti-CD56 et anti-CD3 aux points temporels indiqués. Le jour 0 indique une pré-expansion du PBNK. Le jour 4 indique une post-expansion de PBNK et une pré-transduction des cellules CAR-NK. Le jour 7 indique la post-transduction des cellules CAR-NK. (B) Graphiques à points représentatifs montrant l’efficacité de transduction des cellules CAR-NK à l’aide du système d’emballage des rétrovirus. Les cellules ont été colorées avec des anticorps anti-CD56, anti-CD3 et anti-HIgG(H+L) F(ab')2 pour la cytométrie en flux. (C) Des diagrammes à points représentatifs montrant l’expression CAR dans divers sous-ensembles, y compris CD56+CD3-, CD56-CD3+, CD56+CD3+ et CD56-CD3- au jour 18. Les cellules ont été colorées avec anti-CD56, anti-CD3 et anti-hIgG (H + L) F(ab')2 (indiquant l’expression de CAR) pour la cytométrie en flux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La plupart des produits CAR-NK actuels dans les essais cliniques utilisent des lignées cellulaires NK 17, telles que NK-92, une lignée cellulaire isolée d’un patient atteint de lymphome non hodgkinien18, NK-92MI, lignée cellulaire NK-92 indépendante IL-219, et NKL, isolée d’un grand patient lymphocytairegranulaire 20, car ces lignées cellulaires sont facilement prolifératives pour les produits « prêts à l’emploi ». Cependant, ces lignées cellulaires, par exemple les cellules NK-92, ont une efficacité clinique marginale et une expansion in vivo , car elles nécessitent une irradiation avant la perfusion, limitant ainsi leur prolifération et leur cytotoxicité in vivo21. Pour ces raisons, diverses stratégies sont actuellement explorées pour développer les cellules NK primaires à partir de plusieurs sources, y compris le sang périphérique, CB, la moelle osseuse (BM), les cellules souches embryonnaires humaines (CSH), les cellules souches pluripotentes induites (CSPi) et les tissus tumoraux21,22,23. Par exemple, les cellules NK peuvent être développées ex vivo en utilisant des interleukines, notamment IL-15, IL-18 et IL-21. Les lignées cellulaires lymphoblastoïdes telles que les cellules K562 ou les lignées cellulaires lymphoblastoïdes transformées par le virus d’Epstein-Barr telles que les cellules 721.221, sont également utilisées pour l’expansion des cellules NK16. Cependant, les stratégies susmentionnées génèrent souvent un nombre insuffisant de cellules NK pour un transfert adoptif de l’immunothérapie CAR-NK22,24. Pour aider à résoudre le problème, l’étude montre ici un protocole pour une expansion ex vivo des cellules NK en utilisant une lignée cellulaire génétiquement modifiée transformée par EBV, des cellules nourricières 221-mIL-21.
La méthodologie d’expansion utilisant des cellules nourricières 221-mIL-21 présentée dans ce protocole est optimisée pour étendre les cellules NK avec un taux d’expansion d’au moins 10 à 100 fois plus élevé que les autres lignées cellulaires leucémiques, y compris HL-60 et OCl-AML3 exprimant la membrane IL-21, K562 et K652-mIL21 exprimant le ligandOX40 22,24,25. L’expression CAR est également évaluée pendant environ 2 semaines ex vivo. Plus important encore, la stratégie d’expansion des cellules nourricières 221-mIL-21 peut être appliquée pour étendre les cellules NK à partir de diverses sources, y compris les PBMC, CB et les organes solides tels que le foie, sans étape initiale d’enrichissement NK. Bien que le système d’alimentation 221-mIL-21 ne soit pas aussi dépendant du donneur que les lignées cellulaires d’alimentation susmentionnées, il n’est pas entièrement indépendant des donneurs. En moyenne, le système d’expansion 221-mIL-21 peut atteindre 90% de la pureté des cellules NK avec un nombre élevé de cellules NK, avec environ <5% de contamination par les cellules T le jour 14 après l’expansion. Par conséquent, pour éliminer les possibilités de contamination par les lymphocytes T, il est nécessaire d’isoler les cellules NK des échantillons obtenus avant l’expansion ex vivo ou d’utiliser un système de sélection CD3+ pour éliminer les lymphocytes T après une expansion ex vivo.
L’une des critiques liées à l’utilisation d’un système d’expansion des cellules NK est que les cellules nourricières peuvent ne pas avoir été complètement éradiquées après l’expansion ou avant une transfusion, ce qui peut poser d’importantes préoccupations réglementaires; Par conséquent, l’éradication complète des cellules nourricières avant une transfusion est cruciale. Cependant, des essais cliniques récents de CAR-NK dans lesquels des cellules nourricières K562-mIL21-4-1BBL ont été utilisées pour l’expansion ex vivo des cellules CBNK24,25 n’ont montré aucune complication préoccupante. De plus, nos données préliminaires ont montré une diminution progressive de la population irradiée de 221 mIL-21 à mesure que l’expansion progressait (données non présentées). Cependant, des études plus approfondies sont nécessaires pour que cette méthode d’expansion soit mise en œuvre en milieu clinique. Collectivement, le système d’expansion 221-mIL-21 aide à résoudre le défi de l’expansion des cellules CAR-NK primaires, et contribuera donc de manière significative à l’utilisation plus large de l’immunothérapie à base de cellules CAR-NK dans un proche avenir.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Nous tenons à remercier les membres du laboratoire Liu (Dr. Hsiang-chi Tseng, Dr. Xuening Wang et Dr. Chih-Hsiung Chen) pour leurs commentaires sur les manuscrits. Nous tenons à remercier le Dr Gianpietro Dotti pour les vecteurs SFG et le Dr Eric Long pour les cellules 721.221. Ce travail a été soutenu en partie par HL125018 (D. Liu), AI124769 (D. Liu), AI129594 (D. Liu), AI130197 (D. Liu) et Rutgers-Health Advance Funding (programme NIH REACH), U01HL150852 (R. Panettieri, S. Libutti et R. Pasqualini), S10OD025182 (D. Liu) et le financement de démarrage de la Rutgers University-New Jersey Medical School pour le laboratoire D. Liu.
matériels
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
Références
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon