Method Article
Natural Killer (NK) und CAR-NK Zellexpansionsmethode unter Verwendung der membrangebundenen IL-21-modifizierten B-Zelllinie
In diesem Artikel
Zusammenfassung
Hier stellen wir eine Methode zur Erweiterung von peripheren Blut-Naturkillern (PBNK), NK-Zellen aus Lebergeweben und chimären Antigenrezeptor (CAR)-NK-Zellen vor, die aus peripheren mononukleären Blutzellen (PBMCs) oder Nabelschnurblut (CB) stammen. Dieses Protokoll demonstriert die Expansion von NK- und CAR-NK-Zellen unter Verwendung von 221-mIL-21-Feederzellen zusätzlich zur optimierten Reinheit expandierter NK-Zellen.
Zusammenfassung
Die chimäre Antigenrezeptor (CAR)-modifizierte Immunzelltherapie ist zu einer aufstrebenden Behandlung von Krebs und Infektionskrankheiten geworden. Die NK-basierte Immuntherapie, insbesondere die CAR-NK-Zelle, ist eine der vielversprechendsten Standardentwicklungen ohne schwere lebensbedrohliche Toxizität. Der Engpass für die Entwicklung einer erfolgreichen CAR-NK-Therapie besteht jedoch darin, eine ausreichende Anzahl nicht erschöpfender, langlebiger, handelsüblicher CAR-NK-Zellen von einem Dritten zu erreichen. Hier entwickelten wir eine neue CAR-NK-Expansionsmethode unter Verwendung einer Epstein-Barr-Virus (EBV) transformierten B-Zelllinie, die eine genetisch veränderte Membranform von Interleukin-21 (IL-21) exprimiert. In diesem Protokoll werden schrittweise Verfahren zur Erweiterung von NK- und CAR-NK-Zellen aus Nabelschnurblut und peripherem Blut sowie aus festem Organgewebe bereitgestellt. Diese Arbeit wird die klinische Entwicklung der CAR-NK-Immuntherapie erheblich verbessern.
Einleitung
Natürliche Killerzellen (NK) sind eine wichtige Untergruppe von Lymphozyten, die CD56 exprimieren und denen die Expression des T-Zell-Markers CD3 1,2 fehlt. Konventionelle NK-Zellen werden als angeborene Immunzellen klassifiziert, die für die Immunüberwachung von viral infizierten Zellen und Krebszellen verantwortlich sind. Im Gegensatz zu T-Zellen erkennen NK-Zellen infizierte oder bösartige Zellen mithilfe von CD16 oder anderen aktivierenden Rezeptoren und benötigen nicht die Bildung eines Komplexes zwischen Antigenpeptiden und Haupthistokompatibilitätskomplex (MHC) Klasse I Molekülen 3,4. Neuere klinische Untersuchungen mit chimären Antigenrezeptor (CAR)-NK-Zellen zur Behandlung rezidivierender oder refraktärer CD19-positiver Krebserkrankungen (Non-Hodgkin-Lymphom oder chronische lymphatische Leukämie [CLL]) zeigten die herausragenden Sicherheitsvorteile von CAR-NK-Zellen5. Zum Beispiel ist die CAR-NK-Zellinfusion mit minimaler oder vernachlässigbarer Graft-versus-Host-Krankheit (GVHD), Neurotoxizität, Kardiotoxizität und Zytokinfreisetzungssyndrom (CRS) assoziiert6,7,8,9,10. Konventionelle Methoden zur Erweiterung humaner NK-Zellen zeigten jedoch erschöpfende Phänotypen mit starker brudermörderischer Tötung und Telomermangel, was eine große Herausforderung darstellt, eine ausreichende Anzahl funktioneller NK-Zellen für die adoptive Immuntherapie zu erhalten11.
Um diese Herausforderungen zu meistern, wurde eine Methode entwickelt, um primäre NK-Zellen direkt aus unfraktionierten peripheren mononukleären Blutzellen (PBMCs) oder Nabelschnurblut (CB) unter Verwendung einer bestrahlten und gentechnisch veränderten 721.221 (im Folgenden 221) Zelllinie, einer menschlichen B-lymphoblastoiden Zelllinie mit geringer Expression von MHC-Klasse-I-Molekülen3, zu expandieren. Frühere Studien zeigten die Bedeutung von IL-21 für die NK-Zellexpansion; Daher wurde ein gentechnisch verändertes membrangebundenes IL-21 entwickelt, das eine Version der 721.221-Zelllinie (ab sofort 221-mIL-21) exprimiert 11,12,13,14,15. Die Ergebnisse zeigten, dass 221-mIL-21-Feeder-Zell-expandierte primäre NK-Zellen für etwa 2-3 Wochen auf ein durchschnittliches >40.000-faches mit anhaltend hoher NK-Zellreinheit erweitert wurden. Weitere Informationen zur Anwendung dieses Protokolls finden Sie in Yang et al.16.
Dieses Protokoll zielt darauf ab, das schrittweise Verfahren der neuartigen Expansion von PBNK-, CBNK-, Gewebe-abgeleiteten NK und CAR-NK-Zellen ex vivo zu demonstrieren.
Protokoll
Menschliches Gewebe und blutbezogene Arbeit in diesem Protokoll folgt den Richtlinien des Rutgers University Institutional Review Board (IRB)
1. NK-Zellexpansion aus Lebergewebe (Tag 0), wie in Abbildung 1 gezeigt.
HINWEIS: Die anfängliche Zellzahl und Lebensfähigkeit korreliert stark mit der Zeit seit der Organentnahme und der anfänglichen Gewebeprobenmenge. Wenn jedoch Gewebe in 30 ml Hank's Balanced Salt Solution (HBSS) gegeben und über Nacht auf Eis oder im Kühlschrank bei 4 °C aufbewahrt werden, können NK-Zellen noch bis zu 24 Stunden später mit hoher Reinheit und Lebensfähigkeit expandiert werden.
- Identifizieren Sie lebensfähige Gewebebereiche, um Lymphozyten aus Geweben und Schnitten mit sterilen chirurgischen Geräten zu erhalten.
- Legen Sie Gewebe in 30 ml HBSS (ohne Kalzium oder Magnesium) und halten Sie es auf Eis, bis es bereit ist, sich auf die Isolierung vorzubereiten.
- Zerkleinern Sie das Gewebe in <0,5 cm große Würfel mit sterilen Rasierklingen oder Scheren und Pinzetten in einer Biosicherheitswerkbank.
- Bereiten Sie eine 1x Kollagenase-IV-Lösung (1 mg/ml) vor, indem Sie eine 10-fache Brühe in HBSS verdünnen (10x Kollagenase IV: 10 mg/ml oder ~200 U/ml).
- Legen Sie die gehackten Gewebestücke in die Gewebedissoziatorröhrchen. Füllen Sie die Röhrchen mit nicht mehr als 4 g Gewebe und tauchen Sie die Gewebestücke in ~ 10 ml 1x Kollagenase IV.
HINWEIS: Die Verwendung von DNase I wird nicht empfohlen, da dies die Lebensfähigkeit und den Ertrag von NK leicht verringern kann. Bitte beachten Sie die Materialtabelle für die spezifischen verwendeten Gewebedissoziatorschläuche. - Legen Sie die Gewebedissoziatorröhrchen in einen Gewebedissoziator und mischen Sie es bei 37 °C, um das Gewebe gründlich zu zerkleinern.
HINWEIS: Bei Lebergewebe kann dies über 30 Minuten dauern. Für brüchigeres Gewebe können etwa 15 Minuten ausreichend sein. Bitte beachten Sie die Materialtabelle für spezifische Gewebedissoziatorröhrchen und den verwendeten Gewebedissoziator. - Entfernen Sie die Gewebedissoziatorschläuche und trituieren Sie mit dem Backend einer 5-ml-Spritze durch das 40-μm-Nylonzellsieb. Sammeln Sie das Elutionsmittel und entsorgen Sie die großen unverdauten Fragmente.
- Das Elutionsmittel bei 400 x g für 5 min bei Raumtemperatur herunterdrehen. Asspirieren Sie den Überstand.
- Resuspendieren Sie die Zellpellets in 30% Polyvinylpyrrolidon (PVP)-beschichteter Kieselsäure, um Fettzellen zu entfernen, die sonst die endgültige Lymphozytenfraktion kontaminieren.
- Um 1x PVP-beschichtete Kieselsäure herzustellen, verwenden Sie eine 9:1-Verdünnung von PVP-beschichteter Kieselsäure in 10x PBS.
HINWEIS: Die verwendeten PVP-beschichteten Kieselsäuren finden Sie in der Materialtabelle . - Um 30% PVP-beschichtete Kieselsäure herzustellen, verdünnen Sie 1x PVP-beschichtete Kieselsäure mit PBS/HBSS.
- Um 1x PVP-beschichtete Kieselsäure herzustellen, verwenden Sie eine 9:1-Verdünnung von PVP-beschichteter Kieselsäure in 10x PBS.
- Das Zellpellet bei 400 x g für 5 min bei Raumtemperatur herunterdrehen. Asspirieren Sie den Überstand.
- Resuspendieren Sie das Zellpellet in 9 ml R-10-Medien.
HINWEIS: Informationen zur Zusammensetzung von R-10-Medien finden Sie in der Materialtabelle . - Schichten Sie die Zellsuspension vorsichtig über 4 ml Ficoll- oder Lymphozyten-Trennmedien, um Lymphozyten von roten Blutkörperchen und polymorphkernigen Zellen zu trennen.
- Trennen Sie die Schichten durch Zentrifugieren bei 400 x g für 23 min bei Raumtemperatur bei ausgeschalteter Beschleunigung und Bremse oder bei der niedrigsten Stufe. Dekantieren Sie vorsichtig die obere mittlere Schicht und ernten Sie die Interphase, die gewebeinfiltrierende Lymphozyten enthält.
- Spülen Sie die Zellen mit 10 ml Medien und fahren Sie mit Zellzählung, Durchflusszytometrie, Aliquotierung und Einfrieren von Zellen oder primärem NK-Expansionsprotokoll fort.
2. Primäre NK-Zellexpansion aus PBMCs (oder CB- oder Organgeweben) (Tag 0), wie in Abbildung 2 gezeigt.
- Das gefrorene PBMC und die gefrorenen, bestrahlten Feederzellen in einem 37 °C warmen Wasserbad auftauen.
- Waschen Sie die PBMC- und 100 gammabestrahlten (gy-bestrahlten) 221-mIL-21-Zellen durch Zentrifugation bei 400 x g für 5 min mit 10 mL R-10-Medien separat.
- Speichern Sie 1 x 106 Zellen PBMC für die Durchflusszytometrie.
HINWEIS: Die anfängliche NK-Zellreinheit ist ein wichtiger Faktor bei der Berechnung der NK-Zellexpansionsrate. - Resuspendieren Sie die Zellen in 1 ml R-10-Medien. Zählen Sie die Zellen mit Trypan Blue.
- Mischen Sie 5x 10 6 PBMC-Zellen mit 10 x 10 6 Zellen mit 100 Gy-bestrahlten 221-mIL-21-Zellen in einer speziellen6-Well-Platte (siehe Materialtabelle).
- Fügen Sie 30 ml R-10-Medien hinzu, ergänzt mit humanem IL-2 (200 U/ml) und humanem IL-15 (5 ng/ml) (siehe Materialtabelle).
- Die spezielle 6-Well-Platte bei 37 °C mit 5%CO2 inkubieren.
- Ersetzen Sie die Medien durch R-10-Medien, die mit humanem IL-2 (200 U/ml) und humanem IL-15 (5 ng/ml) ergänzt sind, um die NK-Zellen alle 3-4 Tage zu erhalten.
HINWEIS: Halten Sie weniger als 20 x 106 Zellen pro Vertiefung für jede weitere Erweiterung bei jedem Medienwechsel bereit. Stellen Sie für die beste Lebensfähigkeit sicher, dass die Gesamtzahl der Zellen in jeder Vertiefung 100 x 106 Zellen nicht überschreitet. - Zeichnen Sie die Gesamtzahl der Zellen und die Lebensfähigkeit auf und führen Sie alle 3-4 Tage eine Durchflusszytometrie durch, um die NK-Zellexpansionsrate zu berechnen.
3. Anheftung von 293T-Zellen (Tag 2), wie in Abbildung 2 dargestellt.
- Teilen Sie 1,8 x 106 293T-Zellen in 11 ml D-10-Medien pro behandelter 100-mm-Platte auf.
HINWEIS: Informationen zur Zusammensetzung der D-10-Medien finden Sie in der Materialtabelle . - Inkubieren Sie 293T-Zellen bei 37 °C mit 5%CO2.
4. Retrovirus-Transfektion (Tag 3)
- Mischen Sie in einem 1,7-ml-Röhrchen 470 μL reduzierte Serummedien mit 30 μL Transfektionsreagenz.
HINWEIS: In der Materialtabelle finden Sie die spezifischen reduzierten Serummedien und das verwendete Transfektionsreagenz. - In einem separaten 1,7-ml-Röhrchen werden 2,5 μg pRDF-Plasmid, 3,75 μg Pegpam3-Plasmid und 2,5 μg CAR-Konstrukt im SFG-Vektor in das reduzierte Serummedium gegeben, so dass das Endvolumen 500 μL beträgt.
- Mischen Sie die Lösungen in den Schritten 4.1 und 4.2 tropfenweise.
- Inkubieren Sie das Röhrchen bei Raumtemperatur für 15 min.
- 1 ml der Mischung aus Schritt 4.4 bis 293T Zellplatte an Tag 1 tropfenweise zugeben.
- Die Platte(n) werden bei 37 °C mit 5% CO2 für 48-72 h inkubiert.
5. Retronectin-Plattenbeschichtung (Tag 3)
- Verdünnen Sie Retronektinprotein mit phosphatgepufferter Kochsalzlösung (PBS) auf eine Endkonzentration von 50-100 μg / ml.
- Geben Sie 500 μL des verdünnten Retronektins in jede Vertiefung einer unbehandelten 24-Well-Platte (5 Vertiefungen pro CAR-Konstrukt). Die Platte mit Parafilm verschließen und über Nacht bei 4 °C inkubieren.
6. Transduktion (Tag 4)
- Die Retronektinplatte bei 2103 x g 30 min bei 4 °C zentrifugieren. Verwerfen Sie den Überstand.
- Blockieren Sie jede Vertiefung der 24-Well-Platte mit 1 ml R-10-Medium.
- Die Platte bei 37 °C mit 5%CO2 für 1 h inkubieren.
- Die Zentrifuge auf 32 °C vorwärmen, während die Retronektinplatte verstopft wird.
- Sammeln Sie den Retrovirusüberstand, indem Sie die transfizierten 293T-Zellen mit einem 0,45-μm-Filter filtern.
- Aliquot 2 ml des gefilterten Retrovirus-Überstands in jede Vertiefung.
- Zentrifugieren Sie die 24-Well-Platte bei 2103 x g für 2 h bei 32 °C.
- Während der Plattenzentrifugation sammeln Sie die expandierten PBNK-Zellen von Tag 0 und zählen Sie die Zellen mit Trypan Blue.
HINWEIS: Erweitern Sie die PBNK-Zellen weiter, indem Sie R-10-Medien hinzufügen, die mit IL-2 (200 U / ml) und IL-15 (5 ng / ml) ergänzt werden. - Die expandierten PBNK-Zellen werden mit R-10-Medien, ergänzt mit IL-2 (200 U/ml) und IL-15 (5 ng/ml) auf 2,5 x 10 5-5 x 10 5 Zellen/ml (0,5 x 106-1 x 10 6 Zellen pro Vertiefung) verdünnt.
HINWEIS: Notieren Sie die Gesamtzahl der Zelle, Lebensfähigkeit und speichern Sie 5 x 105 expandierte PBNK-Zellen für die Durchflusszytometrie, da diese Werte für die Bestimmung der NK-Zellexpansionsrate wichtig sind. - Nach der Zentrifugation den Retrovirusüberstand aus jeder Vertiefung teilweise absaugen.
HINWEIS: Aspirieren Sie nicht vollständig, d.h. lassen Sie etwa 100 μL Retrovirusüberstand pro Well, da dies die Transduktionseffizienz verringert. - Aliquot 2 ml der verdünnten expandierten PBNK-Zellen aus Schritt 6.8 zu jeder Vertiefung.
- Zentrifugieren Sie die Platte bei 600 x g für 10 min bei 32 °C. Die Platte bei 37 °C mit 5% CO2 für 48-72 h inkubieren.
HINWEIS: Schließen Sie die Platte nicht mit einem Parafilm ab.
7. CAR-NK-Zellentnahme (Tag 6 oder 7), wie in Abbildung 2 dargestellt.
- Sammeln Sie die Zellen vorsichtig von der 24-Well-Platte und geben Sie die Zellen in ein 50-ml-Zentrifugenröhrchen
HINWEIS: Versuchen Sie, keine Blasen zu erzeugen, da dies zu einer Abnahme der Zelllebensfähigkeit führt. - Zentrifugieren Sie das Röhrchen bei 400 x g für 5 min.
- Resuspendieren Sie das Pellet mit 1 ml R-10-Medien und zählen Sie die Zellen mit Trypan Blue.
HINWEIS: Speichern Sie 5 x 105 Zellen für die Durchflusszytometrie, um die Transduktionseffizienz zu bestimmen. - Die resuspendierten Zellen werden in eine spezielle 6-Well-Platte überführt, die 30 ml R-10-Medien enthält, ergänzt mit IL-2 (200 U/ml) und IL-15 (5 ng/ml).
- Die spezielle 6-Well-Platte bei 37 °C mit 5%CO2 inkubieren.
- Ersetzen Sie R-10-Medien, die mit IL-2 (200 U / ml) und IL-15 (5 ng / ml) ergänzt wurden, um NK-Zellen alle 3 - 4 Tage zu erhalten.
HINWEIS: Halten Sie weniger als 20 x 106 Zellen pro Vertiefung bereit, um sie bei jedem Wechsel weiter auszudehnen. Stellen Sie für die beste Lebensfähigkeit sicher, dass die Gesamtzahl der Zellen in jeder Vertiefung 100 x 106 Zellen nicht überschreitet. - Zeichnen Sie die Gesamtzahl der Zellen und die Lebensfähigkeit auf und führen Sie alle 3-4 Tage eine Durchflusszytometrie durch, um die NK-Zellexpansionsrate zu berechnen.
- Verwenden Sie die Zellen für geeignete In-vitro - oder In-vivo-Assays .
HINWEIS: Die ex vivo expandierten PBNK- und CAR-NK-Zellen können in einem 37 °C Inkubator für ca. 4 Wochen kultiviert werden. - Untersuchen Sie die NK-Zellzahl und -Reinheit an Tag 7, Tag 11, Tag 14, Tag 18 und Tag 21 durch Durchflusszytometrie.
Ergebnisse
Ein schematischer Workflow der gewebeinfiltrierenden NK-Zellisolierung und PBNK-Zellexpansion unter Verwendung der 221-mIL-21-Feederzellmethodik ist in Abbildung 1 und Abbildung 2 dargestellt. Expandierte PBNK-Zellen wurden alle 3 oder 4 Tage für die Durchflusszytometrie entnommen, um die Reinheit der NK-Zellen durch Färbung von Zellen mit Anti-Human-CD56 und Anti-Human-CD3 zu bestimmen. Das Experiment wurde mit zwei verschiedenen Donatoren wiederholt, um die Reproduzierbarkeit des Expansionssystems zu zeigen (Abbildung 3). PBNK-Zellen, die um 221-mIL-21 erweitert wurden, dehnten sich fast 5 × 104-fach aus (Abbildung 3A). Darüber hinaus wurde die Reinheit der NK-Zellen während der gesamten 21-tägigen Expansion mit rund 85% hoch gehalten (Abbildung 3B). Unter Verwendung des 221-mIL-21-Feeder-Zellexpansionssystems lag die NK-Zellreinheit unabhängig von den Spendern konstant zwischen 85% und 95% (Daten nicht gezeigt). Um die Robustheit des 221-mIL-21-Expansionssystems zu demonstrieren, wurden PBMCs vor der Expansion auf Anti-CD56 und Anti-CD3 gefärbt, was eine Zellreinheit von 7,09% für NK-Zellen und einen hohen Prozentsatz an T-Zellen zeigte (Abbildung 4A). PBMCs wurden mit 221-mIL-21 kokultiviert, um NK-Zellen zu erweitern; Die NK-Reinheit wurde vor der CAR-NK-Transduktion an Tag 4 überprüft (Abbildung 4A). CAR-NK-Zellen wurden gesammelt und für Anti-CD56, Anti-CD3 und Anti-hIgG(H+L) F(ab')2 gefärbt, was eine hohe NK-Zellpopulation (86,9 % an Tag 7) und eine hohe CAR-Transduktionseffizienz von etwa 70% zeigte (Abbildung 4). Höhere Transduktionseffizienzen (bis zu 95%) wurden auch mit dem Retrovirus-Verpackungssystem beobachtet. Insgesamt zeigen diese Daten, dass die 221-mIL-21-Feederzellen NK-Zellen erfolgreich expandieren und die NK-Zellreinheit ex vivo bewahren konnten.
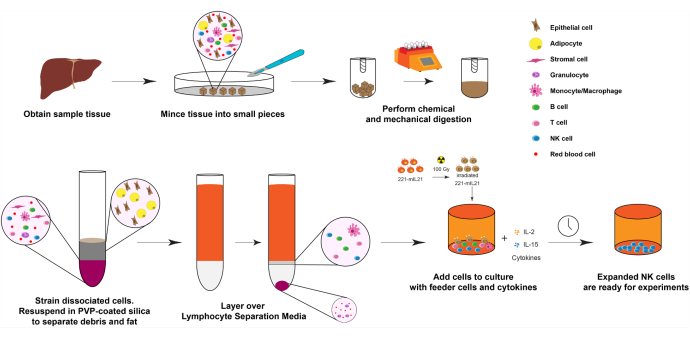
Abbildung 1: Diagramm der NK-Zellexpansion aus festen menschlichen Organproben. Kurz gesagt, die erhaltenen menschlichen Leberproben werden für die mechanische Verdauung in kleine Würfel zerkleinert. Dissoziierte Zellen werden dann mit PVP-beschichtetem Siliziumdioxid und Lymphozyten-Trennmedien isoliert. Weiterhin werden die NK-Zellen unter Verwendung des in Abbildung 2 beschriebenen Expansionsprotokolls erweitert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
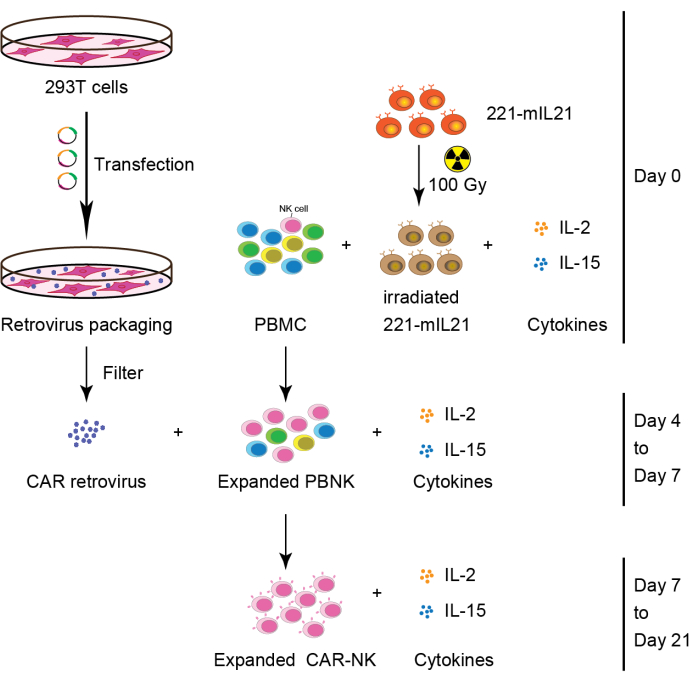
Abbildung 2: Schematischer Workflow der CAR-NK-Zellgeneration aus PBMCs. Kurz gesagt, 221-mIL21-Feederzellen wurden bei 100 Gy bestrahlt, bevor sie am Tag 0 mit PBMCs kokultiviert wurden, die mit IL-2 und IL-15 ergänzt wurden. Parallel dazu wurden 293T-Zellen mit dem Retrovirus-Verpackungssystem transfiziert, um CAR-Retroviren zu erzeugen, die dann in Gegenwart von IL-2 und IL-15 in die expandierten PBNK-Zellen transduziert wurden. Primäre CAR-NK-Zellen wurden an Tag 7 geerntet und expandierten 21 Tage lang. Diese Zahl wurde von Yang et al.16 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
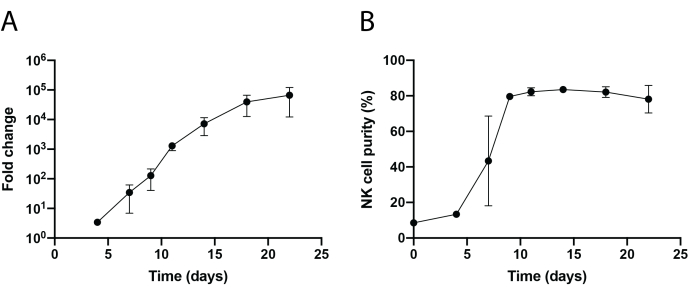
Abbildung 3: Dynamische Zeitrafferexpansion von PBNK-Zellen. (A) Faltenexpansion von PBNK während eines 22-tägigen Zeitverlaufs. Die Zellen wurden an den angegebenen Tagen für die Durchflusszytometrie mit Anti-CD56 und Anti-CD3 gefärbt. Die Gesamtzahl der NK-Zellen wurde durch Multiplikation der NK-Zellreinheit mit der Gesamtzahl der Zellen bestimmt. Die Expansionsrate wurde wie folgt erzeugt: (Anzahl der NK-Zellen)Tn/(Anzahl der NK-Zellen)T0, wobei Anzahl der NK-Zellen = (Prozentsatz der NK-Zellreinheit) × (Gesamtzahl der Zellen),T0 die Anzahl der NK-Zellen zum Zeitpunkt Tag 0 und Tn die Anzahl der NK-Zellen zum Zeitpunkt Tag n ist. (B) NK-Zellreinheit während eines 22-tägigen Zeitverlaufs. Die NK-Zellexpansion wurde zweimal mit zwei verschiedenen Donatoren wiederholt. Fehlerbalken stellen ± REM dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
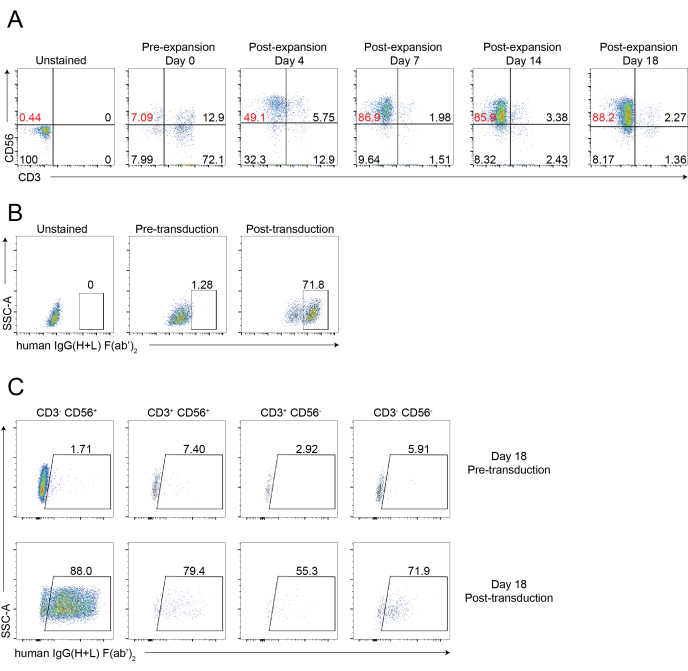
Abbildung 4: Repräsentative durchflusszytometrische Analyse von CAR-NK-Zellen. (A) Repräsentative Punktdiagramme, die den dynamischen Zeitraffer der NK-Zellreinheit der CAR-NK-Zellen während eines 18-tägigen Kurses zeigen. Die Durchflusszytometrie-Analyse wurde bewertet, indem die Zellen zu angegebenen Zeitpunkten mit Anti-CD56 und Anti-CD3 gefärbt wurden. Tag 0 zeigt eine Vorerweiterung von PBNK an. Tag 4 zeigt eine Postexpansion von PBNK und eine Prätransduktion von CAR-NK-Zellen an. Tag 7 zeigt die Posttransduktion von CAR-NK-Zellen an. (B) Repräsentative Punktdiagramme, die die Transduktionseffizienz von CAR-NK-Zellen unter Verwendung des Retrovirus-Verpackungssystems zeigen. Die Zellen wurden mit Anti-CD56, Anti-CD3 und Anti-hIgG(H+L) F(ab')2 für die Durchflusszytometrie gefärbt. (C) Repräsentative Punktdiagramme, die den CAR-Ausdruck in verschiedenen Teilmengen zeigen, einschließlich CD56+CD3-, CD56-CD3+, CD56+CD3+ und CD56-CD3- an Tag 18. Die Zellen wurden mit Anti-CD56, Anti-CD3 und Anti-hIgG(H+L) F(ab')2 (CAR-Expression) für die Durchflusszytometrie angefärbt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die meisten der aktuellen CAR-NK-Produkte in klinischen Studien verwenden NK-Zelllinien 17, wie NK-92, eine Zelllinie, die aus einem Non-Hodgkin-Lymphom-Patienten18 isoliert wurde, NK-92MI, IL-2-unabhängige NK-92-Zelllinie19 und NKL, isoliert von einem großen granulären Lymphozytenpatienten20, da diese Zelllinien für Standardprodukte leicht proliferativ sind. Diese Zelllinien, z. B. NK-92-Zellen, haben jedoch marginale klinische Wirksamkeit und In-vivo-Expansion, da sie vor der Infusion bestrahlt werden müssen, wodurch ihre Proliferation und Zytotoxizität in vivobegrenzt wird 21. Aus diesen Gründen werden derzeit verschiedene Strategien untersucht, um primäre NK-Zellen aus verschiedenen Quellen zu vermehren, darunter peripheres Blut, CB, Knochenmark (BM), menschliche embryonale Stammzellen (HSZ), induzierte pluripotente Stammzellen (iPS-Zellen) und Tumorgewebe21,22,23. Zum Beispiel können NK-Zellen ex vivo mit Interleukinen wie IL-15, IL-18 und IL-21 expandiert werden. Lymphoblastoide Zelllinien wie K562-Zellen oder Epstein-Barr-Virus-transformierte lymphoblastoide Zelllinien wie 721.221 Zellen werden auch für die NK-Zellexpansion16 verwendet. Die oben genannten Strategien erzeugen jedoch oft eine unzureichende Anzahl von NK-Zellen für einen adoptiven Transfer der CAR-NK-Immuntherapie22,24. Um das Problem zu lösen, zeigt die Studie hier ein Protokoll für eine Ex-vivo-NK-Zellexpansion unter Verwendung einer genetisch veränderten EBV-transformierten Zelllinie, 221-mIL-21-Feederzellen.
Die in diesem Protokoll gezeigte Expansionsmethodik unter Verwendung von 221-mIL-21-Feederzellen ist optimiert, um NK-Zellen mit einer Expansionsrate von mindestens 10 bis 100-fach höher zu expandieren als andere Leukämie-Zelllinien, einschließlich HL-60 und OCl-AML3-exprimierender Membran IL-21, K562 und K652-mIL21, die OX40-Ligand22,24,25 exprimieren. Die CAR-Expression wird auch für etwa 2 Wochen ex vivo ausgewertet. Noch wichtiger ist, dass die 221-mIL-21-Feeder-Zellexpansionsstrategie angewendet werden kann, um NK-Zellen aus verschiedenen Quellen, einschließlich PBMCs, CB und soliden Organen wie der Leber, ohne einen anfänglichen NK-Anreicherungsschritt zu expandieren. Das 221-mIL-21-Feedersystem ist zwar nicht so spenderabhängig wie die oben genannten Feederzelllinien, aber nicht völlig unabhängig von Spendern. Im Durchschnitt kann das 221-mIL-21-Expansionssystem 90% der NK-Zellreinheit mit einer hohen NK-Zellzahl erreichen, mit etwa <5% der T-Zellkontamination am Tag 14 nach der Expansion. Um die Möglichkeit einer T-Zell-Kontamination auszuschließen, ist es daher notwendig, NK-Zellen aus erhaltenen Proben vor der Ex-vivo-Expansion zu isolieren oder ein CD3+-Selektionssystem zu verwenden, um T-Zellen nach einer Ex-vivo-Expansion zu eliminieren.
Einer der Kritikpunkte bei der Verwendung eines NK-Zellexpansionssystems ist, dass die Feederzellen nach der Expansion oder vor einer Transfusion möglicherweise nicht vollständig ausgerottet wurden, was erhebliche regulatorische Bedenken aufweisen kann. Daher ist die vollständige Ausrottung der Feederzellen vor einer Transfusion von entscheidender Bedeutung. Neuere klinische CAR-NK-Studien, in denen K562-mIL21-4-1BBL-Feederzellen für die ex vivo CBNK-Zellexpansion24,25 verwendet wurden, zeigten jedoch keine besorgniserregenden Komplikationen. Darüber hinaus zeigten unsere vorläufigen Daten einen allmählichen Rückgang der bestrahlten 221-mIL-21-Population mit fortschreitender Expansion (Daten nicht gezeigt). Für die Umsetzung dieser Expansionsmethode im klinischen Umfeld sind jedoch umfangreichere Studien erforderlich. Insgesamt trägt das 221-mIL-21-Expansionssystem dazu bei, die Herausforderung der Erweiterung primärer CAR-NK-Zellen zu lösen und wird daher in naher Zukunft erheblich zur breiteren Nutzung der CAR-NK-Zell-basierten Immuntherapie beitragen.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Wir danken den Mitgliedern des Liu-Labors (Dr. Hsiang-chi Tseng, Dr. Xuening Wang und Dr. Chih-Hsiung Chen) für ihre Kommentare zu den Manuskripten. Wir danken Dr. Gianpietro Dotti für die SFG-Vektoren und Dr. Eric Long für die 721.221 Zellen. Diese Arbeit wurde teilweise von HL125018 (D. Liu), AI124769 (D. Liu), AI129594 (D. Liu), AI130197 (D. Liu) und Rutgers-Health Advance Funding (NIH REACH-Programm), U01HL150852 (R. Panettieri, S. Libutti und R. Pasqualini), S10OD025182 (D. Liu) und Rutgers University-New Jersey Medical School Startup Finanzierung für D. Liu Laboratory unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
Referenzen
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten