Method Article
Aspectos prácticos de la preparación de muestras y la configuración de 1H R1ρ Experimentos de dispersión de relajación de ARN
En este artículo
Resumen
Presentamos un protocolo para medir la dinámica de micro a milisegundos en 13C/15N-etiquetado y no etiquetado ARN con 1H R1ρ dispersión de dispersión de relajación espectroscopia de resonancia magnética nuclear (RMN). El enfoque de este protocolo radica en la preparación de muestras de alta pureza y la configuración de experimentos de RMN.
Resumen
El ARN es una biomolécula altamente flexible, en la que los cambios en las estructuras juegan un papel crucial en las funciones que las moléculas de ARN ejecutan como mensajeros y moduladores celulares. Si bien estos estados dinámicos permanecen ocultos para la mayoría de los métodos estructurales, la espectroscopia de dispersión de relajación (RD) R1ρ permite el estudio de la dinámica conformacional en el régimen de micro a milisegundos a resolución atómica. El uso de 1H como núcleo observado amplía aún más el régimen de tiempo cubierto y da acceso directo a los enlaces de hidrógeno y al emparejamiento de bases.
Los pasos desafiantes en dicho estudio son la preparación de muestras de alta pureza y alto rendimiento, potencialmente etiquetadas con 13C y 15N, así como la configuración de experimentos y el ajuste de datos para extraer población, tipo de cambio y estructura secundaria del estado previamente invisible. Este protocolo proporciona pasos prácticos cruciales en la preparación de muestras para garantizar la preparación de una muestra de ARN adecuada y la configuración de 1experimentos H R1ρ con muestras de ARN etiquetadas isotópicamente y no etiquetadas.
Introducción
Los ARN realizan una multitud de funciones reguladoras1,catalíticas 2y estructurales3 en la célula, muchas de las cuales están correlacionadas con una estructura molecular flexible y cambios intrincados de esas estructuras4,5,6,7. Los estados poco poblados permanecen invisibles para la mayoría de los métodos de determinación de estructuras o no permiten el estudio de estos estados ocultos a alta resolución atómica. La espectroscopia de resonancia magnética nuclear (RMN) de estado de solución combina ambos aspectos al proporcionar acceso a núcleos atómicos individuales, así como al ofrecer una gran caja de herramientas de experimentos dirigidos a la dinámica a través de todos los regímenes de tiempo8. Los experimentos de RMN RD proporcionan acceso al intercambio conformacional en la escala de tiempo intermedia, en la que se pueden esperar cambios en los patrones de emparejamiento de bases y reordenamientos estructurales locales5,9,10,11 , 12,13,14. Los experimentos de RD se realizan como mediciones largas de R2 en forma de un tren de pulso Carr-Purcell-Meiboom-Gill15 o como mediciones de relajación en el marco giratorio, llamados experimentos R1ρ RD16.
Aunque ambos se pueden usar para extraer la población y el tipo de cambio y la diferencia de cambio químico al estado menor, los experimentos R1ρ RD también dan el signo de la diferencia de cambio químico del estado excitado. Esto permite una inferencia sobre la estructura secundaria, que se correlaciona fuertemente con el cambio químico en las estructuras de ARN17. El cambio químico es un buen indicador de helicidad en el caso de protones y carbonos aromáticos en las nucleobases, de socios de emparejamiento de bases para protones imino y de fruncidos de azúcar en los átomos C4' y C1'18,19. Cabe señalar que recientemente se publicó un experimento de transferencia de saturación de intercambio químico (CEST) que utiliza una mayor potencia de bloqueo de espín (SL), cambiando así la aplicabilidad del experimento CEST a escalas de tiempo de intercambio más rápidas, como una alternativa al experimento R1ρ RD para sistemas con un estado excitado.
Aunque los isótopos de 13C y 15N se han utilizado a menudo para acceder al intercambio estructural, trabajos recientes de este laboratorio utilizaron protones aromáticos e imino como sondas para el intercambio conformacional9,10. El uso de 1H como núcleo observado trae varias ventajas, por ejemplo, acceso al intercambio en escalas de tiempo más rápidas y lentas, mayor sensibilidad y tiempos de medición más cortos. Esto se ve facilitado aún más por el enfoque SELective Optimized Proton Experiment (SELOPE), que proporciona acceso a protones aromáticos a través del descroxing del espectro unidimensional (1D) utilizando acoplamientos escalares homonucleares, en lugar de una transferencia de magnetización heteronuclear, y eliminando la necesidad de etiquetas de isótopos20. Este protocolo aborda la medición en experimentos de 1H R1ρ RD de muestras uniformemente etiquetadas con 13 C/15N y sin etiquetar. Por lo tanto, este artículo presenta un método de preparación de muestras que se encontró que es el más versátil para diferentes necesidades de preparación de muestras21 y discute alternativas en la última sección de este artículo(Figura 1).
En este punto, el lector debe tener en cuenta que otras técnicas de preparación de muestras son aceptables para los experimentos 1H R1ρ RD, y que se pueden realizar otros métodos de análisis estructural y funcional con las muestras sintetizadas con la técnica presentada. 1 Los experimentos H R1ρ RD requieren altas concentraciones de ARN (idealmente >1 mM), así como una alta homogeneidad, tanto en longitud de ARN como en conformación estructural para garantizar una caracterización confiable de la dinámica molecular. La transcripción in vitro (IVT) es el método de elección para muchos investigadores para producir 13muestras de ARN C/15N-labeladas debido a la disponibilidad de trifosfatos nucleósidos (NTP) etiquetados y la incorporación fácil en la reacción enzimática22. Sin embargo, la ampliamente utilizada ARN polimerasa T7 (T7RNAP)23,24,25 sufre de baja homogeneidad de 5' en caso de ciertas secuencias de iniciación26, 27 y a menudo también homogeneidad de 3' durante la escorrentía de transcripción28. La purificación de las especies de ARN objetivo se vuelve más costosa y laboriosa debido a la necesidad de grandes cantidades de ~ 200 nmol. El método utilizado aquí se ha presentado anteriormente donde se discutieron las ventajas en general21. En resumen, resuelve los problemas descritos transcribiendo una transcripción en tándem más grande que luego es escindida específicamente por Escherichia coli RNasa H, guiada por un oligonucleótido quimérico29,30 (ver Figura 2 para más detalles).
La incorporación de una secuencia espaciadora en los extremos 5' y 3' de la transcripción en tándem permite el uso de una secuencia de iniciación de alto rendimiento y la eliminación de voladizos terminales cerca del sitio de linealización de la plantilla de plásmido, respectivamente (Figura 2B). Se demostró que el método mejora significativamente los rendimientos, al tiempo que reduce el costo y la mano de obra, con la advertencia de una síntesis de plantilla más compleja y la necesidad de una enzima y oligonucleótido adicionales. La alta especificidad de la escisión de la RNasa H facilita la purificación debido a la falta de especies de ARN en un rango de tamaño similar. El presente protocolo utiliza un paso de cromatografía líquida de alto rendimiento (HPLC) de intercambio iónico que ha sido publicado por este laboratorio recientemente31,aunque otros métodos son posibles alternativas. 1 H R1ρ RD puede, en general, adquirirse en muestras etiquetadas o no etiquetadas con dos secuencias de pulsos respectivas, el experimento basado en la correlación cuántica única heteronuclear (HSQC) "etiquetado" 1 H R1ρ con una dimensión indirecta 10de13 C y el experimento basado en 10indirectos "noetiquetado" 1 H R1ρ basado en SELOPE con una dimensión indirecta de 1H20.
Estos experimentos bidimensionales (2D) pueden servir como una primera comprobación, independientemente de si la dinámica en la escala de tiempo R1ρ está presente en la muestra. Se puede obtener una visión general de rd para todos los picos resueltos en los espectros, y se pueden identificar picos de interés para un análisis de RD más exhaustivo. Esto significa que incluso las muestras no etiquetadas se pueden verificar antes de tomar la decisión de producir una muestra etiquetada más costosa. Una vez que se selecciona un pico con contribución de intercambio conformacional para ser estudiado más a fondo, es mejor cambiar a las versiones 1D de los experimentos anteriores (si el pico aún se puede resolver) para llevar a cabo los llamados experimentos fuera de resonancia. Para la versión etiquetada, la transferencia HSQC a 13C se reemplaza con un paso selectivo de polarización cruzada heteronuclear (HCP) como se usa en los experimentos 13C R1ρ 32 , 33,34,35,mientras que en el caso del experimento SELOPE, el experimento simplemente se ejecuta como un 1D, lo que es especialmente útil para las señales H8 y H2 que se encuentran en la diagonal en el 2D de todos modos. Un criterio en cuanto a qué secuencia utilizar, siempre que se disponga de una muestra etiquetada y no etiquetada, es qué tan bien aislado está el pico de interés en los dos experimentos.
En general, el experimento SELOPE se recomienda para muestras de ARN de hasta 50 nucleótidos. Para los ARN más grandes, la superposición será mayor; sin embargo, los nucleótidos estructuralmente interesantes a menudo aparecen en regiones de cambio químico que están menos superpuestas y aún podrían ser accesibles en ARN aún más grandes. Otro argumento sería que en muestras no etiquetadas, no se produce ningún acoplamiento en J entre 1H y 12C. Sin embargo, como la potencia mínima de bloqueo de giro se define por la potencia mínima utilizada para desacoplar esos dos giros (~ 1 kHz) en el experimento etiquetado, el experimento sin etiquetar permite el uso de un rango más amplio de intensidades de bloqueo de giro (SL) y, por lo tanto, el acceso a una escala de tiempo de intercambio más amplia. Estos experimentos fuera de resonancia proporcionan información adicional a kex, como la población del estado excitado (conformador alternativo), pES, así como información de cambio químico muy valiosa en forma de Δω (la diferencia de cambio químico del estado fundamental y el estado excitado).
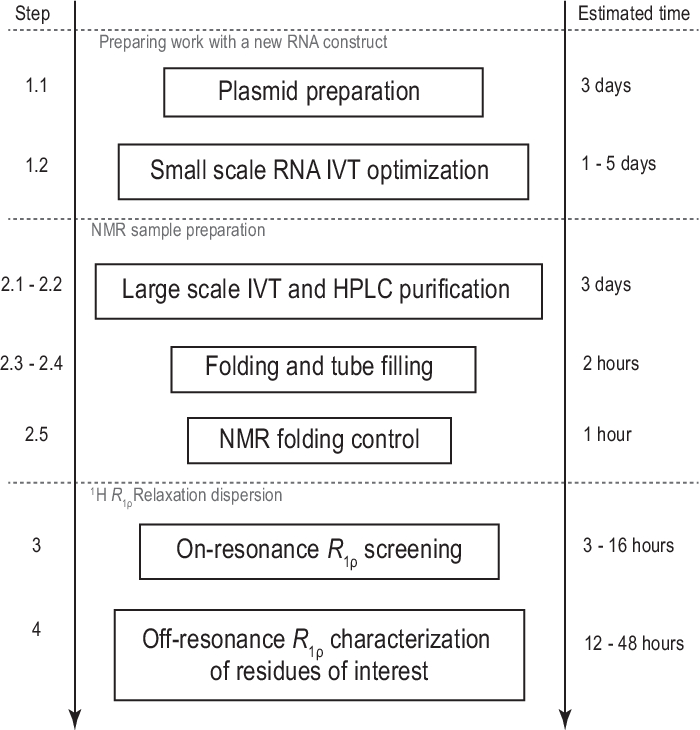
Figura 1: Flujo de trabajo del protocolo presentado. Preparación antes de la producción real de muestras a gran escala, que consiste en la preparación de plantillas y la confirmación de la transcripción in vitro exitosa y la escisión de la RNasa H. Producción a gran escala, incluida la purificación de HPLC, el llenado del tubo de RMN y la confirmación del plegamiento de ARN. En caso de síntesis etiquetada con isótopos, se debe realizar una purificación sin etiquetar para la optimización del gradiente el mismo día. Caracterización por RMN de la dinámica conformacional con experimentos R1ρ. Cada paso se puede realizar de forma independiente, por ejemplo,el análisis 1H R1ρ RD se puede aplicar a cualquier muestra de ARN adecuada producida con otro método. Abreviaturas: IVT = transcripción in vitro; HPLC = cromatografía líquida de alto rendimiento; RMN = resonancia magnética nuclear; RD = dispersión de relajación. Haga clic aquí para ver una versión más grande de esta figura.
El objetivo de este protocolo es proporcionar detalles prácticos y parámetros críticos para el estudio de la dinámica conformacional con dispersiónde relajación 1 H R1ρ en moléculas de horquilla de ARN. Después de proporcionar un protocolo detallado del diseño, la síntesis y la purificación de HPLC de intercambio iónico de un ARN objetivo que se puede realizar utilizando todos, algunos o ninguno NTP como versiones etiquetadas con 13C /15N, se ha descrito el flujo de trabajo de finalizar la muestra de RMN y confirmar el intercambio conformacional con espectroscopia de RMN. Finalmente, se describen los detalles para la configuración de 1experimentos H R1ρ RD en un espectrómetro bruker NMR (Figura 1). El protocolo da cada paso para configurar la versión 1D para muestras etiquetadas y comentarios adicionales y una tabla para ajustar para la configuración de la versión SELOPE (Tabla 2). Después del protocolo, se discuten los pasos críticos y las rutas alternativas para la preparación de la muestra y la configuración de 1H R1ρ RD.
Protocolo
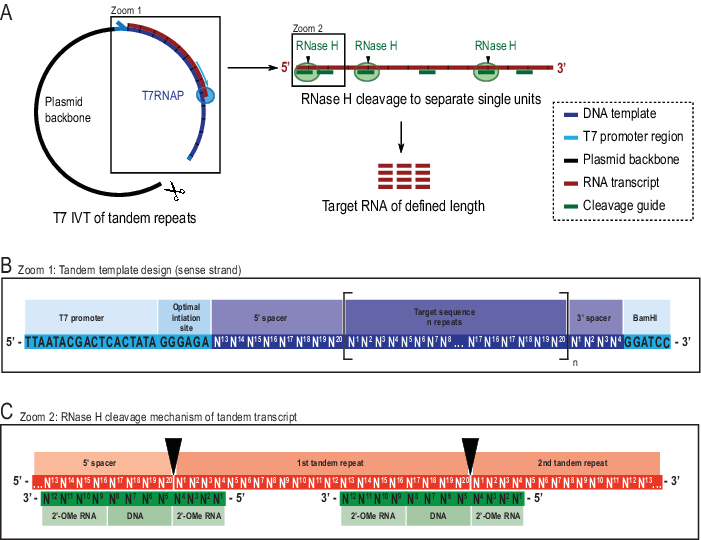
Figura 2: Representación esquemática del protocolo IVT en tándem reportado. (A) Transcripción en tándem a partir de una plantilla de plásmido linealizado con T7RNAP (izquierda) y escisión sucesiva por RNAse H de la transcripción para lograr la longitud objetivo de ARN, dirigida por una guía de ADN quimérico (derecha). (B) Esquema detallado de la plantilla en tándem a partir del promotor viral T7RNAP, una secuencia de iniciación. La secuencia objetivo (azul oscuro, el ejemplo aquí es de 20 nt de largo) se repite "n" veces. Las repeticiones flanqueadas por secuencias espaciadores de 5′ y 3′ que consisten en los últimos ocho y primeros cuatro nucleótidos, respectivamente, para permitir la eliminación de las secuencias de iniciación y restricción de la primera y última unidad de repetición. (C) Hibridación de la transcripción en tándem (rojo) y las guías de escisión quimérica (verde). La RNasa H escinde el ARN opuesto al extremo del ADN 5′. Los flancos de ARN 2′-OMe aumentan la especificidad al mejorar la afinidad de unión de la guía de escisión al ARN objetivo. Esta cifra ha sido modificada de 21. Abreviaturas: T7RNAP = T7 ARN polimerasa. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación del trabajo para una nueva construcción de ARN
- Diseño y preparación de plásmidos
- Escriba la secuencia de plantillas en una herramienta de clonación, por ejemplo,Serial Cloner.
- Tome la secuencia promotora T7 y agregue una secuencia de iniciación de alto rendimiento (T7: 5'-TAATACGACTCACTATA ^GGGAGA-3').
NOTA: La transcripción comenzará en el nucleótido indicado con un caret (^). La secuencia de iniciación GGGAGA es variable, pero fuertemente dependiente de la secuencia; por lo tanto, se recomienda el uso de esta secuencia. - Agregue los últimos 8 nucleótidos (nt) de la secuencia objetivo como un espaciador de 5' (5'S).
- Agregue repeticiones de la secuencia de destino (TS).
- Agregue los primeros cuatro nucleótidos como un espaciador de 3' después de las repeticiones (5'S).
- Agregue un sitio de restricción de BamHI (RS) o un sitio de restricción único similar.
NOTA: La secuencia total como se muestra será clonada u ordenada fácilmente en un plásmido bacteriano de alta copia (por ejemplo,pUC19): 5'-T7-5'S-(TS)n-3'S-RS-3'(Figura 2B). El número de repeticiones debe ser tan alto como lo permita la síntesis de genes (un máximo de 600 nt en este protocolo). - Amplificar el plásmido en E. coli usando un kit comercial.
- Linealizar el plásmido purificado a 20 ng/μL utilizando el sitio de restricción apropiado. Resúmenes de restricción de escala con BamHI hasta 1 ml.
- Purifique el plásmido digerido y confirme la linealización exitosa en un gel de agarosa al 1%. Conservar el plásmido linealizado a -20 °C durante varios meses.
- Diseño de la guía de escisión (Figura 2C)
- Escriba los últimos ocho nucleótidos de la secuencia de ARN objetivo en la dirección 5'-3', y agregue los primeros cuatro nucleótidos de la secuencia de ARN objetivo en el extremo 3' también en la dirección 5'-3'.
- Generar el complemento de ADN inverso de esa secuencia
- Cambie el primer y el último nucleótido a sus modificaciones 2'-OMe agregando una 'm' antes de la letra del nucleótido.
NOTA: Para la síntesis, se utiliza mU en lugar de mT. - Ordene el oligo con purificación de desalización estándar.
NOTA: Compruebe si el oligo generado podría unirse en otro lugar que no sea la conexión de dos secuencias de ARN. Se requiere una complementariedad total en los cuatro nucleótidos de ADN centrales, mientras que las regiones flanqueantes podrían permitir un desajuste. Si es necesario, extienda los flancos hasta 18 nt para generar una secuencia de unión única36.
- IVT a pequeña escala
NOTA: Para trabajos sin RNasa, prepare todos los reactivos en condiciones estériles y libres de RNasa. Utilice el reactivo de descontaminación RNasa (consulte la Tabla de Materiales)y etanol al 95% v/v para limpiar las superficies de trabajo y las pipetas antes de su uso. Lave los guantes con etanol al 95% y use ropa de manga larga sin pelusa. Para minimizar la contaminación por RNasa, no respire sobre tubos abiertos.- Preparar soluciones de stock de Tris-Cl (pH 8.0), ditiothreitol, MgCl2,espermidina y NTPs/GMP (sin búfer). Mezcle los reactivos como se muestra en la Tabla 1. Prepare una mezcla maestra de estos reactivos con anticipación, antes de la adición de enzimas o ácidos nucleicos.
NOTA: Si usa reactivos congelados, mézclelos bien después de descongelarlos. Los reactivos pueden precipitar si se mezclan a concentraciones demasiado altas, por lo que se recomienda encarecidamente seguir el orden de la Tabla 1. - Agregue en el siguiente orden: plásmido, guía de escisión, fosfatasa inorgánica (IPPasa), RNasa H, T7RNAP. Como la actividad enzimática puede variar para las enzimas producidas internamente, pruebe varias concentraciones antes de seleccionar la mejor.
NOTA: Incluya un control negativo para la reacción de escisión, por ejemplo, sin RNasa H, para atribuir una banda objetivo faltante a la escisión defectuosa de la RNasa H y no a una transcripción fallida. - Incubar la reacción a 37 °C durante 1 h y confirmar la reacción en una electroforesis en gel de poliacrilamida desnaturalizadora (PAGE) (Figura 3A). Diluya la muestra 10 veces en solución de carga y cargue 1 μL sobre el gel.
NOTA: Mezcla de gel: 8 M de urea, 20% de acrilamida (19:1 de acrilamida:bisacrilamida) en 1x TBE. Solución de carga: 5 mM de ácido tetraacético etilendiamina (EDTA), 300 μM de azul de bromofenol en formamida. No se puede esperar que las reacciones de escisión de la RNasa H se completen después de 1 h, ya que constantemente se produce nuevo ARN. En este punto, busque una banda objetivo clara y la ausencia de una especie de peso molecular similar(por ejemplo,productos de nucleótidos (nt) ±3).
- Preparar soluciones de stock de Tris-Cl (pH 8.0), ditiothreitol, MgCl2,espermidina y NTPs/GMP (sin búfer). Mezcle los reactivos como se muestra en la Tabla 1. Prepare una mezcla maestra de estos reactivos con anticipación, antes de la adición de enzimas o ácidos nucleicos.
| Reactivo | Concentración de existencias | Cantidad a pequeña escala (μL) |
| H2O | - | 24 |
| Tris | 1 M | 5 |
| MgCl2 | 1 M | 0.5 |
| TDT | 1 M | 0.5 |
| Espermidina | 250 metros | 5 |
| GMP | 100 metros | 2.5 |
| ATP | 100 metros | 1.5 |
| GTP | 100 metros | 1.5 |
| UTP | 100 metros | 1.5 |
| CTP | 100 metros | 1.5 |
| Plásmido | 20 ng/μL | 5 |
| Guía de escote | 100 μM | 10 |
| iPPasa | 10 mg/ml | 0.5 |
| RNasa H | 10 μg/ml | 2 |
| ARN polimerasa T7 | 5 mg/ml | 2 |
Tabla 1: Tabla de reactivos para IVT tándem y escisión simultánea de RNasa H. Las concentraciones de stock se pueden adaptar a la convenienciadelusuario. Si la escisión de la RNasa H debe realizarse después de la IVT T7, agregue la guía de escisión y la RNasa H después de la inactivación por calor de T7RNAP. Las cantidades utilizadas escalan linealmente con la escala de reacción. Abreviaturas: T7RNAP = T7 ARN polimerasa; IVT = transcripción in vitro.
2. Preparación de muestras de RMN
- Amplíe la reacción al volumen deseado (generalmente 10 ml) y ejecute la reacción durante la noche. Prueba para la finalización de la reacción al día siguiente con un gel PAGE desnaturalante (Figura 3A).
NOTA: La reacción de escisión incompleta se muestra por especies de mayor peso molecular por encima de la banda objetivo.- Si la escisión no fue exitosa o completa, el ARN reanneal y la escisión guían en el recipiente de reacción calentando la solución en un microondas convencional a 450 W durante 15 s.
- Enfríe la solución lentamente a 37 °C durante 40 min. Utilice un bloque calefactor para volúmenes inferiores a 1 ml. Tenga en cuenta la formación de nuevo precipitado.
- Añadir más IPPasa y RNasa H, e incubar durante otras 1-3 h a 37 °C. Confirme la finalización de la reacción de escisión con page desnaturalizar.
- Cuando se complete la reacción de escisión de la RNasa H, saciar la reacción agregando EDTA a la concentración final de 50 mM y al vórtice a fondo.
NOTA: La posible precipitación de pirofosfato se disolverá y se formará un nuevo precipitado de proteínas. - Filtre la solución a través de un filtro de jeringa de 0,2 μm y concéntrese a un volumen inyectable en un sistema HPLC, dependiendo del tamaño del bucle de inyección.
NOTA: El protocolo se puede pausar aquí congelando la muestra a -20 °C.
- Purificación de HPLC a gran escala
- Prepare los búferes de intercambio iónico A y B dentro de una semana de uso. Filtrar y desgasificación de los tampones.
NOTA: Tampón A: acetato de sodio de 20 mM; Perclorato de sodio de 20 mM, pH 6.5. Tampón B: 20 mM acetato de sodio; Perclorato de sodio de 600 mM, pH 6.5. - Equilibre la columna con el 100% del búfer B seguido del 100% del búfer A para al menos 2 volúmenes de columna a 75 °C.
- Preparar la secuencia de HPLC(Figura 3B)a un caudal de 5,5 mL/min. Utilice la siguiente secuencia para la purificación de un ARN dimensionado entre 20 y 30 nt: 0-7 min: 0% B; 7-16 min: gradiente 0-20% B; 16-46 min: elución, típicamente con un gradiente de 20-30% B (optimizar según las necesidades); 46-62 min: 100% B; 62-73 min: 0% B.
NOTA: Un cambio en el caudal de 5,5 a 8 ml/min no influyó en la separación en este protocolo. - Optimizar el gradiente de elución mediante la inyección de un equivalente a 1 mL de reacción de transcripción (sin etiquetar) a la vez.
NOTA: Para más detalles y discusión, consulte Karlsson et al.31 y Feyrer et al.21. - Pruebe las fracciones recolectadas en una PÁGINA de desnaturalización. Si el pico de elución principal está bien aislado y contiene el ARN diana puro, amplíe la purificación a un equivalente de 10 ml de reacción de transcripción.
- Recopile las fracciones de interés, concéntrese e intercambie el búfer con el búfer de RMN. Utilice una unidad de filtro ultracentrífuga (consulte la Tabla de materiales)para volúmenes superiores a 50 ml.
NOTA: Tampón de RMN: 15 mM de fosfato de sodio; 25 mM de cloruro de sodio; 0.1 mM EDTA, pH 6.5. Para minimizar la pérdida de ARN que se adhiere a las paredes de los tubos de plástico, lave todos los tubos de recolección con 1 ml de agua, vórtice y centrífuga para recoger todo el líquido. - Determinar la concentración mediante espectroscopia ultravioleta. Calcular el rendimiento de la reacción según Feyrer et al21.
NOTA: La concentración de una muestra de RMN para experimentos de RD no debe ser inferior a 130 nmol, lo que corresponde a 500 μM en un volumen de muestra de 250 μL utilizando tubos de RMN (Tabla de Materiales).
- Prepare los búferes de intercambio iónico A y B dentro de una semana de uso. Filtrar y desgasificación de los tampones.
- Plegamiento de una muestra de ARN
- Diluir y alícuota la muestra de un volumen de ~10 mL en 1 mL por tubo.
- Calentar las alícuotas de ARN a 95 °C durante 5 min.
- Enfríe las muestras colocándolas sobre hielo o en una mezcla de agua, hielo y sal e incube durante 30 minutos.
- Acumule muestras y concéntrese a ~ 250 μL en una unidad de filtro centrífugo de 2 ml.
- Llenado de un tubo de RMN
- Limpie el tubo de RMN en el limpiador de tubos de RMN enjuagando con abundante agua, reactivo de descontaminación de RNasa, agua, etanol al 95% (EtOH) y agua nuevamente. Dejar secar.
- Limpie el émbolo enjuagando con agua y limpiando con reactivo de descontaminación RNasa y 95% de EtOH con una toallita sin pelusa. Dejar secar.
- Agregue el 10% (v/v) de D2O a la muestra de RMN.
- Llene la muestra de ARN en el tubo de RMN con una punta de pipeta grande. Deje que el líquido fluya a lo largo del lado de la pared del tubo.
- Inserte el émbolo y elimine las burbujas de aire empujando el émbolo hacia abajo junto con un movimiento de torsión rápido.
- Tire del émbolo hacia arriba lentamente sin crear nuevas burbujas de aire y fíjelo con una película de cera de parafina.
- Confirme el plegado por RMN.
NOTA: En este punto, es necesario realizar al menos una asignación de resonancia parcial para confirmar la estructura secundaria de la muestra de ARN e identificar regiones de interés para el estudio de la dinámica conformacional. Una descripción exhaustiva sobre la asignación de resonancia de ARN excedería este protocolo, por lo tanto, nos referimos a la literatura bien establecida en este punto19,37,38. Un ensayo de desplazamiento de movilidad electroforética (EMSA) puede ser un indicador útil del plegamiento del ARN y servir como datos complementarios para los experimentos de RMN.- Comparar los siguientes espectros de la muestra para la que se realizan 1experimentos H R1ρ RD con la muestra de referencia correctamente plegada (Figura 4): 1H 1D, especialmente la región de imino 10–15 ppm; Aromático 1H,13C-HSQC; 1 H,1H-SELOPE (opcional).
NOTA: Una huella dactilar aromática también es necesaria, incluso en caso de acuerdo entre las señales de imino, porque la formación de dímeros a menudo muestra las mismas o similares señales de imino que una horquilla de ARN. El experimento SELOPE puede reemplazar un 1H,13C-HSQC para huellas dactilares aromáticas, ya que los experimentos heteronucleares en muestras no etiquetadas consumen mucho tiempo. - Utilice el bucle UUCG como referencia de huella digital (si está presente).
- Realice esta comparación cada vez antes de que se registren losexperimentos de 1 H R1ρ RD.
- Comparar los siguientes espectros de la muestra para la que se realizan 1experimentos H R1ρ RD con la muestra de referencia correctamente plegada (Figura 4): 1H 1D, especialmente la región de imino 10–15 ppm; Aromático 1H,13C-HSQC; 1 H,1H-SELOPE (opcional).
3. 1H R1ρ Dispersión de relajación—enresonancia (versión 1D etiquetada)
NOTA: Los pasos siguientes describen la configuración de los experimentos de RD para una muestra etiquetada utilizando la versión 1D de la secuencia de pulsos rds basada en HSQC. Siga los mismos pasos para la secuencia 1D basada en SELOPE para muestras sin etiquetar. En la Tabla 2se muestra una descripción general de los nombres de parámetros y la configuración para ambos casos. El enfoque en las versiones 1D se debe a que son más prácticas para mediciones fuera de resonancia, y la configuración de las versiones 2D de los experimentos basados en SELOPE y HSQC ha sido discutida en detalle por Schlagnitweit et al.20 y Steiner et al.10,respectivamente.
- Determine la potencia de 1H para un pulso duro de 90° (P1).
- Opción A: Utilice el comando pulsecal Bruker.
- Opción B: En un experimento zg, determine el pulso de 360° midiendo una curva de nutación en el nivel de potencia de pulso duro del protón en el pico de agua.
NOTA: La longitud del pulso de 90 ° es un cuarto de la duración donde se observa la señal cero (si se mide una curva de nutación completa, entonces es el segundo cero; sin embargo, en la práctica, solo se muestrea la región alrededor del valor esperado para el 360°).
- Ejecute un espectro 1H 1D zgesgp.f2f3dec utilizando la longitud de pulso determinada en el paso 3.1 para confirmar el plegamiento del ARN antes de cada medición de R1ρ.
NOTA: Si se ejecutan experimentos de 1H SL por primera vez, compruebe si la potencia SL calculada corresponde a la potencia suministrada a la muestra calibrando la potencia SL para cada ancho de banda deseado. Los pasos de calibración detallados se describen en Steiner et al.10. - Cree un 1H R1ρ para el conjunto de datos etiquetados y establezca parámetros clave.
- Crear un nuevo conjunto de datos; idealmente basado en un conjunto de datos HSQC aromáticos de 1H-13C como se utiliza en muestras de ARN completamente etiquetadas para la asignación de ARN.
NOTA: Esto asegurará que la potencia de 13C, así como la potencia de 15N y la potencia de desacoplamiento ya estén configuradas. - Establezca los parámetros generales de acuerdo con la primera parte de la Tabla 2.
- Establezca parámetros específicos de RD de acuerdo con la segunda parte de la Tabla 2.
- Establezca la potencia de 1H SL en el valor más bajo (1,2 kHz) para las pruebas.
- Genere una lista vd de prueba con una sola entrada, 0 ms, (para optimizar la lista vd, como se describe en el paso 3.4), establezca TDF1 en 1 y actualice D30.
- Ejecute un espectro de prueba con esta configuración.
- Crear un nuevo conjunto de datos; idealmente basado en un conjunto de datos HSQC aromáticos de 1H-13C como se utiliza en muestras de ARN completamente etiquetadas para la asignación de ARN.
- Optimizar la lista vd (lista de longitudes SL a utilizar).
- Ejecute el experimento con una lista vd de prueba (por ejemplo,seis entradas: 0 m, 5 m, 10 m, 20 m, 30 m, 40 m; revuelva estos valores para evitar errores sistemáticos debido al calentamiento).
- Actualice D30 y TDF1 en consecuencia (en este ejemplo, D30 = 42m y TDF1 = 6).
- Intensidad gráfica del pico vs. longitud SL. Identifique la longitud SL a la que la intensidad del pico original disminuye a 1/3.
- Cree la lista vd final que se utilizará en el experimento, teniendo en cuenta lo siguiente: determine la longitud sl más larga como se describe en el paso anterior; evitar el uso de una lista con orden decreciente o ascendente; y añadir algunos duplicados para estudios estadísticos. Recuerde actualizar D30 y TDF1 cada vez que haya algún cambio en la lista vd.
NOTA: El experimento se ejecuta con diferentes longitudes de SL como se indica en la lista vd de una manera pseudo-2D. - Seleccione el número de escaneos para que el pico más débil de la lista tenga una relación señal-ruido (SINO) de al menos 10.
NOTA: Aunque la lista vd se optimizó para una potencia SL baja (1,2 kHz), esta lista vd también debe probarse a la potencia SL más alta que se utilizará(por ejemplo,15 kHz). Esto se debe a que la descomposición será mucho más lenta a alta potencia SL para picos con una contribución significativa de kEX. Por lo tanto, también se debe verificar una descomposición suficiente a alta potencia SL.
| Descripción del parámetro | Nombre del parámetro en secuencia de pulsos | |
| Etiquetado 1D | 1D SELOPE | |
| programa de pulso para 1D de resonancia | 1HR1rho_HCP_onres1D.es | 1HR1r_HH_onres1D.js |
| 1 Frecuencias portadoras H (ppm) | O1P = resonancia de agua en ppm | O1P = desplazamiento químico del pico de interés (ppm) |
| CNST28 = desplazamiento químico del pico de interés (ppm) | CNST29 = resonancia de agua en ppm | |
| 1 H pulso duro 90º | P1 @ PL1 (según lo calibrado en 3.1.1) | P1 @ PL1 (según lo calibrado en 3.1.1) |
| Pulsos con forma y potencias para la supresión del agua | P25 = 1000 us @ sp3 | P12 = 2000 us @ sp1 |
| (Watergate) | (escultura de excitación) | |
| 13 Frecuencia portadora C, en resonancia con desplazamiento químico de 13C del pico de interés | O2P | – |
| 15 Frecuencia portadora de N, cambio químico promedio de 15N para el desacoplamiento (como se usa en HSQC aromático) | O3P | – |
| 13 Desacoplamiento C/15N (configurado como en HSQC) | pcpd2, cpd2 | – |
| pcpd3, cpd3 | ||
| Transferencia de HCP (por ejemplo, p=1/J @ 100 Hz) | – | |
| Los comandos pulse y pulsef2 se pueden utilizar para determinar las potencias de los pulsos duros | ||
| Duración (establecida en 1/J(1H-13C) del pico de interés) | P11 | |
| Potencia 1H y encendido 13C | SP1, SP12 | |
| Transferencia de SELOPE (d = 1/4J(H5-H6)) | – | D5 |
| Pulso selectivo (por ejemplo, región aromática) para SELOPE (4000 us, Eburp) | – | P13 y SP4 |
| Parámetros específicos de SL / RD: | ||
| 1 Potencia H SL, obtenida a partir de pulsos duros calibrados (por ejemplo, utilizando el comando de pulsos). | Pl25 y CNST12 (1,2 – 15 kHz) | Pl24 (50 Hz – 15 kHz) |
| Lista de retardo variable para la duración de SL (inicialmente 1 entrada, 0, optimización descrita en 3.1.3) | vdlist (~ 0 – 40 ms) | vdlist (~ 0 – 150 ms debido a la baja R2 en muestras no etiquetadas) |
| Número de entradas TDF1 en la lista vd (inicialmente 1) | TDF1 | TDF1 |
| Compensación de calor: | ||
| D30 = el mayor valor en la lista vd + 2ms | D30 | D30 |
| Compensación de calor adicional para una amplia gama de SLs | PL25 | |
| Parámetros específicos fuera de resonancia: | ||
| programa de pulso para 1D fuera de resonancia | 1HR1rho_HCP_offres1D.es | 1HR1r_HH_offres1D.js |
| Desplazamiento para experimentos fuera de resonancia | CNST30 | CNST30 |
Tabla 2: Descripción general de los parámetros para configurar experimentos 1D basados en HCP y 1D-SELOPE 1H R1ρ. Abreviaturas: 1D = unidimensional; HCP = polarización cruzada heteronuclear; SELOPE = Experimento de protones optimizado por SELective; ppm = partes por millón; HSQC= correlación cuántica de espín heteronuclear; SL = bloqueo de giro; RD = dispersión de relajación
- Puesta a marcha y adquisición de experimentos en resonancia 1H R1ρ
- Copie el experimento de la sección 3.4 en una nueva carpeta en Topspin.
- En esta carpeta, configure experimentos en diferentes intensidades de SL, cada vez cambiando PL25 y CNST12. Determine el nivel de potencia correcto para cada intensidad SL mediante el comando pulse. Utilice intensidades SL que van desde 1,2 a 15 kHz, con un muestreo más denso para intensidades SL más bajas (consulte la Figura 5G para ver las intensidades SL seleccionadas). Agregue copias de algunos de los experimentos para tener duplicados para algunas de las fortalezas de SL.
- Ejecute estos experimentos.
- Análisis de experimentos de resonancia 1H R1ρ
- En TopSpin, procese cada segmento de cada conjunto de datos pseudo-2D utilizando los mismos parámetros de procesamiento(por ejemplo, ampliación de línea, fase) utilizando el comando xf2y divida el conjunto de datos en 1D utilizando el programa Bruker AU split2D.
- Obtenga intensidades y volúmenes de señal para cada segmento 1D.
NOTA: En la práctica, es mejor desconvolucionar los espectros para deshacerse de las contribuciones de picos potencialmente superpuestos y permite el uso del programa Bruker AU multidcon, que resume convenientemente las intensidades o áreas de los picos de todos los segmentos en un experimento en el archivo de texto decall.txt, que luego se puede leer fácilmente con otros programas (los scripts de Python escritos internamente se usaron aquí, como lo describen Steiner et al.10)en los pasos 3.6.3 y 3.6.4. - Ajuste un decaimiento mono exponencial para cada fuerza SL para obtener el valor R1ρ (o en resonancia, R2+REX).
- Trazar esos valores R2+REX (y) vs. Resistencia SL (x) (Figura 5F,G).
NOTA: Si los valores son significativamente más altos para intensidades SL bajas y disminuyen con mayor potencia SL (como se muestra en la Figura 5G),entonces el pico investigado muestra dispersión, y podría ser interesante llevar a cabo experimentos adicionales (fuera de resonancia) para obtener información sobre la población y la diferencia de cambio químico del estado excitado vs. el estado fundamental.
4. 1H R1ρ Dispersión de relajación: fuera de resonancia (versión 1D etiquetada)
- Puesta a marcha y adquisición de experimentos fuera de resonancia 1H R1ρ
- En una nueva carpeta topspin, configure experimentos a una cierta intensidad SL (generalmente primero a la intensidad SL más baja ya que la contribución REX es más alta allí, consulte la Figura 5G para obtener una selección representativa de SL fuera de resonancia), pero con diferentes compensaciones, cada vez cambiando CNST30.
- Utilice desplazamientos de hasta ± (3 o 4)*resistencia SL, con un muestreo más denso alrededor de 0 offset, como se puede ver en la Figura 5H,I.
- Ejecute estos experimentos.
- Análisis de experimentos fuera de resonancia 1H R1ρ
- Utilice la misma estrategia de procesamiento, como en 3.6.1–3.6.3, para determinar un valor de R1ρ para cada desplazamiento.
- Trazar esos valores frente al desplazamiento (Figura 5G).
NOTA: Una asimetría en esta curva ya puede indicar que se puede obtener información de desplazamiento químico para el estado excitado. Se debe realizar un ajuste y análisis exhaustivos utilizando ecuaciones de Bloch-McConnell o Laguerre para obtener información sobre kEX, pES así como Δω10,20 ( Figura5G). Los conjuntos de datos de ejemplo, los programas de pulso y las macros para ambos experimentos 1D se pueden encontrar en el repositorio de Github de Petzold Lab (https://github.com/PetzoldLab). En la Tabla 2se ofrece una visión general de los parámetros.
Resultados
El protocolo para la producción de ARN facilita la purificación a través de la generación de transcripciones de alta pureza. La Figura 3A muestra los resultados de varias reacciones de escisión de transcripciones en tándem, proporcionando reacciones exitosas y no exitosas. El carril 1 muestra el caso óptimo de una transcripción completamente escindida con solo rastros débiles de productos secundarios. El carril 2a muestra una escisión incompleta, que puede resolverse recocido y la adición de más RNasa H (Carril 2b, paso 2.1.2). Las construcciones de ARN de los carriles 1, 2a y 2b son las mismas. La muestra en el carril 3 muestra una escisión fallida. La solución de problemas de esta reacción implicaría una verificación de la secuencia de la guía de escisión, la pureza de la plantilla de ADN y las temperaturas de recocido. Potencialmente, la escisión de la RNasa H tendrá que realizarse después de la IVT T7 como se muestra en la muestra 2.
La muestra en el carril 4 muestra una cantidad significativa de productos laterales de escisión, que son difíciles de eliminar a través de HPLC de intercambio iónico. La solución de problemas de dicha muestra puede implicar (a) reducir la temperatura, la cantidad de RNasa H o el tiempo de reacción, (b) reducir el gradiente de elución y el volumen de inyección e intentar separar las fracciones objetivo de los productos secundarios. Karlsson et al.31han discutido más información sobre cómo aumentar la resolución en la purificación de HPLC en intercambio iónico. HpLC separa el ARN objetivo de ácidos nucleicos más largos o más cortos y contaminantes de proteínas o moléculas pequeñas. La Figura 3B muestra el resultado óptimo para la purificación de HPLC de intercambio iónico. El gradiente de elución debe elegirse de tal manera que la especie de ARN objetivo eluye al menos un volumen de columna (en este ejemplo: 35 ml) después de la siguiente especie más pequeña y un volumen de columna antes de la siguiente especie más grande.
Las especies más pequeñas en este método incluyen nucleótidos individuales, productos abortivos (8-12 nt), secuencias espaciadores de 3' y 5' (5-14 nt) y guía de escisión (ácido nucleico quimérico de 12 nt), mientras que las secuencias más largas son potencialmente repeticiones en tándem y el plásmido. Cuando se alcanza un pico de elución bien separado, la purificación se puede escalar hasta el equivalente a ~ 20 ml de reacción ivT por inyección. El pliegue correcto de una muestra de ARN es crucial para los experimentos de RD y debe confirmarse antes de cada medición. La Figura 4 muestra un ARN de 22 mer con etiqueta A antes de que se aplicara el protocolo de plegado en el paso 2.4 (azul), y la misma muestra después de que se haya logrado el plegamiento correcto (rojo). Una predicción de estructura secundaria mc-fold(Figura 4C)propone la estructura de horquilla presentada con 4 pares de bases que resultan en 5 señales imino.
Ambos espectros en la Figura 4A confirman estas señales predichas, aunque con intensidades relativas ligeramente diferentes, lo que indica que alguna estructura mal plegada (aquí, un dímero) puede ser problemática para evaluar con solo 1espectro H 1D. Un espectro aromático de 1H,13C-HSQC(Figura 4B),sin embargo, muestra solo 3 de las señales aromáticas para la muestra antes del protocolo de plegado (azul), pero las 4 señales para la muestra que se ha plegado de acuerdo con el paso 2.4 (rojo). La muestra mostrada en azul probablemente formó un homodímero (estructura propuesta en la Figura 4D)que daría lugar a las mismas señales de imino que la horquilla. La señal de A13H2 parece ampliada por el intercambio. Estos resultados ayudan a resaltar la importancia de la confirmación de plegado con experimentos de huellas dactilares imino y aromáticas antes de cada experimento de RD. Las secuencias de pulsos 1H R1ρ descritas en este protocolo permiten la detección de dinámicas en el régimen de intercambio intermedio. Inicialmente se registra una curva de resonancia, y si la dinámica está presente para un residuo específico, se ve una dispersión dentro de los valores R2+REX obtenidos, mientras que esta curva es plana para residuos sin intercambio.
La Figura 5 muestra curvas representativas en resonancia obtenidas para dos átomos de H8 diferentes en una horquilla de ARN sintético(Figura 5A),en la que las experiencias G6H8 se intercambian(Figura 5C),mientras que A4H8 no (Figura 5B). Como el intercambio es relativamente lento en esta muestra (kEX = 292 ± 40 Hz), se aprovechó la ventaja del experimento SELOPE para lograr bajas intensidades sl, y las dos curvas de resonancia se registraron utilizando la versión 1D de la secuencia de pulsos. Luego se utilizó la misma secuencia de pulsos para obtener datos fuera de resonancia para el residuo que muestra dispersión en el perfil de resonancia. La Figura 5D muestra los valores R1ρ obtenidos vs. offset en los que una ligera asimetría de la curva ya indica el signo de Δω.
Esto se hace aún más evidente en la gráfica R2+ REX donde se elimina la contribución R1 (Figura 5E). La columna derecha de la misma figura muestra curvas representativas de resonancia obtenidas para dos átomos H8 diferentes en una horquilla de ARN sintético ligeramente diferente con un intercambio más rápido, en las que las experiencias G6H8 se intercambian(Figura 5G),mientras que A4H8 no (Figura 5F). El tipo de cambio más rápido(kEX = 43.502 ± 38.478 Hz) permitió el registro RD de todos los protones aromáticos a la vez utilizando la versión SELOPE 2D para obtener datos de on- y off-resonance (datos G6H8 mostrados en la Figura 5H,I).
Identificadores generales de resultados positivos y negativos
Los resultados positivos en la escisión Tándem IVT y RNasa H se pueden identificar de la siguiente manera: 1) La banda objetivo es la banda más fuerte en el gel PAGE desnaturalización. 2) No hay o solo hay bandas débiles alrededor de la banda principal. 3) No hay o solo hay especies débiles de mayor peso molecular. 4) El cromatograma HPLC muestra un pico bien separado del ARN objetivo. 5) Cuando se muestrea el pico principal, solo aparece una banda en un gel PAGE desnaturalador.
Los resultados negativos en la escisión Tándem IVT y RNasa H se presentan de la siguiente manera: 1) No o solo se ve una banda principal débil en un gel PAGE desnaturalización. 2) Un patrón de especies de alto peso molecular a partir de repeticiones en tándem de ARN es visible. 3) Aunque la banda principal está presente, las bandas de intensidad similar están por encima o por debajo de la banda principal dentro de ± 3 nt.
Una muestra bien plegada se puede identificar de la siguiente manera: 1) El número de protones imino observados coincide con el número de protones imino esperados de una simulación de estructura secundaria(por ejemplo,Mc-Fold39, Figura 4A). 2) El par de bases oscilantes syn G-U en un bucle UUCG (si está presente) es visible a ~ 9.5 ppm, a veces solo visible a temperatura más baja. Fürtig y sus colegas han descrito otras huellas dactilares del bucle UUCG40. 3) La huella dactilar aromática concueerda con una muestra previamente asignada que se ha confirmado que se pliega correctamente(Figura 4C).
Una muestra mal plegada o degradada se puede identificar de la siguiente manera: 1) Hay más señales de imino de las que predice una simulación de estructura secundaria (NOTA: menos señales de imino no implican necesariamente un plegamiento erróneo, ya que los pares de bases de cierre a menudo no son visibles, y el intercambio conformacional amplía las líneas). 2) Ausencia de señales imino. 3) Señales estrechas de alta intensidad en la región aromática, indicando productos de degradación de nucleótidos individuales. 4) Divergencia entre señales imino o aromáticas a una muestra de referencia de plegamiento confirmado (Figura 4C).
Un átomo que no muestra ningún intercambio en la escala de tiempo detectable se puede identificar de la siguiente manera: 1) a partir de un perfil RD plano (debido a la falta de contribución REX que varía con la potencia SL aplicada)(Figura 5B y Figura 5F). 2) Se debe tener cuidado con el caso de intercambio intermedio lento cuando kEX y Δω son de la misma magnitud. En ese caso, la contribución en resonancia puede ser muy pequeña como se puede ver en la Figura 5C (en este caso los parámetros ajustados son kEX = 292 ± 40 Hz y Δω = 112 ± 4 Hz). En caso de duda, se puede registrar una curva baja sl fuera de resonancia para su verificación.
Un átomo que muestra intercambio en la escala de tiempo intermedia se puede identificar 1) a partir de un perfil de dispersión de relajación no plana en un experimento de RD en resonancia(Figura 5B y Figura 5F); 2) un ancho de línea más amplio en el experimento HSQC o SELOPE también puede ser un indicador de intercambio.
Los valores de potencia SL bien seleccionados para curvas fuera de resonancia(Figura 5E,F):1) tienen una contribución k EX considerable en la curva de resonancia (los valores de potencia SL seleccionados se indican en la Figura 5C y la Figura 5G). 2) Como las curvas fuera de resonancia se miden para al menos 3 valores de potencia SL, los valores de potencia SL seleccionados deben extenderse sobre la región de la curva de resonancia con kEX contribución. 3) Conducir a curvas R2+REX no planas después del ajuste de Laguerre (por ejemplo, Figura 5D:SL fortalezas 25, 50 y 75 Hz; Figura 5E).
Los valores de potencia SL mal seleccionados para curvas fuera de resonancia(Figura 5E,F)conducen a curvas planas R2+ REX después del ajuste de Laguerre. Un ejemplo se muestra en la Figura 5E,en el que la curva de fuera de resonancia de 100 Hz es muy plana y, por lo tanto, no proporciona información significativa sobre Δω.
Indicaciones para artefactos de efecto Overhauser (ROE) nuclear de marco giratorio: 1) Δω obtenido de curvas de resonancia fuera de coincidencia coinciden con los desplazamientos químicos de protones en vecindad espacial / protones, que muestran un pico cruzado con el pico de interés en el espectro de espectroscopia de efecto Overhauser nuclear (NOESY). (por ejemplo,la Figura 5I muestra amplias curvas fuera de resonancia como se esperaba para el intercambio intermedio rápido, pero las curvas también tienen características más nítidas, por ejemplo,a -3000 Hz y +1500 Hz. Estos son muy probablemente debidos a un artefacto ROE en lugar de un cambio químico para este H8 en un conformador diferente). 2) El ajuste de Laguerre funciona, pero no funciona bien (da errores altos o valores físicamente imposibles) para una resonancia de encendido y al menos 3 curvas fuera de resonancia, a pesar de que se obtuvieron exponenciales a partir de experimentos con SINO alto (>20)(por ejemplo, kEX = 43,502 ± 38,478 Hz). A menudo, cada SL encaja bien individualmente, pero encajarlos entre sí da un error mucho mayor; se espera el comportamiento opuesto para un verdadero estado excitado.
Indicaciones para el intercambio "verdadero" Δω: 1) Δω obtenido de curvas fuera de resonancia no coinciden con los desplazamientos químicos de protones en vecindad espacial / protones, que muestran un pico cruzado con el pico de interés en el espectro NOESY(por ejemplo, Figura 5E). 2) El ajuste de Laguerre da errores bajos para una resonancia de encendido y al menos 3 curvas de resonancia(por ejemplo, Figura 5E vs. Figura 5I, ver leyenda para los resultados de ajuste).
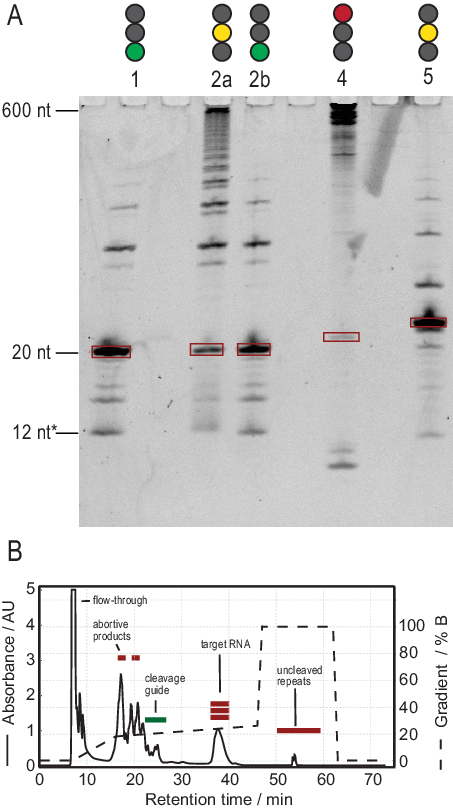
Figura 3: Producción de muestras por reacción de escisión T7 tandem IVT y RNasa H. (A) Desnaturalización PAGE de resultados positivos y negativos de Tándem IVT y RNasa H escisión. La altura de la escalera se refiere a las referencias de ARN, 12 * se refiere a la guía de escisión quimérica. Carril 1: Generación exitosa de un ARN objetivo de 20 nt. Pocos productos más cortos y largos están presentes. Carril 2a: Escisión incompleta de la transcripción en tándem. Aunque la purificación de HPLC es posible, se desperdiciaría mucho material. Carril 2b: La escisión continua de la RNasa H del Carril 2 produce una muestra limpia lista para la inyección de HPLC (idéntica al Carril 1). Carril 4: La escisión de la RNasa H no tuvo éxito en gran medida, y no se produjo ninguna banda objetivo. La transcripción en tándem de larga duración todavía es visible a 600 nt. Carril 5: Se produjo una banda objetivo, pero una banda fuerte -1 está presente. Aunque se puede realizar HPLC, es necesaria una eliminación cuidadosa del producto lateral. (B) Ejemplo de una inyección exitosa de HPLC. El pico a los 38 min contiene ARN puro de la longitud objetivo, mientras que los productos más largos y más cortos están bien separados del ARN objetivo. El Grupo B ha sido modificado a partir del 21. Abreviaturas: IVT = transcripción in vitro; HPLC = cromatografía líquida de alto rendimiento; nt = nucleótidos; AU = unidades arbitrarias. Haga clic aquí para ver una versión más grande de esta figura.
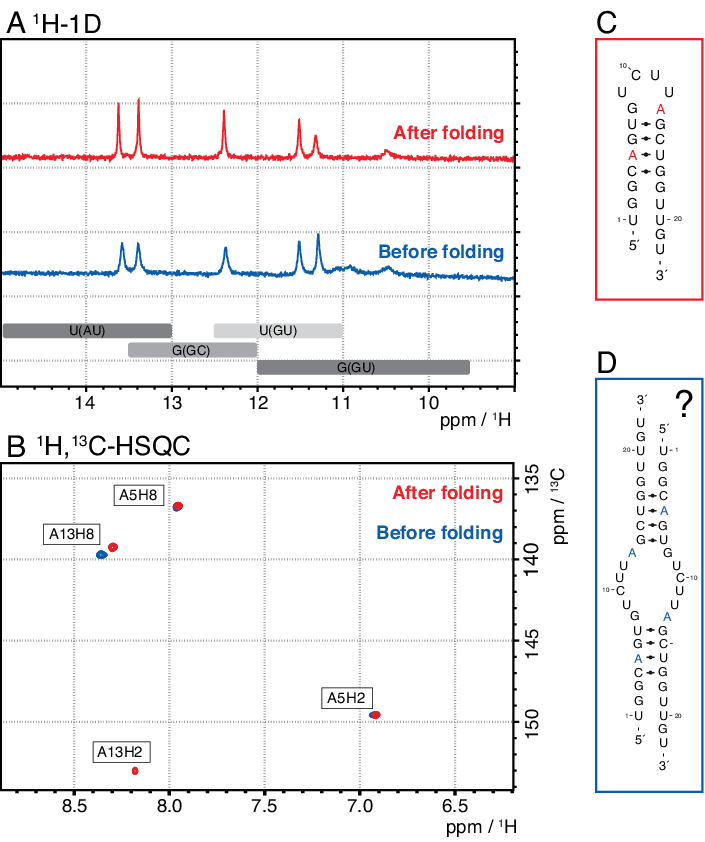
Figura 4: Ejemplo de una horquilla de ARN antes (azul) y después (rojo) del paso de plegamiento 2.4 (ver protocolo) en RMN. (A) Región Imino de un espectro 1H-1D de un ARN 22-mer etiquetado con A. Las regiones esperadas para la identidad del par base de las señales imino se indican en gris a continuación. (B) 1H,13C-HSQC espectro de las resonancias aromáticas del ARN del panel A. La muestra después del plegado (rojo) muestra 4 señales como se esperaba, mientras que la muestra antes del plegamiento (azul) muestra solo 3 señales. (C) Predicción de Mc-Fold del ARN de 22-mer como horquilla. Cinco señales imino son de esperar de esta estructura secundaria, que se pueden encontrar en ambas muestras en el panel A. (D) Estructura propuesta de un homodímero formado por el ARN de 22-mer, dando como resultado los mismos 5 pares de bases que la estructura de horquilla. Abreviaturas: RMN = resonancia magnética nuclear; 1D = unidimensional; HSQC = correlación cuántica única heteronuclear; ppm = partes por millón. Haga clic aquí para ver una versión más grande de esta figura.
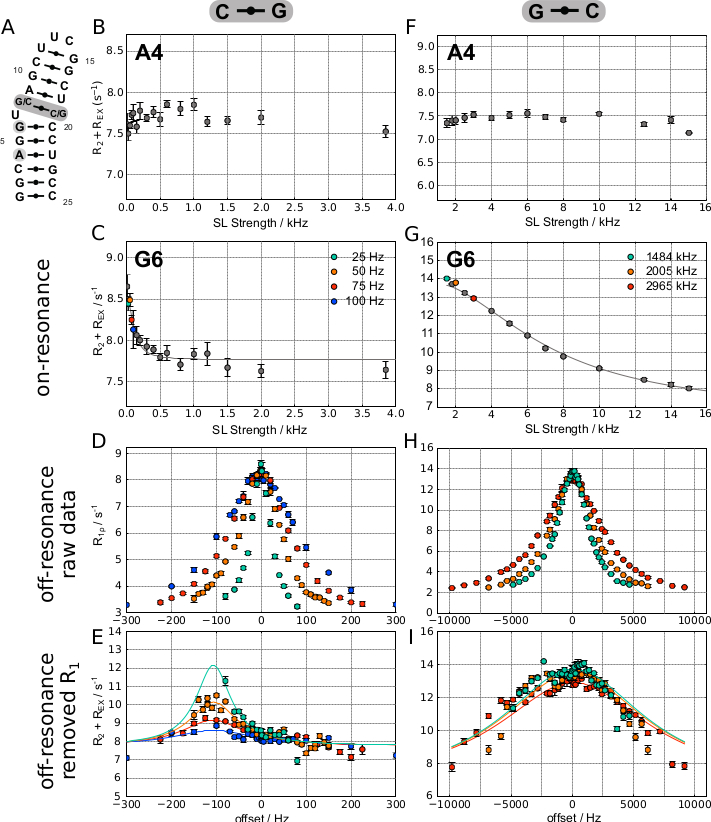
Figura. 5: 1H R1ρ Resultados representativos de RD para dos constructos diferentes basados en una horquilla de ARN. (A) La columna izquierda muestra los resultados obtenidos en el ARN con un par de bases C-G por encima de la U abultada, mientras que la columna derecha muestra los resultados obtenidos en una muestra donde el par de bases se cambió a G-C en su lugar. (B) y (F) muestran perfiles de dispersión plana como los obtenidos para A4H8 para los dos constructos, lo que indica que no hay intercambio conformacional. (C–E) muestran datos de sobrerresonancia, fuera de resonancia y ajustados obtenidos para G6 en el constructo (G-C). El ajuste de Laguerre conduce al siguiente resultado: R1 = 2.87 ± 0.01 Hz, R2 = 7.76 ± 0.03 Hz, k EX = 292 ± 40 Hz, p ES = 0.31 ± 0.03 %, Δω = 112 ± 4 Hz. (G–I) muestran datos de resonancia, fuera de resonancia y ajustados obtenidos para G6 en el constructo (G-C). El ajuste de Laguerre conduce al siguiente resultado: R1 = 1,93 ± 0,02 Hz, R2 = 6,71 ± 0,86 Hz, k EX = 43.502 ± 38.478 Hz, pES = 27 ± 16 %, Δω = 203 ± 166 Hz. Esta cifra fue modificada de 20. Abreviatura: SL = bloqueo de giro. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo presentado en este documento es una síntesis de varios protocolos publicados previamente en forma de artículos de investigación10,20,21,31. Por lo tanto, se pueden aplicar segmentos del protocolo, mientras que otros se pueden intercambiar a la preferencia del lector. Por ejemplo, las mediciones de R1ρ se pueden realizar en una muestra de ARN producida con cualquier método, dado que se asume el plegamiento y la homogeneidad de la longitud. Además, el protocolo no contiene información sobre la asignación de resonancia de la secuencia de ARN, un paso requerido para los experimentos de RD, ya que esto se ha cubierto ampliamente en la literatura anterior19,37,38. Los esquemas de etiquetado parciales, segmentarias o específicos del sitio36,41,42,43,44 son enfoques para facilitar la asignación de resonancia o reducir la superposición de resonancias que son de interés en los experimentos de RD y se han descrito extensamente en la literatura. Este método permite el uso de un etiquetado uniforme de cualquier identidad de nucleótido, lo que ya puede simplificar significativamente la asignación de resonancia.
El método ivT presentado aquí supera los problemas conocidos con las secuencias y el etiquetado, aumenta el rendimiento y disminuye el costo y el tiempo de trabajo en comparación con otros métodos. El uso de la secuencia de iniciación viral reduce la necesidad de optimización de la reacción, que es un problema conocido en el campo que puede llevar mucho tiempo realizar y produce solo unas pocas copias de la transcripción en el caso de la iniciación no G. La escisión T7 IVT y RNasa H de la transcripción en tándem se puede realizar simultáneamente en el mismo vaso. Se puede ver un patrón de repeticiones en tándem multiméricas en un gel PAGE desnaturalización durante la reacción, que se fusiona a una sola banda en el ARN objetivo al completar la reacción de la RNasa H(Figura 3A,carriles 1 y 2b). Los rendimientos típicos utilizando este método oscilan entre 30 y 70 nmol de ARN por 1 ml de IVT. Sin embargo, el método basado en la escisión RNasa H de repeticiones en tándem no viene sin ciertos problemas propios. La reacción de escisión de la RNasa H a menudo no se completa cuando se ejecuta simultáneamente con la transcripción T7(Figura 3A,carril 2a).
La separación de las unidades en tándem se puede finalizar recociendo la guía de escisión de la transcripción y agregando más RNasa H(Figura 3A,carril 2b, paso 2.1.2). Como el calentamiento de grandes volúmenes es lento y conduce a la hidrólisis catalizada por Mg2+del ARN, se utilizó un horno de microondas convencional, que calienta la muestra a >95 ° C en 10-15 s. Hasta el momento no se han observado efectos adversos en las muestras producidas. Algunos constructos muestran una segunda banda menor que no pudo ser eliminada por la optimización de las condiciones de reacción(Figura 3A,carril 4). Por lo general, estos son bastante claramente visibles como un hombro en el cromatograma HPLC, si se utiliza un gradiente de elución bien optimizado, y se pueden eliminar (paso 2.2.5). La siguiente discusión tiene como objetivo resaltar los pasos críticos en el protocolo, específicamente con respecto a la obtención de datos de alta calidad que permitan una interpretación de la dinámica conformacional.
Contaminación por RNasa
Las RNasas extracelulares son ubicuas, altamente estables y representan la mayor amenaza para la estabilidad a largo plazo de las muestras de RMN. Por lo tanto, es crucial trabajar en un entorno libre de RNasa y mantener todos los reactivos y artículos de plástico libres de RNasa. Se recomienda el uso de puntas de filtro y tal vez incluso máscaras faciales. Esto es específicamente importante después de la purificación de HPLC. Las muestras de RMN contaminadas con RNasas generalmente exhiben picos estrechos visibles en espectros 1H-1D después de días o semanas debido a productos de degradación de un solo nucleótido. Dicha muestra no es adecuada para mediciones de R1ρ.
Muestra de RMN
Debido a su naturaleza altamente cargada, el ARN se puede utilizar en altas concentraciones sin precipitación en comparación con la mayoría de las proteínas. El uso de tubos de RMN Shigemi (consulte la Tabla de materiales)es ventajoso, ya que permiten centrar la muestra altamente concentrada en el centro de la bobina, al tiempo que proporcionan condiciones ideales de ajuste y bloqueo debido a la susceptibilidad del fondo de vidrio y el émbolo. De esta manera, la inhomogeneidad B1 se reduce, dando lugar a líneas más estrechas. El volumen de muestra típico en un tubo de RMN es de 250 μL, y la concentración típica es de 1-2 mM. Las muestras por debajo de 500 μM no se recomiendan para experimentos de RD, ya que el experimento tomaría demasiado tiempo y una buena shim. Del mismo modo, no se recomienda un volumen de muestra por debajo de 200 μL porque se requiere una buena estabilidad de shim y campo (bloqueo). Al insertar el émbolo, es crucial evitar la formación de burbujas en la muestra (paso 2.4.5). Si no se fija correctamente, el émbolo puede deslizarse hacia abajo en la muestra, reduciendo el volumen detectable. Además, los cambios rápidos de temperatura pueden conducir a la formación de nuevas burbujas en la muestra. Por lo tanto, se debe tener cuidado al transportar la muestra y al cambiar la temperatura de la sonda en el espectrómetro de RMN. Compruebe si hay burbujas en la muestra cuando vuelva a medirla después de un período más largo.
Plegamiento de ARN
Las moléculas dinámicas de ARN pueden existir en múltiples conformaciones cuando no se pliegan correctamente. A pesar de que las temperaturas de fusión de las estructuras secundarias pueden ser solo ligeramente superiores a la temperatura ambiente, se recomienda un procedimiento completo de calentamiento y enfriamiento por broche antes de la medición. Las muestras de horquilla altamente concentradas que se pliegan bajo control cinético (calentamiento y enfriamiento por presión) pueden formar homodímeros con el tiempo, lo que requiere un control riguroso del plegamiento de ARN antes de cada medición de RMN. Si el ARN medido no es una estructura de horquilla sino un DÚPLEX de ARN, se debe aplicar un plegamiento lento bajo control termodinámico.
En este caso, el proceso de enfriamiento después del calentamiento debe estar en el rango de horas, mientras que el ARN se utiliza en su volumen final y concentración en la muestra de RMN. Un recuento inicial de imino esperado y resonancias aromáticas puede proporcionar información sobre la homogeneidad de la muestra. Si la muestra no se ve como se esperaba, debe volver a plegarse. Mg2+ (añadido como sal de cloruro) puede ayudar con el plegamiento de las estructuras de ARN45. En la práctica, el control de plegamiento sirve como comparación con una muestra que se ha utilizado para asignar al menos parcialmente las resonancias de RMN y para resolver la estructura secundaria experimentalmente.
Consideraciones sobre la potencia de bloqueo de giro y la calefacción
En caso de ejecutar los experimentos 1H R1ρ RD como experimentos de visión general 2D, la potencia SL no debe ser inferior a 1,2 kHz. La frecuencia del transmisor de radiofrecuencia debe colocarse en el centro de la región ppm de los picos de interés(por ejemplo,7,5 ppm para protones aromáticos). El ancho de banda de 1,2 kHz será lo suficientemente grande como para bloquear estos protones sin ningún efecto importante fuera de resonancia. Tales efectos se pueden identificar en el perfil de RD. Si ocurren, los valores de R2+REX aumentan en lugar de disminuir con el aumento de los valores de potencia SL, especialmente para baja potencia SL. Compruebe si los valores de potencia SL calculados corresponden a la potencia entregada a la muestra. En la práctica, la potencia SL calculada se puede utilizar si el pulso duro de 1H 90 ° se calibró cuidadosamente en espectrómetros más nuevos; sin embargo, esto se puede comprobar calibrando la potencia SL para cada ancho de banda deseado.
El rango de potencia SL, que se puede utilizar en experimentos de 1H R1ρ RD es muy amplio, lo que lleva a un calentamiento de muestra variable (1,2 kHz a 15 kHz para HSQC para secuencias basadas en HCP y de 50 Hz a 15 kHz para experimentos SELOPE). El calentamiento desigual de la muestra se puede detectar como un ligero cambio en el cambio químico al comparar las 1D obtenidas para SL de baja potencia frente a. SLs de alta potencia. Este efecto generalmente no se considera en compensaciones de calor en experimentos R1ρ sobre heteronúcleos. La compensación de calor en esos experimentos generalmente se configura para corregir diferentes calentamientos debido a las diferentes duraciones de bloqueo de giro especificadas en la lista vd de cada serie de potencia de bloqueo de giro. Especialmente para el experimento SELOPE, se debe utilizar una segunda compensación de calor en todas las concentraciones SL aplicadas como se describe en20.
Consideraciones sobre la lista vd
Como se mencionó anteriormente, la lista vd debe contener un punto de tiempo lo suficientemente largo como para obtener una desintegración significativa de intensidad (idealmente hasta el 30% de la señal inicial, o lo más baja posible si no es posible alcanzar una desintegración del 70% dentro de las especificaciones de la sonda). Aunque la lista vd se optimizó para una potencia SL baja (1,2 kHz), esta lista vd también debe probarse a la potencia SL más alta que se utilizará(por ejemplo,15 kHz). Esto se debe al hecho de que para picos con una contribución significativa de REX, la descomposición será mucho más lenta a alta potencia SL. Por lo tanto, también se debe verificar una descomposición suficiente a alta potencia SL. Lo mismo debe considerarse para las desintegraciones a altas compensaciones en experimentos fuera de resonancia. El punto de tiempo máximo ideal de la lista vd podría ser significativamente diferente para las diferentes regiones del experimento de dispersión. En ese caso, se podrían incluir más puntos en la lista vd, y los puntos de la lista vd más largos para una mayor potencia SL o compensaciones más altas durante el análisis, en función del BAJO SINO al que conducirán, podrían descartarse. En general, se deben considerar los puntos de lista de 5-8 vd para poder detectar artefactos potenciales que conducen a desintegraciones no exponenciales como el acoplamiento J (ver más abajo).
1D- Consideracionesde selectividad del HCP
Se debe tener especial cuidado al ejecutar la versión 1D basada en HCP si hay otro pico que se superpone con el pico de interés en la dimensión 1H del experimento basado en HSQC 2D. Las transferencias basadas en HCP son muy, pero nunca 100% selectivas, y por lo tanto puede suceder que otro pico contribuya a la intensidad y el comportamiento de descomposición del pico de interés en el 1D. Una indicación para esto sería una diferencia en los valores de R1ρ en resonancia obtenidos utilizando las versiones 1D y 2D del experimento etiquetado.
Consideraciones sobre el ROE:
Para curvas fuera de resonancia de átomos con intercambio intermedio lento, los artefactos ROE se pueden identificar basándose en una comparación del Δω obtenido con un espectro NOESY o ROESY. Si se puede identificar un pico cruzado en una diferencia de desplazamiento químico correspondiente a Δω,entonces el estado excitado observado podría ser de hecho un artefacto ROE(por ejemplo,se encontraron ROE entre protones aromáticos, que están todos en el mismo rango de desplazamiento químico y, por lo tanto, cubiertos por esas curvas fuera de resonancia20). Por experiencia, esto siempre condujo a malos ajustes con grandes errores, posiblemente debido a que el ROE no siguió el mismo patrón que REX con el aumento de la potencia SL. La situación se vuelve más difícil para el intercambio intermedio-rápido. Mientras que la curva de resonancia es (a partir de la comparación con los datos de 13C obtenidos en el núcleo vecino) aún representativa del proceso de intercambio entre el GS y el ES, la curva de fuera de resonancia está influenciada por múltiples artefactos ROE.
En ese caso, la potencia SL para detectar el proceso de intercambio es mayor (>1,5 kHz) y, por lo tanto, abarca un mayor número de protones a medida que las curvas fuera de resonancia abarcan las diferencias de desplazamiento químico de varios candidatos ROE (para H8 estos serían: amino protones a ca. ±1000 Hz, H5 / H1 a ca. -1200 Hz, protones imino a ca. 3500 Hz). Hasta ahora, no se ha encontrado ningún método para suprimir estos artefactos ROE (aparte del uso de nucleótidos parcialmente deuterados46),y los datos fuera de resonancia no deben registrarse para el intercambio intermedio rápido, ya que no se puede extraer información confiable sobre el Δω real con este método, si no se puede excluir la contribución NOE / ROE a través de espectros NOESY.
Consideraciones de J-Coupling (Hartmann-Hahn)
Aunque las curvas de resonancia para protones homonucleares acoplados a J, como H6, se registraron con éxito10,20, se debe tener especial cuidado para las mediciones fuera de resonancia, especialmente para la baja potencia SL, ya que las condiciones de coincidencia Hartmann-Hahn pueden abarcar una amplia gama de las compensaciones investigadas. Los artefactos de Hartmann-Hahn se pueden identificar como oscilaciones en la desintegración exponencial o valores crecientes de R2+REX con fuerzas SL crecientes en gráficos RD en resonancia20.
Divulgaciones
K.P. es consultor de Arrakis Therapeutics, una compañía que descubre pequeñas moléculas dirigidas al ARN.
Agradecimientos
Agradecemos a la instalación de ciencia de proteínas (PSF) en el Instituto Karolinska por la expresión y purificación de la ARN polimerasa T7 y E. coli RNasa H, Martin Hällberg por el generoso regalo de la fosfatasa inorgánica, y a todo petzoldlab por las valiosas discusiones. Agradecemos a Luca Retattino por la preparación de las construcciones de U-bulge y a Emilie Steiner y Carolina Fontana por su contribución a las macros y los scripts de ajuste. Reconocemos al Instituto Karolinska y al Departamento de Bioquímica Médica y Biofísica por el apoyo a la compra de un espectrómetro de 600 MHz y la financiación de la posición (KI FoAss y KID 2-3707/2013). Agradecemos la contribución financiera de Vetenskapsrådet (#2014-4303), Stiftelsen för strategisk Forskning (ICA14-0023 y FFL15-0178) y The Ragnar Söderberg Stiftelse (M91-14), Harald och Greta Jeansson Stiftelse (JS20140009), Carl Tryggers stiftelse (CTS14-383 y 15-383), Eva och Oscar Ahréns Stiftelse, Åke Wiberg Stiftelse (467080968 y M14-0109), Cancerfonden (CAN 2015/388), J.S. reconoce la financiación a través de un Marie Skłodowska-Curie IF (EU H2020, MSCA-IF project no. 747446).
Materiales
| Name | Company | Catalog Number | Comments |
| 40% Acrylamide/Bis Solution | Bio-Rad | 161-0144 | |
| 5-alpha Competent E. coli | NEB | C2987I | |
| Acetic Acid | Sigma-Aldrich | 49199 | |
| Acetonitrile | Sigma-Aldrich | 34851 | |
| AFC-3000, HPLC Fraction collector | Thermo Scientific | 5702.1 | |
| Agarose | Sigma-Aldrich | A9414 | |
| Amersham ImageQuant 800 UV | GE Healthcare | 29399482 | Replacing LAS-4000 or equivalent |
| Amicon ultra centrifugal filter unit | Sigma-Aldrich | UFC900324 | |
| Ammonium persulfate | Sigma-Aldrich | A3678 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| ATP | Sigma-Aldrich | A2383 | |
| ATP-13C10/15N5 | Sigma-Aldrich | 645702 | |
| BamHI restriction enzyme | NEB | R0136L | |
| Bottle top filter | VWR | 514-1019 | |
| Bromophenol Blue | Sigma-Aldrich | 1081220005 | |
| Cleavage guide | IDT | N/A | or equivalent |
| CTP | Sigma-Aldrich | C1506 | |
| CTP-13C10/15N5 | Sigma-Aldrich | 645699 | |
| D2O | Sigma-Aldrich | 151882 | |
| Dionex Ultimate 3000 UHPLC system | Thermo Scientific | N/A | |
| DL-Dithiotreitol | Sigma-Aldrich | 43815 | |
| DMSO | Sigma-Aldrich | D8418 | |
| DNAPac PA200 22x250 Semi-Prep column | Thermo Scientific | SP6734 | |
| DNAPac PA200 22x50 guard column | Thermo Scientific | SP6731 | |
| E.coli RNase H | NEB | M0297L | or made in-house uniprot ref. P0A7Y4 |
| EDTA | Sigma-Aldrich | E6758 | |
| Eppendorf centrifuge, rotor: A-4-44 | Eppendorf | 5804R | |
| Ethanol 95% | Fisher scientific | 11574139 | |
| Ethanol 95% denatured | VWR | 85829.29 | |
| Formamide | Sigma-Aldrich | 47671 | |
| GelRed | VWR | 41003 | |
| GeneRuler 1kbp Plus | Fisher Scientific | SM1333 | Optional |
| GMP | Sigma-Aldrich | G8377 | |
| GMP-13C10/15N5 | Sigma-Aldrich | 650684 | |
| GTP | Sigma-Aldrich | G8877 | |
| GTP-13C10/15N5 | Sigma-Aldrich | 645680 | |
| Hydrochloric Acid | Sigma-Aldrich | H1758 | |
| Inorganic pyrophosphatase | Sigma-Aldrich | I1643-100UN | or made in-house uniprot ref. P0A7A9 |
| Invitrogen UltraPure 10X TBE-buffer | Sigma-Aldrich | T4415 | |
| Julabo TW8 Water bath | VWR | 461-3117 | |
| kuroGEL Midi 13 Horizontal gel electrophoresis | VWR | 700-0056 | or comparable |
| LB broth (Lennox) | Sigma-Aldrich | L3022 | |
| LB broth with agar (Lennox) | Sigma-Aldrich | L2897 | |
| Low Range ssRNA Ladder | NEB | N0364S | Optional |
| LPG-3400RS Pump | Thermo Scientific | 5040.0036 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 63068 | |
| microRNA Marker | NEB | N2102S | |
| Microwave oven | Samsung | MS23F301EAW | |
| Mini-PROTEAN electrophoresis equipment | Bio-Rad | 1658004 | |
| NucleoBond Xtra Maxi | Machinery-Nagel | 740414.10M | |
| pUC19 plasmid containing tandem insert | Genscript | N/A | or equivalent |
| RNaseZAP | Sigma-Aldrich | R2020 | |
| Shigemi tube 5mm | Sigma-Aldrich | Z529427 | |
| Single-use syringe, Luer lock tip | VWR | 613-2008 | |
| Sodium acetate | Sigma-Aldrich | S2889 | |
| Sodium chloride | Sigma-Aldrich | 730-1470 | |
| Sodium perchlorate | Sigma-Aldrich | 71853 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S3139 | |
| Spermidine trihydrochloride | Sigma-Aldrich | 85578 | |
| SYBR Gold | ThermoFisher | S11494 | |
| Syringe filters | VWR | 514-0061 | |
| T7 RNA polymerase | Sigma-Aldrich | 10881767001 | or made in-house uniprot ref. P00573 |
| TCC-3000RS Column thermostat | Thermo Scientific | 5730 | |
| Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Tris Base | Fisher Scientific | 10103203 | |
| UMP | Sigma-Aldrich | U6375 | |
| UMP-13C9/15N2 | Sigma-Aldrich | 651370 | |
| Urea | Sigma-Aldrich | U5378 | |
| UTP | Sigma-Aldrich | U6625 | |
| UTP-13C10/15N5 | Sigma-Aldrich | 645672 | |
| VWD-3100 Detector | Thermo Scientific | 5074.0005 |
Referencias
- Djebali, S., et al. Landscape of transcription in human cells. Nature. 489 (7414), 101-108 (2012).
- Doudna, J. A., Cech, T. R. The chemical repertoire of natural ribozymes. Nature. 418 (6894), 222-228 (2002).
- Sehgal, P. B., Westley, J., Lerea, K. M., DiSenso-Browne, S., Etlinger, J. D. Biomolecular condensates in cell biology and virology: phase-separated membraneless organelles (MLOs). Analytical Biochemistry. , 597(2020).
- Herschlag, D., Allred, B. E., Gowrishankar, S. From static to dynamic: the need for structural ensembles and a predictive model of RNA folding and function. Current Opinion Structural Biology. 30, 125-133 (2015).
- Kimsey, I. J., Petzold, K., Sathyamoorthy, B., Stein, Z. W., Al-Hashimi, H. M. Visualizing transient Watson-Crick-like mispairs in DNA and RNA duplexes. Nature. 519 (7543), 315-320 (2015).
- Dethoff, E. A., Petzold, K., Chugh, J., Casiano-Negroni, A., Al-Hashimi, H. M. Visualizing transient low-populated structures of RNA. Nature. 491 (7426), 724-728 (2012).
- Baisden, J. T., Boyer, J. A., Zhao, B., Hammond, S. M., Zhang, Q. Visualizing a protonated RNA state that modulates microRNA-21 maturation. Nature Chemical Biology. 17 (1), 80-88 (2021).
- Marušič, M., Schlagnitweit, J., Petzold, K. RNA dynamics by NMR spectroscopy. Chembiochem. 20 (21), 2685-2710 (2019).
- Baronti, L., et al. Base-pair conformational switch modulates miR-34a targeting of Sirt1 mRNA. Nature. 583 (7814), 139-144 (2020).
- Steiner, E., Schlagnitweit, J., Lundström, P., Petzold, K. Capturing excited states in the fast-intermediate exchange limit in biological systems using 1H spectroscopy. Angewandte Chemie International Edition. 55 (51), 15869-15872 (2016).
- Moschen, T., et al. Ligand-detected relaxation dispersion NMR spectroscopy: dynamics of preQ1-RNA binding. Angewandte Chemie International Edition. 54 (2), 560-563 (2015).
- LeBlanc, R. M., Longhini, A. P., Tugarinov, V., Dayie, T. K. NMR probing of invisible excited states using selectively labeled RNAs. Journal of Biomolecular NMR. 71 (3), 165-172 (2018).
- Strebitzer, E., Nußbaumer, F., Kremser, J., Tollinger, M., Kreutz, C. Studying sparsely populated conformational states in RNA combining chemical synthesis and solution NMR spectroscopy. Methods. 1148, 39-47 (2018).
- Rangadurai, A., Shi, H., Al-Hashimi, H. M. Extending the sensitivity of CEST NMR spectroscopy to micro-to-millisecond dynamics in nucleic acids using high-power radio-frequency fields. Angewandte Chemie International Edition. 59 (28), 11262-11266 (2020).
- Hansen, D. F., Vallurupalli, P., Kay, L. E. Using relaxation dispersion NMR spectroscopy to determine structures of excited, invisible protein states. Journal of Biomolecular NMR. 41 (3), 113-120 (2008).
- Lundström, P., Akke, M. Off-resonance rotating-frame amide proton spin relaxation experiments measuring microsecond chemical exchange in proteins. Journal of Biomolecular NMR. 32 (2), 163-173 (2005).
- Lee, J., Dethoff, E. A., Al-Hashimi, H. M. Invisible RNA state dynamically couples distant motifs. Proceedings of the National Academy of Sciences of the United States of America. 111 (26), 9485-9490 (2014).
- Schnieders, R., Keyhani, S., Schwalbe, H., Fürtig, B. More than proton detection- new avenues for NMR spectroscopy of RNA. Chemistry. 26 (1), 102-113 (2020).
- Fürtig, B., Richter, C., Wöhnert, J., Schwalbe, H. NMR spectroscopy of RNA. Chembiochem. 4 (10), 936-962 (2003).
- Schlagnitweit, J., Steiner, E., Karlsson, H., Petzold, K. Efficient detection of structure and dynamics in unlabeled RNAs: The SELOPE approach. Chemistry. 24 (23), 6067-6070 (2018).
- Feyrer, H., Munteanu, R., Baronti, L., Petzold, K. One-pot production of RNA in high yield and purity through cleaving tandem transcripts. Molecules. 25 (5), 1142(2020).
- Baronti, L., Karlsson, H., Marušič, M., Petzold, K. A guide to large-scale RNA sample preparation. Analytical and Bioanalytical Chemistry. 410 (14), 3239-3252 (2018).
- Brunelle, J. L., Green, R. In vitro transcription from plasmid or PCR-amplified DNA. Methods in Enzymology. 530, 101-114 (2013).
- Borkotoky, S., Murali, A. The highly efficient T7 RNA polymerase: A wonder macromolecule in biological realm. International Journal of Biological Macromolecules. 118, Pt A 49-56 (2018).
- Arnaud-Barbe, N., Cheynet-Sauvion, V., Oriol, G., Mandrand, B., Mallet, F. Transcription of RNA templates by T7 RNA polymerase. Nucleic Acids Research. 26 (15), 3550-3554 (1998).
- Guillerez, J., Lopez, P. J., Proux, F., Launay, H., Dreyfus, M. A mutation in T7 RNA polymerase that facilitates promoter clearance. Proceedings of the National Academy of Sciences of the United States of America. 102 (17), 5958-5963 (2005).
- Kuzmine, I., Gottlieb, P. A., Martin, C. T. Binding of the priming nucleotide in the initiation of transcription by T7 RNA polymerase. Journal of Biological Chemistry. 278 (5), 2819-2823 (2003).
- Gholamalipour, Y., Karunanayake Mudiyanselage, A., Martin, C. T. 3' end additions by T7 RNA polymerase are RNA self-templated, distributive and diverse in character - RNA-Seq analyses. Nucleic Acids Research. 46 (18), 9253-9263 (2018).
- Inoue, H., Hayase, Y., Iwai, S., Ohtsuka, E. Sequence-dependent hydrolysis of RNA using modified oligonucleotide splints and RNase H. FEBS Letters. 215 (2), 327-330 (1987).
- Wang, X., Li, C., Gao, X., Wang, J., Liang, X. Preparation of small RNAs using rolling circle transcription and site-specific RNA disconnection. Molecular Therapy - Nucleic Acids. 4, 215(2015).
- Karlsson, H., Baronti, L., Petzold, K. A robust and versatile method for production and purification of large-scale RNA samples for structural biology. RNA. 26 (8), 1023-1037 (2020).
- Hartmann, S. R., Hahn, E. L. Nuclear double resonance in the rotating frame. Physical Review. 128 (5), 2042-2053 (1962).
- Chiarparin, E., Pelupessy, I., Bodenhausen, G. Selective cross-polarization in solution state NMR. Molecular Physics. 95 (5), 759-767 (1998).
- Korzhnev, D. M., Orekhov, V. Y., Kay, L. E. Off-resonance R 1ρ NMR studies of exchange dynamics in proteins with low spin-lock fields: an application to a Fyn SH3 domain. Journal of the American Chemical Society. 127 (2), 713-721 (2005).
- Hansen, A. L., Nikolova, E. N., Casiano-Negroni, A., Al-Hashimi, H. M. Extending the range of microsecond-to-millisecond chemical exchange detected in labeled and unlabeled nucleic acids by selective carbon R 1ρ NMR spectroscopy. Journal of the American Chemical Society. 131 (11), 3818-3819 (2009).
- Duss, O., Maris, C., von Schroetter, C., Allain, F. H. -T. A fast, efficient and sequence-independent method for flexible multiple segmental isotope labeling of RNA using ribozyme and RNase H cleavage. Nucleic Acids Research. 38 (20), 188(2010).
- Krähenbühl, B., Lukavsky, P., Wider, G. Strategy for automated NMR resonance assignment of RNA: application to 48-nucleotide K10. Journal of Biomolecular NMR. 59 (4), 231-240 (2014).
- LeBlanc, R. M., Longhini, A. P., Le Grice, S. F. J., Johnson, B. A., Dayie, T. K. Combining asymmetric 13C-labeling and isotopic filter/edit NOESY: a novel strategy for rapid and logical RNA resonance assignment. Nucleic Acids Research. 45 (16), 146(2017).
- Parisien, M., Major, F. The MC-Fold and MC-Sym pipeline infers RNA structure from sequence data. Nature. 452 (7183), 51-55 (2008).
- Fürtig, B., Richter, C., Bermel, W., Schwalbe, H. New NMR experiments for RNA nucleobase resonance assignment and chemical shift analysis of an RNA UUCG tetraloop. Journal of Biomolecular NMR. 28 (1), 69-79 (2004).
- Keyhani, S., Goldau, T., Blümler, A., Heckel, A., Schwalbe, H. Chemo-enzymatic synthesis of position-specifically modified RNA for biophysical studies including light control and NMR spectroscopy. Angewandte Chemie International Edition. 57 (37), 12017-12021 (2018).
- Marchanka, A., Kreutz, C., Carlomagno, T. Isotope labeling for studying RNA by solid-state NMR spectroscopy. Journal of Biomolecular NMR. 71, 151-164 (2018).
- Becette, O., Olenginski, L. T., Dayie, T. K. Solid-phase chemical synthesis of stable isotope-labeled RNA to aid structure and dynamics studies by NMR spectroscopy. Molecules. 24 (19), 3476(2019).
- Zhang, X., Li, M., Liu, Y. Optimization and characterization of position-selective labelling of RNA (PLOR) for diverse RNA and DNA sequences. RNA Biology. 17 (7), 1009-1017 (2020).
- Roh, J. H., et al. Effects of preferential counterion interactions on the specificity of RNA folding. The Journal of Physical Chemistry Letters. 9 (19), 5726-5732 (2018).
- Juen, M. A., et al. Excited states of nucleic acids probed by proton relaxation dispersion NMR spectroscopy. Angewandte Chemie German Edition. 55 (39), 12008-12012 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados