Method Article
Aspects pratiques de la préparation des échantillons et de la configuration des expériences de dispersion de relaxation 1H R1ρ de l’ARN
Dans cet article
Résumé
Nous présentons un protocole pour mesurer la dynamique micro- à milliseconde sur 13C/15ARN marqué et non marqué avec 1H R1ρ dispersion de relaxation résonance magnétique nucléaire (RMN). L’objectif de ce protocole réside dans la préparation d’échantillons de haute pureté et la mise en place d’expériences de RMN.
Résumé
L’ARN est une biomolécule très flexible, dans laquelle les changements dans les structures jouent un rôle crucial dans les fonctions que les molécules d’ARN exécutent en tant que messagers et modulateurs cellulaires. Alors que ces états dynamiques restent cachés à la plupart des méthodes structurelles, la spectroscopie de dispersion de relaxation (RD) R1ρ permet l’étude de la dynamique conformationnelle dans le régime micro-milliseconde à la résolution atomique. L’utilisation de 1H comme noyau observé élargit encore le régime temporel couvert et donne un accès direct aux liaisons hydrogène et à l’appariement des bases.
Les étapes difficiles d’une telle étude sont la préparation d’échantillons de haute pureté et à haut rendement, potentiellement marqués 13C et 15N, ainsi que la mise en place d’expériences et l’ajustement des données pour extraire la population, le taux de change et la structure secondaire de l’état auparavant invisible. Ce protocole fournit des étapes pratiques cruciales dans la préparation des échantillons pour assurer la préparation d’un échantillon d’ARN approprié et la mise en place d’expériences 1H R1ρ avec des échantillons d’ARN marqués isotopiquement et non marqués.
Introduction
Les ARN remplissent une multitude de fonctions régulatrices1,catalytiques2et structurelles3 dans la cellule, dont beaucoup sont corrélées à une structure moléculaire flexible et à des changements complexes de ces structures4,5,6,7. Les états peu peuplés restent invisibles à la plupart des méthodes de détermination de la structure ou ne permettent pas l’étude de ces états cachés à haute résolution atomique. La spectroscopie par résonance magnétique nucléaire (RMN) à l’état de solution combine les deux aspects en donnant accès à des noyaux atomiques individuels et en offrant une vaste boîte à outils d’expériences ciblant la dynamique à travers tous les régimestemporels 8. Les expériences de RMN RD donnent accès à l’échange conformationnel dans l’échelle de temps intermédiaire, dans laquelle on peut s’attendre à des changements dans les modèles d’appariement de bases et à des réarrangements structurels locaux5,9,10,11, 12,13,14. Les expériences RD sont réalisées sous forme de mesures longues R2 sous la forme d’un train d’impulsions Carr-Purcell-Meiboom-Gill15 ou de mesures de relaxation dans le cadre rotatif, appelées expériences R1ρ RD16.
Bien que les deux puissent être utilisés pour extraire la population et le taux de change et la différence de décalage chimique à l’état mineur, les expériences R1ρ RD donnent également le signe de la différence de décalage chimique de l’état excité. Cela permet une inférence sur la structure secondaire, qui est fortement corrélée au déplacement chimique dans les structures d’ARN17. Le décalage chimique est un bon indicateur d’hélicité dans le cas des protons aromatiques et des carbones sur les nucléobases, des partenaires d’appariement de bases pour les protons imino, et des rondelles de sucre sur les atomes C4' et C1'18,19. Il convient de noter que récemment, une expérience de transfert de saturation d’échange chimique (CEST) utilisant une puissance de verrouillage de spin (SL) plus élevée, déplaçant ainsi l’applicabilité de l’expérience CEST à des échelles de temps d’échange plus rapides, a été publiée comme alternative à l’expérience R1ρ RD pour les systèmes avec un état excité.
Bien que les isotopes 13C et 15N aient souvent été utilisés pour accéder aux échanges structurels, des travaux récents de ce laboratoire ont utilisé des protons aromatiques et imino comme sondes pour l’échange conformationnel9,10. L’utilisation de 1H comme noyau observé apporte plusieurs avantages, par exemple, l’accès à l’échange sur des échelles de temps plus rapides et plus lentes, une sensibilité plus élevée et des temps de mesure plus courts. Ceci est encore facilité par l’approche SELective Optimized Proton Experiment (SELOPE), qui donne accès aux protons aromatiques grâce à la décrosénétration du spectre unidimensionnel (1D) à l’aide de couplages scalaires homonucléaires, au lieu d’un transfert d’aimantation hétéronucléaire, et éliminant le besoin d’étiquettes isotopiques20. Ce protocole traite de la mesure dans des expériences 1H R1ρ RD d’échantillons uniformément marqués et non marqués 13 C/15N. Par conséquent, cet article présente une méthode de préparation d’échantillons qui s’est avérée la plus polyvalente pour différents besoins de préparation d’échantillons21 et discute des alternatives dans la dernière section de cet article (Figure 1).
À ce stade, le lecteur doit noter que d’autres techniques de préparation d’échantillons sont acceptables pour les expériences 1H R1ρ RD, et que d’autres méthodes d’analyse structurelle et fonctionnelle peuvent être effectuées avec les échantillons synthétisés avec la technique présentée. 1 Les expériences H R1ρ RD nécessitent des concentrations d’ARN élevées (idéalement >1 mM) ainsi qu’une homogénéité élevée, à la fois dans la longueur de l’ARN et la conformation structurelle pour assurer une caractérisation fiable de la dynamique moléculaire. La transcription in vitro (IVT) est la méthode de choix pour de nombreux chercheurs pour produire 13échantillons d’ARN marqués C /15N en raison de la disponibilité de triphosphates nucléosidiques marqués (NTP) et d’une incorporation facile dans la réaction enzymatique22. Cependant, l’ARN polymérase T7 (T7RNAP) largement utilisée23,24,25 souffre d’une faible homogénéité de 5' dans le cas de certaines séquences d’initiation26,27 et souvent aussi d’homogénéité de 3' lors du ruissellement de transcription28. La purification des espèces d’ARN cibles devient plus coûteuse et laborieuse en raison du besoin de grandes quantités d’environ 200 nmol. La méthode utilisée ici a été présentée précédemment où les avantages ont été discutés en général21. En bref, il résout les problèmes décrits en transcrivant une transcription tandem plus grande qui est ensuite clivée spécifiquement par Escherichia coli RNase H, guidée par un oligonucléotide chimérique29,30 (voir la figure 2 pour plus de détails).
L’incorporation d’une séquence d’espacement aux extrémités 5' et 3' de la transcription en tandem permet l’utilisation d’une séquence d’initiation à haut rendement et l’élimination des surplombs terminaux proches du site de linéarisation du gabarit plasmidique, respectivement(Figure 2B). Il a été démontré que la méthode améliorait considérablement les rendements, tout en réduisant les coûts et la main-d’œuvre, avec la mise en garde d’une synthèse de modèle plus complexe et la nécessité d’une enzyme et d’un oligonucléotide supplémentaires. La grande spécificité du clivage RNase H facilite la purification en raison de l’absence d’espèces d’ARN dans une gamme de taille similaire. Le présent protocole utilise une étape de chromatographie liquide à haute performance (CLHP) par échange d’ions qui a été publiée par ce laboratoire récemment31, bien que d’autres méthodes soient des alternatives possibles. 1 H R1ρ RD peut, en général, être acquis sur des échantillons marqués ou non marqués avec deux séquences d’impulsions respectives, l’expérience à base de corrélation quantique unique hétéronucléaire 1 HR1ρ « étiquetée » avec une dimension indirecte 10de13 C et l’expérience àbase de SELOPE « nonétiquetée » de 1H R1ρ avec une dimension indirecte de 1H20.
Ces expériences bidimensionnelles (2D) peuvent servir de première vérification, peu importe si la dynamique sur l’échelle de temps R1ρ est présente dans l’échantillon. Il est possible d’obtenir une vue d’ensemble de la RD pour tous les pics résolus dans les spectres, et des pics d’intérêt pour une analyse plus approfondie de la RD peuvent être identifiés. Cela signifie que même les échantillons non étiquetés peuvent être vérifiés avant qu’une décision de produire un échantillon étiqueté plus coûteux ne soit prise. Une fois qu’un pic avec contribution d’échange conformationnel est sélectionné pour être étudié plus en profondeur, il est préférable de passer aux versions 1D des expériences ci-dessus (si le pic peut encore être résolu) pour effectuer des expériences dites de résonance off. Pour la version étiquetée, le transfert HSQC vers 13C est remplacé par une étape de polarisation croisée hétéronucléaire sélective (HCP) telle qu’utilisée dans les expériences 13C R1ρ 32 , 33,34,35, tandis que dans le cas de l’expérience SELOPE, l’expérience est simplement exécutée en tant que 1D, ce qui est particulièrement utile pour les signaux H8 et H2 qui se trouvent de toute façon sur la diagonale dans la 2D. L’un des critères quant à la séquence à utiliser, à condition qu’un échantillon étiqueté ou non étiqueté soit disponible, est la mesure dans laquelle le pic d’intérêt est isolé dans les deux expériences.
En général, l’expérience SELOPE est recommandée pour des échantillons d’ARN allant jusqu’à 50 nucléotides. Pour les ARN plus importants, le chevauchement sera plus important; cependant, des nucléotides structurellement intéressants apparaissent souvent dans des régions de déplacement chimique qui se chevauchent moins et qui peuvent encore être accessibles dans des ARN encore plus grands. Un autre argument serait que dans les échantillons non marqués, aucun couplage J ne se produit entre 1H et 12C. Cependant, comme la puissance minimale de verrouillage de spin est définie par la puissance minimale utilisée pour découpler ces deux spins (~ 1 kHz) dans l’expérience étiquetée, l’expérience non étiquetée permet l’utilisation d’une gamme plus large de forces de verrouillage de spin (SL) et, par conséquent, l’accès à une échelle de temps d’échange plus large. Ces expériences hors résonance fournissent des informations supplémentaires à kex, telles que la population de l’état excité (conformateur alternatif), p ES ,ainsi que des informations de décalage chimique très précieuses sous la forme de Δω (la différence de décalage chimique de l’état base et de l’état excité).
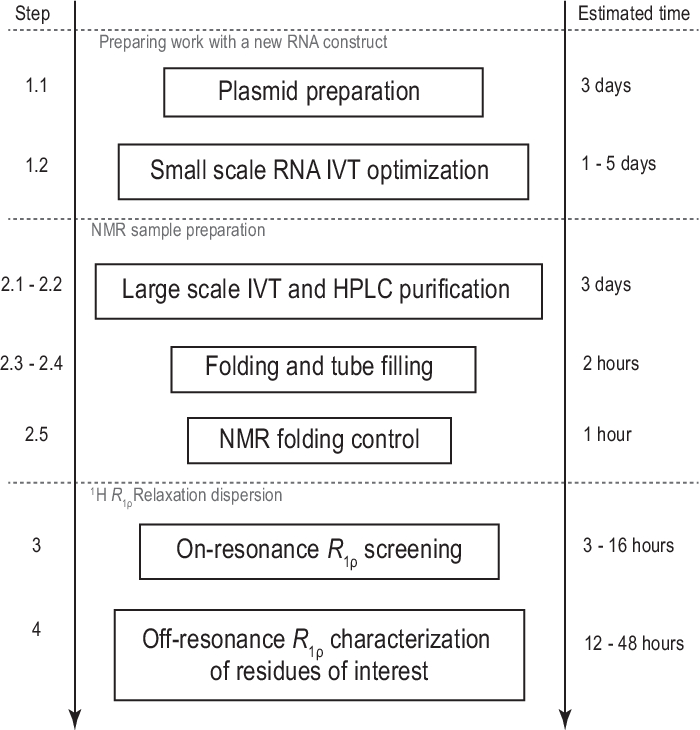
Figure 1: Workflow du protocole présenté. Préparation avant la production réelle de l’échantillon à grande échelle, consistant en la préparation du gabarit et la confirmation de la transcription in vitro réussie et du clivage RNase H. Production à grande échelle, y compris la purification HPLC, le remplissage du tube RMN et la confirmation du repliement de l’ARN. En cas de synthèse isotopique, une purification non étiquetée doit être effectuée pour l’optimisation du gradient le même jour. Caractérisation RMN de la dynamique conformationnelle avec des expériences R1ρ. Chaque étape peut être effectuée indépendamment, par exemple,l’analyse 1H R1ρ RD peut être appliquée à tout échantillon d’ARN approprié produit avec une autre méthode. Abréviations : IVT = transcription in vitro ; CLHP = chromatographie liquide à haute performance; RMN = résonance magnétique nucléaire; RD = dispersion de relaxation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’objectif de ce protocole est de fournir des détails pratiques et des paramètres critiques pour l’étude de la dynamique conformationnelle avec une dispersion de relaxation 1H R1ρ dans les molécules d’épingle à cheveux de l’ARN. Après avoir fourni un protocole détaillé de la conception, de la synthèse et de la purification HPLC par échange d’ions d’un ARN cible qui peut être effectué en utilisant tous, certains ou aucun NTP en tant que versions 13C /15N-marqués, le flux de travail de finalisation de l’échantillon RMN et de confirmation de l’échange conformationnel avec la spectroscopie RMN a été décrit. Enfin, les détails de la configuration des expériences 1H R1ρ RD sur un spectromètre RMN Bruker sont décrits (Figure 1). Le protocole donne chaque étape pour configurer la version 1D pour les échantillons étiquetés et les commentaires supplémentaires et un tableau à ajuster pour la mise en place de la version SELOPE (Tableau 2). Après le protocole, les étapes critiques et les itinéraires alternatifs vers la préparation de l’échantillon et la configuration 1H R1ρ RD sont discutés.
Protocole
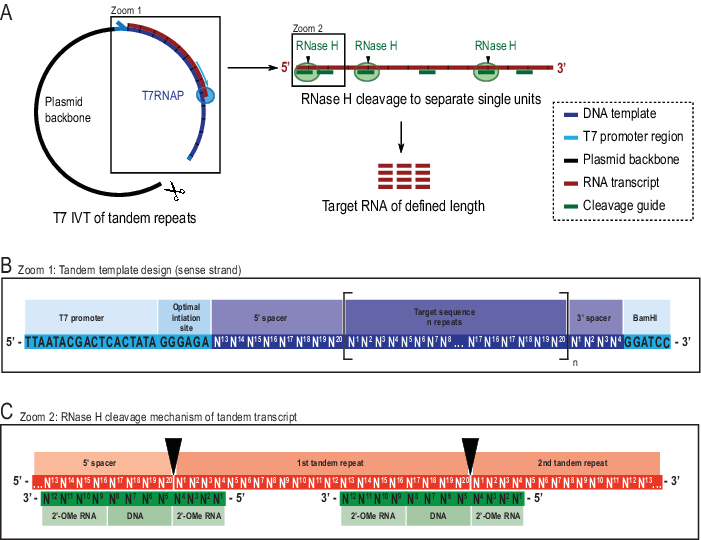
Figure 2: Représentation schématique du protocole IVT tandem rapporté. ( A )Transcriptionen tandem à partir d’un gabarit plasmidique linéarisé avec T7RNAP (à gauche) et clivage successif par L’ARNi H du transcrit pour atteindre l’ARN de longueur cible, dirigé par un guide d’ADN chimérique (à droite). (B) Schéma détaillé du gabarit tandem commençant par le promoteur viral T7RNAP, une séquence d’initiation. La séquence cible (bleu foncé, exemple ici 20 nt de long) est répétée « n » fois. Les répétitions flanquées d’une séquence d’espacement de 5′ et 3′ composées respectivement des huit derniers et des quatre premiers nucléotides, pour permettre l’élimination des séquences d’amorçage et de restriction de la première et de la dernière unité de répétition. (C) Hybridation de la transcription en tandem (rouge) et des guides de clivage chimérique (vert). La RNase H clive l’ARN opposé à l’extrémité 5′ de l’ADN. Les flancs de l’ARN 2′-OMe augmentent la spécificité en améliorant l’affinité de liaison du guide de clivage à l’ARN cible. Ce chiffre a été modifié à partir de 21. Abréviations : T7RNAP = ARN polymérase T7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation des travaux pour une nouvelle construction d’ARN
- Conception et préparation de plasmides
- Écrivez la séquence de modèles dans un outil de clonage, par exempleSerial Cloner.
- Prenez la séquence du promoteur T7 et ajoutez une séquence d’initiation à haut rendement (T7: 5'-TAATACGACTCACTATA ^GGGAGA-3').
REMARQUE: La transcription commencera au nucléotide indiqué par un caret (^). La séquence d’initiation GGGAGA est variable, mais fortement dépendante de la séquence ; par conséquent, l’utilisation de cette séquence est recommandée. - Ajouter les 8 derniers nucléotides (nt) de la séquence cible comme espaceur 5' (5'S).
- Ajoutez des répétitions de la séquence cible (TS).
- Ajouter les quatre premiers nucléotides comme espaceur 3' après les répétitions (5'S).
- Ajoutez un site de restriction BamHI (RS) ou un site de restriction unique similaire.
REMARQUE: La séquence totale telle qu’elle est montrée sera clonée ou facilement ordonnée dans un plasmide bactérien à forte copie(par exemple,pUC19): 5'-T7-5'S-(TS)n-3'S-RS-3' (Figure 2B). Le nombre de répétitions doit être aussi élevé que permis par la synthèse des gènes (un maximum de 600 nt dans ce protocole). - Amplifier le plasmide dans E. coli à l’aide d’un kit commercial.
- Linéariser le plasmide purifié à 20 ng/μL en utilisant le site de restriction approprié. La restriction d’échelle digère avec BamHI jusqu’à 1 mL.
- Purifier le plasmide digéré et confirmer la linéarisation réussie sur un gel d’agarose à 1%. Conservez le plasmide linéarisé à -20 °C pendant plusieurs mois.
- Conception du guide de clivage (Figure 2C)
- Écrivez les huit derniers nucléotides de la séquence d’ARN cible dans la direction 5'-3' et ajoutez les quatre premiers nucléotides de la séquence d’ARN cible à l’extrémité 3' également dans la direction 5'-3'.
- Générer le complément d’ADN inverse de cette séquence
- Remplacez les quatre premiers et derniers nucléotides par leurs modifications 2'-OMe en ajoutant un 'm' avant la lettre nucléotidique.
REMARQUE: Pour la synthèse, mU est utilisé à la place de mT. - Commandez l’oligo avec purification de dessalement standard.
REMARQUE: Vérifiez si l’oligo généré pourrait se lier à un autre endroit que la connexion de deux séquences d’ARN. Une complémentarité totale dans les quatre nucléotides centraux de l’ADN est nécessaire, tandis que les régions de flanquement pourraient permettre une inadéquation. Si nécessaire, étendez les flancs jusqu’à 18 nt pour générer une séquence de liaison unique36.
- IVT à petite échelle
REMARQUE: Pour un travail sans RNase, préparez tous les réactifs dans des conditions stériles et sans RNase. Utilisez le réactif de décontamination RNase (voir le Tableau des matériaux)et de l’éthanol à 95 % v/v pour nettoyer les surfaces de travail et les pipettes avant utilisation. Lavez les gants avec de l’éthanol à 95% et portez des vêtements à manches longues non pelucheux. Pour minimiser la contamination par la RNase, ne respirez pas par-dessus des tubes ouverts.- Préparer des solutions sous forme de Tris-Cl (pH 8,0), de dithiothréitol, deMgCl2,de spermidine et de NTP/GMP (sans tampon). Mélangez les réactifs comme indiqué dans le tableau 1. Préparez un mélange maître de ces réactifs à l’avance, avant l’ajout d’enzymes ou d’acides nucléiques.
REMARQUE: Si vous utilisez des réactifs congelés, mélangez-les soigneusement après la décongélation. Les réactifs peuvent précipiter s’ils sont mélangés à des concentrations trop élevées, il est donc fortement recommandé de suivre l’ordre du tableau 1. - Ajouter dans l’ordre suivant : plasmide, guide de clivage, phosphatase inorganique (IPPase), RNase H, T7RNAP. Comme l’activité enzymatique peut varier pour les enzymes produites en interne, testez plusieurs concentrations avant de choisir la meilleure.
REMARQUE : Inclure un témoin négatif de la réaction de clivage, p. ex. sans RNase H, pour attribuer une bande cible manquante au clivage défectueux de la RNase H et non à une transcription infructueuse. - Incuber la réaction à 37 °C pendant 1 h et confirmer la réaction sur une électrophorèse dénaturante sur gel de polyacrylamide (PAGE) (Figure 3A). Diluer l’échantillon 10 fois dans la solution de chargement et charger 1 μL sur le gel.
REMARQUE: Mélange de gel: 8 M d’urée, 20% d’acrylamide (19: 1 acrylamide: bisacrylamide) dans 1x TBE. Solution de chargement : 5 mM d’acide tétraacétique d’éthylènediamine (EDTA), 300 μM de bleu de bromophénol dans le formamide. On ne peut pas s’attendre à ce que les réactions de clivage de la RNase H soient complètes après 1 h, car de nouveaux ARN sont produits en permanence. À ce stade, recherchez une bande cible claire et l’absence d’une espèce de poids moléculaire similaire(p. ex.,produits nucléotidiques (nt) ±3).
- Préparer des solutions sous forme de Tris-Cl (pH 8,0), de dithiothréitol, deMgCl2,de spermidine et de NTP/GMP (sans tampon). Mélangez les réactifs comme indiqué dans le tableau 1. Préparez un mélange maître de ces réactifs à l’avance, avant l’ajout d’enzymes ou d’acides nucléiques.
| Réactif | Concentration des stocks | Quantité à petite échelle (μL) |
| H2O | - | 24 |
| Tris | 1 M | 5 |
| MgCl2 | 1 M | 0.5 |
| TNT | 1 M | 0.5 |
| Spermidine | 250 mM | 5 |
| BPF | 100 mM | 2.5 |
| ATP | 100 mM | 1.5 |
| Le | 100 mM | 1.5 |
| UTP | 100 mM | 1.5 |
| Le | 100 mM | 1.5 |
| Plasmide | 20 ng/μL | 5 |
| Guide de décolleté | 100 μM | 10 |
| iPPase | 10 mg/mL | 0.5 |
| RNase H | 10 μg/mL | 2 |
| ARN polymérase T7 | 5 mg/mL | 2 |
Tableau 1 : Tableau des réactifs pour le clivage IVT tandem et RNase H simultané. Les concentrations de stock peuvent être adaptées à la convenance del’utilisateur. Si le clivage de la RNase H doit être effectué après la T7 IVT, ajouter le guide de clivage et la RNase H après l’inactivation thermique de T7RNAP. Les quantités utilisées s’échelontent linéairement avec l’échelle de réaction. Abréviations : T7RNAP = ARN polymérase T7 ; IVT = transcription in vitro.
2. Préparation de l’échantillon RMN
- Augmentez la réaction au volume souhaité (généralement 10 mL) et exécutez la réaction pendant la nuit. Test de complétion de la réaction le lendemain avec un gel PAGE dénaturant(Figure 3A).
REMARQUE: Une réaction de clivage incomplète est montrée par des espèces de poids moléculaire plus élevé au-dessus de la bande cible.- Si le clivage n’a pas réussi ou n’a pas été complet, l’ARN réanneal et le guide de clivage dans la cuve de réaction en chauffant la solution dans une micro-ondes conventionnelle à 450 W pendant 15 s.
- Refroidir lentement la solution à 37 °C pendant 40 min. Utilisez un bloc chauffant pour les volumes inférieurs à 1 mL. Notez la formation d’un nouveau précipité.
- Ajouter plus d’IPPase et de RNase H, et incuber encore 1-3 h à 37 °C. Confirmez l’achèvement de la réaction de clivage avec la dénaturation PAGE.
- Lorsque la réaction de clivage de la RNase H est terminée, éteindre la réaction en ajoutant de l’EDTA à une concentration finale de 50 mM et un vortex à fond.
REMARQUE: La précipitation potentielle de pyrophosphate se dissoudra et de nouvelles protéines précipiteront la forme. - Filtrer la solution à travers un filtre à seringue de 0,2 μm et concentrer à un volume injectable dans un système HPLC, en fonction de la taille de la boucle d’injection.
REMARQUE: Le protocole peut être mis en pause ici en congelant l’échantillon à -20 ° C.
- Purification HPLC à grande échelle
- Préparez les tampons d’échange d’ions A et B dans la semaine suivant l’utilisation. Filtrer et dégazer les tampons.
REMARQUE: Tampon A: 20 mM d’acétate de sodium; 20 mM de perchlorate de sodium, pH 6,5. Tampon B : 20 mM d’acétate de sodium; Perchlorate de sodium de 600 mM, pH 6,5. - Équilibrez la colonne avec un tampon B à 100 % suivi d’un tampon A à 100 % pour au moins 2 volumes de colonne à 75 °C.
- Préparer la séquence CLHP(Figure 3B)à un débit de 5,5 mL/min. Utilisez la séquence suivante pour la purification d’un ARN de taille comprise entre 20 et 30 nt: 0-7 min: 0% B; 7-16 min: gradient 0-20% B; 16-46 min: élution, généralement avec un gradient de 20-30% B (optimiser selon les besoins); 46-62 min: 100% B; 62-73 min: 0% B.
REMARQUE : Un changement de débit de 5,5 à 8 mL/min n’a pas influencé la séparation dans ce protocole. - Optimiser le gradient d’élution par l’injection d’un équivalent à 1 mL de réaction de transcription (non étiquetée) à la fois.
NOTE : Pour plus de détails et de discussion, voir Karlsson et al.31 et Feyrer et al.21. - Testez les fractions collectées sur une PAGE dénaturante. Si le pic d’élution principal est bien isolé et contient l’ARN cible pur, augmentez la purification à un équivalent de 10 mL de réaction de transcription.
- Collectez les fractions d’intérêt, concentrez-les et échangez le tampon avec le tampon RMN. Utilisez une unité de filtration ultracentrifugal (voir le tableau des matériaux)pour les volumes supérieurs à 50 mL.
REMARQUE: Tampon RMN: 15 mM de phosphate de sodium; 25 mM de chlorure de sodium; 0,1 mM EDTA, pH 6,5. Pour minimiser la perte d’ARN adhérant aux parois des tubes en plastique, lavez tous les tubes de collecte avec 1 mL d’eau, de vortex et de centrifugeuse pour recueillir tout le liquide. - Déterminez la concentration par spectroscopie ultraviolette. Calculer le rendement de la réaction selon Feyrer et al21.
REMARQUE: La concentration d’un échantillon RMN pour les expériences de RD ne doit pas être inférieure à 130 nmol, ce qui correspond à 500 μM dans un volume d’échantillon de 250 μL à l’aide de tubes RMN (Tableau des matériaux).
- Préparez les tampons d’échange d’ions A et B dans la semaine suivant l’utilisation. Filtrer et dégazer les tampons.
- Repliement d’un échantillon d’ARN
- Diluer et aliquoter l’échantillon d’un volume d’environ 10 mL en 1 mL par tube.
- Chauffer les aliquotes d’ARN à 95 °C pendant 5 min.
- Refroidissez les échantillons en les plaçant sur de la glace ou dans un mélange eau-glace-sel et incubez pendant 30 min.
- Regrouper les échantillons et concentrer à ~250 μL dans une unité de filtration centrifuge de 2 mL.
- Remplissage d’un tube RMN
- Nettoyez le tube RMN dans le nettoyeur de tube RMN en rinçant avec de l’eau abondante, du réactif de décontamination RNase, de l’eau, de l’éthanol à 95% (EtOH) et de l’eau à nouveau. Laisser sécher.
- Nettoyez le piston en rinçant à l’eau et en essuyant avec un réactif de décontamination RNase et 95% EtOH à l’aide d’une lingette non pelucheuse. Laisser sécher.
- Ajouter 10 % (v/v) de D2O à l’échantillon RMN.
- Remplissez l’échantillon d’ARN dans le tube RMN à l’aide d’une grande pointe de pipette. Laissez le liquide s’écouler le long du côté de la paroi du tube.
- Insérez le piston et retirez les bulles d’air en poussant le piston vers le bas avec un mouvement de torsion rapide.
- Tirez le piston lentement vers le haut sans créer de nouvelles bulles d’air et fixez-le avec un film de cire de paraffine.
- Confirmez le pliage par RMN.
NOTE: À ce stade, il est nécessaire d’effectuer au moins une assignation de résonance partielle pour confirmer la structure secondaire de l’échantillon d’ARN et pour identifier les régions d’intérêt pour l’étude de la dynamique conformationnelle. Une description exhaustive de l’assignation de résonance d’ARN dépasserait ce protocole, c’est pourquoi nous nous référons à une littérature bien établie à ce stade19,37,38. Un test de changement de mobilité électrophorétique (EMSA) peut être un indicateur utile du repliement de l’ARN et servir de données complémentaires pour les expériences de RMN.- Comparer les spectres suivants de l’échantillon pour lequel des expériences 1H R1ρ RD sont réalisées avec l’échantillon de référence correctement plié(Figure 4): 1H 1D, en particulier la région imino 10–15 ppm ; Aromatique 1H,13C-HSQC; 1 H,1H-SELOPE (facultatif).
REMARQUE: Une empreinte aromatique est également nécessaire, même en cas d’accord entre les signaux imino, car la formation de dimères montre souvent les mêmes signaux imino ou des signaux imino similaires à ceux d’une épingle à cheveux à ARN. L’expérience SELOPE peut remplacer un C-HSQC de1 H,13pour les empreintes aromatiques, car les expériences hétéronucléaires sur des échantillons non marqués prennent beaucoup de temps. - Utilisez la boucle UUCG comme référence d’empreinte digitale (le cas échéant).
- Effectuez cette comparaison à chaquefois avant que les expériences 1 H R1ρ RD ne soient enregistrées.
- Comparer les spectres suivants de l’échantillon pour lequel des expériences 1H R1ρ RD sont réalisées avec l’échantillon de référence correctement plié(Figure 4): 1H 1D, en particulier la région imino 10–15 ppm ; Aromatique 1H,13C-HSQC; 1 H,1H-SELOPE (facultatif).
3. 1H R1ρ Dispersion de relaxation—on-résonance (version 1D étiquetée)
REMARQUE : Les étapes ci-dessous décrivent la configuration des expériences RD pour un échantillon étiqueté à l’aide de la version 1D de la séquence d’impulsions RD basée sur HSQC. Suivez les mêmes étapes pour la séquence 1D basée sur SELOPE pour les échantillons non étiquetés. Le tableau 2présente une vue d’ensemble des noms et des paramètres des paramètres pour les deux cas. L’accent mis sur les versions 1D est dû au fait qu’elles sont plus pratiques pour les mesures hors résonance, et la configuration des versions 2D des expériences SELOPE et HSQC a été discutée en détail par Schlagnitweit et al.20 et Steiner et al.10, respectivement.
- Déterminez une puissance de 1H pour une impulsion dure de 90° (P1).
- Option A : Utilisez la commande bruker pulsecal.
- Option B: Dans une expérience zg, déterminez l’impulsion à 360° en mesurant une courbe de nutation au niveau de puissance de l’impulsion dure du proton sur le pic d’eau.
REMARQUE: La longueur d’impulsion de 90 ° est un quart de la durée où un signal zéro est observé (si une courbe de nutation complète est mesurée, alors c’est le deuxième zéro; cependant, dans la pratique, seule la région autour de la valeur attendue pour le 360° est échantillonnée).
- Exécutez un spectre 1H 1D zgesgp.f2f3dec en utilisant la longueur d’impulsion déterminée à l’étape 3.1 pour confirmer le repliement de l’ARN avant chaque mesure R1ρ.
REMARQUE: Si des expériences 1H SL sont exécutées pour la première fois, vérifiez si la puissance SL calculée correspond à la puissance fournie à l’échantillon en étalonnant la puissance SL pour chaque bande passante souhaitée. Les étapes d’étalonnage détaillées sont décrites dans Steiner et al.10. - Créez un 1H R1ρ pour l’ensemble de données étiqueté et définissez les paramètres clés.
- Créer un nouvel ensemble de données; idéalement basé sur un ensemble de données HSQC aromatiques de1 H à13C utilisé sur des échantillons d’ARN entièrement marqués pour l’assignation d’ARN.
REMARQUE: Cela garantira que l’alimentation et la puissance de découplage de 13C et 15N sont déjà configurées. - Définissez les paramètres généraux conformément à la première partie du tableau 2.
- Définissez les paramètres spécifiques à RD conformément à la deuxième partie du tableau 2.
- Réglez la puissance 1H SL sur la valeur la plus basse (1,2 kHz) pour les tests.
- Générez une liste vd de test avec une seule entrée, 0 ms, (pour optimiser la liste vd, comme décrit à l’étape 3.4), définissez TDF1 sur 1 et mettez à jour D30.
- Exécutez un spectre de test avec ces paramètres.
- Créer un nouvel ensemble de données; idéalement basé sur un ensemble de données HSQC aromatiques de1 H à13C utilisé sur des échantillons d’ARN entièrement marqués pour l’assignation d’ARN.
- Optimisez la liste vd (liste des longueurs SL à utiliser).
- Exécutez l’expérience avec une liste de tests vd(par exemple,six entrées: 0 m, 5 m, 10 m, 20 m, 30 m, 40 m; brouillez ces valeurs pour éviter les erreurs systématiques dues au chauffage).
- Mettez à jour D30 et TDF1 en conséquence (dans cet exemple, D30 = 42m et TDF1 = 6).
- Tracez l’intensité du pic par rapport à la longueur SL. Identifiez la longueur SL à laquelle l’intensité du pic d’origine diminue à 1/3.
- Créez la liste vd finale à utiliser dans l’expérience, en tenant compte des éléments suivants : déterminez la longueur SL la plus longue comme décrit à l’étape précédente ; éviter d’utiliser une liste avec un ordre décroissant ou croissant; et ajouter quelques doublons pour les études statistiques. N’oubliez pas de mettre à jour D30 et TDF1 chaque fois qu’il y a des changements dans la liste vd.
REMARQUE: L’expérience est exécutée avec différentes longueurs SL comme indiqué dans la liste vd d’une manière pseudo-2D. - Sélectionnez le nombre de scans de sorte que le pic le plus faible de la liste ait un rapport signal/bruit (SINO) d’au moins 10.
REMARQUE: Bien que la liste vd ait été optimisée pour une faible puissance SL (1,2 kHz), cette liste vd doit également être testée à la puissance SL la plus élevée à utiliser(par exemple,15 kHz). En effet, la désintégration sera beaucoup plus lente à une puissance SL élevée pour les pics avec une contribution significative de kEX. Par conséquent, une désintégration suffisante doit également être vérifiée à une puissance SL élevée.
| Description du paramètre | Nom du paramètre dans la séquence d’impulsions | |
| Étiqueté 1D | 1D SELOPE | |
| programme d’impulsions pour les 1D à résonance | 1HR1rho_HCP_onres1D.es | 1HR1r_HH_onres1D.js |
| 1 Fréquences porteuses H (ppm) | O1P = résonance de l’eau en ppm | O1P = déplacement chimique du pic d’intérêt (ppm) |
| CNST28 = déplacement chimique du pic d’intérêt (ppm) | CNST29 = résonance de l’eau en ppm | |
| 1 H dur 90º impulsion | P1 @ PL1 (tel qu’étalonné dans la version 3.1.1) | P1 @ PL1 (tel qu’étalonné dans la version 3.1.1) |
| Impulsions et pouvoirs en forme pour la suppression de l’eau | P25 = 1000 us @ sp3 | P12 = 2000 us @ sp1 |
| (Watergate) | (sculpture par excitation) | |
| 13 Fréquence porteuse C, on-résonance avec décalage chimique de 13C de pic d’intérêt | O2P | – |
| 15 Fréquence porteuse N, décalage chimique moyen de 15N pour le découplage (tel qu’utilisé dans le HSQC aromatique) | O3P | – |
| 13 Découplage C/15N (mis en place comme dans HSQC) | pcpd2, cpd2 | – |
| pcpd3, cpd3 | ||
| Transfert HCP (p. ex., p=1/J @ 100 Hz) | – | |
| Les commandes pulse et pulsef2 peuvent être utilisées pour déterminer les puissances à partir d’impulsions dures | ||
| Durée (réglée sur 1/J(1 H-13 C) du pic d’intérêt) | P11 | |
| Puissance 1H et Puissance sur 13C | SP1, SP12 | |
| Transfert SELOPE (d = 1/4J(H5-H6)) | – | D5 |
| Impulsion sélective (p. ex. région aromatique) pour SELOPE (4000 us, Eburp) | – | P13 et SP4 |
| Paramètres spécifiques SL / RD: | ||
| 1 Puissance H SL, obtenue à partir d’une impulsion dure calibrée (par exemple, à l’aide de la commande d’impulsion). | Pl25 & CNST12 (1,2 – 15 kHz) | Pl24 (50 Hz – 15 kHz) |
| Liste de retard variable pour la durée SL (initialement 1 entrée, 0, optimisation décrite sous 3.1.3) | vdlist (~ 0 – 40 ms) | vdlist (~ 0 – 150 ms en raison du faible R2 dans les échantillons non étiquetés) |
| TDF1 nombre d’entrées dans la liste vd (initialement 1) | TDF1 | TDF1 |
| Compensation thermique : | ||
| D30 = plus grande valeur dans la liste vd + 2ms | D30 | D30 |
| Compensation thermique supplémentaire pour une très large gamme de SA | PL25 | |
| Paramètres spécifiques hors résonance : | ||
| programme d’impulsions pour les 1D hors résonance | 1HR1rho_HCP_offres1D.es | 1HR1r_HH_offres1D.js |
| Décalage pour les expériences hors résonance | CNST30 | CNST30 |
Tableau 2 : Vue d’ensemble des paramètres pour mettre en place des expériences 1D HCP et 1D-SELOPE 1H R1ρ. Abréviations: 1D = unidimensionnel; HCP = polarisation croisée hétéronucléaire; SELOPE = SELective Optimized Proton Experiment; ppm = parties par million; HSQC= corrélation quantique de spin hétéronucléaire; SL = verrou de rotation; RD = dispersion de relaxation
- Mise en place et acquisition d’expériences on-résonance 1H R1ρ
- Copiez l’expérience de la section 3.4 dans un nouveau dossier dans Topspin.
- Dans ce dossier, configurez des expériences à différentes forces SL, en changeant à chaque fois PL25 et CNST12. Déterminez le niveau de puissance correct pour chaque intensité SL à l’aide de la commande pulse. Utilisez des concentrations SL allant de 1,2 à 15 kHz, avec un échantillonnage plus dense pour les forces SL inférieures (voir la figure 5G pour certaines concentrations SL). Ajoutez des copies de certaines des expériences pour avoir des doublons pour certaines des forces SL.
- Exécutez ces expériences.
- Analyse des expériences on-résonance 1H R1ρ
- Dans TopSpin, traitez chaque tranche de chaque ensemble de données pseudo-2D en utilisant les mêmes paramètres de traitement(par exemple, élargissement de ligne, phase) à l’aide de la commande xf2, et divisez le jeu de données en 1D à l’aide du programme Bruker AU split2D.
- Obtenez des intensités et des volumes de signal pour chaque tranche 1D.
REMARQUE: En pratique, il est préférable de déconvoler les spectres pour se débarrasser des contributions des pics qui se chevauchent potentiellement et permet l’utilisation du programme Bruker AU multidcon, qui résume commodément les intensités ou les zones des pics de toutes les tranches dans une expérience dans le fichier texte decall.txt, qui peut ensuite être lu facilement avec d’autres programmes (des scripts Python écrits en interne ont été utilisés ici, comme décrit par Steiner et al.10) dans les étapes 3.6.3 et 3.6.4. - Ajuster une désintégration mono exponentielle pour chaque force SL afin d’obtenir la valeur R1ρ (ou résonance, R2+REX).
- Tracez ces valeurs R2+REX (y) par rapport à. Résistance SL (x) (Figure 5F, G).
REMARQUE: Si les valeurs sont significativement plus élevées pour les faibles forces SL et diminuent avec une puissance SL plus élevée (comme le montre la figure 5G),alors le pic étudié montre la dispersion, et il peut être intéressant de mener des expériences supplémentaires (hors résonance) pour obtenir des informations sur la population et la différence de décalage chimique de l’état excité vs. l’état de base.
4. 1H R1ρ Dispersion de relaxation – hors résonance (version 1D étiquetée)
- Mise en place et acquisition d’expériences hors résonance 1H R1ρ
- Dans un nouveau dossier topspin, mettez en place des expériences à une certaine force SL (généralement d’abord à la force SL la plus faible car la contribution REX y est la plus élevée, voir figure 5G pour une sélection représentative de SL hors résonance), mais avec des décalages différents, changeant à chaque fois CNST30.
- Utilisez des décalages jusqu’à ± (3 ou 4) * SL, avec un échantillonnage plus dense autour de 0 décalage, comme on peut le voir à la figure 5H,I.
- Exécutez ces expériences.
- Analyse des expériences hors résonance 1H R1ρ
- Utilisez la même stratégie de traitement, comme dans 3.6.1–3.6.3, pour déterminer une valeur R1ρ pour chaque décalage.
- Tracez ces valeurs par rapport au décalage ( Figure5G).
REMARQUE: Une asymétrie dans cette courbe peut déjà indiquer que des informations de décalage chimique pour l’état excité peuvent être obtenues. Un ajustement et une analyse approfondis à l’aide d’équations de Bloch-McConnell ou de Laguerre doivent être effectués pour obtenir des informations sur kEX, pES ainsi que Δω10,20 ( Figure5G). Des exemples de jeux de données, de programmes d’impulsions et de macros pour les deux expériences 1D sont disponibles sur le référentiel Github de Petzold Lab (https://github.com/PetzoldLab). Un aperçu des paramètres est donné dans le tableau 2.
Résultats
Le protocole de production d’ARN facilite la purification grâce à la génération de transcriptions de haute pureté. La figure 3A montre les résultats de plusieurs réactions de clivage des transcriptions en tandem, fournissant à la fois des réactions réussies et infructueuses. La voie 1 montre le cas optimal d’une transcription entièrement clivée avec seulement de faibles traces de produits secondaires. La voie 2a montre un clivage incomplet, qui peut être résolu par recuit et l’ajout de plus de RNase H (voie 2b, étape 2.1.2). Les constructions d’ARN des voies 1, 2a et 2b sont les mêmes. L’échantillon de la voie 3 montre un clivage infructueux. Le dépannage de cette réaction impliquerait une vérification de la séquence du guide de clivage, de la pureté du gabarit d’ADN et des températures de recuit. Potentiellement, le clivage de la RNase H devra être effectué après T7 IVT comme indiqué pour l’échantillon 2.
L’échantillon de la voie 4 montre une quantité importante de produits latéraux de clivage, qui sont difficiles à éliminer via la CLHP par échange d’ions. Le dépannage d’un tel échantillon peut impliquer (a) l’abaissement de la température, de la quantité de RNase H ou du temps de réaction, (b) la réduction du gradient d’élution et du volume d’injection et la tentative de séparer les fractions cibles des produits secondaires. Karlsson et al.31ont discuté de plus amples informations sur la façon d’augmenter la résolution dans la purification HPLC par échange d’ions. La CLHP sépare l’ARN cible des acides nucléiques plus ou moins longs et des contaminants protéiques ou à petites molécules. La figure 3B montre le résultat optimal pour la purification HPLC par échange d’ions. Le gradient d’élution doit être choisi de telle sorte que l’espèce d’ARN cible élue au moins un volume de colonne (dans cet exemple : 35 mL) après les espèces plus petites suivantes et un volume de colonne avant les espèces plus grandes suivantes.
Les espèces plus petites dans cette méthode comprennent les nucléotides simples, les produits abortifs (8-12 nt), les séquences d’espacement 3' et 5' (5-14 nt) et le guide de clivage (acide nucléique chimérique 12 nt), tandis que les séquences plus longues sont des répétitions tandem potentiellement des répétitions en tandem et le plasmide. Lorsqu’un pic d’élution bien séparé est atteint, la purification peut être mise à l’échelle jusqu’à l’équivalent d’environ 20 mL de réaction IVT par injection. Le pli correct d’un échantillon d’ARN est crucial pour les expériences de RD et doit être confirmé avant chaque mesure. La figure 4 montre un ARN 22-mer marqué A avant l’application du protocole de pliage de l’étape 2.4 (bleu) et le même échantillon une fois le pliage correct obtenu (rouge). Une prédiction de structure secondaire Mc-Fold(Figure 4C)propose la structure en épingle à cheveux présentée avec 4 paires de bases résultant en 5 signaux imino.
Les deux spectres de la figure 4A confirment ces signaux prédits, bien qu’avec des intensités relatives légèrement différentes, ce qui indique qu’une structure mal repliée (ici, un dimère) peut être problématique à évaluer avec seulement 1spectre H 1D. Un spectre aromatique 1H,13C-HSQC(Figure 4B),cependant, ne montre que 3 des signaux aromatiques pour l’échantillon avant le protocole de pliage (bleu), mais les 4 signaux pour l’échantillon qui a été plié selon l’étape 2.4 (rouge). L’échantillon représenté en bleu a probablement formé un homodimère (structure proposée à la figure 4D)qui entraînerait les mêmes signaux imino que l’épingle à cheveux. Le signal de l’A13H2 semble élargi à l’échange. Ces résultats aident à souligner l’importance de la confirmation du pliage avec des expériences d’empreintes digitales imino et aromatiques avant chaque expérience rd. Les séquences d’impulsions 1H R1ρ décrites dans ce protocole permettent la détection de la dynamique dans le régime d’échange intermédiaire. Initialement, une courbe de résonance est enregistrée, et si une dynamique est présente pour un résidu spécifique, une dispersion est visible dans les valeurs R2+REX obtenues, tandis que cette courbe est plate pour les résidus sans échange.
La figure 5 montre des courbes représentatives de résonance obtenues pour deux atomes H8 différents dans une épingle à cheveux à ARN synthétique (Figure 5A), dans laquelle G6H8 expérimente l’échange (Figure 5C), alors que A4H8 ne le fait pas (Figure 5B). Comme l’échange est relativement lent dans cet échantillon(kEX = 292 ± 40 Hz), l’avantage de l’expérience SELOPE d’obtenir de faibles forces SL a été exploité, et les deux courbes de résonance ont été enregistrées à l’aide de la version 1D de la séquence d’impulsions. La même séquence d’impulsions a ensuite été utilisée pour obtenir des données hors résonance pour le résidu montrant une dispersion dans le profil de résonance. La figure 5D montre les valeurs R1ρ obtenues par rapport au décalage dans lequel une légère asymétrie de la courbe indique déjà le signe de Δω.
Cela devient encore plus évident dans le diagramme R2+ REX où la contribution R1 est supprimée(Figure 5E). La colonne de droite de la même figure montre des courbes de résonance représentatives obtenues pour deux atomes H8 différents dans une épingle à cheveux à ARN synthétique légèrement différente avec un échange plus rapide, dans laquelle G6H8 expérimente l’échange (Figure 5G), alors que A4H8 ne le fait pas (Figure 5F). Le taux de change plus rapide(kEX = 43 502 ± 38 478 Hz) a permis l’enregistrement RD de tous les protons aromatiques à la fois en utilisant la version SELOPE 2D pour obtenir à la fois des données de résonance et de résonance (données G6H8 affichées à la figure 5H,I).
Identificateurs généraux des résultats positifs et négatifs
Les résultats positifs dans le clivage tandem IVT et RNase H peuvent être identifiés comme suit: 1) La bande cible est la bande la plus forte dans le gel PAGE dénaturant. 2) Il n’y a pas ou seulement des bandes faibles autour de la bande principale. 3) Il n’y a pas ou seulement des espèces faibles de poids moléculaire supérieur. 4) Le chromatogramme HPLC montre un pic bien séparé de l’ARN cible. 5) Lorsque le pic principal est échantillonné, une seule bande apparaît sur un gel PAGE dénaturant.
Les résultats négatifs dans le clivage tandem IVT et RNase H sont les suivants: 1) Aucune ou juste une bande principale faible n’est visible sur un gel PAGE dénaturant. 2) Un motif d’espèces de haut poids moléculaire provenant de répétitions en tandem d’ARN est visible. 3) Bien que la bande principale soit présente, les bandes d’intensité similaire sont supérieures ou inférieures à la bande principale dans ± 3 nt.
Un échantillon bien plié peut être identifié comme suit : 1) Le nombre de protons imino observés correspond au nombre de protons imino attendus d’une simulation de structure secondaire(par exemple,Mc-Fold39, Figure 4A). 2) La paire de bases oscillantes syn G-U dans une boucle UUCG (le cas échéant) est visible à ~9,5 ppm, parfois seulement visible à basse température. D’autres empreintes digitales de la boucle UUCG ont été décrites par Fürtig et ses collègues40. 3) L’empreinte aromatique concorde avec un échantillon précédemment attribué dont il a été confirmé qu’il se pliait correctement(Figure 4C).
Un échantillon mal replié ou dégradé peut être identifié comme suit: 1) Il y a plus de signaux imino qu’une simulation de structure secondaire ne le prédit (REMARQUE: moins de signaux imino n’impliquent pas nécessairement un mauvais repliement, car les paires de bases de fermeture ne sont souvent pas visibles et l’échange conformationnel élargit les lignes). 2) Absence de signaux imino. 3) Signaux étroits de haute intensité dans la région aromatique, indiquant des produits de dégradation mononucléotidiques. 4) Divergence entre les signaux imino ou aromatiques à un échantillon de référence de pliage confirmé (Figure 4C).
Un atome ne montrant aucun échange dans l’échelle de temps détectable peut être identifié comme suit: 1) à partir d’un profil RD plat (en raison de la contribution REX manquante variant avec la puissance SL appliquée)(Figure 5B et Figure 5F). 2) Il faut faire attention au cas d’échange lent-intermédiaire lorsque kEX et Δω sont de même ampleur. Dans ce cas, la contribution à la résonance peut être très faible comme on peut le voir à la figure 5C (dans ce cas, les paramètres ajustés sont kEX = 292 ± 40 Hz et Δω = 112 ± 4 Hz). En cas de doute, une faible courbe de résonance SL peut être enregistrée pour vérification.
Un atome montrant un échange dans l’échelle de temps intermédiaire peut être identifié 1) à partir d’un profil de dispersion de relaxation non plat dans une expérience RD à résonance(Figure 5B et Figure 5F); 2) une largeur de ligne plus large dans l’expérience HSQC ou SELOPE peut également être un indicateur d’échange.
Les valeurs de puissance SL bien sélectionnées pour les courbes hors résonance(Figure 5E,F): 1) ont une contribution k EX considérable dans la courbe de résonance (les valeurs de puissance SL sélectionnées sont indiquées à la Figure 5C et à la Figure 5G). 2) Comme les courbes hors résonance sont mesurées pour au moins 3 valeurs de puissance SL, les valeurs de puissance SL sélectionnées doivent être réparties sur la région de la courbe de résonance avec une contribution kEX. 3) Conduire à des courbes R2+REX non plates après l’ajustement de Laguerre(par exemple, Figure 5D: Forces SL 25, 50 et 75 Hz; Figure 5E).
Des valeurs de puissance SL mal sélectionnées pour les courbes hors résonance(Figure 5E,F)conduisent à des courbes plates R2+REX après l’ajustement de Laguerre. Un exemple est montré à la figure 5E, dans lequel la courbe hors résonance de 100 Hz est très plate et ne fournit donc pas d’informations significatives sur Δω.
Indications pour les artefacts nucléaires à effet Overhauser (ROE) à cadre rotatif: 1) Δω obtenu à partir de courbes hors résonance correspondent aux décalages chimiques des protons dans le voisinage spatial / protons, qui montrent un pic croisé avec le pic d’intérêt dans le spectre de spectroscopie nucléaire à effet Overhauser (NOESY). (Par exemple,la figure 5I montre de larges courbes hors résonance comme prévu pour l’échange rapide-intermédiaire, mais les courbes ont également des caractéristiques plus nettes, par exemple,à -3000 Hz et +1500 Hz. Ceux-ci sont très probablement dus à un artefact ROE plutôt qu’à un changement chimique pour ce H8 dans un conformateur différent). 2) L’ajustement de Laguerre fonctionne, mais ne fonctionne pas bien (donne des erreurs élevées ou des valeurs physiquement impossibles) pour une résonance on-résonance et au moins 3 courbes hors résonance, même si des exponentielles ont été obtenues à partir d’expériences avec sino élevé (>20)(par exemple, kEX = 43 502 ± 38 478 Hz). Souvent, chaque SL s’adapte bien individuellement, mais les assembler donne une erreur beaucoup plus élevée; le comportement inverse est attendu pour un véritable état excité.
Indications pour l’échange « vrai » Δω: 1) Δω obtenu à partir de courbes hors résonance ne correspondent pas aux décalages chimiques des protons dans le voisinage spatial/protons, qui montrent un pic croisé avec le pic d’intérêt dans le spectre NOESY(par exemple, Figure 5E). 2) L’ajustement de Laguerre donne de faibles erreurs pour une résonance on-résonance et au moins 3 courbes hors résonance(par exemple, Figure 5E vs. Figure 5I, voir légende pour les résultats d’ajustement).
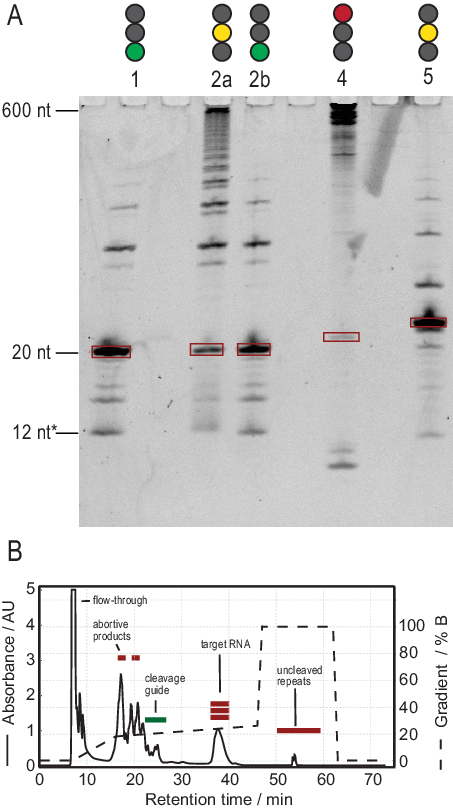
Figure 3: Production d’échantillons par réaction de clivage ivT et RNase H en tandem T7. (A) Dénaturation PAGE des résultats positifs et négatifs du clivage tandem IVT et RNase H. La hauteur de l’échelle fait référence aux références d’ARN, 12* fait référence au guide de clivage chimérique. Voie 1 : Génération réussie d’un ARN cible de 20 nt. Peu de produits plus courts et plus longs sont présents. Voie 2a : Clivage incomplet de la transcription en tandem. Bien que la purification HPLC soit possible, beaucoup de matériaux seraient gaspillés. Voie 2b : Le clivage RNase H continu de la voie 2 produit un échantillon propre prêt pour l’injection HPLC (identique à la voie 1). Voie 4 : Le clivage de la RNase H a été en grande partie infructueux et aucune bande cible n’a été produite. La transcription en tandem pleine longueur est toujours visible à 600 nt. Voie 5 : Une bande cible a été produite, mais une forte bande -1 est présente. Bien que la CLHP puisse être effectuée, un retrait minutieux du produit secondaire est nécessaire. (B) Exemple d’injection HPLC réussie. Le pic à 38 min contient de l’ARN pur de la longueur cible, tandis que les produits plus longs et plus courts sont bien séparés de l’ARN cible. Le panneau B a été modifié à partir du 21. Abréviations : IVT = transcription in vitro ; CLHP = chromatographie liquide à haute performance; nt = nucléotides; AU = unités arbitraires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
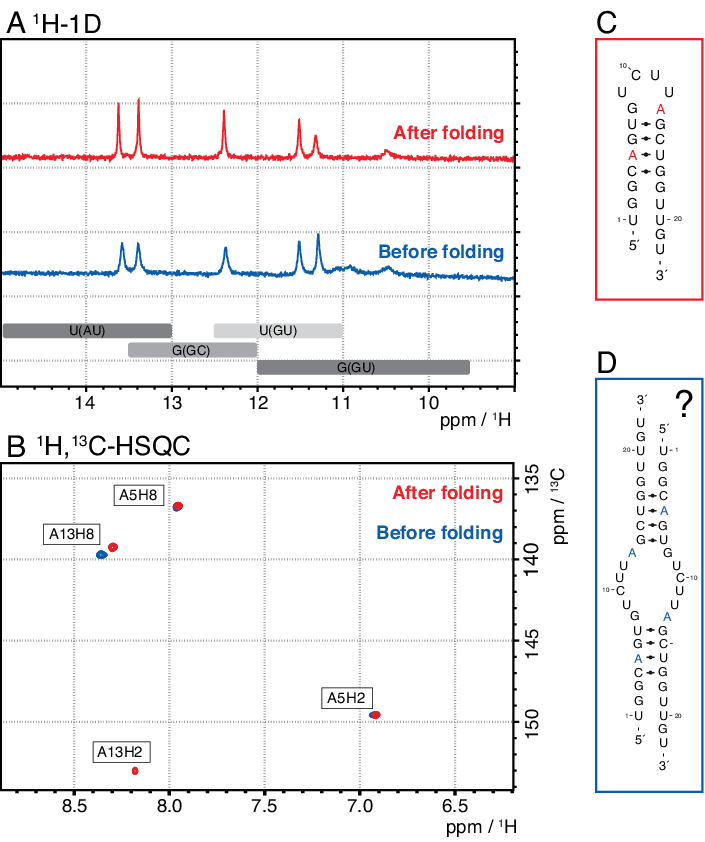
Figure 4: Exemple d’une épingle à cheveux à ARN avant (bleu) et après (rouge) l’étape de pliage 2.4 (voir protocole) en RMN. (A) Région Imino d’un spectre 1H-1D d’un ARN 22-mer marqué A. Les régions attendues pour l’identité de la paire de bases des signaux imino sont indiquées en gris ci-dessous. (B) 1H,13spectre C-HSQC des résonances aromatiques de l’ARN du panneau A. L’échantillon après pliage (rouge) montre 4 signaux comme prévu, tandis que l’échantillon avant pliage (bleu) ne montre que 3 signaux. (C) Prédiction Mc-Fold de l’ARN 22-mer en épingle à cheveux. Cinq signaux imino sont à prévoir de cette structure secondaire, que l’on peut trouver dans les deux échantillons du panneau A. (D) Structure proposée d’un homodimère formé par l’ARN 22-mer, résultant en les mêmes 5 paires de bases que la structure en épingle à cheveux. Abréviations : RMN = résonance magnétique nucléaire; 1D = unidimensionnel; HSQC = corrélation quantique unique hétéronucléaire; ppm = parties par million. Veuillez cliquer ici pour voir une version agrandie de cette figure.
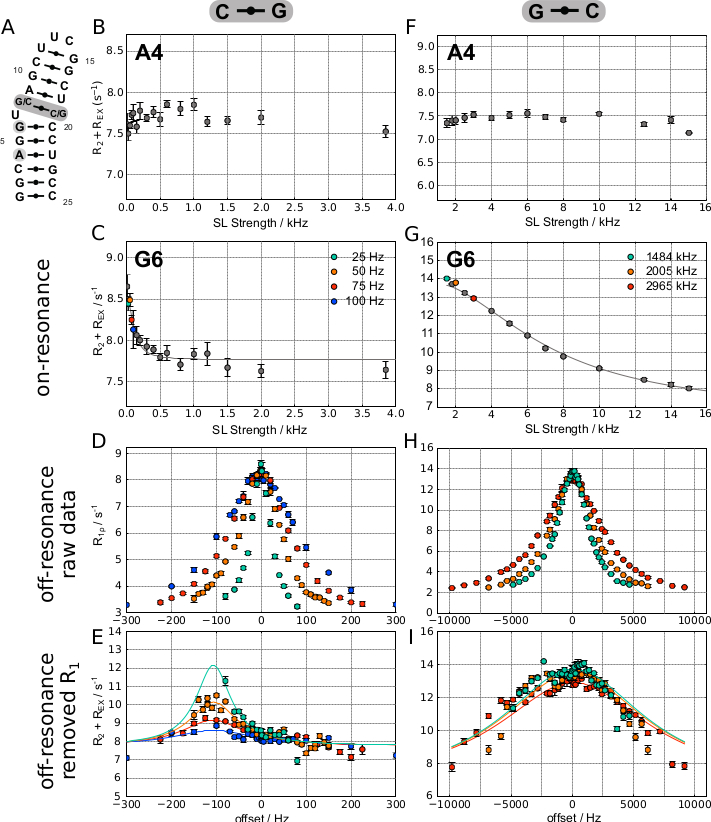
Figure 5: 1H R1ρ RÉSULTATS REPRÉSENTATIFS DE RD pour deux constructions différentes basées sur une épingle à cheveux à ARN. (A) La colonne de gauche montre les résultats obtenus sur l’ARN avec une paire de bases C-G au-dessus du U bombé, tandis que la colonne de droite montre les résultats obtenus sur un échantillon où la paire de bases a été basculée en G-C à la place. (B) et (F) montrent des profils de dispersion plats tels qu’obtenus pour A4H8 pour les deux constructions, indiquant qu’il n’y a pas d’échange conformationnel. (C–E) montrent les données on-résonance, off-resonance et ajustées obtenues pour G6 dans la construction (G-C). L’ajustement de Laguerre conduit au résultat suivant : R1 = 2,87 ± 0,01 Hz, R2 = 7,76 ± 0,03 Hz, kEX = 292 ± 40 Hz, pES = 0,31 ± 0,03 %, Δω = 112 ± 4 Hz. (G–I) montrent des données on-résonance, hors résonance et ajustées obtenues pour G6 dans la construction (G-C). L’ajustement de Laguerre conduit au résultat suivant : R1 = 1,93 ± 0,02 Hz, R2 = 6,71 ± 0,86 Hz, k EX = 43 502 ± 38 478 Hz, p ES = 27 ± 16 %, Δω = 203 ± 166 Hz. Ce chiffre a été modifié à partir de 20. Abréviation : SL = spin lock. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le protocole présenté ici est une synthèse de plusieurs protocoles publiés précédemment sous la forme d’articles de recherche10,20,21,31. Par conséquent, des segments du protocole peuvent être appliqués, tandis que d’autres peuvent être échangés à la préférence du lecteur. Par exemple, les mesures R1ρ peuvent être effectuées sur un échantillon d’ARN produit avec n’importe quelle méthode, étant donné que le repliement et l’homogénéité de la longueur sont supposés. En outre, le protocole ne contient pas d’informations sur l’assignation de résonance de la séquence d’ARN - une étape requise pour les expériences de RD - car cela a été largement couvert dans la littérature précédente19,37,38. Les schémas d’étiquetage partiels, segmentaires ou spécifiques au site36,41,42,43,44 sont des approches visant à faciliter l’assignation de résonance ou à réduire le chevauchement des résonances qui présentent un intérêt dans les expériences de RD et qui ont été décrites en détail dans la littérature. Cette méthode permet l’utilisation d’un étiquetage uniforme de toute identité nucléotidique, ce qui peut déjà simplifier considérablement l’attribution de la résonance.
La méthode IVT présentée ici surmonte les problèmes connus liés aux séquences et à l’étiquetage, augmente le rendement et réduit le coût et le temps de travail par rapport aux autres méthodes. L’utilisation de la séquence d’initiation virale réduit le besoin d’optimisation de la réaction, qui est un problème connu dans le domaine qui peut prendre beaucoup de temps à effectuer et ne donne que quelques copies de la transcription dans le cas d’une initiation non-G. Le clivage T7 IVT et RNase H du transcript en tandem peut être effectué simultanément dans le même récipient. Un motif de répétitions en tandem multimérique peut être vu sur un gel PAGE dénaturant pendant la réaction, qui fusionne en une seule bande sur l’ARN cible à la fin de la réaction RNase H(Figure 3A,voies 1 et 2b). Les rendements typiques utilisant cette méthode varient entre 30 et 70 nmol d’ARN par 1 mL IVT. Pourtant, la méthode basée sur le clivage RNase H des répétitions en tandem ne vient pas sans certains problèmes qui lui sont propres. La réaction de clivage de la RNase H n’est souvent pas terminée lorsqu’elle est exécutée simultanément avec la transcription T7(Figure 3A,voie 2a).
La séparation des unités tandem peut être finalisée en recuit le guide de clivage à la transcription et en ajoutant plus de RNase H(Figure 3A,voie 2b, étape 2.1.2). Comme le chauffage de grands volumes est lent et conduit à une hydrolyse de l’ARN catalysée par Mg2+,un four à micro-ondes conventionnel a été utilisé, qui chauffe l’échantillon à >95 °C en 10-15 s. Aucun effet indésirable sur les échantillons produits n’a été observé jusqu’à présent. Certaines constructions montrent une seconde bande mineure qui n’a pas pu être éliminée par l’optimisation des conditions de réaction(Figure 3A,voie 4). Habituellement, ceux-ci sont assez clairement visibles comme une épaule dans le chromatogramme HPLC, si un gradient d’élution bien optimisé est utilisé, et peuvent être retirés (étape 2.2.5). La discussion suivante vise à mettre en évidence les étapes critiques du protocole, en particulier en ce qui concerne l’obtention de données de haute qualité qui permettent une interprétation de la dynamique conformationnelle.
Contamination par la RNase
Les RNases extracellulaires sont omniprésentes, très stables et constituent la plus grande menace pour la stabilité à long terme des échantillons RMN. Par conséquent, il est crucial de travailler dans un environnement sans RNase et de garder tous les réactifs et les articles en plastique sans RNase. L’utilisation d’embouts filtrants et peut-être même de masques faumaux est recommandée. Ceci est particulièrement important après la purification HPLC. Les échantillons RMN contaminés par des RNases présentent généralement des pics étroits visibles dans les spectres 1H-1D après des jours ou des semaines en raison de produits de dégradation mononucléotidiques. Un tel échantillon ne convient pas aux mesures R1ρ.
Échantillon RMN
En raison de sa nature très chargée, l’ARN peut être utilisé à des concentrations élevées sans précipitation par rapport à la plupart des protéines. L’utilisation de tubes RMN Shigemi (voir le tableau des matériaux)est avantageuse car ils permettent de centrer l’échantillon hautement concentré au centre de la bobine tout en offrant des conditions idéales de calage et de verrouillage en raison du fond et du piston en verre assortis à la susceptibilité. De cette façon, l’inhomogénéité B1 est réduite, donnant lieu à des lignes plus étroites. Le volume d’échantillon typique dans un tube RMN est de 250 μL et la concentration typique est de 1 à 2 mM. Les échantillons inférieurs à 500 μM ne sont pas recommandés pour les expériences de RD car l’expérience prendrait trop de temps et une bonne cale. De même, un volume d’échantillon inférieur à 200 μL n’est pas recommandé car une bonne cale et une bonne stabilité du champ (verrouillage) sont requises. Lors de l’insertion du piston, il est crucial d’éviter la formation de bulles dans l’échantillon (étape 2.4.5). S’il n’est pas fixé correctement, le piston peut glisser vers le bas dans l’échantillon, réduisant ainsi le volume détectable. De plus, des changements rapides de température peuvent entraîner la formation de nouvelles bulles dans l’échantillon. Par conséquent, des précautions doivent être prises lors du transport de l’échantillon et lors du changement de la température de la sonde dans le spectromètre RMN. Vérifiez la quantité de bulles dans l’échantillon lorsque vous mesurez à nouveau après une période plus longue.
Repliement de l’ARN
Les molécules d’ARN dynamiques peuvent exister en plusieurs conformations lorsqu’elles ne sont pas pliées correctement. Même si les températures de fusion des structures secondaires ne peuvent être que légèrement supérieures à la température ambiante, une procédure de chauffage et de refroidissement par encliquetage approfondie est recommandée avant la mesure. Les échantillons en épingle à cheveux hautement concentrés qui se replient sous contrôle cinétique (chauffage et refroidissement par encliquetage) peuvent former des homodimères au fil du temps, ce qui nécessite un contrôle rigoureux du repliement de l’ARN avant chaque mesure RMN. Si l’ARN mesuré n’est pas une structure en épingle à cheveux mais un duplex d’ARN, un repliement lent sous contrôle thermodynamique doit être appliqué.
Dans ce cas, le processus de refroidissement après chauffage doit être de l’ordre de quelques heures, tandis que l’ARN est utilisé à son volume final et à sa concentration dans l’échantillon RMN. Un décompte initial des résonances imino et aromatiques attendues peut donner un aperçu de l’homogénéité de l’échantillon. Si l’échantillon ne ressemble pas à ce qui était prévu, il doit être replié. Mg2+ (ajouté sous forme de sel de chlorure) peut aider à replier les structures d’ARN45. En pratique, le contrôle de pliage sert de comparaison avec un échantillon qui a été utilisé pour attribuer au moins partiellement les résonances RMN et pour résoudre expérimentalement la structure secondaire.
Considérations relatives à l’alimentation et au chauffage du verrouillage par essorage
Dans le cas de l’exécution des expériences 1H R1ρ RD en tant qu’expériences de vue d’ensemble 2D, la puissance SL ne doit pas être inférieure à 1,2 kHz. La fréquence de l’émetteur de radiofréquences doit être placée au milieu de la région ppm des pics d’intérêt(par exemple,7,5 ppm pour les protons aromatiques). La bande passante de 1,2 kHz sera alors suffisamment grande pour verrouiller ces protons sans effets majeurs de hors résonance. De tels effets peuvent être identifiés dans le profil RD. Si elles se produisent, les valeurs R2+REX augmentent au lieu de diminuer avec l’augmentation des valeurs de puissance SL, en particulier pour une faible puissance SL. Vérifiez si les valeurs de puissance SL calculées correspondent à la puissance fournie à l’échantillon. En pratique, la puissance SL calculée peut être utilisée si l’impulsion dure de 1H 90° a été calibrée avec soin sur des spectromètres plus récents; cependant, cela peut être vérifié en étalonnant la puissance SL pour chaque bande passante souhaitée.
La gamme de puissance SL, qui peut être utilisée dans les expériences 1H R1ρ RD, est très large, ce qui conduit à un chauffage variable de l’échantillon (1,2 kHz à 15 kHz pour HSQC pour les séquences HCP et 50 Hz à 15 kHz pour les expériences SELOPE). Un échauffement inégal de l’échantillon peut être détecté comme un léger changement de décalage chimique lors de la comparaison des 1D obtenus pour les FL de faible puissance par rapport à. SA haute puissance. Cet effet n’est généralement pas pris en compte dans les compensations thermiques dans les expériences R1ρ sur les hétéronucléi. La compensation thermique dans ces expériences est généralement configurée pour corriger différents échauffements en raison des différentes durées de verrouillage de spin spécifiées dans la liste vd de chaque série de puissance de verrouillage de spin. En particulier pour l’expérience SELOPE, une deuxième compensation thermique doit être utilisée pour toutes les forces SL appliquées, comme décrit au20.
Considérations relatives à la liste vd
Comme mentionné précédemment, la liste vd doit contenir un point temporel suffisamment long pour obtenir une décroissance significative de l’intensité (idéalement jusqu’à 30% du signal initial, ou aussi bas que possible s’il n’est pas possible d’atteindre une désintégration de 70% dans les spécifications de la sonde). Bien que la liste vd ait été optimisée pour une faible puissance SL (1,2 kHz), cette liste vd doit également être testée à la puissance SL la plus élevée à utiliser(par exemple,15 kHz). Cela est dû au fait que, pour les pics avec une contribution REX significative, la désintégration sera beaucoup plus lente à une puissance SL élevée. Ainsi, une désintégration suffisante doit également être vérifiée à une puissance SL élevée. La même chose doit être prise en compte pour les désintégrations à des décalages élevés dans les expériences hors résonance. Le point de temps maximal idéal de la liste vd pourrait être significativement différent pour les différentes régions de l’expérience de dispersion. Dans ce cas, plus de points pourraient être inclus dans la liste vd, et les points de liste vd plus longs pour une puissance SL plus élevée ou des décalages plus élevés pendant l’analyse, en fonction du faible SINO auquel ils conduiront, pourraient être ignorés. En général, 5 à 8 points de liste vd doivent être considérés pour être en mesure de repérer les artefacts potentiels conduisant à des désintégrations non exponentielles telles que le couplage J (voir ci-dessous).
1D- Considérationsrelatives à la sélectivité des HCP
Une attention particulière doit être prise lors de l’exécution de la version 1D basée sur HCP s’il y a un autre pic chevauchant le pic d’intérêt dans la dimension 1H de l’expérience 2D basée sur HSQC. Les transferts basés sur HCP sont très, mais jamais sélectifs à 100%, et il peut donc arriver qu’un autre pic contribue à l’intensité et au comportement de désintégration du pic d’intérêt dans le 1D. Une indication de ceci serait une différence dans les valeurs R1ρ de résonance obtenues à l’aide des versions 1D et 2D de l’expérience étiquetée.
Considérations relatives au RE :
Pour les courbes hors résonance d’atomes à échange lent-intermédiaire, les artefacts ROE peuvent être identifiés sur la base d’une comparaison du Δω obtenu avec un spectre NOESY ou ROESY. Si un pic croisé peut être identifié à une différence de décalage chimique correspondant à Δω, alors l’état excité observé pourrait en fait être un artefact ROE(par exemple,des ROE ont été trouvés entre des protons aromatiques, qui sont tous dans la même plage de décalage chimique et donc couverts par ces courbes hors résonance20). D’après l’expérience, cela a toujours conduit à de mauvais ajustements avec de grandes erreurs, peut-être en raison du ROE ne suivant pas le même modèle que REX avec une puissance SL croissante. La situation devient plus difficile pour les échanges intermédiaires-rapides. Alors que la courbe on-résonance est (par comparaison avec les données 13C obtenues sur le noyau voisin) toujours représentative du processus d’échange entre le GS et l’ES, la courbe hors résonance est influencée par de multiples artefacts ROE.
Dans ce cas, la puissance SL pour détecter le processus d’échange est plus grande (>1,5 kHz) et couvre donc un plus grand nombre de protons car les courbes hors résonance s’étendent sur les différences de décalage chimique de divers candidats ROE (pour H8, ce seraient: les protons aminés à environ ± 1000 Hz, H5 / H1 à environ -1200 Hz, les protons imino à environ 3500 Hz). Jusqu’à présent, aucune méthode n’a été trouvée pour supprimer ces artefacts ROE (autre que l’utilisation de nucléotides partiellement deutérés46), et les données hors résonance ne doivent pas être enregistrées pour l’échange rapide-intermédiaire, car aucune information fiable sur le Δω réel ne peut être extraite avec cette méthode, si la contribution NOE / ROE ne peut pas être exclue via les spectres NOESY.
Considérations relatives au couplage J (Hartmann-Hahn)
Bien que les courbes de résonance pour les protons homonucléaires couplés en J, tels que H6, aient été enregistrées avec succès10,20, une attention particulière doit être prise pour les mesures hors résonance, en particulier pour la faible puissance SL car les conditions d’appariement Hartmann-Hahn peuvent couvrir une large gamme de décalages étudiés. Les artefacts de Hartmann-Hahn peuvent être identifiés comme des oscillations sur la désintégration exponentielle ou l’augmentation des valeurs R2+REX avec des forces SL croissantes dans les diagrammes RD à résonance20.
Déclarations de divulgation
K.P. est consultant pour Arrakis Therapeutics, une société qui découvre de petites molécules ciblant l’ARN.
Remerciements
Nous remercions l’installation de science des protéines (PSF) du Karolinska Institutet pour l’expression et la purification de l’ARN polymérase T7 et de la RNase H d’E. coli, Martin Hällberg pour le don généreux de la phosphatase inorganique et l’ensemble du Petzoldlab pour de précieuses discussions. Nous remercions Luca Retattino pour la préparation des constructions U-bulge et Emilie Steiner et Carolina Fontana pour leur contribution aux macros et aux scripts d’ajustement. Nous reconnaissons l’Institut Karolinska et le Département de biochimie médicale et de biophysique pour le soutien de l’achat d’un spectromètre de 600 MHz et le financement de la position (KI FoAss et KID 2-3707/2013). Nous remercions Vetenskapsrådet (#2014-4303), Stiftelsen för strategisk Forskning (ICA14-0023 et FFL15-0178) et The Ragnar Söderberg Stiftelse (M91-14), Harald och Greta Jeansson Stiftelse (JS20140009), Carl Tryggers stiftelse (CTS14-383 et 15-383), Eva och Oscar Ahréns Stiftelse, Åke Wiberg Stiftelse (467080968 et M14-0109), Cancerfonden (CAN 2015/388), J.S. reconnaît le financement par le biais d’un Projet Marie Skłodowska-Curie IF (EU H2020, MSCA-IF n° 747446).
matériels
| Name | Company | Catalog Number | Comments |
| 40% Acrylamide/Bis Solution | Bio-Rad | 161-0144 | |
| 5-alpha Competent E. coli | NEB | C2987I | |
| Acetic Acid | Sigma-Aldrich | 49199 | |
| Acetonitrile | Sigma-Aldrich | 34851 | |
| AFC-3000, HPLC Fraction collector | Thermo Scientific | 5702.1 | |
| Agarose | Sigma-Aldrich | A9414 | |
| Amersham ImageQuant 800 UV | GE Healthcare | 29399482 | Replacing LAS-4000 or equivalent |
| Amicon ultra centrifugal filter unit | Sigma-Aldrich | UFC900324 | |
| Ammonium persulfate | Sigma-Aldrich | A3678 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| ATP | Sigma-Aldrich | A2383 | |
| ATP-13C10/15N5 | Sigma-Aldrich | 645702 | |
| BamHI restriction enzyme | NEB | R0136L | |
| Bottle top filter | VWR | 514-1019 | |
| Bromophenol Blue | Sigma-Aldrich | 1081220005 | |
| Cleavage guide | IDT | N/A | or equivalent |
| CTP | Sigma-Aldrich | C1506 | |
| CTP-13C10/15N5 | Sigma-Aldrich | 645699 | |
| D2O | Sigma-Aldrich | 151882 | |
| Dionex Ultimate 3000 UHPLC system | Thermo Scientific | N/A | |
| DL-Dithiotreitol | Sigma-Aldrich | 43815 | |
| DMSO | Sigma-Aldrich | D8418 | |
| DNAPac PA200 22x250 Semi-Prep column | Thermo Scientific | SP6734 | |
| DNAPac PA200 22x50 guard column | Thermo Scientific | SP6731 | |
| E.coli RNase H | NEB | M0297L | or made in-house uniprot ref. P0A7Y4 |
| EDTA | Sigma-Aldrich | E6758 | |
| Eppendorf centrifuge, rotor: A-4-44 | Eppendorf | 5804R | |
| Ethanol 95% | Fisher scientific | 11574139 | |
| Ethanol 95% denatured | VWR | 85829.29 | |
| Formamide | Sigma-Aldrich | 47671 | |
| GelRed | VWR | 41003 | |
| GeneRuler 1kbp Plus | Fisher Scientific | SM1333 | Optional |
| GMP | Sigma-Aldrich | G8377 | |
| GMP-13C10/15N5 | Sigma-Aldrich | 650684 | |
| GTP | Sigma-Aldrich | G8877 | |
| GTP-13C10/15N5 | Sigma-Aldrich | 645680 | |
| Hydrochloric Acid | Sigma-Aldrich | H1758 | |
| Inorganic pyrophosphatase | Sigma-Aldrich | I1643-100UN | or made in-house uniprot ref. P0A7A9 |
| Invitrogen UltraPure 10X TBE-buffer | Sigma-Aldrich | T4415 | |
| Julabo TW8 Water bath | VWR | 461-3117 | |
| kuroGEL Midi 13 Horizontal gel electrophoresis | VWR | 700-0056 | or comparable |
| LB broth (Lennox) | Sigma-Aldrich | L3022 | |
| LB broth with agar (Lennox) | Sigma-Aldrich | L2897 | |
| Low Range ssRNA Ladder | NEB | N0364S | Optional |
| LPG-3400RS Pump | Thermo Scientific | 5040.0036 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 63068 | |
| microRNA Marker | NEB | N2102S | |
| Microwave oven | Samsung | MS23F301EAW | |
| Mini-PROTEAN electrophoresis equipment | Bio-Rad | 1658004 | |
| NucleoBond Xtra Maxi | Machinery-Nagel | 740414.10M | |
| pUC19 plasmid containing tandem insert | Genscript | N/A | or equivalent |
| RNaseZAP | Sigma-Aldrich | R2020 | |
| Shigemi tube 5mm | Sigma-Aldrich | Z529427 | |
| Single-use syringe, Luer lock tip | VWR | 613-2008 | |
| Sodium acetate | Sigma-Aldrich | S2889 | |
| Sodium chloride | Sigma-Aldrich | 730-1470 | |
| Sodium perchlorate | Sigma-Aldrich | 71853 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S3139 | |
| Spermidine trihydrochloride | Sigma-Aldrich | 85578 | |
| SYBR Gold | ThermoFisher | S11494 | |
| Syringe filters | VWR | 514-0061 | |
| T7 RNA polymerase | Sigma-Aldrich | 10881767001 | or made in-house uniprot ref. P00573 |
| TCC-3000RS Column thermostat | Thermo Scientific | 5730 | |
| Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Tris Base | Fisher Scientific | 10103203 | |
| UMP | Sigma-Aldrich | U6375 | |
| UMP-13C9/15N2 | Sigma-Aldrich | 651370 | |
| Urea | Sigma-Aldrich | U5378 | |
| UTP | Sigma-Aldrich | U6625 | |
| UTP-13C10/15N5 | Sigma-Aldrich | 645672 | |
| VWD-3100 Detector | Thermo Scientific | 5074.0005 |
Références
- Djebali, S., et al. Landscape of transcription in human cells. Nature. 489 (7414), 101-108 (2012).
- Doudna, J. A., Cech, T. R. The chemical repertoire of natural ribozymes. Nature. 418 (6894), 222-228 (2002).
- Sehgal, P. B., Westley, J., Lerea, K. M., DiSenso-Browne, S., Etlinger, J. D. Biomolecular condensates in cell biology and virology: phase-separated membraneless organelles (MLOs). Analytical Biochemistry. , 597 (2020).
- Herschlag, D., Allred, B. E., Gowrishankar, S. From static to dynamic: the need for structural ensembles and a predictive model of RNA folding and function. Current Opinion Structural Biology. 30, 125-133 (2015).
- Kimsey, I. J., Petzold, K., Sathyamoorthy, B., Stein, Z. W., Al-Hashimi, H. M. Visualizing transient Watson-Crick-like mispairs in DNA and RNA duplexes. Nature. 519 (7543), 315-320 (2015).
- Dethoff, E. A., Petzold, K., Chugh, J., Casiano-Negroni, A., Al-Hashimi, H. M. Visualizing transient low-populated structures of RNA. Nature. 491 (7426), 724-728 (2012).
- Baisden, J. T., Boyer, J. A., Zhao, B., Hammond, S. M., Zhang, Q. Visualizing a protonated RNA state that modulates microRNA-21 maturation. Nature Chemical Biology. 17 (1), 80-88 (2021).
- Marušič, M., Schlagnitweit, J., Petzold, K. RNA dynamics by NMR spectroscopy. Chembiochem. 20 (21), 2685-2710 (2019).
- Baronti, L., et al. Base-pair conformational switch modulates miR-34a targeting of Sirt1 mRNA. Nature. 583 (7814), 139-144 (2020).
- Steiner, E., Schlagnitweit, J., Lundström, P., Petzold, K. Capturing excited states in the fast-intermediate exchange limit in biological systems using 1H spectroscopy. Angewandte Chemie International Edition. 55 (51), 15869-15872 (2016).
- Moschen, T., et al. Ligand-detected relaxation dispersion NMR spectroscopy: dynamics of preQ1-RNA binding. Angewandte Chemie International Edition. 54 (2), 560-563 (2015).
- LeBlanc, R. M., Longhini, A. P., Tugarinov, V., Dayie, T. K. NMR probing of invisible excited states using selectively labeled RNAs. Journal of Biomolecular NMR. 71 (3), 165-172 (2018).
- Strebitzer, E., Nußbaumer, F., Kremser, J., Tollinger, M., Kreutz, C. Studying sparsely populated conformational states in RNA combining chemical synthesis and solution NMR spectroscopy. Methods. 1148, 39-47 (2018).
- Rangadurai, A., Shi, H., Al-Hashimi, H. M. Extending the sensitivity of CEST NMR spectroscopy to micro-to-millisecond dynamics in nucleic acids using high-power radio-frequency fields. Angewandte Chemie International Edition. 59 (28), 11262-11266 (2020).
- Hansen, D. F., Vallurupalli, P., Kay, L. E. Using relaxation dispersion NMR spectroscopy to determine structures of excited, invisible protein states. Journal of Biomolecular NMR. 41 (3), 113-120 (2008).
- Lundström, P., Akke, M. Off-resonance rotating-frame amide proton spin relaxation experiments measuring microsecond chemical exchange in proteins. Journal of Biomolecular NMR. 32 (2), 163-173 (2005).
- Lee, J., Dethoff, E. A., Al-Hashimi, H. M. Invisible RNA state dynamically couples distant motifs. Proceedings of the National Academy of Sciences of the United States of America. 111 (26), 9485-9490 (2014).
- Schnieders, R., Keyhani, S., Schwalbe, H., Fürtig, B. More than proton detection- new avenues for NMR spectroscopy of RNA. Chemistry. 26 (1), 102-113 (2020).
- Fürtig, B., Richter, C., Wöhnert, J., Schwalbe, H. NMR spectroscopy of RNA. Chembiochem. 4 (10), 936-962 (2003).
- Schlagnitweit, J., Steiner, E., Karlsson, H., Petzold, K. Efficient detection of structure and dynamics in unlabeled RNAs: The SELOPE approach. Chemistry. 24 (23), 6067-6070 (2018).
- Feyrer, H., Munteanu, R., Baronti, L., Petzold, K. One-pot production of RNA in high yield and purity through cleaving tandem transcripts. Molecules. 25 (5), 1142 (2020).
- Baronti, L., Karlsson, H., Marušič, M., Petzold, K. A guide to large-scale RNA sample preparation. Analytical and Bioanalytical Chemistry. 410 (14), 3239-3252 (2018).
- Brunelle, J. L., Green, R. In vitro transcription from plasmid or PCR-amplified DNA. Methods in Enzymology. 530, 101-114 (2013).
- Borkotoky, S., Murali, A. The highly efficient T7 RNA polymerase: A wonder macromolecule in biological realm. International Journal of Biological Macromolecules. 118, 49-56 (2018).
- Arnaud-Barbe, N., Cheynet-Sauvion, V., Oriol, G., Mandrand, B., Mallet, F. Transcription of RNA templates by T7 RNA polymerase. Nucleic Acids Research. 26 (15), 3550-3554 (1998).
- Guillerez, J., Lopez, P. J., Proux, F., Launay, H., Dreyfus, M. A mutation in T7 RNA polymerase that facilitates promoter clearance. Proceedings of the National Academy of Sciences of the United States of America. 102 (17), 5958-5963 (2005).
- Kuzmine, I., Gottlieb, P. A., Martin, C. T. Binding of the priming nucleotide in the initiation of transcription by T7 RNA polymerase. Journal of Biological Chemistry. 278 (5), 2819-2823 (2003).
- Gholamalipour, Y., Karunanayake Mudiyanselage, A., Martin, C. T. 3' end additions by T7 RNA polymerase are RNA self-templated, distributive and diverse in character - RNA-Seq analyses. Nucleic Acids Research. 46 (18), 9253-9263 (2018).
- Inoue, H., Hayase, Y., Iwai, S., Ohtsuka, E. Sequence-dependent hydrolysis of RNA using modified oligonucleotide splints and RNase H. FEBS Letters. 215 (2), 327-330 (1987).
- Wang, X., Li, C., Gao, X., Wang, J., Liang, X. Preparation of small RNAs using rolling circle transcription and site-specific RNA disconnection. Molecular Therapy - Nucleic Acids. 4, 215 (2015).
- Karlsson, H., Baronti, L., Petzold, K. A robust and versatile method for production and purification of large-scale RNA samples for structural biology. RNA. 26 (8), 1023-1037 (2020).
- Hartmann, S. R., Hahn, E. L. Nuclear double resonance in the rotating frame. Physical Review. 128 (5), 2042-2053 (1962).
- Chiarparin, E., Pelupessy, I., Bodenhausen, G. Selective cross-polarization in solution state NMR. Molecular Physics. 95 (5), 759-767 (1998).
- Korzhnev, D. M., Orekhov, V. Y., Kay, L. E. Off-resonance R 1ρ NMR studies of exchange dynamics in proteins with low spin-lock fields: an application to a Fyn SH3 domain. Journal of the American Chemical Society. 127 (2), 713-721 (2005).
- Hansen, A. L., Nikolova, E. N., Casiano-Negroni, A., Al-Hashimi, H. M. Extending the range of microsecond-to-millisecond chemical exchange detected in labeled and unlabeled nucleic acids by selective carbon R 1ρ NMR spectroscopy. Journal of the American Chemical Society. 131 (11), 3818-3819 (2009).
- Duss, O., Maris, C., von Schroetter, C., Allain, F. H. -. T. A fast, efficient and sequence-independent method for flexible multiple segmental isotope labeling of RNA using ribozyme and RNase H cleavage. Nucleic Acids Research. 38 (20), 188 (2010).
- Krähenbühl, B., Lukavsky, P., Wider, G. Strategy for automated NMR resonance assignment of RNA: application to 48-nucleotide K10. Journal of Biomolecular NMR. 59 (4), 231-240 (2014).
- LeBlanc, R. M., Longhini, A. P., Le Grice, S. F. J., Johnson, B. A., Dayie, T. K. Combining asymmetric 13C-labeling and isotopic filter/edit NOESY: a novel strategy for rapid and logical RNA resonance assignment. Nucleic Acids Research. 45 (16), 146 (2017).
- Parisien, M., Major, F. The MC-Fold and MC-Sym pipeline infers RNA structure from sequence data. Nature. 452 (7183), 51-55 (2008).
- Fürtig, B., Richter, C., Bermel, W., Schwalbe, H. New NMR experiments for RNA nucleobase resonance assignment and chemical shift analysis of an RNA UUCG tetraloop. Journal of Biomolecular NMR. 28 (1), 69-79 (2004).
- Keyhani, S., Goldau, T., Blümler, A., Heckel, A., Schwalbe, H. Chemo-enzymatic synthesis of position-specifically modified RNA for biophysical studies including light control and NMR spectroscopy. Angewandte Chemie International Edition. 57 (37), 12017-12021 (2018).
- Marchanka, A., Kreutz, C., Carlomagno, T. Isotope labeling for studying RNA by solid-state NMR spectroscopy. Journal of Biomolecular NMR. 71, 151-164 (2018).
- Becette, O., Olenginski, L. T., Dayie, T. K. Solid-phase chemical synthesis of stable isotope-labeled RNA to aid structure and dynamics studies by NMR spectroscopy. Molecules. 24 (19), 3476 (2019).
- Zhang, X., Li, M., Liu, Y. Optimization and characterization of position-selective labelling of RNA (PLOR) for diverse RNA and DNA sequences. RNA Biology. 17 (7), 1009-1017 (2020).
- Roh, J. H., et al. Effects of preferential counterion interactions on the specificity of RNA folding. The Journal of Physical Chemistry Letters. 9 (19), 5726-5732 (2018).
- Juen, M. A., et al. Excited states of nucleic acids probed by proton relaxation dispersion NMR spectroscopy. Angewandte Chemie German Edition. 55 (39), 12008-12012 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon