Method Article
Практические аспекты пробоподготовки и настройки экспериментовпо релаксационной дисперсии РНК 1 H R1ρ
В этой статье
Резюме
Представлен протокол измерения микро-миллисекундной динамики на 13C/15N-меченой и немаркированной РНК с 1H R1ρ релаксационной дисперсионной ядерного магнитного резонанса (ЯМР) спектроскопии. Основное внимание в этом протоколе уделяется высокочистой пробоподготовке и настройке экспериментов ЯМР.
Аннотация
РНК представляет собой очень гибкую биомолекулу, в которой изменения в структурах играют решающую роль в функциях, которые молекулы РНК выполняют в качестве клеточных мессенджеров и модуляторов. Хотя эти динамические состояния остаются скрытыми для большинства структурных методов, спектроскопия релаксационной дисперсии R1ρ (RD) позволяет изучать конформационную динамику в микро-миллисекундном режиме при атомном разрешении. Использование 1H в качестве наблюдаемого ядра еще больше расширяет охватываемый временной режим и дает прямой доступ к водородным связям и спаривающим основаниям.
Сложными этапами в таком исследовании являются высокочистая и высокопроизводительная пробоподготовка, потенциально 13C- и 15N-меток, а также установка экспериментов и подгонка данных для извлечения популяции, обменного курса и вторичной структуры ранее невидимого состояния. Этот протокол обеспечивает важнейшие практические этапы в подготовке образцов для обеспечения подготовки подходящего образца РНК и установки экспериментов 1H R1ρ как с изотопно мечеными, так и с немаркированных образцами РНК.
Введение
РНК выполняют множество регуляторных1,каталитических2и структурных3 функций в клетке, многие из которых коррелируют с гибкой молекулярной структурой и сложными изменениями этих структур4,5,6,7. Малонаселенные состояния остаются невидимыми для большинства методов определения структуры или не позволяют изучать эти скрытые состояния при высоком атомном разрешении. Спектроскопия ядерного магнитного резонанса (ЯМР) сочетает в себе оба аспекта, предоставляя доступ к отдельным атомным ядрам, а также предлагая большой набор инструментов экспериментов, нацеленных на динамику через все временные режимы8. Эксперименты RD ЯМР обеспечивают доступ к конформационному обмену в промежуточной шкале времени, в которой можно ожидать изменения в паттернах спаривания оснований и локальных структурных перестроек5,9,10,11,12,13,14. Эксперименты RD выполняются в виде длинных измерений R2 в виде импульсного поезда Карра-Перселла-Мейбума-Гилла15 или в виде релаксационных измерений во вращающейся рамке, называемых экспериментами R1ρ RD16.
Хотя оба могут быть использованы для извлечения популяции и разницы обменного курса и химического сдвига в минорное состояние, эксперименты R1ρ RD также дают знак разности химического сдвига возбужденного состояния. Это позволяет сделать вывод о вторичной структуре, которая сильно коррелирует с химическим сдвигом в структурах РНК17. Химический сдвиг является хорошим показателем еликности в случае ароматических протоонов и атомов углерода на нуклеосах, партнеров по спариванию оснований для протоонов имино и сахарных шайб на атомах C4' и C1'18,19. Следует отметить, что недавно эксперимент по переносу насыщения химическим обменом (CEST) с использованием более высокой мощности спинового замка (SL), тем самым смещая применимость эксперимента CEST к более быстрым временным шкалам обмена, был опубликован в качестве альтернативы эксперименту R1ρ RD для систем с одним возбужденным состоянием.
Хотя изотопы 13C и 15N часто использовались для доступа к структурному обмену, недавняя работа из этой лаборатории использовала ароматические протоны и имино в качестве зондов для конформационного обмена9,10. Использование 1H в качестве наблюдаемого ядра приносит несколько преимуществ, например, доступ к обмену на более быстрых и медленных временных масштабах, более высокую чувствительность и более короткое время измерения. Этому также способствует подход SELective Optimized Proton Experiment (SELOPE), обеспечивающий доступ к ароматическим протонам путем декообразования одномерного (1D) спектра с использованием гомоядерных скалярных связей вместо гетероядерного переноса намагниченности и устраняющий необходимость в изотопных метках20. Этот протокол предназначен для измерения в экспериментах 1H R1ρ RD однородно 13C /15N-меченых и немаркированных образцов. Таким образом, в данной статье представлен метод подготовки образцов, который был признан наиболее универсальным для различных потребностей в подготовке образцов21, и обсуждаются альтернативы в последнем разделе этой статьи(рисунок 1).
На этом этапе читатель должен отметить, что другие методы пробоподготовки приемлемы для экспериментов 1H R1ρ RD, и что другие методы структурного и функционального анализа могут быть выполнены с образцами, синтезированными с помощью представленной методики. 1 1 Эксперименты H R1ρ RD требуют высоких концентраций РНК (в идеале >1 мМ), а также высокой однородности, как по длине РНК, так и по структурной конформации для обеспечения надежной характеристики молекулярной динамики. Транскрипция in vitro (IVT) является методом выбора для многих исследователей для получения 13C /15N-меченых образцов РНК из-за наличия меченых нуклеозидтрифосфатов (NTL) и легкого включения в ферментативную реакцию22. Однако широко используемая T7 РНК-полимераза (T7RNAP)23,24,25 страдает низкой однородностью 5' в случае определенных последовательностей инициации26,27 и часто также 3' однородности во время транскрипционногостока 28. Очистка целевого вида РНК становится более дорогостоящей и трудоемкой из-за необходимости больших количеств ~200 нмоль. Метод, используемый здесь, был представлен ранее, где преимущества обсуждались на расширенном21. Короче говоря, он решает описанные проблемы путем транскрибирования более крупного тандемного транскрипта, который затем специально расщепляется Escherichia coli RNase H, руководствуясь химерным олигонуклеотидом29,30 (см. Рисунок 2 для деталей).
Включение спейсерной последовательности на концах 5' и 3' тандемного транскрипта позволяет использовать высокопроизводительную последовательность инициации и удаление концевых свесов вблизи места линеаризации плазмидного шаблона соответственно(рисунок 2B). Было показано, что метод значительно улучшает урожайность, одновременно снижая затраты и трудозатраты, с оговоркой о более сложном синтезе шаблона и необходимости дополнительного фермента и олигонуклеотида. Высокая специфичность расщепления РНКазы Н облегчает очистку из-за отсутствия видов РНК в аналогичном диапазоне размеров. В настоящем протоколе используется ионообменная высокопроизводительная жидкая хроматография (ВЭЖХ), которая была опубликована этой лабораторией недавно31,хотя другие методы являются возможными альтернативами. 1 1 H R1ρ RD может, как правило, быть получен на меченых или немаркированных образцах с двумя соответствующими последовательностями импульсов, «меченым» 1H R1ρ гетероядерной одиночной квантовой корреляции (HSQC) на основе эксперимента с 13C косвенной размерностью10 и «немаркированного» 1H R1ρ ЭКСПЕРИМЕНТ НА основе SELOPE с 1H косвенной размерностью20.
Эти двумерные (2D) эксперименты могут служить первой проверкой, независимо от того, присутствует ли в образце динамика на временной шкале R1ρ. Можно получить обзор RD для всех разрешенных пиков в спектрах, и определить пики, представляющие интерес для более тщательного анализа RD. Это означает, что даже немаркированные образцы могут быть проверены до принятия решения о производстве более дорогого, маркированного образца. После того, как пик с конформационным обменным вкладом выбран для более тщательного изучения, лучше всего переключиться на 1D-версии вышеуказанных экспериментов (если пик все еще может быть разрешен) для проведения так называемых внерезонансных экспериментов. Для маркированной версии перенос HSQC на 13C заменяется селективным шагом гетероядерной кросс-поляризации (HCP), как используется в экспериментах 13C R1ρ 32,33,34,35,в то время как в случае эксперимента SELOPE эксперимент просто запускается как 1D, что особенно полезно для сигналов H8 и H2, которые лежат на диагонали в 2D в любом случае. Одним из критериев того, какую последовательность использовать, при условии, что доступны как помеченный, так и немаркированный образец, является то, насколько хорошо изолирован пик интереса в двух экспериментах.
В целом, эксперимент SELOPE рекомендуется для образцов РНК до 50 нуклеотидов. Для более крупных РНК перекрытие будет больше; однако структурно интересные нуклеотиды часто появляются в областях химического сдвига, которые менее перекрываются и все еще могут быть доступны в еще более крупных РНК. Другим аргументом может быть то, что в немаркированных образцах J-связь не происходит между 1H и 12C. Однако, поскольку минимальная мощность блокировки спина определяется минимальной мощностью, используемой для разъедименения этих двух спинов (~ 1 кГц) в меченом эксперименте, немаркированный эксперимент позволяет использовать более широкий диапазон сильных сторон спин-блокировки (SL) и, следовательно, доступ к более широкой временной шкале обмена. Эти внерезонансные эксперименты предоставляют дополнительную информацию для kex,такую как популяция возбужденного состояния (альтернативный конформер), pES, а также очень ценную информацию о химическом сдвиге в виде Δω (разность химического сдвига основного состояния и возбужденного состояния).
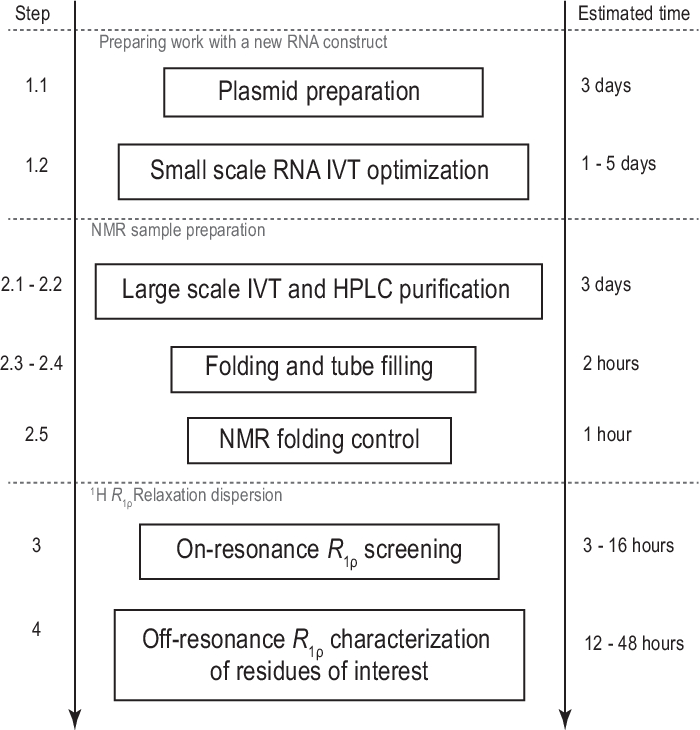
Рисунок 1:Рабочий процесс представленного протокола. Подготовка перед фактическим крупномасштабным производством образца, состоящая из подготовки шаблона и подтверждения успешной транскрипции in vitro и расщепления RNase H. Крупномасштабное производство, включая очистку ВЭЖХ, заполнение ямр-трубки и подтверждение сворачивания РНК. В случае синтеза с мечеными изотопами в тот же день должна быть выполнена немаркированная очистка для оптимизации градиента. ЯМР-характеристика конформационной динамики с помощью экспериментов R1ρ. Каждый этап может быть выполнен независимо, например,анализ RD 1H R1ρможетбыть применен к любому подходящему образцу РНК, полученному другим способом. Сокращения: IVT = транскрипция in vitro; ВЭЖХ = высокоэффективная жидкостная хроматография; ЯМР = ядерный магнитный резонанс; RD = дисперсия релаксации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Целью данного протокола является предоставление практических деталей и критических параметров для изучения конформационной динамики с релаксационной дисперсией 1HR1ρ в молекулах РНК шпильки. После предоставления подробного протокола проектирования, синтеза и очистки ионообмонной ВЭЖХ целевой РНК, которая может быть выполнена с использованием всех, некоторых или ни одного НТП в виде 13C /15N-меченых версий, был описан рабочий процесс завершения образца ЯМР и подтверждения конформационного обмена с ЯМР-спектроскопией. Наконец, описаны детали установки экспериментов 1H R1ρ RD на ЯМР-спектрометре Bruker(рисунок 1). Протокол дает каждый шаг для настройки версии 1D для помеченных образцов и дополнительных комментариев, а также таблицу для настройки настройки версии SELOPE(таблица 2). После протокола обсуждаются критические этапы и альтернативные пути подготовки образцов и настройки RD 1H R1ρ.
протокол
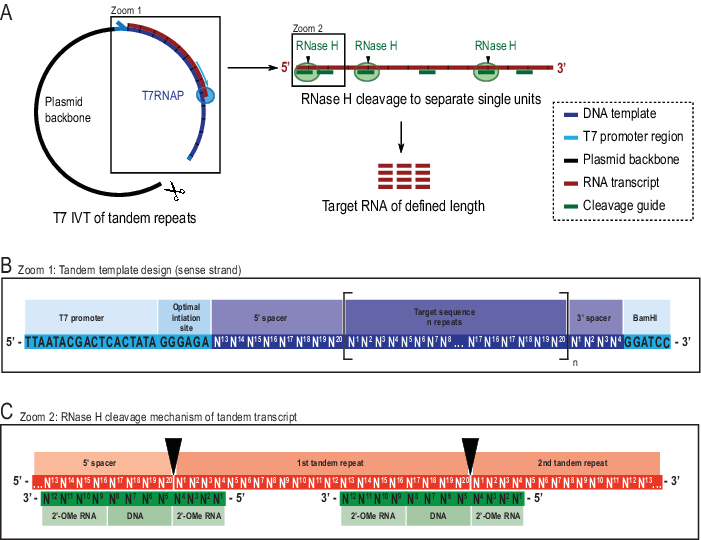
Рисунок 2: Схематическое представление сообщаемого тандемного протокола IVT. (A) Тандемная транскрипция из линеарализованного шаблона плазмиды с T7RNAP (слева) и последовательное расщепление РНКазой H транскрипта для достижения целевой длины РНК, направленной химерным проводником ДНК (справа). (B) Подробная схема тандемного шаблона, начинающегося с вирусного промотора T7RNAP, последовательности инициации. Целевая последовательность (темно-синий, пример здесь длиной 20 нт) повторяется «n» раз. Повторы окружены 5′ и 3′ спейсерными последовательностями, состоящими из последних восьми и первых четырех нуклеотидов соответственно, чтобы обеспечить удаление последовательностей инициации и ограничения из первой и последней единицы повторения. (C)Гибридизация тандемного транскрипта (красный) и химерных направляющих расщепления (зеленый). РНКаза H расщепляет РНК, противоположную концу ДНК 5'. Фланки РНК 2'-OMe повышают специфичность за счет повышения связывания связующего сродства направляющего расщепления к целевой РНК. Этот показатель был изменен с 21. Сокращения: T7RNAP = T7 РНК-полимераза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Подготовка работы для новой конструкции РНК
- Проектирование и подготовка плазмид
- Напишите последовательность шаблона в инструменте клонирования, например,Serial Cloner.
- Возьмем промоторную последовательность T7 и добавьте высокопроизводительную последовательность инициации (T7: 5'-TAATACGACTCACTATA ^GGGAGA-3').
ПРИМЕЧАНИЕ: Транскрипция начнется с нуклеотида, указанного кареткой (^). Последовательность инициации GGGAGA переменна, но сильно зависит от последовательности; поэтому рекомендуется использовать эту последовательность. - Добавьте последние 8 нуклеотидов (nt) целевой последовательности в виде 5' спейсера (5'S).
- Добавьте повторы целевой последовательности (TS).
- Добавьте первые четыре нуклеотида в виде 3' спейсера после повторов (5'S).
- Добавьте сайт ограничения BamHI (RS) или аналогичный уникальный сайт ограничения.
ПРИМЕЧАНИЕ: Общая последовательность, как показано на рисунке, будет клонирована или легко упорядочена в бактериальной плазмиде с высокой копией(например,pUC19): 5'-T7-5'S-(TS)n-3'S-RS-3'(рисунок 2B). Количество повторов должно быть настолько высоким, насколько это допускается синтезом генов (максимум 600 нт в этом протоколе). - Усилите плазмиду в E. coli с помощью коммерческого набора.
- Линеаризуйте очищенную плазмиду при 20 нг/мкл с использованием соответствующего участка рестрикциона. Ограничение накипи переваривается с BamHI до 1 мл.
- Очистите переваренную плазмиду и подтвердите успешную линеаризацию на 1% агарозном гелевом. Хранить линеаризированную плазмиду при -20 °C в течение нескольких месяцев.
- Конструкция направляющей расщепления(рисунок 2C)
- Запишите последние восемь нуклеотидов целевой последовательности РНК в направлении 5'-3' и добавьте первые четыре нуклеотида целевой последовательности РНК на 3' конце также в направлении 5'-3'.
- Генерация обратного дополнения ДНК этой последовательности
- Измените первый и последние четыре нуклеотида на их модификации 2'-OMe, добавив «m» перед нуклеотидной буквой.
ПРИМЕЧАНИЕ: Для синтеза вместо мТ используется мЕ. - Закажите олиго со стандартной обессоливающей очисткой.
ПРИМЕЧАНИЕ: Проверьте, может ли сгенерированное олиго связываться в другом месте, кроме соединения двух последовательностей РНК. Требуется полная комплементарность в центральных четырех нуклеотидах ДНК, в то время как фланговые области могут допускать несоответствие. При необходимости расширьте фланги до 18 nt, чтобы создать уникальную последовательность связывания36.
- Маломасштабный ИВТ
ПРИМЕЧАНИЕ: Для работы без РНКазы подготовьте все реагенты в стерильных и свободных от РНК условиях. Используйте реагент для обеззараживания РНКазы (см. Таблицу материалов)и 95% v/v этанола для очистки рабочих поверхностей и пипеток перед использованием. Стирайте перчатки с 95% этанолом и носите одежду с длинными рукавами без ворса. Чтобы свести к минимуму загрязнение РНКазой, не дышите через открытые трубки.- Готовят стоковые растворы Tris-Cl (рН 8,0), дитиотрейтола, MgCl2,спермидина и NTPs/GMP (небуферизованные). Смешайте реагенты, как показано в таблице 1. Приготовьте мастер-микс этих реагентов заранее, перед добавлением ферментов или нуклеиновых кислот.
ПРИМЕЧАНИЕ: Если вы используете замороженные реагенты, тщательно перемешайте их после размораживания. Реагенты могут выпасть в осадок при смешивании в слишком высоких концентрациях, поэтому настоятельно рекомендуется следовать порядку, приведенным в таблице 1. - Добавьте в следующем порядке: плазмиду, направляющую расщепления, неорганическую фосфатазу (IPPase), RNase H, T7RNAP. Поскольку активность ферментов может варьироваться для ферментов, производимых в компании, протестируйте несколько концентраций, прежде чем выбрать лучшую.
ПРИМЕЧАНИЕ: Включите отрицательный контроль реакции расщепления, например, без RNase H, чтобы отнести отсутствующую целевую полосу к дефектным расщеплению RNase H, а не к неудачной транскрипции. - Инкубируют реакцию при 37 °C в течение 1 ч и подтверждают реакцию на денатурировавшем полиакриламидном гелевом электрофорезе (PAGE)(рисунок 3A). Разбавьте образец в 10 раз в загрузочном растворе и загрузите 1 мкл на гель.
ПРИМЕЧАНИЕ: Гелевая смесь: 8 М мочевины, 20% акриламид (19:1 акриламид:бисакриламид) в 1x TBE. Нагрузочный раствор: 5 мМ этилендиамина тетрауксусной кислоты (ЭДТА), 300 мкМ бромфенола синего в формамиде. Нельзя ожидать, что реакции расщепления РНКазы H будут завершены через 1 ч, так как новая РНК продуцируется постоянно. На этом этапе следите за четкой целевой полосой и отсутствием вида с аналогичной молекулярной массой(например,продукты нуклеотидов ±3 (nt)).
- Готовят стоковые растворы Tris-Cl (рН 8,0), дитиотрейтола, MgCl2,спермидина и NTPs/GMP (небуферизованные). Смешайте реагенты, как показано в таблице 1. Приготовьте мастер-микс этих реагентов заранее, перед добавлением ферментов или нуклеиновых кислот.
| Реагент | Концентрация запасов | Количество в малой гамме (мкл) |
| Н2О | - | 24 |
| Трис | 1 М | 5 |
| МгКл2 | 1 М | 0.5 |
| Дидниты | 1 М | 0.5 |
| Спермидин | 250 мМ | 5 |
| GMP | 100 мМ | 2.5 |
| СПС | 100 мМ | 1.5 |
| ГТП | 100 мМ | 1.5 |
| УТП | 100 мМ | 1.5 |
| ОСАГО | 100 мМ | 1.5 |
| Плазмидные | 20 нг/мкл | 5 |
| Руководство по декольте | 100 мкМ | 10 |
| iPPase | 10 мг/мл | 0.5 |
| РНКаза Н | 10 мкг/мл | 2 |
| Т7 РНК-полимераза | 5 мг/мл | 2 |
Таблица 1: Таблица реагентов для тандемного ИВТ и одновременного расщепления РНКазы Н. Концентрации запасов могут быть адаптированы кудобствампользователя. Если расщепление РНКазы Н необходимо проводить после Т7 ИВТ, добавляют направляющую расщепления и РНКазу Н после термоинактивации Т7РНКП. Используемые количества линейно масштабируются с реакционной шкалой. Сокращения: T7RNAP = T7 РНК-полимераза; IVT = транскрипция in vitro.
2. Пробоподготовка ЯМР
- Масштабируйте реакцию до желаемого объема (обычно 10 мл) и запускайте реакцию в течение ночи. Тест на завершение реакции на следующий день денатурировающим гелем PAGE(рисунок 3A).
ПРИМЕЧАНИЕ: Неполная реакция расщепления проявляется у более высокомолекулярных видов над целевой полосой.- Если расщепление не было успешным или полным, повторное взведение РНК и направляющая расщепления в реакционный сосуд путем нагревания раствора в обычной микроволновой печи при 450 Вт в течение 15 с.
- Медленно охлаждать раствор до 37 °C в течение 40 мин. Используйте нагревательный блок для объемов ниже 1 мл. Отметим образование нового осадка.
- Добавьте больше IPPase и RNase H и инкубируют еще 1-3 ч при 37 °C. Подтвердите завершение реакции расщепления денатурированием PAGE.
- Когда реакция расщепления РНКазы Н завершена, погасите реакцию, добавив ЭДТА к конечной концентрации 50 мМ и тщательно вихрево.
ПРИМЕЧАНИЕ: Потенциальное осаждение пирофосфатов растворится, и образуется осадок нового белка. - Отфильтруйте раствор через шприцевой фильтр 0,2 мкм и сконцентрируйте до объема, впрыскиваемого в систему ВЭЖХ, в зависимости от размера инжекторного контура.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь путем замораживания образца при -20 °C.
- Крупномасштабная очистка ВЭЖХ
- Подготовьте ионные буферы А и В в течение одной недели после использования. Фильтруйте и размагивляйте буферы.
ПРИМЕЧАНИЕ: Буфер A: 20 мМ ацетата натрия; 20 мМ перхлората натрия, рН 6,5. Буфер B: 20 мМ ацетата натрия; 600 мМ перхлората натрия, рН 6,5. - Уравновешивают столбец 100% буфером B, а затем 100% буфером A для по меньшей мере 2 объемов столбцов при 75 °C.
- Подготовьте последовательность ВЭЖХ(рисунок 3B)со скоростью потока 5,5 мл/мин. Используйте следующую последовательность для очистки РНК размером от 20 до 30 нт: 0-7 мин: 0% В; 7-16 мин: градиент 0-20% В; 16-46 мин: элюдение, обычно с градиентом 20-30% B (оптимизация в соответствии с потребностями); 46-62 мин: 100% B; 62-73 мин: 0% B.
ПРИМЕЧАНИЕ: Изменение расхода с 5,5 до 8 мл/мин не повлияло на разделение в данном протоколе. - Оптимизируйте градиент элюдения путем введения эквивалентного 1 мл реакции транскрипции (немаркированной) за раз.
ПРИМЕЧАНИЕ: Для получения более подробной информации и обсуждения обратитесь к Karlsson et al.31 и Feyrer et al.21. - Протестируйте собранные фракции на денатурировкой PAGE. Если основной пик элюдения хорошо выделен и содержит чистую целевую РНК, масштабируйте очистку до эквивалента 10 мл реакции транскрипции.
- Соберите интересуемые фракции, сконцентрируйте и обменяйте буфер с буфером ЯМР. Используйте ультрацентробежный фильтрующий блок (см. Таблицу материалов)для объемов выше 50 мл.
ПРИМЕЧАНИЕ: Буфер ЯМР: 15 мМ фосфата натрия; 25 мМ хлорида натрия; 0,1 мМ ЭДТА, рН 6,5. Чтобы свести к минимуму потери от прилипания РНК к пластиковым стенкам трубок, промыть все сборные трубки 1 мл воды, вихря и центрифуги, чтобы собрать всю жидкость. - Определение концентрации с помощью ультрафиолетовой спектроскопии. Рассчитайте выход реакции согласно Feyrer et al21.
ПРИМЕЧАНИЕ: Концентрация образца ЯМР для экспериментов RD не должна быть ниже 130 нмоль, что соответствует 500 мкМ в объеме образца 250 мкл с использованием ЯМР-пробирок(Таблица материалов).
- Подготовьте ионные буферы А и В в течение одной недели после использования. Фильтруйте и размагивляйте буферы.
- Сворачивание образца РНК
- Разбавляют и аликвотируют образец объемом ~10 мл в 1 мл на пробирку.
- Нагревать Аликвоты РНК до 95 °C в течение 5 мин.
- Оснастьте образцы, поместив их на лед или в смесь вода-лед-соль, и инкубируете в течение 30 минут.
- Бассейн образцов и концентрата до ~250 мкл в центробежном фильтрующем блоке 2 мл.
- Заполнение ЯМР-трубки
- Очистите ЯМР-трубку в очистителе ЯМР-трубки, промыв обильной водой, реагентом для обеззараживания РНКазы, водой, 95% этанолом (EtOH) и снова водой. Оставьте сохнуть.
- Очистите плунжер, промыв водой и протирая реагентом обеззараживания РНКазы и 95% EtOH с помощью безворсовой салфетки. Оставьте сохнуть.
- Добавьте 10% (v/v)D2O к образцу ЯМР.
- Заполните образец РНК в ЯМР-трубку, используя большой наконечник пипетки. Дайте жидкости течь вдоль боковой части стенки трубки.
- Вставьте плунжер и удалите пузырьки воздуха, толкнув плунжер вниз быстрым скручивающим движением.
- Медленно поднимите поршень вверх, не создавая новых пузырьков воздуха, и зафиксируйте его парафиновой восковой пленкой.
- Подтвердите сворачивание с помощью ЯМР.
ПРИМЕЧАНИЕ: На этом этапе необходимо выполнить хотя бы частичное резонансное присвоение для подтверждения вторичной структуры образца РНК и выявления областей, представляющих интерес для изучения конформационной динамики. Исчерпывающее описание назначения резонанса РНК превысило бы этот протокол, поэтому мы ссылаемся на хорошо заявленную литературу на данный момент19,37,38. Электрофоретический анализ сдвига подвижности (EMSA) может быть полезным индикатором сворачивания РНК и служить дополнительными данными для экспериментов ЯМР.- Сравните следующие спектры образца, для которого проводятся эксперименты 1H R1ρ RD, с правильно сложенным эталонным образцом(рисунок 4): 1H 1D, особенно область имино 10–15 ppm; Ароматический 1Ч,13С-HSQC; 1 1 H,1H-SELOPE (опционально).
ПРИМЕЧАНИЕ: Ароматический отпечаток пальца также необходим, даже в случае согласия между сигналами имино, потому что образование димера часто показывает те же или похожие сигналы имино, что и шпилька РНК. Эксперимент SELOPE может заменить 1H,13C-HSQC для ароматического дактилоскопирования, поскольку гетероядерные эксперименты на немаркированных образцах очень трудоемки. - Используйте цикл UUCG в качестве ссылки на отпечатки пальцев (если он есть).
- Выполняйте это сравнение каждый раз перед записью экспериментов 1H R1ρ RD.
- Сравните следующие спектры образца, для которого проводятся эксперименты 1H R1ρ RD, с правильно сложенным эталонным образцом(рисунок 4): 1H 1D, особенно область имино 10–15 ppm; Ароматический 1Ч,13С-HSQC; 1 1 H,1H-SELOPE (опционально).
3. Релаксационная дисперсия 1H R1ρ —резонансная (обозначенная 1D версия)
ПРИМЕЧАНИЕ: Ниже описана настройка экспериментов RD для меченого образца с использованием 1D-версии последовательности импульсов RD на основе HSQC. Выполните те же действия для 1D-последовательности на основе SELOPE для немаркированных образцов. Обзор имен параметров и настроек для обоих случаев приведен в таблице 2. Основное внимание уделяется 1D-версиям, поскольку они более практичны для внерезонансных измерений, а настройка 2D-версий экспериментов на основе SELOPE и HSQC подробно обсуждалась Schlagnitweit et al.20 и Steiner et al.10соответственно.
- Определите мощность 1Ч для жесткого импульса 90° (P1).
- Вариант A: Используйте импульсную команду Bruker.
- Вариант B: В эксперименте zg определить импульс 360° путем измерения кривой нутации на уровне мощности жесткого импульса протона на водном пике.
ПРИМЕЧАНИЕ: Длина импульса 90° составляет четверть от длительности, в которой наблюдается нулевой сигнал (если измеряется кривая полной нутации, то это второй ноль; однако на практике выборка составляется только область вокруг ожидаемого значения для 360°).
- Запустите 1H 1D спектр zgesgp.f2f3dec, используя длину импульса, определенную на шаге 3.1, чтобы подтвердить сворачивание РНК перед каждым измерениемR1ρ.
ПРИМЕЧАНИЕ: Если эксперименты 1H SL проводятся в первый раз, проверьте, соответствует ли рассчитанная мощность SL мощности, поданной в образец, калибруя мощность SL для каждой желаемой полосы пропускания. Подробные этапы калибровки описаны в Steiner et al.10. - Создайте 1H R1ρ для помеченного набора данных и задайте ключевые параметры.
- Создание нового набора данных; в идеале на основенабора данных ароматических HSQC1 H-13C, используемых на полностью меченых образцах РНК для присвоения РНК.
ПРИМЕЧАНИЕ: Это обеспечит 13C, а также 15N питания и разъединяющей мощности уже настроены. - Задайте общие параметры согласно первой части таблицы 2.
- Задайте RD-специфические параметры в соответствии со второй частью таблицы 2.
- Установите мощность 1H SL на наименьшее значение (1,2 кГц) для тестирования.
- Создайте тестовый список vd только с одной записью, 0 мс( для оптимизации списка vd, как описано в шаге 3.4), установите TDF1 в значение 1 и обновите D30.
- Запустите тестовый спектр с этими параметрами.
- Создание нового набора данных; в идеале на основенабора данных ароматических HSQC1 H-13C, используемых на полностью меченых образцах РНК для присвоения РНК.
- Оптимизируйте список vd (список используемых длин SL).
- Запустите эксперимент с тестовым списком vd(например,шесть записей: 0 м, 5 м, 10 м, 20 м, 30 м, 40 м; скремблируйте эти значения, чтобы избежать систематических ошибок из-за нагрева).
- Обновите D30 и TDF1 соответствующим образом (в этом примере D30 = 42m и TDF1 = 6).
- Интенсивность графика пика по сравнению с длиной SL. Определите длину SL, при которой интенсивность исходного пика уменьшается до 1/3.
- Создайте окончательный список vd для использования в эксперименте, принимая во внимание следующее: определите самую длину SL, как описано в предыдущем шаге; избегать использования списка с порядком убывания или возрастания; и добавить несколько дубликатов для статистических исследований. Не забывайте обновлять D30 и TDF1 каждый раз, когда в списке vd происходят какие-либо изменения.
ПРИМЕЧАНИЕ: Эксперимент выполняется с различной длиной SL, указанной в списке vd, псевдо-2D способом. - Выберите количество сканирований таким образом, чтобы самый слабый пик списка имеет отношение сигнал/шум (SINO) не менее 10.
ПРИМЕЧАНИЕ: Хотя список vd был оптимизирован для низкой мощности SL (1,2 кГц), этот список vd также должен быть протестирован при максимальной мощности SL, которая будет использоваться(например,15 кГц). Это связано с тем, что распад будет намного медленнее при высокой мощности SL для пиков со значительным вкладом kEX. Поэтому достаточное затухание также должно быть проверено при высокой мощности SL.
| Описание параметра | Имя параметра в последовательности импульсов | |
| 1D маркировка | 1D СЕЛОПЕ | |
| импульсная программа для резонансных 1Ds | 1HR1rho_HCP_onres1D.es | 1HR1r_HH_onres1D.js |
| 1 1 Несущие частоты H (ppm) | O1P = резонанс воды в ppm | O1P = химический сдвиг пика интереса (ppm) |
| CNST28 = химический сдвиг пика интереса (ppm) | CNST29 = водный резонанс в ppm | |
| 1 1 H жесткий импульс 90º | P1 @ PL1 (как откалибровано в 3.1.1) | P1 @ PL1 (как откалибровано в 3.1.1) |
| Фасонные импульсы и мощности для подавления воды | P25 = 1000 us @ sp3 | P12 = 2000 us @ sp1 |
| (Уотергейт) | (скульптура возбуждения) | |
| 13 13 Несущая частота C, резонансная с химическим сдвигом 13C пика интереса | О2П | – |
| 15 15 Несущая частота N, средний химический сдвиг 15N для разъединение (как используется в ароматическом HSQC) | О3П | – |
| 13 13 Разъединение C/15N (настроено как в HSQC) | ППД2, СПД2 | – |
| pcpd3, cpd3 | ||
| Передача HCP (например, p=1/J при 100 Гц) | – | |
| импульсные и импульсные команды pulsef2 могут использоваться для определения мощности от жестких импульсов | ||
| Продолжительность (установленная на 1/J(1H-13C) интересуемого пика) | П11 | |
| Мощность 1H и мощность на 13C | ПАКЕТ ОБНОВЛЕНИЯ 1 (SP1), ПАКЕТ ОБНОВЛЕНИЯ 12 (SP12) | |
| Передача SELOPE (d = 1/4J(H5-H6)) | – | Д5 |
| Селективный импульс (например, ароматическая область) для SELOPE (4000 us, Eburp) | – | P13 & SP4 |
| SL / RD-специфические параметры: | ||
| 1 1 Мощность H SL, полученная из калиброванного жесткого импульса (например, с помощью импульсной команды). | Pl25 & CNST12 (1,2 – 15 кГц) | Pl24 (50 Гц – 15 кГц) |
| Список переменных задержек для длительности SL (изначально 1 запись, 0, оптимизация, описанная в разделе 3.1.3) | vdlist (~ 0 – 40 мс) | vdlist (~ 0 – 150 мс из-за низкого R2 в немаркированных образцах) |
| TDF1 количество записей в списке vd (изначально 1) | ТДФ1 | ТДФ1 |
| Тепловая компенсация: | ||
| D30 = наибольшее значение в списке vd + 2 мс | Д30 | Д30 |
| Дополнительная тепловая компенсация для очень широкого диапазона СПЛ | ПЛ25 | |
| Внерезонансные специфические параметры: | ||
| импульсная программа для нерезонансных 1Ds | 1HR1rho_HCP_offres1D.es | 1HR1r_HH_offres1D.js |
| Смещение для внерезонансных экспериментов | CNST30 | CNST30 |
Таблица 2: Обзор параметров для настройки экспериментов 1D HCP и 1D-SELOPE 1H R1ρ. Сокращения: 1D = одномерный; HCP = гетероядерная кросс-поляризация; SELOPE = SELective Оптимизированный протонный эксперимент; ppm = частей на миллион; HSQC= гетероядерная спиновая квантовая корреляция; SL = блокировка спина; RD = релаксационная дисперсия
- Настройка и получение резонансных экспериментов 1H R1ρ
- Скопируйте эксперимент из раздела 3.4 в новую папку в Topspin.
- В этой папке настройте эксперименты с разной силой SL, каждый раз меняя PL25 и CNST12. Определите правильный уровень мощности для каждой силы SL с помощью команды pulse. Используйте силы SL в диапазоне от 1,2 до 15 кГц с более плотной выборкой для более низких сил SL (см. Рисунок 5G для выбранных сил SL). Добавьте копии некоторых экспериментов, чтобы иметь дубликаты для некоторых сильных сторон SL.
- Запустите эти эксперименты.
- Анализ резонансных экспериментов 1H R1ρ
- В TopSpin обработайте каждый срез каждого псевдо-2D набора данных, используя одни и те же параметры обработки(например, расширение строки, фаза) с помощью команды xf2и разделите набор данных на 1D с помощью программы Bruker AU split2D.
- Получение интенсивности и громкости сигнала для каждого 1D-среза.
ПРИМЕЧАНИЕ: На практике лучше деконволюцию спектров, чтобы избавиться от вкладов от потенциально перекрывающихся пиков и позволяет использовать программу Bruker AU multidcon, которая удобно суммирует интенсивности или области пиков всех срезов в одном эксперименте в текстовом файле decall.txt, который затем может быть легко прочитан с другими программами (скрипты Python, написанные здесь, как описано Steiner et al.10)на шагах 3.6.3 и 3.6.4. - Подойдите к моно экспоненциальному распаду для каждой силы SL,чтобы получить значение R1ρ (или on-resonance, R2+REX).
- Построение этих значений R2+REX (y) против. Прочность SL (x)(рисунок 5F,G).
ПРИМЕЧАНИЕ: Если значения значительно выше для низких сил SL и уменьшаются с более высокой мощностью SL (как показано на рисунке 5G),то исследуемый пик показывает дисперсию, и может быть интересно провести дополнительные (внерезонансные) эксперименты для получения информации о популяции и разнице химических сдвигов возбужденного состояния против. основное состояние.
4. 1H R1ρ Релаксационная дисперсия — внерезонансная (помеченная 1D-версия)
- Настройка и получение внерезонансных экспериментов 1H R1ρ
- В новой папке topspin установите эксперименты при определенной силе SL (обычно сначала при самой низкой силе SL, поскольку вклад REX там самый высокий, см. Рисунок 5G для репрезентативного выбора нерезонансных SL), но с различными смещениями, каждый раз изменяя CNST30.
- Используйте смещения до ± (3 или 4)* прочность SL, с более плотной выборкой около 0 смещений, как показано на рисунке 5H,I.
- Запустите эти эксперименты.
- Анализ внерезонансных экспериментов 1H R1ρ
- Используйте ту же стратегию обработки, что и в 3.6.1–3.6.3, чтобы определить значение R1ρ для каждого смещения.
- Постройте эти значения против смещения (рисунок 5G).
ПРИМЕЧАНИЕ: Асимметрия в этой кривой уже может указывать на то, что информация о химическом сдвиге для возбужденного состояния может быть получена. Тщательная подгонка и анализ с использованием уравнений Блоха-Макконнелла или Лагерра должны быть выполнены для получения информации о kEX, pES, а также Δω10,20 (рисунок 5G). Примеры наборов данных, импульсных программ и макросов для обоих 1D-экспериментов можно найти в репозитории Petzold Lab Github (https://github.com/PetzoldLab). Обзор параметров приведен в таблице 2.
Результаты
Протокол производства РНК облегчает очистку за счет генерации транскриптов высокой чистоты. На рисунке 3А показаны результаты нескольких реакций расщепления тандемных транскриптов, обеспечивающих как успешные, так и неудачные реакции. Полоса 1 показывает оптимальный случай полностью расщепленной расшифровки с лишь слабыми следами боковых продуктов. Полоса 2а демонстрирует неполное расщепление, которое может быть устранено путем повторного отжига и добавления большего количества РНКазы Н (полоса 2b, этап 2.1.2). Конструкции РНК полос 1, 2a и 2b одинаковы. Образец в полосе 3 показывает неудачное расщепление. Устранение неполадок этой реакции будет включать проверку последовательности направляющих расщепления, чистоты шаблона ДНК и температуры отжига. Потенциально расщепление РНКазы Н должно быть выполнено после T7 IVT, как показано для примера 2.
Образец в полосе 4 показывает значительное количество побочных продуктов расщепления, которые трудно удалить с помощью ионообмонной ВЭЖХ. Поиск и устранение неисправностей такого образца может включать (а) снижение температуры, количества РНКазы Н или времени реакции, (б) уменьшение градиента элюирования и объема впрыска и попытку отделить целевые фракции от побочных продуктов. Дополнительная информация о том, как увеличить разрешение при очистке ионообмонной ВЭЖХ, обсуждалась Karlsson et al.31. ВЭЖХ отделяет целевую РНК от более длинных или более коротких нуклеиновых кислот и белковых или низкомолекулярных загрязнителей. На рисунке 3В показан оптимальный результат для ионообмонной очистки ВЭЖХ. Градиент элюации должен быть выбран таким образом, чтобы целевой вид РНК элюировал по меньшей мере один объем столбца (в этом примере: 35 мл) после следующего меньшего вида и один столбец перед следующим более крупным видом.
Более мелкие виды в этом методе включают одиночные нуклеотиды, абортивные продукты (8-12 nt), 3' и 5' спейсерные последовательности (5-14 nt) и направляющие расщепления (12 nt химерной нуклеиновой кислоты), тогда как более длинные последовательности являются потенциально неочищенными тандемными повторами и плазмидой. Когда достигается хорошо разделенный пик элюдения, очистка может быть увеличена до эквивалента ~ 20 мл реакции IVT за инъекцию. Правильная складка образца РНК имеет решающее значение для экспериментов RD и должна быть подтверждена перед каждым измерением. На рисунке 4 показана А-меченая 22-мерная РНК до того, как был применен протокол складывания на этапе 2.4 (синий), и тот же образец после достижения правильного складывания (красный). Предсказание вторичной структуры Mc-Fold(рисунок 4C)предлагает представленную структуру шпильки с 4 парами оснований, в результате чего получается 5 сигналов имино.
Оба спектра на рисунке 4А подтверждают эти предсказанные сигналы, хотя и с немного отличающейся относительной интенсивностью, что указывает на то, что некоторую неправильно свернутую структуру (здесь димер) может быть проблематично оценить только с помощью спектров 1H 1D. Ароматический спектр 1H,13C-HSQC(рисунок 4B),однако, показывает только 3 ароматических сигнала для образца до протокола складывания (синий), но все 4 сигнала для образца, который был сложен в соответствии со этапом 2.4 (красный). Образец, показанный синим цветом, вероятно, сформировал гомодимер (структура, предложенная на рисунке 4D),который привел бы к тем же сигналам имино, что и шпилька. Сигнал A13H2 кажется расширенным. Эти результаты помогают подчеркнуть важность подтверждения складывания как с помощью экспериментов с имино, так и с ароматическими отпечатками пальцев перед каждым экспериментом RD. Последовательности импульсов 1H R1ρ, описанные в этом протоколе, позволяют обнаруживать динамику в промежуточном обменном режиме. Первоначально регистрируется резонансная кривая, и если динамика присутствует для конкретного остатка, то в пределах полученных значений R2+REX видна дисперсия, в то время как эта кривая плоская для остатков без обмена.
На фиг.5 показаны репрезансные кривые, полученные для двух разных атомов H8 в синтетической шпильке РНК(рисунок 5A),где G6H8 обменивается опытом(рисунок 5C),в то время как A4H8 этого не делает(рисунок 5B). Поскольку обмен в этом образце относительно медленный(kEX = 292 ± 40 Гц), было использовано преимущество эксперимента SELOPE для достижения низких сил SL, и две резонансные кривые были записаны с использованием 1D-версии последовательности импульсов. Затем та же последовательность импульсов использовалась для получения внерезонансных данных для остатка, показывающего дисперсию в резонансном профиле. На рисунке 5D показаны полученные значения R1ρ против смещения, в котором небольшая асимметрия кривой уже указывает на знак Δω.
Это становится еще более очевидным на графике R2+ REX, где вклад R1 удаляется(рисунок 5E). В правом столбце того же рисунка показаны репрезентативные резонансные кривые, полученные для двух разных атомов H8 в немного отличающихся синтетических РНК шпильках с более быстрым обменом, при этом G6H8 обменивается опытом(рисунок 5G),тогда как A4H8 этого не делает(рисунок 5F). Более быстрый обменный курс(kEX = 43 502 ± 38 478 Гц) позволил записывать RD всех ароматических протоны сразу с использованием версии SELOPE 2D для получения как вкл-, так и внерезонансных данных (данные G6H8, показанные на рисунке 5H,I).
Общие идентификаторы положительных и отрицательных результатов
Положительные результаты в тандемном расщеплении IVT и RNase H можно определить следующим образом: 1) Целевая полоса является самой сильной полосой в денатурии геля PAGE. 2) Вокруг основной полосы нет или только слабые полосы. 3) Нет или только слабые более высокомолекулярные виды. 4) Хроматограмма ВЭЖХ показывает хорошо разделенный пик целевой РНК. 5) При отборе проб основного пика на денатурирующую геле PAGE появляется только одна полоса.
Отрицательные результаты в расщеплении тандема IVT и RNase H представлены следующим образом: 1) На денатуривном геле PAGE видна слабая или просто слабая основная полоса. 2) Виден рисунок высокомолекулярных видов из тандемных повторов РНК. 3) Хотя основная полоса присутствует, полосы аналогичной интенсивности находятся выше или ниже основной полосы в пределах ± 3 нт.
Хорошо сложенный образец может быть идентифицирован следующим образом: 1) Количество наблюдаемых протоонов имино соответствует количеству протоонов имино, ожидаемых от моделирования вторичной структуры(например,Mc-Fold39, рисунок 4A). 2) Пара оснований колебания syn G-U в петле UUCG (если она присутствует) видна при ~ 9,5 ppm, иногда видна только при более низкой температуре. Дальнейшая дактилоскопия петли UUCG была описана Фюртигом и его коллегами40. 3) Ароматический отпечаток согласуется с ранее назначенным образцом, который, как было подтверждено, правильно складывается(рисунок 4C).
Неправильно свернутую или деградиивную выборку можно идентифицировать следующим образом: 1) Существует больше сигналов имино, чем предсказывает моделирование вторичной структуры (ПРИМЕЧАНИЕ: меньшее количество сигналов имино не обязательно подразумевает неправильное сворачивание, так как закрывающие пары оснований часто не видны, а конформационный обмен расширяет линии). 2) Отсутствие сигналов имино. 3) Узкие сигналы высокой интенсивности в ароматической области, указывающие на продукты распада одиночных нуклеотидов. 4) Расхождение между имино или ароматическими сигналами с эталонным образцом подтвержденного складывания(рисунок 4С).
Атом, не показывающий обмена в обнаруживаемой временной шкале, может быть идентифицирован следующим образом: 1) по плоскому профилю RD (из-за отсутствия вклада REX, изменяющегося в зависимости от приложенной мощности SL)(рисунок 5B и рисунок 5F). 2) Следует позаботиться о случае медленного промежуточного обмена, когда kEX и Δω имеют одинаковую величину. В этом случае резонансный вклад может быть очень мал, как видно на рисунке 5C (в этом случае установленные параметры k EX = 292 ± 40 Гц и Δω = 112 ± 4 Гц). Если есть сомнения, низкая кривая вне резонанса SL может быть записана для проверки.
Атом, показывающий обмен в промежуточной шкале времени, может быть идентифицирован 1) по неплощестному релаксационной дисперсионному дисперсионному профилю в резонансном эксперименте RD(рисунок 5B и рисунок 5F); 2) более широкая ширина линии в эксперименте HSQC или SELOPE также может быть индикатором для обмена.
Хорошо подобранные значения мощности SL для кривых вне резонанса(рисунок 5E,F):1) имеют значительный вклад kEX в резонансную кривую (выбранные значения мощности SL указаны на рисунке 5C и рисунке 5G). 2) Поскольку кривые вне резонанса измеряются по крайней мере для 3 значений мощности SL, выбранные значения мощности SL должны быть распределены по области резонансной кривой с вкладом kEX. 3) Приведите к неплохим кривым R2+REX после подгонки Laguerre(например, рисунок 5D:силы SL 25, 50 и 75 Гц; Рисунок 5Е).
Плохо подобранные значения мощности SL для нерезонансных кривых(рисунок 5E,F)приводят к плоским кривым R2+ REX после подгонки Лагерра. Пример показан на рисунке 5E,где кривая нерезонанса 100 Гц очень плоская и, следовательно, не дает существенной информации о Δω.
Показания к артефактам вращательно-рамочного ядерного эффекта Оверхаузера (ROE): 1) Δω, полученные из внерезонансных кривых, соответствуют химическим сдвигам протоонов в пространственной окрестности / протонам, которые показывают перекрестный пик с пиком интереса к ядерному спектроскопии эффекта Оверхаузера (NOESY). (Например, на рисунке 5I показаны широкие нерезонансные кривые, как и ожидалось для быстрого промежуточного обмена, но кривые также имеют более резкие особенности, например,при -3000 Гц и +1500 Гц. Это, скорее всего, связано с артефактом ROE, а не с химическим сдвигом для этого H8 в другом конформере). 2) Laguerre fit действительно работает, но плохо работает (дает высокие погрешности или физически невозможные значения) для резонансной и по крайней мере 3 внерезонансных кривых, хотя экспоненциальные кривые были получены из экспериментов с высоким SINO (>20)(например, kEX = 43 502 ± 38 478 Гц). Часто каждый SL хорошо подходит по отдельности, но подгонка их вместе дает гораздо более высокую погрешность; противоположное поведение ожидается для истинно возбужденного состояния.
Показания к «истинному» обмену Δω: 1) Δω, полученные из нерезонансных кривых, не соответствуют химическим сдвигам протоонов в пространственной окрестности/протонам, которые показывают поперечный пик с пиком интереса в спектре NOESY(например, рисунок 5E). 2) Laguerre fit дает низкие погрешности для резонанса и, по крайней мере, 3 нерезонансные кривые(например, рисунок 5E против. Рисунок 5I, см. подпись для получения результатов подгонки).
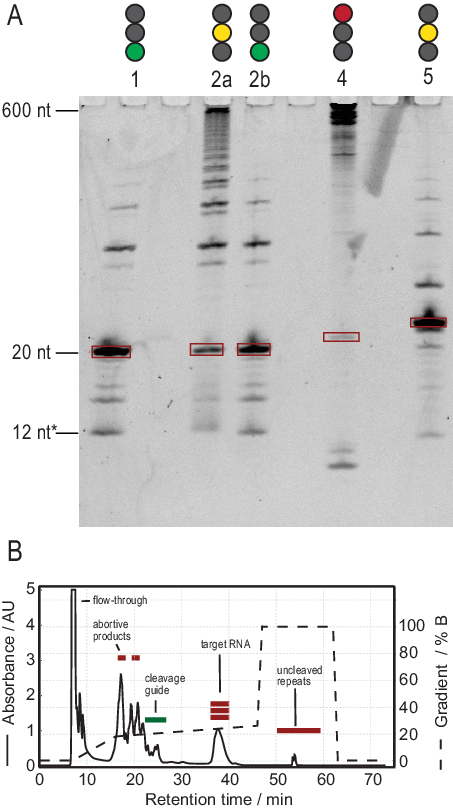
Рисунок 3:Получение образца тандемом Т7 IVT и реакцией расщепления РНКазы Н. (А) Денатурирование PAGE положительных и отрицательных результатов расщепления тандема IVT и RNase H. Высота лестницы относится к ссылкам на РНК, 12* относится к химерическому руководству по расщеплению. Линия 1: Успешная генерация целевой РНК 20 нт. Присутствует несколько более коротких и длинных продуктов. Полоса 2а: Неполное расщепление стенограммы тандема. Хотя очистка ВЭЖХ возможна, много материала будет потрачено впустую. Полоса 2b: Продолжающееся расщепление RNase H полосы 2 производит чистый образец, готовый к впрыску ВЭЖХ (идентично полосе 1). Полоса 4: Расщепление RNase H было в значительной степени неудачным, и не было создано целевой группы. Полноразмерная тандемная расшифровка все еще видна на 600 нт. Lane 5: Была создана целевая группа, но присутствует сильная группа -1. Хотя ВЭЖХ может быть выполнена, необходимо тщательное удаление побочного продукта. (B) Пример успешной инъекции ВЭЖХ. Пик в 38 мин содержит чистую РНК целевой длины, в то время как более длинные и короткие продукты хорошо отделены от целевой РНК. Панель B была изменена с 21. Сокращения: IVT = транскрипция in vitro; ВЭЖХ = высокоэффективная жидкостная хроматография; nt = нуклеотиды; AU = произвольные единицы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
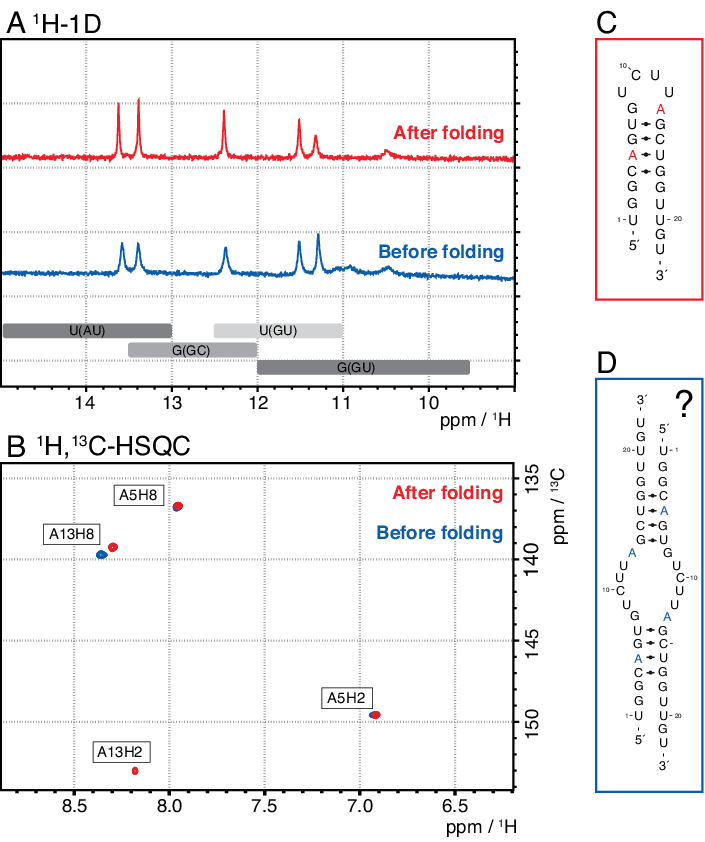
Рисунок 4:Пример шпильки РНК до (синий) и после (красный) этапа складывания 2.4 (см. протокол) в ЯМР. (A)Область Имино 1H-1D спектра А-меченой 22-мерной РНК. Ожидаемые области для идентичности пары оснований сигналов имино обозначены серым цветом ниже. (B) 1H,13C-HSQC спектр ароматических резонансов РНК из панели А. Образец после складывания (красный) показывает 4 сигнала, как и ожидалось, в то время как образец перед сворачиваемо (синий) показывает только 3 сигнала. (C)Предсказание Мак-Фолдом 22-мерной РНК в качестве шпильки. От этой вторичной структуры следует ожидать пять сигналов имино, которые можно найти в обоих образцах на панели A.(D)Предложенная структура гомодимера, образованного 22-мерной РНК, в результате чего получаются те же 5 пар оснований, что и структура шпильки. Сокращения: ЯМР = ядерный магнитный резонанс; 1D = одномерный; HSQC = гетероядерная одиночная квантовая корреляция; ppm = частей на миллион. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
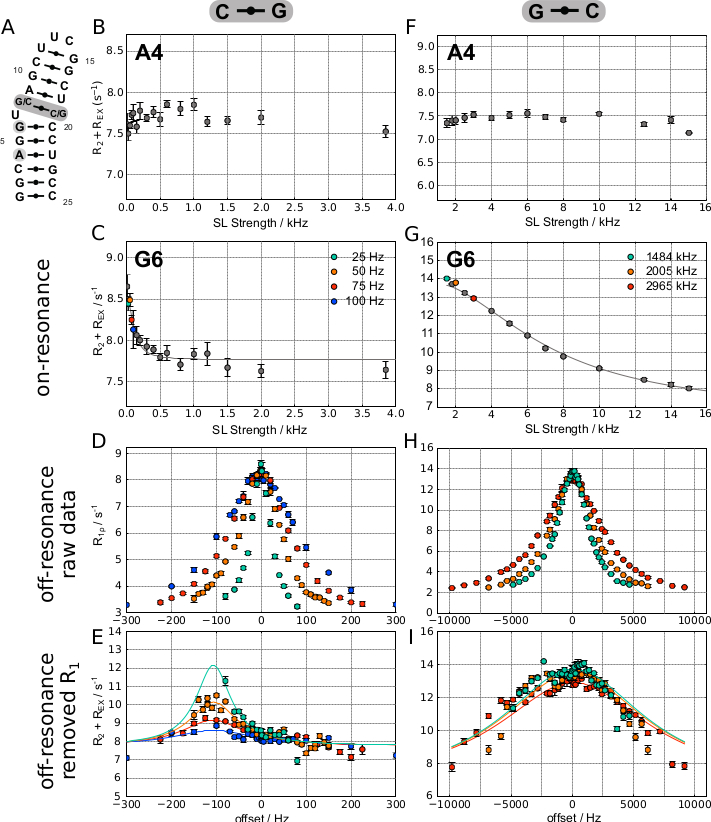
Рисунок 5: 1H R1ρ RD репрезентативные результаты для двух различных конструкций, основанных на шпильке РНК. (A) Левая колонка показывает результаты, полученные на РНК с парой оснований C-G над выпуклым U, в то время как правая колонка показывает результаты, полученные на образце, где пара оснований была переключена на G-C. (B)и(F)показывают плоские дисперсионные профили, полученные для A4H8 для двух конструкций, что указывает на отсутствие конформационного обмена. (C–E) показывают резонансные, внерезонансные и подогнанные данные, полученные для G6 в конструкции (G-C). Подгонка Лагерра приводит к следующему результату: R1 = 2,87 ± 0,01 Гц, R2 = 7,76 ± 0,03 Гц, kEX = 292 ± 40 Гц, pES = 0,31 ± 0,03 %, Δω = 112 ± 4 Гц. (G–I) показывают резонансные, внерезонансные и встроенные данные, полученные для G6 в конструкции (G-C). Подгонка Лагерра приводит к следующему результату: R1 = 1,93 ± 0,02 Гц, R2 = 6,71 ± 0,86 Гц, kEX = 43 502 ± 38 478 Гц, pES = 27 ± 16 %, Δω = 203 ± 166 Гц. Эта цифра была изменена с 20. Аббревиатура: SL = блокировка спина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Протокол, представленный в настоящем документе, представляет собой синтез нескольких протоколов, опубликованных ранее в виде исследовательских статей10,20,21,31. Следовательно, сегменты протокола могут быть применены, в то время как другие могут быть обменяны по предпочтениям читателя. Например, измерения R1ρмогутбыть выполнены на образце РНК, полученном любым методом, учитывая, что предполагается сворачивание и однородность длины. Кроме того, протокол не содержит информации о резонансном присвоении последовательности РНК - шаге, необходимом для экспериментов RD, - поскольку это было подробно освещено в предыдущей литературе19,37,38. Схемы частичной, сегментной или специфичной для сайта маркировки36,41,42,43,44 представляют собой подходы, облегчающие назначение резонанса или уменьшающие перекрытие резонансов, которые представляют интерес в экспериментах RD и подробно описаны в литературе. Этот метод позволяет использовать единую маркировку любой нуклеотидной идентичности, что уже может значительно упростить резонансное присвоение.
Метод IVT, представленный здесь, преодолевает известные проблемы с последовательностями и маркировкой, увеличивает выход и снижает стоимость и время работы по сравнению с другими методами. Использование последовательности вирусных инициаций уменьшает потребность в оптимизации реакции, что является известной проблемой в этой области, которая может занять много времени для выполнения и дает только несколько копий транскрипта в случае инициации без G. Расщепление T7 IVT и RNase H тандемного транскрипта может быть выполнено одновременно в одном сосуде. Картина многомерных тандемных повторов может быть замечена на денатурировавщем геле PAGE во время реакции, который сливаются в одну полосу на целевой РНК по завершении реакции RNase H(рисунок 3A,полосы 1 и 2b). Типичные выходы с использованием этого метода варьируются от 30 до 70 нмоль РНК на 1 мл IVT. Тем не менее, метод, основанный на расщеплении RNase H тандемных повторов, не обойдется без определенных проблем. Реакция расщепления РНКазы Н часто не доходит до завершения при одновременном выполнении с транскрипцией Т7(рисунок 3А,полоса 2а).
Разделение тандемных единиц может быть завершено путем отжига направляющей по расщеплению к расшифровке и добавления дополнительных РНКазы Н(рисунок 3А, полоса2b, этап 2.1.2). Поскольку нагрев больших объемов происходит медленно и приводит к катализируемомуMg2+гидролизу РНК, была использована обычная микроволновая печь, которая нагревает образец до >95 °C за 10-15 с. Неблагоприятного воздействия на произведенные образцы до сих пор не наблюдалось. Некоторые конструкции показывают второстепенную вторую полосу, которая не может быть устранена оптимизацией условий реакции(рисунок 3A,полоса 4). Обычно они довольно хорошо видны в виде плеча на хроматограмме ВЭЖХ, если используется хорошо оптимизированный градиент элюдации, и могут быть удалены (шаг 2.2.5). Нижеследующее обсуждение направлено на то, чтобы выделить критические шаги в протоколе, в частности, в отношении получения высококачественных данных, которые позволяют интерпретировать конформационную динамику.
Загрязнение РНКазой
Внеклеточные РНКазы вездесущи, очень стабильны и представляют наибольшую угрозу для долгосрочной стабильности образцов ЯМР. Поэтому крайне важно работать в среде, свободной от РНКазы, и хранить все реагенты и пластиковую посуду без РНКазы. Рекомендуется использовать наконечники фильтров и, возможно, даже маски для лица. Это особенно важно после очистки ВЭЖХ. Образцы ЯМР, загрязненные РНК, обычно демонстрируют узкие пики, видимые в спектрах 1H-1D через несколько дней или недель из-за продуктов деградации однонуклеотидов. Такой образец не подходит для измеренийR1ρ.
Образец ЯМР
Благодаря своей высокозаряженной природе РНК может использоваться в высоких концентрациях без осаждения по сравнению с большинством белков. Использование ЯМР-трубок Shigemi (см. Таблицу материалов)является преимуществом, поскольку они позволяют центрировать высококонцентрированный образец в центре катушки, обеспечивая при этом идеальные условия шимминга и блокировки благодаря соответствующему чувствительности стеклянному дну и плунжеру. Таким образом, B1-неоднородность уменьшается, что приводит к более узким линиям. Типичный объем образца в ЯМР-трубке составляет 250 мкл, а типичная концентрация составляет 1-2 мМ. Образцы ниже 500 мкМ не рекомендуются для экспериментов RD, так как эксперимент займет слишком много времени и хорошую прокладку. Аналогичным образом, объем образца ниже 200 мкл не рекомендуется, поскольку требуется хорошая прокладка и стабильность поля (блокировка). При вставке плунжера крайне важно избегать образования пузырьков в образце (этап 2.4.5). Если плунжер не закреплен должным образом, он может скользить вниз в образец, уменьшая обнаруживаемый объем. Кроме того, быстрые изменения температуры могут привести к образованию новых пузырьков в образце. Поэтому следует проявлять осторожность при транспортировке образца и при изменении температуры зонда в ЯМР-спектрометре. Проверьте образец на наличие пузырьков при повторном измерении через более длительный период.
Сворачивание РНК
Динамические молекулы РНК могут существовать в нескольких конформациях, если они не сложены должным образом. Несмотря на то, что температура плавления вторичных конструкций может быть лишь немного выше комнатной температуры, перед измерением рекомендуется тщательная процедура нагрева и охлаждения. Высококонцентрированные образцы шпильки, складывающиеся под кинетическим контролем (нагревание и оснасткивающее охлаждение), могут со временем образовывать гомодимеры, что требует строгого контроля сворачивания РНК перед каждым измерением ЯМР. Если измеренная РНК представляет собой не структуру шпильки, а дуплекс РНК, следует применять медленное складывание под термодинамическим контролем.
При этом процесс охлаждения после нагрева должен находиться в пределах часов, при этом РНК используется при ее конечном объеме и концентрации в образце ЯМР. Первоначальное количество ожидаемых резонансов имино и ароматических веществ может дать представление об однородности образца. Если образец выглядит не так, как ожидалось, его следует сложить заново. Mg2+ (добавленный в виде хлоридной соли) может помочь при сворачивании структур РНК45. На практике складчатый контроль служит сравнением с образцом, который был использован для хотя бы частичного присвоения резонансов ЯМР и для экспериментального решения вторичной структуры.
Особенности питания и нагрева отжима
В случае проведения экспериментов 1H R1ρ RD в качестве обзорных экспериментов 2D, мощность SL должна быть не ниже 1,2 кГц. Радиочастотная частота передатчика должна быть помещена в середину области ppm интересующих пиков(например,7,5 ppm для ароматических протонов). Полоса пропускания 1,2 кГц будет достаточно большой, чтобы зафиксировать эти протоны без каких-либо серьезных внерезонансных эффектов. Такие эффекты могут быть идентифицированы в профиле RD. Если они возникают, значения R2+REX увеличиваются, а не уменьшаются с увеличением значений мощности SL, особенно для низкой мощности SL. Проверьте, соответствуют ли рассчитанные значения мощности SL мощности, подаемой в образец. На практике расчетная мощность SL может быть использована, если жесткий импульс 1H 90° был тщательно откалиброван на более новых спектрометрах; однако это можно проверить, калибруя мощность SL для каждой желаемой полосы пропускания.
Диапазон мощности SL, который может бытьиспользован в экспериментах 1 H R1ρ RD, очень широк, что приводит к различному нагреву образца (от 1,2 кГц до 15 кГц для HSQC для последовательностей на основе HCP и от 50 Гц до 15 кГц для экспериментов SELOPE). Неравномерный нагрев образца может быть обнаружен как незначительное изменение химического сдвига при сравнении 1D, полученных для SLs с низким энергопотреблением, и. высокомощные СПЛ. Этот эффект обычно не учитывается в тепловых компенсациях в экспериментах R1ρ на гетеронуклеях. Тепловая компенсация в этих экспериментах обычно устанавливается для коррекции для разного нагрева из-за различной длительности блокировки спина, указанной в списке vd каждой серии мощности блокировки спина. Специально для эксперимента SELOPE вторая тепловая компенсация должна использоваться для всех приложенных прочности SL, как описано в20.
Рекомендации по списку vd
Как упоминалось ранее, список vd должен содержать точку времени, достаточно длинную для получения значительного снижения интенсивности (в идеале до 30% начального сигнала или как можно ниже, если невозможно достичь 70% распада в пределах спецификаций зонда). Хотя список vd был оптимизирован для низкого энергопотребления SL (1,2 кГц), этот список vd также должен быть протестирован при максимальной мощности SL, которая будет использоваться(например,15 кГц). Это связано с тем, что для пиков со значительным вкладом REX распад будет намного медленнее при высокой мощности SL. Таким образом, достаточный распад также должен быть проверен при высокой мощности SL. То же самое следует учитывать для распадов при высоких смещениях в нерезонансных экспериментах. Идеальная максимальная точка времени списка vd может значительно отличаться для разных областей эксперимента по дисперсии. В этом случае в список vd может быть включено больше точек, а более длинные точки списка vd для более высокой мощности SL или более высоких смещений во время анализа, основанные на низком SINO, к которым они приведут, могут быть отброшены. В общем, следует рассматривать 5-8 точек списка vd, чтобы иметь возможность обналичивать потенциальные артефакты, приводящие к неконциненциальным распадам, таким как J-связь (см. Ниже).
1D-Соображения селективности HCP
Особую осторожность следует проявлять при запуске 1D-версии на основе HCP, если есть еще один пик, перекрывающийся с пиком интереса в измерении 1H эксперимента на основе 2D HSQC. Переносы на основе HCP очень, но никогда не на 100% избирательны, и поэтому может случиться так, что еще один пик способствует интенсивности и поведению распада пика интереса к 1D. Показателем этого будет разница в резонансных значениях R1ρ, полученных с использованием 1D и 2D версий меченого эксперимента.
Соображения по ROE:
Для нерезонансных кривых атомов с медленным промежуточным обменом артефакты ROE могут быть идентифицированы на основе сравнения полученного Δω со спектром NOESY или ROESY. Если поперечный пик может быть идентифицирован при разности химических сдвигов, соответствующей Δω,то наблюдаемое возбужденное состояние может фактически быть артефактом ROE(например,ROE были найдены между ароматическими протонами, которые все находятся в одном и том же диапазоне химического сдвига и, следовательно, покрыты этими нерезонансными кривыми20). По опыту, это всегда приводило к плохим посадкам с большими ошибками, возможно, из-за того, что ROE не следовал той же схеме, что и REX с увеличением мощности SL. Ситуация усложняется для промежуточно-быстрого обмена. В то время как резонансная кривая (из сравнения с данными 13C, полученными на соседнем ядре) по-прежнему репрезентативна для процесса обмена между GS и ES, на нерезонансную кривую влияют множественные артефакты ROE.
В этом случае мощность SL для обнаружения процесса обмена больше (>1,5 кГц) и, следовательно, охватывает большее количество протонов, поскольку нерезонансные кривые охватывают различия химических сдвигов различных кандидатов в ROE (для H8 это будут: аминопротоны на частоте около ±1000 Гц, H5 / H1 при около -1200 Гц, протоны имино при частоте около 3500 Гц). До сих пор не было найдено никакого метода подавления этих артефактов ROE (кроме использования частично дейтерированных нуклеотидов46),и нерезонансные данные не должны регистрироваться для быстрого промежуточного обмена, поскольку никакая достоверная информация о фактическом Δω не может быть извлечена с помощью этого метода, если вклад NOE / ROE не может быть исключен с помощью спектров NOESY.
Рекомендации по J-соединению (Хартманн-Хан)
Хотя резонансные кривые для гомоядерных J-связанных протонов, таких как H6, были успешно зарегистрированы10,20,особое внимание должно быть принято для внерезонансных измерений, особенно для низкой мощности SL, поскольку условия соответствия Хартмана-Хана могут охватывать широкий диапазон исследуемых смещений. Артефакты Хартмана-Хана могут быть идентифицированы как колебания на экспоненциальном распаде или увеличении значений R2+REX с увеличением прочности SL на резонансных графикахRD 20.
Раскрытие информации
К.П. является консультантом Arrakis Therapeutics, компании, которая обнаруживает небольшие молекулы, нацеленные на РНК.
Благодарности
Мы благодарим научно-протеиновый научный центр (PSF) в Каролинском институте за экспрессию и очистку РНК-полимеразы Т7 и RNase H E. coli, Мартина Хелльберга за щедрый дар неорганической фосфатазы и всю Лабораторию Петцольда за ценные дискуссии. Мы благодарим Луку Ретаттино за подготовку конструкций U-bulge, а также Эмили Штайнер и Каролину Фонтану за их вклад в макросы и примерку сценариев. Мы выражаем признательность Каролинского института и Департаменту медицинской биохимии и биофизики за поддержку покупки спектрометра 600 МГц и позиционное финансирование (KI FoAss и KID 2-3707/2013). Мы благодарны за финансовый вклад от Vetenskapsrådet (#2014-4303), Stiftelsen för strategisk Forskning (ICA14-0023 и FFL15-0178) и The Ragnar Söderberg Stiftelse (M91-14), Harald och Greta Jeansson Stiftelse (JS20140009), Carl Tryggers stiftelse (CTS14-383 и 15-383), Eva och Oscar Ahréns Stiftelse, Åke Wiberg Stiftelse (467080968 и M14-0109), Cancerfonden (CAN 2015/388), J.S. признает финансирование через Marie Skłodowska-Curie IF (EU H2020, MSCA-IF project No 747446).
Материалы
| Name | Company | Catalog Number | Comments |
| 40% Acrylamide/Bis Solution | Bio-Rad | 161-0144 | |
| 5-alpha Competent E. coli | NEB | C2987I | |
| Acetic Acid | Sigma-Aldrich | 49199 | |
| Acetonitrile | Sigma-Aldrich | 34851 | |
| AFC-3000, HPLC Fraction collector | Thermo Scientific | 5702.1 | |
| Agarose | Sigma-Aldrich | A9414 | |
| Amersham ImageQuant 800 UV | GE Healthcare | 29399482 | Replacing LAS-4000 or equivalent |
| Amicon ultra centrifugal filter unit | Sigma-Aldrich | UFC900324 | |
| Ammonium persulfate | Sigma-Aldrich | A3678 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| ATP | Sigma-Aldrich | A2383 | |
| ATP-13C10/15N5 | Sigma-Aldrich | 645702 | |
| BamHI restriction enzyme | NEB | R0136L | |
| Bottle top filter | VWR | 514-1019 | |
| Bromophenol Blue | Sigma-Aldrich | 1081220005 | |
| Cleavage guide | IDT | N/A | or equivalent |
| CTP | Sigma-Aldrich | C1506 | |
| CTP-13C10/15N5 | Sigma-Aldrich | 645699 | |
| D2O | Sigma-Aldrich | 151882 | |
| Dionex Ultimate 3000 UHPLC system | Thermo Scientific | N/A | |
| DL-Dithiotreitol | Sigma-Aldrich | 43815 | |
| DMSO | Sigma-Aldrich | D8418 | |
| DNAPac PA200 22x250 Semi-Prep column | Thermo Scientific | SP6734 | |
| DNAPac PA200 22x50 guard column | Thermo Scientific | SP6731 | |
| E.coli RNase H | NEB | M0297L | or made in-house uniprot ref. P0A7Y4 |
| EDTA | Sigma-Aldrich | E6758 | |
| Eppendorf centrifuge, rotor: A-4-44 | Eppendorf | 5804R | |
| Ethanol 95% | Fisher scientific | 11574139 | |
| Ethanol 95% denatured | VWR | 85829.29 | |
| Formamide | Sigma-Aldrich | 47671 | |
| GelRed | VWR | 41003 | |
| GeneRuler 1kbp Plus | Fisher Scientific | SM1333 | Optional |
| GMP | Sigma-Aldrich | G8377 | |
| GMP-13C10/15N5 | Sigma-Aldrich | 650684 | |
| GTP | Sigma-Aldrich | G8877 | |
| GTP-13C10/15N5 | Sigma-Aldrich | 645680 | |
| Hydrochloric Acid | Sigma-Aldrich | H1758 | |
| Inorganic pyrophosphatase | Sigma-Aldrich | I1643-100UN | or made in-house uniprot ref. P0A7A9 |
| Invitrogen UltraPure 10X TBE-buffer | Sigma-Aldrich | T4415 | |
| Julabo TW8 Water bath | VWR | 461-3117 | |
| kuroGEL Midi 13 Horizontal gel electrophoresis | VWR | 700-0056 | or comparable |
| LB broth (Lennox) | Sigma-Aldrich | L3022 | |
| LB broth with agar (Lennox) | Sigma-Aldrich | L2897 | |
| Low Range ssRNA Ladder | NEB | N0364S | Optional |
| LPG-3400RS Pump | Thermo Scientific | 5040.0036 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 63068 | |
| microRNA Marker | NEB | N2102S | |
| Microwave oven | Samsung | MS23F301EAW | |
| Mini-PROTEAN electrophoresis equipment | Bio-Rad | 1658004 | |
| NucleoBond Xtra Maxi | Machinery-Nagel | 740414.10M | |
| pUC19 plasmid containing tandem insert | Genscript | N/A | or equivalent |
| RNaseZAP | Sigma-Aldrich | R2020 | |
| Shigemi tube 5mm | Sigma-Aldrich | Z529427 | |
| Single-use syringe, Luer lock tip | VWR | 613-2008 | |
| Sodium acetate | Sigma-Aldrich | S2889 | |
| Sodium chloride | Sigma-Aldrich | 730-1470 | |
| Sodium perchlorate | Sigma-Aldrich | 71853 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S3139 | |
| Spermidine trihydrochloride | Sigma-Aldrich | 85578 | |
| SYBR Gold | ThermoFisher | S11494 | |
| Syringe filters | VWR | 514-0061 | |
| T7 RNA polymerase | Sigma-Aldrich | 10881767001 | or made in-house uniprot ref. P00573 |
| TCC-3000RS Column thermostat | Thermo Scientific | 5730 | |
| Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Tris Base | Fisher Scientific | 10103203 | |
| UMP | Sigma-Aldrich | U6375 | |
| UMP-13C9/15N2 | Sigma-Aldrich | 651370 | |
| Urea | Sigma-Aldrich | U5378 | |
| UTP | Sigma-Aldrich | U6625 | |
| UTP-13C10/15N5 | Sigma-Aldrich | 645672 | |
| VWD-3100 Detector | Thermo Scientific | 5074.0005 |
Ссылки
- Djebali, S., et al. Landscape of transcription in human cells. Nature. 489 (7414), 101-108 (2012).
- Doudna, J. A., Cech, T. R. The chemical repertoire of natural ribozymes. Nature. 418 (6894), 222-228 (2002).
- Sehgal, P. B., Westley, J., Lerea, K. M., DiSenso-Browne, S., Etlinger, J. D. Biomolecular condensates in cell biology and virology: phase-separated membraneless organelles (MLOs). Analytical Biochemistry. , 597 (2020).
- Herschlag, D., Allred, B. E., Gowrishankar, S. From static to dynamic: the need for structural ensembles and a predictive model of RNA folding and function. Current Opinion Structural Biology. 30, 125-133 (2015).
- Kimsey, I. J., Petzold, K., Sathyamoorthy, B., Stein, Z. W., Al-Hashimi, H. M. Visualizing transient Watson-Crick-like mispairs in DNA and RNA duplexes. Nature. 519 (7543), 315-320 (2015).
- Dethoff, E. A., Petzold, K., Chugh, J., Casiano-Negroni, A., Al-Hashimi, H. M. Visualizing transient low-populated structures of RNA. Nature. 491 (7426), 724-728 (2012).
- Baisden, J. T., Boyer, J. A., Zhao, B., Hammond, S. M., Zhang, Q. Visualizing a protonated RNA state that modulates microRNA-21 maturation. Nature Chemical Biology. 17 (1), 80-88 (2021).
- Marušič, M., Schlagnitweit, J., Petzold, K. RNA dynamics by NMR spectroscopy. Chembiochem. 20 (21), 2685-2710 (2019).
- Baronti, L., et al. Base-pair conformational switch modulates miR-34a targeting of Sirt1 mRNA. Nature. 583 (7814), 139-144 (2020).
- Steiner, E., Schlagnitweit, J., Lundström, P., Petzold, K. Capturing excited states in the fast-intermediate exchange limit in biological systems using 1H spectroscopy. Angewandte Chemie International Edition. 55 (51), 15869-15872 (2016).
- Moschen, T., et al. Ligand-detected relaxation dispersion NMR spectroscopy: dynamics of preQ1-RNA binding. Angewandte Chemie International Edition. 54 (2), 560-563 (2015).
- LeBlanc, R. M., Longhini, A. P., Tugarinov, V., Dayie, T. K. NMR probing of invisible excited states using selectively labeled RNAs. Journal of Biomolecular NMR. 71 (3), 165-172 (2018).
- Strebitzer, E., Nußbaumer, F., Kremser, J., Tollinger, M., Kreutz, C. Studying sparsely populated conformational states in RNA combining chemical synthesis and solution NMR spectroscopy. Methods. 1148, 39-47 (2018).
- Rangadurai, A., Shi, H., Al-Hashimi, H. M. Extending the sensitivity of CEST NMR spectroscopy to micro-to-millisecond dynamics in nucleic acids using high-power radio-frequency fields. Angewandte Chemie International Edition. 59 (28), 11262-11266 (2020).
- Hansen, D. F., Vallurupalli, P., Kay, L. E. Using relaxation dispersion NMR spectroscopy to determine structures of excited, invisible protein states. Journal of Biomolecular NMR. 41 (3), 113-120 (2008).
- Lundström, P., Akke, M. Off-resonance rotating-frame amide proton spin relaxation experiments measuring microsecond chemical exchange in proteins. Journal of Biomolecular NMR. 32 (2), 163-173 (2005).
- Lee, J., Dethoff, E. A., Al-Hashimi, H. M. Invisible RNA state dynamically couples distant motifs. Proceedings of the National Academy of Sciences of the United States of America. 111 (26), 9485-9490 (2014).
- Schnieders, R., Keyhani, S., Schwalbe, H., Fürtig, B. More than proton detection- new avenues for NMR spectroscopy of RNA. Chemistry. 26 (1), 102-113 (2020).
- Fürtig, B., Richter, C., Wöhnert, J., Schwalbe, H. NMR spectroscopy of RNA. Chembiochem. 4 (10), 936-962 (2003).
- Schlagnitweit, J., Steiner, E., Karlsson, H., Petzold, K. Efficient detection of structure and dynamics in unlabeled RNAs: The SELOPE approach. Chemistry. 24 (23), 6067-6070 (2018).
- Feyrer, H., Munteanu, R., Baronti, L., Petzold, K. One-pot production of RNA in high yield and purity through cleaving tandem transcripts. Molecules. 25 (5), 1142 (2020).
- Baronti, L., Karlsson, H., Marušič, M., Petzold, K. A guide to large-scale RNA sample preparation. Analytical and Bioanalytical Chemistry. 410 (14), 3239-3252 (2018).
- Brunelle, J. L., Green, R. In vitro transcription from plasmid or PCR-amplified DNA. Methods in Enzymology. 530, 101-114 (2013).
- Borkotoky, S., Murali, A. The highly efficient T7 RNA polymerase: A wonder macromolecule in biological realm. International Journal of Biological Macromolecules. 118, 49-56 (2018).
- Arnaud-Barbe, N., Cheynet-Sauvion, V., Oriol, G., Mandrand, B., Mallet, F. Transcription of RNA templates by T7 RNA polymerase. Nucleic Acids Research. 26 (15), 3550-3554 (1998).
- Guillerez, J., Lopez, P. J., Proux, F., Launay, H., Dreyfus, M. A mutation in T7 RNA polymerase that facilitates promoter clearance. Proceedings of the National Academy of Sciences of the United States of America. 102 (17), 5958-5963 (2005).
- Kuzmine, I., Gottlieb, P. A., Martin, C. T. Binding of the priming nucleotide in the initiation of transcription by T7 RNA polymerase. Journal of Biological Chemistry. 278 (5), 2819-2823 (2003).
- Gholamalipour, Y., Karunanayake Mudiyanselage, A., Martin, C. T. 3' end additions by T7 RNA polymerase are RNA self-templated, distributive and diverse in character - RNA-Seq analyses. Nucleic Acids Research. 46 (18), 9253-9263 (2018).
- Inoue, H., Hayase, Y., Iwai, S., Ohtsuka, E. Sequence-dependent hydrolysis of RNA using modified oligonucleotide splints and RNase H. FEBS Letters. 215 (2), 327-330 (1987).
- Wang, X., Li, C., Gao, X., Wang, J., Liang, X. Preparation of small RNAs using rolling circle transcription and site-specific RNA disconnection. Molecular Therapy - Nucleic Acids. 4, 215 (2015).
- Karlsson, H., Baronti, L., Petzold, K. A robust and versatile method for production and purification of large-scale RNA samples for structural biology. RNA. 26 (8), 1023-1037 (2020).
- Hartmann, S. R., Hahn, E. L. Nuclear double resonance in the rotating frame. Physical Review. 128 (5), 2042-2053 (1962).
- Chiarparin, E., Pelupessy, I., Bodenhausen, G. Selective cross-polarization in solution state NMR. Molecular Physics. 95 (5), 759-767 (1998).
- Korzhnev, D. M., Orekhov, V. Y., Kay, L. E. Off-resonance R 1ρ NMR studies of exchange dynamics in proteins with low spin-lock fields: an application to a Fyn SH3 domain. Journal of the American Chemical Society. 127 (2), 713-721 (2005).
- Hansen, A. L., Nikolova, E. N., Casiano-Negroni, A., Al-Hashimi, H. M. Extending the range of microsecond-to-millisecond chemical exchange detected in labeled and unlabeled nucleic acids by selective carbon R 1ρ NMR spectroscopy. Journal of the American Chemical Society. 131 (11), 3818-3819 (2009).
- Duss, O., Maris, C., von Schroetter, C., Allain, F. H. -. T. A fast, efficient and sequence-independent method for flexible multiple segmental isotope labeling of RNA using ribozyme and RNase H cleavage. Nucleic Acids Research. 38 (20), 188 (2010).
- Krähenbühl, B., Lukavsky, P., Wider, G. Strategy for automated NMR resonance assignment of RNA: application to 48-nucleotide K10. Journal of Biomolecular NMR. 59 (4), 231-240 (2014).
- LeBlanc, R. M., Longhini, A. P., Le Grice, S. F. J., Johnson, B. A., Dayie, T. K. Combining asymmetric 13C-labeling and isotopic filter/edit NOESY: a novel strategy for rapid and logical RNA resonance assignment. Nucleic Acids Research. 45 (16), 146 (2017).
- Parisien, M., Major, F. The MC-Fold and MC-Sym pipeline infers RNA structure from sequence data. Nature. 452 (7183), 51-55 (2008).
- Fürtig, B., Richter, C., Bermel, W., Schwalbe, H. New NMR experiments for RNA nucleobase resonance assignment and chemical shift analysis of an RNA UUCG tetraloop. Journal of Biomolecular NMR. 28 (1), 69-79 (2004).
- Keyhani, S., Goldau, T., Blümler, A., Heckel, A., Schwalbe, H. Chemo-enzymatic synthesis of position-specifically modified RNA for biophysical studies including light control and NMR spectroscopy. Angewandte Chemie International Edition. 57 (37), 12017-12021 (2018).
- Marchanka, A., Kreutz, C., Carlomagno, T. Isotope labeling for studying RNA by solid-state NMR spectroscopy. Journal of Biomolecular NMR. 71, 151-164 (2018).
- Becette, O., Olenginski, L. T., Dayie, T. K. Solid-phase chemical synthesis of stable isotope-labeled RNA to aid structure and dynamics studies by NMR spectroscopy. Molecules. 24 (19), 3476 (2019).
- Zhang, X., Li, M., Liu, Y. Optimization and characterization of position-selective labelling of RNA (PLOR) for diverse RNA and DNA sequences. RNA Biology. 17 (7), 1009-1017 (2020).
- Roh, J. H., et al. Effects of preferential counterion interactions on the specificity of RNA folding. The Journal of Physical Chemistry Letters. 9 (19), 5726-5732 (2018).
- Juen, M. A., et al. Excited states of nucleic acids probed by proton relaxation dispersion NMR spectroscopy. Angewandte Chemie German Edition. 55 (39), 12008-12012 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены