Method Article
Cuantificación absoluta de pirofosfatos de inositol por electroforesis capilar Espectrometría de masas de ionización por electrospray
En este artículo
Resumen
Se describe un procedimiento para la espectrometría de masas de ionización por electroforesis capilar por electrospray para la cuantificación absoluta de pirofosfatos de inositol a partir de extractos de células de mamíferos.
Resumen
Los pirofosfatos de inositol (PP-InsPs) son un grupo importante de moléculas de señalización intracelular. Derivado de fosfatos de inositol (InsPs), estas moléculas presentan la presencia de al menos una fracción de pirofosfato energético en el anillo de mioinositol. Existen ubicuamente en eucariotas y operan como mensajeros metabólicos que estudian la homeostasis del fosfato, la sensibilidad a la insulina y la carga de energía celular. Debido a la ausencia de un cromóforo en estos metabolitos, una densidad de carga muy alta y baja abundancia, su análisis requiere trazador radiactivo, y por lo tanto es complicado y costoso. Aquí, el estudio presenta un protocolo detallado para realizar la cuantificación absoluta y de alto rendimiento de pirofosfatos de inositol a partir de células de mamíferos mediante electroforesis capilar por electrospray ionización espectrometría de masas (CE-ESI-MS). Este método permite el perfil sensible de todas las especies de PP-InsPs biológicamente relevantes en células de mamíferos, lo que permite la separación basal de los regioisómeros. Se presentan concentraciones celulares absolutas de PP-InsPs, incluidos isómeros menores, y monitoreo de sus cambios temporales en células HCT116 bajo varias condiciones experimentales.
Introducción
Desde el descubrimiento inicial de pirofosfatos de mioinositol (PP-InsPs) en 19931,2, se han logrado avances significativos para dilucidar su biosíntesis, recambio y funciones3. Los pirofosfatos de inositol ocurren ubicuamente en las células eucariotas4 y sirven como moléculas de señalización metabólica críticamente involucradas en, por ejemplo, homeostasis de fosfato5,6, sensibilidad a la insulina7, oscilaciones de calcio 8,9, tráfico vesicular10, apoptosis11, reparación del ADN 12, señalización inmune13 , y otros. La plétora de procesos importantes bajo el control de pirofosfatos de inositol requiere una comprensión más profunda de su abundancia celular, fluctuación, y localización.
Aunque los InsPs y los PP-InsPs atrajeron la atención de todas las disciplinas, el análisis de su abundancia se realiza de forma rutinaria utilizando un método desarrollado durante los años 80, que consiste en marcar las células con inositol tritiado, resolviendo los PP-InsP extraídos mediante cromatografía de intercambio aniónico fuerte Sax-HPLC con posterior recuento de centelleo. Los métodos más nuevos basados en espectrometría de masas aún enfrentan desafíos significativos: pirofosfatos de inositol con hasta ocho unidades de fosfato albergan ésteres de fosfato y anhídridos, lo que lleva a una carga negativa significativa y una posible pérdida de fosfato durante la ionización. Hay cuatro tipos principales de PP-InsP que se encuentran en los mamíferos (Figura 1): 1,5-(PP)2-InsP 4 (o 1,5-InsP8), 5-PP-InsP 5 (o 5-InsP 7), 1-PP-InsP 5 (o 1-InsP7) y 5-PP-Ins(1,3,4,6)P 4 (o 5-PP-InsP 4)3,14. Los niveles fisiológicos de PP-InsPs están típicamente en el rango nano a micromolar bajo, con 5-PP-InsP 5 como el más abundante con concentraciones celulares de 0.5 - 5 μM. Se cree que 1,5-(PP)2-InsP 4 y 1-PP-InsP 5 son hasta alrededor del 10% del conjunto de 5-PP-InsP5 y siguen siendo difíciles de rastrear en muchas células15. 5-PP-InsP4 con un grupo OH libre es aún menor en abundancia y generalmente solo se vuelve detectable cuando las hidrolasas de fosfato se inhiben con fluoruro de sodio (NaF)16.
La alta densidad de carga de los PP-InsP dificulta su separación, y la aparición de regioisómeros PP-InsP complica aún más estos esfuerzos. Como resultado, la mayoría de los experimentos se basaron en la cuantificación por marcaje radiactivo metabólico de células utilizando [3H]-inositol, ya que se excluye el fondo de la matriz y se logra una alta sensibilidad17,18. Sin embargo, este método es costoso, requiere mucho tiempo y no permite distinguir adecuadamente los regioisómeros PP-InsP relacionados. Por otra parte, [3H]-inositol etiquetado no tiene en cuenta la síntesis endógena de inositol a partir de la glucosa. Un método basado en electroforesis en gel de poliacrilamida (PAGE) es una alternativa económica ampliamente aplicada pero limitada en su sensibilidad 19,20,21,22. Se han publicado otros enfoques que evitan el radiomarcaje, incluida la cromatografía iónica seguida de la derivatización post-columnaUV-detección 23, la cromatografía de interacción hidrofílica (HILIC)24, o el intercambio aniónico débil (WAX) junto con espectrometría de masas (MS)25. Sin embargo, no están (todavía) a la par con el protocolo clásico [3H]-inositol SAX-HPLC.
Recientemente, se introdujo la espectrometría de masas de ionización por electroforesis capilar por electrospray (CE-ESI-MS) como una estrategia transformadora para el análisis del metabolismo de InsPs y PP-InsPs, cumpliendo con todos los requisitos discutidos anteriormente16. Combinado con la extracción actual de InsP de última generación por ácido perclórico seguida de enriquecimiento con perlas de dióxido de titanio26, CE-ESI-MS tuvo éxito en todos los organismos probados hasta ahora, desde levaduras hasta plantas y mamíferos. Se logró fácilmente la elaboración simultánea de perfiles de InsPs y PP-InsPs, incluidos todos los regioisómeros posibles. Los patrones internos marcados con isótopos estables (SIL) permitieron una cuantificación absoluta rápida y precisa, independientemente de los efectos de la matriz. Debido a que la EM puede capturar diferencias de masa isotópicas, CE-ESI-MS también se puede aplicar para estudiar vías de síntesis celular compartimentadas de InsPs y PP-InsPs, por ejemplo, alimentando células con [13 C 6]-mioinositol o [13 C6]-D-glucosa.
Aquí se describe un protocolo detallado paso a paso para la cuantificación absoluta de PP-InsPs e InsPs a partir de células de mamíferos por CE-ESI-MS. Además del isómero principal 5-PP-InsP 5, 1,5-(PP)2-InsP 4 y 1-PP-InsP5 también se cuantifican en este estudio, a pesar de su menor abundancia. Se estudian dos líneas celulares HCT116 de diferentes laboratorios (NIH, UCL), y se valida que las células HCT116UCL contienen niveles 7 veces más altos de 1,5-(PP)2-InsP 4 que los encontrados en HCT116NIH, mientras que las concentraciones de 5-PP-InsP5 son comparables. Además, la síntesis de 1-PP-InsP5 en HCT116UCL no aumenta significativamente. Además, el aumento de los niveles de PP-InsP mediante el bloqueo de su desfosforilación con fluoruro de sodio se estudia cuantitativamente.
Protocolo
1. Configuración del sistema CE-ESI-MS
- Establecer un sistema CE-ESI-MS que consiste en un sistema CE comercial y un espectrómetro de masas en tándem de triple cuadrupolo, equipado con una fuente de ionización por electrospray (ESI) Agilent Jet Stream (AJS). Se requiere un kit de pulverización CE-ESI-MS y una bomba LC (cromatografía líquida) isocrática.
- Conecte el divisor de flujo de vaina 1:100 (incluido en el kit de pulverización CE-MS) y la salida isocrática de la bomba LC.
- Asegúrese de que el vial de entrada del sistema CE esté a la misma altura que la punta del pulverizador del analizador de masas.
- Utilice la estación de trabajo MassHunter (versión 10.1) o el software MS comparable para controlar todo el sistema y para la adquisición y análisis de datos.
2. Preparación del sistema tampón, capilar y CE-MS
- Prepare el tampón de funcionamiento CE: ajuste el pH de 40 mM de acetato de amonio a 9.0 con hidróxido de amonio. Se recomienda un matraz aforado de 250 ml. Filtre los 250 ml de tampón con filtros de membrana de 0,2 μm del tamaño de un poro. Asegúrese de usar solo agua desionizada ultrapura y reactivos de grado MS.
NOTA: Este tampón se puede mantener a temperatura ambiente durante 2-3 semanas o durante varios meses en una nevera. - Prepare el líquido de la vaina: Mezcle 100 ml de agua ultrapura y 100 ml de isopropanol de grado LC-MS en una botella de 250 ml. Cambie el líquido de la vaina al menos una vez a la semana. Agregue referencia de masa en el líquido de la vaina cuando emplee un espectrómetro de masas de alta resolución.
- Instale el líquido de la vaina: purgue a 5 ml / min durante 5 min y ajuste el caudal a 1 ml / min (10 μL / min en el pulverizador CE-MS). La presión de la bomba será de aproximadamente 180 bar. Asegúrese de que el tubo de reciclaje se conecte de nuevo a la botella de líquido de la funda para reutilizar el disolvente.
- Preparar capilar: Compre un capilar CE-MS (50 μm i.d. y 365 μM o.d. con una longitud de 125 cm) con una ventana de detección UV. El usuario también puede obtener capilares de sílice fundidos en barra mucho más baratos de distribuidores especializados. Cortar un capilar con una longitud de 100 cm. Corte correctamente ambos extremos capilares con un cortador de columna capilar con una cuchilla de diamante giratoria y retire 2-3 cm de recubrimiento de poliimida en ambos extremos con un encendedor. Limpie la superficie capilar con isopropanol.
- Instale el capilar: Haga coincidir el capilar en el cassette CE-MS. Haga clic en el botón Cambiar casete e instale el casete en el dispositivo CE. El extremo de entrada del capilar es alrededor de 2 mm más bajo que el electrodo. Asegúrese de que el extremo de entrada esté más bajo que la superficie de la muestra durante el proceso de inyección.
- Activar capilar: Antes del primer uso, enjuague el capilar con NaOH 1 M, seguido de agua durante 10 minutos y tampón de funcionamiento CE durante 15 min.
- Inserte el extremo capilar en el pulverizador CE-MS: Coloque suavemente el capilar en el pulverizador CE-MS y asegúrese de que el extremo capilar sobresalga aproximadamente 0,1 mm de la punta del pulverizador. Asegúrese de realizar un ajuste preciso del extremo de salida capilar con una lupa y el tornillo de ajuste en el pulverizador. Vuelva a insertar el pulverizador en la fuente de iones y evite tocar el tornillo de ajuste. El MS está en modo de espera al realizar esta operación.
- Compruebe la pulverización ESI: compruebe la estabilidad del pulverizador ESI en el modo de escaneo completo. La fluctuación de los electroferogramas iónicos totales debe estar dentro del 5%.
- Realice una prueba con estándares InsP: Emplee una mezcla de estándares InsP3-InsP 8 de 2 μM (ajustados por RMN cuantitativa de 31P 15,27) para ejecuciones de prueba con una inyección a 50 mbar durante 10 s (10 nL). Establezca los parámetros detallados de ESI y MS como se muestra en la Tabla 1. La corriente CE es de aproximadamente 26 μA. El ancho máximo es de alrededor de 0.4-0.5 min. Asegúrese de que la relación señal-ruido alcance al menos 400.
3. Extracción de fosfatos solubles de inositol de células de mamíferos
NOTA: Las células HCT116NIH fueron un amable regalo de Stephen Shears28. Las células HCT116UCL eran del Laboratorio26 de Saiardi.
- Células de siembra
- Cultive células HCT116NIH o HCT116UCL en matraces T75 a 37 °C en una atmósfera deCO2 de alta humedad al 5% (en lo sucesivo, condiciones estándar) en el medio de águila modificado (DMEM) de Dulbecco suplementado con suero fetal bovino (FBS) al 10%.
- Lave los cultivos madre HCT116NIH y HCT116UCL con solución salina tamponada con fosfato (PBS) (5 ml) e incube las células con ácido tetraacético tripsina-etilendiamina (EDTA) (3 ml, 0,25%) en condiciones estándar hasta que se desprendan por completo. Apague la actividad de la tripsina agregando medio (7 ml), recoja las células en un tubo de centrífuga y centrifuga (200 x g, 3 min).
- Retire el sobrenadante y resuspenda las células en medio (10 mL). Cuente las células y determine la viabilidad mediante la exclusión de azul de tripano.
- Sembrar las células (6 millones de células HCT116 por ensayo) en una placa de 150 mm y ajustar 20 ml de medio de cultivo celular en total. Premezcle el medio y las células en un tubo de centrífuga antes de la siembra para lograr una distribución equitativa de las células en el plato. Prepare un plato paralelo cuando se requiera la normalización por número de celda.
- Cultivar las células en condiciones estándar durante 72 h. Las células alcanzarán alrededor del 80% -90% de confluencia.
- Modulación de los niveles de fosfato de inositol con NaF y recolección celular
- Tratamiento con NaF: Añadir NaF (10 mM) 1 h antes de cosechar en el medio. Mezclar el medio agitando la placa/pipeteo e incubar las células durante 60 minutos en condiciones estándar.
- Después del tratamiento con NaF, retire el medio de las células y colóquelas en hielo.
- Lave las células dos veces con PBS (5 mL, 4 °C) y retire el PBS completamente del plato.
- Añadir ácido perclórico (PA) (1 mL, 1 M, 4 °C). Asegúrese de cubrir toda la superficie con PA (las células se volverán blancas a medida que las proteínas precipiten). Incubar las celdas durante 10 min en una mesa basculante a 4 °C.
- Recoger PA en un tubo de centrífuga y eliminar los residuos contaminantes por centrifugación (17.000 x g, 5 min, 4 °C). Agregue el sobrenadante a las perlas de TiO2 preparadas para el despliegue de InsPs.
- Lave el plato posterior a la extracción dos veces con PBS (5 ml, r.t.) para la desacidificación; eliminar PBS completamente del plato.
- Solubilizar las proteínas en la placa mediante la adición de tampón de lisis celular (1,5 ml, r.t.; dodecil sulfato de sodio [SDS] al 0,1% en NaOH 0,1 M). Incubar el plato durante 15 minutos en una mesa inclinable en r.t. Transfiera el lisado celular a un tubo de centrífuga y centrífuga (17,000 x g, 5 min, 4 °C). Conservar el sobrenadante a -80 °C hasta que se determine la concentración de proteínas mediante el ensayo de proteínas DC utilizando albúmina sérica bovina como patrón de calibración (normalmente, una placa de 150 mm contiene alrededor de 10 mg de proteínas).
- Determinación del número de células a partir de placas paralelas: Recolectar las células de la placa paralela a través de tripsina como se describe en el paso 3.1.2 (utilizar 5 ml de tripsina-EDTA para la placa de 150 mm) y retirar el medio. Resuspenda el pellet celular en PBS (5 mL), mezcle adecuadamente y cuente las células. Realice este paso justo antes de la cosecha mediante enfriamiento directo para obtener recuentos celulares representativos. Además, mida el volumen de las células con un método apropiado (por ejemplo, con una máquina multitamaño).
- Enriquecimiento deTiO2 de fosfatos de inositol
NOTA: Para evitar la descomposición ácida de los compuestos fosforilados, realice todos los pasos de enriquecimiento hasta la elución en hielo y enfríe todos los reactivos a 4 °C. Mantener el tiempo para la extracción al mínimo (1,5-2 h). Realice todos los pasos de extracción con 1 M PA.- Preparación de perlas: Lavar las perlas de TiO2 (5 mg por muestra) conddH2O(1 mL) y centrifugadora (3.500 x g, 1 min, 4 °C). RetireddH2Oy lave las perlas con PA (1 mL). Eliminar el PA por centrifugación (3.500 x g, 1 min, 4 °C). Resuspender las perlas en PA (50 μL por muestra).
- Añadir el sobrenadante que contiene compuestos fosforilados (comparar sección 3.2, paso 3.2.5) a la suspensión de perlas, vórtice, y, a continuación, girar la muestra durante 20 min a 4 °C.
- Centrifugar la muestra (3.500 x g, 1 min, 4 °C) y desechar el sobrenadante. Lavar las perlas con PA (500 μL) y centrífuga (3.500 x g, 1 min, 4 °C). Deseche el sobrenadante y repita el paso de lavado.
- Agregue NH4OH (200 μL, 3%) a las perlas y vuelva a suspender. Gire la muestra durante 5 minutos a r.t.
- Centrifugar la muestra (3.500 x g, 1 min) y transferir el sobrenadante a un nuevo tubo de centrífuga.
- Repita los pasos de elución 3.3.4 y 3.3.5 y combine los eluyentes. Deseche las cuentas.
- Centrifugar los eluyentes combinados (17.000 x g, 1 min, 4 °C) para eliminar cualquier residuo insoluble.
- Secar completamente el sobrenadante por evaporación al vacío (70 min, 60 °C, V-AQ). AñadirddH2O(50 μL) a los extractos secos que contengan InsPs. Vórtice para mezclar la muestra hasta que se disuelva por completo. Almacenar la muestra a -20 °C hasta el análisis CE-ESI-MS.
4. Realización de las ejecuciones CE-ESI-MS
- Preparar una mezcla de patrones internos que contengan 40 μM [13 C 6]1,5-(PP)2-InsP 4, 80 μM [13 C 6]5-PP-InsP 5, 80 μM [13 C 6]1-PP-InsP 5, 400 μM [13 C 6]InsP 6 y 400 μM [13C 6]Ins(1,3,4,5,6)P 5. Determinar las concentraciones de soluciones SIL IS mediante RMN cuantitativa de 31P y 1H, con la ayuda de un patrón de referencia certificado, es decir, ácido fosfoacético.
NOTA: Todos los estándares internos (IS) SIL anteriores con purezas superiores al 96% fueron sintetizados y proporcionados por el grupo de Fiedler15,27. Al igual que con los nucleótidos, estos IS podrían transportar muchas moléculas de agua cristalina y diversos contraiones. En lugar de pesar la sustancia y calcular la concentración, se recomienda la determinación de la concentración de 13soluciones patrón C6 mediante RMN cuantitativa 31P. - Mezclar 10 μL de la muestra con 0,5 μL de mezcla de patrones internos en un vial de muestra CE. 2 μM [13 C 6]1,5-(PP)2-InsP 4, 4 μM [13 C 6]5-PP-InsP 5, 4 μM [13 C 6]1-PP-InsP 5, 20 μM [13 C 6]InsP 6 y 20 μM [13C 6]Ins(1,3,4,5,6)P 5 son las concentraciones finales dentro de las muestras.
- Cuando utilice el sistema de reposición, haga clic en el botón Cambiar botella, coloque los 250 ml preparados de tampón de funcionamiento CE en la botella de electrolito y haga clic en Tubos limpios. Mantenga la aguja de reposición en un frasco de agua.
- Establezca los parámetros ESI y MS como se muestra en la Tabla 1. Optimice los parámetros de origen utilizando un optimizador de fuente con una mezcla de estándares de polifosfato de inositol. Obtenga la configuración de monitoreo de reacciones múltiples (MRM) utilizando Masshunter Optimizer con todos los estándares. Ajuste la configuración de ESI y MS / MS para diferentes instrumentos.
- Realice una ejecución de los extractos de InsP y compruebe el resultado (Figura 2). Establezca una secuencia cuando haya más muestras.
- Deje que el MS esté en modo de espera después de las mediciones. No apague la bomba LC. El flujo de líquido de la vaina protege la aguja del pulverizador. Reemplace el pulverizador CE-ESI-MS por un pulverizador LC-ESI-MS cuando no haya suministro de líquido de la funda.
5. Análisis de datos
- Abra el software de análisis cuantitativo (para QQQ), cree un lote para todas las muestras.
- Cree un nuevo método a partir de los datos MRM adquiridos. Establezca los [13C6]InsPs como estándares internos - (ISTD). Compruebe la configuración del compuesto MRM, la configuración del tiempo de retención, la configuración de ISTD, la configuración de concentración y la configuración del calificador. Pase la validación y salga para aplicar el método al lote actual. Guarde el método.
- Compruebe si cada pico del lote está correctamente integrado; de lo contrario, integre manualmente el pico.
- Exporta los resultados a una hoja de cálculo. Realizar la cuantificación de inositol (piro)fosfatos comparando la respuesta máxima del analito con la respectiva respuesta máxima de SIL IS con concentraciones conocidas. Las curvas de calibración teóricas y experimentales se muestran en la Tabla 2 para 5-PP-InsP 5, InsP 6 e Ins(1,3,4,5,6)P 5 con el rango lineal.
NOTA: La condición previa que aplica la curva de calibración teórica es el uso de un patrón isotópico de alta calidad de analitos específicos y con una concentración creíble. Evalúe el rango lineal. Una curva de calibración es esencial para la cuantificación absoluta cuando la adquisición completa de los patrones isotópicos mencionados anteriormente no es práctica. - Con la concentración medida en la solución de extracto de InsP y su volumen, calcule las cantidades absolutas. Además, normalice la cantidad por recuento de células o contenido de proteínas. Calcule la concentración celular basada en el recuento de células y el volumen celular promedio de HCT116 (1.68 fL).
Resultados
Los resultados que se muestran aquí tienen como objetivo ilustrar el potencial del análisis CE-ESI-MS. Las cifras reportadas son descriptivas de una ejecución CE-ESI-MS técnicamente impecable. En primer lugar, se presenta una mezcla de patrones de pirofosfato de inositol (Figura 1) y un extracto de células de mamífero (Figura 2). En segundo lugar, se proporciona una comparación de dos líneas celulares HCT116 (Figura 3) y células HCT116 tratadas con NaF (Figura 4).
Los electroferogramas iónicos extraídos (EIE) de los patrones de inositol (piro)fosfato a una concentración de 2 μM se muestran en la Figura 1. Se inserta el metabolismo de los pirofosfatos de inositol en mamíferos con sus estructuras simplificadas. Los cuatro pirofosfatos de inositol en mamíferos, 1,5-(PP)2-InsP 4, 5-PP-InsP 5, 1-PP-InsP 5, y5-PP-Ins(1,3,4,6)P4 se distinguen bien utilizando el método descrito. En la Figura 2 se muestra una ejecución CE-ESI-MS de HCT116UCL. Con la ayuda de estándares internos marcados con isótopos estables (SIL), se puede lograr fácilmente una cuantificación absoluta comparando la respuesta de la señal con el SIL de concentración conocida. Se muestran los EIEs integrados del fosfato de inositol de InsP5 a (PP)2-InsP 4 y EIEs no integrados de sus patrones isotópicos. Los DSR de todos los analitos de seis repeticiones técnicas están dentro del 4%. Con la concentración medida y el volumen de extractos, se puede calcular la cantidad de analitos. Con los recuentos celulares y el volumen celular, o el contenido de proteína, la concentración celular absoluta (μM) o la cantidad normalizada por el contenido de proteína (pmol/mg de proteína) son comúnmente los resultados finales de dicho análisis.
Según un estudio anterior, dos lotes de células HCT116 divergentes tienen una variación de los niveles de InsP 8, las células HCT116 UCL contienen niveles 6 veces más altos de InsP8 que las célulasHCT116 NIH 29. Con el método CE-MS, 1,5-(PP)2-InsP 4 en HCT116 NIH podría cuantificarse fácilmente (Figura 3), y las células HCT116 UCL contienen niveles 7 veces más altos de InsP8 que enHCT116 NIH. Además, la acumulación significativa de 1,5-(PP)2-InsP 4 en las células HCT116UCL es paralela a un aumento significativo de 1-PP-InsP5, que ahora se muestra cuantitativamente en la Figura 3.
Los niveles de PP-InsPs aumentan al inhibir su desfosforilación con fluoruro de sodio. El análisis CE-ESI-MS de célulasNIH HCT116 tratadas con NaF demostró la elevación de -5-PP-InsP 5 junto con una reducción en InsP 6 y una aparición de 5-PP-Ins(1,3,4,6)P 4 (Figura 4). Además, la elevación de los niveles de InsP8 es notable, mientras que 1-PP-InsP5 disminuye en cierto grado. El 1-PP-InsP5 no está completamente ausente en HCT116NIH tratado con NaF, pero principalmente bajo el límite de detección o cuantificación.
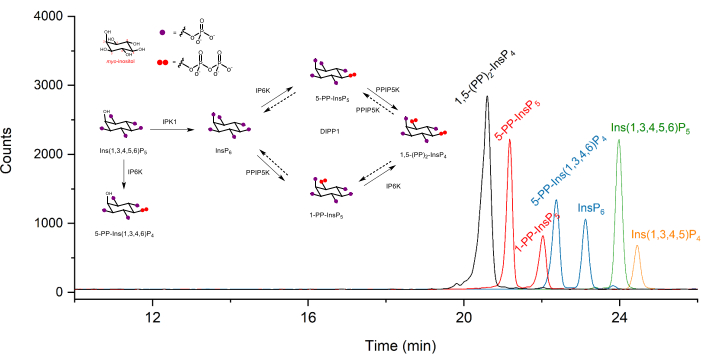
Figura 1: Electroferogramas iónicos extraídos típicos (EIE) de los patrones de inositol (piro)fosfato en el análisis CE-ESI-MS utilizando el protocolo descrito. La concentración de cada analito es de 2 μM. El volumen de la muestra inyectada es de aproximadamente 10 nL con una inyección a 50 mbar durante 10 s. Las inserciones muestran el metabolismo de los pirofosfatos de inositol en mamíferos. IPPK: inositol pentakisphosphate 2-kinase, IP6K: inositol hexakisphosphate kinase, PPIP5K: diphosphoinositol pentakisphosphate kinase, DIPP1: diphosphoinositolpolyphosphate phosphohydrolase 1. Haga clic aquí para ver una versión más grande de esta figura.
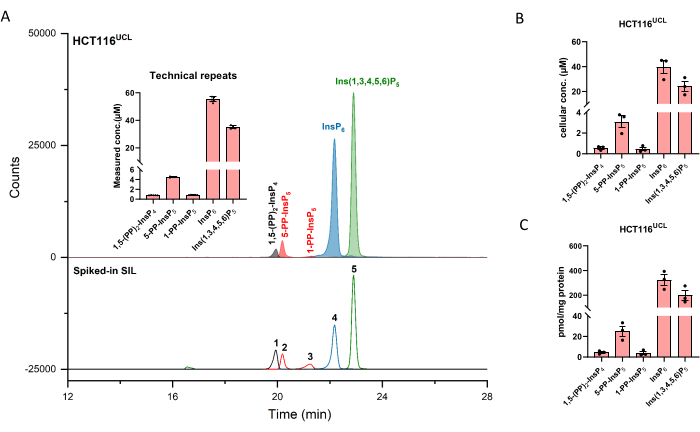
Figura 2: Perfil InsP representativo de células HCT116UCL. (A) EIEs de los principales inositol (piro)fosfatos en HCT116NIH y SIL ISs con púas 2 μM [13 C 6]1,5-(PP)2-InsP 4 (1), 4 μM [13 C 6]5-PP-InsP 5 (2), 4 μM [13 C 6]1-PP-InsP5 (3), 20 μM [13C 6]InsP 6 (4), y 20 μM [13C 6]Ins(1,3,4,5,6)P 5 (5). Los insertos muestran seis repeticiones técnicas de análisis InsP por CE-ESI-MS, los datos se presentan como medias ± SD. (B) Concentración celular de PP-InsPs e InsPs en líneas celulares humanas HCT116UCL y (C) PP-InsPs e InsPs cantidad normalizada por contenido de proteína. Los datos son medios ± SEM de tres experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
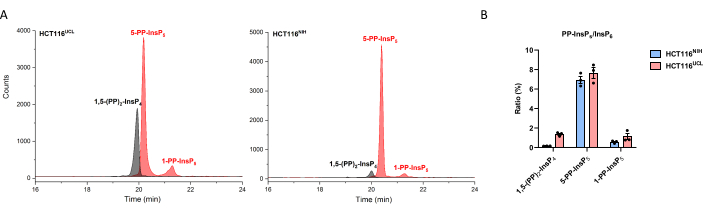
Figura 3: Variación en los niveles de InsP 8 entre dos células HCT116 divergentes. (A) EIEs de pirofosfato de inositol en HCT116 UCL y HCT116NIH. InsP8 en HCT116UCL es marcadamente más abundante que en HCT116NIH. (B) Proporción de pirofosfato de inositol a InsP6 (%) en ambas células HCT116. Las células HCT116UCL contienen niveles 7 veces más altos de InsP8 en comparación con HCT116NIH, mientras que los niveles de 5-PP-InsP5 son iguales. Los datos son medios ± SEM de tres experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
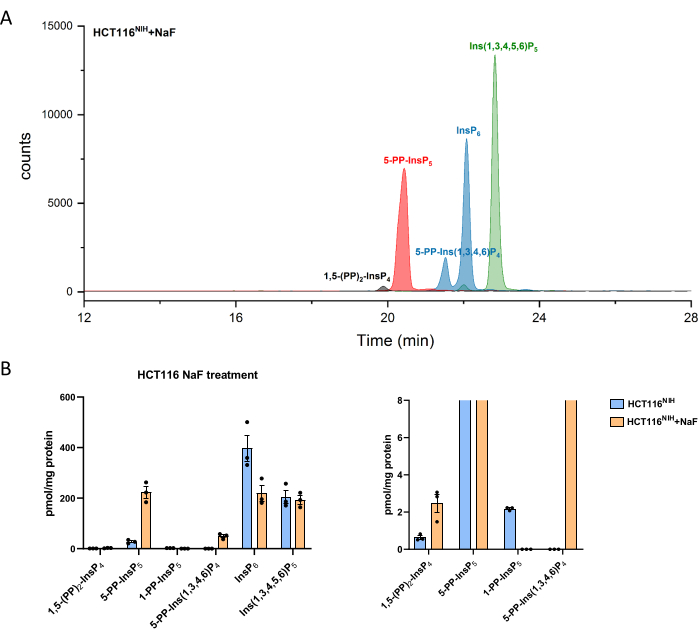
Figura 4: Niveles de inositol (piro)fosfato en células HCT116NIH, con tratamiento con NaF. (A) EIEs de inositol (piro)fosfato en HCT116NIH con tratamiento con fluoruro de sodio (NaF, 10 mM). Los niveles de pirofosfato de inositol incluyendo 1,5-(PP)2-InsP 4, 5-PP-InsP 5, y5-PP-Ins(1,3,4,6)P4 aumentan mediante el bloqueo de su desfosforilación usando NaF. (B) Niveles de inositol (piro)fosfato (las cantidades se normalizan por el contenido de proteína) en células HCT116NIH no tratadas y tratadas con NaF. Los datos son medios ± SEM de tres experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Configuración de parámetros CE-ESI-MS. Los parámetros Source y iFunnel optimizan los parámetros Source e iFunnel. La configuración de los parámetros MSM para inositol (piro)fosfatos está optimizada por MassHunter Optimizer. Haga clic aquí para descargar esta tabla.
Tabla 2: Ecuación de regresión teórica y experimental. La concentración de [13 C 6]5-PP-InsP 5 [13 C 6]InsP 6 y [13C 6]Ins (1, 3, 4, 5, 6)P5 es de 4 μM, 20 μM y 20 μM, respectivamente. Para la ecuación de regresión, la concentración de 5-PP-InsP 5 está en 0.04 μM, 0.1 μM, 0.2 μM, 0.4 μM, 1 μM, 2 μM, 4 μM, 8 μM, 16 μM, 24 μM. La concentración de InsP 6 e Ins (1, 3, 4, 5,6)P 5 está en 0.2 μM, 0.5 μM, 1 μM, 2 μM,5 μM, 10 μM, 20 μM, 40 μM, 80 μM, 120 μM. x es concentración, y es (Área InsP)12C/(Área InsP)13C. Haga clic aquí para descargar esta tabla.
Discusión
Aquí se presenta un método práctico y sensible para la cuantificación de pirofosfatos de inositol altamente cargados en células de mamíferos. Combinando este enfoque de análisis con la extracción actual de InsP de última generación con ácido perclórico seguida de enriquecimiento con TiO2, el análisis CE-ESI-MS tiene ventajas sin precedentes. Con respecto a su rendimiento, sensibilidad, estabilidad, cuantificación absoluta, identificación de isómeros e independencia de la matriz, este método se destaca en comparación con otros enfoques. Este protocolo es aplicable a las células de mamíferos, pero de hecho esta estrategia tiene éxito en muchas muestras diferentes (por ejemplo, levaduras, plantas, parásitos, tejidos de ratón, etc.).
El protocolo de extracción aplicado recupera completamente PP-InsPs e InsP6 de extractos de células de mamíferos16,19. También extraerá muchos otros metabolitos aniónicos, particularmente especies que contienen fosfato, por ejemplo, fosfatos de azúcar y nucleótidos. Sería necesaria la evaluación de la recuperación y descomposición de los analitos del usuario con este protocolo.
En general, el sistema CE-ESI-MS funciona sin problemas y puede acomodar alrededor de 200 muestras cada semana utilizando este protocolo. Sin embargo, a diferencia de la HPLC, la CE ha sido considerada como un método para expertos y personas especializadas durante mucho tiempo, lo que restringió su mercado y limitó su aplicación. Por lo tanto, un dispositivo CE-ESI-MS generalmente está ausente en las facultades analíticas. Las personas que desean llevar a cabo el análisis CE-ESI-MS probablemente carecen de experiencia en CE y pasarán más tiempo resolviendo problemas. Aquí, se destacan los pasos críticos. Lo primero y más importante es la calidad del corte capilar. La sensibilidad y estabilidad del aerosol ESI se basan principalmente en un corte capilar de primera clase. En segundo lugar, el extremo de salida capilar debe estar exactamente a 0,1 mm de la punta del pulverizador. La aguja del pulverizador y el capilar CE deben estar en la dirección axial. La calidad del aerosol ESI es crítica para la cuantificación; Se deben realizar ejecuciones técnicas para evaluar la repetibilidad.
Con el protocolo descrito, el límite de cuantificación (LOQ) para PP-InsPs es de 40 nM con una inyección a 50 mbar durante 10 s (10 nL). Existen varios enfoques para aumentar aún más la sensibilidad del método. En primer lugar, una inyección a 100 mbar durante 20 s (40 nL) seguirá dando como resultado una buena forma de pico y una resolución suficiente para los regioisómeros 5-PP-InsP 5 y 1-PP-InsP5. En segundo lugar, los extractos de InsP se pueden disolver en una menor cantidad de agua. En tercer lugar, el tiempo de permanencia podría aumentarse cuando se utilizan menos transiciones MRM para la cuantificación. Además, una fuente de iones CE-MS que utiliza un flujo de líquido de vaina ultra bajo aumentaría significativamente la sensibilidad.
El tampón de funcionamiento CE con pH 9 proporciona la mejor resolución entre InsP6-InsP 8. Al aumentar el pH a 9.7, la resolución entre InsP3-InsP 6 mejorará significativamente. Debido a la excelente resolución, se recomienda una longitud capilar más corta de 72 cm para aumentar aún más el rendimiento. Además, una temperatura de cassette CE más alta a 40 °C disminuye la viscosidad del tampón electroforético acuoso y acelera su movimiento bajo EOF. De acuerdo con las diferentes demandas de investigación, las modificaciones de este método pueden facilitar aún más el análisis de InsPs y PP-InsPs. Por lo tanto, los protocolos CE-ESI-MS descritos tienen el potencial de abrir nuevas vías de investigación en esta familia multifacética de moléculas de señalización.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Este proyecto ha recibido financiación del Consejo Europeo de Investigación (ERC) en el marco del programa de investigación e innovación Horizonte 2020 de la Unión Europea (acuerdo de subvención nº 864246, a HJJ). DQ agradece el apoyo financiero del Programa Brigitte-Schlieben-Lange. AS cuenta con el apoyo de la subvención MR/T028904/1 del programa MRC.
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 1.5 mL microcentrifuge tubes | Greiner Bio-One | 616201 | - |
| 15 cm tissue culture dishes | Thermo Fisher | 168381 | - |
| 2.0 mL microcentrifuge tubes | Greiner Bio-One | 623201 | - |
| 50 mL centrifuge tubes | Greiner Bio-One | 227261 | - |
| 96-well plates | Thermo Fisher | 260836 | for the DC protein assay |
| CE fused silica capillary | CS Chromatographie | 105180 | 50 µM i.d. 360 µM o.d. |
| Pipette tips | Starlab | I1054-0001, S1111-6701, S1113-1700, S1111-3700 | 10 mL, 1000 µL, 200 µL, 10 µL pipette tips |
| Serological pipets | TPP | 94550, 94525, 94010, 94005 | 50 mL, 25, mL, 10 mL, 5 mL serological pipettes |
| T75 flasks | TPP | 90076 | - |
| Chemicals and Reagents | |||
| NaOH | AppliChem | A6829,0500 | sodium hydroxide pellets for molecular biology, for preparation of cell lysis buffer |
| 0.25% trypsin-EDTA | Gibco | 25200056 | - |
| Ammonium acetate | Thermo Fisher | 1677373 | HPLC grade |
| BSA | Thermo Fisher | 23209 | albumin standard (2.0 mg/mL) for standard curve preparation |
| DC protein assay | Biorad | 5000116 | DC protein assay reagents package |
| DMEM | Gibco | 41966029 | high glucose, pyruvate |
| FBS | Gibco | 10270106, 10500064 (heat inactivated) | 10270106 for HCT116UCL, 10500064 for HCT116NIH |
| Isopropanol | Carl Roth | AE73.2 | 99.95% LC-MS grade |
| NH4OH, 10% | Carl Roth | 6756.1 | for preparation of 3% NH4OH |
| PBS | Gibco | 10010015 | - |
| Perchloric acid, 70% | Carl Roth | 9216.1 | for preparation of 1 M perchloric acid |
| SDS | SERVA | 20760.02 | for preparation of cell lysis buffer |
| Sodium fluoride | Sigma Aldrich | S7920 | - |
| TiO2 beads | GL Sciences | 5020-75000 | 5 µm particle size |
| Trypan blue solution | Gibco | 15250061 | trypan blue stain (0.4%) |
| Ultrapure (Type 1) water | Milli-Q | ZRQSVP3WW | model: Direct-Q 3 UV Water Purification System |
| Equipment | |||
| Analytical balance | Mettler Toledo | 30105893 | model: XPE26; for weighing of beads (5-6 mg per sample) |
| Automated cell counter | Logos Biosystems | L40002 | model: LUNA-II Automated Cell Counter |
| Benchtop centrifuge | Hettich | 1401 | model: UNIVERSAL 320 |
| Benchtop centrifuge with cooling | VWR | 521-1647P | model: Microstar 17R |
| CE system | Agilent | G7100A | - |
| CE/MS Adapter Kit | Agilent | G1603A | - |
| CE/MS Sprayer Kit | Agilent | G1607A | - |
| Cell counting slides | Logos Biosystems | L12001 | LUNA Cell Counting Slides |
| Centrifugal evaporator | Eppendorf | 5305000304 | model: Concentrator plus complete system |
| ESI source | Agilent | AJS ESI | - |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Humidified incubator | Binder | 9040-0088 | model: CB E6.1, for cultivation of mammalian cells |
| Ice box | - | - | should provide enough space for samples, dishes, etc. |
| Isocratic LC system | Agilent | G7110B 1260 Iso Pump | model: Infinity II Quaternary system |
| MSD | Agilent | G6495C | triple quadrupole |
| Multiplate reader | Tecan | 30086375 | model: SPARK 10 M |
| Pipette filler | Thermo Fisher | 10072332 | for serological pipettes |
| Pipettes | Brand | 705884, 705880, 705878, 705872, 705870 | various pipettes |
| Rotator | Labnet | H5500 | model: Mini LabRoller Rotator |
| Shortix capillary column cutter | SGT | S0020 | - |
| Test tube shaker (vortex mixer) | Carl Roth | HXH6.1 | model: Rotilabo-Mini Vortex |
| Tilt table | Labnet | S0600 | model: EDURO MiniMix Nutating Mixer |
| Water bath | Thermo Fisher | FSGPD05 | model: Isotemp GPD 05 |
| Software | |||
| MassHunter Workstation | Agilent | Version 10.1 | - |
| MassHunter Workstation LC/MS Data Acquisition | Agilent | Version 10.1 | - |
| MassHunter Workstation Optimizer | Agilent | Version 10.1 | - |
| MassHunter Workstation Qualitative Analysis | Agilent | Version 10.0 | - |
| QQQ Quantitaion Analysis | Agilent | Version 10.1 | - |
Referencias
- Stephens, L., et al. The detection, purification, structural characterization, and metabolism of diphosphoinositol pentakisphosphate(s) and bisdiphosphoinositol tetrakisphosphate(s). The Journal of Biological Chemistry. 268 (6), 4009-4015 (1993).
- Menniti, F. S., Miller, R. N., Putney, J. W. Jr, Shears, S. B. Turnover of inositol polyphosphate pyrophosphates in pancreatoma cells. The Journal of Biological Chemistry. 268 (6), 3850-3856 (1993).
- Shears, S. B. Inositol pyrophosphates: Why so many phosphates. Advances in Biological Regulation. 57, 203-216 (2015).
- Irvine, R. F., Schell, M. J. Back in the water: the return of the inositol phosphates. Nature Reviews Molecular Cell Biology. 2 (5), 327-338 (2001).
- Szijgyarto, Z., Garedew, A., Azevedo, C., Saiardi, A. Influence of inositol pyrophosphates on cellular energy dynamics. Science. 334 (6057), 802-805 (2011).
- Wild, R., et al. Control of eukaryotic phosphate homeostasis by inositol polyphosphate sensor domains. Science. 352 (6288), 986-990 (2016).
- Chakraborty, A., et al. Inositol pyrophosphates inhibit Akt signaling, thereby regulating insulin sensitivity and weight gain. Cell. 143 (6), 897-910 (2010).
- Bittner, T., et al. Photolysis of caged inositol pyrophosphate InsP8 directly modulates intracellular Ca2+ oscillations and controls C2AB domain localization. Journal of the American Chemical Society. 142 (24), (2020).
- Hauke, S., et al. Photolysis of cell-permeant caged inositol pyrophosphates controls oscillations of cytosolic calcium in a β-cell line. Chemical Science. 10 (9), 2687-2692 (2019).
- Saiardi, A., Sciambi, C., McCaffery, J. M., Wendland, B., Snyder, S. H. Inositol pyrophosphates regulate endocytic trafficking. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14206-14211 (2002).
- Koldobskiy, M. A., et al. p53-mediated apoptosis requires inositol hexakisphosphate kinase-2. Proceedings of the National Academy of Sciences of the United States of America. 107 (49), 20947(2010).
- Rao, F., et al. Inositol hexakisphosphate kinase-1 mediates assembly/disassembly of the CRL4-signalosome complex to regulate DNA repair and cell death. Proceedings of the National Academy of Sciences. 111 (45), 16005(2014).
- Williams, S. P., Gillaspy, G. E., Perera, I. Y. Biosynthesis and possible functions of inositol pyrophosphates in plants. Frontiers in Plant Science. 6, 67(2015).
- Wilson, M. S. C., Livermore, T. M., Saiardi, A. Inositol pyrophosphates: between signalling and metabolism. The Biochemical Journal. 452 (3), 369-379 (2013).
- Harmel, R. K., et al. Harnessing 13C-labeled myo-inositol to interrogate inositol phosphate messengers by NMR. Chemical Science. 10 (20), 5267-5274 (2019).
- Qiu, D., et al. Analysis of inositol phosphate metabolism by capillary electrophoresis electrospray ionization mass spectrometry. Nature Communications. 11 (1), 6035(2020).
- Azevedo, C., Saiardi, A. Extraction and analysis of soluble inositol polyphosphates from yeast. Nature Protocols. 1 (5), 2416-2422 (2006).
- Wilson, M. S. C., Saiardi, A. Importance of radioactive labelling to elucidate inositol polyphosphate signalling. Phosphate Labeling and Sensing in Chemical Biology. , 67-87 (2017).
- Wilson, M. S. C., Bulley, S. J., Pisani, F., Irvine, R. F., Saiardi, A. A novel method for the purification of inositol phosphates from biological samples reveals that no phytate is present in human plasma or urine. Open Biology. 5 (3), 150014(2015).
- Losito, O., Szijgyarto, Z., Resnick, A. C., Saiardi, A. Inositol pyrophosphates and their unique metabolic complexity: analysis by gel electrophoresis. PloS One. 4 (5), 5580(2009).
- Dong, J., et al. Inositol pyrophosphate InsP8 acts as an intracellular phosphate signal in arabidopsis. Molecular Plant. 12 (11), 1463-1473 (2019).
- Riemer, E., et al. ITPK1 is an InsP6/ADP phosphotransferase that controls systemic phosphate homeostasis in Arabidopsis. bioRxiv. , (2020).
- Whitfield, H., et al. An ATP-responsive metabolic cassette comprised of inositol tris/tetrakisphosphate kinase 1 (ITPK1) and inositol pentakisphosphate 2-kinase (IPK1) buffers diphosphosphoinositol phosphate levels. The Biochemical Journal. 477 (14), 2621-2638 (2020).
- Ito, M., et al. Hydrophilic interaction liquid chromatography-tandem mass spectrometry for the quantitative analysis of mammalian-derived inositol poly/pyrophosphates. Journal of chromatography. A. 1573, 87-97 (2018).
- Mantilla, B. S., Amaral, L. D. D., Jessen, H. J., Docampo, R. the inositol pyrophosphate biosynthetic pathway of Trypanosoma cruzi. ACS Chemical Biology. 16 (2), 283-292 (2021).
- Wilson, M. S. C., Saiardi, A. Inositol phosphates purification using titanium dioxide beads. Bio-Protocol. 8 (15), 2959(2018).
- Puschmann, R., Harmel, R. K., Fiedler, D. Scalable chemoenzymatic synthesis of inositol pyrophosphates. Biochemistry. 58 (38), 3927-3932 (2019).
- Gu, C., et al. KO of 5-InsP7 kinase activity transforms the HCT116 colon cancer cell line into a hypermetabolic, growth-inhibited phenotype. Proceedings of the National Academy of Sciences of the United States of America. 114 (45), 11968-11973 (2017).
- Gu, C., Wilson, M. S. C., Jessen, H. J., Saiardi, A., Shears, S. B. Inositol Pyrophosphate Profiling of Two HCT116 Cell Lines Uncovers Variation in InsP8 Levels. PloS One. 11 (10), 0165286(2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados