Method Article
Абсолютное количественное определение пирофосфатов инозитола методом масс-спектрометрии капиллярного электрофореза Электрораспылительная ионизация масс-спектрометрии
В этой статье
Резюме
Описана процедура электрораспылительной ионизационной масс-спектрометрии капиллярного электрофореза для абсолютного количественного определения пирофосфатов инозитола из экстрактов клеток млекопитающих.
Аннотация
Пирофосфаты инозитола (PP-InsPs) являются важной группой внутриклеточных сигнальных молекул. Полученные из инозитолфосфатов (InsPs), эти молекулы характеризуются присутствием по меньшей мере одного энергичного пирофосфатного фрагмента на мио-инозитоловом кольце. Они повсеместно существуют у эукариот и действуют как метаболические мессенджеры, исследующие фосфатный гомеостаз, чувствительность к инсулину и заряд клеточной энергии. Из-за отсутствия хромофора в этих метаболитах, очень высокой плотности заряда и низкой численности, их анализ требует радиоактивного индикатора, а значит, он запутанный и дорогой. Здесь в исследовании представлен подробный протокол для выполнения абсолютного и высокопроизводительного количественного определения пирофосфатов инозитола из клеток млекопитающих с помощью масс-спектрометрии капиллярного электрофореза с электрораспылением ионизации (CE-ESI-MS). Этот метод позволяет проводить чувствительное профилирование всех биологически значимых видов PP-InsPs в клетках млекопитающих, что позволяет проводить базовое разделение региоизомеров. Представлены абсолютные клеточные концентрации PP-InsPs, включая второстепенные изомеры, и мониторинг их временных изменений в клетках HCT116 в нескольких экспериментальных условиях.
Введение
С момента первоначального открытия пирофосфатов мио-инозитола (PP-InsPs) в 1993 году 1,2 был достигнут значительный прогресс в выяснении их биосинтеза, оборота и функций 3. Пирофосфаты инозитола повсеместно встречаются в эукариотических клетках4 и служат метаболическими сигнальными молекулами, критически участвующими, например, в фосфатном гомеостазе 5,6, чувствительности к инсулину7, колебаниях кальция 8,9, везикулярном трафике10, апоптозе11, репарации ДНК12, иммунной сигнализации13 и др. Множество важных процессов под контролем пирофосфатов инозитола требует более глубокого понимания их клеточного изобилия, флуктуации и локализации.
Хотя InsPs и PP-InsPs привлекли внимание во всех дисциплинах, анализ их количества обычно выполняется с использованием метода, разработанного в 80-х годах, состоящего из маркировки клеток тритиированным инозитолом, разрешения извлеченных PP-InsPs с помощью сильной анионообменной хроматографии Sax-HPLC с последующим подсчетом сцинтилляций. Новые методы, основанные на масс-спектрометрии, по-прежнему сталкиваются со значительными проблемами: пирофосфаты инозитола с восемью фосфатными установками содержат эфиры фосфатов и ангидриды, что приводит к значительному отрицательному заряду и потенциальным потерям фосфатов во время ионизации. Существует четыре основных типа PP-InsPs, обнаруженных у млекопитающих (рисунок 1): 1,5-(PP)2-InsP4 (или 1,5-InsP8), 5-PP-InsP5 (или 5-InsP7), 1-PP-InsP5 (или 1-InsP7) и 5-PP-Ins(1,3,4,6)P4 (или 5-PP-InsP4)3,14. Физиологические уровни PP-InsPs обычно находятся в нано- и низкомикромолярном диапазоне, причем 5-PP-InsP5 является наиболее распространенным с клеточными концентрациями 0,5 - 5 мкм. 1,5-(PP)2-InsP 4 и 1-PP-InsP5, как полагают, составляют до 10% пула 5-PP-InsP5 и их трудно отследить во многих клетках15. 5-PP-InsP4 со свободной группой OH еще ниже по количеству и обычно обнаруживается только тогда, когда фосфатные гидролазы ингибируются фторидом натрия (NaF)16.
Высокая плотность заряда PP-InsPs затрудняет их разделение, а появление региоизомеров PP-InsP еще больше усложняет эти усилия. В результате большинство экспериментов опирались на количественное определение метаболической радиоактивной маркировкой клеток с использованием [3H]-инозитола, так как фон из матрицы исключен и высокая чувствительность достигается17,18. Однако этот метод является дорогостоящим, трудоемким и не позволяет правильно различать родственные PP-InsP региоизомеры. Кроме того, маркировка [3H]-инозитола не учитывает эндогенный синтез инозитола из глюкозы. Метод электрофореза на основе полиакриламидного геля (PAGE) является широко применяемой недорогой альтернативой, но ограниченной по своейчувствительности 19,20,21,22. Были опубликованы другие подходы, избегающие радиомаркировки, включая ионную хроматографию, за которой следует постколоночная дериватизация УФ-детектирования23, гидрофильная хроматография взаимодействия (HILIC)24 или слабый анионный обмен (WAX) в сочетании с масс-спектрометрией (MS)25. Однако они (пока) не находятся на одном уровне с классическим протоколом [3H]-инозитол SAX-HPLC.
Недавно капиллярная электрофорезная электрораспылительная масс-спектрометрия с ионизацией (CE-ESI-MS) была введена в качестве преобразующей стратегии для анализа метаболизма InsPs и PP-InsPs, отвечающей всем требованиям, рассмотренным выше16. В сочетании с современной экстракцией InsP хлорной кислотой с последующим обогащением шариками диоксида титана26, CE-ESI-MS преуспел в каждом организме, протестированном до сих пор, от дрожжей до растений и млекопитающих. Было легко достигнуто одновременное профилирование InsPs и PP-InsPs, включая все возможные региоизомеры. Внутренние стандарты со стабильной изотопной маркировкой (SIL) позволили быстро и точно дать абсолютное количественное определение, независимо от матричного воздействия. Поскольку РС может захватывать изотопные различия масс, CE-ESI-MS также может быть применен для изучения компартментированных клеточных путей синтеза InsPs и PP-InsPs, например, путем питания клеток [13C6]-мио-инозитолом или [13C6]-D-глюкозой.
Здесь описан подробный пошаговый протокол для абсолютного количественного определения PP-InsPs и InsPs из клеток млекопитающих CE-ESI-MS. Помимо основного изомера 5-PP-InsP5, в этом исследовании также количественно определены 1,5-(PP)2-InsP4 и 1-PP-InsP5, несмотря на их более низкое содержание. Изучаются две клеточные линии HCT116 из разных лабораторий (NIH, UCL), и подтверждено, что клетки HCT116UCL содержат в 7 раз более высокие уровни 1,5-(PP)2-InsP4, чем в HCT116NIH, в то время как концентрации 5-PP-InsP5 сопоставимы. Кроме того, синтез 1-PP-InsP5 в HCT116UCL достоверно не увеличивается. Также количественно изучается повышение уровня PP-InsP путем блокирования их дефосфорилирования с использованием фторида натрия.
протокол
1. Настройка системы CE-ESI-MS
- Настройте систему CE-ESI-MS, состоящую из коммерческой системы CE и тройного квадрупольного тандемного масс-спектрометра, оснащенного источником электрораспылительной ионизации (ESI) Agilent Jet Stream (AJS). Необходим комплект опрыскивателя CE-ESI-MS и изократический насос LC (жидкостная хроматография).
- Подключите разветвитель потока оболочки 1:100 (входит в комплект опрыскивателя CE-MS) и выход изократического насоса LC.
- Убедитесь, что входной флакон системы CE находится на той же высоте, что и наконечник опрыскивателя анализатора массы.
- Используйте рабочую станцию MassHunter (версия 10.1) или аналогичное программное обеспечение MS для управления всей системой, а также для сбора и анализа данных.
2. Подготовка буферной, капиллярной и CE-MS системы
- Подготовьте рабочий буфер CE: Отрегулируйте рН 40 мМ ацетата аммония до 9,0 с гидроксидом аммония. Рекомендуется использовать объемную колбу объемом 250 мл. Фильтруйте буфер 250 мл с помощью мембранных фильтров размером 0,2 мкм. Обязательно используйте только сверхчистую деионизированную воду и реагенты ms-класса.
ПРИМЕЧАНИЕ: Этот буфер можно хранить при комнатной температуре в течение 2-3 недель или в течение нескольких месяцев в холодильнике. - Приготовьте жидкость для оболочки: смешайте 100 мл сверхчистой воды и 100 мл изопропанола марки LC-MS в бутылке емкостью 250 мл. Меняйте оболочку жидкостью не реже одного раза в неделю. Добавьте эталон массы в оболочку жидкости при использовании масс-спектрометра высокого разрешения.
- Установите оболочку жидкости: Продувка со скоростью 5 мл/мин в течение 5 мин и установка расхода на уровне 1 мл/мин (10 мкл/мин в опрыскиватель CE-MS). Давление насоса составит около 180 бар. Убедитесь, что трубка для рециркуляции соединяется обратно в бутылку с жидкостью для оболочки для повторного использования растворителя.
- Подготовьте капилляр: Приобретите капилляр CE-MS (50 мкм в.д. и 365 мкМ в сутки длиной 125 см) с окном обнаружения УФ-излучения. Пользователь также может получить гораздо более дешевые бар-плавленые кварцевые капилляры от специализированных дистрибьюторов. Вырежьте капилляр длиной 100 см. Правильно вырежьте оба конца капилляра капиллярным колонкорезом с вращающимся алмазным лезвием и удалите 2-3 см полиимидного покрытия с обоих концов зажигалкой. Очистите поверхность капилляров изопропанолом.
- Установка капилляра: сопоставьте капилляр с кассетой CE-MS. Нажмите кнопку Изменить кассету и установите кассету в устройство CE. Входной конец капилляра примерно на 2 мм ниже, чем электрод. Убедитесь, что входной конец находится ниже поверхности образца во время процесса впрыска.
- Активация капилляра: Перед первым использованием промывайте капилляр 1 M NaOH, затем водой в течение 10 минут и буфером CE в течение 15 минут.
- Вставьте капиллярный конец в опрыскиватель CE-MS: аккуратно поместите капилляр в опрыскиватель CE-MS и убедитесь, что капиллярный конец выступает примерно на 0,1 мм из наконечника опрыскивателя. Убедитесь, что вы делаете точную регулировку выходного конца капилляра с помощью увеличительного стекла и регулировочного винта в опрыскивателе. Вставьте распылитель обратно в источник ионов и избегайте прикосновения к регулировочному винту. Ms находится в режиме ожидания при выполнении этой операции.
- Проверьте спрей ESI: Проверьте стабильность опрыскивателя ESI в режиме полного сканирования. Флуктуация общих ионных электроферограмм должна быть в пределах 5%.
- Выполните тестовый запуск со стандартами InsP: Используйте смесь стандартов InsP 3-InsP8 (скорректированных по количественным 31P ЯМР 15,27) для тестовых запусков с инъекцией при 50 мбар в течение 10 с (10 нЛ). Задайте подробные параметры ESI и MS, как показано в таблице 1. Ток CE составляет около 26 мкА. Пиковая ширина составляет около 0,4-0,5 мин. Убедитесь, что отношение сигнал/шум достигает не менее 400.
3. Извлечение растворимых инозитолфосфатов из клеток млекопитающих
ПРИМЕЧАНИЕ: Клетки HCT116NIH были своеобразным подарком от СтивенаШирса 28. Клетки HCT116UCL были из лаборатории Сайарди26.
- Посевные ячейки
- Культивирование клеток HCT116NIH или HCT116UCL в колбах T75 при 37 °C в атмосфере CO2 с высокой влажностью 5% (далее называемой стандартными условиями) в модифицированной орлиной среде Dulbecco (DMEM), дополненной 10% фетальной бычьей сывороткой (FBS).
- Промыть стоковые культуры HCT116NIH и HCT116UCL фосфатно-буферным физиологическим раствором (PBS) (5 мл) и инкубировать клетки трипсин-этилендиаминовой тетрауксусной кислотой (ЭДТА) (3 мл, 0,25%) в стандартных условиях до полного отделения. Гасит активность трипсина путем добавления среды (7 мл), собирает клетки в центрифужную трубку и центрифугу (200 х г, 3 мин).
- Удалить супернатант и повторно суспендировать клетки в среде (10 мл). Подсчитайте клетки и определите жизнеспособность с помощью исключения синего трипана.
- Посейте клетки (6 миллионов клеток HCT116 на анализ) в тарелку толщиной 150 мм и отрегулируйте в общей сложности 20 мл клеточной питательной среды. Предварительно смешайте среду и клетки в центрифужной трубке перед посевом, чтобы добиться равного распределения клеток в чашке. Приготовьте параллельное блюдо, когда требуется нормализация по номеру ячейки.
- Культивировать клетки в стандартных условиях в течение 72 ч. Клетки достигнут около 80%-90% слияния.
- Модуляция уровней инозитолфосфата с помощью NaF и сбора клеток
- Обработка NaF: Добавьте NaF (10 мМ) за 1 ч перед сбором урожая в среду. Смешайте среду путем закручивания пластины/пипетки и инкубируйте клетки в течение 60 мин в стандартных условиях.
- После лечения NaF удалите среду из клеток и поместите клетки на лед.
- Дважды вымойте ячейки PBS (5 мл, 4 °C) и полностью удалите PBS из посуды.
- Добавить хлорную кислоту (ПА) (1 мл, 1 М, 4 °C). Убедитесь, что вся поверхность покрыта ПА (клетки станут белыми, когда белки выпадают в осадок). Инкубировать клетки в течение 10 мин на наклонном столе при 4 °C.
- Соберите ПА в центрифужную трубку и удалите загрязняющий мусор центрифугированием (17 000 х г, 5 мин, 4 °C). Добавьте супернатант в подготовленные шарики TiO2 для вытягивания InsPs.
- Дважды вымойте посуду после экстракции PBS (5 мл, р.т.) для раскисления; полностью удалить PBS из блюда.
- Солюбилизируют белки на пластине путем добавления буфера лизиса клеток (1,5 мл, r.t.; 0,1% додецилсульфата натрия [SDS] в 0,1 М NaOH). Инкубировать блюдо в течение 15 мин на наклонном столе при r.t. Переложите лизат ячейки в центрифужную трубку и центрифугу (17 000 х г, 5 мин, 4 °C). Храните супернатант при -80 °C до тех пор, пока концентрация белка не будет определена с помощью анализа белка DC с использованием бычьего сывороточного альбумина в качестве калибровочного стандарта (обычно одна чашка размером 150 мм содержит около 10 мг белков).
- Определение количества клеток из параллельных блюд: Соберите клетки параллельной чашки с помощью трипсина, как описано в шаге 3.1.2 (используйте 5 мл трипсина-ЭДТА для чашки 150 мм) и удалите среду. Повторно суспендируйте клеточную гранулу в PBS (5 мл), правильно перемешайте и подсчитайте клетки. Выполните этот шаг непосредственно перед сбором урожая с помощью прямого закалки, чтобы получить репрезентативное количество клеток. Кроме того, измеряют объем ячеек соответствующим методом (например, с помощью мультисайзерной машины).
- TiO2 обогащение инозитолфосфатов
ПРИМЕЧАНИЕ: Чтобы избежать кислотного разложения фосфорилированных соединений, выполните все этапы обогащения до элюирования на льду и охладите все реагенты до 4 °C. Сведите время экстракции к минимуму (1,5-2 ч). Выполните все шаги извлечения с 1 МПА.- Приготовление шариков: Промыть TiO2 шарика (5 мг на образец) с ddH2O (1 мл) и центрифугу (3 500 х г, 1 мин, 4 °C). Удалите ddH2Oи вымойте шарики ПА (1 мл). Удаляют ПА центрифугированием (3 500 х г, 1 мин, 4 °C). Повторное суспендирование шариков в ПА (50 мкл на образец).
- Добавьте супернатант, содержащий фосфорилированные соединения (сравните раздел 3.2, этап 3.2.5), к шариковой суспензии, вихрю, а затем поверните образец в течение 20 мин при 4°С.
- Центрифугируйте образец (3 500 х г, 1 мин, 4 °C) и выбросьте супернатант. Вымойте шарики ПА (500 мкл) и центрифугой (3 500 х г, 1 мин, 4 °C). Выбросьте супернатант и повторите этап промывки.
- Добавьте NH4OH (200 мкл, 3%) к шарикам и повторно суспендируйте. Поверните образец в течение 5 мин при r.t.
- Центрифугируйте образец (3 500 х г, 1 мин) и перенесите супернатант в новую центрифужную трубку.
- Повторите этапы элюирования 3.3.4 и 3.3.5 и объедините элюенты. Выбросьте бусины.
- Центрифугируйте комбинированные элюенты (17 000 х г, 1 мин, 4 °C) для удаления нерастворимых остатков.
- Полностью высушите супернатант под вакуумным выпариванием (70 мин, 60 °C, V-AQ). Добавляют ddH2O(50 мкл) к высушенным экстрактам, содержащим InsPs. Вихрь для смешивания образца до полного растворения. Храните образец при -20 °C до анализа CE-ESI-MS.
4. Выполнение запусков CE-ESI-MS
- Готовят смесь внутренних эталонов, содержащую 40 мкМ [13С6]1,5-(PP)2-InsP4, 80 мкМ [13C6]5-PP-InsP5, 80 мкМ [13C6]1-PP-InsP5, 400 мкМ [13C6]InsP6 и 400 мкМ [13C6]Ins(1,3,4,5,6)P5. Определить концентрации растворов SIL IS с помощью количественных ЯМР 31Р и 1Ч, с помощью сертифицированного эталонного стандарта, т.е. фосфоуксусной кислоты.
ПРИМЕЧАНИЕ: Все внутренние стандарты (IS) выше SIL с чистотой выше 96% были синтезированы и предоставлены группой Фидлера15,27. Как и в случае с нуклеотидами, эти ИГ могут нести много кристаллических молекул воды и различные встречные ионы. Вместо взвешивания вещества и расчета концентрации рекомендуется определение концентрации стандартных растворов 13С6 с помощью количественного ЯМР 31. - Смешайте 10 мкл образца с 0,5 мкл внутренней эталонной смеси во флаконе образца CE. 2 мкМ [13С6]1,5-(PP)2-InsP4, 4 мкМ [13C6]5-PP-InsP5, 4 мкМ [13C6]1-PP-InsP5, 20 мкМ [13C6]InsP6 и 20 мкМ [13C6]Ins(1,3,4,5,6)P5 являются конечными концентрациями внутри образцов.
- При использовании системы пополнения нажмите кнопку «Изменить бутылку », поместите подготовленные 250 мл рабочего буфера CE в бутылку с электролитом и нажмите « Чистые трубки». Храните иглу для пополнения в флаконе с водой.
- Задайте параметры ESI и MS, как показано в таблице 1. Оптимизируйте исходные параметры с помощью Оптимизатора исходного кода со смесью стандартов инозитолполифосфата. Получите настройки мониторинга нескольких реакций (MRM) с помощью Masshunter Optimizer со всеми стандартами. Настройте параметры ESI и MS/MS для различных приборов.
- Выполните запуск insP-экстрактов и проверьте результат (рисунок 2). Задайте последовательность при наличии большего количества образцов.
- Пусть MS находится в режиме ожидания после измерений. Не выключайте насос LC. Поток оболочки жидкости защищает иглу опрыскивателя. Замените опрыскиватель CE-ESI-MS опрыскивателем LC-ESI-MS при отсутствии подачи жидкости в оболочку.
5. Анализ данных
- Откройте программное обеспечение количественный анализ (для QQQ), создайте пакет для всех образцов.
- Создайте новый метод из полученных данных управления записями сообщений. Установите [13C6]InsPs в качестве внутренних стандартов - (ISTD). Проверьте настройку состава MRM, настройку времени удержания, настройку ISTD, настройку концентрации и настройку квалификатора. Пройдите проверку и выйдите, чтобы применить метод к текущему пакету. Сохраните метод.
- Проверьте, правильно ли интегрирован каждый пик в пакете; в противном случае вручную интегрируйте пик.
- Экспортируйте результаты в электронную таблицу. Выполните количественное определение инозитол(пиро)фосфатов, сравнив пиковую реакцию анализируемого вещества с соответствующей пиковой реакцией SIL IS с известными концентрациями. Теоретические и экспериментальные калибровочные кривые приведены в таблице 2 для 5-PP-InsP5, InsP6 и Ins(1,3,4,5,6)P5 с линейным диапазоном.
ПРИМЕЧАНИЕ: Предварительным условием применения теоретической калибровочной кривой является использование высококачественной изотопной картины целевых аналитов с достоверной концентрацией. Оцените линейный диапазон. Калибровочная кривая имеет важное значение для абсолютного количественного определения, когда полное получение вышеупомянутых изотопных стандартов нецелесообразно. - С учетом измеренной концентрации в растворе экстракта InsP и его объема рассчитывают абсолютные количества. Кроме того, нормализуйте количество по количеству клеток или содержанию белка. Рассчитайте клеточную концентрацию на основе количества клеток и среднего объема клеток HCT116 (1,68 fL).
Результаты
Результаты, показанные здесь, призваны проиллюстрировать потенциал анализа CE-ESI-MS. Приведенные цифры описывают технически безупречный запуск CE-ESI-MS. Во-первых, представлена смесь стандартов пирофосфата инозитола (рисунок 1) и экстракта клеток млекопитающих (рисунок 2). Во-вторых, приведено сравнение двух клеточных линий HCT116 (рисунок 3) и клеток HCT116, обработанных NaF (рисунок 4).
Экстрагированные ионные электроферограммы (EEI) инозитоловых (пиро)фосфатных эталонов в концентрации 2 мкМ показаны на фиг.1. Вставлен метаболизм пирофосфатов инозитола у млекопитающих с их упрощенной структурой. Четыре инозитолпирофосфата у млекопитающих, 1,5-(PP)2-InsP4, 5-PP-InsP5, 1-PP-InsP5 и 5-PP-Ins(1,3,4,6)P4 хорошо различаются с использованием описанного способа. Запуск CE-ESI-MS HCT116UCL показан на рисунке 2. С помощью внутренних стандартов, меченных стабильными изотопами (SIL), абсолютное количественное определение может быть легко достигнуто путем сравнения отклика сигнала с шипованным SIL известной концентрации. Показаны интегрированные EEI инозитолфосфата от InsP5 до (PP)2-InsP4 и неинтегрированные EEI их изотопных паттернов. RSD всех аналитов из шести технических повторов находятся в пределах 4%. С измеренной концентрацией и объемом экстрактов можно рассчитать количество аналитов. С количеством клеток и объемом клеток или содержанием белка, абсолютная клеточная концентрация (мкМ) или количество, нормализованное содержанием белка (белок пмоль / мг), обычно являются окончательными результатами такого анализа.
Согласно более раннему исследованию, две партии расходящихся клеток HCT116 имеют вариацию уровней InsP8, клетки HCT116UCL содержат в 6 раз более высокие уровни InsP8, чем HCT116NIH клетки29. С помощью метода CE-MS 1,5-(PP)2-InsP4 в HCT116NIH может быть легко количественно определен (рисунок 3), а клетки HCT116UCL содержат в 7 раз более высокие уровни InsP8, чем в HCT116NIH. Кроме того, значительное накопление 1,5-(PP)2-InsP4 в клетках HCT116UCL сопровождается значительно увеличенным 1-PP-InsP5, что теперь количественно показано на рисунке 3.
Уровни PP-InsPs увеличиваются за счет ингибирования их дефосфорилирования с использованием фторида натрия. Анализ CE-ESI-MS клеток HCT116NIH , обработанных NaF, продемонстрировал повышение -5-PP-InsP5 наряду со снижением InsP6 и появлением 5-PP-Ins(1,3,4,6)P4 (Рисунок 4). Кроме того, заметно повышение уровней InsP8 , в то время как 1-PP-InsP5 в некоторой степени снижается. 1-PP-InsP5 не полностью отсутствует в HCT116NIH, обработанном NaF, но в основном либо под пределом обнаружения, либо количественного определения.
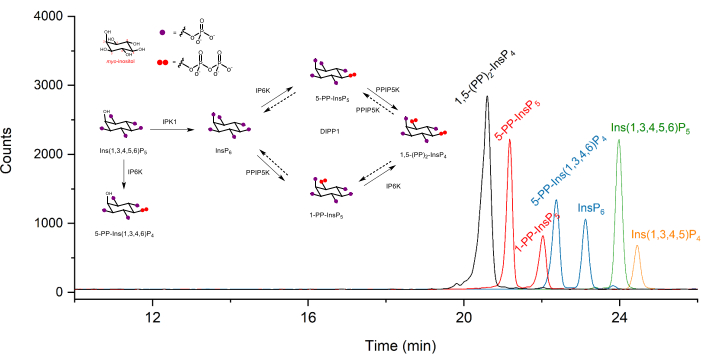
Рисунок 1: Типичные экстрагированные ионные электроферограммы (EEI) стандартов инозитол (пиро)фосфатов в анализе CE-ESI-MS с использованием описанного протокола. Концентрация каждого анализируемого вещества составляет 2 мкМ. Объем вводимого образца составляет около 10 нл с инъекцией при 50 мбар в течение 10 с. Вставки показывают метаболизм пирофосфатов инозитола у млекопитающих. IPPK: инозитол пентакисфосфат 2-киназа, IP6K: инозитолгексакисфосфаткиназа, PPIP5K: дифосфоинозитол пентакисфосфаткиназа, DIPP1: дифосфоинозитолполифосфатфосфогидролаза 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
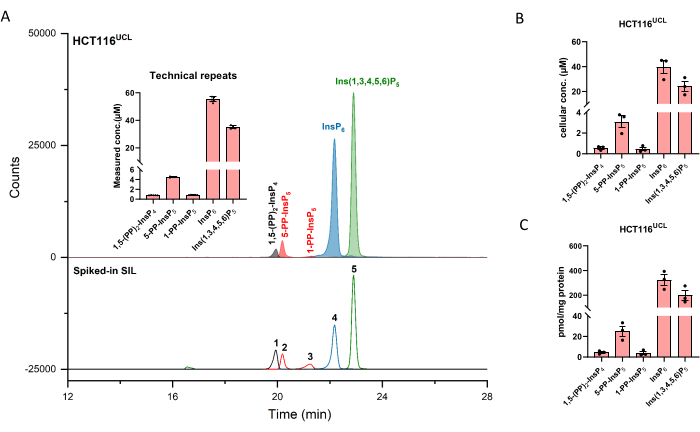
Рисунок 2: Репрезентативный профиль InsP клеток HCT116UCL. (A) EEI основных инозитоловых (пиро)фосфатов в HCT116NIH и шипованных SIL ISs 2 мкМ [13C6]1,5-(PP)2-InsP4 (1), 4 мкМ [13C6]5-PP-InsP5 (2), 4 мкМ [13C6]1-PP-InsP5 (3), 20 мкМ [13C6]InsP6 (4), и 20 мкМ [13С6]Ins(1,3,4,5,6)P5 (5). Вкладыши показывают шесть технических повторов анализа InsP методом CE-ESI-MS, данные представлены в виде средств ± SD. (B) Клеточная концентрация PP-InsPs и InsPs в клеточных линиях человека HCT116UCL и (C) PP-InsPs и InsPs, нормализованная содержанием белка. Данные являются средствами, ± SEM из трех независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
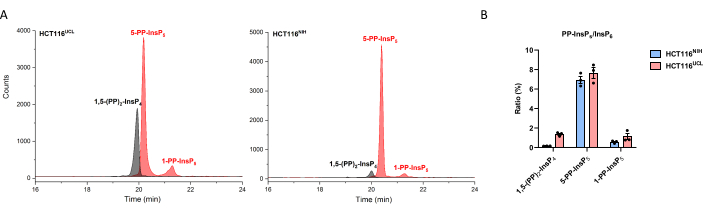
Рисунок 3: Изменение уровней InsP8 между двумя расходящимися ячейками HCT116. (А) EEI инозитолпирофосфата вHCT116UCL и HCT116NIH. InsP8 в HCT116UCL заметно более распространен, чем в HCT116NIH. (B) Отношение пирофосфата инозитола к InsP6 (%) в обеих клетках HCT116. Клетки HCT116UCL содержат в 7 раз более высокие уровни InsP8 по сравнению с HCT116NIH, в то время как уровни 5-PP-InsP5 равны. Данные являются средствами, ± SEM из трех независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
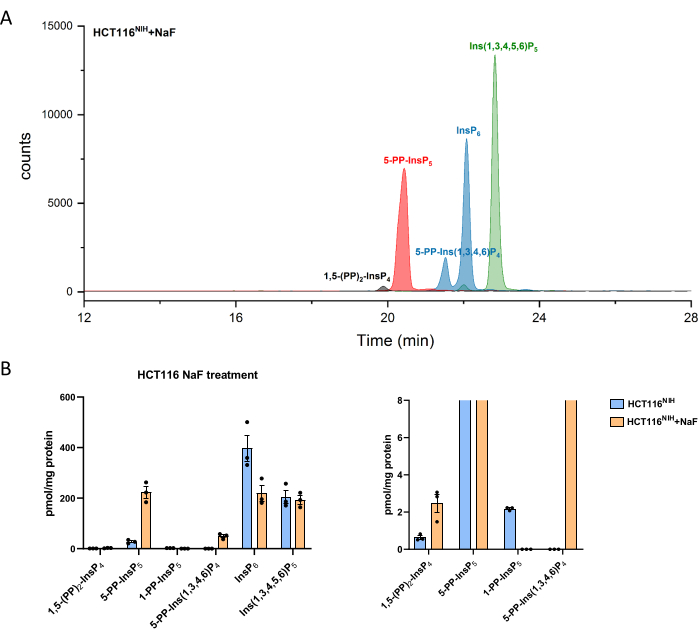
Рисунок 4: Уровни инозитол (пиро)фосфатов в клетках HCT116NIH при обработке NaF. (A) EEI инозитол (пиро)фосфата в HCT116NIH с обработкой фторидом натрия (NaF, 10 мМ). Уровни инозитолпирофосфата, включая 1,5-(PP)2-InsP4, 5-PP-InsP5 и 5-PP-Ins(1,3,4,6)P4, увеличиваются за счет блокирования их дефосфорилирования с помощью NaF. (B) Уровни инозитол(пиро)фосфата (количества нормируются содержанием белка) в необработанных и обработанных NaF клетках HCT116NIH. Данные являются средствами, ± SEM из трех независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Настройки параметров CE-ESI-MS. Параметры Source и iFunnel оптимизированы с помощью Source и iFunnel Optimizer. Настройки параметров MSM для инозитоловых (пиро)фосфатов оптимизированы MassHunter Optimizer. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Теоретическое и экспериментальное уравнение регрессии. Концентрация [13C6]5-PP-InsP5 [13C6]InsP6 и [13C6]Ins (1, 3, 4, 5, 6)P5 составляет 4 мкМ, 20 мкМ и 20 мкМ соответственно. Для уравнения регрессии концентрация 5-PP-InsP5 составляет 0,04 мкМ, 0,1 мкМ, 0,2 мкМ, 0,4 мкМ, 1 мкМ, 2 мкМ, 4 мкМ, 8 мкМ, 16 мкМ, 24 мкМ. InsP6 и Ins (1, 3, 4, 5, 6)P5 концентрация составляет 0,2 мкМ, 0,5 мкМ, 1 мкМ, 2 мкМ, 5 мкМ, 10 мкМ, 20 мкМ, 20 мкМ, 40 мкМ, 80 мкМ, 120 мкМ. x - концентрация, y - (Площадь InsP)12C/(Область InsP)13C. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Здесь представлен практический и чувствительный метод количественного определения высокозаряженных пирофосфатов инозитола в клетках млекопитающих. Сочетая этот подход к анализу с современной экстракцией InsP с помощью хлорной кислоты с последующим обогащением TiO2, анализ CE-ESI-MS имеет беспрецедентные преимущества. Что касается его пропускной способности, чувствительности, стабильности, абсолютного количественного определения, идентификации изомеров и зависимости от матрицы, этот метод выделяется по сравнению с другими подходами. Этот протокол применим к клеткам млекопитающих, но на самом деле эта стратегия преуспевает во многих различных образцах (например, дрожжи, растения, паразиты, ткани мыши и т. Д.).
Применяемый протокол экстракции полностью восстанавливает PP-InsPs и InsP6 из экстрактов клеток млекопитающих16,19. Он также будет извлекать многие другие анионные метаболиты, особенно фосфатсодержащие виды, например, сахарные фосфаты и нуклеотиды. Оценка восстановления и декомпозиции аналитов пользователя с помощью этого протокола будет необходима.
Как правило, система CE-ESI-MS работает бесперебойно и может вместить около 200 образцов каждую неделю с использованием этого протокола. Однако, в отличие от ВЭЖХ, СЕ долгое время рассматривалась как метод для экспертов и специализированных лиц, что ограничивало ее рынок и ограничивало ее применение. Таким образом, устройство CE-ESI-MS обычно отсутствует на аналитических факультетах. Люди, которые хотят провести анализ CE-ESI-MS, вероятно, не имеют опыта CE и будут тратить больше времени на устранение неполадок. Здесь выделены важнейшие шаги. В первую очередь это качество разреза капилляров. Чувствительность и стабильность спрея ESI в основном зависят от первоклассного капиллярного разреза. Во-вторых, капиллярный выходной конец должен находиться ровно на расстоянии 0,1 мм от наконечника опрыскивателя. Игла опрыскивателя и капилляр СЕ должны находиться в осевом направлении. Качество спрея ESI имеет решающее значение для количественного определения; для оценки повторяемости следует выполнить технические прогоны.
При описанном протоколе предел количественного определения (LOQ) для PP-InsPs составляет 40 нМ при впрыске при 50 мбар в течение 10 с (10 нЛ). Существует несколько подходов к дальнейшему повышению чувствительности метода. Во-первых, инъекция при 100 мбар в течение 20 с (40 нЛ) все равно приведет к хорошей пиковой форме и достаточному разрешению для региоизомеров 5-PP-InsP5 и 1-PP-InsP5. Во-вторых, экстракты InsP могут быть растворены в меньшем количестве воды. В-третьих, время ожидания может быть увеличено при использовании меньшего количества переходов MRM для количественного определения. Кроме того, источник ионов CE-MS, использующий поток жидкости со сверхнизкой оболочкой, значительно повысит чувствительность.
Работающий буфер CE с pH 9 обеспечивает наилучшее разрешение между InsP 6-InsP8. При повышении pH до 9,7 разрешение среди InsP 3-InsP6 значительно улучшится. Благодаря отличному разрешению для дальнейшего увеличения пропускной способности рекомендуется более короткая длина капилляра 72 см. Кроме того, более высокая температура кассеты CE при 40 °C снижает вязкость водного электрофоретического буфера и ускоряет их движение под EOF. В соответствии с различными исследовательскими требованиями модификации этого метода могут дополнительно облегчить анализ InsPs и PP-InsPs. Таким образом, описанные протоколы CE-ESI-MS могут открыть новые возможности для исследований в этом многогранном семействе сигнальных молекул.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Этот проект получил финансирование от Европейского исследовательского совета (ERC) в рамках исследовательской и инновационной программы Европейского союза Horizon 2020 (грантовое соглашение No 864246, HJJ). DQ признает финансовую поддержку со стороны Программы Бригитты-Шлибен-Ланге. AS поддерживается грантом программы MRC MR/T028904/1.
Материалы
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 1.5 mL microcentrifuge tubes | Greiner Bio-One | 616201 | - |
| 15 cm tissue culture dishes | Thermo Fisher | 168381 | - |
| 2.0 mL microcentrifuge tubes | Greiner Bio-One | 623201 | - |
| 50 mL centrifuge tubes | Greiner Bio-One | 227261 | - |
| 96-well plates | Thermo Fisher | 260836 | for the DC protein assay |
| CE fused silica capillary | CS Chromatographie | 105180 | 50 µM i.d. 360 µM o.d. |
| Pipette tips | Starlab | I1054-0001, S1111-6701, S1113-1700, S1111-3700 | 10 mL, 1000 µL, 200 µL, 10 µL pipette tips |
| Serological pipets | TPP | 94550, 94525, 94010, 94005 | 50 mL, 25, mL, 10 mL, 5 mL serological pipettes |
| T75 flasks | TPP | 90076 | - |
| Chemicals and Reagents | |||
| NaOH | AppliChem | A6829,0500 | sodium hydroxide pellets for molecular biology, for preparation of cell lysis buffer |
| 0.25% trypsin-EDTA | Gibco | 25200056 | - |
| Ammonium acetate | Thermo Fisher | 1677373 | HPLC grade |
| BSA | Thermo Fisher | 23209 | albumin standard (2.0 mg/mL) for standard curve preparation |
| DC protein assay | Biorad | 5000116 | DC protein assay reagents package |
| DMEM | Gibco | 41966029 | high glucose, pyruvate |
| FBS | Gibco | 10270106, 10500064 (heat inactivated) | 10270106 for HCT116UCL, 10500064 for HCT116NIH |
| Isopropanol | Carl Roth | AE73.2 | 99.95% LC-MS grade |
| NH4OH, 10% | Carl Roth | 6756.1 | for preparation of 3% NH4OH |
| PBS | Gibco | 10010015 | - |
| Perchloric acid, 70% | Carl Roth | 9216.1 | for preparation of 1 M perchloric acid |
| SDS | SERVA | 20760.02 | for preparation of cell lysis buffer |
| Sodium fluoride | Sigma Aldrich | S7920 | - |
| TiO2 beads | GL Sciences | 5020-75000 | 5 µm particle size |
| Trypan blue solution | Gibco | 15250061 | trypan blue stain (0.4%) |
| Ultrapure (Type 1) water | Milli-Q | ZRQSVP3WW | model: Direct-Q 3 UV Water Purification System |
| Equipment | |||
| Analytical balance | Mettler Toledo | 30105893 | model: XPE26; for weighing of beads (5-6 mg per sample) |
| Automated cell counter | Logos Biosystems | L40002 | model: LUNA-II Automated Cell Counter |
| Benchtop centrifuge | Hettich | 1401 | model: UNIVERSAL 320 |
| Benchtop centrifuge with cooling | VWR | 521-1647P | model: Microstar 17R |
| CE system | Agilent | G7100A | - |
| CE/MS Adapter Kit | Agilent | G1603A | - |
| CE/MS Sprayer Kit | Agilent | G1607A | - |
| Cell counting slides | Logos Biosystems | L12001 | LUNA Cell Counting Slides |
| Centrifugal evaporator | Eppendorf | 5305000304 | model: Concentrator plus complete system |
| ESI source | Agilent | AJS ESI | - |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Humidified incubator | Binder | 9040-0088 | model: CB E6.1, for cultivation of mammalian cells |
| Ice box | - | - | should provide enough space for samples, dishes, etc. |
| Isocratic LC system | Agilent | G7110B 1260 Iso Pump | model: Infinity II Quaternary system |
| MSD | Agilent | G6495C | triple quadrupole |
| Multiplate reader | Tecan | 30086375 | model: SPARK 10 M |
| Pipette filler | Thermo Fisher | 10072332 | for serological pipettes |
| Pipettes | Brand | 705884, 705880, 705878, 705872, 705870 | various pipettes |
| Rotator | Labnet | H5500 | model: Mini LabRoller Rotator |
| Shortix capillary column cutter | SGT | S0020 | - |
| Test tube shaker (vortex mixer) | Carl Roth | HXH6.1 | model: Rotilabo-Mini Vortex |
| Tilt table | Labnet | S0600 | model: EDURO MiniMix Nutating Mixer |
| Water bath | Thermo Fisher | FSGPD05 | model: Isotemp GPD 05 |
| Software | |||
| MassHunter Workstation | Agilent | Version 10.1 | - |
| MassHunter Workstation LC/MS Data Acquisition | Agilent | Version 10.1 | - |
| MassHunter Workstation Optimizer | Agilent | Version 10.1 | - |
| MassHunter Workstation Qualitative Analysis | Agilent | Version 10.0 | - |
| QQQ Quantitaion Analysis | Agilent | Version 10.1 | - |
Ссылки
- Stephens, L., et al. The detection, purification, structural characterization, and metabolism of diphosphoinositol pentakisphosphate(s) and bisdiphosphoinositol tetrakisphosphate(s). The Journal of Biological Chemistry. 268 (6), 4009-4015 (1993).
- Menniti, F. S., Miller, R. N., Putney, J. W. Jr, Shears, S. B. Turnover of inositol polyphosphate pyrophosphates in pancreatoma cells. The Journal of Biological Chemistry. 268 (6), 3850-3856 (1993).
- Shears, S. B. Inositol pyrophosphates: Why so many phosphates. Advances in Biological Regulation. 57, 203-216 (2015).
- Irvine, R. F., Schell, M. J. Back in the water: the return of the inositol phosphates. Nature Reviews Molecular Cell Biology. 2 (5), 327-338 (2001).
- Szijgyarto, Z., Garedew, A., Azevedo, C., Saiardi, A. Influence of inositol pyrophosphates on cellular energy dynamics. Science. 334 (6057), 802-805 (2011).
- Wild, R., et al. Control of eukaryotic phosphate homeostasis by inositol polyphosphate sensor domains. Science. 352 (6288), 986-990 (2016).
- Chakraborty, A., et al. Inositol pyrophosphates inhibit Akt signaling, thereby regulating insulin sensitivity and weight gain. Cell. 143 (6), 897-910 (2010).
- Bittner, T., et al. Photolysis of caged inositol pyrophosphate InsP8 directly modulates intracellular Ca2+ oscillations and controls C2AB domain localization. Journal of the American Chemical Society. 142 (24), (2020).
- Hauke, S., et al. Photolysis of cell-permeant caged inositol pyrophosphates controls oscillations of cytosolic calcium in a β-cell line. Chemical Science. 10 (9), 2687-2692 (2019).
- Saiardi, A., Sciambi, C., McCaffery, J. M., Wendland, B., Snyder, S. H. Inositol pyrophosphates regulate endocytic trafficking. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14206-14211 (2002).
- Koldobskiy, M. A., et al. p53-mediated apoptosis requires inositol hexakisphosphate kinase-2. Proceedings of the National Academy of Sciences of the United States of America. 107 (49), 20947(2010).
- Rao, F., et al. Inositol hexakisphosphate kinase-1 mediates assembly/disassembly of the CRL4-signalosome complex to regulate DNA repair and cell death. Proceedings of the National Academy of Sciences. 111 (45), 16005(2014).
- Williams, S. P., Gillaspy, G. E., Perera, I. Y. Biosynthesis and possible functions of inositol pyrophosphates in plants. Frontiers in Plant Science. 6, 67(2015).
- Wilson, M. S. C., Livermore, T. M., Saiardi, A. Inositol pyrophosphates: between signalling and metabolism. The Biochemical Journal. 452 (3), 369-379 (2013).
- Harmel, R. K., et al. Harnessing 13C-labeled myo-inositol to interrogate inositol phosphate messengers by NMR. Chemical Science. 10 (20), 5267-5274 (2019).
- Qiu, D., et al. Analysis of inositol phosphate metabolism by capillary electrophoresis electrospray ionization mass spectrometry. Nature Communications. 11 (1), 6035(2020).
- Azevedo, C., Saiardi, A. Extraction and analysis of soluble inositol polyphosphates from yeast. Nature Protocols. 1 (5), 2416-2422 (2006).
- Wilson, M. S. C., Saiardi, A. Importance of radioactive labelling to elucidate inositol polyphosphate signalling. Phosphate Labeling and Sensing in Chemical Biology. , 67-87 (2017).
- Wilson, M. S. C., Bulley, S. J., Pisani, F., Irvine, R. F., Saiardi, A. A novel method for the purification of inositol phosphates from biological samples reveals that no phytate is present in human plasma or urine. Open Biology. 5 (3), 150014(2015).
- Losito, O., Szijgyarto, Z., Resnick, A. C., Saiardi, A. Inositol pyrophosphates and their unique metabolic complexity: analysis by gel electrophoresis. PloS One. 4 (5), 5580(2009).
- Dong, J., et al. Inositol pyrophosphate InsP8 acts as an intracellular phosphate signal in arabidopsis. Molecular Plant. 12 (11), 1463-1473 (2019).
- Riemer, E., et al. ITPK1 is an InsP6/ADP phosphotransferase that controls systemic phosphate homeostasis in Arabidopsis. bioRxiv. , (2020).
- Whitfield, H., et al. An ATP-responsive metabolic cassette comprised of inositol tris/tetrakisphosphate kinase 1 (ITPK1) and inositol pentakisphosphate 2-kinase (IPK1) buffers diphosphosphoinositol phosphate levels. The Biochemical Journal. 477 (14), 2621-2638 (2020).
- Ito, M., et al. Hydrophilic interaction liquid chromatography-tandem mass spectrometry for the quantitative analysis of mammalian-derived inositol poly/pyrophosphates. Journal of chromatography. A. 1573, 87-97 (2018).
- Mantilla, B. S., Amaral, L. D. D., Jessen, H. J., Docampo, R. the inositol pyrophosphate biosynthetic pathway of Trypanosoma cruzi. ACS Chemical Biology. 16 (2), 283-292 (2021).
- Wilson, M. S. C., Saiardi, A. Inositol phosphates purification using titanium dioxide beads. Bio-Protocol. 8 (15), 2959(2018).
- Puschmann, R., Harmel, R. K., Fiedler, D. Scalable chemoenzymatic synthesis of inositol pyrophosphates. Biochemistry. 58 (38), 3927-3932 (2019).
- Gu, C., et al. KO of 5-InsP7 kinase activity transforms the HCT116 colon cancer cell line into a hypermetabolic, growth-inhibited phenotype. Proceedings of the National Academy of Sciences of the United States of America. 114 (45), 11968-11973 (2017).
- Gu, C., Wilson, M. S. C., Jessen, H. J., Saiardi, A., Shears, S. B. Inositol Pyrophosphate Profiling of Two HCT116 Cell Lines Uncovers Variation in InsP8 Levels. PloS One. 11 (10), 0165286(2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены