Method Article
キャピラリー電気泳動エレクトロスプレーイオン化質量分析によるイノシトールピロリン酸の絶対定量(英語)
要約
哺乳類細胞抽出物からのイノシトールピロリン酸の絶対定量のためのキャピラリー電気泳動エレクトロスプレーイオン化質量分析の手順が記載されている。
要約
イノシトールピロリン酸 (PP-InsPs) 細胞内シグナル伝達分子の重要なグループです.イノシトールホスフェート(InsPs)に由来し、これらの分子は、 ミオイノシトール環上に少なくとも1つのエネルギーピロリン酸部分が存在することを特徴とします。それらは真核生物に遍在し、リン酸恒常性、インスリン感受性、および細胞エネルギー電荷を研究する代謝メッセンジャーとして機能します。これらの代謝物に発色団がなく、電荷密度が非常に高く、存在量が少ないため、それらの分析には放射性トレーサーが必要であり、したがって複雑で高価です。ここでは、この研究では、キャピラリー電気泳動エレクトロスプレーイオン化質量分析(CE-ESI-MS)による哺乳類細胞からのイノシトールピロリン酸の絶対的かつ高スループット定量を実行するための詳細なプロトコルを示します。この方法は、哺乳類細胞におけるすべての生物学的に関連するPP-InsPs種の高感度プロファイリングを可能にし、位置異性体のベースライン分離を可能にします。マイナー異性体を含むPP-InsPの絶対細胞濃度、およびいくつかの実験条件下でのHCT116細胞におけるそれらの時間的変化のモニタリングが提示されています。
概要
1993年にミオイノシトールピロリン酸(PP-InsPs)が最初に発見されて以来1,2、その生合成、代謝回転、機能の解明は大きく進歩しました3。イノシトールピロリン酸は真核細胞4に遍在的に存在し、例えば、リン酸恒常性5,6、インスリン感受性7、カルシウム振動8,9、小胞輸送10、アポトーシス11、DNA修復12、免疫シグナル伝達13に決定的に関与する代謝シグナル伝達分子として機能します。、その他。イノシトールピロリン酸の制御下にある重要なプロセスの過多は、それらの細胞の存在量のより深い理解を必要とします, 変動, と局在.
InsPとPP-InsPは分野を超えて注目を集めましたが、それらの存在量の分析は、トリチウム化イノシトールで細胞を標識し、抽出したPP-InsPを強陰イオン交換クロマトグラフィーSax-HPLCで分離し、その後シンチレーションカウントするという80年代に開発された方法を使用して日常的に行われています。質量分析に基づく新しい方法は依然として大きな課題に直面しています:最大8つのリン酸単位を有するイノシトールピロリン酸はリン酸エステルおよび無水物を保持しており、イオン化中に重大な負電荷と潜在的なリン酸塩損失をもたらします。哺乳類に見られるPP-InsPには、1,5-(PP)2-InsP 4(または1,5-InsP8)、5-PP-InsP 5(または5-InsP 7)、1-PP-InsP 5(または1-InsP7)、および5-PP-Ins(1,3,4,6)P 4(または5-PP-InsP 4)3,14の4つの主要なタイプがあります。PP-InsPの生理学的レベルは、典型的にはナノモルから低マイクロモルの範囲であり、5-PP-InsP 5が最も豊富で、細胞濃度は0.5〜5μMである。 1,5-(PP)2-InsP 4および1-PP-InsP5は、5-PP-InsP5プールの最大約10%であると考えられており、多くの細胞で追跡することは依然として困難である15。遊離OH基を有する5-PP-InsP4は存在量がさらに低く、通常はリン酸加水分解酵素がフッ化ナトリウム(NaF)で阻害された場合にのみ検出可能になります16。
PP-InsPの電荷密度が高いと分離が困難になり、PP-InsP位置異性体の発生によりこれらの作業がさらに複雑になります。その結果、ほとんどの実験は、マトリックスからのバックグラウンドが除外され、高感度が達成されるため、[3H]-イノシトールを使用した細胞の代謝放射性標識による定量に依存していました17,18。しかしながら、この方法は費用と時間がかかり、関連するPP−InsP位置異性体を適切に区別することを可能にしない。さらに、[3H]-イノシトール標識は、グルコースからの内因性イノシトール合成を考慮していません。ポリアクリルアミドゲル電気泳動(PAGE)ベースの方法は、広く適用されている安価な代替品ですが、感度には限界があります19,20,21,22。イオンクロマトグラフィーとそれに続くポストカラム誘導体化UV検出23、親水性相互作用クロマトグラフィー(HILIC)24、または弱陰イオン交換(WAX)と質量分析(MS)25の組み合わせなど、放射性標識を回避する他のアプローチが発表されています。ただし、それらは(まだ)従来の[3H]-イノシトールSAX-HPLCプロトコルと同等ではありません。
最近、キャピラリー電気泳動エレクトロスプレーイオン化質量分析(CE-ESI-MS)が、InsPおよびPP-InsPs代謝の分析のための変革戦略として導入され、上記のすべての要件を満たしました16。CE-ESI-MSは、過塩素酸による現在の最先端のInsP抽出とそれに続く二酸化チタンビーズ26による濃縮と組み合わせることで、酵母から植物や哺乳類まで、これまでにテストされたすべての生物で成功しました。すべての可能な位置異性体を含むInsPとPP-InsPの同時プロファイリングは容易に達成されました。安定同位体標識(SIL)内部標準により、マトリックス効果に関係なく、迅速かつ正確な絶対定量が可能になりました。MSは同位体質量の違いを捉えることができるため、CE-ESI-MSは、細胞に[13C6]-ミオイノシトールまたは[13C6]-D-グルコースを供給するなど、InsPおよびPP-InsPの区画化された細胞合成経路の研究にも適用できます。
CE-ESI-MSによる哺乳類細胞からのPP-InsPおよびInsPの絶対定量のための詳細なステップバイステップのプロトコルをここで説明します。主要な5-PP-InsP 5異性体とは別に、1,5-(PP)2-InsP 4および1-PP-InsP5も、存在量が少ないにもかかわらず、この研究では定量化されています。異なる研究所(NIH、UCL)からの2つのHCT116細胞株が研究されており、HCT116UCL細胞にはHCT116NIHに見られるよりも7倍高いレベルの1,5-(PP)2-InsP 4が含まれていることが検証されていますが、5-PP-InsP5濃度は同等です。加えて、HCT116UCLにおける1-PP-InsP5合成は有意に増加していない。また、フッ化ナトリウムを用いてPP-InsPの脱リン酸化を阻止することによるPP-InsPレベルの増加を定量的に研究しています。
プロトコル
1. CE-ESI-MS システムのセットアップ
- 商用CEシステムと、アジレントジェットストリーム(AJS)エレクトロスプレーイオン化(ESI)ソースを備えたトリプル四重極タンデム質量分析計で構成されるCE-ESI-MSシステムをセットアップします。CE-ESI-MS噴霧器キットとアイソクラティックLC(液体クロマトグラフィー)ポンプが必要です。
- シースフロー1:100スプリッター(CE-MSスプレーキットに含まれています)とアイソクラティックLCポンプ出口を接続します。
- CEシステムの入口バイアルが質量分析装置の噴霧器先端と同じ高さにあることを確認してください。
- MassHunterワークステーション(バージョン10.1)または同等のMSソフトウェアを使用して、システム全体を制御し、データの取得と分析を行います。
2. バッファー、キャピラリー、CE-MSシステムの調製
- CEランニングバッファーの準備:水酸化アンモニウムで40 mM酢酸アンモニウムのpHを9.0に調整します。250mLメスフラスコを推奨します。250 mLのバッファーを0.2 μmの孔径メンブレンフィルターでろ過します。超高純度の脱イオン水とMSグレードの試薬のみを使用してください。
注意: このバッファーは、室温で2〜3週間、または冷蔵庫で数か月間保管できます。 - シース液の調製:100 mLの超純水と100 mLのLC-MSグレードのイソプロパノールを250 mLのボトルに混合します。少なくとも週に一度はシース液を交換してください。高分解能質量分析計を使用する場合は、シース液に質量基準を追加します。
- シース液の取り付け:5 mL /分で5分間パージし、流量を1 mL /分に設定します(CE-MS噴霧器に10 μL /分)。ポンプ圧力は約180バールになります。溶剤を再利用するために、リサイクルチューブがシースリキッドボトルに接続されていることを確認してください。
- キャピラリーの準備:UV検出ウィンドウ付きのCE-MSキャピラリー(内径50 μmおよび外径365 μM、長さ125 cm)を購入します。ユーザーは、専門の販売代理店からはるかに安価なバー溶融シリカキャピラリーを入手することもできます。長さ100 cmの毛細血管を切ります。回転するダイヤモンドブレードを備えたキャピラリーカラムカッターで両方のキャピラリー端を適切に切断し、両端の2〜3 cmのポリイミドコーティングをライターで取り除きます。毛細血管表面をイソプロパノールで洗浄します。
- キャピラリーの取り付け:キャピラリーをCE-MSカセットに合わせます。[カセットの変更]ボタンをクリックして、 カセット をCEデバイスに取り付けます。キャピラリーの入口端は電極より約2mm低い。注入プロセス中は、入口端がサンプルの表面よりも低いことを確認してください。
- キャピラリーの活性化:最初に使用する前に、キャピラリーを1 M NaOHで洗い流し、続いて水を10分間、CEランニングバッファーを15分間流します。
- キャピラリーエンドをCE-MSスプレーに挿入します:キャピラリーをCE-MSスプレーにそっと入れ、キャピラリーエンドがスプレーの先端から約0.1mm突き出ていることを確認します。虫眼鏡と噴霧器の調整ネジを使用して、キャピラリー出口の端を正確に調整してください。噴霧器をイオン源に戻し、調整ネジに触れないようにしてください。この操作を実行すると、MSはスタンバイモードになります。
- ESIスプレーを確認してください:フルスキャンモードでのESIスプレーの安定性を確認します。全イオンエレクトロフェログラムの変動は5%以内でなければなりません。
- InsP標準で試験を実行する:2 μM InsP3-InsP 8標準物質(定量的31P NMR 15,27で調整)の混合物を使用して、50 mbarで10秒間(10 nL)注入する試験運転を行います。詳細なESIおよびMSパラメータを表1に示すように設定します。CE電流は約26μAです。ピーク幅は約0.4〜0.5分です。信号対雑音比が少なくとも400に達していることを確認します。
3. 哺乳類細胞からの可溶性イノシトールリン酸の抽出
注:HCT116NIH 細胞は、Stephen Shears28からの親切な贈り物でした。HCT116UCL 細胞はサイアルディのラボ26からのものでした。
- 細胞の播種
- 10%ウシ胎児血清(FBS)を添加したダルベッコ改変イーグル培地(DMEM)中で、5%高湿度CO2雰囲気(さらに標準状態と呼ぶ)で37°CのT75フラスコでHCT116NIHまたはHCT116UCL細胞を培養する。
- HCT116NIH およびHCT116UCL ストック培養液をリン酸緩衝生理食塩水(PBS)(5 mL)で洗浄し、細胞が完全に剥離するまで標準条件下でトリプシン-エチレンジアミン四酢酸(EDTA)(3 mL、0.25%)で細胞をインキュベートします。培地(7mL)を加えてトリプシン活性をクエンチし、細胞を遠沈管に集め、遠心分離機(200 x g、3分間)した。
- 上清を除去し、細胞を培地(10 mL)に再懸濁します。細胞をカウントし、トリパンブルー排除を介して生存率を決定します。
- 細胞(アッセイあたり600万HCT116細胞)を150 mmディッシュに播種し、合計20 mLの細胞培養培地を調整します。播種前に遠心チューブ内で培地と細胞をプレミックスして、ディッシュ内の細胞を均等に分配します。細胞数による正規化が必要な場合は、平行皿を準備します。
- 細胞を標準条件下で72時間培養する。細胞は約80%〜90%のコンフルエントに達する。
- NaFと細胞採取によるイノシトールリン酸レベルの調節
- NaF処理:培地に収穫する1時間前にNaF(10 mM)を追加します。プレート/ピペッティングを旋回させて培地を混合し、標準条件下で60分間細胞をインキュベートします。
- NaF処理後、細胞から培地を取り出し、細胞を氷上に置きます。
- 細胞をPBS(5 mL、4°C)で2回洗浄し、PBSをディッシュから完全に取り出します。
- 過塩素酸(PA)を加える (1 mL, 1 M, 4 °C).表面全体をPAで覆うようにしてください(タンパク質が沈殿すると細胞が白くなります)。細胞を4°Cのチルトテーブル上で10分間インキュベートします。
- PAを遠沈管に回収し、遠心分離(17,000 x g、5分、4°C)によって汚染破片を除去します。InsPsのプルダウンのために調製したTiO2 ビーズに上清を加える。
- 脱酸のために抽出後の皿をPBS(5 mL、r.t.)で2回洗浄します。皿からPBSを完全に取り除きます。
- 細胞溶解バッファー(1.5 mL、r.t.;0.1 M NaOH中の0.1%ドデシル硫酸ナトリウム[SDS])を添加して、プレート上のタンパク質を可溶化します。r.t.のチルトテーブルで皿を15分間インキュベートします。細胞ライセートを遠沈管と遠心分離機(17,000 x g、5分、4°C)に移します。ウシ血清アルブミンを校正標準として使用するDCタンパク質アッセイでタンパク質濃度が測定されるまで、上清を-80°Cで保存します(通常、1つの150 mmディッシュには約10 mgのタンパク質が含まれています)。
- 平行ディッシュからの細胞数の決定:ステップ3.1.2(150 mmディッシュには5 mLのトリプシン-EDTAを使用)に記載されているように、トリプシンを介して平行ディッシュの細胞を回収し、培地を除去します。細胞ペレットをPBS(5 mL)に再懸濁し、適切に混合して細胞をカウントします。このステップは、収穫直前に直接クエンチングで実行し、代表的な細胞数を取得します。さらに、適切な方法(マルチサイザーマシンなど)で細胞の体積を測定します。
- イノシトールリン酸塩のTiO2 濃縮
注:リン酸化化合物の酸性分解を避けるために、氷上で溶出するまですべての濃縮ステップを実行し、すべての試薬を4°Cに冷却します。 抽出の時間は最小限に抑えてください(1.5〜2時間)。1 M PAですべての抽出ステップを実行します。- ビーズの調製:TiO 2ビーズ(サンプルあたり5 mg)をddH2O(1 mL)および遠心分離機(3,500 x g、1分、4°C)で洗浄します。ddH2Oを除去し、ビーズをPA(1 mL)で洗浄します。遠心分離(3,500 x g、1分、4°C)によりPAを除去します。ビーズをPA(サンプルあたり50 μL)に再懸濁します。
- リン酸化化合物を含む上清をビーズ懸濁液に加え(比較セクション3.2、ステップ3.2.5)、ボルテックス、次いでサンプルを4°Cで20分間回転させる。
- サンプルを遠心分離し(3,500 x g、1分、4°C)、上清を廃棄します。ビーズをPA(500 μL)および遠心分離機(3,500 x g、1分、4°C)で洗浄します。上清を捨て、洗浄ステップを繰り返します。
- NH4OH (200 μL, 3%) をビーズに加え、再懸濁します。r.t.でサンプルを5分間回転させます。
- サンプルを遠心分離し(3,500 x g、1分)、上清を新しい遠沈管に移します。
- 溶出ステップ3.3.4と3.3.5を繰り返し、溶離液を結合します。ビーズを捨てます。
- 合わせた溶離液(17,000 x g、1分、4°C)を遠心分離して、不溶性残留物を除去します。
- 上清を真空蒸発下(70分、60°C、V-AQ)で完全に乾燥させます。InsPを含む乾燥抽出物にddH2O(50μL)を加える。完全に溶解するまで試料を混合するボルテックス。CE-ESI-MS分析までサンプルを-20°Cで保存します。
4. CE-ESI-MS の実行
- 40 μM [13 C 6]1,5-(PP)2-InsP 4、80 μM [13 C 6]5-PP-InsP 5、80 μM [13 C 6]1-PP-InsP 5、400 μM [13 C6]InsP 6および400 μM [13C 6]Ins(1,3,4,5,6)P 5を含む内部標準物質を調製します。SIL IS溶液の濃度は、認定された参照標準物質(ホスホ酢酸)を使用して、定量的な31Pおよび1H NMRによって決定します。
注:純度が96%を超える上記のSIL内部標準(IS)はすべて、フィードラーグループ15,27によって合成および提供されました。ヌクレオチドと同じように、これらのISは多くの結晶水分子と多様な対イオンを運ぶことができます。物質を計量して濃度を計算する代わりに、定量的31P NMRによる13C6標準溶液の濃度決定が推奨されます。 - CEサンプルバイアルで10 μLのサンプルと0.5 μLの内部標準混合物を混合します。2 μM [13 C 6]1,5-(PP)2-InsP 4、4 μM [13 C 6]5-PP-InsP 5、4 μM [13 C 6]1-PP-InsP 5、20 μM [13C6]InsP 6、および20 μM [13C 6]Ins(1,3,4,5,6)P 5は、サンプル内の最終濃度です。
- 補充システムを使用する場合は、[ボトルの変更]ボタンをクリックし、準備した250 mLのCEランニングバッファーを電解質 ボトル に入れて、[ クリーンチューブ]をクリックします。補充針を水バイアルに入れてください。
- 表1に示すようにESIおよびMSパラメータを設定します。イノシトールポリリン酸標準の混合物を含むソースオプティマイザーを使用して、ソースパラメータを最適化します。すべての標準でマスハンターオプティマイザーを使用して、多重反応モニタリング(MRM)設定を取得します。さまざまな計測器のESIおよびMS/MS設定を調整します。
- InsP 抽出を実行し、結果を確認します (図 2)。サンプル数が多い場合は、シーケンスを設定します。
- 測定後、MSをスタンバイモードにします。LCポンプをオフにしないでください。シース液の流れが噴霧器の針を保護します。シース液が供給されていない場合は、CE-ESI-MS噴霧器をLC-ESI-MS噴霧器と交換してください。
5.データ分析
- 定量分析(QQQ用)ソフトウェアを開き、すべてのサンプルのバッチを作成します。
- 取得したMRMデータから新規メソッドを作成します。[13C6]InsPを内部標準として設定します-(ISTD)。MRM コンパウンドのセットアップ、保持時間のセットアップ、ISTD のセットアップ、濃度のセットアップ、および修飾子のセットアップを確認してください。検証に合格して終了し、メソッドを現在のバッチに適用します。メソッドを保存します。
- バッチ内の各ピークが適切に積分されているかどうかを確認します。それ以外の場合は、ピークを手動で積分します。
- 結果をスプレッドシートにエクスポートします。分析種のピーク応答を既知の濃度のSIL ISのそれぞれのピーク応答と比較することにより、イノシトール(ピロ)リン酸塩の定量を実行します。線形範囲の5-PP-InsP 5、InsP 6、およびIns(1,3,4,5,6)P5の理論的および実験的検量線を表2に示します。
注:理論的な検量線を適用する前提条件は、標的分析物の高品質の同位体パターンを使用し、信頼できる濃度を使用することです。線形範囲を評価します。検量線は、上記の同位体標準物質の完全な取得が実用的でない場合の絶対定量に不可欠です。 - InsP抽出液中の測定濃度とその体積を用いて、絶対量を算出する。また、細胞数やタンパク質量により量を正規化する。HCT116(1.68 fL)の細胞数と平均細胞体積に基づいて細胞濃度を計算します。
結果
ここに示す結果は、CE-ESI-MS分析の可能性を説明することを目的としています。報告された数値は、技術的に完璧なCE-ESI-MSの実行を説明しています。まず、イノシトールピロリン酸標準物質(図1)と哺乳類細胞抽出物(図2)の混合物を提示します。次に、2つのHCT116細胞株(図3)とNaF処理HCT116(図4)細胞の比較を提供します。
2 μMの濃度で抽出されたイノシトール(ピロ)リン酸標準物質のイオンエレクトロフェログラム(EIE)を図1に示します。単純化された構造を有する哺乳動物におけるイノシトールピロリン酸の代謝が挿入される。哺乳動物における4つのイノシトールピロリン酸、1,5−(PP)2−InsP4、5−PP−InsP5、1−PP−InsP5、および5−PP−Ins(1,3,4,6)P4は、記載された方法を用いて十分に区別される。HCT116UCLのCE-ESI-MS実行を図2に示します。安定同位体標識(SIL)内部標準物質の助けを借りて、シグナル応答を既知の濃度のスパイクインSILと比較することにより、絶対定量を容易に達成できます。InsP5から(PP)2-InsP4までのイノシトールリン酸の集積EIEと、それらの同位体パターンの非集積EIEが表示されます。6回のテクニカルリピートによるすべての分析種のRSDは4%以内です。測定された濃度と抽出物の量を使用して、分析対象物の量を計算できます。細胞数と細胞体積、またはタンパク質含有量では、絶対細胞濃度(μM)またはタンパク質含有量(pmol/mgタンパク質)で正規化された量が、通常、このような分析の最終結果です。
以前の研究によれば、分岐したHCT116細胞の2つのバッチはInsP8レベルの変動を有し、HCT116UCL細胞はHCT116NIH細胞よりも6倍高いレベルのInsP8を含む29。CE-MS法では、HCT116NIH中の1,5-(PP)2-InsP 4を簡単に定量することができ(図3)、HCT116UCL細胞にはHCT116NIHよりも7倍高いレベルのInsP8が含まれています。さらに、HCT116UCL細胞における1,5-(PP)2-InsP 4の有意な蓄積は、有意に増加した1-PP-InsP5と並行しており、これは現在定量的に図3に示されている。
PP-InsPsレベルは、フッ化ナトリウムを使用して脱リン酸化を阻害することによって増加します。NaF処理HCT116NIH細胞のCE-ESI-MS分析では、InsP 6の減少および5-PP-Ins(1,3,4,6)P 4の出現とともに、-5-PP-InsP5の上昇が示されました(図4)。 その上、InsP8レベルの上昇は顕著ですが、1-PP-InsP5はある程度減少します。1-PP-InsP5は、NaF処理HCT116NIHには完全に存在しないわけではありませんが、ほとんどの場合、検出または定量の限界下にあります。
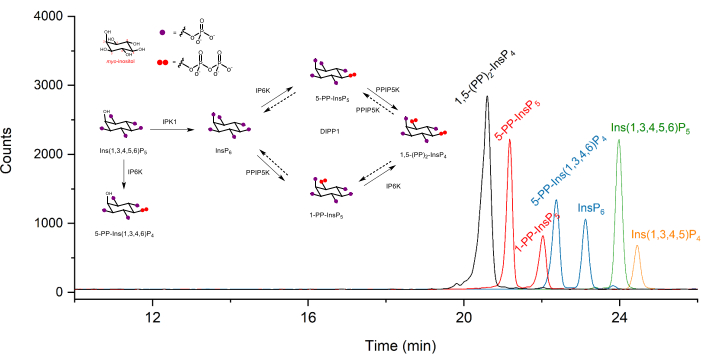
図1:記載されたプロトコルを使用したCE-ESI-MS分析におけるイノシトール(ピロ)リン酸標準の典型的な抽出イオンエレクトロフェログラム(EIE)。 各分析物の濃度は2 μMで、注入されたサンプル量は約10 nLで、50 mbarで10秒間注入します。インサートは、哺乳類におけるイノシトールピロリン酸の代謝を示す。IPPK:イノシトールペンタキスリン酸2-キナーゼ、IP6K:イノシトールヘキサキスリン酸キナーゼ、PPIP5K:ジホスホイノシトールペンタキスリン酸キナーゼ、DIPP1:ジホスホイノシトールポリリン酸ホスホヒドロラーゼ1。 この図の拡大版を表示するには、ここをクリックしてください。
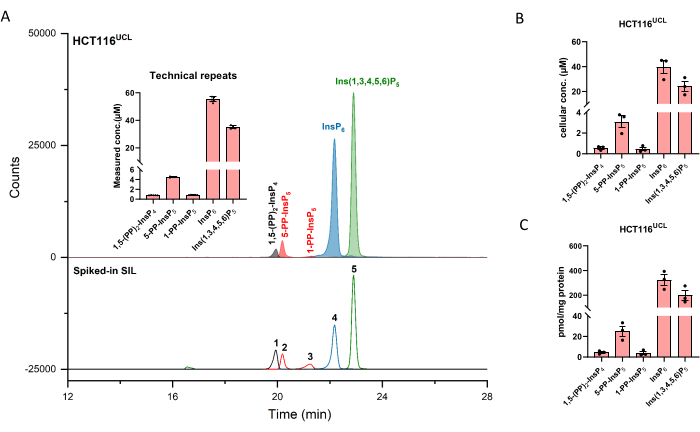
図2:HCT116UCL細胞の代表的なInsPプロファイル。 (A)HCT116NIHおよびスパイクSIL ISにおける主要なイノシトール(ピロ)リン酸塩のEIE 2 μM [13 C 6]1,5-(PP)2-InsP 4 (1), 4 μM [13 C 6]5-PP-InsP5 (2), 4 μM [13 C 6]1-PP-InsP5 (3), 20 μM [13C 6]InsP 6 (4), および20 μM [13C 6]Ins(1,3,4,5,6)P 5(5)。挿入物は、CE-ESI-MSによるInsP分析の6つの技術的反復を示し、データはSD±手段として提示されている。 (B)ヒト細胞株HCT116UCLにおけるPP-InsPおよびInsPの細胞濃度、および(C)タンパク質含有量で正規化されたPP-InsPおよびInsPs量。データは、3つの独立した実験からのSEM±手段である。この図の拡大版を表示するには、ここをクリックしてください。
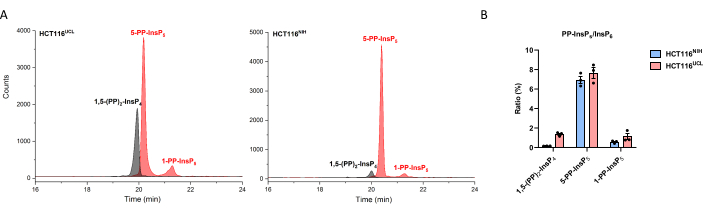
図3:分岐した2つのHCT116細胞間の InsP8レベルの変動。(ア)HCT116 UCLおよびHCT116NIHにおけるイノシトールピロリン酸のEIE。HCT116UCLのInsP8は、HCT116NIHよりも著しく豊富です。(b)両方のHCT116細胞におけるInsP6に対するピロリン酸イノシトールの比率(%)。HCT116UCL細胞は、HCT116NIHと比較して7倍高いレベルのInsP8を含んでいますが、5-PP-InsP5レベルは同等です。データは、3つの独立した実験からのSEM±手段である。この図の拡大版を表示するには、ここをクリックしてください。
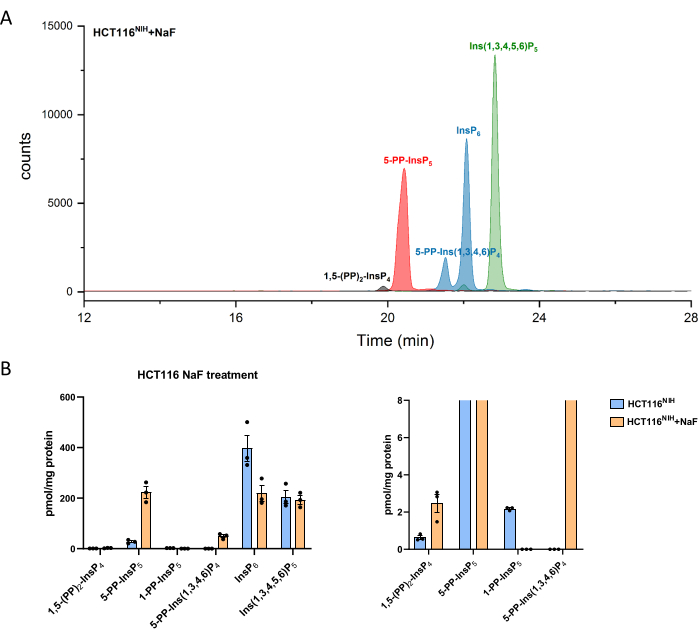
図4:NaF処理によるHCT116NIH 細胞におけるイノシトール(ピロ)リン酸レベル。 (A)フッ化ナトリウム処理(NaF、10 mM)を用いたHCT116NIH 中のイノシトール(ピロ)リン酸のEIE。1,5-(PP)2-InsP 4、5-PP-InsP 5、および5-PP-Ins(1,3,4,6)P4 を含むイノシトールピロリン酸のレベルは、NaFを使用して脱リン酸化をブロックすることによって増加します。(B)未処理およびNaF処理HCT116NIH 細胞におけるイノシトール(ピロ)リン酸レベル(量はタンパク質含有量によって正規化される)。データは、3つの独立した実験からのSEM±手段である。 この図の拡大版を表示するには、ここをクリックしてください。
表 1: CE-ESI-MS パラメータ設定。 ソースパラメータとiFunnelパラメータは、ソースとiFunnelオプティマイザーによって最適化されます。イノシトール(ピロ)リン酸塩のMSMパラメータ設定は、MassHunterオプティマイザによって最適化されています。 この表をダウンロードするには、ここをクリックしてください。
表2:理論的および実験的回帰式。 [13C 6]5-PP-InsP 5 [13 C 6]InsP 6および[13C 6]Ins (1, 3, 4, 5,6)P5の濃度は、それぞれ4 μM、20 μM、および20 μMです。回帰式の場合、5-PP-InsP5濃度は0.04 μM、0.1 μM、0.2 μM、0.4 μM、1 μM、2 μM、4 μM、8 μM、16 μM、24 μMです。 40 μM, 80 μM, 120 μM. x は濃度、y は (面積 InsP)12C/(面積 InsP)13C です。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ここで紹介するのは、哺乳類細胞中の高荷電イノシトールピロリン酸を定量するための実用的で高感度な方法です。この分析アプローチと、過塩素酸による現在の最先端のInsP抽出とそれに続くTiO2による濃縮を組み合わせることで、CE-ESI-MS分析には前例のない利点があります。スループット、感度、安定性、絶対定量、異性体同定、およびマトリックス依存性に関して、この方法は他のアプローチと比較して際立っています。このプロトコルは哺乳類細胞に適用できますが、実際、この戦略は多くの異なるサンプル(酵母、植物、寄生虫、マウス組織など)で成功しています。
適用された抽出プロトコルは、哺乳類細胞抽出物からPP-InsPおよびInsP6を完全に回収する16,19。また、他の多くの陰イオン代謝物、特にリン酸含有種、例えば糖リン酸およびヌクレオチドを抽出する。このプロトコルを使用したユーザーの分析種の回収と分解の評価が必要になります。
一般に、CE-ESI-MSシステムはスムーズに動作し、このプロトコルを使用して毎週約200サンプルに対応できます。しかし、HPLCとは異なり、CEは長い間専門家や専門家のための方法と見なされており、市場を制限し、アプリケーションを制限してきました。したがって、CE-ESI-MSデバイスは通常、分析学部には存在しません。CE-ESI-MS分析を実行したい人は、おそらくCEの経験が不足しており、トラブルシューティングにより多くの時間を費やすでしょう。ここでは、重要なステップが強調表示されています。何よりもまず、キャピラリーカットの品質です。ESIスプレーの感度と安定性は、主に一流のキャピラリーカットに依存しています。第二に、毛細管出口端は噴霧器先端から正確に0.1 mm離れている必要があります。噴霧器の針とCE毛細管は軸方向にある必要があります。ESIスプレーの品質は定量にとって重要です。再現性を評価するために技術的な実行を実行する必要があります。
記載されたプロトコルでは、PP-InsPの定量限界(LOQ)は、50mbarで10秒間(10nL)注入した場合で40nMです。メソッド感度をさらに高めるには、いくつかのアプローチがあります。まず、100 mbarで20秒(40 nL)の注入でも、位置異性体5-PP-InsP 5および1-PP-InsP5に対して良好なピーク形状と十分な分解能が得られます。第二に、InsP抽出物は少量の水に溶解することができる。第三に、定量に使用するMRM遷移が少ない場合、滞留時間が長くなる可能性があります。さらに、超低シース液流を使用するCE-MSイオン源は、感度を大幅に向上させます。
pH 9のCEランニングバッファーは、InsP6-InsP 8の間で最高の分解能を提供します。pHを9.7に上げると、InsP3-InsP 6 間の分解能が大幅に向上します。優れた分解能のため、スループットをさらに向上させるために、キャピラリー長を72cm短くすることをお勧めします。さらに、40°CでCEカセット温度が高くなると、水性電気泳動バッファーの粘度が低下し、EOF下での移動が加速します。さまざまな研究要求に応じて、この方法を変更すると、InsPおよびPP-InsPの分析がさらに容易になります。したがって、記載されたCE-ESI-MSプロトコルは、この多面的なシグナル伝達分子ファミリーへの新しい研究の道を開く可能性を秘めています。
開示事項
著者は競合する利益を宣言しません。
謝辞
このプロジェクトは、欧州連合のホライズン2020研究およびイノベーションプログラム(HJJへの助成金契約番号864246)の下で欧州研究会議(ERC)から資金提供を受けています。DQは、ブリジッテ・シュリーベン・ランゲ・プログラムからの財政的支援を認めています。AS は、MRC プログラム助成金 MR/T028904/1 によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 1.5 mL microcentrifuge tubes | Greiner Bio-One | 616201 | - |
| 15 cm tissue culture dishes | Thermo Fisher | 168381 | - |
| 2.0 mL microcentrifuge tubes | Greiner Bio-One | 623201 | - |
| 50 mL centrifuge tubes | Greiner Bio-One | 227261 | - |
| 96-well plates | Thermo Fisher | 260836 | for the DC protein assay |
| CE fused silica capillary | CS Chromatographie | 105180 | 50 µM i.d. 360 µM o.d. |
| Pipette tips | Starlab | I1054-0001, S1111-6701, S1113-1700, S1111-3700 | 10 mL, 1000 µL, 200 µL, 10 µL pipette tips |
| Serological pipets | TPP | 94550, 94525, 94010, 94005 | 50 mL, 25, mL, 10 mL, 5 mL serological pipettes |
| T75 flasks | TPP | 90076 | - |
| Chemicals and Reagents | |||
| NaOH | AppliChem | A6829,0500 | sodium hydroxide pellets for molecular biology, for preparation of cell lysis buffer |
| 0.25% trypsin-EDTA | Gibco | 25200056 | - |
| Ammonium acetate | Thermo Fisher | 1677373 | HPLC grade |
| BSA | Thermo Fisher | 23209 | albumin standard (2.0 mg/mL) for standard curve preparation |
| DC protein assay | Biorad | 5000116 | DC protein assay reagents package |
| DMEM | Gibco | 41966029 | high glucose, pyruvate |
| FBS | Gibco | 10270106, 10500064 (heat inactivated) | 10270106 for HCT116UCL, 10500064 for HCT116NIH |
| Isopropanol | Carl Roth | AE73.2 | 99.95% LC-MS grade |
| NH4OH, 10% | Carl Roth | 6756.1 | for preparation of 3% NH4OH |
| PBS | Gibco | 10010015 | - |
| Perchloric acid, 70% | Carl Roth | 9216.1 | for preparation of 1 M perchloric acid |
| SDS | SERVA | 20760.02 | for preparation of cell lysis buffer |
| Sodium fluoride | Sigma Aldrich | S7920 | - |
| TiO2 beads | GL Sciences | 5020-75000 | 5 µm particle size |
| Trypan blue solution | Gibco | 15250061 | trypan blue stain (0.4%) |
| Ultrapure (Type 1) water | Milli-Q | ZRQSVP3WW | model: Direct-Q 3 UV Water Purification System |
| Equipment | |||
| Analytical balance | Mettler Toledo | 30105893 | model: XPE26; for weighing of beads (5-6 mg per sample) |
| Automated cell counter | Logos Biosystems | L40002 | model: LUNA-II Automated Cell Counter |
| Benchtop centrifuge | Hettich | 1401 | model: UNIVERSAL 320 |
| Benchtop centrifuge with cooling | VWR | 521-1647P | model: Microstar 17R |
| CE system | Agilent | G7100A | - |
| CE/MS Adapter Kit | Agilent | G1603A | - |
| CE/MS Sprayer Kit | Agilent | G1607A | - |
| Cell counting slides | Logos Biosystems | L12001 | LUNA Cell Counting Slides |
| Centrifugal evaporator | Eppendorf | 5305000304 | model: Concentrator plus complete system |
| ESI source | Agilent | AJS ESI | - |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Humidified incubator | Binder | 9040-0088 | model: CB E6.1, for cultivation of mammalian cells |
| Ice box | - | - | should provide enough space for samples, dishes, etc. |
| Isocratic LC system | Agilent | G7110B 1260 Iso Pump | model: Infinity II Quaternary system |
| MSD | Agilent | G6495C | triple quadrupole |
| Multiplate reader | Tecan | 30086375 | model: SPARK 10 M |
| Pipette filler | Thermo Fisher | 10072332 | for serological pipettes |
| Pipettes | Brand | 705884, 705880, 705878, 705872, 705870 | various pipettes |
| Rotator | Labnet | H5500 | model: Mini LabRoller Rotator |
| Shortix capillary column cutter | SGT | S0020 | - |
| Test tube shaker (vortex mixer) | Carl Roth | HXH6.1 | model: Rotilabo-Mini Vortex |
| Tilt table | Labnet | S0600 | model: EDURO MiniMix Nutating Mixer |
| Water bath | Thermo Fisher | FSGPD05 | model: Isotemp GPD 05 |
| Software | |||
| MassHunter Workstation | Agilent | Version 10.1 | - |
| MassHunter Workstation LC/MS Data Acquisition | Agilent | Version 10.1 | - |
| MassHunter Workstation Optimizer | Agilent | Version 10.1 | - |
| MassHunter Workstation Qualitative Analysis | Agilent | Version 10.0 | - |
| QQQ Quantitaion Analysis | Agilent | Version 10.1 | - |
参考文献
- Stephens, L., et al. The detection, purification, structural characterization, and metabolism of diphosphoinositol pentakisphosphate(s) and bisdiphosphoinositol tetrakisphosphate(s). The Journal of Biological Chemistry. 268 (6), 4009-4015 (1993).
- Menniti, F. S., Miller, R. N., Putney, J. W., Shears, S. B. Turnover of inositol polyphosphate pyrophosphates in pancreatoma cells. The Journal of Biological Chemistry. 268 (6), 3850-3856 (1993).
- Shears, S. B. Inositol pyrophosphates: Why so many phosphates. Advances in Biological Regulation. 57, 203-216 (2015).
- Irvine, R. F., Schell, M. J. Back in the water: the return of the inositol phosphates. Nature Reviews Molecular Cell Biology. 2 (5), 327-338 (2001).
- Szijgyarto, Z., Garedew, A., Azevedo, C., Saiardi, A. Influence of inositol pyrophosphates on cellular energy dynamics. Science. 334 (6057), 802-805 (2011).
- Wild, R., et al. Control of eukaryotic phosphate homeostasis by inositol polyphosphate sensor domains. Science. 352 (6288), 986-990 (2016).
- Chakraborty, A., et al. Inositol pyrophosphates inhibit Akt signaling, thereby regulating insulin sensitivity and weight gain. Cell. 143 (6), 897-910 (2010).
- Bittner, T., et al. Photolysis of caged inositol pyrophosphate InsP8 directly modulates intracellular Ca2+ oscillations and controls C2AB domain localization. Journal of the American Chemical Society. 142 (24), (2020).
- Hauke, S., et al. Photolysis of cell-permeant caged inositol pyrophosphates controls oscillations of cytosolic calcium in a β-cell line. Chemical Science. 10 (9), 2687-2692 (2019).
- Saiardi, A., Sciambi, C., McCaffery, J. M., Wendland, B., Snyder, S. H. Inositol pyrophosphates regulate endocytic trafficking. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14206-14211 (2002).
- Koldobskiy, M. A., et al. p53-mediated apoptosis requires inositol hexakisphosphate kinase-2. Proceedings of the National Academy of Sciences of the United States of America. 107 (49), 20947 (2010).
- Rao, F., et al. Inositol hexakisphosphate kinase-1 mediates assembly/disassembly of the CRL4-signalosome complex to regulate DNA repair and cell death. Proceedings of the National Academy of Sciences. 111 (45), 16005 (2014).
- Williams, S. P., Gillaspy, G. E., Perera, I. Y. Biosynthesis and possible functions of inositol pyrophosphates in plants. Frontiers in Plant Science. 6, 67 (2015).
- Wilson, M. S. C., Livermore, T. M., Saiardi, A. Inositol pyrophosphates: between signalling and metabolism. The Biochemical Journal. 452 (3), 369-379 (2013).
- Harmel, R. K., et al. Harnessing 13C-labeled myo-inositol to interrogate inositol phosphate messengers by NMR. Chemical Science. 10 (20), 5267-5274 (2019).
- Qiu, D., et al. Analysis of inositol phosphate metabolism by capillary electrophoresis electrospray ionization mass spectrometry. Nature Communications. 11 (1), 6035 (2020).
- Azevedo, C., Saiardi, A. Extraction and analysis of soluble inositol polyphosphates from yeast. Nature Protocols. 1 (5), 2416-2422 (2006).
- Wilson, M. S. C., Saiardi, A. Importance of radioactive labelling to elucidate inositol polyphosphate signalling. Phosphate Labeling and Sensing in Chemical Biology. , 67-87 (2017).
- Wilson, M. S. C., Bulley, S. J., Pisani, F., Irvine, R. F., Saiardi, A. A novel method for the purification of inositol phosphates from biological samples reveals that no phytate is present in human plasma or urine. Open Biology. 5 (3), 150014 (2015).
- Losito, O., Szijgyarto, Z., Resnick, A. C., Saiardi, A. Inositol pyrophosphates and their unique metabolic complexity: analysis by gel electrophoresis. PloS One. 4 (5), 5580 (2009).
- Dong, J., et al. Inositol pyrophosphate InsP8 acts as an intracellular phosphate signal in arabidopsis. Molecular Plant. 12 (11), 1463-1473 (2019).
- Riemer, E., et al. ITPK1 is an InsP6/ADP phosphotransferase that controls systemic phosphate homeostasis in Arabidopsis. bioRxiv. , (2020).
- Whitfield, H., et al. An ATP-responsive metabolic cassette comprised of inositol tris/tetrakisphosphate kinase 1 (ITPK1) and inositol pentakisphosphate 2-kinase (IPK1) buffers diphosphosphoinositol phosphate levels. The Biochemical Journal. 477 (14), 2621-2638 (2020).
- Ito, M., et al. Hydrophilic interaction liquid chromatography-tandem mass spectrometry for the quantitative analysis of mammalian-derived inositol poly/pyrophosphates. Journal of chromatography. A. 1573, 87-97 (2018).
- Mantilla, B. S., Amaral, L. D. D., Jessen, H. J., Docampo, R. the inositol pyrophosphate biosynthetic pathway of Trypanosoma cruzi. ACS Chemical Biology. 16 (2), 283-292 (2021).
- Wilson, M. S. C., Saiardi, A. Inositol phosphates purification using titanium dioxide beads. Bio-Protocol. 8 (15), 2959 (2018).
- Puschmann, R., Harmel, R. K., Fiedler, D. Scalable chemoenzymatic synthesis of inositol pyrophosphates. Biochemistry. 58 (38), 3927-3932 (2019).
- Gu, C., et al. KO of 5-InsP7 kinase activity transforms the HCT116 colon cancer cell line into a hypermetabolic, growth-inhibited phenotype. Proceedings of the National Academy of Sciences of the United States of America. 114 (45), 11968-11973 (2017).
- Gu, C., Wilson, M. S. C., Jessen, H. J., Saiardi, A., Shears, S. B. Inositol Pyrophosphate Profiling of Two HCT116 Cell Lines Uncovers Variation in InsP8 Levels. PloS One. 11 (10), 0165286 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved