Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mejorar la reproducibilidad para cumplir con la información mínima para estudios de vesículas extracelulares 2018 Directrices en el análisis de seguimiento de nanopartículas
En este artículo
Resumen
El análisis de seguimiento de nanopartículas (NTA) es un método ampliamente utilizado para caracterizar vesículas extracelulares. Este artículo destaca los parámetros y controles experimentales de NTA, además de un método uniforme de análisis y caracterización de muestras y diluyentes necesarios para complementar las pautas propuestas por MISEV2018 y EV-TRACK para la reproducibilidad entre laboratorios.
Resumen
El análisis de seguimiento de nanopartículas (NTA) ha sido uno de los varios métodos de caracterización utilizados para la investigación de vesículas extracelulares (EV) desde 2006. Muchos consideran que los instrumentos NTA y sus paquetes de software se pueden utilizar fácilmente después de una capacitación mínima y que la calibración del tamaño es factible internamente. Como tanto la adquisición de NTA como el análisis de software constituyen la caracterización de EV, se abordan en Información mínima para estudios de vesículas extracelulares 2018 (MISEV2018). Además, han sido monitoreados por Transparent Reporting y Centralizing Knowledge in Extracellular Vesicle Research (EV-TRACK) para mejorar la robustez de los experimentos ev (por ejemplo, minimizar la variación experimental debido a factores no controlados).
A pesar de los esfuerzos para fomentar el informe de métodos y controles, muchos trabajos de investigación publicados no informan los entornos críticos necesarios para reproducir las observaciones originales de NTA. Pocos artículos informan de la caracterización NTA de controles o diluyentes negativos, asumiendo evidentemente que los productos disponibles comercialmente, como la solución salina tamponada con fosfato o el agua destilada ultrapura, están libres de partículas. Del mismo modo, los controles positivos o los estándares de tamaño rara vez son reportados por los investigadores para verificar el tamaño de las partículas. La ecuación de Stokes-Einstein incorpora variables de viscosidad y temperatura de la muestra para determinar el desplazamiento de partículas. Informar de la temperatura estable de la cámara láser durante toda la recolección de video de muestra es, por lo tanto, una medida de control esencial para una replicación precisa. La filtración de muestras o diluyentes tampoco se informa rutinariamente, y si es así, rara vez se incluyen los detalles del filtro (fabricante, material de membrana, tamaño de poro) y las condiciones de almacenamiento. Los estándares mínimos de detalle experimental aceptable de la Sociedad Internacional de Vesículas Extracelulares (ISEV) deben incluir un protocolo NTA bien documentado para la caracterización de EV. El siguiente experimento proporciona evidencia de que el investigador individual debe establecer un protocolo de análisis NTA e incluirlo en los métodos de publicaciones que utilizan la caracterización NTA como una de las opciones para cumplir con los requisitos MISEV2018 para la caracterización de una sola vesícula.
Introducción
El análisis preciso y repetible de vehículos eléctricos y otras partículas a escala nanométrica presenta numerosos desafíos en toda la investigación y la industria. La replicación de la investigación ev ha sido difícil, en parte, debido a la falta de uniformidad en el informe de los parámetros necesarios asociados con la recopilación de datos. Para abordar estas deficiencias, el ISEV propuso pautas de la industria como un conjunto mínimo de estándares bioquímicos, biofísicos y funcionales para los investigadores de vehículos eléctricos y los publicó como una declaración de posición, comúnmente conocida como MISEV20141. El ritmo acelerado de la investigación de vehículos eléctricos requirió una guía actualizada, y la "MISEV2018: una declaración de posición del ISEV" amplió las directrices MISEV20142. El documento MISEV2018 incluyó tablas, esquemas de protocolos sugeridos y pasos a seguir para documentar la caracterización específica asociada a EV. Como medida adicional para facilitar la interpretación y replicación de los experimentos, EV-TRACK se desarrolló como una base de conocimientos de crowdsourcing (http://evtrack.org) para permitir informes más transparentes de la biología de ev y la metodología utilizada para los resultados publicados3. A pesar de estas recomendaciones para la presentación de informes estandarizados de métodos, el campo continúa sufriendo con respecto a la replicación y confirmación de los resultados publicados.
Encajando con el esfuerzo de los Institutos Nacionales de Salud y la Fundación Nacional de Ciencias por las herramientas de evaluación de la calidad, este documento sugiere que ISEV requiere informes estandarizados de métodos y detalles para que las herramientas de evaluación de datos puedan aplicarse con el objetivo de replicar los resultados entre laboratorios. El informe de las fuentes celulares, los procedimientos de cultivo celular y los métodos de aislamiento de EV son factores importantes para definir las cualidades de la población de EV. Entre los instrumentos de NTA, factores como la configuración de detección, el índice de refracción del fluido portador, las poblaciones de partículas heterogéneas que contribuyen a la polidispersidad, la falta de requisitos de informes estandarizados y la ausencia de resultados de medición intra e interobservadores hacen que la comparación de NTA entre laboratorios sea difícil o imposible.
En uso desde 2006, NTA es un método popular para la determinación del tamaño y la concentración de nanopartículas que actualmente es utilizado por aproximadamente el 80% de los investigadores de EV4. Las Directrices MISEV2018 requieren dos formas de análisis de una sola vesícula, de las cuales NTA es una de las opciones populares. NTA sigue siendo de uso común para la caracterización de EV debido a su amplia accesibilidad, bajo costo por muestra y su teoría fundacional directa (la ecuación de Stokes-Einstein). La evaluación de EV por NTA genera una distribución del tamaño de partícula y una estimación de concentración utilizando la dispersión de luz láser y el análisis de movimiento browniano, con el límite inferior de detección determinado por el índice de refracción del EV. Cuando se utiliza una muestra de fluido de viscosidad y temperatura conocidas, se rastrean las trayectorias de los evs para determinar su desplazamiento cuadrático medio en dos dimensiones. Esto permite calcular el coeficiente de difusión de partículas y convertirlo en un diámetro hidrodinámico equivalente a una esfera mediante una ecuación de Stokes-Einstein modificada 5,6,7. El análisis de partícula a partícula de NTA tiene menos interferencia por aglomerados o partículas más grandes en una población heterogénea de EV que otros métodos de caracterización7. Mientras que unas pocas partículas más grandes tienen un impacto mínimo en la precisión del tamaño, la presencia de cantidades incluso diminutas de partículas grandes y de alta dispersión de la luz da como resultado una reducción notable en la detección de partículas más pequeñas debido a la reducción de la detección y el seguimiento de EVpor software 8. Como técnica de medición, generalmente se considera que el NTA no está sesgado hacia partículas más grandes o agregados de partículas, pero puede resolver poblaciones de múltiples tamaños a través del análisis de partículas individuales9. Debido al uso de la dispersión de la luz por partículas, una de las limitaciones del análisis NTA es que cualquier partícula como polvo, plástico o polvo con atributos de refracción y tamaño similares en comparación con los EV no se puede diferenciar de los EV reales por este método de caracterización.
El NanoSight LM10 (analizador de tamaño de nanopartículas) y LM14 (módulo láser) se han vendido desde 2006, y aunque se han desarrollado modelos más nuevos de este instrumento, este modelo en particular se encuentra en muchas instalaciones centrales y se considera un caballo de batalla confiable. Se necesita capacitación para optimizar adecuadamente la configuración de NTA para mediciones de alta resolución de tamaño y concentración. Los dos ajustes importantes necesarios para una grabación de vídeo óptima son (1) el nivel de la cámara y (2) el umbral de detección. Estos deben ser establecidos por el operador en función de las características de la muestra. Una de las principales limitaciones del análisis NTA es la recomendación de concentraciones de muestra entre 107 y 109 partículas/ml, para lograr esta dilución de la muestra puede ser necesaria10. Las soluciones utilizadas para la dilución, como la solución salina tamponada con fosfato, la solución salina de 0,15 M o el agua ultrapura, rara vez están libres de partículas de menos de 220 μm de tamaño, lo que puede afectar las mediciones de NTA. La caracterización NTA de las soluciones utilizadas para la dilución debe realizarse al mismo nivel de cámara y umbral de detección que las muestras de nanopartículas que se están analizando. El tamaño y la concentración de nanopartículas presentes en los diluyentes utilizados para las diluciones de muestras de EV rara vez se incluyen en publicaciones que involucran el análisis NTA de EV.
Este protocolo utiliza el análisis NTA de liposomas sintéticos similares a EV evaluados utilizando niveles de cámara seleccionados, umbrales de detección y filtrado mecánico de las muestras para analizar los efectos sistemáticos del nivel de la cámara, el umbral de detección o la filtración de muestras en el conjunto de datos NTA. Los liposomas se sintetizaron como se describe en el Archivo Suplementario S1. Los liposomas sintéticos se utilizaron en este experimento debido a su uniformidad de tamaño, características físicas y estabilidad en el almacenamiento a 4 ° C. Aunque se podrían haber utilizado muestras reales de EV, la heterogenicidad y estabilidad de los EV durante el almacenamiento pueden haber complicado este estudio y su interpretación. Las similitudes en los informes de NTA de (A) liposomas y (B) EV indican que los efectos sistemáticos revelados para los liposomas en este documento probablemente también se aplicarán a la caracterización de EV (Figura 1). Juntos, estos hallazgos respaldan la noción de que el informe completo de la configuración crítica del software y la descripción del procesamiento de muestras, como el diluyente, la dilución y la filtración, afectan la reproducibilidad de los datos de NTA.
El propósito de este trabajo es demostrar que la variación de los ajustes de NTA (temperatura, nivel de cámara y umbral de detección) y la preparación de la muestra cambia los resultados recogidos: se obtuvieron diferencias sistemáticas y significativas en tamaño y concentración. Como NTA es una de las opciones populares para cumplir con la especificación de caracterización MISEV2018, estos resultados demuestran la importancia de informar la preparación de muestras y la configuración de NTA para garantizar la reproducibilidad.
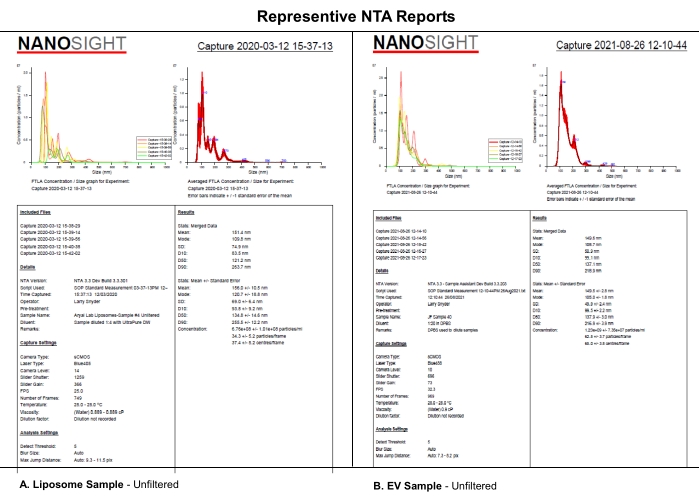
Figura 1: Informes representativos de NTA para comparar liposomas con EV. (A) Liposomas: muestra sin filtrar caracterizada en NTA el 12 de marzo de 2020. (B) EV: muestra sin filtrar caracterizada en NTA el 26 de agosto de 2021. Abreviaturas: NTA = Análisis de seguimiento de nanopartículas; EV = vesículas extracelulares. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Directrices generales del protocolo
- Mantenga el microscopio en una mesa de aire o como mínimo en una mesa libre de vibraciones. Asegúrese de que las vibraciones extrañas (por ejemplo, golpes con los pies en el suelo, tocar la mesa, cierres de puertas, tráfico de laboratorio) se mantengan al mínimo.
- Ajuste y mantenga la temperatura del módulo láser a una temperatura constante para todas las grabaciones de video.
NOTA: La temperatura elegida fue de 25 °C porque el analizador de tamaño de nanopartículas se calibró a esa temperatura. Por lo tanto, es importante que todos los usuarios del instrumento conozcan y utilicen la temperatura calibrada. La temperatura ambiente no es un ajuste aceptable porque puede variar. - Asegúrese de que todos los diluyentes, también llamados controles negativos (por ejemplo, solución salina tamponada con fosfato (DPBS) de Dulbecco, agua destilada ultrapura [DW]), estén todos caracterizados por NTA utilizando el mismo nivel de cámara y umbral de detección que las muestras de nanopartículas que se están midiendo. Utilice DPBS caracterizados para el lavado del módulo láser y la dilución de muestras. Factorice los contaminantes en el DPBS de control negativo en los resultados de la muestra si sus niveles son significativos.
- Almacene las muestras a 4 °C antes de la evaluación y nunca las congele, ya que esto degradaría la muestra de liposomas. Caliente las muestras/estándares/diluyentes a temperatura ambiente durante 30 minutos antes del análisis.
NOTA: El manejo de la muestra fue específico para el material que se examinaba. - Evalúe la muestra y los estándares utilizando la medición rápida para establecer una dilución adecuada para obtener 107 a 109 partículas / ml (aproximadamente 50 a 100 partículas / pantalla de video NTA) que se determine que es óptima para los análisis de NTA.
NOTA: Los autores han encontrado que las concentraciones de partículas en el extremo superior de este rango producen resultados más consistentes y reproducibles. - Rellene todos los campos aplicables dentro del cuadro Captura de la pestaña SOP para mediciones rápidas y estándar , incluida la dilución y el diluyente utilizados.
2. Preparación de estándares de calibración de tamaño de 50 nm y 100 nm
NOTA: Consulte la Tabla de materiales.
- Estándares de transferencia de tamaño de 50 nm diluidos 1:5.000
- Agregue 2 μL de los estándares de 50 nm a 9,998 μL de cloruro de potasio (KCl) de 10 mM filtrado por 0.22 μm/Tween 20 al 0.03% en DW ultrapuro en un tubo cónico de 15 mL dos veces enjuagado. Conservar el estándar diluido de 50 nm a 4 °C durante un máximo de un año.
- Estándares de transferencia de tamaño de 100 nm diluidos 1:333
- Agregue 30 μL de los estándares de 100 nm a 9,970 μL de KCl de 10 mM filtrados por 0.22 μm / Tween 20 de 0.03% en DW ultrapuro en un tubo cónico de 15 ml dos veces enjuagado. Conservar el estándar diluido de 100 nm a 4 °C durante un máximo de un año.
3. Limpieza y montaje del módulo láser
- Inspeccione visualmente el módulo láser y las ventanas de la cubierta de la celda de flujo en busca de arañazos o imperfecciones.
NOTA: Si cualquiera de las superficies de vidrio está rayada, las imágenes pueden verse afectadas. - Limpie ambas superficies de vidrio suavemente con un limpiador de lentes de buena calidad y papel de lente. No use toallitas de papel tisú o toallas de papel en superficies de vidrio.
- Asegúrese de que el sello de la junta tórica esté correctamente asentado en la ranura de la cubierta de la celda de flujo antes del ensamblaje.
- Coloque la cubierta de la celda de flujo en el módulo láser, asegurándose de que los contactos eléctricos estén en la orientación adecuada. Coloque los 4 tornillos de pulgar cargados por resorte a través de la placa de la celda de flujo y enganche las roscas del módulo láser, pero no se apriete individualmente.
- Ejerciendo una presión uniforme sobre la cubierta de la celda de flujo, apriete uniformemente los tornillos del pulgar de manera diagonal alterna hasta que se ajusten. Solo apriete los tornillos del pulgar hasta que estén apretados con los dedos. No apriete demasiado.
NOTA: El apriete desigual de los tornillos del pulgar puede agrietar la superficie del módulo láser. Los tornillos de pulgar de diseño más nuevo "tocarán fondo" a la presión adecuada, evitando posibles aprietes excesivos.
4. Procedimiento de lavado para el módulo láser antes y entre muestras
- Use un recipiente recién abierto de DPBS y alícuota en tubos de polipropileno de 15 ml de triple enjuague. Asegúrese de que los productos utilizados para enjuagar o diluir las muestras estén caracterizados por NTA antes de su uso (consulte el paso 1.3).
- Enjuague dos jeringas de tuberculina de 1 ml con adaptadores de bloqueo deslizante 3 veces con 1 ml de DPBS para eliminar cualquier residuo de partículas. Utilice cualquiera de los puertos como entrada, pero utilícelo de forma coherente durante el experimento. No use jeringas más grandes debido al peligro de romper los puertos de la jeringa por el aumento de peso y tamaño de la jeringa.
- Retire y deseche el émbolo de la1ª jeringa de tuberculina e insértelo en el puerto restante para que sirva como un depósito de diluyente/muestra anulado.
NOTA: Si no se retira el émbolo, aumentará la presión en la cámara de muestra y se producirán fugas alrededor del sello. - Llene la2ª jeringa con 1 ml de DPBS y conéctela al puerto de entrada de la cubierta de la celda de flujo.
- Mantenga el módulo láser inclinado con el puerto de la jeringa de salida elevado para permitir que el aire se purgue de la cámara a medida que el DPBS se inyecta lentamente en el módulo láser.
- Enjuague el DPBS restante del módulo láser inyectando 1 ml de aire en el puerto de entrada. Repita el lavado 2 veces más.
- Vacíe el módulo láser lo más completamente posible después de la última descarga.
NOTA: Es necesario un lavado exhaustivo y cuidadoso después del análisis NTA del estándar de 50 nm, ya que estas partículas persisten en el módulo láser. El módulo láser ya está listo para ser utilizado.
5. Colocación del módulo láser en la etapa del microscopio
- Localice las guías de alineación de enfoque del módulo láser en el brazo del microscopio (Figura 2) y alinee con la perilla de enfoque.

Figura 2: Guía de alineación de enfoque del módulo láser. Haga clic aquí para ver una versión más grande de esta figura.
- Frente al microscopio, coloque el módulo láser en la etapa ranurada y deslícelo suavemente lo más lejos posible hacia la derecha.
NOTA: Si se hace con cuidado, la alineación y el punto focal serán más fáciles de localizar entre las muestras. - Encienda el interruptor basculante de la caja de control láser.
6. Enfoque y posicionamiento del módulo láser
NOTA: Esto debe realizarse con líquido en la cámara.
- Cargue el software NTA (consulte la Tabla de materiales) desde el escritorio.
NOTA: Puede aparecer un error, "Temperatura H/W no encontrada en COM3." Simplemente cierre y vuelva a abrir el software para solucionarlo. - Haga clic en Iniciar cámara en la pestaña Capturar en el cuadro de la esquina superior izquierda. Si la cámara se apaga automáticamente después de 5 minutos, simplemente haga clic en Iniciar cámara nuevamente para reiniciarla.
- En la misma pestaña, ajuste el nivel de la cámara a 14 a 16 para iluminar la línea láser y simplificar la identificación y el enfoque de partículas.
- Desvíe la imagen de la cámara a los oculares moviendo el control deslizante superior en el lado izquierdo del tocado hacia adentro o hacia afuera.
- Encuentre el área de mayor densidad, comúnmente conocida como la huella digital. Centra y enfoca la huella digital verticalmente en el campo de visión.
NOTA: La línea láser estará a la izquierda de la huella digital. Oscurecer la habitación puede ayudar a facilitar la localización de la huella digital y el enfoque en la línea láser. - Centrar la línea láser en el campo de visión; mueva el control deslizante superior para desviar la luz a la cámara como se observa en la pantalla de la computadora.
NOTA: La línea láser ahora visible en la pantalla es una imagen especular de la vista del ocular; la izquierda en los oculares estará justo en la pantalla de la computadora. - Ajuste el enfoque para enfocar la imagen de partículas individuales en movimiento en la pantalla con la perilla de enfoque.
NOTA: Debido a la profundidad de enfoque, todas las partículas no estarán enfocadas, lo cual es aceptable. Incluso las partículas que están ligeramente desenfocadas serán capturadas por la cámara y analizadas por el software.
7. Carga de estándares/muestras/diluyente en el módulo láser para el análisis NTA
- Extraiga 1 ml de estándar/muestra/diluyente en una jeringa de tuberculina enjuagada de 1 ml y conéctela al puerto de entrada de la cubierta de la celda de flujo. Avance el émbolo hasta que el líquido sea evidente en la jeringa abierta conectada al puerto de salida.
- En la vista de la cámara, desplácese a la derecha de la línea láser a un área de un número uniforme de partículas. Si es necesario, ajuste la orientación vertical para centrar las bandas horizontales de luz. Vuelva a enfocar hasta que el mayor número de partículas esté a la vista. Asegúrese de que, para todas las medidas posteriores, esta posición se mantenga lo más fielmente posible.
- Ajuste el nivel de la cámara hasta el punto de que el símbolo de información oscura parpadee intermitentemente en la parte superior derecha de la vista de la cámara.
NOTA: Esto ayuda a garantizar que se realice una selección coherente del nivel de cámara al nivel de sensibilidad mínimo para cada serie de recopilación de datos.
NOTA: El nivel de la cámara no se puede cambiar durante la captura.
8. Validación de la calibración
NOTA: Se recomienda validar la calibración del módulo utilizando estándares de tamaño (ver sección 2) antes del análisis de la muestra. La validación de rutina es necesaria para garantizar mediciones precisas. En un laboratorio multiusuario, los ajustes individuales del usuario de los ajustes de configuración del software pueden causar inadvertidamente una recopilación de datos inexacta. Para la recopilación de datos críticos, la validación diaria es una cuestión de buenas prácticas de laboratorio. La reproducibilidad diaria de la validación debe incluirse en los resultados informados. Normalmente, la calibración es establecida por el técnico y no es ajustable por el usuario individual a menos que el usuario tenga acceso de administrador. Esto evita la reconfiguración no autorizada por parte de usuarios individuales.
- Estándares diluidos en caliente (ver sección 2) a temperatura ambiente durante 30 min.
- Vórtice brevemente los estándares y luego cargue como se describe en la sección 7.
- Realizar la muestra de NTA como se describe en la sección 10 y registrar los valores para el posterior cálculo del coeficiente de variación, que debe ser inferior al 2% si se calibra correctamente.
9. Optimización de la concentración de la muestra para NTA
NOTA: La pantalla debe contener entre 50 y 100 partículas medibles cuando el nivel de la cámara y la concentración de la muestra se ajustan correctamente. Si hay alguna pregunta sobre si una muestra tiene un número de partícula apropiado, se puede ejecutar una medición rápida en la muestra en este punto (consulte los pasos 9.1 a 9.7). Se utiliza para evaluar las características de la muestra rápidamente antes de capturas de video más largas. La pestaña Medición rápida se encuentra dentro de la pestaña SOP en el cuadro central inferior.
- Establezca la duración de la captura en 30 s.
- Acepte el nombre de archivo base existente o escriba un nuevo nombre de archivo haciendo clic en la pestaña ... de un nuevo sitio de almacenamiento para los datos generados.
- Marque la casilla Temperatura objetivo e introduzca la temperatura deseada.
- Cargue el ejemplo como se describió anteriormente (paso 7.1) y haga clic en Crear y ejecutar script.
- Espere a que se muestre el número de partículas por fotograma en la parte inferior derecha de la pantalla de video después de completar el video de 30 s. Si el número de partículas es superior a 100, enjuague el módulo láser 3 veces (como se describió anteriormente en el paso 4.6).
- Diluya la muestra al rango de concentración deseado utilizando el diluyente caracterizado.
- Cargue la muestra diluida correctamente en el módulo láser enjuagado y ejecute la medición rápida para verificar que la muestra esté dentro del rango aceptable.
10. Ejemplo de NTA
NOTA: La ficha Medición estándar se encuentra dentro de la ficha SOP en el cuadro central inferior y se utiliza para el análisis rutinario de muestras (consulte los pasos 10.1 a 10.12).
- Establezca la duración en 30 o 60 s y el número de videos en 5.
- Acepte el nombre de archivo base existente o escriba un nuevo nombre de archivo haciendo clic en la pestaña ... de un nuevo sitio de almacenamiento para los datos generados.
- Marque la casilla Temperatura objetivo e introduzca la temperatura deseada.
- Haga clic en Crear script para reutilizar esta medición estándar.
- Una vez que el ejemplo se haya cargado como se describe en la sección 7 y el experimento esté listo para ejecutarse, haga clic en Crear y ejecutar script.
- Rellene los campos de la pantalla emergente Establecer detalles del informe con información sobre el operador, la descripción de la muestra, la dilución de la muestra y el diluyente utilizado.
NOTA: Esta información se registrará e imprimirá en el informe experimental final. - Cuando se hayan rellenado todos los campos deseados, haga clic en Aceptar para iniciar el script.
NOTA: Si se seleccionó la temperatura objetivo , el calentador estabilizará la muestra en el módulo láser a la temperatura deseada durante 5 s antes de permitir que el script continúe con la medición. El panel de diagnóstico en la esquina inferior izquierda de la pantalla leerá HEATER ON y mostrará la temperatura de la muestra. - Antes de cada captura de video, busque un mensaje para avanzar el émbolo manualmente. Inyecte ~ 0.05 ml de la muestra en la cámara láser y permita que las partículas "descansen" (es decir, no fluyan) y luego haga clic en Aceptar.
- Espere a que aparezca un cuadro de confirmación de configuración al finalizar la5ª captura de video y a que el cuadro Proceso parpadee. Establezca el umbral de detección para el procesamiento de la muestra anotando el número de cruces azules que marcan partículas en la pantalla a medida que los fotogramas avanzan manualmente desde la parte inferior de la pantalla de video. Si hay más de 3-4 cruces azules que marcan partículas en cada pantalla a medida que avanzan los marcos, aumente el umbral de detección.
NOTA: Los cruces azules en las partículas individuales son análogos al efecto "enjambre" en la citometría de flujo y deben minimizarse para una precisión y reproducibilidad óptimas de la recopilación de datos. - Haga clic en Configuración aceptar cuando el umbral de detección sea aceptable.
- Espere a que los videos se procesen automáticamente y se muestre un histograma de resultados y una notificación de finalización en el cuadro de diálogo antes de hacer clic en Aceptar.
- Una vez que aparezca el cuadro Configuración de exportación , guarde los resultados haciendo clic en Exportar.
NOTA: Todos los resultados de los vídeos y análisis se almacenarán en el archivo de destino definido en el paso 10.2. Esto requiere una gran cantidad de almacenamiento. Supervise y transfiera a un dispositivo de almacenamiento secundario según sea necesario.
11. Nuevo análisis de la muestra actual en diferentes umbrales de detección
NOTA: Inmediatamente después del análisis NTA (paso 10), los datos se pueden volver a analizar utilizando diferentes configuraciones de umbral de detección. Sin embargo, el nivel de cámara no se puede modificar después de la captura.
- Resalta los 5 videos de captura enumerados en el Experimento actual.
- Haga clic en Procesar archivos seleccionados y espere a que aparezca el cuadro Configuración de confirmación y el cuadro Proceso parpadee para cambiar el umbral de detección.
- Ajuste el umbral de detección al nivel deseado y haga clic en Configuración de aceptar.
- Espere a que los videos se procesen automáticamente y se muestre un histograma de resultados y una notificación de finalización en el cuadro de diálogo antes de hacer clic en Aceptar.
- Haga clic en Exportar configuración. Cuando se realicen evaluaciones adicionales en la muestra más reciente, asegúrese de hacer clic en el cuadro Exportar resultados del experimento actual , ya que no se mostrará el cuadro emergente Exportar resultados después del nuevo análisis de la muestra.
NOTA: Como no hay recordatorios para hacer esto, se puede pasar por alto fácilmente y el análisis se perderá. Sin embargo, los datos subyacentes permanecerán y se pueden volver a analizar más adelante.
12. Análisis de archivos archivados
NOTA: Si no se han guardado experimentos analizados previamente o si es necesario realizar análisis adicionales en estas muestras, los archivos individuales se pueden volver a cargar en el software NTA para evaluaciones adicionales del umbral de detección . Los cambios en el nivel de la cámara no se pueden modificar después de la captura.
- Cargue el software NTA desde el escritorio.
- Haga clic en la ficha Análisis en el panel central inferior.
- Haga clic en Abrir experimento y navegue hasta el archivo .nano deseado.
NOTA: Los archivos de vídeo asociados con el experimento .nano seleccionado deben estar en la misma carpeta que el archivo de experimento principal; de lo contrario, aparecerá un error al intentar procesar los archivos. Los primeros 6 dígitos del nombre del archivo son la fecha en que se ejecutó el experimento (xx-xx-xx). Los últimos 6 dígitos del nombre del archivo son la hora en que se grabó el video (xx-xx-xx) y el identificador de video individual. El archivo PDF de cada experimento combinado enumera los archivos .nano incluidos para ese análisis. - Haga clic en Procesar archivos seleccionados para ejecutar el análisis.
- Una vez que el cuadro Proceso parpadee para permitir cambios en el umbral de detección, establezca el umbral en el nivel deseado y haga clic en Aceptar.
- Espere a que los videos se procesen automáticamente y se muestre un histograma de resultados y una notificación de finalización en el cuadro de diálogo antes de hacer clic en Aceptar.
- Haga clic en Exportar resultados. Asegúrese de hacer clic en el cuadro Exportar resultados en el experimento actual, ya que el cuadro emergente Exportar resultados no se mostrará después del nuevo análisis.
NOTA: Como no hay recordatorios para hacer esto, se puede pasar por alto fácilmente y el análisis se perderá.
13. Limpieza y desmontaje del módulo láser
- Apague la caja de control láser.
- Enjuague toda la muestra del módulo láser y deséchela correctamente.
- Mantenga el módulo láser inclinado con el puerto de jeringa abierto elevado para permitir que el aire se purgue de la cámara a medida que el DPBS se inyecta lentamente en el módulo láser y se enjuaga desde el puerto de la jeringa de salida.
- Enjuague el DPBS restante del módulo láser y deséchelo.
- Repita el lavado 2 veces más y vacíe el módulo láser lo más completamente posible después del último lavado.
- Ejerciendo una presión uniforme sobre la cubierta de la celda de flujo, afloje uniformemente los tornillos para el pulgar de manera diagonal alterna hasta que se desconecten de los hilos, retire los tornillos para el pulgar y guárdelos en la caja del módulo láser.
- Retire la cubierta de la celda de flujo del módulo láser.
- Limpie ambas superficies de vidrio suavemente con un limpiador de lentes de buena calidad y papel de lente. No use papel de seda o toallas de papel en superficies de vidrio.
- Inspeccione visualmente las "ventanas" del módulo láser y la cubierta de la celda de flujo en busca de arañazos o imperfecciones después del uso e informe al supervisor.
- Reemplace el módulo láser y la cubierta de la celda de flujo en sus estuches para evitar daños en las superficies de vidrio durante el almacenamiento.
14. Protocolo de análisis de muestras
- Muestras sin filtrar
- Vórtice la muestra antes de cargar y grabe videos de 5 x 60 s en el nivel de cámara 12 y el nivel de umbral de detección 3 como se describió anteriormente. Vuelva a analizar estos vídeos utilizando los umbrales de detección 2 y 5.
- Repita las colecciones de vídeo de la misma muestra en los niveles de cámara 13 y 14 y en el nivel de umbral de detección 3. Vuelva a analizar estos 2 videos adicionales utilizando los umbrales de detección 2 y 5. Repita todo el proceso usando videos de 5 x 30 s en la configuración SOP .
- Muestras filtradas
- Vórtice la muestra y luego cárguela y filtre simultáneamente (filtro de jeringa de 0,22 μm) directamente en el módulo láser.
NOTA: El filtro de la jeringa se enjuagó con 2 veces el volumen del espacio muerto del filtro antes de usarlo para eliminar las partículas residentes. Los filtros de jeringa (ver la Tabla de Materiales) tenían un espacio muerto medido de 0.5 mL y fueron enjuagados con 1.0 mL de la muestra antes de las mediciones. Anote el tipo de filtro en los campos de datos SOP . La muestra filtrada se procesó exactamente como se describe para las muestras sin filtrar en el paso 14.1.
- Vórtice la muestra y luego cárguela y filtre simultáneamente (filtro de jeringa de 0,22 μm) directamente en el módulo láser.
15. Análisis estadístico de los resultados de la NTA
- Para el análisis de los principales efectos o interacciones, realizar análisis de varianza tras una comprobación de los supuestos ANOVA (normalidad, unimodal, homogeneidad de varianza). Utilice el ANOVA unidireccional de Kruskal-Wallis en los rangos en casos de incumplimiento de los supuestos de ANOVA.
- Después del retorno de los efectos principales significativos, utilice el método de Dunn para realizar pruebas de medias para comparaciones planificadas previamente. Considere que un valor p de 0.05 es significativo en las pruebas de dos colas.
NOTA: Los archivos de datos generados aquí están disponibles de los autores después de la finalización de un acuerdo de transferencia de materiales.
Access restricted. Please log in or start a trial to view this content.
Resultados
La Tabla 1 contiene los resultados de los videos NTA para las muestras de liposomas (18 filtradas y 18 sin filtrar) y un diluyente DPBS representativo. Las comparaciones entre los dos grupos se completaron independientemente del nivel de la cámara o el umbral de detección en este documento. Las muestras filtradas tenían un diámetro medio de partículas de 108,5 nm, un modo de partículas de 86,2 nm y una concentración de 7,4 × 108 partículas/ml. Por el contrario, las muestras sin filtra...
Access restricted. Please log in or start a trial to view this content.
Discusión
Existen varios métodos disponibles para estimar el tamaño y la concentración de nanopartículas11. Estos incluyen métodos de conjunto que generan una estimación del tamaño de una población, incluida la dispersión dinámica de la luz (DLS), la sedimentación centrífuga y el análisis a nivel de partícula única: microscopía electrónica, NTA, microscopía de fuerza atómica y detección de pulso resistivo sintonizable. De estos, DLS y NTA son métodos de medición de tamaño y concentrac...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Ninguno de los autores tiene conflictos de intereses.
Agradecimientos
El trabajo fue apoyado por el estado de Kansas al Instituto del Medio Oeste para la Biología Comparada de Células Madre (MICSCB), el Centro de Investigación del Cáncer Johnson a MLW y NIH R21AG066488 a LKC. OLS recibió el apoyo gra del MICSCB. Los autores agradecen al Dr. Santosh Aryal por proporcionar los liposomas utilizados en este proyecto y a los miembros de los laboratorios Weiss y Christenson por conversaciones y comentarios útiles. Se agradece al Dr. Hong He por su apoyo técnico. MLW agradece a Betti Goren Weiss por su apoyo y consejo.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
Referencias
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Consortium, E. -T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945(2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57(2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271(2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101(2013).
- Malvern analytical Ltd. NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639(2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados