É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Melhorando a reprodutibilidade para atender informações mínimas para estudos de diretrizes extracelulares de vesículas 2018 em análise de rastreamento de nanopartículas
Neste Artigo
Resumo
A análise de rastreamento de nanopartículas (NTA) é um método amplamente utilizado para caracterizar vesículas extracelulares. Este artigo destaca parâmetros e controles experimentais da NTA, além de um método uniforme de análise e caracterização de amostras e diluentes necessários para complementar as diretrizes propostas pelo MISEV2018 e EV-TRACK para reprodutibilidade entre laboratórios.
Resumo
A análise de rastreamento de nanopartículas (NTA) tem sido um dos vários métodos de caracterização utilizados para pesquisas de vesícula extracelular (EV) desde 2006. Muitos consideram que os instrumentos NTA e seus pacotes de software podem ser facilmente utilizados após o treinamento mínimo e que a calibração de tamanho é viável internamente. Como tanto a aquisição da NTA quanto a análise de software constituem caracterização de EV, elas são abordadas em Informações Mínimas para Estudos de Vesículas Extracelulares 2018 (MISEV2018). Além disso, eles têm sido monitorados por Relatórios Transparentes e Centralização do Conhecimento em Pesquisa De Vesícula Extracelular (EV-TRACK) para melhorar a robustez dos experimentos de EV (por exemplo, minimizar a variação experimental devido a fatores descontrolados).
Apesar dos esforços para incentivar a notificação de métodos e controles, muitos artigos de pesquisa publicados não relatam as configurações críticas necessárias para reproduzir as observações originais da NTA. Poucos artigos relatam a caracterização da NTA de controles negativos ou diluentes, evidentemente assumindo que produtos disponíveis comercialmente, como soro fisiológico tamponado com fosfato ou água destilada ultrapura, são livres de partículas. Da mesma forma, controles positivos ou padrões de tamanho raramente são relatados pelos pesquisadores para verificar o dimensionamento de partículas. A equação de Stokes-Einstein incorpora variáveis de viscosidade e temperatura para determinar o deslocamento de partículas. Relatar a temperatura estável da câmara de laser durante toda a coleção de vídeo da amostra é, portanto, uma medida de controle essencial para uma replicação precisa. A filtragem de amostras ou diluentes também não é relatada rotineiramente e, se for o caso, as especificidades do filtro (fabricante, material de membrana, tamanho dos poros) e condições de armazenamento raramente são incluídas. Os padrões mínimos de detalhes experimentais aceitáveis da Sociedade Internacional para Vesícula Extracelular (ISEV) devem incluir um protocolo NTA bem documentado para a caracterização de EVs. O experimento a seguir fornece evidências de que um protocolo de análise NTA precisa ser estabelecido pelo pesquisador individual e incluído nos métodos de publicações que utilizam a caracterização do NTA como uma das opções para cumprir os requisitos MISEV2018 para caracterização de vesícula única.
Introdução
A análise precisa e repetível de EVs e outras partículas em escala de nanômetros apresenta inúmeros desafios em toda a pesquisa e indústria. A replicação da pesquisa de EV tem sido difícil, em parte, devido à falta de uniformidade na comunicação dos parâmetros necessários associados à coleta de dados. Para suprir essas deficiências, o ISEV propôs diretrizes do setor como um conjunto mínimo de padrões bioquímicos, biofísicos e funcionais para pesquisadores de EV e publicou-as como uma declaração de posição, comumente referida como MISEV20141. O ritmo acelerado da pesquisa de EV exigiu uma diretriz atualizada, e o "MISEV2018: uma declaração de posição do ISEV" expandiu as diretrizes do MISEV20142. O artigo do MISEV2018 incluiu tabelas, contornos de protocolos sugeridos e passos a seguir para documentar a caracterização específica associada ao EV. Como mais uma medida para facilitar a interpretação e a replicação de experimentos, o EV-TRACK foi desenvolvido como uma base de conhecimento de fonte de multidões (http://evtrack.org) para permitir um relato mais transparente da biologia EV e da metodologia utilizada para os resultados publicados3. Apesar dessas recomendações para relatórios padronizados de métodos, o campo continua sofrendo com a replicação e confirmação dos resultados publicados.
Encaixando-se com o esforço dos Institutos Nacionais de Saúde e da Fundação Nacional de Ciência para ferramentas de avaliação da qualidade, este artigo sugere que o ISEV requer relatórios padronizados de métodos e detalhes para que as ferramentas de avaliação de dados possam ser aplicadas com o objetivo de replicar resultados entre laboratórios. Reportar fontes celulares, procedimentos de cultura celular e métodos de isolamento de EV são fatores importantes para definir as qualidades da população de EV. Entre os instrumentos da NTA, fatores como configurações de detecção, índice refrativo de fluido portador, populações de partículas heterogêneas contribuindo para a polidispersidade, falta de requisitos padronizados de notificação e resultados de medição intra e inter-observadores tornam a comparação da NTA entre laboratórios difícil ou impossível.
Em uso desde 2006, o NTA é um método popular para o tamanho das nanopartículas e determinação de concentração que atualmente é usado por aproximadamente 80% dos pesquisadores de EV4. As Diretrizes MISEV2018 exigem duas formas de análise de vesícula única, das quais a NTA é uma das opções populares. A NTA continua a ser usada em comum para caracterização de EV devido à sua ampla acessibilidade, baixo custo por amostra e sua teoria fundadora direta (a equação de Stokes-Einstein). A avaliação do EV pela NTA gera uma estimativa de distribuição e concentração de tamanho de partículas utilizando dispersão de luz laser e análise de movimento browniano, com o menor limite de detecção determinado pelo índice de refração do EV. Ao usar uma amostra fluida de viscosidade e temperatura conhecidas, as trajetórias dos EVs são rastreadas para determinar seu deslocamento médio-quadrado em duas dimensões. Isso permite que o coeficiente de difusão de partículas seja calculado e convertido em um diâmetro hidrodinâmico equivalente à esfera por uma equação modificada de Stokes-Einstein 5,6,7. A análise de partículas-partículas da NTA tem menos interferência por aglomerados ou partículas maiores em uma população heterogênea de EVs do que outros métodos de caracterização7. Embora algumas partículas maiores tenham um impacto mínimo na precisão do dimensionamento, a presença de quantidades minúsculas de partículas grandes e de dispersão de luz resulta em uma notável redução na detecção de partículas menores devido à redução da detecção e rastreamento de EV de softwarereduzido. Como técnica de medição, a NTA é geralmente considerada não tendenciosa em relação a partículas maiores ou agregados de partículas, mas pode resolver populações de múltiplos tamanhos através da análise individual de partículas9. Devido ao uso de dispersão de luz por partículas, uma das limitações da análise NTA é que qualquer particulado como poeira, plástico ou pó com atributos de refração e tamanho semelhantes em comparação com EVs não pode ser diferenciado dos EVs reais por este método de caracterização.
O NanoSight LM10 (analisador de tamanho de nanopartículas) e O LM14 (módulo laser) foram vendidos desde 2006, e embora modelos mais recentes deste instrumento tenham sido desenvolvidos, este modelo em particular é encontrado em muitas instalações principais e é considerado um cavalo de trabalho confiável. O treinamento é necessário para otimizar adequadamente as configurações nta para medições de alto nível de tamanho e concentração. As duas configurações importantes necessárias para gravações de vídeo ideais são (1) o nível da câmera e (2) o limiar de detecção. Estes devem ser definidos pelo operador com base nas características da amostra. Uma das principais restrições da análise da NTA é a recomendação de concentrações amostrais entre 107 e 109 partículas/mL, para alcançar esta diluição amostral pode ser necessária10. Soluções utilizadas para diluição, como soro fisiológico tamponado de fosfato, soro fisiológico de 0,15 M ou água ultrauso, raramente são livres de partículas com menos de 220 μm de tamanho, o que pode afetar as medições da NTA. A caracterização nta das soluções utilizadas para diluição deve ser realizada no mesmo nível de câmera e limiar de detecção das amostras de nanopartículas que estão sendo analisadas. O tamanho e a concentração de nanopartículas presentes em diluentes utilizados para diluições de amostras de EV raramente são incluídos em publicações envolvendo análises de EVs.
Este protocolo utiliza a análise NTA de lipossomos sintéticos semelhantes ao EV avaliados usando níveis de câmera selecionados, limiares de detecção e filtragem mecânica das amostras para analisar os efeitos sistemáticos do nível da câmera, limiar de detecção ou filtragem de amostras no conjunto de dados NTA. Lipossomos foram sintetizados como descrito no Arquivo Suplementar S1. Lipossomos sintéticos foram utilizados neste experimento devido à sua uniformidade de tamanho, características físicas e estabilidade no armazenamento a 4 °C. Embora amostras reais de EVs pudessem ter sido usadas, a heterogenicidade e estabilidade dos EVs durante o armazenamento podem ter complicado este estudo e sua interpretação. As semelhanças nos relatórios NTA de (A) lipossomos e (B) EVs indicam que os efeitos sistemáticos revelados para lipossomos neste artigo provavelmente também se aplicarão à caracterização de EV (Figura 1). Juntos, esses achados apoiam a noção de que o relato completo de configurações críticas de software e a descrição do processamento de amostras, como diluente, diluição e filtração, impactam na reprodutibilidade dos dados da NTA.
O objetivo deste artigo é demonstrar que foram obtidas as configurações nta variando (temperatura, nível de câmera e limiar de detecção) e mudanças na preparação da amostra dos resultados coletados: foram obtidas diferenças sistemáticas e significativas de tamanho e concentração. Como a NTA é uma das opções populares para cumprir a especificação de caracterização MISEV2018, esses resultados demonstram a importância de relatar a preparação da amostra e as configurações da NTA para garantir a reprodutibilidade.
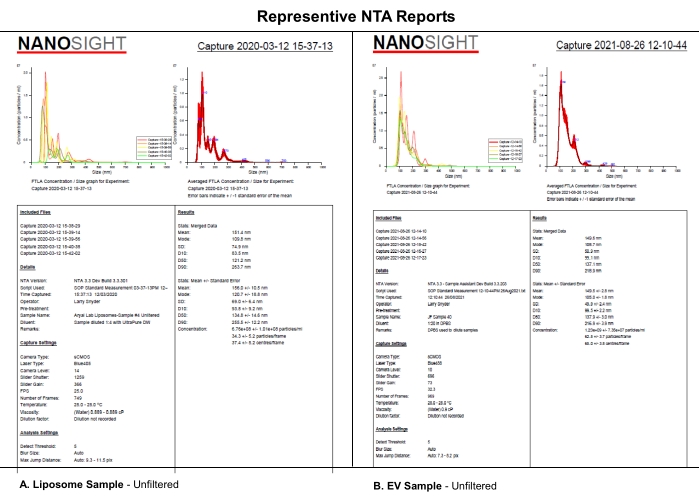
Figura 1: Representante NTA relata comparar lipossomos com EVs. (A) Lipossomos: amostra não filtrada caracterizada na NTA em 12 de março de 2020. (B) EVs: amostra não filtrada caracterizada na NTA em 26 de agosto de 2021. Abreviaturas: NTA = Análise de rastreamento de nanopartículas; EVs = vesículas extracelulares. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Diretrizes gerais do protocolo
- Mantenha o microscópio em uma mesa de ar ou no mínimo em uma mesa livre de vibrações. Certifique-se de que vibrações estranhas (por exemplo, batidas no chão, tocando na mesa, fechamentos de portas, tráfego de laboratório) sejam mantidas ao mínimo.
- Defina e mantenha a temperatura do módulo laser a uma temperatura constante para todas as gravações de vídeo.
NOTA: A temperatura escolhida foi de 25 °C porque o analisador de tamanho de nanopartículas foi calibrado a essa temperatura. Por isso, é importante que todos os usuários do instrumento conheçam e usem a temperatura calibrada. A temperatura ambiente não é uma configuração aceitável porque pode variar. - Certifique-se de que todos os diluentes, também chamados de controles negativos (por exemplo, a solução salina tamponada de fosfato (DPBS) de Dulbecco, são todos caracterizados por NTA usando o mesmo nível de câmera e limiar de detecção que as amostras de nanopartículas que estão sendo medidas. Utilização de DPBS caracterizados para a descarga do módulo laser e diluição de amostras. Contaminantes de fatores no controle negativo DPBS em resultados amostrais se seus níveis forem significativos.
- Armazene amostras a 4 °C antes da avaliação e nunca as congele, pois isso degradaria a amostra liposa. Amostras/padrões/diluentes quentes à temperatura ambiente por 30 minutos antes da análise.
NOTA: O manuseio da amostra foi específico para o material examinado. - Avalie a amostra e os padrões utilizando a medição rápida para estabelecer uma diluição apropriada para obter 10a 109 partículas/mL (aproximadamente 50 a 100 partículas/tela de vídeo NTA) consideradas ótimas para análises NTA.
NOTA: Os autores descobriram que as concentrações de partículas na extremidade superior desta faixa produzem resultados mais consistentes e reprodutíveis. - Preencha todos os campos aplicáveis dentro da caixa Capture da guia SOP para medições rápidas e padrão , incluindo a diluição e diluente utilizados.
2. Preparação de padrões de calibração de tamanho de 50 nm e 100 nm
NOTA: Veja a Tabela de Materiais.
- Padrões de transferência de tamanho de 50 nm diluídos 1:5.000
- Adicione 2 μL dos padrões de 50 nm a 9.998 μL de 0,22 μm filtrado 10 mM cloreto de potássio (KCl)/0,03% Tween 20 em dw ultrapure em um tubo cônico de 15 mL enxaguado duas vezes. Armazene o padrão diluído de 50 nm a 4 °C por até um ano.
- Padrões de transferência de tamanho de 100 nm diluídos 1:333
- Adicione 30 μL dos padrões de 100 nm a 9.970 μL de 0,22 μm filtrado 10 mM KCl/0,03% Tween 20 em ultrapure DW em um tubo cônico de 15 mL duas vezes enxaguado. Armazene o padrão diluído de 100 nm a 4 °C por até um ano.
3. Limpeza e montagem do módulo laser
- Inspecione visualmente o módulo laser e as janelas de cobertura de células de fluxo para arranhões ou imperfeições.
NOTA: Se qualquer superfície de vidro estiver arranhada, a imagem pode ser afetada. - Limpe as duas superfícies de vidro suavemente com um limpador de lentes de boa qualidade e papel de lente. Não use lenços de tecido ou toalhas de papel em superfícies de vidro.
- Certifique-se de que a vedação o-anel está devidamente sentada na ranhura da tampa da célula de fluxo antes do conjunto.
- Coloque a tampa da célula de fluxo no módulo laser, garantindo que os contatos elétricos estejam na orientação adequada. Coloque os 4 parafusos carregados de mola através da placa de célula de fluxo e engaje os fios do módulo laser, mas não aperte individualmente.
- Colocando pressão uniforme na tampa da célula de fluxo, aperte uniformemente os parafusos de polegar de forma diagonal alternada até ficar confortável. Só aperte os parafusos até apertar o dedo. Não aperte demais.
NOTA: O aperto desigual das torres de polegares pode quebrar a superfície do módulo laser. As placas de polegar mais novas projetadas "diminuirão" a pressão adequada, evitando possíveis apertarem.
4. Procedimento de descarga para o módulo laser antes e entre as amostras
- Use um recipiente recém-aberto de DPBS e alíquota em tubos de polipropileno de 15 mL de lavagem tripla. Certifique-se de que os produtos utilizados para lavar ou diluir amostras são caracterizados por NTA antes do uso (ver etapa 1.3).
- Lave duas seringas tuberculinas de 1 mL com adaptadores de bloqueio de deslizamento 3 vezes com 1 mL de DPBS para remover quaisquer resíduos de partículas. Use qualquer porta como entrada, mas use-a consistentemente durante o experimento. Não utilize seringas maiores devido ao perigo de quebrar as portas de seringa devido ao aumento do peso e tamanho da seringa.
- Remova e descarte o êmbolo da seringa de1º tubérculo e insira-o na porta restante para servir como um reservatório diluído/amostral vazio.
NOTA: A não remoção do êmbolo causará aumento da pressão na câmara de amostra e vazamento ao redor do selo. - Encha a2ª seringa com 1 mL de DPBS e conecte-a à porta de entrada da tampa da célula de fluxo.
- Segure o módulo laser inclinado com a porta de seringa de saída elevada para permitir que o ar seja expurgado da câmara à medida que o DPBS é injetado lentamente no módulo laser.
- Lave o DPBS restante do módulo laser injetando 1 mL de ar na porta de entrada. Repita a descarga mais 2 vezes.
- Esvazie o módulo laser o mais completamente possível após a última descarga.
NOTA: A descarga minuciosa e cuidadosa é necessária após a análise da NTA do padrão de 50 nm, pois essas partículas persistem no módulo laser. O módulo laser está pronto para ser usado.
5. Colocação do módulo laser no estágio do microscópio
- Localize os guias de alinhamento de foco do módulo laser no braço do microscópio (Figura 2) e alinhe-os usando o botão de foco.

Figura 2: Guia de alinhamento de foco do módulo laser. Clique aqui para ver uma versão maior desta figura.
- De frente para o microscópio, coloque o módulo laser no estágio ranhurado e deslize-o suavemente o mais longe possível para a direita.
NOTA: Se feito com cuidado, o alinhamento e o ponto focal serão mais fáceis de localizar entre as amostras. - Ligue o interruptor do roqueiro na caixa de controle a laser.
6. Foco e posicionamento do módulo laser
NOTA: Deve ser realizado com fluido na câmara.
- Carregue o software NTA (veja a tabela de materiais) da área de trabalho.
NOTA: Um erro pode aparecer: "Temperatura H/W não encontrada no COM3."" Basta fechar e reabrir o software para corrigi-lo. - Clique em Iniciar câmera sob a guia Capturar na caixa de canto superior esquerdo. Se a câmera desligar automaticamente após 5 minutos, basta clicar em Iniciar a Câmera novamente para reiniciá-la.
- Na mesma guia, ajuste o nível da câmera para 14 a 16 para iluminar a linha laser e simplificar a identificação e o foco das partículas.
- Desvie a imagem da câmera para as oculares movendo o controle deslizante superior do lado esquerdo do fone de ouvido para dentro ou para fora.
- Encontre a área de maior densidade, comumente referida como a impressão digital. Centralize e concentre a impressão digital verticalmente no campo de visão.
NOTA: A linha laser será à esquerda da impressão digital. Escurecer a sala pode ajudar a facilitar a localização da impressão digital e o foco na linha laser. - Centralize a linha laser no campo de visão; mova o controle deslizante superior para desviar a luz para a câmera como observado na tela do computador.
NOTA: A linha laser agora visível na tela é uma imagem espelhada da visão da ocular; esquerda nas oculares estará bem na tela do computador. - Ajuste o foco para aguçar a imagem de partículas móveis individuais na tela com o botão de foco.
NOTA: Devido à profundidade de foco, todas as partículas não estarão em foco, o que é aceitável. Mesmo partículas ligeiramente fora de foco serão capturadas pela câmera e analisadas pelo software.
7. Padrões de carregamento/amostras/diluídos no módulo laser para análise de NTA
- Elasenhe 1 mL de padrão/amostra/diluente em uma seringa de tuberculina de 1 mL enxaguada e conecte-a à porta de entrada da tampa da célula de fluxo. Avance o êmbolo até que o fluido seja evidente na seringa aberta presa à porta de saída.
- Na visão da câmera, mova-se para a direita da linha laser para uma área de um número uniforme de partículas. Se necessário, ajuste a orientação vertical para centralizar as faixas horizontais de luz. Refoce-se até que o maior número de partículas esteja à vista. Certifique-se de que, para todas as medidas subsequentes, esta posição seja mantida o mais próximo possível.
- Ajuste o nível da câmera ao ponto que o símbolo de informações escuras pisca intermitentemente no canto superior direito da visão da câmera.
NOTA: Isso ajuda a garantir que uma seleção consistente do nível da câmera seja feita no nível mínimo de sensibilidade para cada série de coleta de dados.
NOTA: O nível da câmera não pode ser alterado durante a captura.
8. Validação da calibração
NOTA: Recomenda-se validar a calibração do módulo usando padrões de tamanho (ver seção 2) antes da análise da amostra. A validação de rotina é necessária para garantir medições precisas. Em um laboratório multiusuário, ajustes individuais do usuário das configurações de configuração de software podem inadvertidamente causar coleta de dados imprecisas. Para a coleta crítica de dados, a validação diária é uma questão de boa prática laboratorial. A reprodutibilidade diária da validação precisa ser incluída nos resultados relatados. Normalmente, a calibração é definida pelo técnico e não é ajustável pelo usuário individual, a menos que o usuário tenha acesso ao administrador. Isso evita a reconfiguração não autorizada por usuários individuais.
- Padrões aquecidos diluídos (ver seção 2) à temperatura ambiente por 30 minutos.
- Brevemente vórtice dos padrões e, em seguida, carregar como descrito na seção 7.
- Realize a amostra NTA conforme descrito na seção 10 e registos de registro para cálculo subsequente do coeficiente de variação, que deve ser inferior a 2% se corretamente calibrado.
9. Otimização da concentração amostral para NTA
NOTA: A tela deve conter entre 50 e 100 partículas mensuráveis quando o nível da câmera e a concentração da amostra forem ajustados corretamente. Se houver alguma dúvida sobre se uma amostra tem um número de partícula apropriado, uma Medição Rápida pode ser executada na amostra neste momento (ver etapas 9.1 a 9.7). É usado para avaliar as características da amostra rapidamente antes de capturas de vídeo mais longas. A guia Medição Rápida é encontrada dentro da guia SOP na caixa inferior do meio.
- Definir duração de captura para 30 s.
- Aceite o nome de arquivo base existente ou digite um novo nome de arquivo clicando na guia ... para um novo site de armazenamento para dados gerados.
- Verifique a caixa para obter a temperatura do alvo e insira a temperatura desejada.
- Carregue a amostra como descrito anteriormente (etapa 7.1) e clique em Criar e Executar Script.
- Aguarde que o número de partículas por quadro seja exibido no canto inferior direito da tela de vídeo após a conclusão do vídeo de 30 s. Se o número de partículas for superior a 100, lave o módulo laser 3 vezes (como descrito anteriormente na etapa 4.6).
- Diluir a amostra para a faixa de concentração desejada utilizando o diluído caracterizado.
- Carregue a amostra devidamente diluída no módulo laser lavado e execute a Medição Rápida para verificar se a amostra está dentro do intervalo aceitável.
10. Amostra NTA
NOTA: A guia de medição padrão está dentro da guia SOP na caixa inferior do meio e é usada para análise de amostra de rotina (ver etapas 10.1 a 10.12).
- Defina a duração para 30 ou 60 e o número de vídeos para 5.
- Aceite o nome de arquivo base existente ou digite um novo nome de arquivo clicando na guia ... para um novo site de armazenamento para dados gerados.
- Verifique a caixa para obter a temperatura do alvo e insira a temperatura desejada.
- Clique em Criar script para reutilizar esta medição padrão.
- Uma vez que a amostra seja carregada como descrito na seção 7 e o experimento esteja pronto para ser executado, clique em Criar e Executar Script.
- Preencha os campos na tela pop-up Set Report Details com informações sobre o operador, descrição da amostra, diluição da amostra e diluído utilizado.
NOTA: Essas informações serão registradas e impressas no relatório experimental final. - Quando todos os campos desejados tiverem sido preenchidos, clique em OK para iniciar o script.
NOTA: Se a temperatura do alvo for selecionada, o aquecedor estabilizará a amostra no módulo laser até a temperatura desejada por 5 s antes de permitir que o script prossiga com a medição. O painel de diagnóstico no canto inferior esquerdo da tela lerá HEATER ON e exibirá a temperatura da amostra. - Antes de cada captura de vídeo, procure um prompt para avançar manualmente o êmbolo. Injete ~0,05 mL da amostra na câmara laser e permita que as partículas cheguem a "descansar" (ou seja, não fluindo), e então clique em OK.
- Aguarde que uma caixa de confirmação de configurações apareça após a conclusão da capturade vídeo 5 e para que a caixa Processe pisce. Defina o Limiar de Detecção para processamento da amostra, observando o número de cruzes azuis marcando partículas na tela à medida que os quadros são avançados manualmente a partir da parte inferior da tela de vídeo. Se houver mais de 3-4 cruzes azuis marcando partículas em cada tela à medida que os quadros são avançados, aumente o Limiar de Detecção.
NOTA: As cruzes azuis nas partículas individuais são análogas ao efeito "enxame" na citometria de fluxo e devem ser minimizadas para a melhor precisão e reprodutibilidade da coleta de dados. - Clique em Configurações OK quando o limiar de detecção for aceitável.
- Aguarde que os vídeos sejam processados automaticamente e um histograma de resultados e uma notificação de caixa de diálogo de conclusão sejam exibidos antes de clicar em OK.
- Uma vez que a caixa Configurações de exportação seja exibida, salve os resultados clicando em Exportar.
NOTA: Todos os resultados de vídeos e análises serão armazenados no arquivo de destino definido na etapa 10.2. Isso requer uma grande quantidade de armazenamento. Monitore e transfira para um dispositivo de armazenamento secundário, conforme necessário.
11. Re-análise da amostra atual em diferentes limiares de detecção
NOTA: Imediatamente após a análise do NTA (etapa 10), os dados podem ser reanalisados usando diferentes configurações de limiar de detecção. No entanto, o nível da câmera não pode ser modificado após a captura.
- Destaque todos os 5 vídeos de captura listados no Experimento Atual.
- Clique em Processar arquivos selecionados e aguarde que a caixa de confirmação de configuração apareça e a caixa Processe piscar para alterar o limiar de detecção.
- Ajuste o limiar de detecção para o nível desejado e clique em Definir OK.
- Aguarde que os vídeos sejam processados automaticamente e um histograma de resultados e uma notificação de caixa de diálogo de conclusão sejam exibidos antes de clicar em OK.
- Clique em Exportar configurações. Quando forem realizadas avaliações adicionais na amostra mais recente, certifique-se de clicar na caixa Resultados de Exportação no Experimento Atual , pois a caixa popup resultados de exportação não será exibida após a reavaliação da amostra.
NOTA: Como não há lembretes para fazer isso, ele pode ser facilmente negligenciado, e a análise será perdida. No entanto, os dados subjacentes permanecerão e podem ser reanalisados mais tarde.
12. Análise de arquivos arquivados
NOTA: Se os experimentos previamente analisados não tiverem sido salvos ou uma análise adicional for feita nessas amostras, os arquivos individuais podem ser recarregados no software NTA para avaliações adicionais do Limite de Detecção . As alterações do nível da câmera não podem ser modificadas após a captura.
- Carregue o software NTA da área de trabalho.
- Clique na guia Análise no painel do meio inferior.
- Clique em Abrir experimento e navegue até o arquivo .nano desejado.
NOTA: Os arquivos de vídeo associados ao experimento .nano selecionado devem estar na mesma pasta do arquivo principal do experimento; caso contrário, um erro aparecerá ao tentar processar os arquivos. Os primeiros 6 dígitos do nome do arquivo são a data em que o experimento foi executado (xx-xx-xx). Os últimos 6 dígitos do nome do arquivo são o momento em que o vídeo foi gravado (xx-xx-xx) e o identificador de vídeo individual. O arquivo PDF de cada experimento combinado lista os arquivos .nano incluídos para essa análise. - Clique em Processar arquivos selecionados para executar a análise.
- Uma vez que a caixa Processe piscar para permitir alterações no Limiar de Detecção, defina o limiar para o nível desejado e clique em OK.
- Aguarde que os vídeos sejam processados automaticamente e um histograma de resultados e uma notificação de caixa de diálogo de conclusão sejam exibidos antes de clicar em OK.
- Clique em Resultados de Exportação. Certifique-se de clicar na caixa Resultados de Exportação no Experimento Atual, pois a caixa pop-up resultados de exportação não será exibida após a re-análise.
NOTA: Como não há lembretes para fazer isso, ele pode ser facilmente negligenciado, e a análise será perdida.
13. Limpeza e desmontagem do módulo laser
- Desligue a caixa de controle a laser.
- Lave toda a amostra do módulo laser e descarte-a corretamente.
- Segure o módulo laser inclinado com a porta de seringa aberta elevada para permitir que o ar seja expurgado da câmara à medida que o DPBS é injetado lentamente no módulo laser e é liberado da porta da seringa de saída.
- Lave o DPBS restante do módulo laser e descarte.
- Repita a descarga mais 2 vezes e esvazie o módulo laser o mais completamente possível após a última descarga.
- Colocando pressão uniforme na tampa da célula de fluxo, afrouxar uniformemente os parafusos de polegar de forma diagonal alternada até desengatar dos fios, remover as parafusos e armazenar na caixa do módulo laser.
- Remova a tampa da célula de fluxo do módulo laser.
- Limpe as duas superfícies de vidro suavemente com um limpador de lentes de boa qualidade e papel de lente. Não use papel de tecido ou toalhas de papel em superfícies de vidro.
- Inspecione visualmente o módulo laser e a cobertura de células de fluxo "janelas" para arranhões ou imperfeições após o uso e reporte ao supervisor.
- Substitua o módulo laser e a tampa da célula de fluxo em suas caixas para evitar danos às superfícies de vidro durante o armazenamento.
14. Protocolo de análise de amostras
- Amostras não filtradas
- Vórtice a amostra antes de carregar e gravar vídeos de 5 x 60 s no Nível de Câmera 12 e Nível de Limite de Detecção 3 , conforme descrito acima. Reanalisar esses vídeos usando os Limites de Detecção 2 e 5.
- Repita as coleções de vídeo da mesma amostra nos Níveis de Câmera 13 e 14 e no Nível de Limite de Detecção 3. Reanalisar esses 2 vídeos adicionais usando os Limites de Detecção 2 e 5. Repita todo o processo usando vídeos de 5 x 30 s na configuração SOP .
- Amostras filtradas
- Vortex a amostra e, em seguida, simultaneamente carregá-la e filtrar -a (filtro de seringa de 0,22 μm) diretamente no módulo laser.
NOTA: O filtro de seringa foi lavado com 2 vezes o volume do espaço morto do filtro antes de ser usado para remover quaisquer partículas residentes. Os filtros de seringa (ver a Tabela de Materiais) tinham um espaço morto medido de 0,5 mL e foram lavados com 1,0 mL da amostra antes das medições. Observe o tipo de filtro nos campos de dados SOP . A amostra filtrada foi processada exatamente como descrito para amostras não filtradas na etapa 14.1.
- Vortex a amostra e, em seguida, simultaneamente carregá-la e filtrar -a (filtro de seringa de 0,22 μm) diretamente no módulo laser.
15. Análise estatística dos resultados da NTA
- Para a análise dos principais efeitos ou interações, realize a análise da variância após uma verificação das suposições ANOVA (normalidade, unimodal, homogeneidade de variância). Use Kruskal-Wallis unidirecional ANOVA em fileiras em casos de falha de suposições ANOVA.
- Após o retorno de efeitos principais significativos, use o método de Dunn para realizar testes de meios para comparações pré-planejadas. Considere um valor p de 0,05 para ser significativo em testes de duas caudas.
NOTA: Os arquivos de dados gerados aqui estão disponíveis pelos autores após a conclusão de um contrato de transferência de materiais.
Access restricted. Please log in or start a trial to view this content.
Resultados
A Tabela 1 contém os resultados dos vídeos NTA para as amostras de lipossomo (18 filtrados e 18 não filtrados) e um representante do DPBS diluente. As comparações entre os dois grupos foram concluídas independentemente do nível da câmera ou do limiar de detecção neste artigo. As amostras filtradas apresentaram diâmetro médio de partículas de 108,5 nm, um modo de partícula de 86,2 nm e uma concentração de 7,4 × 108 partículas/mL. Em contraste, as amostras não filtradas aprese...
Access restricted. Please log in or start a trial to view this content.
Discussão
Existem vários métodos disponíveis para estimar o tamanho e concentração das nanopartículas11. Estes incluem métodos de conjunto que geram uma estimativa de tamanho de uma população, incluindo dispersão dinâmica de luz (DLS), sedimentação centrífuga e microscopia de nível de partícula única, NTA, microscopia de força atômica e sensoriamento de pulso resistivo tíclico. Destes, DLS e NTA são amplamente utilizados, tamanho não destrutivo e métodos de medição de concentração...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Nenhum dos autores tem conflitos de interesse.
Agradecimentos
O trabalho foi apoiado pelo estado do Kansas para o Midwest Institute for Comparative Stem Cell Biology (MICSCB), o Johnson Cancer Research Center to MLW e NIH R21AG06488 para LKC. O OLS recebeu suporte gra do MICSCB. Os autores agradecem ao Dr. Santosh Aryal por fornecer os lipossomos utilizados neste projeto e aos membros dos laboratórios Weiss e Christenson por conversas úteis e feedback. Hong Ele é grato pelo apoio técnico. MLW agradece Betti Goren Weiss por seu apoio e conselho.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
Referências
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Consortium, E. -T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945(2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57(2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271(2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101(2013).
- Malvern analytical Ltd. NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639(2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados