需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
提高可重复性以满足细胞外囊泡研究的最少信息 2018纳米颗粒跟踪分析指南
摘要
纳米颗粒跟踪分析(NTA)是一种广泛使用的表征细胞外囊泡的方法。本文重点介绍了NTA实验参数和对照,以及样品和稀释剂的统一分析和表征方法,这是补充MISEV2018和EV-TRACK提出的实验室之间可重复性指南所必需的。
摘要
自2006年以来,纳米颗粒跟踪分析(NTA)一直是用于细胞外囊泡(EV)研究的几种表征方法之一。许多人认为,NTA仪器及其软件包可以在最少的培训后轻松使用,并且尺寸校准在内部是可行的。由于NTA采集和软件分析都构成了EV表征,因此在2018年细胞外囊泡研究的最小信息(MISEV2018)中进行了讨论。此外,它们还通过透明报告和集中细胞外囊泡研究(EV-TRACK)知识进行监测,以提高EV实验的稳健性(例如,最大限度地减少由于不受控制的因素引起的实验变异)。
尽管努力鼓励报告方法和控制,但许多已发表的研究论文未能报告重现原始NTA观察结果所需的关键环境。很少有论文报道阴性对照或稀释剂的NTA表征,显然假设市售产品,如磷酸盐缓冲盐水或超纯蒸馏水,是无颗粒的。同样,研究人员也很少报告阳性对照或尺寸标准来验证颗粒大小。斯托克斯-爱因斯坦方程结合了样品粘度和温度变量来确定颗粒位移。因此,在整个样品视频采集过程中报告稳定的激光室温度是准确复制的重要控制措施。样品或稀释剂的过滤也不是常规报告的,如果是这样,过滤器的细节(制造商,膜材料,孔径)和储存条件很少包括在内。国际细胞外囊泡学会(ISEV)可接受的实验细节的最低标准应包括用于EV表征的有据可查的NTA方案。以下实验提供了证据,证明NTA分析方案需要由个体研究人员建立,并包含在使用NTA表征作为满足MISEV2018单囊泡表征要求的选项之一的出版物方法中。
引言
对电动汽车和其他纳米级颗粒进行准确和可重复的分析给整个研究和行业带来了许多挑战。电动汽车研究的复制一直很困难,部分原因是报告与数据收集相关的必要参数缺乏统一性。为了解决这些缺陷,ISEV提出了行业指南,作为EV研究人员的最小生化,生物物理和功能标准集,并将其作为立场声明发布,通常称为MISEV20141。电动汽车研究步伐的加快需要更新指南,而"MISEV2018:ISEV的立场声明"扩展了MISEV2014指南2。MISEV2018论文包括表格,建议协议的概述以及记录特定EV相关表征的步骤。作为促进实验解释和复制的进一步措施,EV-TRACK被开发为众包知识库(http://evtrack.org),以实现EV生物学和用于已发表结果的方法的更透明报告3。尽管提出了这些关于方法标准化报告的建议,但该领域在复制和确认已公布的结果方面继续受到影响。
与美国国立卫生研究院和美国国家科学基金会在质量评估工具方面的努力相吻合,本文表明ISEV需要标准化的方法和细节报告,以便数据评估工具可以应用于实验室之间复制结果的目标。报告细胞源、细胞培养程序和 EV 分离方法是确定 EV 群体质量的重要因素。在NTA仪器中,检测设置,载体流体的折射率,导致多分散性的非均相颗粒群体,缺乏标准化的报告要求以及缺乏观察点内和观察者之间的测量结果等因素使得实验室之间的NTA比较变得困难或不可能。
自2006年开始使用以来,NTA是一种流行的纳米颗粒尺寸和浓度测定方法,目前约有80%的EV研究人员使用4。MISEV2018指南要求两种形式的单囊泡分析,其中NTA是流行的选择之一。NTA由于其广泛的可访问性,每个样品的低成本以及其直接的创始理论(斯托克斯 - 爱因斯坦方程)而继续被普遍用于EV表征。NTA的EV评估使用激光散射和布朗运动分析生成粒度分布和浓度估计,检测的下限由EV的折射率确定。当使用已知粘度和温度的流体样品时,将跟踪EV的轨迹以确定其在二维中的均方位移。这允许通过修正的斯托克斯 - 爱因斯坦方程5,6,7计算粒子扩散系数并将其转换为球面等效流体动力学直径。与其他表征方法相比,NTA的颗粒间分析在非均相EV群体中受到团聚物或更大颗粒的干扰较少7。虽然一些较大的颗粒对定量精度的影响很小,但即使微量的大的、高光散射颗粒的存在,由于软件EV检测和跟踪的减少,也会显著减少对较小颗粒的检测。作为一种测量技术,NTA通常被认为不偏向于较大的颗粒或颗粒聚集体,但可以通过单个颗粒分析9解决多个大小的群体。由于使用颗粒光散射,NTA分析的局限性之一是,与EV相比具有相似折射和尺寸属性的任何颗粒物(例如灰尘,塑料或粉末)都无法通过这种表征方法与实际EV区分开来。
NanoSight LM10(纳米颗粒尺寸分析仪)和LM14(激光模块)自2006年以来一直销售,尽管已经开发了该仪器的新型号,但这种特殊型号在许多核心设施中都可以找到,被认为是可靠的主力。需要进行培训以正确优化NTA设置,以实现高分辨率的尺寸和浓度测量。最佳视频录制所需的两个重要设置是(1)相机电平和(2)检测阈值。这些必须由操作员根据样品的特性进行设置。NTA分析的主要制约因素之一是建议样品浓度在107 和109 个颗粒/mL之间,要达到该样品稀释可能需要10个。用于稀释的溶液,如磷酸盐缓冲盐水、0.15 M盐水或超纯水,很少不含小于220μm的颗粒,这可能会影响NTA测量。用于稀释的溶液的NTA表征应在与正在分析的纳米颗粒样品相同的相机水平和检测阈值下进行。用于EV样品稀释的稀释剂中存在的纳米颗粒的大小和浓度很少包含在涉及EV的NTA分析的出版物中。
该协议使用合成EV样脂质体的NTA分析,这些脂质体使用选定的相机水平,检测阈值和样品的机械过滤来分析相机水平,检测阈值或样品过滤对NTA数据集的系统影响。脂质体的合成如 补充文件S1中所述。本实验使用合成脂质体,因为它们的尺寸均匀性,物理特性和在4°C下储存的稳定性。 虽然可以使用电动汽车的实际样品,但电动汽车在储存过程中的异质性和稳定性可能使这项研究及其解释复杂化。来自(A)脂质体和(B)EV的NTA报告中的相似性表明,本文中揭示的脂质体的系统效应可能也适用于EV表征(图1)。总之,这些发现支持了这样一种观点,即关键软件设置的完整报告和样品处理的描述,如稀释剂,稀释和过滤,会影响NTA数据的可重复性。
本文的目的是证明改变NTA设置(温度,相机水平和检测阈值)和样品制备会改变收集的结果:获得系统,显着的尺寸和浓度差异。由于NTA是满足MISEV2018表征规范的常用选项之一,这些结果证明了报告样品制备和NTA设置以确保可重复性的重要性。
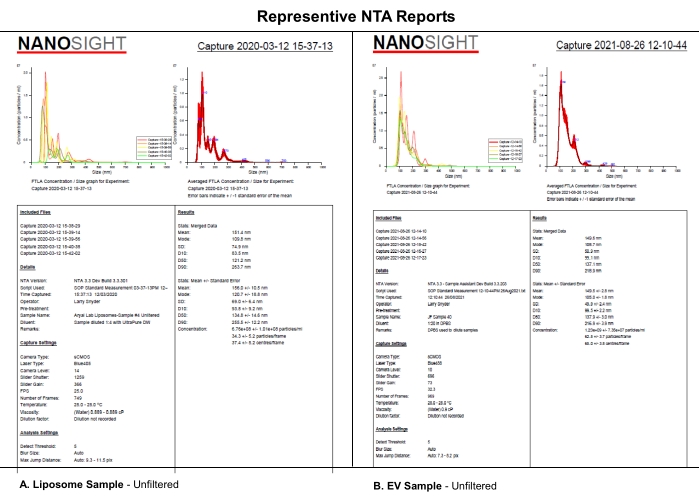
图1:代表性的NTA报告将脂质体与EV进行比较。 (A)脂质体:2020年3月12日在NTA上表征的未过滤样品。(B) EV:2021年8月26日在NTA上表征的未经过滤的样品。缩写:NTA =纳米颗粒跟踪分析;EV = 细胞外囊泡。 请点击此处查看此图的大图。
研究方案
1. 一般协议指南
- 将显微镜保持在空气工作台上,或至少在无振动工作台上。确保将无关的振动(例如,脚踩在地板上,触摸桌子,门关闭,实验室交通)保持在最低限度。
- 为所有视频录制设置并保持激光模块的温度恒定。
注意:选择的温度为25°C,因为纳米颗粒尺寸分析仪在该温度下进行了校准。因此,重要的是仪器的所有用户都知道并使用校准的温度。室温是不可接受的设置,因为它可能会有所不同。 - 确保所有稀释剂,也称为阴性对照(例如,Dulbecco的磷酸盐缓冲盐水(DPBS),超纯蒸馏水[DW]),都使用与被测纳米颗粒样品相同的相机水平和检测阈值进行NTA表征。使用表征的DPBS进行激光模块的冲洗和样品的稀释。如果阴性对照中的污染物水平显著,则将 DPBS 阴性对照中的污染物计入样品结果中。
- 在评估之前将样品储存在4°C,切勿冷冻它们,因为这会降解脂质体样品。在分析前将样品/标准品/稀释剂加热至室温30分钟。
注:样品处理特定于所检测的材料。 - 使用 快速测量 来评估样品和标准品,以建立适当的稀释度,以获得确定为NTA分析最佳的107 至109 颗粒/ mL(约50至100个颗粒/ NTA视频屏幕)。
注意:作者发现,该范围较高端的颗粒浓度会产生更一致和可重复的结果。 - 在 SOP 选项卡的"捕获"框中填写快速和标准测量的所有适用字段,包括使用的稀释度和稀释剂。
2. 制备50 nm和100 nm尺寸校准标准
注:请参阅 材料表。
- 50 nm尺寸转印标准品稀释1:5,000
- 将 2 μL 的 50 nm 标准品加入 9,998 μL 0.22 μm 过滤的 10 mM 氯化钾 (KCl)/0.03% 吐温 20 的超纯 DW 中,放入两次冲洗的 15 mL 锥形管中。将稀释的50nm标准品在4°C下储存长达一年。
- 100 nm尺寸转印标准稀释1:333
- 将30μL的100nm标准品加入9,970μL的0.22μm过滤的10mM KCl / 0.03%吐温20超纯DW中,放入两次冲洗的15mL锥形管中。将稀释的100nm标准品在4°C下储存长达一年。
3. 激光模块的清洁和组装
- 目视检查激光模块和流通池盖窗口是否有划痕或瑕疵。
注意:如果任一玻璃表面被划伤,成像可能会受到影响。 - 用优质的镜片清洁剂和镜片纸轻轻清洁两个玻璃表面。请勿在玻璃表面上使用纸巾或纸巾。
- 在装配之前,确保O形圈密封件正确安装在流通池盖的凹槽中。
- 将流通池盖放在激光模块上,确保电触点处于正确的方向。将4个弹簧加载的指旋螺钉穿过流通池板,并接合激光模块的螺纹,但不要单独拧紧。
- 在流通池盖上施加均匀的压力,以交替的对角线方式均匀拧紧指旋螺钉,直到紧贴。仅拧紧指旋螺钉直至手指紧绷。不要过度拧紧。
注:指旋螺钉的拧紧不均匀可能会使激光模块表面破裂。较新的设计指旋螺钉将在适当的压力下"触底反弹",避免可能的过度拧紧。
4. 激光模块在样品前和样品之间的冲洗程序
- 使用新打开的DPBS容器,等分试样放入三重冲洗的15 mL聚丙烯管中。确保用于冲洗或稀释样品的产品在使用前具有NTA特征(参见步骤1.3)。
- 用滑锁适配器用 1 mL DPBS 冲洗两个 1 mL 结核菌素注射器 3 次,以去除任何颗粒残留物。使用任一端口作为输入,但在试验期间一致地使用它。不要使用较大的注射器,因为注射器的重量和尺寸增加有破坏注射器端口的危险。
- 从第1个 结核菌素注射器中取出并丢弃柱塞,并将其插入剩余的端口以用作空隙稀释剂/样品储液器。
注意:不拆卸柱塞将导致样品室压力增加和密封件周围泄漏。 - 用1 mL DPBS填充第 2个注射器,并将其连接到流通池盖的入口端口。
- 保持激光模块倾斜,出口注射器端口升高,以便在DPBS缓慢注入激光模块时从腔室中清除空气。
- 通过将1 mL空气注入进气口,从激光模块中冲洗剩余的DPBS。重复冲洗2次以上。
- 在最后一次冲洗后,尽可能完全清空激光模块。
注意:在对50 nm标准进行NTA分析后,必须进行彻底,仔细的冲洗,因为这些颗粒会持续存在于激光模块中。激光模块现已准备就绪,可供使用。
5. 激光模块在显微镜载物台上的放置
- 将激光模块聚焦对准导轨定位在显微镜的臂上(图2),并使用聚焦旋钮对准它们。

图2:激光模块焦点对准指南。 请点击此处查看此图的大图。
- 面对显微镜,将激光模块放在凹槽载物台中,并尽可能向右轻轻滑动。
注意:如果仔细完成,样品之间的对准和焦点将更容易定位。 - 打开激光控制盒上的摇臂开关。
6. 激光模块的聚焦定位
注意:这必须使用腔室中的流体进行。
- 从桌面加载 NTA 软件(请参阅 材料表)。
注意:可能会出现错误:"在 COM3 上找不到温度 H/W"。只需关闭并重新打开软件即可修复它。 - 单击左上角框中"捕获"选项卡下的"启动相机"。如果相机在 5 分钟后自动关闭,只需再次单击"启动相机"即可重新启动它。
- 在同一选项卡中,将 相机级别 调整 为14至16 ,以增亮激光线并简化粒子识别和聚焦。
- 通过将头件左侧的顶部滑块移入或移出,将图像从相机转移到目镜。
- 查找密度增加的区域,通常称为 指纹。在视野中垂直居中并聚焦指纹。
注:激光线位于指纹的左侧。使房间变暗可能有助于定位指纹并专注于激光线。 - 将激光线在视野中居中;移动顶部滑块以将光线转移到照相机,如在计算机屏幕上观察到的那样。
注:现在屏幕上可见的激光线是目镜视图的镜像;目镜的左边将放在电脑屏幕上。 - 调整焦点以使用对焦旋钮锐化屏幕上单个移动粒子的图像。
注意:由于焦深,所有粒子都不会聚焦,这是可以接受的。即使是稍微失焦的粒子也会被相机捕获并由软件进行分析。
7. 将标准品/样品/稀释剂装入激光模块中以进行 NTA 分析
- 将 1 mL 标准品/样品/稀释剂吸入冲洗过的 1 mL 结核菌素注射器中,并将其连接到流通池盖的入口端口。推进柱塞,直到液体在连接到出口口的开放式注射器中明显可见。
- 在相机视图中,将激光线的右侧移动到具有均匀数量的粒子的区域。如有必要,请调整垂直方向以使水平光带居中。重新对焦,直到视图中粒子数量最多。确保对于所有后续措施,尽可能密切地保持此位置。
- 将 相机级别 调整到相机视图右上角的 "深色 "信息符号间歇性地打开和关闭的点。
注意:这有助于确保在每个数据收集系列的最小灵敏度级别下进行一致的相机级别选择。
注意: 相机级别 在拍摄过程中无法更改。
8. 校准验证
注:建议在样品分析之前使用尺寸标准品(见第2节)验证模块校准。常规验证对于确保准确测量是必要的。在多用户实验室中,单个用户对软件配置设置的调整可能会无意中导致数据收集不准确。对于关键数据收集,日常验证是实验室的良好实践问题。验证的日常可重复性需要包括在报告的结果中。通常,校准由技术人员设置,除非用户具有管理员访问权限,否则单个用户无法调整校准。这可以防止单个用户进行未经授权的重新配置。
- 将稀释的标准品(见第2节)加热至室温30分钟。
- 简要涡旋标准,然后按第 7 节所述加载。
- 按照第10节所述执行样本NTA,并记录值以随后计算变异系数,如果正确校准,变异系数应小于2%。
9. 优化 NTA 的样品浓度
注意:当相机液位和样品浓度正确调整时,屏幕应包含50至100个可测量颗粒。如果对样品是否具有适当的颗粒编号有任何疑问,此时可以对样品进行 快速测量 (请参阅步骤9.1至9.7)。它用于在较长的视频捕获之前快速评估样品特性。" 快速测量 "选项卡位于底部中间框的 SOP 选项卡中。
- 将 拍摄持续时间 设置为 30 秒。
- 接受现有基本文件名,或通过单击生成的数据的新存储站点的" ..." 选项卡输入新文件名。
- 选中 目标温度 框并输入所需温度。
- 按照前面所述加载示例(步骤 7.1),然后单击" 创建并运行脚本"。
- 等待30秒视频完成后,每帧粒子数显示在视频屏幕的右下角。如果颗粒数大于100,则冲洗激光模块3次(如前面的步骤4.6中所述)。
- 使用表征的稀释剂将样品稀释至所需的浓度范围。
- 将适当稀释的样品装入冲洗的激光模块并运行 快速测量 以验证样品是否在可接受的范围内。
10. 示例 NTA
注:" 标准测量 "选项卡位于底部中间框的 SOP 选项卡中,用于常规样品分析(参见步骤10.1至10.12)。
- 将持续时间设置为 30 或 60 秒 ,将视频数设置为 5。
- 接受现有基本文件名,或通过单击生成的数据的新存储站点的" ..." 选项卡输入新文件名。
- 选中 目标温度 框并输入所需温度。
- 单击" 创建脚本" 以重复使用此 标准度量。
- 按照第 7 节中所述加载示例并准备好运行实验后,单击" 创建并运行脚本"。
- 填写 "设置报告详细信息" 弹出屏幕中的字段,其中包含有关操作员、样品描述、样品稀释度和所用稀释剂的信息。
注意:这些信息将被记录并打印在最终的实验报告中。 - 填写完所有所需字段后,单击" 确定 "启动脚本。
注意:如果选择了 目标温度 ,加热器会将激光模块中的样品稳定到所需温度5秒,然后允许脚本继续进行测量。屏幕左下角的诊断面板将显示加热器打开并显示样品的温度。 - 在每次视频捕获之前,请查找手动 推进 柱塞的提示。将〜0.05 mL样品注入激光室,让颗粒"静止"(即不流动),然后单击 "确定"。
- 等待第 5 次视频捕获完成后出现"设置确认"框,并等待"进程"框闪烁。设置用于处理样品的检测阈值,方法是在从视频屏幕底部手动推进帧时,注意屏幕上标记颗粒的蓝色十字的数量。如果随着帧的推进,每个屏幕上有超过 3-4 个蓝色十字标记粒子,请增加检测阈值。
注意:单个颗粒上的蓝色十字类似于流式细胞术中的"群"效应,应将其最小化,以实现数据收集的最佳准确性和可重复性。 - 当检测阈值可接受时,单击 "设置确定 "。
- 等待视频自动处理并显示结果直方图和完成对话框通知,然后单击 "确定"。
- 出现 "导出设置" 框后,单击" 导出"保存结果。
注意:视频和分析的所有结果都将存储在步骤 10.2 中定义的目标文件中。这需要大量的存储空间。根据需要监视并传输到辅助存储设备。
11. 在不同检测阈值下重新分析当前样品
注意:在 NTA 分析(步骤 10)之后,可以使用不同的检测阈值设置重新分析数据。但是,无法在捕获后修改 相机级别 。
- 突出显示 当前实验中列出的所有 5 个捕获视频。
- 单击" 处理选定的文件",然后等待" 设置确认 "框出现,并闪烁 "进程"框 以更改 检测阈值。
- 将 检测阈值 调整到所需水平,然后单击 设置确定。
- 等待视频自动处理并显示结果直方图和完成对话框通知,然后单击 "确定"。
- 单击导出设置。对最新样本执行其他评估时,请务必单击"当前实验"中的"导出结果"框,因为在示例重新分析后,将不会显示"导出结果"弹出框。
注意:由于没有提醒这样做,因此很容易被忽略,并且分析将丢失。但是,基础数据将保留,并且可以在以后重新分析。
12. 存档文件分析
注意:如果先前分析的实验尚未保存,或者需要对这些样品进行其他分析,则可以将各个文件重新加载到NTA软件中以进行额外的 检测阈值 评估。 相机级别 更改无法在捕获后修改。
- 从桌面加载 NTA 软件。
- 单击中下面板中的 分析 选项卡。
- 单击" 打开实验 "并导航到所需的 .nano 文件。
注意:与所选 .nano 实验关联的视频文件必须与主实验文件位于同一文件夹中。否则,在尝试处理文件时将出现错误。文件名的前 6 位数字是运行实验的日期 (xx-xx-xx)。文件名的最后 6 位数字是录制视频的时间 (xx-xx-xx) 和单个视频标识符。每个组合实验的 PDF 文件列出了用于该分析的 .nano 文件。 - 单击" 处理所选文件" 以运行分析。
- "进程"框闪烁以允许更改"检测阈值"后,将阈值设置为所需级别,然后单击"确定"。
- 等待视频自动处理并显示结果直方图和完成对话框通知,然后单击 "确定"。
- 单击导出结果。请务必单击"当前实验"中的"导出结果"框,因为在重新分析后将不会显示"导出结果"弹出框。
注意:由于没有提醒这样做,因此很容易被忽略,并且分析将丢失。
13. 激光模块的清洗和拆卸
- 关闭激光控制盒。
- 从激光模块中冲洗整个样品并正确丢弃。
- 保持激光模块倾斜,打开的注射器端口升高,以便在DPBS缓慢注入激光模块并从出口注射器端口冲洗时,将空气从腔室中清除。
- 从激光模块中冲洗剩余的DPBS并丢弃。
- 重复冲洗2次以上,并在最后一次冲洗后尽可能完全清空激光模块。
- 在流通池盖上施加均匀的压力,以交替的对角线方式均匀松开指旋螺钉,直到脱离螺纹,取下指旋螺钉,并存放在激光模块外壳中。
- 从激光模块上取通池盖。
- 用优质的镜片清洁剂和镜片纸轻轻清洁两个玻璃表面。请勿在玻璃表面上使用薄纸或纸巾。
- 使用后目视检查激光模块和流通池盖"窗口"是否有划痕或瑕疵,并向主管报告。
- 更换激光模块和流通池盖,以防止在储存过程中损坏玻璃表面。
14. 样品分析方案
- 未经过滤的样品
- 在加载之前涡旋样品,并如上所述在相机级别12和检测阈值级别3处录制5 x 60 s视频。使用检测阈值 2 和 5 重新分析这些视频。
- 在相机级别 13 和 14 以及检测阈值级别 3 重复同一样本的视频收集。使用检测阈值 2 和 5 重新分析这 2 个附加视频。在SOP设置中使用5 x 30 s视频重复整个过程。
- 过滤样品
- 涡旋样品,然后同时将其加载并过滤(0.22μm注射器过滤器)直接放入激光模块中。
注意:注射器过滤器在使用前用2倍于过滤器死区体积的体积冲洗,以去除任何滞留颗粒。注射器过滤器(见 材料表)的测量死区为0.5 mL,并在测量前用1.0 mL样品冲洗。请注意 SOP 数据字段中的筛选器类型。过滤后的样品完全按照步骤14.1中未过滤样品的描述进行处理。
- 涡旋样品,然后同时将其加载并过滤(0.22μm注射器过滤器)直接放入激光模块中。
15. NTA结果的统计分析
- 对于主效应或相互作用的分析,在检查方差分析假设(正态性、单峰、方差的同质性)之后,执行方差分析。在方差分析假设失败的情况下,对秩使用 Kruskal-Wallis 单因子方差分析。
- 在返回显著主效应之后,使用 Dunn 方法执行均值测试以进行预先计划的比较。将 p 值 0.05 视为在双尾检验中显著。
注:此处生成的数据文件可在材料转让协议完成后从作者处获得。
结果
表1 包含脂质体样品(18个过滤和18个未过滤)和代表性DPBS稀释剂的NTA视频的结果。无论相机水平或检测阈值如何,两组之间的比较都已完成。过滤样品的平均粒径为108.5 nm,颗粒模式为86.2 nm,浓度为7.4×108 颗粒/mL。相比之下,未过滤样品的平均粒径为159.1 nm,颗粒模式为105.7 nm,浓度为7.6×108 个颗粒/mL。无论相机水平或检测阈值如何,滤波和未滤波样本的均值和模式?...
讨论
有几种方法可用于估计纳米颗粒的大小和浓度11。这些包括从群体生成尺寸估计值的集合方法,包括动态光散射(DLS),离心沉降和单颗粒水平分析电子显微镜,NTA,原子力显微镜和可调谐电阻脉冲传感。其中,DLS和NTA是广泛使用的无损尺寸和浓度测量方法,基于布朗运动的理想介质。DLS依赖于光的散射,强度与粒子体积的平方成正比。因此,DLS比NTA对大颗粒,聚集体或多分散?...
披露声明
作者均无任何利益冲突。
致谢
这项工作得到了堪萨斯州对中西部比较干细胞生物学研究所(MICSCB),约翰逊癌症研究中心对MLW和NIH R21AG066488对LKC的支持。OLS得到了MICSCB的GRA支持。作者感谢Santosh Aryal博士提供本项目中使用的脂质体,并感谢Weiss和Christenson实验室的成员进行有益的对话和反馈。感谢何鸿博士的技术支持。MLW感谢Betti Goren Weiss的支持和建议。
材料
| Name | Company | Catalog Number | Comments |
| Automatic Pipetter | |||
| Centrifuge Tubes, Conical, Nunc 15 mL | Thermo Sci. | 339650 | |
| Kimwipes | |||
| Lens Cleaner | |||
| Lens Paper | |||
| NanoSight LM-10 | Malvern Panalytical | ||
| NanoSight LM-14 Laser Module | Malvern Panalytical | ||
| Nanosight NTA Software Ver. 3.2 | Malvern Panalytical | ||
| Paper Towels | |||
| Pipette Tips, 1-200 µL, Filtered, Sterile, Low Binding | BioExpress | P -3243-200X | |
| Pipette Tips, 50-1,000 µL, Filtered, Sterile | BioExpress | P-3243-1250 | |
| Saline, Dulbecco's Phosphate Buffered (No Ca or Mg) | Gibco | 14190-144 | |
| Standards, Latex Transfer- 100 nm (3 mL) | Malvern | NTA4088 | |
| Standards, Latex Transfer- 50 nm (3 mL) | Malvern | NTA4087 | |
| Syringe Filter, 33 mm, .22 µm, MCE, Sterile | Fisher brand | 09-720-004 | |
| Syringe, TB, 1 mL, slip tip | Becton Dickinson | 309659 | |
| Waste fluid container |
参考文献
- Lotvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), (2014).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Gardiner, C., et al. Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey. Journal of Extracellular Vesicles. 5, 32945 (2016).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Kestens, V., Bozatzidis, V., De Temmerman, P. J., Ramaye, Y., Roebben, G. Validation of a particle tracking analysis method for the size determination of nano- and microparticles. Journal of Nanoparticle Research. 19 (8), 271 (2017).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27 (5), 796-810 (2010).
- Hole, P., et al. Interlaboratory comparison of size measurements on nanoparticles using nanoparticle tracking analysis (NTA). Journal of Nanoparticle Research. 15 (12), 2101 (2013).
- Malvern analytical Ltd. . NanoSight LM10 Operating Manual-P550H. , (2013).
- Kim, A., Ng, W. B., Bernt, W., Cho, N. J. Validation of size estimation of nanoparticle tracking analysis on polydisperse macromolecule assembly. Scientific Reports. 9 (1), 2639 (2019).
- Gollwitzer, C., et al. A comparison of techniques for size measurement of nanoparticles in cell culture medium. Analytical Methods. 8 (26), 5272-5282 (2016).
- vander Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。