Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Registro de transitorios de calcio en unión neuromuscular de ratón con alta resolución temporal mediante microscopía confocal
En este artículo
Resumen
El protocolo describe el método de carga de un tinte de calcio fluorescente a través del nervio cortado en las terminales nerviosas motoras del ratón. Además, se presenta un método único para registrar transitorios rápidos de calcio en las terminaciones nerviosas periféricas mediante microscopía confocal.
Resumen
La estimación del nivel de calcio presináptico es una tarea clave en el estudio de la transmisión sináptica, ya que la entrada de calcio en la célula presináptica desencadena una cascada de eventos que conducen a la liberación de neurotransmisores. Además, los cambios en los niveles de calcio presináptico median la actividad de muchas proteínas intracelulares y juegan un papel importante en la plasticidad sináptica. El estudio de la señalización del calcio también es importante para encontrar formas de tratar las enfermedades neurodegenerativas. La unión neuromuscular es un modelo adecuado para estudiar la plasticidad sináptica, ya que tiene un solo tipo de neurotransmisor. Este artículo describe el método para cargar un tinte sensible al calcio a través del haz de nervios cortado en las terminaciones nerviosas motoras de los ratones. Este método permite la estimación de todos los parámetros relacionados con los cambios intracelulares de calcio, como el nivel de calcio basal y el calcio transitorio. Dado que la afluencia de calcio desde el exterior de la célula hacia las terminales nerviosas y su unión / desunión al tinte sensible al calcio ocurre dentro del rango de unos pocos milisegundos, se requiere un sistema de imágenes rápido para registrar estos eventos. De hecho, las cámaras de alta velocidad se utilizan comúnmente para el registro de cambios rápidos de calcio, pero tienen parámetros de baja resolución de imagen. El protocolo presentado aquí para el registro transitorio de calcio permite una resolución espacio-temporal extremadamente buena proporcionada por microscopía confocal.
Introducción
El problema de medir las ondas rápidas de calcio en las células excitables es uno de los aspectos más importantes y desafiantes del estudio de la transmisión de señales en los sistemas nerviosos central y periférico. Los iones de calcio juegan un papel importante en el desencadenamiento de la liberación de neurotransmisores, la plasticidad sináptica y la modulación de la actividad de varias proteínas intracelulares 1,2,3,4,5. El estudio de la señalización del calcio también es importante para encontrar formas de tratar las enfermedades neurodegenerativas6. Para medir los cambios en los niveles de calcio, se utilizan comúnmente colorantes fluorescentes sensibles al calcio, y se analizan los cambios en su nivel de fluorescencia 7,8,9.
La carga de colorantes de calcio en las células se puede lograr de diferentes maneras. Predominantemente, se utilizan colorantes perfeccionados por células10,11. Sin embargo, en tal caso, no solo es difícil controlar la concentración de un tinte dentro de la célula, sino que también es difícil seleccionar las células objetivo para la carga. Este método no es aplicable para estudiar las terminaciones nerviosas periféricas ya que el tinte entra en las células postsinápticas. En cambio, los tintes impermean celulares son más adecuados para tales preparaciones. En este caso, los colorantes se administran a las células mediante microinyección o a través de una pipeta de parche12,13,14. También hay un método de carga a través de un muñón nervioso. Este último método es el más adecuado para preparaciones de unión neuromuscular 15,16,17,18,19,20. Permite realizar tinción solo para células de interés. Aunque este método no proporciona una evaluación precisa de la concentración del colorante en la célula diana, la concentración puede estimarse aproximadamente comparando el nivel de fluorescencia de las células en reposo en soluciones con una concentración conocida de calcio21. En este estudio, se presenta una modificación de este método aplicado a las sinapsis de mamíferos.
La entrada de calcio durante la fase de despolarización del potencial de acción es un proceso rápido, especialmente en la unión neuromuscular; Por lo tanto, para su registro, se requiere el equipo adecuado1. Un estudio reciente que utilizó un tinte fluorescente sensible al voltaje demostró que la duración del potencial de acción en la sinapsis periférica de un ratón es de aproximadamente 300 μs22. El calcio transitorio, evaluado utilizando colorantes sensibles al calcio en las sinapsis periféricas de la rana, tiene una duración más larga: el tiempo de subida es de aproximadamente 2-6 ms y el tiempo de descomposición es de aproximadamente 30-90 ms, dependiendo del colorante de calcio utilizado23,24. Para medir procesos rápidos con la ayuda de tintes fluorescentes, generalmente se utilizan cámaras CCD o CMOS, con matrices CCD rápidas y sensibles. Sin embargo, estas cámaras tienen la desventaja de baja resolución, limitada por el tamaño de los elementos sensibles de la matriz25,26,27,28. Las cámaras más rápidas con sensibilidad suficiente para registrar tanto potenciales de acción como transitorios de calcio en respuesta a la estimulación de baja frecuencia de las células tienen una frecuencia de barrido de 2.000 Hz, y una matriz con una dimensión de 80 x 8029. Para obtener señales con una mayor resolución espacial, se utiliza microscopía confocal, especialmente si es necesario evaluar algunos cambios volumétricos en la señal30,31,32. Pero debe tenerse en cuenta que la microscopía confocal tiene una alta velocidad de escaneo en modo de escaneo en línea, pero todavía existen limitaciones significativas en la velocidad de grabación de procesos rápidos al construir una imagen espacial33. Existen microscopios confocales basados en discos giratorios de Nipkow (microscopía de barrido de hendidura) y escáneres multipunto-array, que tienen una mayor velocidad de barrido. Al mismo tiempo, son inferiores a los microscopios confocales clásicos en el filtrado de imágenes confocales (diafonía estenopeica para microscopios con un disco de Nipkow)32,34,35. La imagen confocal con escaneo de resonancia también puede proporcionar una alta resolución espacio-temporal requerida para mediciones temporales altas36. Sin embargo, tenga en cuenta que el registro de respuestas fluorescentes débiles a una alta velocidad de escaneo cuando se utilizan escáneres de resonancia requiere detectores altamente sensibles como los detectores híbridos36.
Este artículo presenta un método para aumentar la resolución temporal de las señales registradas con la Microscopía Confocal de Barrido Láser (LSCM) manteniendo la resolución espacial37. El método actual es un desarrollo adicional de los métodos descritos anteriormente y transferidos a la plataforma LSCM38,39,40. Este enfoque no requiere cambios en el hardware del microscopio y se basa en la aplicación de un algoritmo para registrar periódicamente señales fluorescentes evocadas con un cambio de tiempo relativo al momento de la estimulación.
Protocolo
Los experimentos se realizaron en preparaciones nerviosas-musculares aisladas de elevador del auris largo (m. LAL) de los ratones BALB/C (20-23 g, 2-3 meses de edad)41. Los procedimientos experimentales se realizaron de acuerdo con las directrices para el uso de animales de laboratorio de la Universidad Federal de Kazán y la Universidad Médica de Kazán, de conformidad con la Guía de los NIH para el cuidado y uso de animales de laboratorio. El protocolo experimental cumplió con los requisitos de la Directiva 86/609/CEE del Consejo de las Comunidades Europeas y fue aprobado por el Comité de Ética de la Universidad Médica de Kazán.
1. Preparación de las soluciones de Ringer y Filing
- Prepare la solución de Ringer para el músculo de mamífero mezclando los siguientes ingredientes: NaCl (137 mM), KCl (5 mM), CaCl 2 (2 mM), MgCl 2 (1 mM), NaH2 PO4 (1 mM), NaHCO3 (11.9 mM) y glucosa (11 mM). Burbujear a través de la solución con 95% de O2 y 5% deCO2 y ajustar su pH a 7.2-7.4 agregando HCl / NaOH si es necesario.
- Prepare la solución de carga de tinte.
- Prepare la solución HEPES (10 mM) con pH en el rango de 7.2-7.4. 500 μg de colorante comercial viene en un vial de 500 μL. Disolver el colorante en 14 μL de la solución HEPES para obtener una concentración de colorante de 30 mM. Agitar bien y centrifugar hasta que se disuelva totalmente.
- Diluir la solución del indicador de Ca2+ con solución HEPES hasta una concentración de 1 mM. Guárdelo en un congelador (-20 °C) y evite la exposición a la luz.
2. Procedimiento de carga de tinte
NOTA: El procedimiento de carga de tinte se realiza de acuerdo con el protocolo de carga a través del muñón nervioso, adaptado de los protocolos publicados anteriormente 19,42,43,44,45,46.
- Diseccionar el músculo LAL de acuerdo con el procedimiento de disección para esta preparación como se describe en los protocolos publicados anteriormente47,48.
- Fije el tejido ligeramente estirado (no más del 30% de la longitud inicial) en la placa de Petri recubierta de elastómero con pasadores finos de acero inoxidable y agregue la solución de Ringer hasta que el músculo esté completamente cubierto.
NOTA: La placa de Petri fue precargada con elastómero de acuerdo con las instrucciones del fabricante (ver Tabla de materiales).
- Fije el tejido ligeramente estirado (no más del 30% de la longitud inicial) en la placa de Petri recubierta de elastómero con pasadores finos de acero inoxidable y agregue la solución de Ringer hasta que el músculo esté completamente cubierto.
- Preparar la pipeta de relleno
- Utilizando un extractor de micropipetas (ver Tabla de materiales), prepare una micropipeta con una punta fina que sea lo más afilada posible para los registros intracelulares. Utilizar capilares sin filamentos internos (1,5 mm de diámetro exterior y 0,86 o 1,10 mm de diámetro interior).
- Romper la punta de la micropipeta después de anotar el cono con un abrasivo, dejando la punta abierta a unos 100 μm de diámetro. Pule al fuego la punta hasta el límite cuando el diámetro interno se reduzca de >80 μm a 12-13 μm. Coloque un tubo de silicona en un lado de la pipeta de llenado y una jeringa (sin aguja) en el otro lado.
- Bajo un microscopio estereoscópico, encuentre el lugar donde el tronco nervioso se convierte en ramas nerviosas separadas. Coloque la pipeta de llenado con el tubo montado y la jeringa en la placa de Petri con cera. Mueva la punta de la pipeta hasta que quede por encima del nervio.
- Con tijeras finas, corte el nervio cerca de la fibra muscular, dejando un pequeño trozo del muñón del nervio de aproximadamente 1 mm de largo. Aspire suavemente el muñón nervioso junto con un poco de solución de Ringer, sin pellizcarlo, en la punta de la pipeta de relleno. Retire el tubo de silicona de la pipeta de llenado.
- Extraiga cierta cantidad de la solución de carga de tinte (~0.3 μL) usando una jeringa con un filamento largo. Este volumen corresponde a aproximadamente 3 cm del filamento.
NOTA: Inicialmente, es necesario hacer un filamento a partir de una punta de pipeta con un volumen de 10 μL tirando del fuego con una lámpara de alcohol o un quemador de gas. - Inserte suavemente la punta del filamento con solución de carga en la pipeta de llenado. Suelte la mezcla directamente sobre el muñón nervioso. Incubar la preparación a temperatura ambiente en la oscuridad durante 30 min.
- Después de eso, enjuague la preparación con la solución fresca de Ringer e incube a 25 °C durante un máximo de 2 h en un vaso de precipitados de vidrio con 50 ml (o más) de solución de Ringer (la preparación debe cubrirse con la solución). Durante este tiempo, el tinte llegará a las sinapsis.
3. Captura de vídeo con microscopía confocal
NOTA: El registro de transitorios de calcio se realiza con un microscopio confocal de barrido láser (LSCM) (consulte la Tabla de materiales). Para registrar transitorios rápidos de calcio, se utilizó un protocolo original que permitía grabaciones de señales con una resolución espacial y temporal suficiente. El método ha sido descrito a fondo en la publicación de Arkhipov et al37. El microscopio estaba equipado con un objetivo de inmersión en agua 20x (1.00 NA). La línea láser de 488 nm se atenuó al 10% de intensidad y la fluorescencia de emisión se recogió de 503 a 558 nm.
- Monte la preparación en la cámara experimental recubierta de elastómero de silicio y fíjela, ligeramente estirada, con un conjunto de microagujas de acero. Enjuague ampliamente la preparación con la solución de Ringer.
NOTA: Se utilizó una cámara experimental de perfusión simple hecha a medida hecha de vidrio orgánico con el fondo de la cámara cubierto con un elastómero (preparado de acuerdo con las instrucciones del fabricante; consulte la Tabla de materiales). La cámara tiene un tubo de suministro de solución. La solución se bombea a través de una aguja de jeringa, montada en un soporte magnético (consulte la Tabla de materiales). Como cámara experimental, se podría usar una placa de Petri (como la utilizada para la incubación de la preparación) pero con tubos de suministro y succión adjuntos. - Instale un electrodo de succión que se utilizará para estimular el nervio.
NOTA: La construcción del electrodo es similar a lo que se publicó en el artículo de 2015 por Kazakov et al49. Coloque y fije el electrodo encerándolo al lado del baño. Mueva la punta cerca del muñón nervioso y aspire en el electrodo. - Monte la cámara de preparación en la platina del microscopio y coloque los accesorios de entrada y salida en la cámara.
- Para perfundir la preparación, use un sistema simple impulsado por flujo por gravedad. Encienda la bomba de succión de perfusión para eliminar el exceso de solución.
- Conecte el electrodo de succión estimulante en un estimulador eléctrico y asegúrese de que las contracciones musculares se produzcan después de los estímulos. Ver sección 3.9-3.12 para las condiciones de estimulación y registro.
- Llene el sistema de perfusión con la solución de Ringer con d-tubocurarina (10 μM).
NOTA: Esta solución ayuda a prevenir las contracciones musculares. Los bloqueadores específicos de la D-tubocurarina o de la alfa-bungarotoxina de los receptores nicotínicos de acetilcolina en la membrana postsináptica bloquearían total o parcialmente las contracciones musculares50. Además, para prevenir las contracciones musculares, se podrían utilizar bloqueadores específicos de los canales de sodio postsinápticos, como la μ-conotoxina GIIIB51. - Encienda la bomba de aspiración de perfusión y comience la perfusión de la preparación con la solución de Ringer que contiene d-tubocurarina.
- Establezca los parámetros de imagen en el software LSCM de la siguiente manera.
- En el software LSCM (LAS AF; consulte Tabla de materiales), elija Electrofisiología.
NOTA: En este modo, cuando se captura una imagen en el punto de tiempo, se envía un pulso de sincronización al estimulador con la ayuda de la caja de disparo. Esto provoca la generación de potencial de acción en la preparación (Figura 1; unidad estimuladora). - Seleccione Modo de adquisición. Para activar el estimulador mediante el pulso de sincronización del microscopio, en la configuración del menú Trabajo , seleccione la configuración del disparador . Establezca el campo Trigger Out On Frame (Desencadenador en el fotograma) en el canal out1 .
- Utilice los siguientes ajustes: Modo de escaneo: XYT, Frecuencia de escaneo: 1400 Hz, Factor de zoom: 6.1, Pinhole: completamente abierto. Asegúrese de que el modo X bidireccional de transpaso secuencial esté activado.
- Establezca un tiempo mínimo para formar un fotograma a 52 ms y fotogramas a recopilar en un vídeo sin procesar a 20 fotogramas.
NOTA: Esta configuración permite la captura de imágenes con una resolución de 128 x 128 píxeles mientras se toma un solo fotograma cada 52 ms. - Ajuste la longitud de onda de excitación del láser de argón a 488 nm con un 8% de potencia de salida.
- En el software LSCM (LAS AF; consulte Tabla de materiales), elija Electrofisiología.

Figura 1: El esquema de la configuración experimental. 1. Microscopio confocal de barrido láser (LSCM). 2. Módulo de sincronización de LSCM (caja de disparo). 3. Estimulador. 4. Unidad de aislamiento. 5. La muestra biológica. 6. Electrodo de succión para la estimulación eléctrica del nervio. 7. Sistemas de perfusión (7a: depósito de perfusión, 7b: gotero, 7c: regulador de flujo, 7d: matraz de vacío). Las flechas apuntan a la dirección de propagación del pulso de sincronización. Haga clic aquí para ver una versión más grande de esta figura.
- Presione el botón Live Mode para cambiar al modo Live, lo que ayuda a obtener una vista previa de los terminales nerviosos cargados con el tinte.

Figura 2: Nervio del ratón y terminales cargados con el indicador Ca2+. Haga clic aquí para ver una versión más grande de esta figura.
- Unidad de estimulación
NOTA: En este trabajo se utilizó el estimulador descrito en el artículo de Land et al.52 . Este dispositivo permite establecer parámetros temporales de estimulación a través del software MatLab.- Cree un nuevo archivo, pegue el código del artículo mencionado anteriormente en la ventana de código de MatLab y guarde el archivo. Haga clic en Ejecutar, para que aparezca una ventana con parámetros de estimulación. Establezca el tiempo de retardo y la duración del estímulo.
NOTA: El retardo determina la resolución temporal de la señal fluorescente reconstituida. El pulso eléctrico de 0,2 ms de duración se retrasa y luego se envía a la unidad de aislamiento. Este último forma la amplitud y polaridad del pulso estimulante y aísla eléctricamente el objeto biológico del equipo de grabación. - Para estimular el nervio, seleccione la amplitud supramáxima del impulso estimulante (25% -50% mayor que la intensidad máxima de estimulación necesaria para activar todas las fibras nerviosas).
NOTA: El método presentado se basa en un algoritmo especial para grabaciones de señales fluorescentes rápidas individuales utilizando LSCM con el barrido minimizado. En cada paso del algoritmo desarrollado, la señal fluorescente registrada se desplaza de la anterior por un intervalo de tiempo que es más corto que el barrido del microscopio. El valor de los desplazamientos de tiempo determina la resolución temporal de la señal requerida. El número de pasos (desplazamientos) en el algoritmo depende de la resolución temporal requerida y la resolución temporal original. Con este método de registro, la estimulación de la preparación se lleva a cabo con una frecuencia de 0,25 Hz.
- Cree un nuevo archivo, pegue el código del artículo mencionado anteriormente en la ventana de código de MatLab y guarde el archivo. Haga clic en Ejecutar, para que aparezca una ventana con parámetros de estimulación. Establezca el tiempo de retardo y la duración del estímulo.
- En el modo Live, busca el ROI y obtén el mejor enfoque. Ejecute el software de adquisición de datos.
- Cambie el retardo del estimulador 2 ms menos en relación con el valor anterior y ejecute el software de adquisición de datos.
- Repita el paso 3.11 26 veces para adquirir 26 secuencias, con cada secuencia desplazada 2 ms de la anterior.
4. Procesamiento de video
NOTA: Una serie de imágenes de vídeo adquiridas por el microscopio confocal se exporta en formato TIFF con el software libre LAS X (ver Tabla de Materiales). Esta serie se dividió en marcos y se exportó a una carpeta. Para generar la secuencia de imágenes con mayor resolución temporal, se utilizó el software ImageJ, que tiene un código inicial abierto para el análisis y procesamiento de los datos. El algoritmo de procesamiento de señales se representa esquemáticamente en la Figura 3.
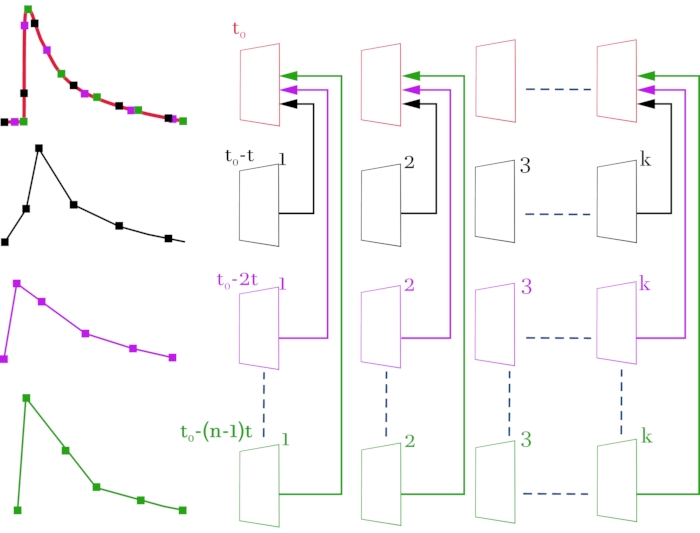
Figura 3: Esquema para compilar un archivo de vídeo de alta resolución (2 ms en fotograma) a partir de archivos de vídeo originales con una resolución temporal baja (52 ms en fotograma). Los archivos de vídeo originales y las señales correspondientes están coloreados en negro, magenta y verde. El archivo de vídeo compilado y la señal resultante son de color rojo. El esquema de la derecha, línea por línea, muestra las imágenes de video obtenidas con un microscopio confocal. A la izquierda, las señales correspondientes de fluorescencia cambian del ROI seleccionado. La línea superior se forma cuadro por cuadro a partir de los marcos recibidos de acuerdo con el esquema. El resultado es una imagen de vídeo que consiste en toda la matriz de fotogramas para que haya un tiempo de retardo de 2 ms entre fotogramas en lugar de 52 ms. Cada línea corresponde a un desplazamiento de la señal de estimulación por (n - 1) * t, donde t es el cambio de tiempo (2 ms), y n es el número de iteraciones de desplazamiento. k indica el número de fotogramas en los archivos de vídeo originales (líneas 2-4) y depende de la duración de la señal grabada. En este caso, para registrar una señal con una duración de 1 s, es necesario seleccionar k = 20 (52 ms * 20 = 1040 ms). t0 es el retraso requerido antes de la estimulación. Para calcular el número de iteraciones de desplazamiento n, la resolución temporal inicial entre fotogramas (52 ms) debe dividirse por la resolución temporal requerida (2 ms). En este caso, n = 26, que corresponde a 26 barridos registrados. Como resultado de las manipulaciones realizadas, se obtiene una imagen de video que consta de n * k = 520 cuadros. Haga clic aquí para ver una versión más grande de esta figura.
- Ejecute el software LAS X. Abra el proyecto que se creó durante la realización del experimento. Haga clic en Exportar y, a continuación, en Guardar como para guardar fotogramas en formato .tiff en la carpeta de destino.
- Ejecute el software ImageJ. Haga clic en Archivo > importar > secuencia de imágenes.
- En la ventana Abrir secuencia de imagen , elija la carpeta de destino y abra el primer fotograma.
- En la ventana Opciones de secuencia , en el campo Imagen inicial , establezca el número de fotograma en 1 para el primer fotograma. En el campo Incremento , establezca el valor igual al número de fotogramas en la grabación de señal inicial (20 para el presente caso) y haga clic en Aceptar.
- Para guardar el archivo generado de los primeros fotogramas cosidos en una carpeta separada, haga clic en Archivo > Guardar carpeta >.
- Repita los pasos 4.3-4.5 para los siguientes 19 fotogramas. En la ventana Opciones de secuencia , defina el número de fotograma correspondiente en el campo Imagen inicial .
- Para generar el vídeo completo de alta resolución, une todos los fotogramas. Para hacer esto, haga clic en Archivo > Importar > secuencia de imágenes y seleccione 1 en los campos Imagen inicial e Incremento . El resultado será el video final con mayor resolución temporal. Guarde el archivo en .tiff o en cualquier otro formato adecuado.
5. Análisis de vídeo
NOTA: En ImageJ, seleccione ROI y fondo. Resta el fondo del ROI. Los datos se representan como la relación, (ΔF / F 0 - 1) * 100%, donde F0 es la intensidad de fluorescencia en reposo y ΔF es la intensidad de fluorescencia durante la estimulación.
- Haga clic en Image > Stacks > Tools > Stack Sorter. Luego, haga clic en Análisis > Herramientas > ROI Manager.
- Arrastre y suelte el archivo .tiff guardado en el paso 4.7 en la ventana ImageJ. Expanda la imagen para una mejor vista. Para mejorar la visualización de la imagen, haga clic en Imagen > Ajustar > Brillo / Contraste > Auto. Este paso no afectará a los datos.
- Coloque el fondo cerca de la terminal nerviosa dibujando ROI. Agréguelo al administrador de ROI. Calcule el fondo haciendo clic en Más > Multimedida. Copie los valores medios, péguelos en el programa Hoja de cálculo y calcule el promedio.
- Resta el valor promedio calculado de las pilas haciendo clic en Procesar > Principal > Restar. Introduzca el valor.
- Dibuje el ROI alrededor de una terminal nerviosa a través de una línea poligonal. Agréguelo al administrador de ROI.
- Mida la intensidad de la terminal nerviosa: Haga clic en Más > Multimedida. Copie los valores medios y péguelos en el programa Hoja de cálculo.
- Calcular el desplazamiento medio de las señales.
NOTA: Utilice los puntos correspondientes dependiendo del tiempo de retardo antes de la estimulación. Este paso establece el valor F0 que se utilizará en cálculos posteriores. - Divida los valores de señal por el valor de desplazamiento promedio.
NOTA: Después de este paso, la señal no contiene la contribución del fondo y la fluorescencia bruta a los valores de amplitud para el ROI seleccionado. - Reste 1 de los valores obtenidos en el paso 5.8 y luego multiplíquelo por 100%.
- Traza un gráfico de Ca2+- transitorio y calcula la amplitud.
Resultados
Después de cargar la preparación con colorante de acuerdo con la técnica presentada, la mayoría de las sinapsis ubicadas cerca del muñón nervioso tenían un nivel suficiente de fluorescencia (ver Figura 2). Después de cargar la preparación con el tinte y aplicar el método descrito de registro y procesamiento de imágenes, se obtuvieron transitorios de calcio con la resolución espacial y temporal deseada (ver Figura 4). El transitorio de calcio se ha re...
Discusión
En este artículo se presenta el método para cargar colorante sensible al Ca2+ en terminaciones nerviosas de ratón a través del muñón nervioso y para registrar un transitorio rápido de calcio utilizando un microscopio confocal. Como resultado de la implementación de este método de carga, la mayoría de las sinapsis ubicadas cerca del muñón nervioso tenían un nivel suficiente de fluorescencia para permitir el registro de la entrada de calcio en las terminaciones nerviosas en respuesta a la estimulaci...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los estudios de fluorescencia de este trabajo se llevaron a cabo con el apoyo financiero de la Subvención de la Fundación Rusa de Ciencias (proyecto No. 19-15-00329). El método fue desarrollado bajo la financiación de la asignación del gobierno para FRC Kazan Scientific Center de RAS АААА-А18-118022790083-9. La investigación se desarrolló con el uso del equipo del Centro Federal de Investigación "Kazan Scientific Center of RAS". Los autores desean agradecer al Dr. Victor I. Ilyin por la lectura crítica de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Capillary Glass | Clark Electromedical instruments, UK | GC150-10 | |
| Confocal and multiphoton microscope system Leica TCS SP5 MP | Leica Microsystems , Heidelberg, Germany | ||
| Flaming/Brown Micropipette Puller P 97 | Sutter Instrument, USA | P-97 | |
| Flow regulator | KD Medical GmbH Hospital Products, Germany | KD REG | Disposable infusion set with Flow regulator |
| HEPES | Sigma-Aldrich, USA | H0887 | 100mL |
| Illumination system Leica CLS 150X | Leica Microsystems, Germany | ||
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Las AF software | Leica Microsystems, Heidelberg, Germany | ||
| Las X software | Leica Microsystems, Heidelberg, Germany | https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/ | |
| Magnetic Holder with Suction Tubing | BIOSCIENCE TOOLS, USA | MTH-S | |
| Microspin FV 2400 | Biosan, Latvia | BS-010201-AAA | |
| Minutien Pins | Fine science tools, Canada | 26002-20 | |
| Multi-spin MSC 3000 | Biosan, Latvia | BS-010205-AAN | |
| Oregon Green 488 BAPTA-1 pentapotassium salt | Molecular Probes, USA | O6806 | 500 μg |
| Pipette | Biohit, Russia | 720210 | 0.5-10 µL |
| Pipette tip | Biohit, Russia | 781349 | 10 µL |
| Plasticine | local producer | ||
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40 mm |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel | |
| Stereomicroscope, Leica M80 | Leica Microsystems , Germany | ||
| Suction electrode | Kazakov A. SIMPLE SUCTION ELECTRODE FOR ELECTRIC STIMULATION OF BIOLOGICAL OBJECTS / A. Kazakov, M. Alexandrov, N. V. Zhilyakov et al. // International research journal. - 2015. - No. 9 (40) Part 3. - P. 13-16. | http://research-journal.org/biology/prostoj-vsasyvayushhij-elektrod-dlya-elektricheskoj-stimulyacii-biologicheskix-obektov/ | |
| Sylgard 184 elastomer | Dow Corning, USA | ||
| Syringe | local producer | 0.5 mL | |
| Syringe | local producer | 60 mL |
Referencias
- Llinas, R., Steinberg, I. Z., Walton, K. Presynaptic calcium currents and their relation to synaptic transmission: voltage clamp study in squid giant synapse and theoretical model for the calcium gate. Proceedings of the National Academy of Sciences of the United States of America. 73 (8), 2918-2922 (1976).
- Augustine, G. J. How does calcium trigger neurotransmitter release. Current Opinion in Neurobiology. 11 (3), 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37 (5), 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Current Opinion in Neurobiology. 15 (3), 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Current Opinion in Cell Biology. 22 (4), 496-505 (2010).
- Leal, S. S., Gomes, C. M. Calcium dysregulation links ALS defective proteins and motor neuron selective vulnerability. Frontiers in Cellular Neuroscience. 9, 225 (2015).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods in Cell Biology. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Macleod, G. T. Topical application of indicators for calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 786-790 (2012).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in Neuroscience and Development: A Laboratory Manual. , 307-314 (2005).
- Eilers, J., Konnerth, A. Dye loading with patch pipettes. Cold Spring Harbor Protocols. 2009 (4), 5201 (2009).
- Coleman, W. L., et al. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. Journal of Physiology. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct injection of indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 797-801 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10 (3), 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. α-Latrotoxin releases calcium in frog motor nerve terminals. The Journal of Neuroscience. 20 (23), 8685-8692 (2000).
- Newman, Z., et al. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. The European Journal of Neuroscience. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 791-796 (2012).
- Rossano, A. J., Macleod, G. T. Loading drosophila nerve terminals with calcium indicators. Journal of Visualized Experiments: JoVE. (6), e250 (2007).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Suzuki, S., et al. Ca2+ dynamics at the frog motor nerve terminal. Pflugers Archiv: European Journal of Physiology. 440 (3), 351-365 (2000).
- Ojala, K. S., et al. A high-affinity, partial antagonist effect of 3,4-diaminopyridine mediates action potential broadening and enhancement of transmitter release at NMJs. Journal of Biological Chemistry. 296, 100302 (2021).
- Samigullin, D., et al. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Frontiers in Synaptic Neuroscience. 6, 29 (2015).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. The Journal of Physiology. 505, 585-592 (1997).
- Bullen, A., Patel, S. S., Saggau, P. High-speed, random-access fluorescence microscopy: I. High-resolution optical recording with voltage-sensitive dyes and ion indicators. Biophysical Journal. 73 (1), 477-491 (1997).
- Bullen, A., Saggau, P. High-speed, random-access fluorescence microscopy: II. Fast quantitative measurements with voltage-sensitive dyes. Biophysical Journal. 76 (4), 2272-2287 (1999).
- Bullen, A., Saggau, P. Optical recording from individual neurons in culture. Modern Techniques in Neuroscience Research. (4), 89-126 (1999).
- Bullen, A., Saggau, P. Indicators and optical configuration for simultaneous high-resolution recording of membrane potential and intracellular calcium using laser scanning microscopy. Pflugers Archiv European Journal of Physiology. 436 (5), 788-796 (1998).
- Wilson, T. Optical aspects of confocal microscopy. Confocal Microscopy. , 93-141 (1990).
- Cox, G. Biological confocal microscopy. Materials Today. 5 (3), 34-41 (2002).
- Mukhitov, A., Arkhipova, S., Nikolsky, E. Modern Light Microscopy in Biological and Medical Research. Nauka. , (2011).
- Mertz, J. Optical sectioning microscopy with planar or structured illumination. Nature Methods. 8 (10), 811-819 (2011).
- Webb, R. H. Confocal optical microscopy. Reports on Progress in Physics. 59 (3), 427-471 (1996).
- Toomre, D., Pawley, J. B. Disk-scanning confocal microscopy. Handbook of Biological Confocal Microscopy: Third Edition. , 221-238 (2006).
- Venkateswarlu, K., et al. Three-dimensional imaging and quantification of real-time cytosolic calcium oscillations in microglial cells cultured on electrospun matrices using laser scanning confocal microscopy. Biotechnology and Bioengineering. 117 (10), 3108-3123 (2020).
- Arkhipov, A. Y., Khaziev, E. F., Skorinkin, A. I., Bukharaeva, E. A., Samigullin, D. V. Enhancement of the temporal resolution of fluorescent signals acquired by the confocal microscope. Microscopy and Microanalysis. 26 (2), 204-210 (2020).
- Rama, S. Shift and mean algorithm for functional imaging with high spatio-temporal resolution. Frontiers in Cellular Neuroscience. 9, (2015).
- Chan, K. G., Streichan, S. J., Trinh, L. A., Liebling, M. Simultaneous temporal superresolution and denoising for cardiac fluorescence microscopy. IEEE Transactions on Computational Imaging. 2 (3), 348-358 (2016).
- Veeraraghavan, A., Reddy, D., Raskar, R. Coded strobing photography: compressive sensing of high speed periodic videos. IEEE Transactions on Pattern Analysis and Machine Intelligence. 33 (4), 671-686 (2011).
- Angaut-Petit, D., Molgo, J., Connold, A. L., Faille, L. The levator auris longus muscle of the mouse: A convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. Neuroscience Letters. 82 (1), 83-88 (1987).
- Macleod, G. T. Calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 7 (7), 758-766 (2012).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Bukharaeva, E. A., Nikolsky, E. E. Loading a calcium dye into frog nerve endings through the nerve stump: calcium transient registration in the frog neuromuscular junction. Journal of Visualized Experiments: JoVE. (125), e55122 (2017).
- Samigullin, D. V., et al. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoScience. 7 (1), 162-166 (2017).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. Journal of Neuroscience. 31 (31), 11268-11281 (2011).
- Luo, F., Dittrich, M., Cho, S., Stiles, J. R., Meriney, S. D. Transmitter release is evoked with low probability predominately by calcium flux through single channel openings at the frog neuromuscular junction. Journal of Neurophysiology. 113 (7), 2480-2489 (2015).
- Wright, M., Kim, A., Son, Y. -. J. Subcutaneous administration of muscarinic antagonists and triple-immunostaining of the levator auris longus muscle in mice. Journal of Visualized Experiments: JoVE. (55), e3124 (2011).
- Burke, S. R. A., Reed, E. J., Romer, S. H., Voss, A. A. Levator Auris Longus preparation for examination of mammalian neuromuscular transmission under voltage clamp conditions. Journal of Visualized Experiments: JoVE. (135), e57482 (2018).
- Kazakov, A., Alexandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Meždunarodnyj naučno-issledovatel'skij žurnal (International Research Journal). 9 (40), 13-16 (2015).
- Bowman, W. C. Neuromuscular block. British Journal of Pharmacology. 147, 277-286 (2006).
- Hill, J. M., Alewood, P. F., Craik, D. J. Three-dimensional solution structure of µ-conotoxin GIIIB, a specific blocker of skeletal muscle sodium channels. Biochemistry. 35 (27), 8824-8835 (1996).
- Land, B. R., Johnson, B. R., Wyttenbach, R. A., Hoy, R. R. Tools for physiology labs: Inexpensive equipment for physiological stimulation. Journal of Undergraduate Neuroscience Education. 3 (1), 30-35 (2004).
- Samigullin, D. V., Zhilyakov, N. V., Khaziev, E. F., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient and quantal release in mouse neuromuscular junction under extracellular calcium concentration change. BioNanoScience. 8 (4), 984-987 (2018).
- Khaziev, E., et al. acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Frontiers in Physiology. 7, 621 (2016).
- Zhilyakov, N., Arkhipov, A., Malomouzh, A., Samigullin, D. Activation of neuronal nicotinic receptors inhibits acetylcholine release in the neuromuscular junction by increasing ca2+ flux through cav1 channels. International Journal of Molecular Sciences. 22 (16), 9031 (2021).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophysical Journal. 74 (3), 1549-1563 (1998).
- McArdle, J. J., et al. Advantages of the triangularis sterni muscle of the mouse for investigations of synaptic phenomena. Journal of Neuroscience Methods. 4 (2), 109-115 (1981).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados