Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Регистрация переходных процессов кальция в нервно-мышечном соединении мыши с высоким временным разрешением с помощью конфокальной микроскопии
В этой статье
Резюме
Протокол описывает способ загрузки флуоресцентного кальциевого красителя через разрезанный нерв в мышиные двигательные нервные окончания. Кроме того, представлен уникальный метод регистрации быстрых переходных процессов кальция в периферических нервных окончаниях с помощью конфокальной микроскопии.
Аннотация
Оценка уровня пресинаптического кальция является ключевой задачей в изучении синаптической передачи, поскольку поступление кальция в пресинаптическую клетку вызывает каскад событий, приводящих к высвобождению нейротрансмиттера. Кроме того, изменения уровня пресинаптического кальция опосредуют активность многих внутриклеточных белков и играют важную роль в синаптической пластичности. Изучение передачи сигналов кальция также важно для поиска способов лечения нейродегенеративных заболеваний. Нервно-мышечное соединение является подходящей моделью для изучения синаптической пластичности, так как имеет только один тип нейротрансмиттера. В этой статье описывается метод загрузки кальциечувствительного красителя через разрезанный нервный пучок в двигательные нервные окончания мышей. Этот метод позволяет оценить все параметры, связанные с внутриклеточными изменениями кальция, такие как базальный уровень кальция и переходный кальций. Поскольку приток кальция из клетки снаружи в нервные окончания и его связывание /развязывание с кальциечувствительным красителем происходят в диапазоне нескольких миллисекунд, для записи этих событий требуется быстрая система визуализации. Действительно, высокоскоростные камеры обычно используются для регистрации быстрых изменений кальция, но они имеют низкие параметры разрешения изображения. Протокол, представленный здесь для регистрации переходного кальция, обеспечивает чрезвычайно хорошее пространственно-временное разрешение, обеспечиваемое конфокальной микроскопией.
Введение
Проблема измерения быстрых кальциевых волн в возбудимых клетках является одним из важнейших и сложных аспектов изучения передачи сигнала в центральной и периферической нервной системе. Ионы кальция играют важную роль в запуске высвобождения нейромедиаторов, синаптической пластичности и модуляции активности различных внутриклеточных белков 1,2,3,4,5. Изучение передачи сигналов кальция также важно для поиска способов лечения нейродегенеративных заболеваний6. Для измерения изменений уровня кальция обычно используют флуоресцентные кальциечувствительные красители, а изменения уровня их флуоресценции анализируются 7,8,9.
Загрузка кальциевых красителей в клетки может достигаться по-разному. Преимущественно используются клеточно-проницаемые красители10,11. Однако в таком случае не только трудно контролировать концентрацию красителя внутри клетки, но и трудно выбрать клетки-мишени для загрузки. Этот метод не применим для изучения периферических нервных окончаний, так как краситель попадает в постсинаптические клетки. Вместо этого для таких препаратов больше подходят клеточные непроницаемые красители. В этом случае красители доставляются в клетки путем микроинъекции или через пластырную пипетку 12,13,14. Существует также метод загрузки через культю нерва. Последний способ наиболее подходит для препаратов нервно-мышечных соединений 15,16,17,18,19,20. Это позволяет выполнять окрашивание только для интересующих клеток. Хотя этот способ не обеспечивает точную оценку концентрации красителя в клетке-мишени, концентрацию можно оценить приблизительно путем сравнения уровня флуоресценции клеток в состоянии покоя в растворах с известной концентрацией кальция21. В данном исследовании представлена модификация данного метода, применяемая к синапсам млекопитающих.
Поступление кальция во время деполяризующей фазы потенциала действия происходит быстрым процессом, особенно в нервно-мышечном соединении; поэтому для его регистрации требуется соответствующее оборудование1. Недавнее исследование с использованием чувствительного к напряжению флуоресцентного красителя показало, что продолжительность потенциала действия в периферическом синапсе мыши составляет примерно 300 мкс22. Кальций переходный, оцениваемый с помощью кальций-чувствительных красителей в периферических синапсах лягушки, имеет большую продолжительность: время нарастания составляет около 2-6 мс, а время распада составляет около 30-90 мс, в зависимости от используемого кальциевого красителя23,24. Для измерения быстрых процессов с помощью флуоресцентных красителей обычно используются ПЗС- или КМОП-камеры с быстрыми и чувствительными ПЗС-матрицами. Однако эти камеры имеют недостаток низкого разрешения, ограниченного размерами чувствительных элементов матрицы 25,26,27,28. Самые быстрые камеры с достаточной чувствительностью для записи как потенциалов действия, так и переходных процессов кальция в ответ на низкочастотную стимуляцию клеток имеют частоту сканирования 2000 Гц, а матрицу с размерностью 80 х 8029. Для получения сигналов с более высоким пространственным разрешением используется конфокальная микроскопия, особенно если необходимо оценить некоторые объемные изменения сигнала 30,31,32. Но следует иметь в виду, что конфокальная микроскопия имеет высокую скорость сканирования в режиме линейного сканирования, но все же существуют существенные ограничения на скорость записи быстрых процессов при построении пространственного изображения33. Существуют конфокальные микроскопы на основе вращающихся дисков Нипкова (щелевая сканирующая микроскопия) и сканеры Multipoint-Array, которые имеют более высокую скорость сканирования. При этом они уступают классическим конфокальным микроскопам в конфокальной фильтрации изображений (точечные перекрестные помехи для микроскопов с диском Нипкова)32,34,35. Конфокальная визуализация с резонансным сканированием также может обеспечить высокое пространственно-временное разрешение, необходимое для высоких временных измерений36. Однако учтите, что для регистрации слабых флуоресцентных откликов при высокой скорости сканирования при использовании резонансных сканеров требуются высокочувствительные детекторы, такие как гибридные детекторы36.
В данной статье представлен метод увеличения временного разрешения сигналов, записанных с помощью лазерной сканирующей конфокальной микроскопии (LSCM) при сохранении пространственного разрешения37. Текущий метод является дальнейшим развитием методов, описанных ранее и перенесенных на платформу LSCM 38,39,40. Такой подход не требует изменений в аппаратном обеспечении микроскопа и основан на применении алгоритма записи периодически вызываемых флуоресцентных сигналов со сдвигом времени относительно момента стимуляции.
протокол
Проводились эксперименты на изолированных нервно-мышечных препаратах levator auris longus (m. LAL) у мышей BALB/C (20-23 г, 2-3 месяца)41. Экспериментальные процедуры проводились в соответствии с руководством по использованию лабораторных животных Казанского федерального университета и Казанского медицинского университета, в соответствии с Руководством NIH по уходу и использованию лабораторных животных. Протокол эксперимента соответствовал требованиям Директивы Совета Европейских сообществ 86/609/EEC и был одобрен Этическим комитетом Казанского медицинского университета.
1. Подготовка решений для звонка и подачи заявок
- Приготовьте раствор Рингера для мышц млекопитающих, смешивая следующие ингредиенты: NaCl (137 мМ), KCl (5 мМ), CaCl2 (2 мМ), MgCl2 (1 мМ),2PO4 (1 мМ), NaHCO3 (11,9 мМ) и глюкоза (11 мМ). Пропустите раствор с 95% O2 и 5% CO2 и отрегулируйте его рН до 7,2-7,4, добавив HCl/NaOH при необходимости.
- Подготовьте раствор для загрузки красителя.
- Готовят раствор HEPES (10 мМ) с рН в диапазоне 7,2-7,4. 500 мкг коммерческого красителя поставляется во флаконе объемом 500 мкл. Растворить краситель в 14 мкл раствора HEPES для получения концентрации красителя 30 мМ. Хорошо встряхните и центрифугируйте до полного растворения.
- Разбавить раствор индикатора Ca2+ раствором HEPES до концентрации 1 мМ. Храните его в морозильной камере (-20 °C) и избегайте воздействия света.
2. Процедура загрузки красителя
ПРИМЕЧАНИЕ: Процедура загрузки красителем выполняется в соответствии с протоколом для нагрузки через культю нерва, адаптированным изпротоколов, ранее опубликованных 19,42,43,44,45,46.
- Рассечение мышцы LAL в соответствии с процедурой рассечения для этого препарата, описанной в ранее опубликованных протоколах47,48.
- Зафиксируйте ткань, слегка растянутую (не более 30% от первоначальной длины) в чашке Петри, покрытой эластомером, тонкими штифтами из нержавеющей стали и добавьте раствор Рингера до тех пор, пока мышца не будет полностью покрыта.
ПРИМЕЧАНИЕ: Чашка Петри была предварительно заполнена эластомером в соответствии с инструкциями производителя (см. Таблицу материалов).
- Зафиксируйте ткань, слегка растянутую (не более 30% от первоначальной длины) в чашке Петри, покрытой эластомером, тонкими штифтами из нержавеющей стали и добавьте раствор Рингера до тех пор, пока мышца не будет полностью покрыта.
- Подготовьте пипетку для наполнения
- Используя съемник микропипетки (см. Таблицу материалов), подготовьте микропипетку с тонким наконечником, который будет максимально острым для внутриклеточных записей. Используйте капилляры без внутренних нитей (наружный диаметр 1,5 мм и внутренний диаметр 0,86 или 1,10 мм).
- Отломите наконечник микропипетки после забивания конуса абразивом, оставив наконечник открытым примерно до 100 мкм в диаметре. Отполируйте наконечник огнем, чтобы ограничить, когда внутренний диаметр уменьшится с >80 мкм до 12-13 мкм. Прикрепите силиконовую трубку к одной стороне пломбировочной пипетки и шприц (без иглы) к другой стороне.
- Под стереомикроскопом найдите место, где нервный ствол превращается в отдельные нервные ветви. Поместите пломбирную пипетку с установленной трубкой и шприцем на чашку Петри с использованием воска. Двигайте кончиком пипетки до тех пор, пока он не встанет над нервом.
- Тонкими ножницами перережьте нерв близко к мышечному волокну, оставив небольшой кусочек культи нерва длиной около 1 мм. Аккуратно аспирируйте культю нерва вместе с каким-нибудь раствором Рингера, не зажимая его, в кончик пломбировочной пипетки. Снимите силиконовую трубку с пломбировочной пипетки.
- Нарисуйте некоторое количество раствора для загрузки красителя (~0,3 мкл) с помощью шприца с длинной нитью. Этот объем соответствует примерно 3 см нити накала.
ПРИМЕЧАНИЕ: Изначально необходимо сделать нить накала из наконечника пипетки объемом 10 мкл путем натягивания на огонь с помощью спиртовой лампы или газовой горелки. - Аккуратно вставьте наконечник нити с загрузочным раствором в пипетку для наполнения. Выпустите смесь непосредственно на культю нерва. Инкубировать препарат при комнатной температуре в темноте в течение 30 мин.
- После этого препарат промыть свежим раствором Рингера и инкубировать при 25 °C в течение до 2 ч в стеклянном стакане с 50 мл (или более) раствором Рингера (приготовление должно быть покрыто раствором). За это время краситель достигнет синапсов.
3. Видеозахват с помощью конфокальной микроскопии
ПРИМЕЧАНИЕ: Регистрация переходных процессов кальция осуществляется с помощью лазерного сканирующего конфокального микроскопа (LSCM) (см. Таблицу материалов). Для регистрации быстрых переходных процессов кальция использовался оригинальный протокол, который позволял записывать сигналы с достаточным пространственным и временным разрешением. Метод был подробно описан в публикации Архипова и др.37. Микроскоп был оснащен 20-кратным водомерным объективом (1,00 NA). Лазерная линия 488 нм была ослаблена до 10% интенсивности, а эмиссионная флуоресценция была собрана от 503 до 558 нм.
- Установите препарат в экспериментальную камеру с силиконовым эластомерным покрытием и зафиксируйте ее, слегка растянутую, с помощью набора стальных микроигл. Тщательно промойте препарат раствором Рингера.
ПРИМЕЧАНИЕ: Использовалась простая на заказ перфузионная экспериментальная камера из органического стекла с нижней частью камеры, покрытой эластомером (подготовленная в соответствии с инструкциями производителя; см. Таблицу материалов). Камера имеет трубку подачи раствора. Раствор откачивается с помощью шприцевой иглы, установленной на магнитном держателе (см. Таблицу материалов). В качестве экспериментальной камеры можно было использовать чашку Петри (аналогичную той, которая использовалась для инкубации препарата), но с прикрепленными приточными и всасывающими трубками. - Установите всасывающий электрод, который будет использоваться для стимуляции нерва.
ПРИМЕЧАНИЕ: Конструкция электрода похожа на то, что было опубликовано в статье 2015 года Казакова и др.49. Поместите и зафиксируйте электрод воском рядом с ванной. Поднесите кончик близко к культе нерва и аспирируйте его в электрод. - Установите подготовительную камеру на ступень микроскопа и поместите впускные и выпускные фитинги в камеру.
- Для перфузии препарата используйте простую систему с гравитационным потоком. Включите перфузионный всасывающий насос, чтобы удалить лишний раствор.
- Подключите стимулирующий всасывающий электрод к электрическому стимулятору и убедитесь, что мышечные сокращения происходят после стимулов. См. разделы 3.9-3.12 для определения условий стимуляции и регистрации.
- Заполните перфузионную систему раствором Рингера d-тубокурарином (10 мкМ).
ПРИМЕЧАНИЕ: Это решение помогает предотвратить мышечные сокращения. D-тубокурарин или альфа-бунгаротсин-специфические блокаторы никотиновых ацетилхолиновых рецепторов на постсинаптической мембране будут полностью или частично блокировать мышечные сокращения50. Кроме того, для предотвращения мышечных сокращений могут быть использованы специфические блокаторы постсинаптических натриевых каналов, такие как μ-конотоксин GIIIB51. - Включите перфузионный всасывающий насос и начните перфузию препарата раствором Рингера, содержащим d-тубокурарин.
- Задайте параметры изображения в программном обеспечении LSCM следующим образом.
- В программном обеспечении LSCM (LAS AF; см. Таблица материалов) выберите Электрофизиология.
ПРИМЕЧАНИЕ: В этом режиме, когда изображение захватывается в точке времени, синхронизирующий импульс отправляется на стимулятор с помощью триггерной коробки. Это вызывает генерацию потенциала действия в препарате (рисунок 1; блок стимулятора). - Выберите Режим получения. Для запуска стимулятора с помощью синхронизирующего импульса микроскопа в меню Настройки задания выберите Настройки триггера . Установите в поле Триггер Выход на кадре канал out1 .
- Используйте следующие настройки: Режим сканирования: XYT, Частота сканирования: 1400 Гц, Коэффициент масштабирования: 6.1, Pinhole: полностью открыт. Убедитесь, что включен последовательный транс-проходящий двунаправленный режим X.
- Установите минимальное время для формирования кадра в 52 мс и кадров для сбора в необработанное видео в 20 кадров.
ПРИМЕЧАНИЕ: Эти настройки позволяют захватывать изображение с разрешением 128 x 128 пикселей, делая один кадр каждые 52 мс. - Установить длину волны возбуждения аргонового лазера на уровне 488 нм с 8% выходной мощности.
- В программном обеспечении LSCM (LAS AF; см. Таблица материалов) выберите Электрофизиология.

Рисунок 1: Схема экспериментальной установки. 1. Лазерный сканирующий конфокальный микроскоп (LSCM). 2. Модуль синхронизации LSCM (триггерная коробка). 3. Стимулятор. 4. Изоляционный блок. 5. Биологический образец. 6. Всасывающий электрод для электростимуляции нерва. 7. Перфузионные системы (7a: резервуар перфусата, 7b: капельница, 7c: регулятор потока, 7d: вакуумная колба). Стрелки указывают на направление распространения синхронизирующего импульса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Нажмите кнопку Live Mode , чтобы переключиться в режим Live, который помогает получить предварительный просмотр нервных окончаний, загруженных красителем.

Рисунок 2: Мышиный нерв и терминали, загруженные индикатором Ca2+ . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Блок стимуляции
ПРИМЕЧАНИЕ: В данной работе использовался стимулятор, описанный в статье Land et al.52 . Данное устройство позволяет задавать временные параметры стимуляции с помощью программного обеспечения MatLab.- Создайте новый файл, вставьте код из вышеупомянутой статьи в окно кода MatLab и сохраните файл. Нажмите кнопку Выполнить, так появится окно с параметрами стимуляции. Установите время задержки и продолжительность стимула.
ПРИМЕЧАНИЕ: Задержка определяет временное разрешение восстановленного флуоресцентного сигнала. Электрический импульс длительностью 0,2 мс задерживается, а затем направляется в изоляционный блок. Последний образует амплитуду и полярность стимулирующего импульса и электрически изолирует биологический объект от записывающей аппаратуры. - Для стимуляции нерва подбирают супрамаксимальную амплитуду стимулирующего импульса (на 25%-50% больше максимальной интенсивности стимуляции, необходимой для активации всех нервных волокон).
ПРИМЕЧАНИЕ: Представленный метод основан на специальном алгоритме записи одиночных быстрых флуоресцентных сигналов с использованием LSCM с минимизированной разверткой. На каждом этапе разработанного алгоритма записанный флуоресцентный сигнал смещается от предыдущего на временной интервал, который короче развертки микроскопа. Величина временных сдвигов определяет временное разрешение требуемого сигнала. Количество шагов (сдвигов) в алгоритме зависит от требуемого временного разрешения и исходного временного разрешения. При таком способе регистрации стимуляцию препарата проводят с частотой 0,25 Гц.
- Создайте новый файл, вставьте код из вышеупомянутой статьи в окно кода MatLab и сохраните файл. Нажмите кнопку Выполнить, так появится окно с параметрами стимуляции. Установите время задержки и продолжительность стимула.
- В режиме Live найдите рентабельность инвестиций и получите наилучший фокус. Запустите программное обеспечение для сбора данных.
- Сдвиньте задержку на стимуляторе на 2 мс меньше относительно предыдущего значения и запустите программное обеспечение для сбора данных.
- Повторите шаг 3.11 26 раз, чтобы получить 26 последовательностей, причем каждая последовательность смещается на 2 мс по сравнению с предыдущей.
4. Обработка видео
ПРИМЕЧАНИЕ: Серия видеоизображений, полученных конфокальным микроскопом, экспортируется в формате TIFF со свободным программным обеспечением LAS X (см. Таблицу материалов). Эта серия была разделена на кадры и экспортирована в папку. Для генерации последовательности изображений с более высоким временным разрешением использовалось программное обеспечение ImageJ, имеющее открытый исходный код для анализа и обработки данных. Алгоритм обработки сигналов схематически представлен на рисунке 3.
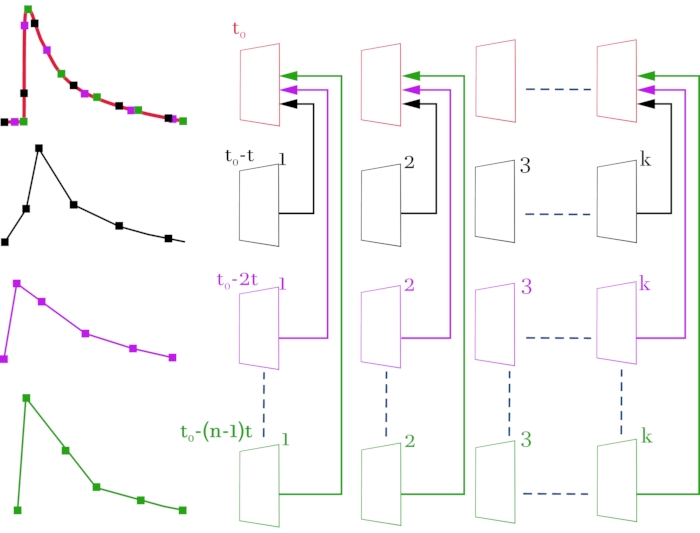
Рисунок 3: Схема компиляции видеофайла высокого разрешения (2 мс на кадр) из исходных видеофайлов с низким временным разрешением (52 мс на кадре). Исходные видеофайлы и соответствующие сигналы окрашены в черный, пурпурный и зеленый цвета. Скомпилированный видеофайл и полученный сигнал окрашены в красный цвет. Схема справа, строка за строкой, показывает видеоизображения, полученные с помощью конфокального микроскопа. Слева соответствующие сигналы флуоресценции изменяются от выбранной ROI. Самая верхняя линия формируется кадр за кадром из полученных рамок по схеме. В результате получается видеоизображение, состоящее из всего массива кадров, так что между кадрами возникает время задержки 2 мс вместо 52 мс. Каждой линии соответствует смещение сигнала стимуляции на (n - 1) * t, где t - сдвиг времени (2 мс), а n - количество итераций сдвига. k обозначает количество кадров в исходных видеофайлах (строки 2-4) и зависит от длительности записанного сигнала. В этом случае для регистрации сигнала длительностью 1 с необходимо выбрать k = 20 (52 мс * 20 = 1040 мс). t0 – необходимая задержка перед стимуляцией. Для вычисления количества итераций сдвига n начальное временное разрешение между кадрами (52 мс) должно быть разделено на требуемое временное разрешение (2 мс). В этом случае n = 26, что соответствует 26 зарегистрированным разверткам. В результате выполненных манипуляций получается видеоизображение, состоящее из n * k = 520 кадров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Запустите программное обеспечение LAS X. Откройте проект, созданный во время выполнения эксперимента. Нажмите «Экспорт», а затем «Сохранить как», чтобы сохранить кадры в формате .tiff в папке назначения.
- Запустите программное обеспечение ImageJ. Нажмите файл > импорт > последовательности изображений.
- В окне Открыть последовательность изображений выберите папку назначения и откройте первый кадр.
- В окне Параметры последовательности в поле Начальное изображение задайте для первого кадра номер кадра значение 1. В поле Increment установите значение, равное количеству кадров в начальной записи сигнала (20 для данного случая) и нажмите OK.
- Чтобы сохранить сгенерированный файл сшитых первых кадров в отдельную папку, нажмите на Файл > Сохранить > папку.
- Повторите шаги 4.3-4.5 для следующих 19 кадров. В окне Параметры последовательности задайте соответствующий номер кадра в поле Начальное изображение .
- Чтобы создать полное видео с высоким временным разрешением, сшите все кадры вместе. Для этого нажмите на Файл > Импорт > Последовательность изображений и выберите 1 в полях Начальное изображение и Инкремент . Результатом станет финальное видео с увеличенным временным разрешением. Сохраните файл в .tiff или любом другом подходящем формате.
5. Анализ видео
ПРИМЕЧАНИЕ: В ImageJ выберите ROI и фон. Вычтите фон из ROI. Данные представлены в виде соотношения (ΔF/F0 - 1)*100%, где F0 - интенсивность флуоресценции в состоянии покоя, а ΔF - интенсивность флуоресценции при стимуляции.
- Нажмите На Image > Stacks > Tools > Stack Sorter. Затем нажмите «Инструменты анализа >» > «Менеджер окупаемости инвестиций».
- Перетащите файл .tiff, сохраненный на шаге 4.7, в окно ImageJ. Разверните изображение для лучшего обзора. Чтобы улучшить визуализацию изображения, нажмите «Изображение > «Настроить > яркость / контрастность > «Авто». Этот шаг не повлияет на данные.
- Установите фон близко к нервному окончанию, нарисовав ROI. Добавьте его в менеджер ROI. Рассчитайте фон, щелкнув Дополнительно > Multi Measure. Скопируйте средние значения, вставьте их в программу электронных таблиц и вычислите среднее значение.
- Вычтите вычисляемое среднее значение из стеков, щелкнув Процесс > Главная > Вычитать. Введите значение.
- Нарисуйте ROI вокруг нервного терминала с помощью полигональной линии. Добавьте его в менеджер ROI.
- Измерьте интенсивность нервного терминала: нажмите «Подробнее» > «Мультимера». Скопируйте средние значения и вставьте их в программу электронных таблиц.
- Рассчитайте среднее смещение сигналов.
ПРИМЕЧАНИЕ: Используйте соответствующие точки в зависимости от времени задержки перед стимуляцией. На этом шаге устанавливается значение F0 , которое будет использоваться в последующих вычислениях. - Разделите значения сигнала на среднее значение смещения.
ПРИМЕЧАНИЕ: После этого шага сигнал не содержит вклада фоновой и необработанной флуоресценции в значения амплитуды для выбранной ROI. - Вычтите 1 из значений, полученных на шаге 5.8, а затем умножьте на 100%.
- Постройте график Ca2+- переходного периода и рассчитайте амплитуду.
Результаты
После загрузки препарата красителем по представленной методике большинство синапсов, расположенных близко к культе нерва, имели достаточный уровень флуоресценции (см. Фиг.2). После загрузки препарата красителем и применения описанного способа регистрации и обработки ?...
Обсуждение
В данной статье представлен способ загрузки Ca2+-чувствительного красителя в нервные окончания мыши через культю нерва и регистрации быстрого кальциевого транзитора с помощью конфокального микроскопа. В результате реализации данного нагрузочного метода большинство синапсов, ра...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Флуоресцентные исследования данной работы проводились при финансовой поддержке гранта Российского научного фонда (проект No 19-15-00329). Методика разработана при финансировании из государственного задания для ФРЦ Казанского научного центра РАН АААА-А18-118022790083-9. Исследование разработано с использованием оборудования Федерального исследовательского центра «Казанский научный центр РАН». Авторы хотели бы поблагодарить доктора Виктора Ивановича Ильина за критическое прочтение этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Capillary Glass | Clark Electromedical instruments, UK | GC150-10 | |
| Confocal and multiphoton microscope system Leica TCS SP5 MP | Leica Microsystems , Heidelberg, Germany | ||
| Flaming/Brown Micropipette Puller P 97 | Sutter Instrument, USA | P-97 | |
| Flow regulator | KD Medical GmbH Hospital Products, Germany | KD REG | Disposable infusion set with Flow regulator |
| HEPES | Sigma-Aldrich, USA | H0887 | 100mL |
| Illumination system Leica CLS 150X | Leica Microsystems, Germany | ||
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Las AF software | Leica Microsystems, Heidelberg, Germany | ||
| Las X software | Leica Microsystems, Heidelberg, Germany | https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/ | |
| Magnetic Holder with Suction Tubing | BIOSCIENCE TOOLS, USA | MTH-S | |
| Microspin FV 2400 | Biosan, Latvia | BS-010201-AAA | |
| Minutien Pins | Fine science tools, Canada | 26002-20 | |
| Multi-spin MSC 3000 | Biosan, Latvia | BS-010205-AAN | |
| Oregon Green 488 BAPTA-1 pentapotassium salt | Molecular Probes, USA | O6806 | 500 μg |
| Pipette | Biohit, Russia | 720210 | 0.5-10 µL |
| Pipette tip | Biohit, Russia | 781349 | 10 µL |
| Plasticine | local producer | ||
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40 mm |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel | |
| Stereomicroscope, Leica M80 | Leica Microsystems , Germany | ||
| Suction electrode | Kazakov A. SIMPLE SUCTION ELECTRODE FOR ELECTRIC STIMULATION OF BIOLOGICAL OBJECTS / A. Kazakov, M. Alexandrov, N. V. Zhilyakov et al. // International research journal. - 2015. - No. 9 (40) Part 3. - P. 13-16. | http://research-journal.org/biology/prostoj-vsasyvayushhij-elektrod-dlya-elektricheskoj-stimulyacii-biologicheskix-obektov/ | |
| Sylgard 184 elastomer | Dow Corning, USA | ||
| Syringe | local producer | 0.5 mL | |
| Syringe | local producer | 60 mL |
Ссылки
- Llinas, R., Steinberg, I. Z., Walton, K. Presynaptic calcium currents and their relation to synaptic transmission: voltage clamp study in squid giant synapse and theoretical model for the calcium gate. Proceedings of the National Academy of Sciences of the United States of America. 73 (8), 2918-2922 (1976).
- Augustine, G. J. How does calcium trigger neurotransmitter release. Current Opinion in Neurobiology. 11 (3), 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37 (5), 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Current Opinion in Neurobiology. 15 (3), 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Current Opinion in Cell Biology. 22 (4), 496-505 (2010).
- Leal, S. S., Gomes, C. M. Calcium dysregulation links ALS defective proteins and motor neuron selective vulnerability. Frontiers in Cellular Neuroscience. 9, 225 (2015).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods in Cell Biology. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Macleod, G. T. Topical application of indicators for calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 786-790 (2012).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in Neuroscience and Development: A Laboratory Manual. , 307-314 (2005).
- Eilers, J., Konnerth, A. Dye loading with patch pipettes. Cold Spring Harbor Protocols. 2009 (4), 5201 (2009).
- Coleman, W. L., et al. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. Journal of Physiology. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct injection of indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 797-801 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10 (3), 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. α-Latrotoxin releases calcium in frog motor nerve terminals. The Journal of Neuroscience. 20 (23), 8685-8692 (2000).
- Newman, Z., et al. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. The European Journal of Neuroscience. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 791-796 (2012).
- Rossano, A. J., Macleod, G. T. Loading drosophila nerve terminals with calcium indicators. Journal of Visualized Experiments: JoVE. (6), e250 (2007).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Suzuki, S., et al. Ca2+ dynamics at the frog motor nerve terminal. Pflugers Archiv: European Journal of Physiology. 440 (3), 351-365 (2000).
- Ojala, K. S., et al. A high-affinity, partial antagonist effect of 3,4-diaminopyridine mediates action potential broadening and enhancement of transmitter release at NMJs. Journal of Biological Chemistry. 296, 100302 (2021).
- Samigullin, D., et al. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Frontiers in Synaptic Neuroscience. 6, 29 (2015).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. The Journal of Physiology. 505, 585-592 (1997).
- Bullen, A., Patel, S. S., Saggau, P. High-speed, random-access fluorescence microscopy: I. High-resolution optical recording with voltage-sensitive dyes and ion indicators. Biophysical Journal. 73 (1), 477-491 (1997).
- Bullen, A., Saggau, P. High-speed, random-access fluorescence microscopy: II. Fast quantitative measurements with voltage-sensitive dyes. Biophysical Journal. 76 (4), 2272-2287 (1999).
- Bullen, A., Saggau, P. Optical recording from individual neurons in culture. Modern Techniques in Neuroscience Research. (4), 89-126 (1999).
- Bullen, A., Saggau, P. Indicators and optical configuration for simultaneous high-resolution recording of membrane potential and intracellular calcium using laser scanning microscopy. Pflugers Archiv European Journal of Physiology. 436 (5), 788-796 (1998).
- Wilson, T. Optical aspects of confocal microscopy. Confocal Microscopy. , 93-141 (1990).
- Cox, G. Biological confocal microscopy. Materials Today. 5 (3), 34-41 (2002).
- Mukhitov, A., Arkhipova, S., Nikolsky, E. Modern Light Microscopy in Biological and Medical Research. Nauka. , (2011).
- Mertz, J. Optical sectioning microscopy with planar or structured illumination. Nature Methods. 8 (10), 811-819 (2011).
- Webb, R. H. Confocal optical microscopy. Reports on Progress in Physics. 59 (3), 427-471 (1996).
- Toomre, D., Pawley, J. B. Disk-scanning confocal microscopy. Handbook of Biological Confocal Microscopy: Third Edition. , 221-238 (2006).
- Venkateswarlu, K., et al. Three-dimensional imaging and quantification of real-time cytosolic calcium oscillations in microglial cells cultured on electrospun matrices using laser scanning confocal microscopy. Biotechnology and Bioengineering. 117 (10), 3108-3123 (2020).
- Arkhipov, A. Y., Khaziev, E. F., Skorinkin, A. I., Bukharaeva, E. A., Samigullin, D. V. Enhancement of the temporal resolution of fluorescent signals acquired by the confocal microscope. Microscopy and Microanalysis. 26 (2), 204-210 (2020).
- Rama, S. Shift and mean algorithm for functional imaging with high spatio-temporal resolution. Frontiers in Cellular Neuroscience. 9, (2015).
- Chan, K. G., Streichan, S. J., Trinh, L. A., Liebling, M. Simultaneous temporal superresolution and denoising for cardiac fluorescence microscopy. IEEE Transactions on Computational Imaging. 2 (3), 348-358 (2016).
- Veeraraghavan, A., Reddy, D., Raskar, R. Coded strobing photography: compressive sensing of high speed periodic videos. IEEE Transactions on Pattern Analysis and Machine Intelligence. 33 (4), 671-686 (2011).
- Angaut-Petit, D., Molgo, J., Connold, A. L., Faille, L. The levator auris longus muscle of the mouse: A convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. Neuroscience Letters. 82 (1), 83-88 (1987).
- Macleod, G. T. Calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 7 (7), 758-766 (2012).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Bukharaeva, E. A., Nikolsky, E. E. Loading a calcium dye into frog nerve endings through the nerve stump: calcium transient registration in the frog neuromuscular junction. Journal of Visualized Experiments: JoVE. (125), e55122 (2017).
- Samigullin, D. V., et al. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoScience. 7 (1), 162-166 (2017).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. Journal of Neuroscience. 31 (31), 11268-11281 (2011).
- Luo, F., Dittrich, M., Cho, S., Stiles, J. R., Meriney, S. D. Transmitter release is evoked with low probability predominately by calcium flux through single channel openings at the frog neuromuscular junction. Journal of Neurophysiology. 113 (7), 2480-2489 (2015).
- Wright, M., Kim, A., Son, Y. -. J. Subcutaneous administration of muscarinic antagonists and triple-immunostaining of the levator auris longus muscle in mice. Journal of Visualized Experiments: JoVE. (55), e3124 (2011).
- Burke, S. R. A., Reed, E. J., Romer, S. H., Voss, A. A. Levator Auris Longus preparation for examination of mammalian neuromuscular transmission under voltage clamp conditions. Journal of Visualized Experiments: JoVE. (135), e57482 (2018).
- Kazakov, A., Alexandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Meždunarodnyj naučno-issledovatel'skij žurnal (International Research Journal). 9 (40), 13-16 (2015).
- Bowman, W. C. Neuromuscular block. British Journal of Pharmacology. 147, 277-286 (2006).
- Hill, J. M., Alewood, P. F., Craik, D. J. Three-dimensional solution structure of µ-conotoxin GIIIB, a specific blocker of skeletal muscle sodium channels. Biochemistry. 35 (27), 8824-8835 (1996).
- Land, B. R., Johnson, B. R., Wyttenbach, R. A., Hoy, R. R. Tools for physiology labs: Inexpensive equipment for physiological stimulation. Journal of Undergraduate Neuroscience Education. 3 (1), 30-35 (2004).
- Samigullin, D. V., Zhilyakov, N. V., Khaziev, E. F., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient and quantal release in mouse neuromuscular junction under extracellular calcium concentration change. BioNanoScience. 8 (4), 984-987 (2018).
- Khaziev, E., et al. acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Frontiers in Physiology. 7, 621 (2016).
- Zhilyakov, N., Arkhipov, A., Malomouzh, A., Samigullin, D. Activation of neuronal nicotinic receptors inhibits acetylcholine release in the neuromuscular junction by increasing ca2+ flux through cav1 channels. International Journal of Molecular Sciences. 22 (16), 9031 (2021).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophysical Journal. 74 (3), 1549-1563 (1998).
- McArdle, J. J., et al. Advantages of the triangularis sterni muscle of the mouse for investigations of synaptic phenomena. Journal of Neuroscience Methods. 4 (2), 109-115 (1981).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены