Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Konfokal Mikroskopi Kullanılarak Fare Nöromüsküler Kavşağında Yüksek Zamansal Çözünürlükte Kalsiyum Geçici Maddelerinin Kaydı
Bu Makalede
Özet
Protokol, kesilmiş sinirden fare motor sinir terminallerine floresan kalsiyum boyası yükleme yöntemini açıklar. Ek olarak, konfokal mikroskopi kullanarak periferik sinir uçlarındaki hızlı kalsiyum geçicilerini kaydetmek için benzersiz bir yöntem sunulmuştur.
Özet
Presinaptik kalsiyum seviyesinin tahmini, sinaptik iletimin incelenmesinde kilit bir görevdir, çünkü presinaptik hücreye kalsiyum girişi, nörotransmitter salınımına yol açan bir dizi olayı tetikler. Ayrıca, presinaptik kalsiyum seviyelerindeki değişiklikler birçok hücre içi proteinin aktivitesine aracılık eder ve sinaptik plastisitede önemli bir rol oynar. Kalsiyum sinyallemesini incelemek, nörodejeneratif hastalıkları tedavi etmenin yollarını bulmak için de önemlidir. Nöromüsküler kavşak, sadece bir tür nörotransmittere sahip olduğu için sinaptik plastisiteyi incelemek için uygun bir modeldir. Bu makalede, kalsiyuma duyarlı bir boyanın kesilmiş sinir demeti boyunca farelerin motor sinir uçlarına yüklenme yöntemi açıklanmaktadır. Bu yöntem, bazal kalsiyum seviyesi ve kalsiyum geçici gibi hücre içi kalsiyum değişiklikleriyle ilgili tüm parametrelerin tahmin edilmesini sağlar. Kalsiyumun hücre dışından sinir terminallerine akışı ve kalsiyuma duyarlı boyaya bağlanması/çözülmesi birkaç milisaniye aralığında gerçekleştiğinden bu olayları kaydetmek için hızlı bir görüntüleme sistemi gereklidir. Gerçekten de, yüksek hızlı kameralar hızlı kalsiyum değişimlerinin kaydedilmesi için yaygın olarak kullanılır, ancak düşük görüntü çözünürlüğü parametrelerine sahiptirler. Burada kalsiyum geçici kaydı için sunulan protokol, konfokal mikroskopi tarafından sağlanan son derece iyi mekansal-zamansal çözünürlüğe izin verir.
Giriş
Uyarılabilir hücrelerde hızlı kalsiyum dalgalarını ölçme problemi, merkezi ve periferik sinir sistemlerinde sinyal iletimini incelemenin en önemli ve zorlu yönlerinden biridir. Kalsiyum iyonları, nörotransmitter salınımını, sinaptik plastisiteyi ve çeşitli hücre içi proteinlerin aktivitesinin modülasyonunu tetiklemede önemli bir rol oynar 1,2,3,4,5. Kalsiyum sinyallemesini incelemek, nörodejeneratif hastalıkları tedavi etmenin yollarını bulmak için de önemlidir6. Kalsiyum seviyelerindeki değişiklikleri ölçmek için, floresan kalsiyuma duyarlı boyalar yaygın olarak kullanılır ve floresan seviyelerindeki değişiklikler analiz edilir 7,8,9.
Kalsiyum boyalarının hücrelere yüklenmesi farklı şekillerde sağlanabilir. Ağırlıklı olarak, hücre perkastan boyalar10,11 oranında kullanılır. Bununla birlikte, böyle bir durumda, sadece hücre içindeki bir boya konsantrasyonunu kontrol etmek zor değildir, aynı zamanda yükleme için hedef hücreleri seçmek de zordur. Bu yöntem, boya postsinaptik hücrelere girdiğinden periferik sinir uçlarını incelemek için geçerli değildir. Bunun yerine, hücre geçirimsiz boyalar bu tür preparatlar için daha uygundur. Bu durumda, boyalar hücrelere mikroenjeksiyonla veya bir yama pipeti 12,13,14 yoluyla verilir. Bir sinir kütüğünden yükleme yöntemi de vardır. İkinci yöntem, nöromüsküler bileşke preparatları15,16,17,18,19,20 için en uygun yöntemdir. Sadece ilgilenilen hücreler için boyama yapılmasına izin verir. Bu yöntem, hedef hücredeki boya konsantrasyonunun doğru bir değerlendirmesini sağlamasa da, konsantrasyon, çözeltilerde duran hücrelerin floresan seviyesini, bilinen bir kalsiyum21 konsantrasyonu ile karşılaştırarak yaklaşık olarak tahmin edilebilir. Bu çalışmada, memelilerin sinapslarına uygulanan bu yöntemin bir modifikasyonu sunulmuştur.
Aksiyon potansiyelinin depolarize fazı sırasında kalsiyum girişi, özellikle nöromüsküler kavşakta hızlı bir süreçtir; bu nedenle, tescili için uygun ekipman gereklidir1. Voltaja duyarlı bir floresan boya kullanan yeni bir çalışma, bir farenin periferik sinapsındaki aksiyon potansiyelinin süresinin yaklaşık 300 μs22 olduğunu göstermiştir. Kurbağanın periferik sinapslarında kalsiyuma duyarlı boyalar kullanılarak değerlendirilen kalsiyum geçici, daha uzun bir süreye sahiptir: yükselme süresi yaklaşık 2-6 ms ve çürüme süresi, kullanılan kalsiyum boyasına bağlı olarak yaklaşık 30-90 ms'dir. Floresan boyaların yardımıyla hızlı süreçleri ölçmek için, genellikle hızlı ve hassas CCD matrislerine sahip CCD veya CMOS kameralar kullanılır. Bununla birlikte, bu kameralar,matris 25,26,27,28'in hassas elemanlarının boyutuyla sınırlı olan düşük çözünürlük dezavantajına sahiptir. Hücrelerin düşük frekanslı uyarılmasına yanıt olarak hem aksiyon potansiyellerini hem de kalsiyum geçicilerini kaydetmek için yeterli hassasiyete sahip en hızlı kameralar, 2.000 Hz'lik bir tarama frekansına ve 80 x 8029 boyutunda bir matrise sahiptir. Daha yüksek uzamsal çözünürlüğe sahip sinyaller elde etmek için, özellikle30,31,32 sinyalindeki bazı hacimsel değişiklikleri değerlendirmek gerekirse, konfokal mikroskopi kullanılır. Ancak, konfokal mikroskobun çizgi tarama modunda yüksek bir tarama hızına sahip olduğu akılda tutulmalıdır, ancak uzamsal bir görüntü oluştururken hızlı işlemlerin kayıt hızında hala önemli sınırlamalar vardır33. Daha yüksek tarama hızına sahip dönen Nipkow disklerine (yarık tarama mikroskobu) ve Çok Noktalı Dizi Tarayıcılara dayanan konfokal mikroskoplar vardır. Aynı zamanda, konfokal görüntü filtrelemede klasik konfokal mikroskoplardan daha düşüktürler (Nipkow diskli mikroskoplar için iğne delikleri çapraz konuşma)32,34,35. Rezonans taramalı konfokal görüntüleme aynı zamanda yüksek zamansal ölçümler için gereken yüksek uzaysal-zamansal çözünürlük sağlayabilir36. Bununla birlikte, rezonans tarayıcıları kullanırken zayıf floresan tepkilerinin yüksek bir tarama hızında kaydedilmesinin, hibrit dedektörler gibi son derece hassas dedektörler gerektirdiğini dikkate alın36.
Bu makalede, uzamsal çözünürlük37'yi korurken Lazer Tarama Konfokal Mikroskopisi (LSCM) ile kaydedilen sinyallerin zamansal çözünürlüğünü artırmak için bir yöntem sunulmaktadır. Mevcut yöntem, daha önce açıklanan ve LSCM platformu 38,39,40'a aktarılan yöntemlerin daha da geliştirilmesidir. Bu yaklaşım, mikroskop donanımında değişiklik gerektirmez ve periyodik olarak uyarılan floresan sinyalleri, stimülasyon anına göre bir zaman kayması ile kaydetmek için bir algoritmanın uygulanmasına dayanır.
Protokol
Fareler BALB/C'den (20-23 g, 2-3 aylık) levator auris longus'un (m. LAL) izole sinir-kas preparatları üzerinde deneyler yapıldı41. Deneysel prosedürler, Kazan Federal Üniversitesi ve Kazan Tıp Üniversitesi'nin laboratuvar hayvanlarının kullanımına ilişkin kılavuzlara uygun olarak, NIH Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak gerçekleştirilmiştir. Deneysel protokol, 86/609/EEC sayılı Avrupa Toplulukları Konseyi Direktifi'nin gerekliliklerini karşıladı ve Kazan Tıp Üniversitesi Etik Komitesi tarafından onaylandı.
1. Zil ve Dosyalama çözümlerinin hazırlanması
- Aşağıdaki bileşenleri karıştırarak memeli kası için Ringer çözeltisini hazırlayın: NaCl (137 mM), KCl (5 mM), CaCl 2 (2 mM), MgCl 2 (1 mM), NaH2 PO4 (1 mM), NaHCO3 (11.9 mM) ve glikoz (11 mM). Çözeltiden %95O2 ve %5 CO2 ile kabarcık geçirin ve gerekirse HCl/NaOH ekleyerek pH'ını 7.2-7.4'e ayarlayın.
- Boya yükleme çözeltisini hazırlayın.
- 7.2-7.4 aralığında pH'lı HEPES (10 mM) çözeltisi hazırlayın. 500 μg ticari boya, 500 μL'lik bir şişede gelir. 30 mM'lik bir boya konsantrasyonu elde etmek için boyayı HEPES çözeltisinin 14 μL'sinde çözün. İyice çalkalayın ve tamamen çözünene kadar santrifüj yapın.
- Ca2+ göstergesinin çözeltisini HEPES çözeltisi ile 1 mM konsantrasyona kadar seyreltin. Bir dondurucuda (-20 ° C) saklayın ve ışığa maruz kalmaktan kaçının.
2. Boya yükleme prosedürü
NOT: Boya yükleme prosedürü, daha önce yayınlanan 19,42,43,44,45,46 protokollerinden uyarlanmış sinir kütüğünden yükleme protokolüne göre gerçekleştirilir.
- LAL kasını daha önce yayınlanmış protokoller47,48'de açıklandığı gibi bu preparat için diseksiyon prosedürüne göre diseke edin.
- Elastomer kaplı Petri kabında hafifçe gerilmiş dokuyu (başlangıç uzunluğundan en fazla% 30) ince paslanmaz çelik pimlerle sabitleyin ve kas tamamen kaplanana kadar Ringer çözeltisini ekleyin.
NOT: Petri kabı, üreticinin talimatlarına göre elastomer ile önceden doldurulmuştur (bkz.
- Elastomer kaplı Petri kabında hafifçe gerilmiş dokuyu (başlangıç uzunluğundan en fazla% 30) ince paslanmaz çelik pimlerle sabitleyin ve kas tamamen kaplanana kadar Ringer çözeltisini ekleyin.
- Dolum Pipetini Hazırlama
- Bir mikropipet çektirici kullanarak (bkz. Malzeme Tablosu), hücre içi kayıtlar için mümkün olduğunca keskin olan ince uçlu bir mikropipet hazırlayın. İç filamentsiz kılcal damarlar kullanın (dış çapta 1,5 mm ve iç çapta 0,86 veya 1,10 mm).
- Konikliği aşındırıcı ile puanladıktan sonra mikropipet ucunu kırın ve ucu yaklaşık 100 μm çapında açık bırakın. İç çap >80 μm'den 12-13 μm'ye düştüğünde sınırlamak için ucu ateşle cilalayın. Dolum Pipetinin bir tarafına silikon bir tüp ve diğer tarafına bir şırınga (iğnesiz) takın.
- Bir stereomikroskop altında, sinir gövdesinin ayrı sinir dallarına dönüştüğü yeri bulun. Dolgu Pipetini monte edilmiş tüp ve şırınga ile balmumu kullanarak Petri kabının üzerine yerleştirin. Pipet ucunu sinirin üzerinde durana kadar hareket ettirin.
- İnce makasla siniri kas lifine yakın bir şekilde kesin ve sinir kütüğünün yaklaşık 1 mm uzunluğunda küçük bir parçasını bırakın. Sinir kütüğünü, bazı Ringer çözeltisiyle birlikte, sıkıştırmadan, Doldurma Pipetinin ucuna nazikçe aspire edin. Silikon tüpü Dolum Pipetinden çıkarın.
- Uzun filamentli bir şırınga kullanarak boya yükleme çözeltisinin bir miktarını (~ 0.3 μL) çekin. Bu hacim filamentin yaklaşık 3 cm'sine karşılık gelir.
NOT: Başlangıçta, bir alkol lambası veya bir gaz brülörü kullanarak ateşi çekerek 10 μL hacimli bir pipet ucundan bir filament yapmak gerekir. - Filament ucunu yükleme solüsyonu ile birlikte yavaşça Dolum Pipetine yerleştirin. Karışımı doğrudan sinir kütüğüne bırakın. Hazırlığı oda sıcaklığında karanlıkta 30 dakika boyunca inkübe edin.
- Bundan sonra, preparatı taze Ringer çözeltisi ile durulayın ve 50 mL (veya daha fazla) Ringer çözeltisi olan bir cam beherde 2 saate kadar 25 ° C'de inkübe edin (preparat çözelti ile kaplanmalıdır). Bu süre zarfında, boya sinapslara ulaşacaktır.
3. Konfokal mikroskopi ile video yakalama
NOT: Kalsiyum geçicilerinin kaydı, lazer taramalı konfokal mikroskop (LSCM) ile gerçekleştirilir (bkz. Hızlı kalsiyum geçicilerini kaydetmek için, sinyallerin yeterli uzamsal ve zamansal çözünürlükte kaydedilmesine izin veren orijinal bir protokol kullanılmıştır. Yöntem, Arkhipov ve ark.37 tarafından yayınlanan yayında ayrıntılı olarak tanımlanmıştır. Mikroskop, 20x su daldırma hedefi (1.00 NA) ile donatılmıştır. 488 nm lazer hattı% 10 yoğunluğa düşürüldü ve emisyon floresansı 503 ila 558 nm arasında toplandı.
- Preparatı silikon elastomer kaplı deney odasına monte edin ve hafifçe gerilmiş bir dizi çelik mikro iğne ile sabitleyin. Hazırlığı Ringer çözeltisi ile iyice durulayın.
NOT: Organik camdan yapılmış, odanın tabanı elastomer ile kaplı basit bir ısmarlama perfüzyon deney odası kullanılmıştır (üreticinin talimatlarına uygun olarak hazırlanmıştır; bakınız Malzeme Tablosu). Odanın bir çözelti besleme tüpü vardır. Çözelti, manyetik bir tutucuya monte edilmiş bir şırınga iğnesi aracılığıyla dışarı pompalanır (bkz. Bir deney odası olarak, bir Petri kabı (preparatın inkübasyonu için kullanılanlar gibi) kullanılabilir, ancak bağlı besleme ve emme tüpleri ile. - Siniri uyarmak için kullanılacak emme elektrodunu takın.
NOT: Elektrotun yapısı, Kazakov ve ark.49 tarafından 2015 yılında yayınlanan makaleye benzer. Elektrodu banyonun yanına ağda yaparak yerleştirin ve sabitleyin. Ucu sinir kütüğüne yaklaştırın ve elektroda aspire edin. - Hazırlama odasını mikroskop aşamasına monte edin ve giriş ve çıkış bağlantı parçalarını odaya yerleştirin.
- Hazırlığı incelemek için, basit bir yerçekimi akışı tahrikli sistem kullanın. Fazla çözeltiyi çıkarmak için perfüzyon emme pompasını açın.
- Uyarıcı emme elektrodunu bir elektrik stimülatörüne takın ve uyaranlardan sonra kas kasılmalarının meydana geldiğinden emin olun. Stimülasyon koşulları ve kayıt için bölüm 3.9-3.12'ye bakınız.
- Perfüzyon sistemini Ringer'ın d-tubokurarin (10 μM) çözeltisi ile doldurun.
NOT: Bu çözüm kas kasılmalarını önlemeye yardımcı olur. Postsinaptik membran üzerindeki nikotinik asetilkolin reseptörlerinin D-tubokurarin veya alfa-bungarotoksine özgü blokerleri, kas kasılmalarını tamamen veya kısmen bloke edecektir50. Ayrıca, kas kasılmalarını önlemek için, μ-konotoksin GIIIB gibi postsinaptik sodyum kanallarının spesifik blokerleri kullanılabilir51. - Perfüzyon emme pompasını açın ve preparatın perfüzyonunu d-tubokurarin içeren Ringer çözeltisi ile başlatın.
- LSCM yazılımında görüntüleme parametrelerini aşağıdaki gibi ayarlayın.
- LSCM yazılımında (LAS AF; bakınız Malzeme Tablosu), Elektrofizyoloji'yi seçin.
NOT: Bu modda, zaman noktasında bir görüntü yakalandığında, tetikleyici kutu yardımıyla uyarıcıya senkronize edici bir darbe gönderilir. Bu, preparatta aksiyon potansiyeli üretimini ortaya çıkarır (Şekil 1; uyarıcı ünite). - Edinme Modu'nu seçin. Mikroskop senkronizasyon darbesini kullanarak uyarıcıyı tetiklemek için, İş menü ayarlarında Tetikleyici ayarları'nı seçin. Çerçevede Tetikleyici Çıkışı alanını out1 kanalına ayarlayın.
- Şu ayarları kullanın: Tarama Modu: XYT, Tarama Frekansı: 1400 Hz, Yakınlaştırma Faktörü: 6.1, İğne Deliği: tamamen açık. Sıralı geçiş yapan Çift Yönlü X modunun açık olduğundan emin olun.
- 52 ms'de bir kare oluşturmak için minimum süreyi ve 20 karede ham bir videoda toplanacak kareleri ayarlayın.
NOT: Bu ayarlar, her 52 ms'de bir tek bir kare çekerken 128 x 128 piksel çözünürlükte görüntü yakalamaya izin verir. - Argon lazerin uyarma dalga boyunu çıkış gücünün% 8'i ile 488 nm'de ayarlayın.
- LSCM yazılımında (LAS AF; bakınız Malzeme Tablosu), Elektrofizyoloji'yi seçin.

Şekil 1: Deney düzeneğinin şeması. 1. Lazer Taramalı Konfokal Mikroskop (LSCM). 2. LSCM'nin senkronizasyon modülü (tetik kutusu). 3. Stimülatör. 4. İzolasyon ünitesi. 5. Biyolojik örnek. 6. Sinirin elektriksel uyarımı için emme elektrodu. 7. Perfüzyon sistemleri (7a: perfüzyon rezervuarı, 7b: damlalık, 7c: akış regülatörü, 7d: vakum şişesi). Oklar, senkronize darbenin yayılma yönüne işaret eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Canlı moda geçmek için Canlı Mod düğmesine basın, bu da boya ile yüklenen sinir terminallerinin önizlemesini almanıza yardımcı olur.

Şekil 2: Ca2+ göstergesi yüklü fare siniri ve terminalleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Stimülasyon ünitesi
NOT: Bu çalışmada, Land ve ark.52 tarafından makalede açıklanan uyarıcı kullanılmıştır. Bu cihaz, MatLab yazılımı aracılığıyla stimülasyonun zamansal parametrelerinin ayarlanmasına izin verir.- Yeni bir dosya oluşturun, yukarıda belirtilen makaledeki kodu MatLab kod penceresine yapıştırın ve dosyayı kaydedin. Çalıştır'a tıklayın, böylece stimülasyon parametrelerini içeren bir pencere belirir. Uyaranın gecikme süresini ve süresini ayarlayın.
NOT: Gecikme, yeniden yapılandırılmış floresan sinyalinin zamansal çözünürlüğünü belirler. 0,2 ms süreli elektrik darbesi geciktirilir ve daha sonra izolasyon ünitesine gönderilir. İkincisi, uyarıcı darbenin genliğini ve polaritesini oluşturur ve biyolojik nesneyi kayıt cihazından elektriksel olarak izole eder. - Siniri uyarmak için, uyarıcı impulsun supramaksimal genliğini seçin (tüm sinir liflerini aktive etmek için gereken maksimum stimülasyon yoğunluğundan% 25 -% 50 daha fazla).
NOT: Sunulan yöntem, LSCM kullanılarak tek bir hızlı floresan sinyalinin en aza indirilmiş süpürme ile kaydedilmesi için özel bir algoritmaya dayanmaktadır. Geliştirilen algoritmanın her adımında, kaydedilen floresan sinyali, mikroskop taramasından daha kısa bir zaman aralığı ile bir öncekinden kaydırılır. Zaman kaymalarının değeri, gerekli sinyalin zamansal çözünürlüğünü belirler. Algoritmadaki adımların (kaymaların) sayısı, gerekli zamansal çözünürlüğe ve orijinal zamansal çözünürlüğe bağlıdır. Bu kayıt yöntemiyle, preparatın uyarılması 0.25 Hz sıklıkta gerçekleştirilir.
- Yeni bir dosya oluşturun, yukarıda belirtilen makaledeki kodu MatLab kod penceresine yapıştırın ve dosyayı kaydedin. Çalıştır'a tıklayın, böylece stimülasyon parametrelerini içeren bir pencere belirir. Uyaranın gecikme süresini ve süresini ayarlayın.
- Canlı modda, YG'yi arayın ve en iyi odağı elde edin. Veri toplama yazılımını çalıştırın.
- Stimülatördeki gecikmeyi önceki değere göre 2 ms daha az kaydırın ve veri toplama yazılımını çalıştırın.
- 26 dizi elde etmek için 3,11 adımını 26 kez tekrarlayın, her dizi bir öncekinden 2 ms kaydırılır.
4. Video işleme
NOT: Konfokal mikroskop tarafından elde edilen bir dizi video görüntüsü, LAS X özgür yazılımı ile TIFF formatında dışa aktarılır (bkz. Bu seri çerçevelere bölündü ve bir klasöre dışa aktarıldı. Görüntü dizisini daha yüksek zaman çözünürlüğü ile oluşturmak için, verilerin analizi ve işlenmesi için açık bir başlangıç koduna sahip olan ImageJ yazılımı kullanılmıştır. Sinyal işleme algoritması Şekil 3'te şematik olarak gösterilmiştir.
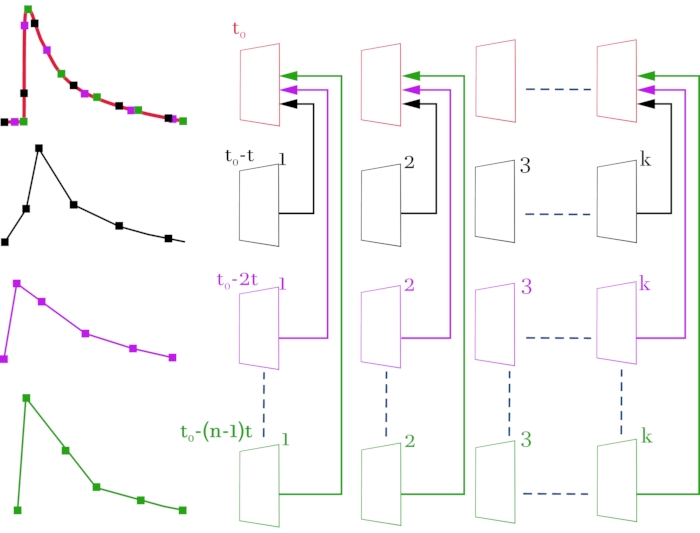
Şekil 3: Düşük zamansal çözünürlüğe (kare üzerinde 52 ms) sahip orijinal video dosyalarından yüksek çözünürlüklü bir video dosyası (kare üzerinde 2 ms) derleme şeması. Orijinal video dosyaları ve ilgili sinyaller siyah, macenta ve yeşil renktedir. Derlenen video dosyası ve ortaya çıkan sinyal kırmızı renktedir. Sağdaki şema, satır satır, konfokal mikroskopla elde edilen video görüntülerini gösterir. Solda, karşılık gelen floresan sinyalleri seçilen ROI'den değişir. En üst çizgi, şemaya göre alınan çerçevelerden kare kare oluşturulur. Sonuç, tüm kare dizisinden oluşan bir video görüntüsüdür, böylece kareler arasında 52 ms yerine 2 ms'lik bir gecikme süresi vardır. Her satır, stimülasyon sinyalinin (n - 1) * t ile bir ofsetine karşılık gelir, burada t, zaman kayması (2 ms) ve n, kayma yinelemelerinin sayısıdır. k, orijinal video dosyalarındaki kare sayısını (satır 2-4) gösterir ve kaydedilen sinyalin süresine bağlıdır. Bu durumda, 1 s süreli bir sinyal kaydetmek için, k = 20 (52 ms * 20 = 1040 ms) seçmek gerekir. t0 , stimülasyondan önce gerekli gecikmedir. n kaydırma yinelemelerinin sayısını hesaplamak için, kareler arasındaki ilk zamansal çözünürlük (52 ms) gerekli zamansal çözünürlüğe (2 ms) bölünmelidir. Bu durumda, n = 26, bu da 26 kayıtlı süpürmeye karşılık gelir. Yapılan manipülasyonlar sonucunda n*k=520 karelik bir video görüntüsü elde edilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- LAS X yazılımını çalıştırın. Deneme gerçekleştirilirken oluşturulan projeyi açın. Çerçeveleri hedef klasöre .tiff biçimde kaydetmek için Dışa Aktar'a ve ardından Farklı Kaydet'e tıklayın.
- ImageJ yazılımını çalıştırın. Görüntü dizisini içe > Dosya > tıklayın.
- Görüntü Dizisini Aç penceresinde, hedef klasörü seçin ve ilk kareyi açın.
- Sıra Seçenekleri penceresinde, Başlangıç Görüntüsü alanında, ilk kare için kare numarasını 1 olarak ayarlayın. Artış alanında, değeri ilk sinyal kaydındaki kare sayısına eşit olarak ayarlayın (mevcut durum için 20) ve Tamam'a tıklayın.
- Dikişli ilk karelerin oluşturulan dosyasını ayrı bir klasöre kaydetmek için, Dosya > > Klasöre Kaydet'e tıklayın.
- Sonraki 19 kare için 4.3-4.5 arasındaki adımları yineleyin. Sıra Seçenekleri penceresinde, Başlangıç Görüntüsü alanında ilgili kare numarasını ayarlayın.
- Tam yüksek çözünürlüklü video oluşturmak için tüm kareleri bir araya getirin. Bunu yapmak için, Dosya > > Görüntü Dizisini İçe Aktar'a tıklayın ve Başlangıç Görüntüsü ve Artış alanlarında 1'i seçin. Sonuç, artırılmış zamansal çözünürlüğe sahip son video olacaktır. Dosyayı .tiff veya başka bir uygun biçimde kaydedin.
5. Video analizi
NOT: ImageJ'de YG ve arka plan seçeneğini belirleyin. YG'den arka planı çıkarın. Veriler, (ΔF / F 0 - 1) *% 100 oranında temsil edilir; burada F0, istirahatteki floresanın yoğunluğudur ve ΔF, stimülasyon sırasında floresanın yoğunluğudur.
- Yığın Sıralayıcı'> Resim > Yığınları > Araçları'na tıklayın. Ardından, Yatırım Getirisi Yöneticisi'> Analiz > Araçları'na tıklayın.
- Adım 4.7'de kaydedilen .tiff dosyasını sürükleyip ImageJ penceresine bırakın. Daha iyi bir görünüm için görüntüyü genişletin. Görüntü görselleştirmeyi geliştirmek için, Görüntü'ye tıklayın > Otomatik > > Parlaklığını / Kontrastını Ayarlayın. Bu adım verileri etkilemez.
- Yatırım getirisi çizerek arka planı sinir terminaline yakın bir yere ayarlayın. Yatırım getirisi yöneticisine ekleyin. Daha > Çoklu Hesaplama'ya tıklayarak arka planı hesaplayın. Ortalama değerleri kopyalayın, E-tablo programına yapıştırın ve ortalamayı hesaplayın.
- Hesaplanan ortalama değeri, Ana > İşlem'> Çıkar'a tıklayarak yığınlardan çıkarın. Değeri girin.
- Bir çokgen çizgisi aracılığıyla bir sinir terminalinin etrafına yatırım getirisi çizin. Yatırım getirisi yöneticisine ekleyin.
- Sinir terminalinin yoğunluğunu ölçün: Daha Fazla > Çoklu Ölçüm'e tıklayın. Ortalama değerleri kopyalayın ve E-tablo programına yapıştırın.
- Sinyallerin ortalama ofsetini hesaplayın.
NOT: Stimülasyondan önceki gecikme süresine bağlı olarak ilgili noktaları kullanın. Bu adım, sonraki hesaplamalarda kullanılacak F0 değerini belirler. - Sinyal değerlerini ortalama ofset değerine bölün.
NOT: Bu adımdan sonra sinyal, arka planın ve ham floresanın seçilen ROI için genlik değerlerine katkısını içermez. - Adım 5.8'de elde edilen değerlerden 1'i çıkarın ve ardından %100 ile çarpın.
- Ca2+- geçici bir grafik çizin ve genliği hesaplayın.
Sonuçlar
Preparatı sunulan tekniğe göre boya ile yükledikten sonra, sinir kütüğüne yakın bulunan sinapsların çoğu yeterli bir floresan seviyesine sahipti (bkz. Şekil 2). Boya ile hazırlama yüklendikten ve tarif edilen kayıt ve görüntü işleme yöntemi uygulandıktan sonra, istenen mekansal ve zamansal çözünürlüğe sahip kalsiyum geçicileri elde edildi (bkz. Şekil 4). Kalsiyum geçicisi önerilen yöntemle geri kazanılmıştır (bkz.
Tartışmalar
Bu makalede, Ca 2 + 'ya duyarlı boyanın sinir kütüğü yoluyla fare sinir uçlarına yüklenmesi ve konfokal mikroskop kullanılarak hızlı bir kalsiyum geçicisinin kaydedilmesi yöntemi sunulmuştur. Bu yükleme yönteminin uygulanmasının bir sonucu olarak, sinir kütüğüne yakın bulunan sinapsların çoğu, motor sinirin düşük frekanslı uyarımına yanıt olarak kalsiyumun sinir uçlarına girişinin kaydedilmesini sağlamak için yeterli bir floresan seviyesine sahipti.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışmanın floresan çalışmaları, Rusya Bilim Vakfı Hibe (proje No. 19-15-00329) finansal desteği ile gerçekleştirilmiştir. Yöntem, RAS АААА-А18-118022790083-9 FRC Kazan Bilim Merkezi için hükümet görevlendirmesinden sağlanan finansman altında geliştirilmiştir. Araştırma, Federal Araştırma Merkezi "RAS Kazan Bilim Merkezi" ekipmanlarının kullanılmasıyla geliştirilmiştir. Yazarlar, bu makaleyi eleştirel bir şekilde okuduğu için Dr. Victor I. İlyin'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Capillary Glass | Clark Electromedical instruments, UK | GC150-10 | |
| Confocal and multiphoton microscope system Leica TCS SP5 MP | Leica Microsystems , Heidelberg, Germany | ||
| Flaming/Brown Micropipette Puller P 97 | Sutter Instrument, USA | P-97 | |
| Flow regulator | KD Medical GmbH Hospital Products, Germany | KD REG | Disposable infusion set with Flow regulator |
| HEPES | Sigma-Aldrich, USA | H0887 | 100mL |
| Illumination system Leica CLS 150X | Leica Microsystems, Germany | ||
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Las AF software | Leica Microsystems, Heidelberg, Germany | ||
| Las X software | Leica Microsystems, Heidelberg, Germany | https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/ | |
| Magnetic Holder with Suction Tubing | BIOSCIENCE TOOLS, USA | MTH-S | |
| Microspin FV 2400 | Biosan, Latvia | BS-010201-AAA | |
| Minutien Pins | Fine science tools, Canada | 26002-20 | |
| Multi-spin MSC 3000 | Biosan, Latvia | BS-010205-AAN | |
| Oregon Green 488 BAPTA-1 pentapotassium salt | Molecular Probes, USA | O6806 | 500 μg |
| Pipette | Biohit, Russia | 720210 | 0.5-10 µL |
| Pipette tip | Biohit, Russia | 781349 | 10 µL |
| Plasticine | local producer | ||
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40 mm |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel | |
| Stereomicroscope, Leica M80 | Leica Microsystems , Germany | ||
| Suction electrode | Kazakov A. SIMPLE SUCTION ELECTRODE FOR ELECTRIC STIMULATION OF BIOLOGICAL OBJECTS / A. Kazakov, M. Alexandrov, N. V. Zhilyakov et al. // International research journal. - 2015. - No. 9 (40) Part 3. - P. 13-16. | http://research-journal.org/biology/prostoj-vsasyvayushhij-elektrod-dlya-elektricheskoj-stimulyacii-biologicheskix-obektov/ | |
| Sylgard 184 elastomer | Dow Corning, USA | ||
| Syringe | local producer | 0.5 mL | |
| Syringe | local producer | 60 mL |
Referanslar
- Llinas, R., Steinberg, I. Z., Walton, K. Presynaptic calcium currents and their relation to synaptic transmission: voltage clamp study in squid giant synapse and theoretical model for the calcium gate. Proceedings of the National Academy of Sciences of the United States of America. 73 (8), 2918-2922 (1976).
- Augustine, G. J. How does calcium trigger neurotransmitter release. Current Opinion in Neurobiology. 11 (3), 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37 (5), 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Current Opinion in Neurobiology. 15 (3), 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Current Opinion in Cell Biology. 22 (4), 496-505 (2010).
- Leal, S. S., Gomes, C. M. Calcium dysregulation links ALS defective proteins and motor neuron selective vulnerability. Frontiers in Cellular Neuroscience. 9, 225 (2015).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods in Cell Biology. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Macleod, G. T. Topical application of indicators for calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 786-790 (2012).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in Neuroscience and Development: A Laboratory Manual. , 307-314 (2005).
- Eilers, J., Konnerth, A. Dye loading with patch pipettes. Cold Spring Harbor Protocols. 2009 (4), 5201 (2009).
- Coleman, W. L., et al. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. Journal of Physiology. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct injection of indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 797-801 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10 (3), 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. α-Latrotoxin releases calcium in frog motor nerve terminals. The Journal of Neuroscience. 20 (23), 8685-8692 (2000).
- Newman, Z., et al. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. The European Journal of Neuroscience. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 791-796 (2012).
- Rossano, A. J., Macleod, G. T. Loading drosophila nerve terminals with calcium indicators. Journal of Visualized Experiments: JoVE. (6), e250 (2007).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Suzuki, S., et al. Ca2+ dynamics at the frog motor nerve terminal. Pflugers Archiv: European Journal of Physiology. 440 (3), 351-365 (2000).
- Ojala, K. S., et al. A high-affinity, partial antagonist effect of 3,4-diaminopyridine mediates action potential broadening and enhancement of transmitter release at NMJs. Journal of Biological Chemistry. 296, 100302 (2021).
- Samigullin, D., et al. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Frontiers in Synaptic Neuroscience. 6, 29 (2015).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. The Journal of Physiology. 505, 585-592 (1997).
- Bullen, A., Patel, S. S., Saggau, P. High-speed, random-access fluorescence microscopy: I. High-resolution optical recording with voltage-sensitive dyes and ion indicators. Biophysical Journal. 73 (1), 477-491 (1997).
- Bullen, A., Saggau, P. High-speed, random-access fluorescence microscopy: II. Fast quantitative measurements with voltage-sensitive dyes. Biophysical Journal. 76 (4), 2272-2287 (1999).
- Bullen, A., Saggau, P. Optical recording from individual neurons in culture. Modern Techniques in Neuroscience Research. (4), 89-126 (1999).
- Bullen, A., Saggau, P. Indicators and optical configuration for simultaneous high-resolution recording of membrane potential and intracellular calcium using laser scanning microscopy. Pflugers Archiv European Journal of Physiology. 436 (5), 788-796 (1998).
- Wilson, T. Optical aspects of confocal microscopy. Confocal Microscopy. , 93-141 (1990).
- Cox, G. Biological confocal microscopy. Materials Today. 5 (3), 34-41 (2002).
- Mukhitov, A., Arkhipova, S., Nikolsky, E. Modern Light Microscopy in Biological and Medical Research. Nauka. , (2011).
- Mertz, J. Optical sectioning microscopy with planar or structured illumination. Nature Methods. 8 (10), 811-819 (2011).
- Webb, R. H. Confocal optical microscopy. Reports on Progress in Physics. 59 (3), 427-471 (1996).
- Toomre, D., Pawley, J. B. Disk-scanning confocal microscopy. Handbook of Biological Confocal Microscopy: Third Edition. , 221-238 (2006).
- Venkateswarlu, K., et al. Three-dimensional imaging and quantification of real-time cytosolic calcium oscillations in microglial cells cultured on electrospun matrices using laser scanning confocal microscopy. Biotechnology and Bioengineering. 117 (10), 3108-3123 (2020).
- Arkhipov, A. Y., Khaziev, E. F., Skorinkin, A. I., Bukharaeva, E. A., Samigullin, D. V. Enhancement of the temporal resolution of fluorescent signals acquired by the confocal microscope. Microscopy and Microanalysis. 26 (2), 204-210 (2020).
- Rama, S. Shift and mean algorithm for functional imaging with high spatio-temporal resolution. Frontiers in Cellular Neuroscience. 9, (2015).
- Chan, K. G., Streichan, S. J., Trinh, L. A., Liebling, M. Simultaneous temporal superresolution and denoising for cardiac fluorescence microscopy. IEEE Transactions on Computational Imaging. 2 (3), 348-358 (2016).
- Veeraraghavan, A., Reddy, D., Raskar, R. Coded strobing photography: compressive sensing of high speed periodic videos. IEEE Transactions on Pattern Analysis and Machine Intelligence. 33 (4), 671-686 (2011).
- Angaut-Petit, D., Molgo, J., Connold, A. L., Faille, L. The levator auris longus muscle of the mouse: A convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. Neuroscience Letters. 82 (1), 83-88 (1987).
- Macleod, G. T. Calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 7 (7), 758-766 (2012).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Bukharaeva, E. A., Nikolsky, E. E. Loading a calcium dye into frog nerve endings through the nerve stump: calcium transient registration in the frog neuromuscular junction. Journal of Visualized Experiments: JoVE. (125), e55122 (2017).
- Samigullin, D. V., et al. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoScience. 7 (1), 162-166 (2017).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. Journal of Neuroscience. 31 (31), 11268-11281 (2011).
- Luo, F., Dittrich, M., Cho, S., Stiles, J. R., Meriney, S. D. Transmitter release is evoked with low probability predominately by calcium flux through single channel openings at the frog neuromuscular junction. Journal of Neurophysiology. 113 (7), 2480-2489 (2015).
- Wright, M., Kim, A., Son, Y. -. J. Subcutaneous administration of muscarinic antagonists and triple-immunostaining of the levator auris longus muscle in mice. Journal of Visualized Experiments: JoVE. (55), e3124 (2011).
- Burke, S. R. A., Reed, E. J., Romer, S. H., Voss, A. A. Levator Auris Longus preparation for examination of mammalian neuromuscular transmission under voltage clamp conditions. Journal of Visualized Experiments: JoVE. (135), e57482 (2018).
- Kazakov, A., Alexandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Meždunarodnyj naučno-issledovatel'skij žurnal (International Research Journal). 9 (40), 13-16 (2015).
- Bowman, W. C. Neuromuscular block. British Journal of Pharmacology. 147, 277-286 (2006).
- Hill, J. M., Alewood, P. F., Craik, D. J. Three-dimensional solution structure of µ-conotoxin GIIIB, a specific blocker of skeletal muscle sodium channels. Biochemistry. 35 (27), 8824-8835 (1996).
- Land, B. R., Johnson, B. R., Wyttenbach, R. A., Hoy, R. R. Tools for physiology labs: Inexpensive equipment for physiological stimulation. Journal of Undergraduate Neuroscience Education. 3 (1), 30-35 (2004).
- Samigullin, D. V., Zhilyakov, N. V., Khaziev, E. F., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient and quantal release in mouse neuromuscular junction under extracellular calcium concentration change. BioNanoScience. 8 (4), 984-987 (2018).
- Khaziev, E., et al. acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Frontiers in Physiology. 7, 621 (2016).
- Zhilyakov, N., Arkhipov, A., Malomouzh, A., Samigullin, D. Activation of neuronal nicotinic receptors inhibits acetylcholine release in the neuromuscular junction by increasing ca2+ flux through cav1 channels. International Journal of Molecular Sciences. 22 (16), 9031 (2021).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophysical Journal. 74 (3), 1549-1563 (1998).
- McArdle, J. J., et al. Advantages of the triangularis sterni muscle of the mouse for investigations of synaptic phenomena. Journal of Neuroscience Methods. 4 (2), 109-115 (1981).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır