É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Registro de Transintes de Cálcio na Junção Neuromuscular do Rato com Alta Resolução Temporal utilizando Microscopia Confocal
Neste Artigo
Resumo
O protocolo descreve o método de carregar um corante de cálcio fluorescente através do nervo cortado em terminais nervosos motores do rato. Além disso, é apresentado um método único para o registro de transintes rápidos de cálcio nas terminações nervosas periféricas usando microscopia confocal.
Resumo
A estimativa do nível de cálcio pré-sináptico é uma tarefa fundamental no estudo da transmissão sináptica, uma vez que a entrada de cálcio na célula presináptica desencadeia uma cascata de eventos que levam à liberação de neurotransmissores. Além disso, mudanças nos níveis de cálcio pré-sináptico mediam a atividade de muitas proteínas intracelulares e desempenham um papel importante na plasticidade sináptica. Estudar a sinalização de cálcio também é importante para encontrar maneiras de tratar doenças neurodegenerativas. A junção neuromuscular é um modelo adequado para estudar a plasticidade sináptica, pois possui apenas um tipo de neurotransmissor. Este artigo descreve o método para carregar um corante sensível ao cálcio através do feixe de nervo cortado nas terminações nervosas motoras dos camundongos. Este método permite a estimativa de todos os parâmetros relacionados a alterações intracelulares de cálcio, como nível de cálcio basal e transitório de cálcio. Uma vez que o fluxo de cálcio do exterior celular para os terminais nervosos e sua ligação/desvinculação ao corante sensível ao cálcio ocorrem dentro da faixa de alguns milissegundos, um sistema de imagem rápido é necessário para registrar esses eventos. De fato, câmeras de alta velocidade são comumente usadas para o registro de mudanças rápidas de cálcio, mas têm parâmetros de baixa resolução de imagem. O protocolo aqui apresentado para o registro transitório de cálcio permite uma resolução espacial-temporal extremamente boa fornecida pela microscopia confocal.
Introdução
O problema da medição de ondas rápidas de cálcio em células excitáveis é um dos aspectos mais importantes e desafiadores do estudo da transmissão de sinais nos sistemas nervosos central e periférico. Os íons de cálcio desempenham um papel importante no desencadeamento da liberação de neurotransmissores, plasticidade sináptica e modulação da atividade de várias proteínas intracelulares 1,2,3,4,5. Estudar a sinalização de cálcio também é importante para encontrar maneiras de tratar doenças neurodegenerativas6. Para medir as alterações nos níveis de cálcio, corantes fluorescentes sensíveis ao cálcio são comumente usados, e alterações no nível de fluorescência são analisadas 7,8,9.
O carregamento de corantes de cálcio nas células pode ser alcançado de diferentes maneiras. Predominantemente, são utilizados corantes permeantes de células10,11. No entanto, nesse caso, não é apenas difícil controlar a concentração de um corante dentro da célula, mas também é difícil selecionar células-alvo para carregamento. Este método não é aplicável para estudar terminações nervosas periféricas, uma vez que o corante entra em células postinásticas. Em vez disso, corantes impermecedulares celulares são mais adequados para tais preparações. Neste caso, os corantes são entregues às células por microinjeção ou através de uma pipeta de remendo 12,13,14. Há também um método de carregar através de um toco nervoso. Este último método é mais adequado para preparações de junção neuromuscular 15,16,17,18,19,20. Permite realizar a coloração apenas para células de interesse. Embora este método não forneça uma avaliação precisa da concentração do corante na célula-alvo, a concentração pode ser estimada aproximadamente comparando o nível de fluorescência das células em repouso em soluções com uma concentração conhecida de cálcio21. Neste estudo, é apresentada uma modificação desse método aplicado às sinapses dos mamíferos.
A entrada de cálcio durante a fase de despolarização do potencial de ação é um processo rápido, especialmente na junção neuromuscular; portanto, para seu registro, é necessário equipamento adequado1. Um estudo recente usando um corante fluorescente sensível à tensão demonstrou que a duração do potencial de ação na sinapse periférica de um rato é de aproximadamente 300 μs22. O cálcio transitório, avaliado com corantes sensíveis ao cálcio nas sinapses periféricas do sapo, tem uma duração maior: o tempo de elevação é de cerca de 2-6 ms e o tempo de decomposição é de cerca de 30-90 ms, dependendo do corante de cálcio usado23,24. Para medir processos rápidos com a ajuda de corantes fluorescentes, as câmeras CCD ou CMOS são geralmente utilizadas, com matrizes CCD rápidas e sensíveis. No entanto, essas câmeras têm a desvantagem da baixa resolução, limitada pelo tamanho dos elementos sensíveis da matriz 25,26,27,28. As câmeras mais rápidas com sensibilidade suficiente para registrar tanto potenciais de ação quanto transitórios de cálcio em resposta à estimulação de baixa frequência das células têm uma frequência de varredura de 2.000 Hz, e uma matriz com uma dimensão de 80 x 8029. Para obter sinais com maior resolução espacial, é utilizada microscopia confocal, especialmente se for necessário avaliar algumas alterações volumosas no sinal 30,31,32. Mas deve-se ter em mente que a microscopia confocal tem uma alta velocidade de digitalização no modo de varredura de linha, mas ainda há limitações significativas na velocidade de gravações de processos rápidos ao construir uma imagem espacial33. Existem microscópios confocal baseados em discos Nipkow rotativos (microscopia de varredura de fenda) e scanners multipoint-array, que têm uma velocidade de varredura mais alta. Ao mesmo tempo, eles são inferiores aos microscópios confocal clássicos na filtragem de imagem confocal (pinholes crosstalk para microscópios com um disco Nipkow)32,34,35. A imagem confocal com ressonância também pode fornecer uma alta resolução espátula-temporal necessária para altas medições temporais36. No entanto, leve-se em conta que o registro de respostas fluorescentes fracas a uma alta velocidade de varredura ao usar scanners de ressonância requer detectores altamente sensíveis, como detectores híbridos36.
Este artigo apresenta um método para aumentar a resolução temporal dos sinais registrados com a Microscopia Confocal de Varredura a Laser (LSCM) mantendo a resolução espacial37. O método atual é um desenvolvimento adicional dos métodos descritos anteriormente e transferidos para a plataforma LSCM 38,39,40. Esta abordagem não requer alterações no hardware do microscópio e é baseada na aplicação de um algoritmo para gravação periodicamente de sinais fluorescentes evocados com uma mudança de tempo em relação ao momento de estimulação.
Protocolo
Os experimentos foram realizados em preparações nervosas-musculares isoladas do levator auris longus (m. LAL) dos Ratos BALB/C (20-23 g, 2-3 meses)41. Os procedimentos experimentais foram realizados de acordo com as diretrizes para o uso de animais de laboratório da Universidade Federal de Kazan e da Universidade Médica de Kazan, em conformidade com o Guia do NIH para o Cuidado e Uso de Animais de Laboratório. O protocolo experimental atendeu aos requisitos da Diretiva 86/609/CEE do Conselho das Comunidades Europeias e foi aprovado pelo Comitê de Ética da Universidade Médica de Kazan.
1. Preparação das soluções ringer e arquivamento
- Prepare a solução do Ringer para o músculo mamífero misturando os seguintes ingredientes: NaCl (137 mM), KCl (5 mM), CaCl2 (2 mM), MgCl2 (1 mM), NaH2PO4 (1 mM), NaHCO3 (11,9 mM) e glicose (11 mM). Bubble através da solução com 95% O2 e 5% CO2 e ajuste seu pH para 7,2-7,4 adicionando HCl/NaOH, se necessário.
- Prepare a solução de carregamento de corante.
- Prepare a solução HEPES (10 mM) com pH na faixa 7.2-7.4. 500 μg de corante comercial vem em um frasco de 500 μL. Dissolva o corante em 14 μL da solução HEPES para obter uma concentração de corante de 30 mM. Agite bem e centrífugue até dissolver totalmente.
- Diluir a solução do indicador Ca2+ com solução HEPES até 1 mM de concentração. Mantenha-o em um congelador (-20 °C) e evite a exposição à luz.
2. Procedimento de carregamento de corante
NOTA: O procedimento de carregamento de corante é realizado de acordo com o protocolo de carregamento através do toco nervoso, adaptado dos protocolos publicados anteriormente 19,42,43,44,45,46.
- Dissecar o músculo LAL de acordo com o procedimento de dissecção para esta preparação, conforme descrito nos protocolos publicados anteriormente47,48.
- Fixar o tecido ligeiramente esticado (não mais de 30% do comprimento inicial) na placa de Petri revestida de elastômero com pinos finos de aço inoxidável e adicionar a solução de Ringer até que o músculo esteja totalmente coberto.
NOTA: A placa de Petri foi pré-preenchida com elastômero de acordo com as instruções do fabricante (ver Tabela de Materiais).
- Fixar o tecido ligeiramente esticado (não mais de 30% do comprimento inicial) na placa de Petri revestida de elastômero com pinos finos de aço inoxidável e adicionar a solução de Ringer até que o músculo esteja totalmente coberto.
- Prepare a pipeta de enchimento
- Usando um puxador de micropipette (ver Tabela de Materiais), prepare uma micropipette com uma ponta fina que é o mais afiada possível para as gravações intracelulares. Use capilares sem filamentos internos (1,5 mm de diâmetro externo e 0,86 ou 1,10 mm de diâmetro interno).
- Quebre a ponta da micropipette depois de marcar o afunilador com um abrasivo, deixando a ponta aberta para cerca de 100 μm de diâmetro. Polir o fogo para baixo para limitar quando o diâmetro interno encolhe de >80 μm para 12-13 μm. Coloque um tubo de silicone em um lado da Pipeta de Enchimento e uma seringa (sem agulha) para o outro lado.
- Sob um estereoscópio, encontre o lugar onde o tronco nervoso se transforma em galhos nervosos separados. Coloque a Pipeta de Enchimento com o tubo montado e a seringa na placa de Petri usando cera. Mova a ponta da pipeta até que fique acima do nervo.
- Com uma tesoura fina, corte o nervo perto da fibra muscular, deixando um pequeno pedaço do toco nervoso de cerca de 1 mm de comprimento. Aspire suavemente o toco nervoso junto com alguma solução de Ringer, sem beliscá-lo, na ponta da Pipeta de Enchimento. Remova o tubo de silicone da Pipeta de Enchimento.
- Desenhe alguma quantidade da solução de carregamento de corante (~0,3 μL) usando uma seringa com um filamento longo. Este volume corresponde a aproximadamente 3 cm do filamento.
NOTA: Inicialmente, é necessário fazer um filamento a partir de uma ponta de pipeta com um volume de 10 μL puxando o fogo usando uma lâmpada de álcool ou um queimador de gás. - Insira suavemente a ponta de filamento com a solução de carregamento na Pipeta de Enchimento. Solte a mistura diretamente no toco nervoso. Incubar a preparação à temperatura ambiente no escuro por 30 minutos.
- Depois disso, enxágue a preparação com a solução de Ringer fresca e incubar a 25 °C por até 2 h em um copo de vidro com 50 mL (ou mais) solução ringer (a preparação deve ser coberta com a solução). Durante este tempo, o corante atingirá as sinapses.
3. Captura de vídeo com microscopia confocal
NOTA: O registro de transintes de cálcio é realizado com um microscópio confocal de escaneamento a laser (LSCM) (ver Tabela de Materiais). Para registrar transitórios rápidos de cálcio, utilizou-se um protocolo original que permitia registros de sinais com resolução espacial e temporal suficiente. O método foi descrito minuciosamente na publicação por Arkhipov et al37. O microscópio foi equipado com um objetivo de imersão em água de 20x (1,00 NA). A linha laser de 488 nm foi atenuada a 10% de intensidade e a fluorescência de emissões foi coletada de 503 a 558 nm.
- Monte a preparação na câmara experimental revestida de elastômero de silício e fixe-a, ligeiramente esticada, com um conjunto de micro-agulhas de aço. Enxágüe extensivamente a preparação com a solução de Ringer.
NOTA: Foi utilizada uma simples câmara experimental de perfusão feita sob medida feita de vidro orgânico com a parte inferior da câmara coberta com um elastômero (preparado de acordo com as instruções do fabricante; ver Tabela de Materiais). A câmara tem um tubo de fornecimento de soluções. A solução é bombeada através de uma agulha de seringa, montada em um suporte magnético (ver Tabela de Materiais). Como uma câmara experimental, uma placa de Petri poderia ser usada (como a usada para incubação da preparação), mas com tubos de fornecimento e sucção conectados. - Instale eletrodo de sucção que será usado para estimular o nervo.
NOTA: A construção do eletrodo é semelhante à publicada no artigo de 2015 por Kazakov et al49. Coloque e conserte o eletrodo depilando ao lado do banho. Mova a ponta perto do toco nervoso e aspire-a no eletrodo. - Monte a câmara de preparação no estágio do microscópio e coloque as encaixes de entrada e saída na câmara.
- Para perfundir a preparação, use um sistema simples de fluxo de gravidade. Ligue a bomba de sucção de perfusão para remover a solução em excesso.
- Conecte o eletrodo de sucção estimulante em um estimulador elétrico e garanta que as contrações musculares ocorram após estímulos. Consulte a seção 3.9-3.12 para condições de estimulação e gravação.
- Encha o sistema de perfusão com a solução do Ringer com d-tubocurarine (10 μM).
NOTA: Esta solução ajuda a prevenir contrações musculares. D-tubocurarine ou bloqueadores específicos de alfa-bungarotoxina de receptores de acetilcolina nicotina na membrana pós-sináptica bloqueariam completamente ou parcialmente as contrações musculares50. Além disso, para prevenir contrações musculares, poderiamser utilizados bloqueadores específicos de canais de sódio postinopáticos, como μ-conotoxina GIIIB. - Ligue a bomba de sucção de perfusão e inicie a perfusão da preparação com a solução do Ringer contendo d-tubocurarine.
- Defina parâmetros de imagem no software LSCM da seguinte forma.
- No software LSCM (LAS AF; ver Tabela de Materiais), escolha Eletrofisiologia.
NOTA: Neste modo, quando uma imagem é capturada no ponto de partida, um pulso sincronizado é enviado ao estimulador com a ajuda da caixa de gatilho. Isso provoca geração potencial de ação na preparação (Figura 1; unidade estimuladora). - Selecione o modo de aquisição. Para acionar o estimulador usando o pulso de sincronização do microscópio, nas configurações do menu Trabalho , selecione as configurações do gatilho . Defina o campo Trigger Out On Frame para o canal out1 .
- Use as seguintes configurações: Modo de digitalização: XYT, Frequência de Digitalização: 1400 Hz, Fator Zoom: 6.1, Pinhole: totalmente aberto. Certifique-se de que o modo X transdirecionário sequencial esteja ligado.
- Defina o tempo mínimo para formar um quadro a 52 ms e quadros a serem coletados em um vídeo bruto em 20 quadros.
NOTA: Essas configurações permitem a captura de imagens com uma resolução de 128 x 128 pixels, enquanto tomam um único quadro a cada 52 ms. - Defina o comprimento de onda de excitação do laser de argônio a 488 nm com 8% de potência de saída.
- No software LSCM (LAS AF; ver Tabela de Materiais), escolha Eletrofisiologia.

Figura 1: O esquema da configuração experimental. 1. Microscópio confocal de varredura a laser (LSCM). 2. Módulo de sincronização do LSCM (caixa de gatilho). 3. Estimulador. 4. Unidade de isolamento. 5. A amostra biológica. 6. Eletrodo de sucção para estimulação elétrica do nervo. 7. Sistemas de perfusão (7a: reservatório perfusado, 7b: conta-gotas, 7c: regulador de fluxo, 7d: frasco de vácuo). As setas apontam para a direção da propagação do pulso sincronizado. Clique aqui para ver uma versão maior desta figura.
- Pressione o botão Modo Vivo para mudar para o modo Live, o que ajuda a obter uma visualização de terminais nervosos carregados com o corante.

Figura 2: Nervo do mouse e terminais carregados com o indicador Ca2+ . Clique aqui para ver uma versão maior desta figura.
- Unidade de estimulação
NOTA: Neste trabalho, utilizou-se o estimulador descrito no artigo por Land et al.52 . Este dispositivo permite definir parâmetros temporais de estimulação através do software MatLab.- Crie um novo arquivo, cole o código do artigo acima mencionado na janela de código MatLab e salve o arquivo. Clique em Executar, para que uma janela com parâmetros de estimulação apareça. Defina o tempo de atraso e a duração do estímulo.
NOTA: O atraso determina a resolução temporal do sinal fluorescente reconstituído. O pulso elétrico de 0,2 ms de duração está atrasado e, em seguida, enviado para a unidade de isolamento. Este último forma a amplitude e polaridade do pulso estimulante e isola eletricamente o objeto biológico do equipamento de gravação. - Para estimular o nervo, selecione a amplitude supramaximal do impulso estimulante (25%-50% maior do que a intensidade máxima de estimulação necessária para ativar todas as fibras nervosas).
NOTA: O método apresentado é baseado em um algoritmo especial para gravações de sinais fluorescentes rápidos únicos usando LSCM com a varredura minimizada. A cada passo do algoritmo desenvolvido, o sinal fluorescente gravado é deslocado do anterior por um intervalo de tempo mais curto que a varredura do microscópio. O valor das mudanças de tempo determina a resolução temporal do sinal necessário. O número de etapas (mudanças) no algoritmo depende da resolução temporal necessária e da resolução temporal original. Com este método de registro, o estímulo da preparação é realizado com uma frequência de 0,25 Hz.
- Crie um novo arquivo, cole o código do artigo acima mencionado na janela de código MatLab e salve o arquivo. Clique em Executar, para que uma janela com parâmetros de estimulação apareça. Defina o tempo de atraso e a duração do estímulo.
- No modo Live, procure o ROI e obtenha o melhor foco. Execute o software de aquisição de dados.
- Mude o atraso no estimulador em 2 ms a menos em relação ao valor anterior e execute o software de aquisição de dados.
- Repita o passo 3.11 26 vezes para adquirir 26 sequências, com cada sequência deslocada por 2 ms da anterior.
4. Processamento de vídeo
NOTA: Uma série de imagens de vídeo adquiridas pelo microscópio confocal é exportada no formato TIFF com o software livre LAS X (ver Tabela de Materiais). Esta série foi dividida em quadros e exportada para uma pasta. Para gerar a sequência de imagem com maior resolução de tempo, utilizou-se o software ImageJ, que possui um código inicial aberto para análise e processamento dos dados. O algoritmo de processamento de sinais é representado esquematicamente na Figura 3.
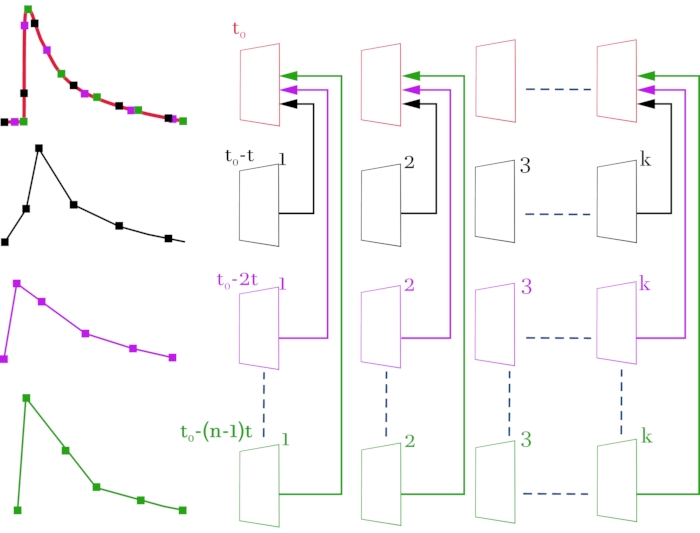
Figura 3: Esquema para compilar um arquivo de vídeo de alta resolução (2 ms no quadro) a partir de arquivos de vídeo originais com baixa resolução temporal (52 ms no quadro). Os arquivos de vídeo originais e os sinais correspondentes são coloridos em preto, magenta e verde. O arquivo de vídeo compilado e o sinal resultante são coloridos de vermelho. O esquema à direita, linha por linha, mostra as imagens de vídeo obtidas com um microscópio confocal. À esquerda, os sinais correspondentes de fluorescência mudam do ROI selecionado. A linha mais alta é formada quadro a quadro a partir dos quadros recebidos de acordo com o esquema. O resultado é uma imagem de vídeo composta por toda a matriz de quadros para que haja um tempo de atraso de 2 ms entre os quadros em vez de 52 ms. Cada linha corresponde a um deslocamento do sinal de estimulação por (n - 1) * t, onde t é mudança de tempo (2 ms), e n é o número de iterações de turno. k denota o número de quadros nos arquivos de vídeo originais (linhas 2-4) e depende da duração do sinal gravado. Neste caso, para registrar um sinal com duração de 1 s, é necessário selecionar k = 20 (52 ms * 20 = 1040 ms). t0 é o atraso necessário antes da estimulação. Para calcular o número de iterações de turno n, a resolução temporal inicial entre os quadros (52 ms) deve ser dividida pela resolução temporal exigida (2 ms). Neste caso, n = 26, o que corresponde a 26 varreduras registradas. Como resultado das manipulações realizadas, uma imagem de vídeo composta por n * k = 520 quadros é obtida. Clique aqui para ver uma versão maior desta figura.
- Execute o software LAS X. Abra o projeto que foi criado durante a realização do experimento. Clique em Exportar e, em seguida, em Salvar Como salvar quadros em .tiff formato na pasta de destino.
- Execute o software ImageJ. Clique em Arquivo > Importar > sequência de imagem.
- Na janela Sequência de imagem aberta , escolha a pasta de destino e abra o primeiro quadro.
- Na janela Opções de sequência , no campo Imagem inicial , defina o número do quadro para 1 para o primeiro quadro. No campo Incremento , defina o valor igual ao número de quadros na gravação inicial do sinal (20 para o presente caso) e clique em OK.
- Para salvar o arquivo gerado dos primeiros quadros costurados em uma pasta separada, clique em Arquivo > Salvar > pasta.
- Repita as etapas 4.3-4.5 para os próximos 19 quadros. Na janela Opções de sequência , defina o número de quadro correspondente no campo Imagem inicial .
- Para gerar o vídeo completo de alta resolução, costure todos os quadros juntos. Para fazer isso, clique em Arquivo > Importar > Sequência de Imagem e selecione 1 nos campos Imagem inicial e Incremento . O resultado será o vídeo final com maior resolução temporal. Salve o arquivo em .tiff ou em qualquer outro formato adequado.
5. Análise de vídeo
NOTA: No ImageJ, selecione ROI e plano de fundo. Subtrair o fundo do ROI. Os dados são representados como a razão( ΔF / F0 - 1) * 100%, onde F0 é a intensidade da fluorescência em repouso e ΔF é a intensidade da fluorescência durante a estimulação.
- Clique em Image > Stacks > Tools > Stack Sorter. Em seguida, clique em Análise > Ferramentas > gerenciador de ROI.
- Arraste e solte o arquivo .tiff salvo na etapa 4.7 na janela ImageJ. Expanda a imagem para uma visão melhor. Para melhorar a visualização da imagem, clique em Imagem > Ajuste > brilho/contraste > Auto. Esta etapa não afetará os dados.
- Defina o fundo perto do terminal nervoso desenhando ROI. Adicione ao gerente do ROI. Calcule o plano de fundo clicando em Mais > Multi Medida. Copie valores médios, cole para o programa Planilha e calcule a média.
- Subtraia o valor médio calculado das pilhas clicando em Process > Subtrair principal >. Digite o valor.
- Desenhe o ROI em torno de um terminal nervoso através de uma linha de polígono. Adicione ao gerente do ROI.
- Meça a intensidade do terminal nervoso: Clique em Mais > Multi Medida. Copie valores médios e cole-os no programa Planilha.
- Calcule a compensação média dos sinais.
NOTA: Use os pontos correspondentes dependendo do tempo de atraso antes da estimulação. Esta etapa estabelece o valor F0 que será utilizado em cálculos subsequentes. - Divida os valores do sinal pelo valor médio de deslocamento.
NOTA: Após esta etapa, o sinal não contém a contribuição do fundo e fluorescência bruta aos valores de amplitude do ROI selecionado. - Subtrair 1 dos valores obtidos na etapa 5,8 e, em seguida, multiplicar por 100%.
- Plote um gráfico de Ca2+- transitório e calcule a amplitude.
Resultados
Após o carregamento da preparação com corante de acordo com a técnica apresentada, a maioria das sinapses localizadas perto do toco nervoso apresentava um nível suficiente de fluorescência (ver Figura 2). Após o carregamento da preparação com o corante e aplicação do método descrito de registro e processamento de imagem, foram obtidos transitórios de cálcio com a resolução espacial e temporal desejada (ver Figura 4). O transitório de cálcio foi...
Discussão
O método de carregamento de corante ca2+sensível em terminações nervosas do rato através do toco nervoso e para registro de um transitório rápido de cálcio usando um microscópio confocal é apresentado neste artigo. Como resultado da implementação deste método de carregamento, a maioria das sinapses localizadas perto do toco nervoso tinha um nível suficiente de fluorescência para permitir o registro da entrada de cálcio nas terminações nervosas em resposta à estimulação de baixa frequência...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os estudos de fluorescência deste trabalho foram realizados com o apoio financeiro do Subsídio da Fundação De ciência russa (projeto nº 19-15-00329). O método foi desenvolvido sob financiamento da atribuição governamental para o FRC Kazan Scientific Center of RAS ААААА-А18-118022790083-9. A pesquisa foi desenvolvida com o uso dos equipamentos do Centro Federal de Pesquisa "Centro Científico Kazan do RAS". Os autores gostariam de agradecer ao Dr. Victor I. Ilyin pela leitura crítica deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Capillary Glass | Clark Electromedical instruments, UK | GC150-10 | |
| Confocal and multiphoton microscope system Leica TCS SP5 MP | Leica Microsystems , Heidelberg, Germany | ||
| Flaming/Brown Micropipette Puller P 97 | Sutter Instrument, USA | P-97 | |
| Flow regulator | KD Medical GmbH Hospital Products, Germany | KD REG | Disposable infusion set with Flow regulator |
| HEPES | Sigma-Aldrich, USA | H0887 | 100mL |
| Illumination system Leica CLS 150X | Leica Microsystems, Germany | ||
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Las AF software | Leica Microsystems, Heidelberg, Germany | ||
| Las X software | Leica Microsystems, Heidelberg, Germany | https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/ | |
| Magnetic Holder with Suction Tubing | BIOSCIENCE TOOLS, USA | MTH-S | |
| Microspin FV 2400 | Biosan, Latvia | BS-010201-AAA | |
| Minutien Pins | Fine science tools, Canada | 26002-20 | |
| Multi-spin MSC 3000 | Biosan, Latvia | BS-010205-AAN | |
| Oregon Green 488 BAPTA-1 pentapotassium salt | Molecular Probes, USA | O6806 | 500 μg |
| Pipette | Biohit, Russia | 720210 | 0.5-10 µL |
| Pipette tip | Biohit, Russia | 781349 | 10 µL |
| Plasticine | local producer | ||
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40 mm |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel | |
| Stereomicroscope, Leica M80 | Leica Microsystems , Germany | ||
| Suction electrode | Kazakov A. SIMPLE SUCTION ELECTRODE FOR ELECTRIC STIMULATION OF BIOLOGICAL OBJECTS / A. Kazakov, M. Alexandrov, N. V. Zhilyakov et al. // International research journal. - 2015. - No. 9 (40) Part 3. - P. 13-16. | http://research-journal.org/biology/prostoj-vsasyvayushhij-elektrod-dlya-elektricheskoj-stimulyacii-biologicheskix-obektov/ | |
| Sylgard 184 elastomer | Dow Corning, USA | ||
| Syringe | local producer | 0.5 mL | |
| Syringe | local producer | 60 mL |
Referências
- Llinas, R., Steinberg, I. Z., Walton, K. Presynaptic calcium currents and their relation to synaptic transmission: voltage clamp study in squid giant synapse and theoretical model for the calcium gate. Proceedings of the National Academy of Sciences of the United States of America. 73 (8), 2918-2922 (1976).
- Augustine, G. J. How does calcium trigger neurotransmitter release. Current Opinion in Neurobiology. 11 (3), 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37 (5), 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Current Opinion in Neurobiology. 15 (3), 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Current Opinion in Cell Biology. 22 (4), 496-505 (2010).
- Leal, S. S., Gomes, C. M. Calcium dysregulation links ALS defective proteins and motor neuron selective vulnerability. Frontiers in Cellular Neuroscience. 9, 225 (2015).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods in Cell Biology. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Macleod, G. T. Topical application of indicators for calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 786-790 (2012).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in Neuroscience and Development: A Laboratory Manual. , 307-314 (2005).
- Eilers, J., Konnerth, A. Dye loading with patch pipettes. Cold Spring Harbor Protocols. 2009 (4), 5201 (2009).
- Coleman, W. L., et al. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. Journal of Physiology. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct injection of indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 797-801 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10 (3), 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. α-Latrotoxin releases calcium in frog motor nerve terminals. The Journal of Neuroscience. 20 (23), 8685-8692 (2000).
- Newman, Z., et al. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. The European Journal of Neuroscience. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 791-796 (2012).
- Rossano, A. J., Macleod, G. T. Loading drosophila nerve terminals with calcium indicators. Journal of Visualized Experiments: JoVE. (6), e250 (2007).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Suzuki, S., et al. Ca2+ dynamics at the frog motor nerve terminal. Pflugers Archiv: European Journal of Physiology. 440 (3), 351-365 (2000).
- Ojala, K. S., et al. A high-affinity, partial antagonist effect of 3,4-diaminopyridine mediates action potential broadening and enhancement of transmitter release at NMJs. Journal of Biological Chemistry. 296, 100302 (2021).
- Samigullin, D., et al. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Frontiers in Synaptic Neuroscience. 6, 29 (2015).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. The Journal of Physiology. 505, 585-592 (1997).
- Bullen, A., Patel, S. S., Saggau, P. High-speed, random-access fluorescence microscopy: I. High-resolution optical recording with voltage-sensitive dyes and ion indicators. Biophysical Journal. 73 (1), 477-491 (1997).
- Bullen, A., Saggau, P. High-speed, random-access fluorescence microscopy: II. Fast quantitative measurements with voltage-sensitive dyes. Biophysical Journal. 76 (4), 2272-2287 (1999).
- Bullen, A., Saggau, P. Optical recording from individual neurons in culture. Modern Techniques in Neuroscience Research. (4), 89-126 (1999).
- Bullen, A., Saggau, P. Indicators and optical configuration for simultaneous high-resolution recording of membrane potential and intracellular calcium using laser scanning microscopy. Pflugers Archiv European Journal of Physiology. 436 (5), 788-796 (1998).
- Wilson, T. Optical aspects of confocal microscopy. Confocal Microscopy. , 93-141 (1990).
- Cox, G. Biological confocal microscopy. Materials Today. 5 (3), 34-41 (2002).
- Mukhitov, A., Arkhipova, S., Nikolsky, E. Modern Light Microscopy in Biological and Medical Research. Nauka. , (2011).
- Mertz, J. Optical sectioning microscopy with planar or structured illumination. Nature Methods. 8 (10), 811-819 (2011).
- Webb, R. H. Confocal optical microscopy. Reports on Progress in Physics. 59 (3), 427-471 (1996).
- Toomre, D., Pawley, J. B. Disk-scanning confocal microscopy. Handbook of Biological Confocal Microscopy: Third Edition. , 221-238 (2006).
- Venkateswarlu, K., et al. Three-dimensional imaging and quantification of real-time cytosolic calcium oscillations in microglial cells cultured on electrospun matrices using laser scanning confocal microscopy. Biotechnology and Bioengineering. 117 (10), 3108-3123 (2020).
- Arkhipov, A. Y., Khaziev, E. F., Skorinkin, A. I., Bukharaeva, E. A., Samigullin, D. V. Enhancement of the temporal resolution of fluorescent signals acquired by the confocal microscope. Microscopy and Microanalysis. 26 (2), 204-210 (2020).
- Rama, S. Shift and mean algorithm for functional imaging with high spatio-temporal resolution. Frontiers in Cellular Neuroscience. 9, (2015).
- Chan, K. G., Streichan, S. J., Trinh, L. A., Liebling, M. Simultaneous temporal superresolution and denoising for cardiac fluorescence microscopy. IEEE Transactions on Computational Imaging. 2 (3), 348-358 (2016).
- Veeraraghavan, A., Reddy, D., Raskar, R. Coded strobing photography: compressive sensing of high speed periodic videos. IEEE Transactions on Pattern Analysis and Machine Intelligence. 33 (4), 671-686 (2011).
- Angaut-Petit, D., Molgo, J., Connold, A. L., Faille, L. The levator auris longus muscle of the mouse: A convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. Neuroscience Letters. 82 (1), 83-88 (1987).
- Macleod, G. T. Calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 7 (7), 758-766 (2012).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Bukharaeva, E. A., Nikolsky, E. E. Loading a calcium dye into frog nerve endings through the nerve stump: calcium transient registration in the frog neuromuscular junction. Journal of Visualized Experiments: JoVE. (125), e55122 (2017).
- Samigullin, D. V., et al. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoScience. 7 (1), 162-166 (2017).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. Journal of Neuroscience. 31 (31), 11268-11281 (2011).
- Luo, F., Dittrich, M., Cho, S., Stiles, J. R., Meriney, S. D. Transmitter release is evoked with low probability predominately by calcium flux through single channel openings at the frog neuromuscular junction. Journal of Neurophysiology. 113 (7), 2480-2489 (2015).
- Wright, M., Kim, A., Son, Y. -. J. Subcutaneous administration of muscarinic antagonists and triple-immunostaining of the levator auris longus muscle in mice. Journal of Visualized Experiments: JoVE. (55), e3124 (2011).
- Burke, S. R. A., Reed, E. J., Romer, S. H., Voss, A. A. Levator Auris Longus preparation for examination of mammalian neuromuscular transmission under voltage clamp conditions. Journal of Visualized Experiments: JoVE. (135), e57482 (2018).
- Kazakov, A., Alexandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Meždunarodnyj naučno-issledovatel'skij žurnal (International Research Journal). 9 (40), 13-16 (2015).
- Bowman, W. C. Neuromuscular block. British Journal of Pharmacology. 147, 277-286 (2006).
- Hill, J. M., Alewood, P. F., Craik, D. J. Three-dimensional solution structure of µ-conotoxin GIIIB, a specific blocker of skeletal muscle sodium channels. Biochemistry. 35 (27), 8824-8835 (1996).
- Land, B. R., Johnson, B. R., Wyttenbach, R. A., Hoy, R. R. Tools for physiology labs: Inexpensive equipment for physiological stimulation. Journal of Undergraduate Neuroscience Education. 3 (1), 30-35 (2004).
- Samigullin, D. V., Zhilyakov, N. V., Khaziev, E. F., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient and quantal release in mouse neuromuscular junction under extracellular calcium concentration change. BioNanoScience. 8 (4), 984-987 (2018).
- Khaziev, E., et al. acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Frontiers in Physiology. 7, 621 (2016).
- Zhilyakov, N., Arkhipov, A., Malomouzh, A., Samigullin, D. Activation of neuronal nicotinic receptors inhibits acetylcholine release in the neuromuscular junction by increasing ca2+ flux through cav1 channels. International Journal of Molecular Sciences. 22 (16), 9031 (2021).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophysical Journal. 74 (3), 1549-1563 (1998).
- McArdle, J. J., et al. Advantages of the triangularis sterni muscle of the mouse for investigations of synaptic phenomena. Journal of Neuroscience Methods. 4 (2), 109-115 (1981).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados