A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
רישום של סידן חולף בצומת נוירומוסקולרי עכבר עם רזולוציה טמפורלית גבוהה באמצעות מיקרוסקופיה קונפוקלית
In This Article
Summary
הפרוטוקול מתאר את השיטה של העמסת צבע סידן פלואורסצנטי דרך העצב החתוך לתוך מסופי העצבים המוטוריים של העכבר. בנוסף, מוצגת שיטה ייחודית לרישום ארעי סידן מהירים בקצות העצבים ההיקפיים באמצעות מיקרוסקופיה קונפוקלית.
Abstract
הערכה של רמת הסידן הקדם-סינפטי היא משימה מרכזית בחקר ההולכה הסינפטית, שכן כניסת סידן לתא הקדם-סינפטי מעוררת מפל של אירועים המובילים לשחרור מוליכים עצביים. יתר על כן, שינויים ברמות הסידן הקדם-סינפטי מתווכים את פעילותם של חלבונים תוך-תאיים רבים וממלאים תפקיד חשוב בגמישות הסינפטית. חקר איתות הסידן חשוב גם למציאת דרכים לטיפול במחלות נוירודגנרטיביות. הצומת העצבי-שרירי הוא מודל מתאים לחקר הפלסטיות הסינפטית, שכן יש לו רק סוג אחד של נוירוטרנסמיטר. מאמר זה מתאר את השיטה להעמסת צבע רגיש לסידן דרך צרור העצבים החתוך לתוך קצות העצבים המוטוריים של העכברים. שיטה זו מאפשרת להעריך את כל הפרמטרים הקשורים לשינויים בסידן תוך תאי, כגון רמת הסידן הבסיסית וסידן חולף. מאחר שזרימת הסידן מהחלק החיצוני של התא אל קצות העצבים וקשירתו/אי-כריכתו לצבע הרגיש לסידן מתרחשות בטווח של אלפיות השנייה הבודדות, נדרשת מערכת הדמיה מהירה לתיעוד אירועים אלה. ואכן, מצלמות במהירות גבוהה משמשות בדרך כלל לרישום של שינויי סידן מהירים, אך יש להם פרמטרים ברזולוציית תמונה נמוכה. הפרוטוקול המוצג כאן לרישום סידן חולף מאפשר רזולוציה מרחבית-טמפורלית טובה ביותר המסופקת על ידי מיקרוסקופיה קונפוקלית.
Introduction
הבעיה של מדידת גלי סידן מהירים בתאים מעוררים היא אחד ההיבטים החשובים והמאתגרים ביותר בחקר העברת אותות במערכת העצבים המרכזית וההיקפית. יוני סידן ממלאים תפקיד חשוב בהפעלת שחרור מוליכים עצביים, פלסטיות סינפטית וויסות הפעילות של חלבונים תוך-תאיים שונים 1,2,3,4,5. חקר איתות סידן חשוב גם למציאת דרכים לטיפול במחלות נוירודגנרטיביות6. כדי למדוד שינויים ברמות הסידן, צבעים פלואורסצנטיים רגישים לסידן נמצאים בשימוש נפוץ, ושינויים ברמת הפלואורסצנטיות שלהם מנותחים 7,8,9.
העמסה של צבעי סידן לתוך תאים יכולה להיות מושגת בדרכים שונות. בעיקר, צבעים המיועדים לתאים משמשים10,11. עם זאת, במקרה כזה, זה לא רק קשה לשלוט על הריכוז של צבע בתוך התא, אבל זה גם קשה לבחור תאי יעד לטעינה. שיטה זו אינה ישימה לחקר קצות עצבים היקפיים מכיוון שהצבע נכנס לתאים פוסט-סינפטיים. במקום זאת, צבעים אטומים לתאים מתאימים יותר להכנות כאלה. במקרה זה, הצבעים מועברים לתאים על ידי מיקרו הזרקה או דרך פיפטה טלאי12,13,14. יש גם שיטה של העמסה דרך גדם עצב. השיטה השנייה מתאימה ביותר לתכשירי צומת נוירומוסקולרי 15,16,17,18,19,20. זה מאפשר ביצוע צביעה רק עבור תאים מעניינים. למרות ששיטה זו אינה מספקת הערכה מדויקת של ריכוז הצבע בתא היעד, ניתן להעריך את הריכוז בקירוב על ידי השוואת רמת הפלואורסצנטיות של התאים במנוחה בתמיסות עם ריכוז ידוע של סידן21. במחקר זה מוצג שינוי של שיטה זו המיושמת על סינפסות של יונקים.
כניסת סידן בשלב הדה-פולריזציה של פוטנציאל הפעולה היא תהליך מהיר, במיוחד בצומת הנוירומוסקולרי; לכן, לרישום שלה, ציוד מתאים נדרש1. מחקר שנערך לאחרונה באמצעות צבע פלואורסצנטי רגיש למתח הראה כי משך פוטנציאל הפעולה בסינפסה ההיקפית של עכבר הוא כ-300 μs22. לסידן חולף, המוערך באמצעות צבעים רגישים לסידן בסינפסות ההיקפיות של הצפרדע, יש משך זמן ארוך יותר: זמן העלייה הוא כ 2-6 ms וזמן הדעיכה הוא כ 30-90 ms, בהתאם צבע סידן בשימוש23,24. כדי למדוד תהליכים מהירים בעזרת צבעים פלואורסצנטיים, מצלמות CCD או CMOS משמשות בדרך כלל, עם מטריצות CCD מהירות ורגישות. עם זאת, למצלמות אלה יש את החיסרון של רזולוציה נמוכה, המוגבלת על ידי גודל האלמנטים הרגישים של המטריצה25,26,27,28. למצלמות המהירות ביותר עם רגישות מספקת כדי לתעד הן פוטנציאל פעולה והן טרנזיינטים של סידן בתגובה לגירוי בתדר נמוך של תאים יש תדר סריקה של 2,000 הרץ, ומטריצה עם ממד של 80 x 8029. כדי לקבל אותות עם רזולוציה מרחבית גבוהה יותר, מיקרוסקופיה קונפוקלית משמשת, במיוחד אם יש צורך להעריך כמה שינויים נפחיים האות30,31,32. אבל יש לזכור כי מיקרוסקופיה קונפוקלית יש מהירות סריקה גבוהה במצב סריקת קו, אבל יש עדיין מגבלות משמעותיות על מהירות ההקלטות של תהליכים מהירים בעת בניית תמונה מרחבית33. ישנם מיקרוסקופים קונפוקליים המבוססים על דיסקים מסתובבים של Nipkow (מיקרוסקופיה לסריקת חריצים) וסורקי מערך רב-נקודתיים, בעלי מהירות סריקה גבוהה יותר. יחד עם זאת, הם נחותים מהמיקרוסקופים הקונפוקליים הקלאסיים בסינון תמונה קונפוקלית (חורים מוצלבים למיקרוסקופים עם דיסק Nipkow)32,34,35. הדמיה קונפוקלית עם סריקת תהודה יכולה גם לספק רזולוציה מרחבית-טמפורלית גבוהה הנדרשת למדידות טמפורליות גבוהות36. עם זאת, יש לקחת בחשבון כי רישום של תגובות פלואורסצנטיות חלשות במהירות סריקה גבוהה בעת שימוש בסורקי תהודה דורש גלאים רגישים ביותר כגון גלאים היברידיים36.
מאמר זה מציג שיטה להגדלת הרזולוציה הזמנית של אותות המוקלטים באמצעות מיקרוסקופיה קונפוקלית לסריקת לייזר (LSCM) תוך שמירה על הרזולוציה המרחבית37. השיטה הנוכחית היא פיתוח נוסף של השיטות שתוארו קודם לכן והועברו לפלטפורמת LSCM38,39,40. גישה זו אינה דורשת שינויים בחומרת המיקרוסקופ ומבוססת על יישום אלגוריתם להקלטת אותות פלואורסצנטיים מעוררים מעת לעת עם שינוי זמן ביחס לרגע הגירוי.
Protocol
ניסויים בוצעו על תכשירים מבודדים של שריר עצב של levator auris longus (m. LAL) מהעכברים BALB/C (20-23 גרם, 2-3 חודשים)41. הליכי הניסוי בוצעו בהתאם להנחיות לשימוש בחיות מעבדה של האוניברסיטה הפדרלית של קאזאן והאוניברסיטה הרפואית של קאזאן, בהתאם למדריך NIH לטיפול ושימוש בחיות מעבדה. פרוטוקול הניסוי עמד בדרישות דירקטיבה 86/609/EEC של מועצת הקהילות האירופית ואושר על ידי הוועדה האתית של האוניברסיטה הרפואית של קאזאן.
1. הכנת פתרונות הצלצול והתיוק
- הכינו את התמיסה של הצלצול לשריר היונקים על ידי ערבוב המרכיבים הבאים: NaCl (137 mM), KCl (5 mM), CaCl 2 (2 mM), MgCl 2 (1 mM), NaH2 PO4 (1 mM),NaHCO3 (11.9 mM) וגלוקוז (11 mM). בועה דרך התמיסה עם 95% O 2 ו-5% CO 2 והתאם את ה-pH שלה ל-7.2-7.4 על ידי הוספת HCl/NaOH במידת הצורך.
- הכן את פתרון העמסת הצבע.
- הכן תמיסת HEPES (10 mM) עם pH בטווח 7.2-7.4. 500 מיקרוגרם של צבע מסחרי מגיע בקבוקון 500 μL. ממיסים את הצבע ב-14 מיקרון של תמיסת HEPES כדי לקבל ריכוז צבע של 30 מ"מ. יש לנער היטב את הצנטריפוגה עד להמסה מוחלטת.
- דלל את התמיסה של מחוון Ca2+ עם תמיסת HEPES עד לריכוז של 1 mM. יש לשמור במקפיא (-20°C) ולהימנע מחשיפה לאור.
2. הליך טעינת צבע
הערה: הליך טעינת הצבע מבוצע על פי פרוטוקול ההעמסה דרך גדם העצב, המותאם מהפרוטוקולים שפורסמו בעבר 19,42,43,44,45,46.
- לנתח שריר LAL על פי הליך דיסקציה עבור הכנה זו כמתואר בפרוטוקולים שפורסמו בעבר47,48.
- מקבעים את הרקמה מתוחה מעט (לא יותר מ-30% מהאורך ההתחלתי) בצלחת פטרי המצופה אלסטומר בסיכות נירוסטה עדינות ומוסיפים את התמיסה של רינגר עד לכיסוי מלא של השריר.
הערה: צלחת הפטרי מולאה מראש באלסטומר בהתאם להוראות היצרן (ראה טבלת חומרים).
- מקבעים את הרקמה מתוחה מעט (לא יותר מ-30% מהאורך ההתחלתי) בצלחת פטרי המצופה אלסטומר בסיכות נירוסטה עדינות ומוסיפים את התמיסה של רינגר עד לכיסוי מלא של השריר.
- הכינו את פיפטיית המילוי
- באמצעות משיכת מיקרופיפטה (ראו טבלת חומרים), הכינו מיקרופיפט עם קצה עדין שהוא חד ככל האפשר להקלטות התוך-תאיות. השתמש נימים ללא חוטים פנימיים (1.5 מ"מ קוטר חיצוני ו 0.86 או 1.10 מ"מ קוטר פנימי).
- נתקו את קצה המיקרופיפטה לאחר הניקוד המחודד עם שוחק, והשאירו את הקצה פתוח לקוטר של כ-100 מיקרומטר. יש להבריק את הקצה כלפי מטה עד להגבלה כאשר הקוטר הפנימי מתכווץ מ->80 מיקרומטר ל-12-13 מיקרומטר. חברו צינור סיליקון לצד אחד של פיפטיית המילוי ומזרק (ללא מחט) לצד השני.
- תחת סטריאומיקרוסקופ, מצא את המקום שבו גזע העצבים הופך לענפי עצב נפרדים. מניחים את פיפת המילוי עם הצינור המותקן והמזרק על צלחת פטרי באמצעות שעווה. הזז את קצה הפיפטה עד שהוא עומד מעל העצב.
- עם מספריים עדינים, לחתוך את העצב קרוב לסיבי השריר, משאיר חתיכה קטנה של גדם העצב על 1 מ"מ אורך. שאפו בעדינות את גדם העצבים יחד עם תמיסה כלשהי של רינגר, מבלי לצבוט אותו, לתוך קצה פיפת המילוי. הסר את צינור הסיליקון מפיפטה המילוי.
- צייר כמות מסוימת של תמיסת טעינת הצבע (~ 0.3 μL) באמצעות מזרק עם נימה ארוכה. נפח זה מתאים כ 3 ס"מ של נימה.
הערה: בתחילה, יש צורך ליצור נימה מקצה פיפטה עם נפח של 10 μL על ידי משיכת האש באמצעות מנורת אלכוהול או מבער גז. - הכנס בעדינות את קצה החוט עם תמיסת ההעמסה לתוך פיפת המילוי. שחררו את התערובת ישירות על גדם העצב. לדגור את ההכנה בטמפרטורת החדר בחושך במשך 30 דקות.
- לאחר מכן, שוטפים את ההכנה בתמיסת רינגר טרי ודוגרים ב-25 מעלות צלזיוס עד שעתיים בכוס זכוכית עם תמיסת רינגר של 50 מ"ל (או יותר) (ההכנה חייבת להיות מכוסה בתמיסה). במהלך תקופה זו, הצבע יגיע לסינפסות.
3. לכידת וידאו עם מיקרוסקופיה קונפוקלית
הערה: רישום של טרנזיינטים של סידן מתבצע באמצעות מיקרוסקופ קונפוקלי לסריקת לייזר (LSCM) (ראה טבלת חומרים). כדי לרשום ארעי סידן מהירים, נעשה שימוש בפרוטוקול מקורי שאיפשר הקלטות של אותות ברזולוציה מרחבית וזמנית מספקת. השיטה תוארה ביסודיות בפרסום על ידי Arkhipov et al37. המיקרוסקופ היה מצויד במטרה לטבול במים פי 20 (1.00 NA). קו הלייזר של 488 ננומטר הוחלש לעוצמה של 10% ופלואורסצנטיות פליטה נאספה מ-503 ל-558 ננומטר.
- הרכיבו את התכשיר לתוך תא הניסוי המצופה אלסטומר מסיליקון וקבעו אותו, מתוח מעט, עם סט של מיקרו-מחטים מפלדה. שטפו את התכשיר באופן נרחב עם התמיסה של רינגר.
הערה: נעשה שימוש בתא ניסוי פשוט בהתאמה אישית העשוי מזכוכית אורגנית כאשר תחתית התא מכוסה באלסטומר (שהוכן בהתאם להוראות היצרן; ראה טבלת חומרים). לתא יש צינור אספקת פתרון. התמיסה נשאבת החוצה באמצעות מחט מזרק, המורכבת על מחזיק מגנטי (ראו טבלת חומרים). כתא ניסוי, ניתן להשתמש בצלחת פטרי (כמו זו המשמשת לדגירת ההכנה) אך עם צינורות אספקה ויניקה מחוברים. - התקן אלקטרודת יניקה אשר תשמש כדי לעורר את העצב.
הערה: בניית האלקטרודה דומה למה שפורסם במאמר 2015 על ידי Kazakov et al49. מניחים ומקבעים את האלקטרודה על ידי שעווה לצד האמבטיה. הזיזו את הקצה קרוב לגדם העצב ושאפו אותו לתוך האלקטרודה. - הרכיבו את תא ההכנה על במת המיקרוסקופ והכניסו את אביזרי הכניסה והשקע לתוך התא.
- כדי לזרז את ההכנה, השתמש במערכת פשוטה המונעת על ידי זרימת כבידה. הפעל את משאבת היניקה כדי להסיר את התמיסה העודפת.
- חברו את אלקטרודת היניקה הממריצה לגירוי חשמלי וודאו כי התכווצויות השרירים מתרחשות לאחר גירויים. ראה סעיף 3.9-3.12 לתנאי גירוי והקלטה.
- מלא את מערכת הזלוף בתמיסת הצלצול ב- d-tubocurarine (10 μM).
הערה: פתרון זה מסייע במניעת התכווצויות שרירים. חוסמי D-טובוקוררין או אלפא-בונגארוטוקסין ספציפיים של קולטני אצטילכולין ניקוטיניים על הממברנה הפוסט-סינפטית יחסמו באופן מלא או חלקי התכווצויות שרירים50. כמו כן, למניעת התכווצויות שרירים, ניתן להשתמש בחוסמים ספציפיים של תעלות נתרן פוסט-סינפטיות כגון μ-קונוטוקסין GIIIB51. - הפעל את משאבת היניקה של הזלוף והתחל זלוף של התכשיר עם תמיסת הצלצול המכילה d-tubocurarine.
- הגדר פרמטרי הדמיה בתוכנת LSCM באופן הבא.
- בתוכנת LSCM (LAS AF; ראה טבלת חומרים), בחר אלקטרופיזיולוגיה.
הערה: במצב זה, כאשר תמונה נלכדת בנקודת הזמן, פולס מסנכרן נשלח לגירוי בעזרת תיבת ההדק. זה מעורר יצירת פוטנציאל פעולה בתכשיר (איור 1; יחידת מגרה). - בחר מצב רכישה. להפעלת הגירוי באמצעות פולס הסנכרון של המיקרוסקופ, בהגדרות התפריט ' עבודה ', בחר בהגדרות ' טריגר' . הגדר את השדה Trigger Out On Frame לערוץ out1 .
- השתמש בהגדרות הבאות: מצב סריקה: XYT, תדירות הסריקה: 1400 הרץ, גורם זום: 6.1, חור סיכה: פתוח לחלוטין. ודא שמצב X דו-כיווני רציף העובר באופן חוצה עוברים מופעל.
- הגדר זמן מינימלי ליצירת מסגרת ב-52 אלפיות השנייה ומסגרות לאיסוף בסרטון גולמי ב-20 פריימים.
הערה: הגדרות אלה מאפשרות לכידת תמונה ברזולוציה של 128 x 128 פיקסלים תוך צילום מסגרת אחת כל 52 אלפיות השנייה. - הגדר את אורך גל העירור של לייזר הארגון ב-488 ננומטר עם 8% מעוצמת היציאה.
- בתוכנת LSCM (LAS AF; ראה טבלת חומרים), בחר אלקטרופיזיולוגיה.

איור 1: הסכימה של מערך הניסוי. 1. מיקרוסקופ קונפוקלי לסריקת לייזר (LSCM). 2. מודול סנכרון של LSCM (תיבת הדק). 3. מגרה. 4. יחידת בידוד. 5. הדגימה הביולוגית. 6. אלקטרודת יניקה לגירוי חשמלי של עצב. 7. מערכות זלוף (7a: מאגר perfusate, 7b: dropper, 7c: וסת זרימה, 7d: בקבוק ואקום). החצים מצביעים על כיוון ההתפשטות של הדופק המסנכרן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- לחץ על הלחצן Live Mode כדי לעבור למצב חי, המסייע לקבל תצוגה מקדימה של מסופי העצבים הטעונים בצבע.

איור 2: עצב העכבר והטרמינלים הטעונים במחוון Ca2+. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- יחידת גירוי
הערה: בעבודה זו נעשה שימוש בממריץ המתואר במאמר על ידי Land et al.52 . מכשיר זה מאפשר הגדרת פרמטרים זמניים של גירוי באמצעות תוכנת MatLab.- צור קובץ חדש, הדבק את הקוד מהמאמר הנ"ל בחלון הקוד MatLab ושמור את הקובץ. לחץ על הפעלה, כך שמופיע חלון עם פרמטרים של גירוי. הגדר את זמן ההשהיה ואת משך הזמן של הגירוי.
הערה: ההשהיה קובעת את הרזולוציה הזמנית של האות הפלואורסצנטי המחודש. הפולס החשמלי של משך 0.2 אלפיות השנייה מתעכב, ולאחר מכן נשלח ליחידת הבידוד. זה האחרון יוצר את המשרעת והקוטביות של הדופק המגרה ומבודד חשמלית את האובייקט הביולוגי מציוד ההקלטה. - כדי לעורר את העצב, בחר משרעת supramaximal של הדחף מגרה (25%-50% גדול יותר מאשר עוצמת הגירוי המרבי הדרוש כדי להפעיל את כל סיבי העצב).
הערה: השיטה המוצגת מבוססת על אלגוריתם מיוחד להקלטות של אותות פלואורסצנטיים מהירים בודדים באמצעות LSCM עם הטאטוא הממוזער. בכל שלב של האלגוריתם שפותח, האות הפלואורסצנטי המוקלט מועבר מקודמו על ידי מרווח זמן קצר יותר ממטאטא המיקרוסקופ. הערך של משמרות זמן קובע את הרזולוציה הזמנית של האות הנדרש. מספר הצעדים (תזוזות) באלגוריתם תלוי ברזולוציה הטמפורלית הנדרשת וברזולוציה הטמפורלית המקורית. בשיטה זו של רישום, גירוי ההכנה מתבצע בתדר של 0.25 הרץ.
- צור קובץ חדש, הדבק את הקוד מהמאמר הנ"ל בחלון הקוד MatLab ושמור את הקובץ. לחץ על הפעלה, כך שמופיע חלון עם פרמטרים של גירוי. הגדר את זמן ההשהיה ואת משך הזמן של הגירוי.
- במצב חי, חפש את החזר ההשקעה וקבל את המיקוד הטוב ביותר. הפעל את התוכנה לאיסוף נתונים.
- הזז את ההשהיה על הגירוי ב-2 אלפיות השנייה פחות ביחס לערך הקודם והפעל את תוכנת רכישת הנתונים.
- חזור על שלב 3.11 26 פעמים כדי לרכוש 26 רצפים, כאשר כל רצף הוזז ב-2 אלפיות השנייה מהקודם.
4. עיבוד וידאו
הערה: סדרה של תמונות וידאו שנרכשו על-ידי מיקרוסקופ קונפוקלי מיוצאת בתבנית TIFF עם התוכנה החופשית LAS X (ראה טבלת חומרים). סדרה זו חולקה למסגרות ויוצאה לתיקייה. ליצירת רצף התמונה עם רזולוציית זמן גבוהה יותר, נעשה שימוש בתוכנת ImageJ, בעלת קוד ראשוני פתוח לניתוח ועיבוד הנתונים. האלגוריתם של עיבוד אותות מיוצג באופן סכמטי באיור 3.
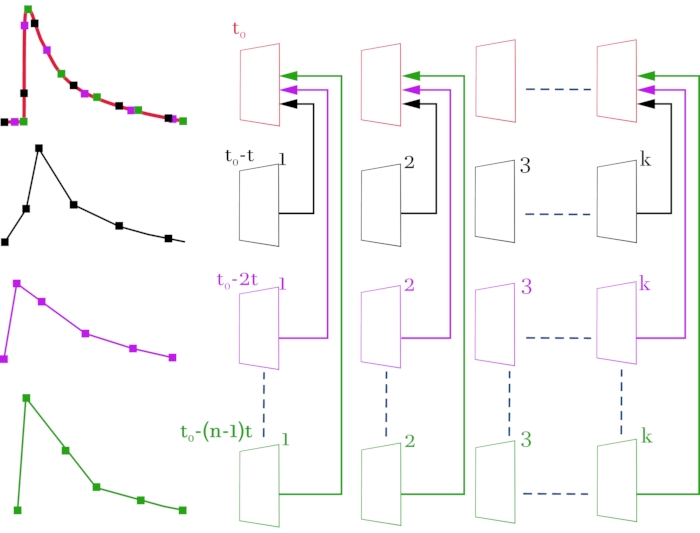
איור 3: סכימה להרכבת קובץ וידאו ברזולוציה גבוהה (2 אלפיות השנייה על המסגרת) מקבצי וידאו מקוריים ברזולוציה זמנית נמוכה (52 אלפיות השנייה במסגרת). קבצי הווידאו המקוריים והאותות המתאימים צבועים בשחור, מגנטה וירוק. קובץ הווידאו שעבר הידור והאות המתקבל צבועים באדום. הסכימה מימין, שורה אחר שורה, מציגה את תמונות הווידאו המתקבלות במיקרוסקופ קונפוקלי. בצד שמאל, האותות המתאימים של פלואורסצנציה משתנים מההחזר על ההשקעה שנבחר. הקו העליון ביותר נוצר מסגרת אחר מסגרת מהמסגרות שהתקבלו על פי התוכנית. התוצאה היא תמונת וידאו המורכבת מכל מערך המסגרות, כך שיש זמן השהיה של 2 אלפיות השנייה בין המסגרות במקום 52 אלפיות השנייה. כל שורה מתאימה להסטה של אות הגירוי ב- (n - 1) * t, כאשר t הוא הסטת זמן (2 אלפיות השנייה), ו- n הוא מספר איטרציות ההזזה. K מציין את מספר המסגרות בקבצי הווידאו המקוריים (שורות 2-4) ותלוי במשך האות המוקלט. במקרה זה, כדי לרשום אות עם משך של 1 שניות, יש צורך לבחור k = 20 (52 ms * 20 = 1040 ms). t0 הוא העיכוב הנדרש לפני הגירוי. כדי לחשב את מספר איטרציות ההזזה n, יש לחלק את הרזולוציה הטמפורלית הראשונית בין מסגרות (52 אלפיות השנייה) ברזולוציה הזמנית הנדרשת (2 מילישניות). במקרה זה, n = 26, אשר מתאים 26 מטאטאים רשומים. כתוצאה מהמניפולציות שבוצעו, מתקבלת תמונת וידאו המורכבת מ- n * k = 520 מסגרות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- הפעל את תוכנת LAS X. פתח את הפרויקט שנוצר במהלך ביצוע הניסוי. לחץ על ייצוא ולאחר מכן על שמירה בשם כדי לשמור מסגרות בתבנית .tiff בתיקיית היעד.
- הפעל את תוכנת ImageJ. לחץ על קובץ > ייבוא > רצף תמונות.
- בחלון Open Image Sequence , בחרו בתיקיית היעד ופתחו את המסגרת הראשונה.
- בחלון ' אפשרויות רצף ', בשדה 'תמונה התחלתית ', קבעו את מספר המסגרת ל- 1 במסגרת הראשונה. בשדה הפרש קבוע , הגדר את הערך השווה למספר המסגרות בהקלטת האות הראשונית (20 במקרה הנוכחי) ולחץ על אישור.
- כדי לשמור את הקובץ שנוצר של מסגרות ראשונות תפורות בתיקייה נפרדת, לחץ על קובץ > שמור תיקיית >.
- חזור על שלבים 4.3-4.5 עבור 19 המסגרות הבאות. בחלון ' אפשרויות רצף ', קבעו את מספר המסגרת המתאים בשדה 'תמונה התחלתית '.
- כדי ליצור את הסרטון המלא ברזולוציה גבוהה, תפר את כל המסגרות יחד. לשם כך, לחץ על קובץ > ייבוא > רצף תמונות ובחר 1 בשדות תמונה התחלתית והפרעה . התוצאה תהיה הסרטון הסופי עם רזולוציה זמנית מוגברת. שמור את הקובץ .tiff או בכל פורמט מתאים אחר.
5. ניתוח וידאו
הערה: ב- ImageJ, בחר ROI ורקע. הפחת רקע מ- ROI. הנתונים מיוצגים כיחס, (ΔF / F 0 - 1) * 100%, כאשר F0 היא עוצמת הפלואורסצנציה במנוחה ו- ΔF היא עוצמת הפלואורסצנציה במהלך הגירוי.
- לחץ על אוספי תמונות > > כלים > סדרן אוסף. לאחר מכן, לחץ על ניתוח > כלים > מנהל ROI.
- גרור ושחרר את קובץ .tiff שנשמר בשלב 4.7 לתוך חלון ImageJ. הרחב את התמונה לקבלת תצוגה טובה יותר. כדי לשפר את התצוגה החזותית של התמונה, לחץ על תמונה > התאם > בהירות/ניגודיות > אוטומטית. שלב זה לא ישפיע על הנתונים.
- הגדר את הרקע קרוב למסוף העצבים על ידי ציור ROI. הוסף אותו למנהל החזר ההשקעה. חשב את הרקע על ידי לחיצה על עוד > Multi Measure. העתק ערכים ממוצעים, הדבק בתוכנית הגיליון האלקטרוני וחשב את הממוצע.
- הפחת את הערך הממוצע המחושב מהערימות על-ידי לחיצה על תהליך > ראשי > חיסור. הזן את הערך.
- משוך ROI סביב מסוף עצבים באמצעות קו מצולע. הוסף אותו למנהל החזר ההשקעה.
- מדוד את עוצמת מסוף העצבים: לחץ על עוד > Multi Measure. העתק ערכים ממוצעים והדבק אותם בתוכנית הגיליון האלקטרוני.
- חישוב הקיזוז הממוצע של אותות.
הערה: השתמש בנקודות המתאימות בהתאם לזמן ההשהיה לפני הגירוי. שלב זה קובע את הערך F0 שישמש בחישובים הבאים. - חלק את ערכי האות בערך ההסטה הממוצע.
הערה: לאחר שלב זה, האות אינו מכיל את התרומה של הרקע והפלואורסצנציה הגולמית לערכי המשרעת עבור ההחזר על ההשקעה שנבחר. - הפחת 1 מהערכים המתקבלים בשלב 5.8, ולאחר מכן הכפל ב- 100%.
- שרטט גרף של Ca2+- ארעי וחשב את המשרעת.
תוצאות
לאחר טעינת התכשיר בצבע על פי הטכניקה המוצגת, לרוב הסינפסות הממוקמות קרוב לגדם העצב הייתה רמה מספקת של פלואורסצנטיות (ראו איור 2). לאחר טעינת ההכנה עם הצבע ויישום השיטה המתוארת של רישום ועיבוד תמונה, התקבלו ארעי סידן ברזולוציה המרחבית והזמנית הרצויה (ראו איור 4
Discussion
השיטה להעמסת צבע רגיש Ca2+ לתוך קצות העצבים של העכבר דרך גדם העצב ולרישום מעבר סידן מהיר באמצעות מיקרוסקופ קונפוקלי מוצגת במאמר זה. כתוצאה מיישום שיטת העמסה זו, לרוב הסינפסות הממוקמות קרוב לגדם העצב הייתה רמה מספקת של פלואורסצנטיות כדי לאפשר רישום של כניסת סידן לקצות העצבים בתגובה לג?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקרים פלואורסצנטיים של עבודה זו בוצעו בתמיכה כספית של מענק קרן המדע הרוסית (פרויקט מס '19-15-00329). השיטה פותחה במימון המשימה הממשלתית עבור המרכז המדעי FRC קאזאן של RAS ААААА-А18-118022790083-9. המחקר פותח תוך שימוש בציוד של מרכז המחקר הפדרלי "מרכז מדעי קאזאן של RAS". המחברים מבקשים להודות לד"ר ויקטור א. איליין על הקריאה הביקורתית של כתב יד זה.
Materials
| Name | Company | Catalog Number | Comments |
| Capillary Glass | Clark Electromedical instruments, UK | GC150-10 | |
| Confocal and multiphoton microscope system Leica TCS SP5 MP | Leica Microsystems , Heidelberg, Germany | ||
| Flaming/Brown Micropipette Puller P 97 | Sutter Instrument, USA | P-97 | |
| Flow regulator | KD Medical GmbH Hospital Products, Germany | KD REG | Disposable infusion set with Flow regulator |
| HEPES | Sigma-Aldrich, USA | H0887 | 100mL |
| Illumination system Leica CLS 150X | Leica Microsystems, Germany | ||
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Las AF software | Leica Microsystems, Heidelberg, Germany | ||
| Las X software | Leica Microsystems, Heidelberg, Germany | https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/ | |
| Magnetic Holder with Suction Tubing | BIOSCIENCE TOOLS, USA | MTH-S | |
| Microspin FV 2400 | Biosan, Latvia | BS-010201-AAA | |
| Minutien Pins | Fine science tools, Canada | 26002-20 | |
| Multi-spin MSC 3000 | Biosan, Latvia | BS-010205-AAN | |
| Oregon Green 488 BAPTA-1 pentapotassium salt | Molecular Probes, USA | O6806 | 500 μg |
| Pipette | Biohit, Russia | 720210 | 0.5-10 µL |
| Pipette tip | Biohit, Russia | 781349 | 10 µL |
| Plasticine | local producer | ||
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40 mm |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel | |
| Stereomicroscope, Leica M80 | Leica Microsystems , Germany | ||
| Suction electrode | Kazakov A. SIMPLE SUCTION ELECTRODE FOR ELECTRIC STIMULATION OF BIOLOGICAL OBJECTS / A. Kazakov, M. Alexandrov, N. V. Zhilyakov et al. // International research journal. - 2015. - No. 9 (40) Part 3. - P. 13-16. | http://research-journal.org/biology/prostoj-vsasyvayushhij-elektrod-dlya-elektricheskoj-stimulyacii-biologicheskix-obektov/ | |
| Sylgard 184 elastomer | Dow Corning, USA | ||
| Syringe | local producer | 0.5 mL | |
| Syringe | local producer | 60 mL |
References
- Llinas, R., Steinberg, I. Z., Walton, K. Presynaptic calcium currents and their relation to synaptic transmission: voltage clamp study in squid giant synapse and theoretical model for the calcium gate. Proceedings of the National Academy of Sciences of the United States of America. 73 (8), 2918-2922 (1976).
- Augustine, G. J. How does calcium trigger neurotransmitter release. Current Opinion in Neurobiology. 11 (3), 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37 (5), 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Current Opinion in Neurobiology. 15 (3), 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Current Opinion in Cell Biology. 22 (4), 496-505 (2010).
- Leal, S. S., Gomes, C. M. Calcium dysregulation links ALS defective proteins and motor neuron selective vulnerability. Frontiers in Cellular Neuroscience. 9, 225 (2015).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods in Cell Biology. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harbor Protocols. 2010 (3), (2010).
- Macleod, G. T. Topical application of indicators for calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 786-790 (2012).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in Neuroscience and Development: A Laboratory Manual. , 307-314 (2005).
- Eilers, J., Konnerth, A. Dye loading with patch pipettes. Cold Spring Harbor Protocols. 2009 (4), 5201 (2009).
- Coleman, W. L., et al. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. Journal of Physiology. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct injection of indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 797-801 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10 (3), 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. α-Latrotoxin releases calcium in frog motor nerve terminals. The Journal of Neuroscience. 20 (23), 8685-8692 (2000).
- Newman, Z., et al. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. The European Journal of Neuroscience. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 2012 (7), 791-796 (2012).
- Rossano, A. J., Macleod, G. T. Loading drosophila nerve terminals with calcium indicators. Journal of Visualized Experiments: JoVE. (6), e250 (2007).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Suzuki, S., et al. Ca2+ dynamics at the frog motor nerve terminal. Pflugers Archiv: European Journal of Physiology. 440 (3), 351-365 (2000).
- Ojala, K. S., et al. A high-affinity, partial antagonist effect of 3,4-diaminopyridine mediates action potential broadening and enhancement of transmitter release at NMJs. Journal of Biological Chemistry. 296, 100302 (2021).
- Samigullin, D., et al. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Frontiers in Synaptic Neuroscience. 6, 29 (2015).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. The Journal of Physiology. 505, 585-592 (1997).
- Bullen, A., Patel, S. S., Saggau, P. High-speed, random-access fluorescence microscopy: I. High-resolution optical recording with voltage-sensitive dyes and ion indicators. Biophysical Journal. 73 (1), 477-491 (1997).
- Bullen, A., Saggau, P. High-speed, random-access fluorescence microscopy: II. Fast quantitative measurements with voltage-sensitive dyes. Biophysical Journal. 76 (4), 2272-2287 (1999).
- Bullen, A., Saggau, P. Optical recording from individual neurons in culture. Modern Techniques in Neuroscience Research. (4), 89-126 (1999).
- Bullen, A., Saggau, P. Indicators and optical configuration for simultaneous high-resolution recording of membrane potential and intracellular calcium using laser scanning microscopy. Pflugers Archiv European Journal of Physiology. 436 (5), 788-796 (1998).
- Wilson, T. Optical aspects of confocal microscopy. Confocal Microscopy. , 93-141 (1990).
- Cox, G. Biological confocal microscopy. Materials Today. 5 (3), 34-41 (2002).
- Mukhitov, A., Arkhipova, S., Nikolsky, E. Modern Light Microscopy in Biological and Medical Research. Nauka. , (2011).
- Mertz, J. Optical sectioning microscopy with planar or structured illumination. Nature Methods. 8 (10), 811-819 (2011).
- Webb, R. H. Confocal optical microscopy. Reports on Progress in Physics. 59 (3), 427-471 (1996).
- Toomre, D., Pawley, J. B. Disk-scanning confocal microscopy. Handbook of Biological Confocal Microscopy: Third Edition. , 221-238 (2006).
- Venkateswarlu, K., et al. Three-dimensional imaging and quantification of real-time cytosolic calcium oscillations in microglial cells cultured on electrospun matrices using laser scanning confocal microscopy. Biotechnology and Bioengineering. 117 (10), 3108-3123 (2020).
- Arkhipov, A. Y., Khaziev, E. F., Skorinkin, A. I., Bukharaeva, E. A., Samigullin, D. V. Enhancement of the temporal resolution of fluorescent signals acquired by the confocal microscope. Microscopy and Microanalysis. 26 (2), 204-210 (2020).
- Rama, S. Shift and mean algorithm for functional imaging with high spatio-temporal resolution. Frontiers in Cellular Neuroscience. 9, (2015).
- Chan, K. G., Streichan, S. J., Trinh, L. A., Liebling, M. Simultaneous temporal superresolution and denoising for cardiac fluorescence microscopy. IEEE Transactions on Computational Imaging. 2 (3), 348-358 (2016).
- Veeraraghavan, A., Reddy, D., Raskar, R. Coded strobing photography: compressive sensing of high speed periodic videos. IEEE Transactions on Pattern Analysis and Machine Intelligence. 33 (4), 671-686 (2011).
- Angaut-Petit, D., Molgo, J., Connold, A. L., Faille, L. The levator auris longus muscle of the mouse: A convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. Neuroscience Letters. 82 (1), 83-88 (1987).
- Macleod, G. T. Calcium imaging at the Drosophila larval neuromuscular junction. Cold Spring Harbor Protocols. 7 (7), 758-766 (2012).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Bukharaeva, E. A., Nikolsky, E. E. Loading a calcium dye into frog nerve endings through the nerve stump: calcium transient registration in the frog neuromuscular junction. Journal of Visualized Experiments: JoVE. (125), e55122 (2017).
- Samigullin, D. V., et al. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoScience. 7 (1), 162-166 (2017).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. Journal of Neuroscience. 31 (31), 11268-11281 (2011).
- Luo, F., Dittrich, M., Cho, S., Stiles, J. R., Meriney, S. D. Transmitter release is evoked with low probability predominately by calcium flux through single channel openings at the frog neuromuscular junction. Journal of Neurophysiology. 113 (7), 2480-2489 (2015).
- Wright, M., Kim, A., Son, Y. -. J. Subcutaneous administration of muscarinic antagonists and triple-immunostaining of the levator auris longus muscle in mice. Journal of Visualized Experiments: JoVE. (55), e3124 (2011).
- Burke, S. R. A., Reed, E. J., Romer, S. H., Voss, A. A. Levator Auris Longus preparation for examination of mammalian neuromuscular transmission under voltage clamp conditions. Journal of Visualized Experiments: JoVE. (135), e57482 (2018).
- Kazakov, A., Alexandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Meždunarodnyj naučno-issledovatel'skij žurnal (International Research Journal). 9 (40), 13-16 (2015).
- Bowman, W. C. Neuromuscular block. British Journal of Pharmacology. 147, 277-286 (2006).
- Hill, J. M., Alewood, P. F., Craik, D. J. Three-dimensional solution structure of µ-conotoxin GIIIB, a specific blocker of skeletal muscle sodium channels. Biochemistry. 35 (27), 8824-8835 (1996).
- Land, B. R., Johnson, B. R., Wyttenbach, R. A., Hoy, R. R. Tools for physiology labs: Inexpensive equipment for physiological stimulation. Journal of Undergraduate Neuroscience Education. 3 (1), 30-35 (2004).
- Samigullin, D. V., Zhilyakov, N. V., Khaziev, E. F., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient and quantal release in mouse neuromuscular junction under extracellular calcium concentration change. BioNanoScience. 8 (4), 984-987 (2018).
- Khaziev, E., et al. acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Frontiers in Physiology. 7, 621 (2016).
- Zhilyakov, N., Arkhipov, A., Malomouzh, A., Samigullin, D. Activation of neuronal nicotinic receptors inhibits acetylcholine release in the neuromuscular junction by increasing ca2+ flux through cav1 channels. International Journal of Molecular Sciences. 22 (16), 9031 (2021).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophysical Journal. 74 (3), 1549-1563 (1998).
- McArdle, J. J., et al. Advantages of the triangularis sterni muscle of the mouse for investigations of synaptic phenomena. Journal of Neuroscience Methods. 4 (2), 109-115 (1981).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved