Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Descubriendo la dinámica oculta de las estructuras fotónicas naturales utilizando imágenes holográficas
En este artículo
Resumen
El artículo se centra principalmente en el poder combinado de los métodos ópticos (lineales y no lineales) y holográficos utilizados para revelar fenómenos a nanoescala. Los resultados obtenidos de los estudios de reacciones químicas biofotónicas y oscilatorias se dan como ejemplos representativos, destacando la capacidad de la holografía para revelar dinámicas a nanoescala.
Resumen
En este método, se explota el potencial de la óptica y la holografía para descubrir detalles ocultos de la respuesta dinámica de un sistema natural a nanoescala. En la primera parte, se presentan los estudios ópticos y holográficos de estructuras fotónicas naturales, así como las condiciones para la aparición del efecto fotoforético, a saber, el desplazamiento o la deformación de una nanoestructura debido a un gradiente térmico inducido por la luz, a nanoescala. Este efecto se revela mediante interferometría holográfica digital en tiempo real que monitorea la deformación de las escamas que cubren las alas de los insectos inducida por la temperatura. El vínculo entre la geometría y la nanocorrugación que conduce a la aparición del efecto fotoforético se demuestra y confirma experimentalmente. En la segunda parte, se muestra cómo la holografía se puede utilizar potencialmente para descubrir detalles ocultos en el sistema químico con dinámica no lineal, como el fenómeno de transición de fase que ocurre en la reacción oscilatoria compleja de Briggs-Rauscher (BR). El potencial presentado de la holografía a nanoescala podría abrir enormes posibilidades para controlar y moldear el efecto fotoforético y la formación de patrones para diversas aplicaciones, como la captura y levitación de partículas, incluido el movimiento de hidrocarburos no quemados en la atmósfera y la separación de diferentes aerosoles, la descomposición de microplásticos y el fraccionamiento de partículas en general, y la evaluación de la temperatura y la conductividad térmica de partículas de combustible de tamaño micrométrico.
Introducción
Para comprender y notar completamente todos los fenómenos únicos en el nanomundo, es crucial emplear técnicas que sean capaces de revelar todos los detalles relacionados con las estructuras y la dinámica a nanoescala. En esta cuenta, se presenta la combinación única de métodos lineales y no lineales, combinados con el poder de la holografía para revelar la dinámica del sistema a nanoescala.
La técnica holográfica descrita se puede ver como el método de triple rec (rec es la abreviatura de grabación), ya que en un momento dado la señal es grabada simultáneamente por una cámara fotográfica, una cámara térmica y un interferómetro. La espectroscopia óptica lineal y no lineal y la holografía son técnicas bien conocidas, cuyos principios fundamentales se describen ampliamente en la literatura 1,2.
Para abreviar una larga historia, la interferometría holográfica permite la comparación de frentes de onda registrados en diferentes momentos en el tiempo para caracterizar la dinámica del sistema. Anteriormente se utilizaba para medir la dinámica vibracional 3,4. El poder de la holografía como el método de interferometría más simple se basa en su capacidad para detectar el desplazamiento más pequeño dentro del sistema. En primer lugar, explotamos la holografía para observar y revelar el efecto fotoforético5 (es decir, el desplazamiento de la deformación de una nanoestructura debido a un gradiente térmico inducido por la luz), en diferentes estructuras biológicas. Para una verdadera presentación del método, se seleccionaron muestras representativas de una serie de muestras biológicas probadas6. Alas de la mariposa fritillaria reina de España, Issoria lathonia (Linnaeus, 1758; I. lathonia), se utilizaron en el marco de este estudio.
Después de haber demostrado con éxito la ocurrencia de fotoforesis a nanoescala en tejidos biológicos, se aplicó un protocolo similar para monitorear el proceso espontáneo de ruptura de simetría7 causado por una transición de fase en una reacción química oscilatoria. En esta parte, se estudió la transición de fase de una baja concentración de yoduro y yodo (llamada estado I) a una alta concentración de yoduro y yodo con formación de yodo sólido (definido como estado II) que ocurre en una reacción BR químicamente no lineal 8,9. Aquí, informamos por primera vez un enfoque holográfico que permite estudiar tal transición de fase y dinámica de ruptura de simetría espontánea a nanoescala que ocurre en sistemas condensados.
Protocolo
1. Precaracterización
- Realizar una precaracterización completa de la muestra.
- Realizar todos los experimentos en especímenes secos comprados de una fuente comercial. Guarde las muestras en el laboratorio, en un lugar seco y oscuro, a temperatura ambiente.
- Antes de las mediciones holográficas, realice una caracterización completa de la muestra mediante microscopio electrónico de barrido (SEM), espectroscopia óptica lineal y microscopía óptica no lineal (NOM)10 (Figura 1).
- Además de las propiedades ópticas de las muestras medidas por técnicas lineales, se recopila información complementaria con rayos láser de mayor intensidad que permiten la caracterización de sus propiedades ópticas no lineales.
- Utilizar las susceptibilidades ópticas no lineales correspondientes para cuantificar la respuesta óptica no lineal y formar la base de técnicas ópticas no lineales como la fluorescencia de excitación multifotónica no destructiva y la segunda generación armónica (SHG), que se utilizan para caracterizar diversas muestras biológicas.
- Para los fenómenos químicos no lineales que ocurren en la reacción BR oscilante, llevar a cabo el estudio de monitoreo interferométrico de la transición de fase in situ del estado I al estado II con las siguientes concentraciones de reactivos: [CH2(COOH)2]0 = 0.0789 mol dm-3, [MnSO4]0 = 0.0075 mol dm-3, [HClO4]0 = 0.03 mol dm-3, [KIO3] 0 = 0.0752 mol dm-3, y [H2O2]0 = 1.269 mol dm-3 (0 después del corchete representa la concentración inicial al comienzo del proceso). Haga que el volumen total utilizado para la reacción BR sea igual a 2,5 ml.
NOTA: Los valores de concentración utilizados aquí son iguales a los del estudio de Pagnacco et al.8, pero con volumen de reacción dividido por 10.
- Prepare la muestra para el experimento.
- Utilice alas de la mariposa fritilar reina de España, I. lathonia, para este experimento. Coloque el ala sobre una superficie dura y haga una sección con un cortador de 10 mm de diámetro. Coloque la muestra en la caja de muestras, que puede ser cualquier recipiente con tapa.

Figura 1: Sección transversal ondulada de la escala del ala de la mariposa. La sección transversal se registró en un microscopio de barrido óptico no lineal (A, B). También se realizó una observación SEM (C) de un ala de la mariposa fritillaria reina de España, I. lathonia. Esta cifra ha sido modificada de14. Haga clic aquí para ver una versión más grande de esta figura.
2. Configuración experimental
- Configuración holográfica
NOTA: Las mediciones de interferometría holográfica se realizaron con una configuración óptica a medida (Figura 2).- Ajuste la temperatura de laboratorio a 23 °C ± 0,2 °C. Encienda el láser. Utilice un láser (detalles dados en la Tabla de Materiales) con una longitud de onda de excitación de 532 nm para estas observaciones holográficas.
- Compruebe la alineación de los elementos ópticos (Figura 2). Primero, verifique que la configuración se realice de acuerdo con el esquema de la Figura 2.
- Alinee el rayo láser perfectamente con el espejo cóncavo M. Compruebe y ajuste la posición del expansor de haz óptico (L).
- Determine la parte del haz que incide en la muestra S y asegúrese de que forma un haz reflejo O. Compruebe si el resto del haz se recoge en un espejo esférico CM, que se utilizará para generar el haz de referencia R. Compruebe si el detector C está colocado dentro de la zona de interferencia de los dos haces especificados.
NOTA: Se utiliza un sensor de semiconductor de óxido metálico complementario (CMOS) como detector. - Configure las cámaras de acuerdo con las instrucciones de la cámara utilizada. Configure una cámara óptica/fotográfica para el experimento holográfico como se muestra en la Figura 2 (C es la cámara; los detalles se dan en la Tabla de Materiales). Configure una segunda cámara óptica/fotográfica para ver los cambios visibles en la reacción BR y una cámara térmica con una resolución térmica de 50 mK y una distancia focal de 13 mm por encima de la mesa óptica.
NOTA: La cámara utilizada en el experimento holográfico no utiliza una lente objetiva; la luz incide directamente en el chip.
- Prepare el ejemplo en la configuración holográfica.
- Prepare la muestra de ala como en el paso 1.2.1. Coloque la muestra preparada sobre un soporte metálico redondo con un diámetro de 15 mm. El soporte tiene tres orificios existentes para los tornillos a los que está unido el anillo de metal que sostiene la muestra.
- Fije el anillo al soporte. Coloque la muestra adjunta en la parte del soporte de muestra ubicada en la mesa óptica.
- Prepare la muestra para el monitoreo de reacciones químicas. En la mesa óptica, en el lugar previsto, coloque un soporte con una superficie adhesiva plana sobre la que se colocará la cubeta / recipiente.
- Prepare el reactivo utilizado para inicializar la reacción como en el paso 1.1.5. Llene los reactivos en la cubeta y mezcle en cubeta en el siguiente orden de volúmenes y concentraciones: 0.7 mL de 0.2817 mol dm-3 CH2(COOH)2; 0,5 mL de 0,0375 mol dm-3 MnSO4; 0,5 ml de 0,15 mol dm-3 HClO4; 0,5 ml de 0,376 mol dm-3 KIO3 ; y 0,3 mL de 10,575 mol dm-3 H2O2.
- Asegúrese de que el volumen total en la cubeta sea de 2,5 ml y colóquelo en el soporte en la configuración.
- Configure instrumentos adicionales si es necesario. Para monitorear el efecto fotoforético, use un láser adicional (detalles dados en la Tabla de Materiales) para el calentamiento local.
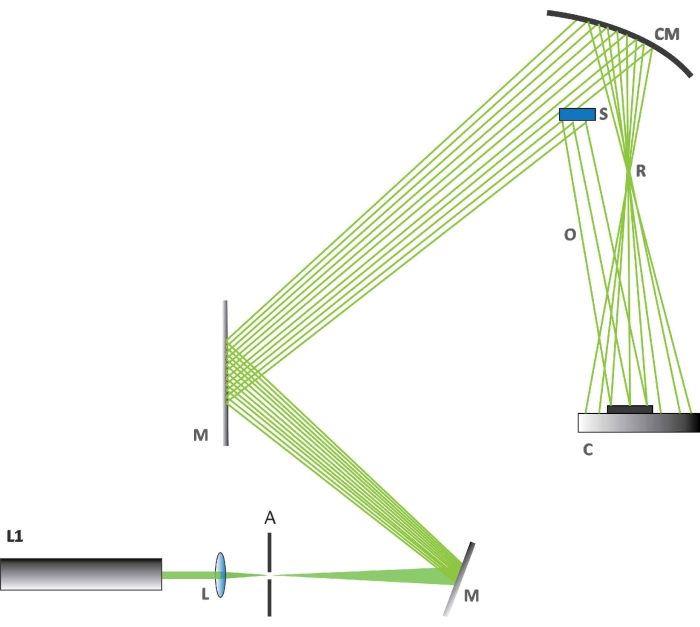
Figura 2: La configuración holográfica. La figura muestra cómo se organizan los diversos componentes para el experimento holográfico. Abreviaturas: L1 = láser a 532 nm, L = lente biconvexa, A = apertura, M = un espejo plano utilizado para desviar el rayo láser, CM = espejo cóncavo, C = cámara CMOS, S = sección del ala de mariposa, R = haz de referencia, O = haz de objeto. Haga clic aquí para ver una versión más grande de esta figura.
3. Configuración del software utilizado
NOTA: El software C++ casero basado en la aproximación de Fresnel11 se utiliza para analizar datos de experimentos holográficos. El software desarrollado para el estudio presentado se puede encontrar en . 12 Los detalles del software no se pueden publicar en este momento; sin embargo, se proporcionará información adicional previa solicitud. La aproximación de Fresnel es extremadamente útil en la holografía digital, ya que se centra en diferentes superficies y se acerca al área del primer orden de difracción, que contiene información completa sobre la escena grabada.
- Encienda la computadora y ejecute el software.
NOTA: El paso para ejecutar el software depende del software en sí. No existe ningún software comercial para este propósito.
4. Realiza el experimento
- Apague las luces externas. Lleva a cabo todo el experimento en una habitación oscura.
- Sincronice las cámaras utilizando un intervalo elegido. Para este experimento, inicie la cámara holográfica después de los 60 s, y las otras dos cámaras inmediatamente después de ella, utilizando un software o manualmente.
- Presione los botones de grabación y defina en el software cuándo se inicia la grabación.
- Inducir cambios dinámicos en el sistema de interés. El método de iniciación depende del tipo de muestra; en el caso de efecto fotoforético, calentar externamente la muestra utilizando los láseres disponibles: 450 nm, 532 nm, 660 nm, 980 nm. En el caso de la reacción BR, comience la reacción mezclando los reactivos químicos. Observa el experimento holográfico.
- Configure la cámara fotográfica y térmica para seguir todo el experimento y determinar el momento del final de la grabación holográfica a partir de las mediciones ópticas y térmicas.
- Pronuncia el final del proceso. El final de la grabación está preprogramado, de acuerdo con la duración estimada del proceso. Para la reacción BR, use la solidificación como el final de la reacción. En el caso del efecto fotoforético, no existe tal momento específico. En cualquier caso, este paso enfatiza la importancia de la triple grabación.
5. Adquisición de resultados12
- Guarde los resultados. Ordene con precisión los archivos en función del tiempo para reconstruir hologramas y un análisis de datos más profundo.
NOTA: En este paso, los datos se transfieren de la cámara utilizada para la holografía al ordenador (disco duro) en carpetas con el nombre de las fechas de disparo. Utilice los botones copiar/pegar y cambiar el nombre. - Compruebe el holograma de la sonda para obtener la configuración adecuada. De esta manera, los mejores ajustes se seleccionan en el primer holograma mirándolo y luego se utilizan para la reconstrucción de todos los hologramas.
- Elija un holograma haciendo clic en uno de ellos de la carpeta que realizó anteriormente (paso 5.1) y realice una reconstrucción haciendo clic en el botón Reconstruir .
- Cambia la configuración para lograr la mejor imagen y vuelve a hacer la reconstrucción. Las opciones para ajustar parámetros como muestreo, desplazamiento y distancia de Fresnel aparecerán en la pantalla (menú de software). Repita estos pasos hasta que se defina la mejor configuración.
- Realizar las reconstrucciones. Elija todos los hologramas haciendo clic en el botón Abrir archivo y eligiendo todos los archivos. Aplicar los parámetros deseados para la reconstrucción numérica de hologramas; permanecen sin cambios después del paso 5.2.1, por lo que no realice ninguna acción esta vez.
- Realice las reconstrucciones utilizando el botón Reconstruir y los interferogramas insertando los nombres de archivo en el campo inicio con/fin con y luego haciendo clic en el botón Lote. Los interferogramas aparecen en la carpeta creada anteriormente (en el paso 5.1).
NOTA: Después de grabar una serie de hologramas en el tiempo, el primer holograma representa un estado imperturbable, mientras que la acción de una fuerza externa causa hologramas posteriores. Es necesario reconstruir los hologramas utilizando la transformada de Fresneldesplazada 13. - Obtener los interferogramas por sustracción (en términos de números complejos) de un holograma particular en el tiempo con el primer holograma obtenido.
NOTA: Este protocolo permite observar el efecto de la fuerza sobre el objeto. El cambio en el patrón de interferencia en función del tiempo es una consecuencia de la deformación o desplazamiento que se produce dentro del sistema durante la medición. Estos cambios se utilizan para monitorear la dinámica del sistema a nanoescala.
6. Análisis de los resultados
- Realizar un análisis visual como primer paso de control de calidad del proceso. En este paso, busque cambios visibles en el patrón de interferencia y trate de hacer coincidir los cambios en el patrón de interferencia con los resultados obtenidos por mediciones ópticas y térmicas.
- Realice un contrainterrogatorio de todas las grabaciones. En esta segunda fase del análisis, analizar a fondo las imágenes visualmente de las cámaras ópticas y térmicas con las reconstrucciones holográficas con el fin de revelar la dinámica a nanoescala. De esta manera, el momento de reacción se ve simultáneamente en imágenes holográficas, térmicas y fotográficas.
- Haga una representación gráfica de los resultados basada en análisis numéricos / de software y preséntelos en forma de gráficos (1D, 2D o 3D), gráficos, histogramas, etc. Después de un análisis completo de los resultados, saque conclusiones y anticipe más investigaciones basadas en esto.
Resultados
Se indujo y monitoreó un efecto fotoforético en un primer experimento en el ala de una mariposa Morpho menelaus 5. El efecto fue iniciado por la acción de láseres LED de diferentes longitudes de onda (450 nm, 532 nm, 660 nm y 980 nm). Aquí, se utilizaron las alas de una mariposa I. lathonia 14 . Después del procedimiento de grabación, la imagen del holograma fue reconstruida.
Discusión
En el estudio biofotónico presentado, se demuestra que se puede utilizar un nuevo método holográfico para detectar un desplazamiento morfológico mínimo o deformación causada por la radiación térmica de bajo nivel.
El paso más crítico en la medición holográfica con muestras biológicas es el paso de preparación. La preparación de la muestra (corte/ pegado para que coincida con el tamaño del soporte) depende de las propiedades mecánicas de la muestra, y no es posible tener un pro...
Divulgaciones
Los autores declaran no haber conflicto de intereses.
Agradecimientos
M. S. P., D. G., D. V. y B. K. reconocen el apoyo a las estructuras biológicas y bioinspiradas para la vigilancia multiespectral, financiadas por NATO SPS (NATO Science for Peace and Security) 2019-2022. B. K., D. V., B. B., D. G. y M. S. P. reconocen la financiación proporcionada por el Instituto de Física de Belgrado, a través de la financiación institucional del Ministerio de Educación, Ciencia y Desarrollo Tecnológico de la República de Serbia. Además, B. K. reconoce el apoyo de F R S - FNRS. M. P. agradece el apoyo del Ministerio de Educación, Ciencia y Desarrollo Tecnológico de la República de Serbia, número de contrato 451-03-9/2021-14/200026. S. R. M. fue apoyado por una beca BEWARE de la Región Valona (Convención n° 2110034), como investigador postdoctoral. T. V. reconoce el apoyo financiero de la Fundación Hércules. D.V., M.S.P., D.G., M.P., B.B. y B.K. reconocen el apoyo de la Oficina de Investigación Naval Global a través de la Beca de Investigación N62902-22-1-2024. Este estudio se llevó a cabo en cumplimiento parcial de los requisitos para el doctorado de Marina Simović Pavlović en la Universidad de Belgrado, Facultad de Ingeniería Mecánica.
Materiales
| Name | Company | Catalog Number | Comments |
| Active Vibration Isolation, Four Optical Table Supports | Thorlabs | PTR502 | High Load Capacity: 2,500 kg, Height 600 mm |
| Cuvette | Standard glass cuvette | ||
| Holographic camera (optical camera for holography) | Cannon | EOS 50D | Sensor Size 22.3 x 14.9 mm; Pixel pitch 4.69 µm; Max. resolution 4752 x 3168; JPEG file format |
| Hydrogen peroxide, H2O2 | Merck (Darmstadt, Germany) | ||
| Laser | Laser Quantum | Torus 532 laser | Wavelength 532 nm; Power 390 mW; Coherence length 10 m |
| LED lasers | |||
| Malonic acid, C3H4O4 | Acr s Organics (Geel, Belgium) s Organics (Geel, Belgium) | ||
| Manganese sulphate, MnSO4 | Fluka (Buchs, Switzerlend) | ||
| Nonlinear optical microscope | IPB | ||
| Optical accessories | Thorlab | ||
| Optical spectroscope | |||
| Optical table | Thorlabs | TOP450II PTR52509 | dimensions 2000*1250*310 mm |
| Perchloric acid, HClO4 | Merck (Darmstadt, Germany) | ||
| Potassium iodate, KIO3 | Merck (Darmstadt, Germany) | ||
| Software | Home-build software made by one of the authors: Dusan Grujic. This software was conducted in partial fulfillment of the requirements for the PhD deegree of D.G. | ||
| Thermal camera | Flir | A65 | 640x512 pixel; Thermal resolution 50 mK |
| Video camera | Nikon | 1v3 | 18.4 Mpixel; 60 fps |
Referencias
- Pietrzyk, D. J., Frank, C. W. Development of an analytical method. Analytical Chemistry. , 10-19 (1979).
- Ostrovsky, Y. I., Shchepinov, V. P., Yakovlev, V. V. . Holographic Interferometry in Experimental Mechanics. 60, (2013).
- Pedrini, G., Osten, W., Gusev, M. E. High-speed digital holographic interferometry for vibration measurement. Applied Optics. 45 (15), 3456-3462 (2006).
- Pantelić, D. V., Grujić, D. &. #. 3. 8. 1. ;., Vasiljević, D. M. S. i. n. g. l. e. -. b. e. a. m. dual-view digital holographic interferometry for biomechanical strain measurements of biological objects. Journal of Biomedical Optics. 19 (12), 127005 (2014).
- Grujić, D., et al. Infrared camera on butterfly's wing. Optics Express. 26 (11), 14143-14158 (2018).
- Mouchet, S. R., Deparis, O. . Natural Photonics and Bioinspiration. , (2021).
- Pagnacco, M. C., et al. Spontaneous symmetry breaking: the case of crazy clock and beyond. Symmetry. 14, 413 (2022).
- Pagnacco, M. C., Maksimovic, J. P., Potkonjak, N. I., Božić, B. &. #. 2. 7. 2. ;., Horvath, A. K. Transition from low to high iodide and iodine concentration states in the Briggs-Rauscher reaction: evidence on crazy clock behavior. The Journal of Physical Chemistry A. 122 (2), 482-491 (2018).
- Pagnacco, M. C., Maksimović, J. P., Janković, B. &. #. 3. 8. 1. ;. Analysis of transition from low to high iodide and iodine state in the Briggs-Rauscher oscillatory reaction containing malonic acid using Kolmogorov-Johnson-Mehl-Avrami (KJMA) theory. Reaction Kinetics, Mechanisms and Catalysts. 123 (1), 61-80 (2018).
- Mouchet, S. R., et al. Unveiling the non-linear optical response of Trichtenotoma childreni longhorn bestle. Journal of Biophotonics. 12 (9), 201800470 (2019).
- Shimobaba, T., et al. Computational wave optics library for C++: CWO++ library. Computer Physics Communications. 183 (5), 1124-1138 (2012).
- Grujic, D. . Application of digital holography for detection of infrared radiation on biophotonic structures. , (2022).
- Muffoletto, R. P., Tyler, J. M., Tohline, J. E. Shifted Fresnel diffraction for computational holography. Optical Express. 15 (9), 5631-5640 (2007).
- Pavlović, D., et al. Naturally safe: Cellular noise for document security. Journal of Biophotonics. 12 (12), 201900218 (2019).
- Bray, W. C. A periodic reaction inhomogeneous solution and its relation to catalysis. Journal of the American Chemical Society. 43 (6), 1262-1267 (1921).
- Nicolis, G. Self-organization in nonequilibrium systems. Dissipative Structures to Order through Fluctuations. , 339-426 (1977).
- Prigogine, I., Hiebert, E. N. From being to becoming: Time and complexity in the physical sciences. Physics Today. 35 (1), 69 (1982).
- Nikolova, L., Ramanujam, P. S. . Polarization Holography. , (2009).
- Haisch, C., Kykal, C., Niessner, R. Photophoretic velocimetry for the characterization of aerosols. Analytical Chemistry. 80 (5), 1546-1551 (2008).
- Kononenko, V. L., et al. Feasibility studies on photophoretic effects in field-flow fractionation of particles. Journal of Liquid Chromatography & Related Technologies. 20 (16-17), 2907-2929 (1997).
- Zhang, X., Bar-Ziv, E. A novel approach to determine thermal conductivity of micron-sized fuel particles. Combustion Science and Technology. 130 (1-6), 79-95 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados