Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Aufdecken verborgener Dynamiken natürlicher photonischer Strukturen mit holographischer Bildgebung
In diesem Artikel
Zusammenfassung
Das Papier konzentriert sich in erster Linie auf die kombinierte Kraft von optischen (linear und nichtlinear) und holographischen Methoden, die verwendet werden, um Phänomene auf der Nanoskala aufzudecken. Die Ergebnisse der biophotonischen und oszillatorischen chemischen Reaktionen werden als repräsentative Beispiele angeführt, die die Fähigkeit der Holographie unterstreichen, die Dynamik auf einer Nanoskala aufzudecken.
Zusammenfassung
Bei dieser Methode wird das Potenzial von Optik und Holographie ausgeschöpft, verborgene Details der dynamischen Reaktion eines natürlichen Systems auf der Nanoskala aufzudecken. Im ersten Teil werden die optischen und holographischen Untersuchungen natürlicher photonischer Strukturen sowie die Bedingungen für das Auftreten des photophoretischen Effekts, nämlich der Verschiebung oder Verformung einer Nanostruktur aufgrund eines lichtinduzierten thermischen Gradienten, auf der Nanoskala vorgestellt. Dieser Effekt wird durch die digitale holographische Echtzeit-Interferometrie aufgedeckt, die die Verformung von Schuppen überwacht, die die Flügel von Insekten bedecken, die durch die Temperatur induziert werden. Der Zusammenhang zwischen Geometrie und Nanokorrugation, der zur Entstehung des photophoretischen Effekts führt, ist experimentell nachgewiesen und bestätigt. Im zweiten Teil wird gezeigt, wie die Holographie möglicherweise verwendet werden kann, um verborgene Details im chemischen System mit nichtlinearer Dynamik aufzudecken, wie z.B. das Phasenübergangsphänomen, das in einer komplexen oszillierenden Briggs-Rauscher-Reaktion (BR) auftritt. Das vorgestellte Potenzial der Holographie auf der Nanoskala könnte enorme Möglichkeiten zur Kontrolle und Formung des photophoretischen Effekts und der Musterbildung für verschiedene Anwendungen wie Partikeleinfang und Levitation eröffnen, einschließlich der Bewegung unverbrannter Kohlenwasserstoffe in der Atmosphäre und der Trennung verschiedener Aerosole, Zersetzung von Mikroplastik und Fraktionierung von Partikeln im Allgemeinen sowie Bewertung der Temperatur und Wärmeleitfähigkeit von Brennstoffpartikeln in Mikrometergröße.
Einleitung
Um alle einzigartigen Phänomene in der Nanowelt vollständig zu verstehen und zu bemerken, ist es wichtig, Techniken anzuwenden, die in der Lage sind, alle Details in Bezug auf Strukturen und Dynamik auf der Nanoskala aufzudecken. Aus diesem Grund wird die einzigartige Kombination von linearen und nichtlinearen Methoden in Kombination mit der Kraft der Holographie vorgestellt, um die Dynamik des Systems auf der Nanoskala aufzudecken.
Die beschriebene holographische Technik kann als Triple-Rec-Verfahren (rec ist die Abkürzung für Aufzeichnung) angesehen werden, da das Signal zu einem bestimmten Zeitpunkt gleichzeitig von einer Fotokamera, einer Wärmebildkamera und einem Interferometer aufgezeichnet wird. Lineare und nichtlineare optische Spektroskopie und Holographie sind bekannte Techniken, deren Grundprinzipien in der Literatur ausführlich beschrieben werden 1,2.
Um es kurz zu machen, die holographische Interferometrie ermöglicht den Vergleich von Wellenfronten, die zu verschiedenen Zeitpunkten aufgezeichnet wurden, um die Dynamik des Systems zu charakterisieren. Es wurde zuvor verwendet, um die Schwingungsdynamik 3,4 zu messen. Die Leistungsfähigkeit der Holographie als einfachste Interferometrie-Methode beruht auf ihrer Fähigkeit, die kleinste Verschiebung innerhalb des Systems zu erkennen. Zuerst nutzten wir die Holographie, um den photophoretischen Effekt5 (d.h. die Verschiebung der Verformung einer Nanostruktur aufgrund eines lichtinduzierten thermischen Gradienten) in verschiedenen biologischen Strukturen zu beobachten und aufzudecken. Für eine wahrheitsgetreue Darstellung der Methode wurden repräsentative Proben aus einer Reihe von getesteten biologischen Probenausgewählt 6. Flügel der Königin von Spanien Fritillärschmetterling, Issoria lathonia (Linnaeus, 1758; I. lathonia) wurden im Rahmen dieser Studie verwendet.
Nachdem das Auftreten von Photophorese auf der Nanoskala in biologischen Geweben erfolgreich nachgewiesen wurde, wurde ein ähnliches Protokoll angewendet, um den spontanen Symmetriebruchprozess7 zu überwachen, der durch einen Phasenübergang in einer oszillierenden chemischen Reaktion verursacht wurde. In diesem Teil wurde der Phasenübergang von einer niedrigen Konzentration von Jodid und Jod (genannt Zustand I) zu einer hohen Konzentration von Jodid und Jod mit fester Jodbildung (definiert als Zustand II), die in einer chemisch nichtlinearen BR-Reaktion auftritt, untersucht 8,9. Hier berichteten wir zum ersten Mal über einen holographischen Ansatz, der es ermöglicht, einen solchen Phasenübergang und eine spontane symmetriebrechende Dynamik auf der Nanoskala zu untersuchen, die in kondensierten Systemen auftritt.
Protokoll
1. Prächarakterisierung
- Führen Sie eine vollständige Vorcharakterisierung der Probe durch.
- Führen Sie alle Experimente an trockenen Proben durch, die von einer kommerziellen Quelle gekauft wurden. Lagern Sie die Proben im Labor, an einem trockenen und dunklen Ort, bei Raumtemperatur.
- Führen Sie vor holographischen Messungen eine vollständige Probencharakterisierung durch scannendes elektronisches Mikroskop (REM), lineare optische Spektroskopie und nichtlineare optische Mikroskopie (NOM)10 durch (Abbildung 1).
- Zusätzlich zu den optischen Eigenschaften von Proben, die mit linearen Techniken gemessen wurden, sammeln Sie zusätzliche Informationen mit Laserstrahlen höherer Intensität, die eine Charakterisierung ihrer nichtlinearen optischen Eigenschaften ermöglichen.
- Verwenden Sie die entsprechenden nichtlinearen optischen Suszeptibilitäten, um die nichtlineare optische Reaktion zu quantifizieren und bilden Sie die Grundlage für nichtlineare optische Techniken wie zerstörungsfreie Multiphotonenanregungsfluoreszenz und Second Harmonic Generation (SHG), die zur Charakterisierung verschiedener biologischer Proben verwendet werden.
- Für die nichtlinearen chemischen Phänomene, die in der oszillierenden BR-Reaktion auftreten, führen Sie die Untersuchung der interferometrischen Überwachung des in situ Phasenübergangs vom Zustand I zum Zustand II mit den folgenden Konzentrationen von Reaktanden durch: [CH2(COOH)2]0 = 0,0789 mol dm-3, [MnSO 4]0 = 0,0075 mol dm-3, [HClO4]0 = 0,03 mol dm-3, [KIO3] 0 = 0,0752 mol dm-3 und [H2O2]0 = 1,269 mol dm-3 (0 nach der Klammer steht für die Anfangskonzentration zu Beginn des Prozesses). Das für die BR-Reaktion verwendete Gesamtvolumen beträgt 2,5 ml.
HINWEIS: Die hier verwendeten Konzentrationswerte entsprechen denen in der Studie von Pagnacco et al.8, jedoch mit einem Reaktionsvolumen geteilt durch 10.
- Bereiten Sie die Probe für das Experiment vor.
- Verwenden Sie Flügel der Königin von Spanien Fritillärschmetterling, I. lathonia, für dieses Experiment. Legen Sie den Flügel auf eine harte Oberfläche und machen Sie einen Abschnitt mit einem Fräser von 10 mm Durchmesser. Legen Sie die Probe in die Probenbox, bei der es sich um einen beliebigen Behälter mit Deckel handeln kann.

Abbildung 1: Wellenquerschnitt der Schmetterlingsflügelschuppe. Der Querschnitt wurde mit einem nichtlinearen optischen Rastermikroskop (A,B) erfasst. Eine REM-Beobachtung (C) eines Flügels des Königin-von-Spanien-Schmetterlings I. lathonia wurde ebenfalls durchgeführt. Diese Zahl wurde von14 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Versuchsaufbau
- Holografischer Aufbau
HINWEIS: Die holographischen Interferometriemessungen wurden mit einem maßgeschneiderten optischen Aufbau durchgeführt (Abbildung 2).- Stellen Sie die Labortemperatur auf 23 °C ± 0,2 °C ein. Schalten Sie den Laser ein. Verwenden Sie für diese holographischen Beobachtungen einen Laser (Details in der Tabelle der Materialien) mit einer Anregungswellenlänge von 532 nm.
- Überprüfen Sie die Ausrichtung der optischen Elemente (Abbildung 2). Überprüfen Sie zunächst, ob die Einrichtung gemäß dem Schema in Abbildung 2 erfolgt.
- Richten Sie den Laserstrahl perfekt auf den konkaven Spiegel M aus. Überprüfen und justieren Sie die Position des optischen Strahlexpanders (L).
- Bestimmen Sie den Strahlteil, der auf Probe S trifft, und stellen Sie sicher, dass er einen Reflexstrahl O bildet. Überprüfen Sie, ob der Rest des Strahls auf einem sphärischen Spiegel CM gesammelt wird, der zur Erzeugung des Referenzstrahls R verwendet werden soll. Überprüfen Sie, ob der Detektor C innerhalb der Interferenzzone der beiden spezifizierten Strahlen platziert ist.
HINWEIS: Als Detektor wird ein CMOS-Sensor (Complementary Metal Oxide Semiconductor) verwendet. - Richten Sie die Kameras gemäß den Anweisungen für die verwendete Kamera ein. Richten Sie eine optische/fotografische Kamera für das holographische Experiment ein, wie in Abbildung 2 dargestellt (C ist die Kamera; Einzelheiten sind in der Materialtabelle angegeben). Richten Sie eine zweite optische/fotografische Kamera ein, um sichtbare Veränderungen der BR-Reaktion zu sehen, und eine Wärmebildkamera mit einer thermischen Auflösung von 50 mK und einer Brennweite von 13 mm über dem optischen Tisch.
HINWEIS: Die Kamera, die im holographischen Experiment verwendet wird, verwendet kein Objektiv. Das Licht trifft direkt auf den Chip.
- Bereiten Sie das Beispiel in holografisches Setup vor.
- Bereiten Sie die Flügelprobe wie in Schritt 1.2.1 beschrieben vor. Legen Sie die vorbereitete Probe auf einen runden Metallträger mit einem Durchmesser von 15 mm. Die Stütze hat drei vorhandene Löcher für die Schrauben, an denen der Metallring, der die Probe hält, befestigt ist.
- Befestigen Sie den Ring an der Stütze. Legen Sie die beigefügte Probe in den Teil der Probenhalterung, der sich auf dem optischen Tisch befindet.
- Bereiten Sie die Probe für die Überwachung chemischer Reaktionen vor. Auf dem optischen Tisch an der vorgesehenen Stelle eine Stütze mit einer ebenen Klebefläche platzieren, auf der die Küvette / das Gefäß platziert wird.
- Bereiten Sie das Reagenz vor, das zum Initialisieren der Reaktion verwendet wird, wie in Schritt 1.1.5 beschrieben. Füllen Sie die Reaktanden in die Küvette und mischen Sie die Küvette in der folgenden Reihenfolge von Volumina und Konzentrationen ein: 0,7 ml 0,2817 mol dm-3 CH2(COOH)2; 0,5 ml 0,0375 mol dm-3 MnSO4; 0,5 ml 0,15 mol dm-3 HClO4; 0,5 ml 0,376 mol dm-3 KIO3 ; und 0,3 ml von 10,575 mol dm-3 H 2O2.
- Stellen Sie sicher, dass das Gesamtvolumen in der Küvette 2,5 ml beträgt, und legen Sie es auf die Halterung im Setup.
- Richten Sie bei Bedarf zusätzliche Instrumente ein. Zur Überwachung des photophoretischen Effekts verwenden Sie einen zusätzlichen Laser (Details in der Materialtabelle) für die lokale Beheizung.
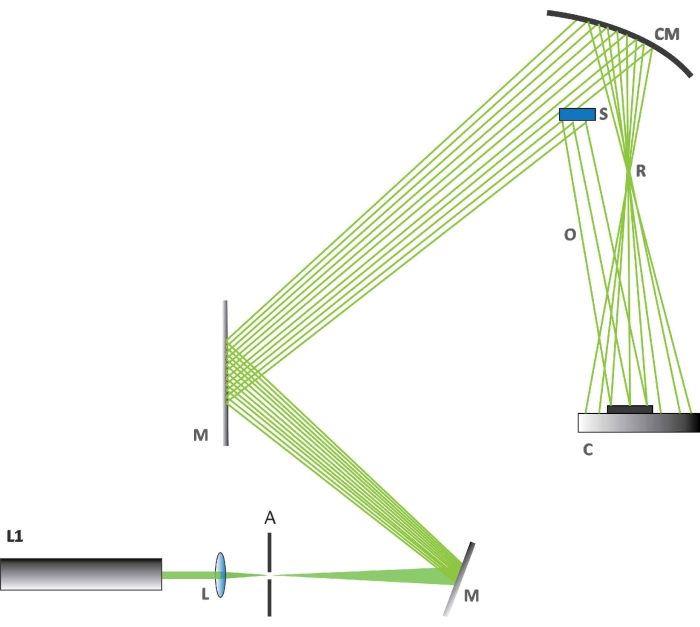
Abbildung 2: Der holografische Aufbau. Die Abbildung zeigt, wie die verschiedenen Komponenten für das holographische Experiment angeordnet sind. Abkürzungen: L1 = Laser bei 532 nm, L = bikonvexe Linse, A = Blende, M = ein flacher Spiegel zur Ablenkung des Laserstrahls, CM = konkaver Spiegel, C = CMOS-Kamera, S = Schmetterlingsflügelabschnitt, R = Referenzstrahl, O = Objektstrahl. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Einrichtung der verwendeten Software
HINWEIS: Die selbst entwickelte C ++ - Software, die auf der Fresnel-Näherung11 basiert, wird verwendet, um Daten aus holographischen Experimenten zu analysieren. Die für die vorgestellte Studie entwickelte Software finden Sie unter . 12 Die Einzelheiten der Software können derzeit nicht veröffentlicht werden; Zusätzliche Informationen werden jedoch auf Anfrage zur Verfügung gestellt. Die Fresnel-Approximation ist in der digitalen Holographie äußerst nützlich, da sie sich auf verschiedene Oberflächen konzentriert und auf den Bereich der ersten Beugungsordnung zoomt, der vollständige Informationen über die aufgenommene Szene enthält.
- Schalten Sie den Computer ein und führen Sie die Software aus.
HINWEIS: Der Schritt zum Ausführen der Software hängt von der Software selbst ab. Es gibt keine kommerzielle Software für diesen Zweck.
4. Führen Sie das Experiment durch
- Schalten Sie die Außenleuchten aus. Führen Sie das ganze Experiment in einem dunklen Raum durch.
- Synchronisieren Sie die Kameras mithilfe eines ausgewählten Intervalls. Starten Sie für dieses Experiment die holographische Kamera nach 60 s und die beiden anderen Kameras unmittelbar danach, entweder mit einer Software oder manuell.
- Drücken Sie die Aufnahmetasten und legen Sie in der Software fest, wann die Aufnahme beginnt.
- Bewirken Sie dynamische Veränderungen im interessierenden System. Die Methode der Initiierung hängt von der Art der Probe ab; Im Falle eines photophoretischen Effekts erwärmen Sie die Probe extern mit den verfügbaren Lasern: 450 nm, 532 nm, 660 nm, 980 nm. Im Falle der BR-Reaktion starten Sie die Reaktion, indem Sie die chemischen Reaktanden mischen. Beobachten Sie das holographische Experiment.
- Stellen Sie die Foto- und Wärmebildkamera so ein, dass sie das gesamte Experiment verfolgt, und bestimmen Sie den Moment des Endes der holographischen Aufnahme aus den optischen und thermischen Messungen.
- Sprechen Sie das Ende des Prozesses aus. Das Ende der Aufzeichnung ist entsprechend der geschätzten Dauer des Prozesses vorprogrammiert. Verwenden Sie für die BR-Reaktion die Erstarrung als Ende der Reaktion. Im Falle des photophärischen Effekts gibt es keinen solchen spezifischen Moment. In jedem Fall unterstreicht dieser Schritt die Wichtigkeit der dreifachen Aufnahme.
5. Erwerb der Ergebnisse12
- Speichern Sie die Ergebnisse. Sortieren Sie die Dateien präzise in Abhängigkeit von der Zeit für die Rekonstruktion von Hologrammen und tiefere Datenanalysen.
HINWEIS: In diesem Schritt werden die Daten von der für die Holografie verwendeten Kamera auf den Computer (Festplatte) in Ordnern übertragen, die nach den Aufnahmedaten benannt sind. Verwenden Sie die Schaltflächen Kopieren/Einfügen und Umbenennen. - Überprüfen Sie das Sondenhologramm auf entsprechende Einstellungen. Auf diese Weise werden die besten Einstellungen auf dem ersten Hologramm durch Betrachten ausgewählt und dann für die Rekonstruktion aller Hologramme verwendet.
- Wählen Sie ein Hologramm aus, indem Sie auf eines davon aus dem Ordner klicken, den Sie zuvor erstellt haben (Schritt 5.1), und erstellen Sie eine Rekonstruktion, indem Sie auf die Schaltfläche Rekonstruieren klicken.
- Ändern Sie die Einstellungen, um das beste Bild zu erzielen und die Rekonstruktion erneut durchzuführen. Optionen zum Anpassen von Parametern wie Probenahme, Offset und Fresnel-Abstand werden auf dem Bildschirm angezeigt (Softwaremenü). Wiederholen Sie diese Schritte, bis die besten Einstellungen definiert sind.
- Führen Sie die Rekonstruktionen durch. Wählen Sie alle Hologramme aus, indem Sie auf die Schaltfläche Datei öffnen klicken und alle Dateien auswählen. Wenden Sie die gewünschten Parameter für die numerische Rekonstruktion von Hologrammen an; Sie bleiben nach Schritt 5.2.1 unverändert, daher führen Sie diesmal keine Aktion aus.
- Führen Sie die Rekonstruktionen mit der Schaltfläche Rekonstruieren und die Interferogramme durch, indem Sie die Dateinamen in das Feld Start mit/Ende mit einfügen und dann auf die Schaltfläche Batch klicken. Die Interferogramme werden im zuvor erstellten Ordner angezeigt (in Schritt 5.1).
HINWEIS: Nach der Aufzeichnung einer Reihe von Hologrammen in der Zeit stellt das erste Hologramm einen ungestörten Zustand dar, während die Wirkung einer äußeren Kraft nachfolgende Hologramme verursacht. Es ist notwendig, die Hologramme mit der verschobenen Fresnel-Transformation13 zu rekonstruieren. - Erhalten Sie die Interferogramme durch Subtraktion (in Form komplexer Zahlen) eines bestimmten Hologramms in der Zeit mit dem ersten erhaltenen Hologramm.
HINWEIS: Dieses Protokoll ermöglicht die Beobachtung der Wirkung der Kraft auf das Objekt. Die Änderung des Interferenzmusters als Funktion der Zeit ist eine Folge von Verformungen oder Verschiebungen, die innerhalb des Systems während der Messung auftreten. Diese Änderungen werden verwendet, um die Dynamik des Systems auf der Nanoskala zu überwachen.
6. Analyse der Ergebnisse
- Führen Sie eine visuelle Analyse als ersten Qualitätskontrollschritt des Prozesses durch. Suchen Sie in diesem Schritt nach sichtbaren Änderungen des Interferenzmusters und versuchen Sie, die Änderungen des Interferenzmusters mit den Ergebnissen optischer und thermischer Messungen abzugleichen.
- Führen Sie ein Kreuzverhör aller Aufnahmen durch. In dieser zweiten Phase der Analyse analysieren Sie die Bilder sowohl der optischen als auch der thermischen Kamera mit den holographischen Rekonstruktionen gründlich, um die Dynamik auf der Nanoskala aufzudecken. Auf diese Weise wird das Reaktionsmoment gleichzeitig in holografischen, thermischen und fotografischen Bildern gesehen.
- Erstellen Sie eine grafische Darstellung der Ergebnisse basierend auf numerischen / Softwareanalysen und präsentieren Sie sie in Form von Diagrammen (1D, 2D oder 3D), Diagrammen, Histogrammen usw. Ziehen Sie nach einer vollständigen Analyse der Ergebnisse Schlussfolgerungen und antizipieren Sie weitere Forschungen auf dieser Grundlage.
Ergebnisse
Ein photophoretischer Effekt wurde in einem ersten Experiment am Flügel eines Morpho-Menelas-Schmetterlings induziert und überwacht5. Der Effekt wurde durch die Wirkung von LED-Lasern unterschiedlicher Wellenlängen (450 nm, 532 nm, 660 nm und 980 nm) ausgelöst. Hier wurden die Flügel eines I. lathonia Schmetterlings14 verwendet. Nach dem Aufnahmevorgang wurde das Hologrammbild rekonstruiert.
Diskussion
In der vorgestellten biophotonischen Studie wird gezeigt, dass eine neuartige holographische Methode verwendet werden kann, um minimale morphologische Verschiebung oder Verformung durch schwache Wärmestrahlung nachzuweisen.
Der kritischste Schritt bei der holographischen Messung mit biologischen Proben ist der Vorbereitungsschritt. Die Vorbereitung der Probe (Schneiden/Kleben entsprechend der Größe des Halters) hängt von den mechanischen Eigenschaften der Probe ab, und es ist nicht möglic...
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
M. S. P., D. G., D. V. und B. K. würdigen die Unterstützung der biologischen und bioinspirierten Strukturen für die multispektrale Überwachung, die von NATO SPS (NATO Science for Peace and Security) 2019-2022 finanziert werden. B. K., D. V., B. B., D. G. und M. S. P. erkennen die Finanzierung durch das Institut für Physik Belgrad durch die institutionelle Finanzierung durch das Ministerium für Bildung, Wissenschaft und technologische Entwicklung der Republik Serbien an. Darüber hinaus dankt B. K. der Unterstützung durch F R S - FNRS. M. P. dankt der Unterstützung des Ministeriums für Bildung, Wissenschaft und technologische Entwicklung der Republik Serbien, Vertragsnummer 451-03-9/2021-14/200026. S. R. M. wurde durch ein BEWARE Fellowship der Wallonischen Region (Convention n°2110034) als Postdoktorand unterstützt. T. V. würdigt die finanzielle Unterstützung durch die Hercules Foundation. D.V., M.S.P., D.G., M.P., B.B. und B.K. bestätigen die Unterstützung des Office of Naval Research Global durch den Forschungszuschuss N62902-22-1-2024. Diese Studie wurde in teilweiser Erfüllung der Anforderungen für den Doktortitel von Marina Simović Pavlović an der Universität Belgrad, Fakultät für Maschinenbau, durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Active Vibration Isolation, Four Optical Table Supports | Thorlabs | PTR502 | High Load Capacity: 2,500 kg, Height 600 mm |
| Cuvette | Standard glass cuvette | ||
| Holographic camera (optical camera for holography) | Cannon | EOS 50D | Sensor Size 22.3 x 14.9 mm; Pixel pitch 4.69 µm; Max. resolution 4752 x 3168; JPEG file format |
| Hydrogen peroxide, H2O2 | Merck (Darmstadt, Germany) | ||
| Laser | Laser Quantum | Torus 532 laser | Wavelength 532 nm; Power 390 mW; Coherence length 10 m |
| LED lasers | |||
| Malonic acid, C3H4O4 | Acr s Organics (Geel, Belgium) s Organics (Geel, Belgium) | ||
| Manganese sulphate, MnSO4 | Fluka (Buchs, Switzerlend) | ||
| Nonlinear optical microscope | IPB | ||
| Optical accessories | Thorlab | ||
| Optical spectroscope | |||
| Optical table | Thorlabs | TOP450II PTR52509 | dimensions 2000*1250*310 mm |
| Perchloric acid, HClO4 | Merck (Darmstadt, Germany) | ||
| Potassium iodate, KIO3 | Merck (Darmstadt, Germany) | ||
| Software | Home-build software made by one of the authors: Dusan Grujic. This software was conducted in partial fulfillment of the requirements for the PhD deegree of D.G. | ||
| Thermal camera | Flir | A65 | 640x512 pixel; Thermal resolution 50 mK |
| Video camera | Nikon | 1v3 | 18.4 Mpixel; 60 fps |
Referenzen
- Pietrzyk, D. J., Frank, C. W. Development of an analytical method. Analytical Chemistry. , 10-19 (1979).
- Ostrovsky, Y. I., Shchepinov, V. P., Yakovlev, V. V. . Holographic Interferometry in Experimental Mechanics. 60, (2013).
- Pedrini, G., Osten, W., Gusev, M. E. High-speed digital holographic interferometry for vibration measurement. Applied Optics. 45 (15), 3456-3462 (2006).
- Pantelić, D. V., Grujić, D. &. #. 3. 8. 1. ;., Vasiljević, D. M. S. i. n. g. l. e. -. b. e. a. m. dual-view digital holographic interferometry for biomechanical strain measurements of biological objects. Journal of Biomedical Optics. 19 (12), 127005 (2014).
- Grujić, D., et al. Infrared camera on butterfly's wing. Optics Express. 26 (11), 14143-14158 (2018).
- Mouchet, S. R., Deparis, O. . Natural Photonics and Bioinspiration. , (2021).
- Pagnacco, M. C., et al. Spontaneous symmetry breaking: the case of crazy clock and beyond. Symmetry. 14, 413 (2022).
- Pagnacco, M. C., Maksimovic, J. P., Potkonjak, N. I., Božić, B. &. #. 2. 7. 2. ;., Horvath, A. K. Transition from low to high iodide and iodine concentration states in the Briggs-Rauscher reaction: evidence on crazy clock behavior. The Journal of Physical Chemistry A. 122 (2), 482-491 (2018).
- Pagnacco, M. C., Maksimović, J. P., Janković, B. &. #. 3. 8. 1. ;. Analysis of transition from low to high iodide and iodine state in the Briggs-Rauscher oscillatory reaction containing malonic acid using Kolmogorov-Johnson-Mehl-Avrami (KJMA) theory. Reaction Kinetics, Mechanisms and Catalysts. 123 (1), 61-80 (2018).
- Mouchet, S. R., et al. Unveiling the non-linear optical response of Trichtenotoma childreni longhorn bestle. Journal of Biophotonics. 12 (9), 201800470 (2019).
- Shimobaba, T., et al. Computational wave optics library for C++: CWO++ library. Computer Physics Communications. 183 (5), 1124-1138 (2012).
- Grujic, D. . Application of digital holography for detection of infrared radiation on biophotonic structures. , (2022).
- Muffoletto, R. P., Tyler, J. M., Tohline, J. E. Shifted Fresnel diffraction for computational holography. Optical Express. 15 (9), 5631-5640 (2007).
- Pavlović, D., et al. Naturally safe: Cellular noise for document security. Journal of Biophotonics. 12 (12), 201900218 (2019).
- Bray, W. C. A periodic reaction inhomogeneous solution and its relation to catalysis. Journal of the American Chemical Society. 43 (6), 1262-1267 (1921).
- Nicolis, G. Self-organization in nonequilibrium systems. Dissipative Structures to Order through Fluctuations. , 339-426 (1977).
- Prigogine, I., Hiebert, E. N. From being to becoming: Time and complexity in the physical sciences. Physics Today. 35 (1), 69 (1982).
- Nikolova, L., Ramanujam, P. S. . Polarization Holography. , (2009).
- Haisch, C., Kykal, C., Niessner, R. Photophoretic velocimetry for the characterization of aerosols. Analytical Chemistry. 80 (5), 1546-1551 (2008).
- Kononenko, V. L., et al. Feasibility studies on photophoretic effects in field-flow fractionation of particles. Journal of Liquid Chromatography & Related Technologies. 20 (16-17), 2907-2929 (1997).
- Zhang, X., Bar-Ziv, E. A novel approach to determine thermal conductivity of micron-sized fuel particles. Combustion Science and Technology. 130 (1-6), 79-95 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten