Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Découvrir la dynamique cachée des structures photoniques naturelles à l’aide de l’imagerie holographique
Dans cet article
Résumé
L’article se concentre principalement sur la puissance combinée des méthodes optiques (linéaires et non linéaires) et holographiques utilisées pour révéler des phénomènes à l’échelle nanométrique. Les résultats obtenus à partir des études sur les réactions chimiques biophotoniques et oscillatoires sont donnés à titre d’exemples représentatifs, soulignant la capacité de l’holographie à révéler la dynamique à l’échelle nanométrique.
Résumé
Dans cette méthode, le potentiel de l’optique et de l’holographie pour découvrir les détails cachés de la réponse dynamique d’un système naturel à l’échelle nanométrique est exploité. Dans la première partie, les études optiques et holographiques des structures photoniques naturelles sont présentées ainsi que les conditions d’apparition de l’effet photophorétique, à savoir le déplacement ou la déformation d’une nanostructure due à un gradient thermique induit par la lumière, à l’échelle nanométrique. Cet effet est révélé par l’interférométrie holographique numérique en temps réel surveillant la déformation des écailles recouvrant les ailes des insectes induite par la température. Le lien entre la géométrie et la nanocordation qui conduit à l’émergence de l’effet photophorétique est démontré expérimentalement et confirmé. Dans la deuxième partie, il est montré comment l’holographie peut être potentiellement utilisée pour découvrir des détails cachés dans le système chimique avec une dynamique non linéaire, comme le phénomène de transition de phase qui se produit dans la réaction oscillatoire complexe de Briggs-Rauscher (BR). Le potentiel présenté de l’holographie à l’échelle nanométrique pourrait ouvrir d’énormes possibilités pour contrôler et mouler l’effet photophorétique et la formation de motifs pour diverses applications telles que le piégeage et la lévitation des particules, y compris le mouvement des hydrocarbures imbrûlés dans l’atmosphère et la séparation de différents aérosols, la décomposition des microplastiques et le fractionnement des particules en général, et l’évaluation de la température et de la conductivité thermique des particules de combustible de la taille d’un micron.
Introduction
Pour bien comprendre et remarquer tous les phénomènes uniques dans le nanomonde, il est crucial d’utiliser des techniques capables de révéler tous les détails concernant les structures et la dynamique à l’échelle nanométrique. Sur ce compte, la combinaison unique de méthodes linéaires et non linéaires, combinée à la puissance de l’holographie pour révéler la dynamique du système à l’échelle nanométrique sont présentées.
La technique holographique décrite peut être considérée comme la méthode triple rec (rec est l’abréviation de l’enregistrement), car à un moment donné, le signal est simultanément enregistré par une caméra photographique, une caméra thermique et un interféromètre. La spectroscopie optique linéaire et non linéaire et l’holographie sont des techniques bien connues, dont les principes fondamentaux sont largement décrits dans la littérature 1,2.
Pour faire court, l’interférométrie holographique permet de comparer les fronts d’onde enregistrés à différents moments dans le temps pour caractériser la dynamique du système. Il était auparavant utilisé pour mesurer la dynamique vibratoire 3,4. La puissance de l’holographie en tant que méthode d’interférométrie la plus simple est basée sur sa capacité à détecter le plus petit déplacement dans le système. Tout d’abord, nous avons exploité l’holographie pour observer et révéler l’effet photophorétique5 (c’est-à-dire le déplacement de la déformation d’une nanostructure due à un gradient thermique induit par la lumière), dans différentes structures biologiques. Pour une présentation fidèle de la méthode, des échantillons représentatifs ont été sélectionnés parmi un certain nombre d’échantillons biologiques testés6. Ailes du papillon fritillaire de la reine d’Espagne, Issoria lathonia (Linnaeus, 1758; I. lathonia), ont été utilisés dans le cadre de cette étude.
Après avoir démontré avec succès l’apparition de la photophorèse à l’échelle nanométrique dans les tissus biologiques, un protocole similaire a été appliqué pour surveiller le processus spontané de rupture de symétrie7 causé par une transition de phase dans une réaction chimique oscillatoire. Dans cette partie, la transition de phase d’une faible concentration d’iodure et d’iode (appelée état I) à une concentration élevée d’iodure et d’iode avec formation d’iode solide (définie comme l’état II) qui se produit dans une réaction BR chimiquement non linéaire a été étudiée 8,9. Ici, nous avons rapporté pour la première fois une approche holographique qui permet d’étudier une telle transition de phase et une dynamique spontanée de rupture de symétrie à l’échelle nanométrique se produisant dans des systèmes condensés.
Protocole
1. Précaractérisation
- Effectuer une précaractérisation complète de l’échantillon.
- Effectuer toutes les expériences sur des spécimens secs achetés auprès d’une source commerciale. Conservez les échantillons en laboratoire, dans un endroit sec et sombre, à température ambiante.
- Avant les mesures holographiques, effectuez une caractérisation complète de l’échantillon au microscope électronique à balayage (MEB), à la spectroscopie optique linéaire et à la microscopie optique non linéaire (NOM)10 (Figure 1).
- En plus des propriétés optiques des échantillons mesurés par des techniques linéaires, recueillez des informations supplémentaires avec des faisceaux laser de plus haute intensité qui permettent de caractériser leurs propriétés optiques non linéaires.
- Utilisez les susceptibilités optiques non linéaires correspondantes pour quantifier la réponse optique non linéaire et constituer la base de techniques optiques non linéaires telles que la fluorescence d’excitation multiphotonique non destructive et la deuxième génération harmonique (SHG), qui sont utilisées pour caractériser divers échantillons biologiques.
- Pour les phénomènes chimiques non linéaires se produisant dans la réaction BR oscillante, effectuer l’étude de la surveillance interférométrique de la transition de phase in situ de l’état I à l’état II avec les concentrations suivantes de réactifs: [CH2(COOH)2]0 = 0,0789 mol dm-3, [MnSO4]0 = 0,0075 mol dm-3, [HClO4]0 = 0,03 mol dm-3, [KIO3] 0 = 0,0752 mol dm-3 et [H2O2]0 = 1,269 mol dm-3 (0 après le support représente la concentration initiale au début du processus). Rendre le volume total utilisé pour la réaction BR égal à 2,5 mL.
NOTE: Les valeurs de concentration utilisées ici sont égales à celles de l’étude de Pagnacco et al.8, mais avec un volume de réaction divisé par 10.
- Préparez l’échantillon pour l’expérience.
- Utilisez les ailes du papillon fritillaire de la reine d’Espagne, I. lathonia, pour cette expérience. Placez l’aile sur une surface dure et faites une section avec une fraise de 10 mm de diamètre. Placez l’échantillon dans la boîte d’échantillon, qui peut être n’importe quel récipient avec un couvercle.

Figure 1 : Section ondulée de l’échelle des ailes de papillon. La coupe transversale a été enregistrée sur un microscope optique à balayage non linéaire (A, B). Une observation SEM (C) d’une aile du papillon fritillaire de la reine d’Espagne, I. lathonia, a également été effectuée. Ce chiffre a été modifié par rapport à14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Configuration expérimentale
- Configuration holographique
REMARQUE: Les mesures d’interférométrie holographique ont été effectuées avec une configuration optique sur mesure (Figure 2).- Réglez la température du laboratoire à 23 °C ± 0,2 °C. Allumez le laser. Utilisez un laser (détails donnés dans le tableau des matériaux) avec une longueur d’onde d’excitation de 532 nm pour ces observations holographiques.
- Vérifiez l’alignement des éléments optiques (Figure 2). Tout d’abord, vérifiez que la configuration est effectuée conformément au schéma de la figure 2.
- Alignez parfaitement le faisceau laser avec le miroir concave M. Vérifiez et ajustez la position de l’expanseur de faisceau optique (L).
- Déterminer la partie du faisceau qui empiète sur l’échantillon S et s’assurer qu’elle forme un faisceau réflexe O. Vérifiez si le reste du faisceau est collecté sur un miroir sphérique CM, à utiliser pour générer le faisceau de référence R. Vérifiez si le détecteur C est placé dans la zone d’interférence des deux faisceaux spécifiés.
REMARQUE: Un capteur semi-conducteur d’oxyde métallique complémentaire (CMOS) est utilisé comme détecteur. - Configurez les caméras conformément aux instructions de la caméra utilisée. Installez un appareil photo optique/photographique pour l’expérience holographique comme le montre la figure 2 (C est l’appareil photo; détails donnés dans la table des matériaux). Installez une deuxième caméra optique/photographique pour visualiser les changements visibles dans la réaction BR et une caméra thermique avec une résolution thermique de 50 mK et une distance focale de 13 mm au-dessus de la table optique.
REMARQUE: La caméra utilisée dans l’expérience holographique n’utilise pas d’objectif; la lumière empiète directement sur la puce.
- Préparez l’échantillon dans une configuration holographique.
- Préparer l’échantillon d’aile comme à l’étape 1.2.1. Placer l’échantillon préparé sur un support métallique rond d’un diamètre de 15 mm. Le support a trois trous existants pour les vis auxquelles est fixé l’anneau métallique contenant l’échantillon.
- Fixez l’anneau au support. Placez l’échantillon attaché dans la partie du support d’échantillon située sur la table optique.
- Préparer l’échantillon pour la surveillance des réactions chimiques. Sur la table optique, à l’endroit prévu, placez un support avec une surface adhésive plane sur laquelle la cuvette / récipient sera placé.
- Préparez le réactif utilisé pour initialiser la réaction comme à l’étape 1.1.5. Remplir les réactifs dans la cuvette et mélanger la cuvette dans l’ordre suivant des volumes et des concentrations : 0,7 mL de 0,2817 mol dm-3 CH2(COOH)2 ; 0,5 mL de 0,0375 mol dm-3 MnSO4; 0,5 mL de 0,15 mol dm-3 HClO4; 0,5 mL de 0,376 mol dm-3 KIO3 ; et 0,3 mL de 10,575 mol dm-3 H2O2.
- Assurez-vous que le volume total de la cuvette est de 2,5 mL et placez-le sur le support dans la configuration.
- Mettez en place des instruments supplémentaires si nécessaire. Pour surveiller l’effet photophorétique, utilisez un laser supplémentaire (détails donnés dans le tableau des matériaux) pour le chauffage local.
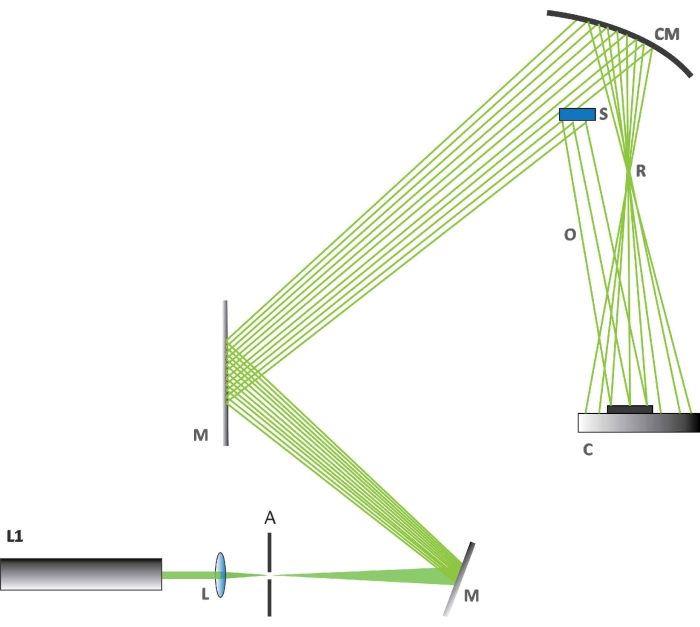
Figure 2 : Configuration holographique. La figure montre comment les différents composants sont disposés pour l’expérience holographique. Abréviations : L1 = laser à 532 nm, L = lentille biconvexe, A = ouverture, M = miroir plat utilisé pour dévier le faisceau laser, CM = miroir concave, C = caméra CMOS, S = section d’aile papillon, R = faisceau de référence, O = faisceau d’objet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Configuration du logiciel utilisé
REMARQUE: Un logiciel C ++ maison basé sur l’approximation de Fresnel11 est utilisé pour analyser les données d’expériences holographiques. Le logiciel développé pour l’étude présentée peut être consulté à l’adresse . 12 Les détails du logiciel ne peuvent pas être publiés pour le moment; toutefois, des renseignements supplémentaires seront fournis sur demande. L’approximation de Fresnel est extrêmement utile en holographie numérique car elle se concentre sur différentes surfaces et zoome sur la zone du premier ordre de diffraction, qui contient des informations complètes sur la scène enregistrée.
- Allumez l’ordinateur et exécutez le logiciel.
REMARQUE: L’étape d’exécution du logiciel dépend du logiciel lui-même. Il n’existe pas de logiciel commercial à cet effet.
4. Effectuer l’expérience
- Éteignez les lumières externes. Effectuez toute l’expérience dans une pièce sombre.
- Synchronisez les caméras à l’aide d’un intervalle choisi. Pour cette expérience, démarrez la caméra holographique après 60 s, et les deux autres caméras immédiatement après, à l’aide d’un logiciel ou manuellement.
- Appuyez sur les boutons d’enregistrement et définissez dans le logiciel quand l’enregistrement démarre.
- Induire des changements dynamiques dans le système d’intérêt. La méthode d’initiation dépend du type d’échantillon; dans le cas d’un effet photophorétique, chauffer extérieurement l’échantillon à l’aide des lasers disponibles : 450 nm, 532 nm, 660 nm, 980 nm. Dans le cas de la réaction BR, commencez la réaction en mélangeant les réactifs chimiques. Observez l’expérience holographique.
- Réglez la caméra photographique et thermique pour suivre l’ensemble de l’expérience et déterminer le moment de la fin de l’enregistrement holographique à partir des mesures optiques et thermiques.
- Prononcez la fin du processus. La fin de l’enregistrement est préprogrammée, en fonction de la durée estimée du processus. Pour la réaction BR, utilisez la solidification comme fin de la réaction. Dans le cas de l’effet photophorétique, il n’y a pas un tel moment spécifique. Dans tous les cas, cette étape souligne l’importance du triple enregistrement.
5. Acquisition des résultats12
- Enregistrez les résultats. Triez précisément les fichiers en fonction du temps pour reconstruire les hologrammes et approfondir l’analyse des données.
REMARQUE: Dans cette étape, les données sont transférées de l’appareil photo utilisé pour l’holographie vers l’ordinateur (disque dur) dans des dossiers nommés d’après les dates de prise de vue. Utilisez les boutons Copier/Coller et Renommer. - Vérifiez l’hologramme de la sonde pour connaître les paramètres appropriés. De cette façon, les meilleurs paramètres sont sélectionnés sur le premier hologramme en le regardant, puis utilisés pour la reconstruction de tous les hologrammes.
- Choisissez un hologramme en cliquant sur l’un d’eux dans le dossier que vous avez créé précédemment (étape 5.1) et effectuez une reconstruction en cliquant sur le bouton Reconstruire .
- Modifiez les paramètres pour obtenir la meilleure image et refaites la reconstruction. Les options de réglage des paramètres tels que l’échantillonnage, le décalage et la distance de Fresnel apparaîtront à l’écran (menu logiciel). Répétez ces étapes jusqu’à ce que les meilleurs paramètres soient définis.
- Effectuez les reconstructions. Choisissez tous les hologrammes en cliquant sur le bouton Ouvrir le fichier et en choisissant tous les fichiers. Appliquer les paramètres souhaités pour la reconstruction numérique des hologrammes; ils restent inchangés après l’étape 5.2.1, alors n’effectuez aucune action cette fois-ci.
- Effectuez les reconstructions à l’aide du bouton Reconstruire et des interférogrammes en insérant les noms de fichiers dans le champ début/fin par, puis en cliquant sur le bouton Batch. Les interférogrammes apparaissent dans le dossier créé précédemment (à l’étape 5.1).
REMARQUE: Après avoir enregistré une série d’hologrammes dans le temps, le premier hologramme représente un état imperturbable, tandis que l’action d’une force externe provoque des hologrammes ultérieurs. Il est nécessaire de reconstruire les hologrammes en utilisant la transformée de Fresnel décalée13. - Obtenir les interférogrammes par soustraction (en termes de nombres complexes) d’un hologramme particulier dans le temps avec le premier hologramme obtenu.
REMARQUE: Ce protocole permet d’observer l’effet de la force sur l’objet. Le changement dans le schéma d’interférence en fonction du temps est une conséquence de la déformation ou du déplacement qui se produit dans le système pendant la mesure. Ces changements sont utilisés pour surveiller la dynamique du système à l’échelle nanométrique.
6. Analyses des résultats
- Effectuer une analyse visuelle comme première étape de contrôle de la qualité du processus. Dans cette étape, recherchez les changements visibles dans le modèle d’interférence et essayez de faire correspondre les changements dans le modèle d’interférence avec les résultats obtenus par des mesures optiques et thermiques.
- Effectuer un contre-interrogatoire de tous les enregistrements. Dans cette deuxième phase de l’analyse, analysez en profondeur les images visuellement des caméras optiques et thermiques avec les reconstructions holographiques afin de révéler la dynamique à l’échelle nanométrique. De cette façon, le moment de réaction est vu simultanément dans des images holographiques, thermiques et photographiques.
- Faites une représentation graphique des résultats basée sur l’analyse numérique / logicielle et présentez-les sous forme de graphiques (1D, 2D ou 3D), de graphiques, d’histogrammes, etc. Après une analyse complète des résultats, tirez des conclusions et anticipez d’autres recherches sur cette base.
Résultats
Un effet photophorétique a été induit et surveillé lors d’une première expérience sur l’aile d’un papillon Morpho menelaus 5. L’effet a été initié par l’action de lasers LED de différentes longueurs d’onde (450 nm, 532 nm, 660 nm et 980 nm). Ici, les ailes d’un papillon I. lathonia 14 ont été utilisées. Après la procédure d’enregistrement, l’image hologramme a été reconstruite.
Discussion
Dans l’étude biophotonique présentée, il est montré qu’une nouvelle méthode holographique peut être utilisée pour détecter un déplacement morphologique minimal ou une déformation causée par un rayonnement thermique de faible niveau.
L’étape la plus critique de la mesure holographique avec des échantillons biologiques est l’étape de préparation. La préparation de l’échantillon (découpe/collage pour correspondre à la taille du support) dépend des propriétés mécan...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
M. S. P., D. G., D. V. et B. K. reconnaissent leur soutien aux structures biologiques et bioinspirées pour la surveillance multispectrale, financées par le programme SPS de l’OTAN (OTAN Science pour la paix et la sécurité) 2019-2022. B. K., D. V., B. B., D. G. et M. S. P. reconnaissent le financement fourni par l’Institut de physique de Belgrade, par le biais du financement institutionnel du ministère de l’Éducation, des Sciences et du Développement technologique de la République de Serbie. De plus, B. K. reconnaît le soutien de F R S - FNRS. M. P. reconnaît le soutien du ministère de l’Éducation, de la Science et du Développement technologique de la République de Serbie, numéro de contrat 451-03-9/2021-14/200026. S. R. M. a été soutenu par une Bourse BEWARE de la Région Wallonne (Convention n°2110034), en tant que chercheur postdoctoral. T. V. reconnaît le soutien financier de la Fondation Hercules. D.V., M.S.P., D.G., M.P., B.B. et B.K. reconnaissent le soutien de l’Office of Naval Research Global par le biais de la subvention de recherche N62902-22-1-2024. Cette étude a été menée en respect partiel des exigences pour le doctorat de Marina Simović Pavlović à l’Université de Belgrade, Faculté de génie mécanique.
matériels
| Name | Company | Catalog Number | Comments |
| Active Vibration Isolation, Four Optical Table Supports | Thorlabs | PTR502 | High Load Capacity: 2,500 kg, Height 600 mm |
| Cuvette | Standard glass cuvette | ||
| Holographic camera (optical camera for holography) | Cannon | EOS 50D | Sensor Size 22.3 x 14.9 mm; Pixel pitch 4.69 µm; Max. resolution 4752 x 3168; JPEG file format |
| Hydrogen peroxide, H2O2 | Merck (Darmstadt, Germany) | ||
| Laser | Laser Quantum | Torus 532 laser | Wavelength 532 nm; Power 390 mW; Coherence length 10 m |
| LED lasers | |||
| Malonic acid, C3H4O4 | Acr s Organics (Geel, Belgium) s Organics (Geel, Belgium) | ||
| Manganese sulphate, MnSO4 | Fluka (Buchs, Switzerlend) | ||
| Nonlinear optical microscope | IPB | ||
| Optical accessories | Thorlab | ||
| Optical spectroscope | |||
| Optical table | Thorlabs | TOP450II PTR52509 | dimensions 2000*1250*310 mm |
| Perchloric acid, HClO4 | Merck (Darmstadt, Germany) | ||
| Potassium iodate, KIO3 | Merck (Darmstadt, Germany) | ||
| Software | Home-build software made by one of the authors: Dusan Grujic. This software was conducted in partial fulfillment of the requirements for the PhD deegree of D.G. | ||
| Thermal camera | Flir | A65 | 640x512 pixel; Thermal resolution 50 mK |
| Video camera | Nikon | 1v3 | 18.4 Mpixel; 60 fps |
Références
- Pietrzyk, D. J., Frank, C. W. Development of an analytical method. Analytical Chemistry. , 10-19 (1979).
- Ostrovsky, Y. I., Shchepinov, V. P., Yakovlev, V. V. . Holographic Interferometry in Experimental Mechanics. 60, (2013).
- Pedrini, G., Osten, W., Gusev, M. E. High-speed digital holographic interferometry for vibration measurement. Applied Optics. 45 (15), 3456-3462 (2006).
- Pantelić, D. V., Grujić, D. &. #. 3. 8. 1. ;., Vasiljević, D. M. S. i. n. g. l. e. -. b. e. a. m. dual-view digital holographic interferometry for biomechanical strain measurements of biological objects. Journal of Biomedical Optics. 19 (12), 127005 (2014).
- Grujić, D., et al. Infrared camera on butterfly's wing. Optics Express. 26 (11), 14143-14158 (2018).
- Mouchet, S. R., Deparis, O. . Natural Photonics and Bioinspiration. , (2021).
- Pagnacco, M. C., et al. Spontaneous symmetry breaking: the case of crazy clock and beyond. Symmetry. 14, 413 (2022).
- Pagnacco, M. C., Maksimovic, J. P., Potkonjak, N. I., Božić, B. &. #. 2. 7. 2. ;., Horvath, A. K. Transition from low to high iodide and iodine concentration states in the Briggs-Rauscher reaction: evidence on crazy clock behavior. The Journal of Physical Chemistry A. 122 (2), 482-491 (2018).
- Pagnacco, M. C., Maksimović, J. P., Janković, B. &. #. 3. 8. 1. ;. Analysis of transition from low to high iodide and iodine state in the Briggs-Rauscher oscillatory reaction containing malonic acid using Kolmogorov-Johnson-Mehl-Avrami (KJMA) theory. Reaction Kinetics, Mechanisms and Catalysts. 123 (1), 61-80 (2018).
- Mouchet, S. R., et al. Unveiling the non-linear optical response of Trichtenotoma childreni longhorn bestle. Journal of Biophotonics. 12 (9), 201800470 (2019).
- Shimobaba, T., et al. Computational wave optics library for C++: CWO++ library. Computer Physics Communications. 183 (5), 1124-1138 (2012).
- Grujic, D. . Application of digital holography for detection of infrared radiation on biophotonic structures. , (2022).
- Muffoletto, R. P., Tyler, J. M., Tohline, J. E. Shifted Fresnel diffraction for computational holography. Optical Express. 15 (9), 5631-5640 (2007).
- Pavlović, D., et al. Naturally safe: Cellular noise for document security. Journal of Biophotonics. 12 (12), 201900218 (2019).
- Bray, W. C. A periodic reaction inhomogeneous solution and its relation to catalysis. Journal of the American Chemical Society. 43 (6), 1262-1267 (1921).
- Nicolis, G. Self-organization in nonequilibrium systems. Dissipative Structures to Order through Fluctuations. , 339-426 (1977).
- Prigogine, I., Hiebert, E. N. From being to becoming: Time and complexity in the physical sciences. Physics Today. 35 (1), 69 (1982).
- Nikolova, L., Ramanujam, P. S. . Polarization Holography. , (2009).
- Haisch, C., Kykal, C., Niessner, R. Photophoretic velocimetry for the characterization of aerosols. Analytical Chemistry. 80 (5), 1546-1551 (2008).
- Kononenko, V. L., et al. Feasibility studies on photophoretic effects in field-flow fractionation of particles. Journal of Liquid Chromatography & Related Technologies. 20 (16-17), 2907-2929 (1997).
- Zhang, X., Bar-Ziv, E. A novel approach to determine thermal conductivity of micron-sized fuel particles. Combustion Science and Technology. 130 (1-6), 79-95 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon