Method Article
Disección, fijación y visualización del Drosophila Pupal Notum
En este artículo
Resumen
El presente protocolo detalla la preparación y visualización del tejido fijo del notum pupal de Drosophila . Se puede utilizar para el tejido intacto o herido, y se conserva la arquitectura original del tejido. Los procedimientos para diseccionar, fijar y teñir se describen en este artículo.
Resumen
Las pupas de Drosophila melanogaster están inmóviles durante varios días durante la metamorfosis, durante los cuales desarrollan un nuevo cuerpo con un tegumento adulto delgado y transparente. Su inmovilidad y transparencia los hacen ideales para experimentos de imágenes en vivo in vivo . Muchos estudios se han centrado en la monocapa epitelial dorsal del notum pupal debido a su accesibilidad y tamaño relativamente grande. Además de los estudios de mecánica epitelial y desarrollo, el notum ha sido un tejido ideal para estudiar la cicatrización de heridas. Después de una lesión, todo el proceso de reparación epitelial se puede capturar mediante imágenes en vivo durante 6-12 h. A pesar de la popularidad del notum para imágenes en vivo, muy pocos estudios publicados han utilizado muestras fijas de notum. La fijación y la tinción son enfoques comunes para casi todos los demás tejidos de Drosophila, aprovechando el gran repertorio de tinciones celulares simples y anticuerpos. Sin embargo, el notum pupal es frágil y propenso al rizo y la distorsión después de la eliminación del cuerpo, por lo que es difícil complementar las imágenes en vivo. Este protocolo ofrece un método sencillo para fijar y teñir el notum pupal, tanto intacto como después de la herida con láser. Con esta técnica, el lado ventral de la pupa se pega a una funda para inmovilizar la pupa, y el notum se retira, fija y tiñe cuidadosamente. El epitelio notum se monta en un portaobjetos o entre dos fundas para facilitar la obtención de imágenes desde el lado dorsal o ventral del tejido.
Introducción
El notum pupal de Drosophila melanogaster se ha utilizado cada vez más para estudios de imágenes en vivo en la última década porque el animal está inmóvil y tiene una cutícula transparente en esta etapa 1,2,3,4,5,6,7. Sin embargo, el notum pupal es difícil de diseccionar y arreglar, lo que dificulta complementar los estudios de imágenes en vivo con la tinción de anticuerpos y células. El objetivo general de este trabajo es crear un protocolo reproducible para diseccionar y fijar el notum pupal para la tinción de anticuerpos y células en muestras nuevas o previamente fotografiadas en vivo.
A medida que las larvas comienzan la metamorfosis, la epidermis se aleja de la cutícula larvaria, formando una caja pupal dura8. El plan corporal larvario se descompone y se desarrolla el nuevo plan corporal adulto. Durante este tiempo, las pupas están inmóviles, lo que las hace ideales para imágenes en vivo. Un tejido comúnmente fotografiado es el notum pupal, un epitelio monocapa adulto que se forma en el tórax dorsal. El notum es visualmente accesible después de una simple disección para eliminar el caso pupal9. Luego se puede montar todo el animal, y el notum se puede obtener imágenes en vivo durante horas o días, lo que lo convierte en un tejido ideal para estudiar los comportamientos de las células epiteliales durante el desarrollo, la homeostasis y después de la herida 10,11,12,13,14. Sin embargo, el notum es difícil de diseccionar y arreglar porque es frágil y está cubierto con una delgada cutícula adulta transparente que es hidrofóbica. Esta cutícula hidrofóbica la hace propensa a enroscarse en soluciones acuosas cuando se retira del resto del cuerpo. Por lo tanto, la disección y fijación notum se ha reportado solo en raras ocasiones y la disección a menudo no se describe 15,16,17,18. Sin un protocolo detallado en la literatura, es prohibitivamente difícil para un investigador de Drosophila complementar las imágenes vivas con la tinción de pupas.
Esta técnica tiene como objetivo diseccionar y fijar de forma reproducible muestras que han sido previamente fotografiadas en vivo, incluidas las que han sido heridas con láser. Debido a que las imágenes en vivo requieren la eliminación del caso pupal, esta técnica de disección comienza por eliminar el caso pupal anterior, a diferencia de los protocolos anteriores que fijan o bisectan pupas dentro del caso pupal 4,19,20. El notum es un tejido frágil, y las heridas pueden exacerbar su fragilidad. Por lo tanto, para soportar este delicado tejido, el tegumento (el epitelio y la cutícula adulta transparente adjunta) del notum y parte de la cabeza y el abdomen se diseccionan lejos del resto de la pupa mientras siempre se sumergen en un ambiente acuoso. Este método reduce la probabilidad de que el tejido se enrosque y sea inutilizable. Esta técnica ha teñido con éxito el tejido notum herido tan pronto como 30 min después de la herida (Figura 1E-H) y a las 3 h después de la herida (Figura 1I-L). Se espera que este protocolo sea efectivo durante la duración del desarrollo de notum o la reparación de heridas. La técnica actual será útil para los investigadores que deseen unir las capacidades de imágenes en vivo del notum pupal con la abundancia de reactivos inmunohistoquímicos disponibles.
Protocolo
Drosophila melanogaster (moscas de la fruta) se mantuvo a 25 °C en un medio estándar de harina de maíz-melaza. Los estudios se realizaron sobre pupas H2A de histona marcadas con EGFP (w[*]; P{w+mC=His2Av-EGFP.C}2/SM6a). Las moscas se obtuvieron de un centro de stock público (ver Tabla de Materiales).
1. Inmovilización de pupas
- Aplique una tira de 2" de cinta adhesiva de doble cara a un portaobjetos de microscopio.
- Identifique las prepupas blancas en viales elevados a 25 °C y utilice un marcador para indicar su ubicación fuera del vial. Devolver los viales a 25 °C.
NOTA: Las prepupas blancas se caracterizan por su inmovilidad, color blanco y espiráculos evertidos. Estos se forman 0-1 h después de la formación de pupario (APF), o etapa P18. - 12-15 h más tarde, retire cuidadosamente 3-4 de las pupas indicadas (sin reventarlas) con un endoscopio de disección y recójalas en el portaobjetos del microscopio junto a la cinta.
NOTA: Las pupas ahora estarán en la etapa P5 con un saco de cabeza evertido visible en el extremo anterior8 de las pupas. - Coloque las pupas al menos a una pupa separada de ancho sobre la cinta con sus lados ventrales hacia abajo.
- Coloque una gota de pegamento adhesivo en una película de parafina (consulte la Tabla de materiales) o en la tapa del tubo de una centrífuga. Sumerja el extremo de una punta de pipeta de 0.1-10 μL (sin pipeta) en la gota de pegamento adhesivo. Golpee la punta de la pipeta dos veces en un capa de cubierta de 24 mm x 60 mm (1.5 de espesor), a 1 cm x 1 cm de distancia de una esquina, creando una línea de pegamento adhesivo ~ 1/2 de la longitud de la pupa.
- Preestablezca una pipeta de 0.2-2 μL (P2) a 2 μL, y una pipeta de 200 μL (P200) a 200 μL, y colóquelas con puntas para que estén listas para ser llenadas con 1x PBS + 0.1 mM Ca2+, que solidificará rápidamente el pegamento adhesivo al contacto.
- Inserte pinzas (ver Tabla de materiales) cerca del lado de la cabeza y retire suavemente la caja de la parte anterior a posterior9. Retire la mayor cantidad posible de la caja. Agarre las patas en desarrollo de la pupa con un par de fórceps contundentes y retire cuidadosamente la pupa de su estuche.
NOTA: Una pequeña ruptura en la porción ventral de las pupas no será perjudicial para este procedimiento. - Coloque la pupa en la esquina de la cubierta.
- Agarre la pupa en el abdomen posterior o el ala en desarrollo con fórceps contundentes, levante y coloque el lado ventral de las pupas hacia abajo en la línea de pegamento adhesivo.
- Llene rápidamente la pipeta P2 con 2 μL de 1x PBS + 0.1 mM de Ca2+, y manteniéndola en el aire, expulse lo suficiente para formar una pequeña burbuja en la punta (0.25-0.5 μL).
- Toque la pequeña burbuja de la solución en un lado de las pupas en la base del tórax, luego repita en el otro lado.
NOTA: Esto solidificará una pequeña cantidad del pegamento adhesivo para mantener la pupa en su lugar. Generalmente, no se utilizarán todas las soluciones. - Llene la pipeta P200 con 200 μL de 1x PBS + 0.1 mM de Ca2+, luego coloque la punta de la pipeta sobre el tórax y expulse el contenido para sumergir las pupas por completo. El resto del pegamento adhesivo se solidificará inmediatamente.
- Retire ~ 100 μL de la solución de PBS, de modo que la pupa apenas se sumerja antes de proceder inmediatamente al siguiente paso.
NOTA: Para muestras no enrolladas, comience desde el paso 1.1. Para las muestras heridas parcialmente diseccionadas, comience en el paso 1.5. La herida por ablación láser se ha descrito previamente14,21. Los pasos de inmovilización, disección y montaje deben realizarse con un microscopio de disección.
2. Disección del notum
- Agarre un par de tijeras de microdisección que sujetan un lado del mango contra el dedo índice y el dedo medio de la mano dominante, de modo que el pulgar de la mano dominante aplique la fuerza de corte (Figura 2A, B).
- Estabilice el cuello de las tijeras contra el dedo medio de la mano no dominante mientras sujeta el cubrebocas con el dedo anular de la mano no dominante.
- Recorte en la mitad del abdomen dorsal para crear un pequeño agujero, ~ 0.2-0.5 mm. Alguna hemolinfa generalmente se derramará y es un buen indicador de la brecha.
- Haga pequeños cortes de 0.5-0.75 mm a través del tegumento de posterior a anterior, rodeando el tejido dorsal para aislarlo. Para crear un tejido lo más plano posible, evite cortar demasiado ventralmente; solo se debe quitar la "cúpula" dorsal del tórax junto con pequeñas secciones de la cabeza y el abdomen.
- Repita los cortes posteriores a anteriores en el otro lado de las pupas.
- Gire la etapa de disección para permitir un corte limpio a través de la cabeza si es necesario.
NOTA: En esta etapa, el tegumento dorsal, o notum, se separará del resto de la pupa. Si parece separado pero no se mueve fácilmente, unos pocos cortes debajo del notum pueden ayudar a desalojarlo. - Agregue ~ 200 μL de 1x PBS al centro de la cubierta y haga un canal que lo conecte a la gota de disección original arrastrando suavemente la punta de la pipeta a través del vidrio de la cubierta desde la nueva gota hasta la original.
- Usando un par de pinzas romas, empuje o arrastre suavemente el notum aislado hasta el centro de la cubierta y gire, de modo que el lado interior mire hacia arriba. Nunca retire el tejido de la gota.
NOTA: Es esencial alejar el notum del sitio de disección original para evitar cualquier resto del pegamento adhesivo que ocluya la muestra durante la toma de imágenes posterior. - Sostenga el notum hacia abajo con las pinzas romas presionando en las secciones abdominales o de la cabeza. Usando un par de fórceps afilados y / o expulsiones suaves de 1x PBS de una pipeta de 200 μL, elimine cualquier cuerpo graso restante, bandas musculares o hemolinfa (si está presente) para exponer completamente el epitelio monocapa y hacer que la tinción final sea más uniforme. El notum diseccionado debe aparecer como en la Figura 3A.
- Una vez que el tejido esté limpio, use una pipeta de 200 μL para eliminar la mayor cantidad posible de la solución de PBS (junto con los desechos y la parte ventral de las pupas), monitoreando con un endoscopio de disección para evitar aspirar el notum.
- Una vez que se haya eliminado la mayor parte del líquido, use un tejido absorbente para limpiar cuidadosamente el resto del pegamento adhesivo y la pupa, así como cualquier otro residuo que permanezca en la cubierta.
NOTA: Si queda algún pegamento adhesivo en la cubierta, no causará un problema siempre que sea más delgado que el tejido dorsal en sí. - Agregue 150-200 μL de PFA al 4% (en 1x PBS) y fije durante 20 minutos a temperatura ambiente. Dependiendo de la velocidad de disección, se pueden diseccionar 1 o más pupas durante la fijación de la primera pupa.
- Retire el PFA y reemplácelo con 1x PBS para lavar el notum una vez durante 30 s.
- Si procede con la tinción de anticuerpos, realice lavados de 5 minutos (3 veces) en 1x PBS o 1x PBST (Archivo Suplementario 1) para permeabilizar el tejido si el antígeno es intracelular.
- Almacene la muestra en 1x PBS + 0.02% NaN3 durante la noche en una cámara humidificada, o si planea teñir el tejido, incube durante la noche en solución de bloqueo (Archivo suplementario 1).
3. Tinción del notum
NOTA: Para la tinción con anticuerpos o manchas celulares, siga los pasos a continuación. -El notum no debe retirarse de la solución, ya que esto probablemente hará que el tejido se enrosque. Por lo tanto, adapte los protocolos de tinción para que se realicen completamente en el cobertor y manténgalos en una cámara humidificada durante los pasos de más de 5 minutos. El monitoreo de las muestras bajo un microscopio de disección puede ayudar a prevenir la aspiración accidental del tejido durante los lavados.
- Para visualizar los bordes celulares, incubar en 200 μL de anticuerpo igG2a primario de ratón anti-FasIII (ver Tabla de Materiales) a una concentración de 1:8 diluida en Blocking Buffer + 0.02% NaN3 durante la noche a 4 °C.
- Lave el exceso de anticuerpos primarios (3 veces) con 200 μL de 1x PBS + 0.02% NaN3 durante 1 h por lavado a temperatura ambiente.
- Realizar incubación secundaria de anticuerpos con 200 μL de concentración 1:200 anti-mouse IgGa2 en Cy3 en Blocking Buffer + 0.02% NaN3 durante 2 h a temperatura ambiente.
- Lave el exceso de anticuerpos secundarios (3 veces) con 200 μL de 1x PBS + 0.02% NaN3 durante 1 h por lavado a temperatura ambiente.
- Para visualizar los núcleos, incubar muestras en 1 μg/mL de DAPI durante 45 min para dar tiempo suficiente para que la mancha penetre a través de bandas musculares; la fijación en un medio de montaje que contenga DAPI no es efectiva con este tejido.
- Lave el exceso de DAPI (3 veces) con 200 μL de 1x PBS + 0.02% NaN3 durante 5 min por lavado a temperatura ambiente, luego deje en 200 μL de 1x PBS + 0.02% NaN3 durante la noche a 4 °C, o monte inmediatamente.
4. Montaje y visualización del notum
- Después de la tinción, prepare un nuevo cubrehojas (topper) de 24 × 60 con soportes.
NOTA: Debido a que el notum tiene forma de cúpula, aplanarlo por completo da como resultado un tejido arrugado distorsionado. La creación de un espacio entre las dos cubiertas permite que el notum conserve su forma normal. - Cree un espacio de ~ 200 μm mediante el uso de espaciadores hechos de 22 x 22 fundas (grosor No. 0, ~ 100 μm de espesor), adheridas ~ 1 cm de distancia con esmalte de uñas en el medio de la parte superior.
- Para adherirse, coloque los espaciadores en la parte superior y pinte los bordes distales de los espaciadores con una capa delgada de esmalte de uñas. Dejar secar.
NOTA: Solo use un esmalte de uñas que sea delgado y moqueante; El esmalte de uñas grueso agregará espacio adicional innecesario entre el cubrehojas y el topper. - Retire la mayor cantidad posible de la solución acuosa de la muestra.
- Aplique inmediatamente dos gotas (~100 μL) de medio de montaje antidesvanecimiento (consulte la Tabla de materiales) a la muestra.
- Si es necesario, use pinzas limpias y afiladas para colocar el notum en el centro de la gota mediana de montaje antidesvaneo.
- Coloque el estuche con el notum sobre un soporte de ~ 10 x 40 mm, como un trozo de espuma delgada (cortado del material de embalaje dentro de las cajas de cubierta), para elevar la muestra para que no se adhiera a la superficie de trabajo.
- Bajo un endoscopio de disección, baje lentamente el topper sobre la muestra. Una vez que el medio de montaje antidesvanecimiento se encuentre con el topper, suelte suavemente y permita que la acción capilar tire del topper hacia abajo.
NOTA: Dentro de los primeros segundos, se pueden hacer ajustes menores en la posición de la cubierta sin dañar el notum. - Coloque otra pieza de espuma en la tapa y use un portaobjetos de microscopio estándar como peso para persuadir suavemente el medio de montaje antidesvanecimiento entre la cubierta de la muestra, la tapa y los espaciadores.
- Después de 5-10 min, use un tejido absorbente para eliminar cualquier exceso de medio de montaje antidesvanecimiento tocando suavemente los bordes de la cubierta.
- Aplique suavemente esmalte de uñas en cada esquina de las fundas para adherirlas entre sí. Una vez seco, pinta todos los bordes de las fundas para sellar. Evite cubrir todos los bordes primero, ya que esto a menudo puede cambiar el deslizamiento y dañar el tejido dorsal.
- Visualice el notum bajo microscopía de fluorescencia (ver Tabla de Materiales) a través del lado dorsal y/o ventral.
Resultados
La técnica presentada funciona bien en el notum no enrollado (Figura 1A-D), lo que permite investigar el desarrollo y la homeostasis del tejido, por ejemplo, la formación de las células de cerdas mecanosensoriales poliploides18, o el flujo anterior a posterior de las células epiteliales10. Este protocolo también es aplicable a un notum ablacionado con láser (Figura 1E-L), donde la respuesta celular a la lesión se puede analizar en vivo con fluoróforos endógenos como Histone2-EGFP (Figura 1B, F, J). La post-tinción con inmunohistoquímica (paso 3) puede revelar muchas características, como Fasciclin III, que etiqueta los bordes celulares (Figura 1C, G, K). Además, las tinciones cuantitativas como DAPI (Figura 1A, E, I) se pueden utilizar para evaluar los cambios en el contenido de ADN, incluida la poliploidía inducida porheridas 22.
El protocolo actual es particularmente beneficioso, ya que se puede utilizar después de experimentos de imágenes en vivo a largo plazo. Como las pupas están inmóviles, se pueden tomar imágenes durante horas (Figura 4A, B). Es importante destacar que este protocolo no causa cambios considerables en la arquitectura general o la morfología del epitelio de la herida después de la disección (Figura 4B, C). Por lo tanto, las características dentro del tejido podrían ser fotografiadas a largo plazo y luego investigadas más a fondo con inmunohistoquímica o tinciones celulares.
Las imágenes profundas dentro de los tejidos son complejas debido a su opacidad, y Drosophila está recubierta de una cutícula cerosa8, lo que hace que las imágenes profundas sean aún más difíciles. Sin embargo, con esta técnica, se puede colocar un notum diseccionado entre dos cubiertas que permiten obtener imágenes de la monocapa epitelial desde cualquier lado: el lado apical a través de la cutícula (Figura 5A-D) y / o el lado basal del epitelio que se enfrenta a la cavidad corporal (Figura 5E-H). Estas diferentes vistas son ideales para visualizar diferentes estructuras dentro del tejido. Por ejemplo, la vista apical es ideal para visualizar los bordes y núcleos de las células epiteliales que se encuentran justo debajo de la cutícula (Figura 5A-D). Con la vista basal, estas señales apicales son menos visibles (Figura 5E-H). Sin embargo, se observan estructuras basales en el margen de la herida (Figura 5J, L amarillas, flechas blancas). Estas estructuras basales son mucho más brillantes ya que hay menos oclusión en la vista basal que en la vista apical.
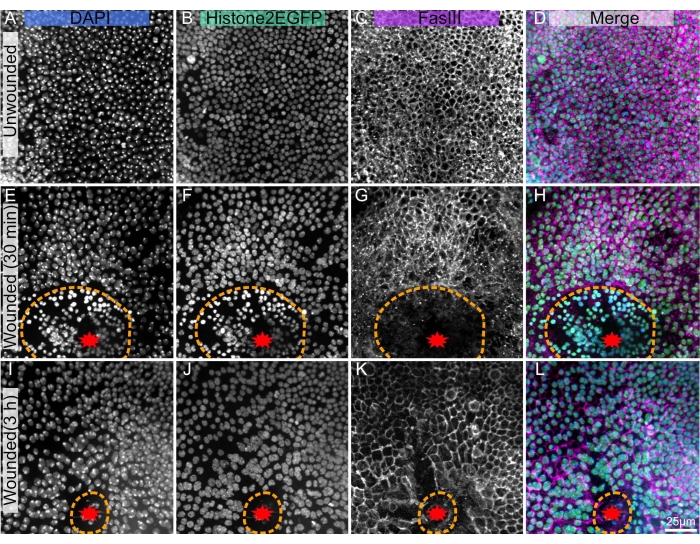
Figura 1: Nota pupal de Drosophila disecada, fija y teñida. (A-D) Notum no herido. (E-H), Notum herido 30 min después de la ablación con láser. (I-L) Notum herido 3 h después de la ablación con láser. (A,E,I) La tinción DAPI muestra núcleos. (B, F, J) La histona transgénica2-EGFP, utilizada en imágenes en vivo, es visible después de la fijación y tinción. (C, G, K) El anticuerpo anti-FasIII muestra que las manchas de anticuerpos funcionan bien en el notum fijo. (D,H,L) Imagen combinada. Las imágenes se capturan con un objetivo de 40x utilizando microscopía de disco giratorio, las proyecciones de máxima intensidad de las pilas Z se muestran con rodajas Z de 0,3 μm. A-D representa 263 rodajas Z. E-H representa 195 rebanadas. I-L representa 53 cortes Z. La línea discontinua naranja denota el margen de la herida. La barra de escala en L es de 25 μm, aplicable a A-L. Haga clic aquí para ver una versión más grande de esta figura.
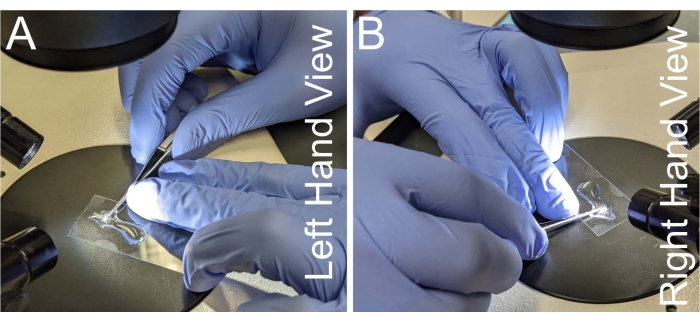
Figura 2: Colocación de la mano para la disección notum. (A-B) Vistas izquierda y derecha de la colocación de la mano para sostener las tijeras de microdisección. Para evitar el temblor de la mano, el cuello de las tijeras se coloca contra el dedo medio de la mano no dominante. Las tijeras deben ser paralelas al portaobjetos del microscopio para evitar la deformación del tejido de notum. Haga clic aquí para ver una versión más grande de esta figura.
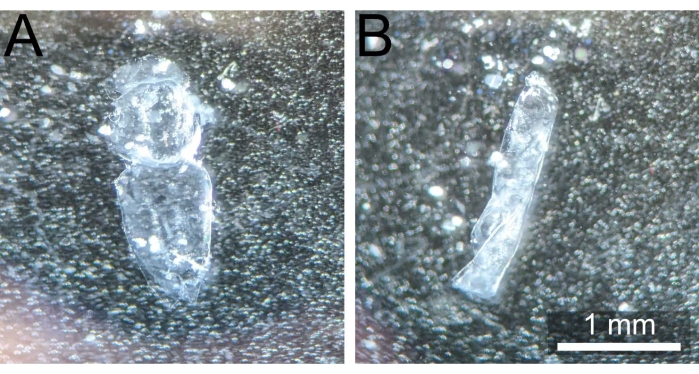
Figura 3: Notum correctamente diseccionado vs. notum rizado. (A) Pupal notum post disección y limpieza sin curvar y listo para la fijación. (B) Pupal notum enroscado sobre sí mismo después de ser retirado de 1x PBS, haciéndolo así inutilizable. Haga clic aquí para ver una versión más grande de esta figura.
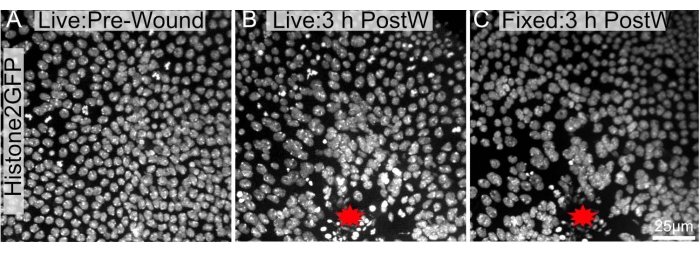
Figura 4: Las imágenes pre y post-fijadas son en gran medida similares. Se tomó una imagen de un notum pupal que expresa Histone2-EGFP en los núcleos (A) vivo antes de la ablación y (B) 3 h después de la ablación con láser. (C) El notum fue recuperado, diseccionado y arreglado como se menciona en el protocolo y re-fotografiado después de la fijación. El sitio de la herida está etiquetado con una estrella roja. Las imágenes fueron capturadas con un objetivo 40x utilizando microscopía de disco giratorio, se tomaron rodajas en Z cada 0,3 μm. Se muestran proyecciones de intensidad máxima de 34 cortes Z antes de la diseminación (A), 48 cortes Z 3 h después del enrollado (B) y 103 cortes Z después de la disección, fijación y tinción (C). La barra de escala en C es de 25 μm, aplicable a A-C. Haga clic aquí para ver una versión más grande de esta figura.
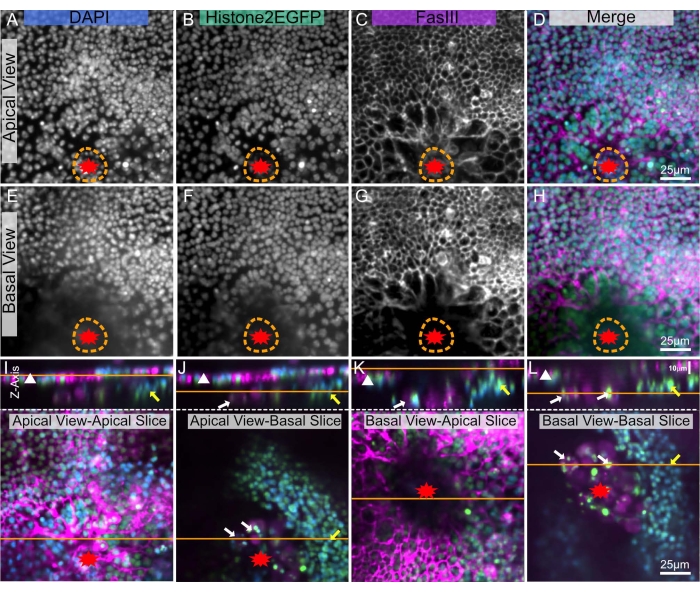
Figura 5: Imágenes de los lados apical y basal de un notum herido. El mismo notum pupal herido se muestra en todos los paneles. La herida está marcada con una estrella roja. La línea punteada naranja indica el margen de la herida. (A-D) El notum se visualiza desde el lado apical, a través de la cutícula. (E-H) El notum se visualiza desde el lado interior basal. (I-L) Los paneles superiores muestran una imagen X-Z del notum, lado apical hacia arriba, con la hoja epitelial designada por un triángulo blanco. La línea naranja denota el plano apical-basal de la rebanada X-Y, que se muestra en los paneles inferiores. Dentro de los paneles inferiores, la línea naranja muestra el plano de la imagen X-Z anterior. (I) Apically imaged notum - apical slice. La vista superior X-Z muestra imágenes precisas de la lámina epitelial apical (triángulo blanco). Esta vista es equivalente a una vista de imágenes en vivo. (J) Notum apicalmente fotografiado - rodaja basal, parcialmente obstruida por tejido apical. Otros tejidos denotados por flecha amarilla (posible banda muscular) y flechas blancas (posibles células sanguíneas) son visibles en el lado basal. (K) Notum basalmente fotografiado - rebanada apical, parcialmente obstruida por tejido basal y costra de la herida (área central oscura). (L) Notum basalmente fotografiado - rodaja basal. Esta vista muestra mejor los tejidos basales denotados con flechas amarillas y blancas. A,E: Tinción DAPI, B,F: Histona-EGFP, C,G: Tinción FasIII. Las imágenes fueron capturadas con un objetivo 20x con microscopía de disco giratorio. Se tomaron rodajas Z cada 0,9 μm. A-D muestra la proyección de intensidad máxima de 19 cortes. E-H representa la proyección de intensidad máxima de 17 cortes. Las barras de escala de 25 μm en D, H, L se aplican a A-D, E-H, I-L, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Expediente Complementario 1: Preparación de soluciones y buffers. Se detallan las recetas para las siguientes soluciones: 1xPBS, 1x PBST, solución de bloqueo y fijador de paraformaldehído. Haga clic aquí para descargar este archivo.
Discusión
Pasos críticos
La optimización de tres pasos aumentará drásticamente el éxito de este protocolo. Primero, en el paso 1.5, ahorre con el pegamento adhesivo aplicado a la cubierta. Si se agrega demasiado pegamento adhesivo, las pupas pueden quedar enterradas en una capa gruesa de pegamento adhesivo solidificado, lo que hará imposible la disección, y si cubre el notum en sí, el pegamento adhesivo ocluirá la luz de la muestra. En segundo lugar, durante los pasos 2.3-2.6, asegúrese de eliminar solo la cúpula superior del notum, excluyendo la mayor cantidad posible del tejido lateral. Si se incluye, el tejido lateral se comprimirá durante el montaje y hará que el centro del notum se doble hacia adentro, a menudo colocándolo fuera de la distancia de trabajo de los objetivos de alta apertura numérica. En tercer lugar, durante la etapa de limpieza 2.9, se debe tener mucho cuidado de no dañar el epitelio monocapa. Si al tejido le faltan grandes porciones o no se puede detectar ninguna señal, es probable que este paso sea el culpable.
Solución de problemas
Problema 1: Después del montaje, la pupa se desprende de la cinta de doble cara durante la disección. Este es un problema común, especialmente para los principiantes. El mejor remedio es asegurarse de que el exterior de la caja de pupas esté completamente seco / libre de restos de alimentos. Quitar los alimentos con un par de fórceps contundentes y dejar que el estuche se seque al aire durante 10-15 minutos ayudará a adherirse a la cinta. Alternativamente, use la mano no dominante y un par de fórceps contundentes para sostener las pupas contra la cinta durante la disección. Si el problema persiste, aplicar una pequeña gota de esmalte de uñas de 5-10 μL en la base del extremo posterior de la caja y permitir que se endurezca generalmente proporciona suficiente adherencia incluso para las pupas más rebeldes.
Problema 2: Notum se colapsa durante el paso 2.3, o la brecha inicial a través del tegumento no es suave. Si el tegumento es difícil de romper, puede haber demasiado pegamento adhesivo de los pasos de inmovilización. Colocar las pupas disecadas en menos pegamento adhesivo mejorará este problema. Además, asegúrese de que las tijeras de microdisección sean afiladas. Las tijeras romas no podrán cortar el tegumento y tienden a hacer que colapse hacia adentro. Una vez que la hemolinfa se derrame fuera de las pupas, asegúrese de que una de las cuchillas de corte pueda ingresar a la pupa sin causar que el notum se deforme. Si el notum colapsa y la cuchilla no entra en la pupa, continúe cortando hasta que una cuchilla entre en las pupas.
Problema 3: Durante el paso 2.4, las tijeras atrapan o arrastran el tegumento. Si las tijeras comienzan a atrapar o arrastrar el tegumento, a menudo ayuda cambiar al lado opuesto de las pupas y proceder a "aflojar" el tegumento. Otras tijeras de microdisección romas dificultarán el logro de cortes limpios a través del tegumento, y se deben usar tijeras afiladas.
Problema 4: La muestra se aspira accidentalmente durante la tinción (pasos 3.1-3.6). El notum diseccionado es difícil de ver porque es transparente. Puede ser útil colocar una sábana azul oscuro o negra debajo de la cubierta para proporcionar contraste (un viejo bastidor de soporte de punta de pipeta funciona bien). Además, todos los cambios en la solución se pueden realizar bajo un microscopio de disección.
Problema 5: No se detecta ninguna señal/se detecta una señal irregular. Después de descartar problemas específicos de manchas, si no se detecta ninguna señal o es irregular, es probable que el paso 2.9 (limpieza) sea el culpable. Una señal ausente o irregular puede originarse por el daño y la eliminación del tejido epitelial durante la limpieza. Por el contrario, una señal deficiente puede ser causada por la oclusión de las bandas musculares / células grasas del cuerpo si no se eliminan, ya que pueden limitar la difusión de manchas y anticuerpos en el notum en relación con el tejido circundante. Si el tejido está dañado, ser más suave durante la limpieza es la mejor solución. Si, en cambio, la mancha es visible pero irregular, se recomienda aumentar el vigor / tiempo dedicado al paso de limpieza para eliminar la mayor cantidad posible del músculo y la grasa del cuerpo. Además, aumentar la duración de la mancha puede ayudar a resolver este problema con una mejor limpieza.
Problema 6: El tejido notum tiene una apariencia deformada / arrugada durante la toma de imágenes. La deformación y las arrugas del tejido provienen de dos fuentes. Primero, comprimir el notum durante el montaje hará que se doble y se deforme. La mejor solución es eliminar la mayor cantidad posible de los tejidos laterales para que la cúpula sea lo más corta posible y pueda caber entre los espaciadores de la cubierta. En segundo lugar, si el notum se dobla durante la disección, esta curva no se enderezará durante el montaje, por lo que se debe tener especial cuidado de no deformar el notum durante la disección. La flexión accidental del notum es más común cuando se corta el tegumento lejos del resto de las pupas. Es tentador tener las tijeras de disección en un ángulo relativo a las pupas en lugar de mantenerlas en el plano de muestra como las pupas. Sin embargo, las tijeras en ángulo hacen que el tegumento se doble hacia arriba cuando se corta en lugar de permanecer plano.
Métodos existentes, limitaciones y aplicaciones futuras
Wang et al.20 reportaron un protocolo de disección comparable para el aislamiento del epitelio pupal. Esta técnica requiere que la pupa permanezca dentro de su estuche y se divida rápidamente con un bisturí. Este protocolo es incompatible con las muestras previamente fotografiadas en vivo, ya que las imágenes en vivo requieren la eliminación de una gran sección de la caja de pupa. Debido a que las pupas carecen de rigidez, la bisección de pupas fuera de la caja destrozó el tejido, inspirando la creación de este protocolo. La técnica detallada aquí permite el aislamiento y la fijación del notum, y podría usarse como el primer paso para una amplia gama de otros métodos como la crioseccionación, la hibridación in situ o la microscopía electrónica.
Esta técnica tiene algunas limitaciones. En primer lugar, diseccionar, fijar y teñir el notum consume más tiempo que las proteínas marcadas fluorescentemente con imágenes en vivo en el notum, lo que requiere solo una disección simple para eliminar el caso pupal 9,23. En segundo lugar, en comparación con las disecciones de otros tejidos de Drosophila, esta disección es más difícil debido al tejido delgado y frágil y la cutícula hidrofóbica. Para simplemente visualizar proteínas en Drosophila epithelia, la inmunohistoquímica en embriones fijos, discos de alas larvales u ovarios es más fácil. Sin embargo, esta técnica permite que el poder de las imágenes en vivo se combine con la fijación y la tinción, lo que la convierte en una herramienta poderosa una vez dominada.
Una técnica de disección/ fijación tiene algunas ventajas sobre las imágenes en vivo. Las estructuras basales (interiores) se pueden resolver mejor con una vista basal (Figura 5L,J). Lo más importante es que las imágenes en vivo se limitan a los fluoróforos que deben suministrarse genéticamente, lo que a menudo requiere largos esquemas de cruce genético. Por el contrario, el presente protocolo permite la aplicación de tinciones, inmunohistoquímica y otras técnicas que requieren disección y fijación. Esto aumenta drásticamente el número de señales sondeadas en el tejido, al tiempo que disminuye potencialmente el tiempo hasta los resultados experimentales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al Dr. M. Shane Hutson por establecer el sistema de ablación con láser utilizado para las heridas de pupa y sus contribuciones y comentarios sobre el desarrollo del protocolo. Este trabajo fue apoyado por 1R01GM130130 a APM y M. Shane Hutson. JW fue soportado por 2T32HD007502-21.
Materiales
| Name | Company | Catalog Number | Comments |
| ½” Scotch Permanent Double-Sided tape | Scotch 3M | 665 | |
| 0.1-10 µL uTIP pipette tip | Biotix | M-0011-9FC | |
| 22 x 22 mm No. 0 thickness coverslips | Thomas Scientific | 1207Z28 | |
| 24 x 60 mm coverslip | Corning | 2980-246 | |
| 3M VetBond | 3M | 1469SB | Called "adhesive glue" in protocol |
| Anti-FasIII primary Mouse IgG2a | Developmental Studies Hybridoma Bank | 7G10 | |
| Calcium Chloride | Fisher Chemical | c79-500 | |
| Cy3-conjugated AffiniPure Goat Anti-Mouse IgG2a | Jackson ImmunoResearch | 115-165-206 | |
| DAPI | Sigma Aldrich | D9542-1mg | |
| Dumont #5 Fine Tip Forceps | Fine Science Tools | No. 11254-20 | |
| Dumont #5 Fine Tip Forceps: Blunt | Fine Science Tools | No. 11254-20 | Heavily used and unsharpened forceps, or dulled with a whetstone |
| Fisherbrand Double frosted microscope slides | Fisher Scientific | 22-034-486 | |
| Fluorescent Light Source | Lumencor | Celesta 90-10512 | |
| Fly Stock: EGFP-tagged Histone H2A | Bloomington Drosophila Stock Center | 24163 | |
| Fly Vial Foam Plugs "Flugs" | Genesee Scientific | 49-101 | |
| Humidified Chamber: Foil-wrapped small container lined with filter paper saturated with water | Cole-Parmer | 759075D | A great humidified chamber can be made from the styrofoam box containing Cole-Parmer cuvettes, 759075D, filled with 50 ml water. |
| KimWipe | KimTech | 34155 | Called "Absorbent Tissue" in protocol |
| Nikon Ti2 Eclipse | Nikon | Eclipse Ti2-E | |
| NIS Elements Software | Nikon | AR | |
| Parafilm | Pechiney Plastic Packaging | PM-996 | |
| Paraformaldehyde (PFA) 16% | Ted Pella, Inc | 18505 | |
| Plastic Vials | Genesee Scientific | 32-114 | |
| Sodium Azide (NaN3) | Fisher Scientific | 19038-1000 | |
| Stereo Microdissection Scope | Carl Zeiss | STEMI 2000 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | New or freshly sharpened scissors |
| Vecta Shield | Vector Laboratories | H-1000 | Called " antifade mounting medium" in protocol |
| Vecta Shield with DAPI | Vector Laboratories | H-1200 | Not ideal for pupal notum. |
| X-Light V2 Spinning Disc | Crest Optics | V2 L-FOV |
Referencias
- Valon, L., et al. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination. Developmental Cell. 56 (12), 1700-1711 (2021).
- Levayer, R., Dupont, C., Moreno, E. Tissue crowding induces caspase-dependent competition for space. Current Biology. 26 (5), 670-677 (2016).
- Couturier, L., et al. Regulation of cortical stability by RhoGEF3 in mitotic sensory organ precursor cells in Drosophila. Biology Open. 6 (12), 1851-1860 (2017).
- Couturier, L., Mazouni, K., Corson, F., Schweisguth, F. Regulation of Notch output dynamics via specific E(spl)-HLH factors during bristle patterning in Drosophila. Nature Communications. 10, 3486 (2019).
- Fujisawa, Y., Shinoda, N., Chihara, T., Miura, M. ROS regulate caspase-dependent cell delamination without apoptosis in the drosophila pupal notum. iScience. 23, 101413 (2020).
- Besson, C., et al. Planar cell polarity breaks the symmetry of par protein distribution prior to mitosis in drosophila sensory organ precursor cells. Current Biology. 25 (8), 1104-1110 (2015).
- Koto, A., Kuranaga, E., Miura, M. Apoptosis ensures spacing pattern formation of drosophila sensory organs. Current Biology. 21, 278-287 (2011).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Moreira, C., Regan, J., Zaidman-Rémy, A., Jacinto, A., Prag, S. Drosophila hemocyte migration: an in vivo assay for directional cell migration. Methods in Molecular Biology. 769, 249-260 (2011).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. Elife. 4, 08519 (2015).
- Cristo, I., Carvalho, L., Ponte, S., Jacinto, A. Novel role for Grainy head in the regulation of cytoskeletal and junctional dynamics during epithelial repair. Journal of Cell Science. 131 (17), 213595 (2018).
- Bellaïche, Y., Gho, M., Kaltschmidt, J. A., Brand, A. H., Schweisguth, F. Frizzled regulates localization of cell-fate determinants and mitotic spindle rotation during asymmetric cell division. Nature Cell Biology. 3 (1), 50-57 (2001).
- Shannon, E. K. Multiple mechanisms drive calcium signal dynamics around laser-induced epithelial wounds. Biophysical Journal. 113 (7), 1623-1635 (2017).
- O'Connor, J. T., et al. Proteolytic activation of Growth-blocking peptides triggers calcium responses through the GPCR Mthl10 during epithelial wound detection. Developmental Cell. 56 (15), 2160-2175 (2021).
- Hartenstein, V., Posakony, J. W. Development of adult sensilla on the wing and notum of Drosophila melanogaster. Development. 107 (2), 389-405 (1989).
- Yeh, E., Zhou, L., Rudzik, N., Boulianne, G. L. Neuralized functions cell autonomously to regulate Drosophila sense organ development. The EMBO Journal. 19 (17), 4827-4837 (2000).
- Loubéry, S., et al. Uninflatable and notch control the targeting of sara endosomes during asymmetric division. Current Biology. 24 (18), 2142-2148 (2014).
- Kawamori, A., Shimaji, K., Yamaguchi, M. Dynamics of endoreplication during Drosophila posterior scutellar macrochaete development. PLoS One. 7 (6), 38714 (2012).
- Couturier, L., Schweisguth, F., Bellen, H. J., Yamamoto, S. . Notch Signaling: Methods and Protocols. , 79-86 (2014).
- Wang, W., Yoder, J. H. Drosophila pupal abdomen immunohistochemistry. Journal of Visualized Experiments. (56), e3139 (2011).
- Kiehart, D. P., et al., Celis, J. E., et al. . Cell Biology (Third Edition). , 87-103 (2006).
- Bailey, E. C., Dehn, A. S., Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. A Drosophila model to study wound-induced polyploidization. Journal of Visualized Experiments. (160), e61252 (2020).
- O’Connor, J. T., S, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protocols. , (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados