Method Article
Dissezione, fissaggio e visualizzazione della Drosophila Pupal Notum
In questo articolo
Riepilogo
Il presente protocollo descrive in dettaglio la preparazione e la visualizzazione del tessuto fisso del notum pupale di Drosophila . Può essere utilizzato per tessuti intatti o feriti e l'architettura originale del tessuto è preservata. Le procedure per sezionare, fissare e colorare sono tutte descritte in questo articolo.
Abstract
Le pupe di Drosophila melanogaster sono immobili per diversi giorni durante la metamorfosi, durante la quale sviluppano un nuovo corpo con un sottile tegumento adulto trasparente. La loro immobilità e trasparenza li rendono ideali per esperimenti di live imaging in vivo . Molti studi si sono concentrati sul monostrato epiteliale dorsale del notum pupale a causa della sua accessibilità e delle dimensioni relativamente grandi. Oltre agli studi di meccanica epiteliale e sviluppo, il notum è stato un tessuto ideale per studiare la guarigione delle ferite. Dopo un infortunio, l'intero processo di riparazione epiteliale può essere catturato mediante imaging dal vivo per 6-12 ore. Nonostante la popolarità del notum per l'imaging dal vivo, pochissimi studi pubblicati hanno utilizzato campioni di notum fissi. La fissazione e la colorazione sono approcci comuni per quasi tutti gli altri tessuti della Drosophila, sfruttando l'ampio repertorio di semplici macchie cellulari e anticorpi. Tuttavia, il notum pupale è fragile e incline all'arricciatura e alla distorsione dopo la rimozione dal corpo, rendendo difficile integrare l'imaging dal vivo. Questo protocollo offre un metodo semplice per fissare e colorare il notum pupale, sia intatto che dopo la ferita laser. Con questa tecnica, il lato ventrale della pupa viene incollato a una copertina per immobilizzare la pupa e il notum viene accuratamente rimosso, fissato e macchiato. L'epitelio notum è montato su un vetrino o tra due coverslip per facilitare l'imaging dal lato dorsale o ventrale del tessuto.
Introduzione
Il notum pupale di Drosophila melanogaster è stato sempre più utilizzato per studi di imaging dal vivo nell'ultimo decennio perché l'animale è immobile e ha una cuticola trasparente in questa fase 1,2,3,4,5,6,7. Tuttavia, il notum pupale è difficile da sezionare e correggere, rendendo difficile integrare gli studi di imaging dal vivo con anticorpi e colorazione cellulare. L'obiettivo generale di questo lavoro è quello di creare un protocollo riproducibile per sezionare e fissare il notum pupale per la colorazione di anticorpi e cellule su campioni nuovi o precedentemente fotografati dal vivo.
Quando le larve iniziano la metamorfosi, l'epidermide si allontana dalla cuticola larvale, formando un caso di pupa dura8. Il piano del corpo larvale viene scomposto e viene sviluppato il nuovo piano del corpo adulto. Durante questo periodo, le pupe sono immobili, rendendole ideali per l'imaging dal vivo. Un tessuto comunemente fotografato è il notum pupale, un epitelio monostrato adulto che si forma nel torace dorsale. Il notum è visivamente accessibile dopo una semplice dissezione per rimuovere il caso pupale9. L'intero animale può quindi essere montato e il notum può essere ripreso dal vivo per ore o giorni, rendendolo un tessuto ideale per studiare i comportamenti delle cellule epiteliali durante lo sviluppo, l'omeostasi e la successiva ferita 10,11,12,13,14. Tuttavia, il notum è difficile da sezionare e fissare perché è fragile e coperto da una sottile cuticola adulta trasparente che è idrofoba. Questa cuticola idrofoba lo rende incline all'arricciamento in soluzioni acquose quando viene rimosso dal resto del corpo. Pertanto, la dissezione e la fissazione del notum sono state riportate solo raramente e la dissezione spesso non è descritta 15,16,17,18. Senza un protocollo dettagliato in letteratura, è proibitivo per un ricercatore di Drosophila integrare l'imaging dal vivo con la colorazione delle pupe.
Questa tecnica mira a sezionare e fissare in modo riproducibile i campioni che sono stati precedentemente ripresi dal vivo, compresi quelli che sono stati feriti al laser. Poiché l'imaging dal vivo richiede la rimozione del caso pupale, questa tecnica di dissezione inizia rimuovendo il caso pupale anteriore, a differenza dei protocolli precedenti che fissano o tagliano in due le pupe all'interno del caso pupale 4,19,20. Il notum è un tessuto fragile e la ferita può esacerbare la sua fragilità. Così, per sostenere questo tessuto delicato, il tegumento (l'epitelio e la cuticola adulta trasparente attaccata) del notum e parte della testa e dell'addome vengono sezionati lontano dal resto della pupa mentre sono sempre immersi in un ambiente acquoso. Questo metodo riduce la probabilità che il tessuto si arricci e sia inutilizzabile. Questa tecnica ha colorato con successo il tessuto notum ferito già a 30 minuti dopo la ferita (Figura 1E-H) e a 3 ore dopo l'infortunio (Figura 1I-L). Questo protocollo dovrebbe essere efficace per la durata dello sviluppo del notum o della riparazione della ferita. L'attuale tecnica sarà utile per i ricercatori che desiderano unire le capacità di imaging dal vivo del notum pupale con l'abbondanza di reagenti immunoistochimici disponibili.
Protocollo
La Drosophila melanogaster (moscerini della frutta) è stata mantenuta a 25 °C su un mezzo standard di farina di mais-melassa. Gli studi sono stati condotti su pupe di istone H2A marcate con EGFP (w[*]; P{w+mC=His2Av-EGFP.C}2/SM6a). Le mosche sono state ottenute da un centro di stoccaggio pubblico (vedi Tabella dei materiali).
1. Immobilizzazione delle pupe
- Applicare una striscia da 2 "di nastro biadesivo su un vetrino per microscopio.
- Identificare le prepupe bianche in flaconcini sollevati a 25 °C e utilizzare un marcatore per indicare la loro posizione al di fuori del flaconcino. Riportare i flaconcini a 25 °C.
NOTA: Le prepupae bianche sono caratterizzate dalla loro immobilità, colore bianco e spiracoli estromessi. Questi si formano 0-1 h dopo la formazione del puparium (APF), o stadio P18. - 12-15 ore dopo, rimuovere con cura 3-4 delle pupe indicate (senza farle scoppiare) usando un cannocchiale di dissezione e raccoglierle sul vetrino del microscopio accanto al nastro.
NOTA: Le pupe saranno ora allo stadio P5 con un sacco a testa estroflesso visibile all'estremità anteriore8 delle pupe. - Posizionare le pupe ad almeno una larghezza di pupa sul nastro con i lati ventrali verso il basso.
- Posizionare una goccia di colla adesiva su un film di paraffina (vedere Tabella dei materiali) o in un coperchio del tubo della centrifuga. Immergere l'estremità di una punta della pipetta da 0,1-10 μL (senza pipetta) nella goccia di colla adesiva. Toccare due volte la punta della pipetta su un coperchio di 24 mm x 60 mm (spessore 1,5), a 1 cm x 1 cm da un angolo, creando una linea di colla adesiva ~ 1/2 della lunghezza della pupa.
- Preimpostare una pipetta da 0,2-2 μL (P2) a 2 μL e una pipetta da 200 μL (P200) a 200 μL e adattarle con punte in modo che siano pronte per essere riempite con 1x PBS + 0,1 mM Ca2+, che solidificherà rapidamente la colla adesiva a contatto.
- Inserire una pinza (vedi Tabella dei materiali) vicino al lato della testa e rimuovere delicatamente la custodia dalla parte anteriore a quella posteriore9. Rimuovi il più possibile la custodia. Afferra le gambe in via di sviluppo della pupa con un paio di pinze smussate e tira con attenzione la pupa dalla sua custodia.
NOTA: Una piccola rottura sulla porzione ventrale delle pupe non sarà dannosa per questa procedura. - Posare la pupa nell'angolo della copertina.
- Afferrare la pupa all'addome posteriore o all'ala in via di sviluppo con una pinza smussata, sollevare e posizionare il lato ventrale delle pupe verso il basso nella linea di colla adesiva.
- Riempire rapidamente la pipetta P2 con 2 μL di 1x PBS + 0,1 mM di Ca2+, e tenendola in aria, espellere quanto basta per formare una piccola bolla sulla punta (0,25-0,5 μL).
- Toccare la piccola bolla della soluzione su un lato delle pupe alla base del torace, quindi ripetere sull'altro lato.
NOTA: Questo solidificherà una piccola quantità di colla adesiva per mantenere la pupa in posizione. Generalmente, non verranno utilizzate tutte le soluzioni. - Riempire la pipetta P200 con 200 μL di 1x PBS + 0,1 mM di Ca2+, quindi posizionare la punta della pipetta sul torace ed espellere il contenuto per immergere completamente le pupe. Il resto della colla adesiva si solidificherà immediatamente.
- Rimuovere ~ 100 μL della soluzione PBS, in modo che la pupa sia appena immersa prima di procedere immediatamente al passaggio successivo.
NOTA: per i campioni non avvolti, iniziare dal passaggio 1.1. Per i campioni parzialmente sezionati feriti, iniziare dal punto 1.5. La ferimento tramite ablazione laser è stato descritto in precedenza14,21. Le fasi di immobilizzazione, dissezione e montaggio devono essere eseguite utilizzando un microscopio di dissezione.
2. Sezionare il notum
- Afferrare un paio di forbici per microdissezione che rinforzano un lato del manico contro l'indice e il medio della mano dominante, in modo che il pollice della mano dominante applichi la forza di taglio (Figura 2A, B).
- Stabilizzare il collo delle forbici contro il dito medio della mano non dominante mentre si rinforza il coverslip con l'anulare della mano non dominante.
- Tagliacci al centro dell'addome dorsale per creare un piccolo foro, ~ 0,2-0,5 mm. Qualche emolinfa di solito fuoriesce ed è un buon indicatore della violazione.
- Fai piccoli tagli di 0,5-0,75 mm attraverso il tegumento dal posteriore all'anteriore, circondando il tessuto dorsale per isolarlo. Per creare un tessuto il più piatto possibile, evitare di tagliare troppo ventralmente; solo la "cupola" dorsale del torace deve essere rimossa insieme a piccole sezioni della testa e dell'addome.
- Ripeti i tagli posteriori a anteriori dall'altra parte delle pupe.
- Ruotare lo stadio di dissezione per consentire un taglio netto attraverso la testa, se necessario.
NOTA: In questa fase, il tegumento dorsale, o notum, sarà separato dal resto della pupa. Se appare separato ma non è facilmente spostabile, alcuni tagli sotto il notum possono aiutare a spostarlo. - Aggiungere ~ 200 μL di 1x PBS al centro del coperchio e creare un canale che lo colleghi alla goccia di dissezione originale trascinando delicatamente la punta della pipetta attraverso il vetro di copertura dalla nuova goccia all'originale.
- Usando un paio di pinze smussate, spingere o trascinare delicatamente il notum isolato al centro del coverslip e ruotare, in modo che il lato interno sia rivolto verso l'alto. Non rimuovere mai il tessuto dalla goccia.
NOTA: è essenziale spostare il notum lontano dal sito di dissezione originale per evitare che eventuali residui della colla adesiva occludano il campione durante l'imaging successivo. - Tenere il notum verso il basso con la pinza smussata premendo nelle sezioni addominali o della testa. Utilizzando un paio di pinze affilate e / o espulsioni delicate di 1x PBS da una pipetta da 200 μL, rimuovere eventuali corpi adiposi rimanenti, bande muscolari o emolinfa (se presente) per esporre completamente l'epitelio monostrato e rendere l'eventuale colorazione più uniforme. Il notum sezionato dovrebbe apparire come nella Figura 3A.
- Una volta che il tessuto è pulito, utilizzare una pipetta da 200 μL per rimuovere il più possibile la soluzione PBS (insieme ai detriti e alla parte ventrale delle pupe), monitorando con un cannocchiale di dissezione per evitare di aspirare il notum.
- Una volta che la maggior parte del liquido è stata rimossa, utilizzare un tessuto assorbente per pulire con cura il resto della colla adesiva e della pupa, così come qualsiasi altro detrito che indugia sulla copertina.
NOTA: se sulla copertina rimane della colla adesiva, non causerà un problema finché è più sottile del tessuto dorsale stesso. - Aggiungere 150-200 μL di PFA al 4% (in 1x PBS) e fissare per 20 minuti a temperatura ambiente. A seconda della velocità di dissezione, 1 o più pupe possono essere sezionate durante la fissazione della prima pupa.
- Rimuovere il PFA e sostituirlo con 1x PBS per lavare il notum una volta per 30 s.
- Se si procede con la colorazione anticorpale, eseguire 5 lavaggi minuti (3 volte) in 1x PBS o 1x PBST (File supplementare 1) per permeabilizzare il tessuto se l'antigene è intracellulare.
- Conservare il campione in 1x PBS + 0,02% NaN3 durante la notte in una camera umidificata o, se si prevede di macchiare il tessuto, incubare durante la notte in soluzione di blocco (file supplementare 1).
3. Colorazione del notum
NOTA: Per la colorazione con anticorpi o macchie cellulari seguire i passaggi seguenti. -Il notum non deve essere rimosso dalla soluzione, in quanto ciò probabilmente causerà l'arricciamento del tessuto. Pertanto, adattare i protocolli di colorazione da condurre interamente sul coverslip e conservare in una camera umidificata per qualsiasi passaggio superiore a 5 minuti. Il monitoraggio dei campioni al microscopio di dissezione può aiutare a prevenire l'aspirazione accidentale del tessuto durante i lavaggi.
- Per visualizzare i bordi cellulari, incubare in 200 μL di anticorpo primario anti-FasIII Mouse IgG2a (vedi Tabella dei materiali) a concentrazione 1:8 diluita in Tampone bloccante + 0,02% NaN3 durante la notte a 4 °C.
- Lavare l'anticorpo primario in eccesso (3 volte) con 200 μL di 1x PBS + 0,02% NaN3 per 1 ora per lavaggio a temperatura ambiente.
- Eseguire l'incubazione di anticorpi secondari con 200 μL di concentrazione anti-topo 1:200 IgGa2 in Cy3 in Blocking Buffer + 0,02% NaN3 per 2 ore a temperatura ambiente.
- Lavare l'anticorpo secondario in eccesso (3 volte) con 200 μL di 1x PBS + 0,02% NaN3 per 1 ora per lavaggio a temperatura ambiente.
- Per visualizzare i nuclei, incubare i campioni in 1 μg/mL di DAPI per 45 min per consentire alla macchia di penetrare attraverso le bande muscolari; il fissaggio in un mezzo di montaggio contenente DAPI non è efficace con questo tessuto.
- Lavare il DAPI in eccesso (3 volte) con 200 μL di 1x PBS + 0,02% NaN3 per 5 minuti per lavaggio a temperatura ambiente, quindi lasciare in 200 μL di 1x PBS + 0,02% NaN3 durante la notte a 4 °C, o montare immediatamente.
4. Montaggio e visualizzazione del notum
- Dopo la colorazione, preparare un nuovo coverslip 24 × 60 (topper) con supporti.
NOTA: poiché il notum è a forma di cupola, appiattindolo completamente si ottiene un tessuto rugoso distorto. La creazione di uno spazio tra i due coverslip consente al notum di mantenere la sua forma normale. - Crea uno spazio di ~ 200 μm utilizzando distanziali realizzati con 22 x 22 coverslip (spessore n. 0, spessore ~ 100 μm), aderenti a ~ 1 cm di distanza con smalto per unghie al centro del topper.
- Per aderire, posizionare i distanziali sul topper e dipingere i bordi distali dei distanziali con un sottile strato di smalto per unghie. Lasciare asciugare.
NOTA: utilizzare solo uno smalto sottile e che cola; lo smalto spesso aggiungerà spazio aggiuntivo non necessario tra il coverslip e il topper. - Rimuovere il più possibile la soluzione acquosa dal campione.
- Applicare immediatamente due gocce (~100 μL) di mezzo di montaggio anti-dissolvenza (vedere Tabella dei materiali) sul campione.
- Se necessario, utilizzare una pinza pulita e affilata per posizionare il notum al centro della goccia media di montaggio anti-dissolvenza.
- Posizionare il coperchio con il notum su un supporto di ~ 10 x 40 mm, ad esempio un pezzo di schiuma sottile (tagliato dal materiale di imballaggio all'interno di scatole di coverslip), per elevare il campione in modo che non aderisca alla superficie di lavoro.
- Sotto un ambito di dissezione, abbassare lentamente il topper sul campione. Una volta che il mezzo di montaggio anti-dissolvenza incontra il topper, rilasciare delicatamente e consentire l'azione capillare per tirare il topper verso il basso.
NOTA: entro i primi secondi, è possibile apportare piccole regolazioni alla posizione del coverslip senza danneggiare il notum. - Posizionare un altro pezzo di schiuma sul topper e utilizzare un vetrino per microscopio standard come peso per convincere delicatamente il mezzo di montaggio anti-dissolvenza tra il coperchio del campione, il topper e i distanziali.
- Dopo 5-10 minuti, utilizzare un tessuto assorbente per allontanare qualsiasi mezzo di montaggio anti-dissolvenza in eccesso toccando delicatamente i bordi del coverslip.
- Applicare delicatamente lo smalto su ogni angolo delle coperture per farle aderire insieme. Una volta asciutto, dipingere tutti i bordi delle coperture per sigillare. Evitare di rivestire prima tutti i bordi, in quanto ciò può spesso spostare il coverslip e danneggiare il tessuto dorsale.
- Visualizzare il notum sotto microscopia a fluorescenza (vedi Tabella dei materiali) attraverso il lato dorsale e/o ventrale.
Risultati
La tecnica presentata funziona bene sul notum non avvolto (Figura 1A-D), consentendo di studiare lo sviluppo e l'omeostasi del tessuto, ad esempio la formazione delle cellule di setole meccanosensoriali poliploidi18 o il flusso anteriore al flusso posteriore delle cellule epiteliali10. Questo protocollo è applicabile anche ad un notum ablato al laser (Figura 1E-L), dove la risposta cellulare alla lesione può essere analizzata dal vivo con fluorofori endogeni come Histone2-EGFP (Figura 1B,F,J). La post-colorazione con immunoistochimica (fase 3) può rivelare molte caratteristiche, come Fasciclin III, che etichetta i bordi cellulari (Figura 1C, G, K). Inoltre, le macchie quantitative come DAPI (Figura 1A,E,I) possono essere utilizzate per valutare i cambiamenti del contenuto di DNA, compresa la poliploidia22 indotta dalla ferita.
L'attuale protocollo è particolarmente vantaggioso in quanto può essere utilizzato dopo esperimenti di imaging dal vivo a lungo termine. Poiché le pupe sono immobili, possono essere fotografate per ore (Figura 4A, B). È importante sottolineare che questo protocollo non causa cambiamenti considerevoli all'architettura o alla morfologia complessiva dell'epitelio della ferita dopo la dissezione (Figura 4B, C). Pertanto, le caratteristiche all'interno del tessuto potrebbero essere visualizzate a lungo termine e quindi ulteriormente studiate con immunoistochimica o macchie cellulari.
L'imaging in profondità all'interno dei tessuti è complesso a causa della loro opacità e i Drosophila sono rivestiti in una cuticola cerosa8 rendendo l'imaging profondo ancora più difficile. Tuttavia, con questa tecnica, un notum sezionato può essere posizionato tra due coverslip che consentono l'imaging del monostrato epiteliale da entrambi i lati: il lato apicale attraverso la cuticola (Figura 5A-D) e / o il lato basale dell'epitelio che si affaccia sulla cavità corporea (Figura 5E-H). Queste diverse viste sono ideali per visualizzare diverse strutture all'interno del tessuto. Ad esempio, la vista apicale è ideale per visualizzare i bordi delle cellule epiteliali e i nuclei che si trovano appena sotto la cuticola (Figura 5A-D). Con la vista basale, questi segnali apicali sono meno visibili (Figura 5E-H). Tuttavia, le strutture basali sono osservate al margine della ferita (Figura 5J, L frecce gialle, bianche). Queste strutture basali sono molto più luminose in quanto vi è meno occlusione nella vista basale rispetto alla vista apicale.
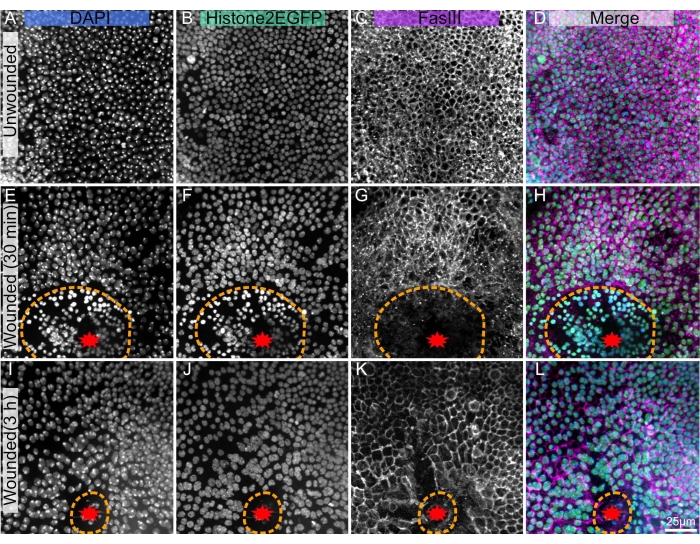
Figura 1: Drosophila pupal nota sezionata, fissa e macchiata. (A-D) Notum non avvolto. (E-H), Notum ferito 30 minuti dopo l'ablazione laser. (I-L) Notum ferito 3 ore dopo l'ablazione laser. (A,E,I) La macchia DAPI mostra nuclei. (B,F,J) Transgenic Histone2-EGFP, utilizzato nell'imaging dal vivo, è visibile dopo il fissaggio e la colorazione. (C,G,K) L'anticorpo anti-FasIII mostra che le macchie di anticorpi funzionano bene sul notum fisso. (D,H,L) Immagine unita. Le immagini vengono catturate con obiettivo 40x utilizzando la microscopia a disco rotante, le proiezioni di massima intensità degli Z-stack sono mostrate con fette Z da 0,3 μm. A-D rappresenta 263 fette Z. E-H rappresenta 195 fette. I-L rappresenta 53 fette Z. La linea tratteggiata arancione indica il margine della ferita. La barra della scala in L è 25 μm, applicabile ad A-L. Fare clic qui per visualizzare una versione più grande di questa figura.
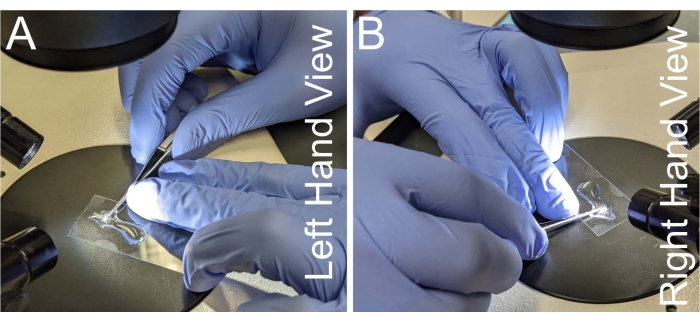
Figura 2: Posizionamento della mano per la dissezione del notum. (A-B) Viste sinistra e destra del posizionamento della mano per tenere le forbici per microdissezione. Per evitare di scuotere la mano, il collo delle forbici è posto contro il dito medio della mano non dominante. Le forbici devono essere parallele al vetrino del microscopio per evitare la deformazione del tessuto notum. Fare clic qui per visualizzare una versione più grande di questa figura.
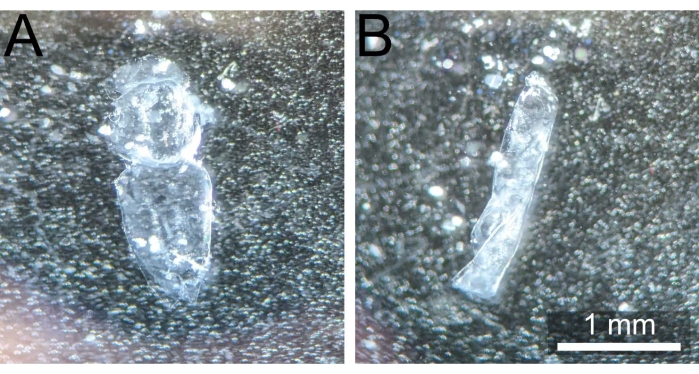
Figura 3: Notum correttamente sezionato vs notum arricciato. (A) Notum pupale post dissezione e pulizia non polimerizzato e pronto per la fissazione. (B) Pupal notum arricciato su se stesso dopo essere stato rimosso da 1x PBS, rendendolo così inutilizzabile. Fare clic qui per visualizzare una versione più grande di questa figura.
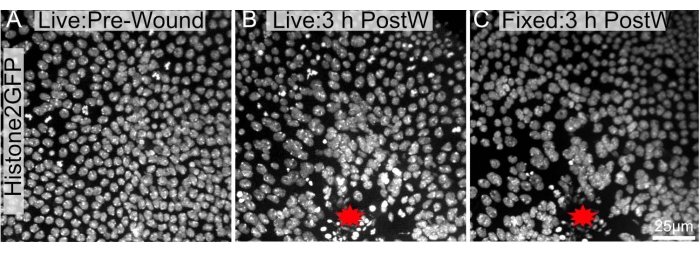
Figura 4: Le immagini pre e post-fisse sono in gran parte simili. Un notum pupale che esprime Histone2-EGFP nei nuclei è stato ripreso (A) dal vivo prima dell'ablazione e (B) 3 ore dopo l'ablazione laser. (C) Il notum è stato recuperato, sezionato e fissato come menzionato nel protocollo e ripreso dopo il fissaggio. Il sito della ferita è etichettato con una stella rossa. Le immagini sono state catturate con obiettivo 40x utilizzando la microscopia a disco rotante, le fette Z sono state prese ogni 0,3 μm. Vengono mostrate proiezioni di intensità massima di 34 fette Z pre-avvolte (A), 48 fette Z 3 ore dopo l'avvolgimento (B) e 103 fette Z post dissezione, fissazione e colorazione (C). La barra della scala in C è di 25 μm, applicabile ad A-C. Fare clic qui per visualizzare una versione più grande di questa figura.
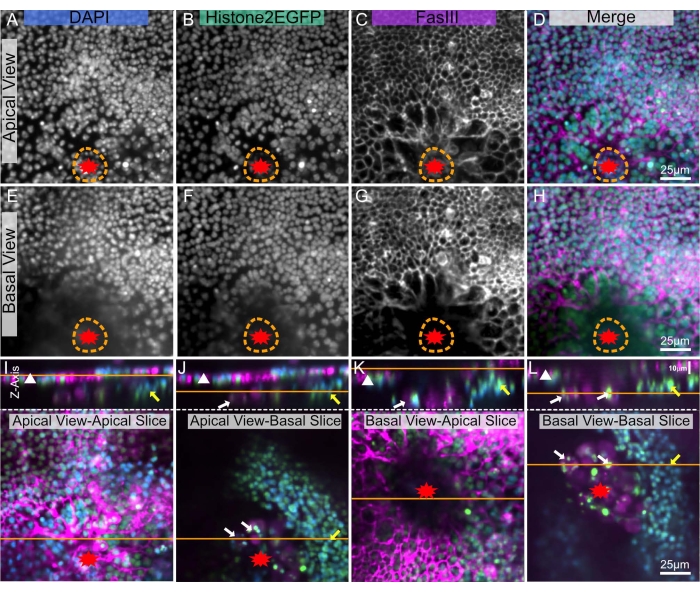
Figura 5: Imaging dei lati apicali e basali di un notum ferito. Lo stesso notum pupale ferito è mostrato in tutti i pannelli. La ferita è contrassegnata da una stella rossa. La linea tratteggiata arancione indica il margine della ferita. (A-D) Il notum è ripreso dal lato apicale, attraverso la cuticola. (E-H) Il notum è ripreso dal lato interno basale. (I-L) I pannelli superiori mostrano un'immagine X-Z del notum, lato apicale verso l'alto, con il foglio epiteliale designato da un triangolo bianco. La linea arancione denota il piano apicale-basale della fetta X-Y, mostrato nei pannelli inferiori. All'interno dei pannelli inferiori, la linea arancione mostra il piano dell'immagine X-Z sopra. (I) Notum apicalmente immaginato - fetta apicale. La vista superiore X-Z mostra l'imaging preciso del foglio epiteliale apicale (triangolo bianco). Questa vista equivale a una vista di imaging dal vivo. (J) Notum apicalmente ripreso - fetta basale, parzialmente ostruita dal tessuto apicale. Altri tessuti indicati da freccia gialla (possibile fascia muscolare) e frecce bianche (possibili cellule del sangue) sono visibili sul lato basale. (K) Notum basalmente ripreso - fetta apicale, parzialmente ostruita dal tessuto basale e dalla crosta della ferita (area centrale scura). (L) Notum basalmente ripreso - fetta basale. Questa vista mostra meglio i tessuti basali indicati con frecce gialle e bianche. A,E: colorazione DAPI, B,F: Istone-EGFP, C,G: Colorazione FasIII. Le immagini sono state catturate con obiettivo 20x con microscopia a disco rotante. Le fette Z sono state prese ogni 0,9 μm. A-D mostra la proiezione di intensità massima di 19 fette. E-H rappresenta la proiezione di intensità massima di 17 fette. Le barre di scala da 25 μm in D,H,L si applicano rispettivamente ad A-D, E-H, I-L. Fare clic qui per visualizzare una versione più grande di questa figura.
Fascicolo complementare 1: Preparazione di soluzioni e tamponi. Le ricette per le seguenti soluzioni sono dettagliate: 1xPBS, 1x PBST, soluzione di blocco e fissativo paraformaldeide. Fare clic qui per scaricare questo file.
Discussione
Passaggi critici
L'ottimizzazione di tre passaggi aumenterà notevolmente il successo di questo protocollo. Innanzitutto, nel passaggio 1.5, sii parsimonioso con la colla adesiva applicata al coperchio. Se viene aggiunta troppa colla adesiva, le pupe possono essere sepolte in uno spesso strato di colla adesiva solidificata, che renderà impossibile la dissezione, e se copre il notum stesso, la colla adesiva occluderà la luce dal campione. In secondo luogo, durante i passaggi 2.3-2.6, assicurarsi di rimuovere solo la cupola superiore del notum, escludendo il più possibile il tessuto laterale. Se incluso, il tessuto laterale si comprimerà durante il montaggio e farà sì che il centro del notum si pieghi verso l'interno, spesso posizionandolo al di fuori della distanza di lavoro degli obiettivi ad alta apertura numerica. In terzo luogo, durante la fase di pulizia 2.9, è necessario prestare estrema attenzione a non danneggiare l'epitelio monostrato. Se il tessuto ha grandi porzioni mancanti o nessun segnale può essere rilevato, questo passaggio è probabile che la colpa sia.
Risoluzione dei problemi
Problema 1: Dopo il montaggio, la pupa si stacca dal nastro biadesivo durante la dissezione. Questo è un problema comune, soprattutto per i principianti. Il miglior rimedio è quello di garantire che l'esterno della custodia delle pupe sia completamente asciutto / privo di detriti alimentari. Rimuovere il cibo con un paio di pinze smussate e lasciare asciugare la custodia all'aria per 10-15 minuti aiuterà ad aderire al nastro. In alternativa, utilizzare la mano non dominante e un paio di pinze smussate per tenere le pupe contro il nastro durante la dissezione. Se il problema persiste, applicare una piccola goccia di smalto da 5-10 μL alla base dell'estremità posteriore della custodia e permettergli di indurirsi generalmente fornisce un'adesione sufficiente anche per la più in regola delle pupe.
Problema 2: Notum collassa durante il passaggio 2.3 o la violazione iniziale attraverso il tegumento non è liscia. Se il tegumento è difficile da violare, potrebbe esserci troppa colla adesiva dalle fasi di immobilizzazione. Posizionare le pupe sezionate in meno colla adesiva migliorerà questo problema. Inoltre, assicurarsi che le forbici per microdissezione siano affilate. Le forbici smussate non saranno in grado di tagliare il tegumento e tendono a farlo collassare verso l'interno. Una volta che l'emolinfa fuoriesce dalle pupe, assicurarsi che una delle lame da taglio possa entrare nella pupa senza causare la deformazione del notum. Se il notum collassa e la lama non entra nella pupa, continua a tagliare fino a quando una lama entra nelle pupe.
Problema 3: Durante il passaggio 2.4, le forbici catturano o trascinano il tegumento. Se le forbici iniziano a catturare o trascinare il tegumento, spesso aiuta a passare al lato opposto delle pupe e procedere ad "allentare" il tegumento. Ulteriori forbici da microdissezione smussate renderanno difficile ottenere tagli puliti attraverso il tegumento e devono essere utilizzate forbici affilate.
Problema 4: Il campione viene aspirato accidentalmente durante la colorazione (passaggi 3.1-3.6). Il notum sezionato è difficile da vedere perché è trasparente. Può essere utile posizionare un foglio blu scuro o nero sotto il coperchio per fornire contrasto (un vecchio rack portapunta pipetta funziona bene). Inoltre, tutte le modifiche alla soluzione possono essere eseguite al microscopio di dissezione.
Problema 5: non viene rilevato alcun segnale/viene rilevato un segnale irregolare. Dopo aver escluso problemi specifici della macchia, se non viene rilevato alcun segnale o è irregolare, il passaggio 2.9 (pulizia) è probabilmente il colpevole. Un segnale assente o irregolare può provenire da danni e rimozione del tessuto epiteliale durante la pulizia. Al contrario, un segnale scarso può essere causato dall'occlusione dalle bande muscolari / cellule del corpo adiposo se non vengono rimosse, in quanto possono limitare la diffusione di macchie e anticorpi nel notum rispetto al tessuto circostante. Se il tessuto è danneggiato, essere più delicati durante la pulizia è la soluzione migliore. Se, invece, la macchia è visibile ma irregolare, aumentando il vigore/tempo dedicato alla fase di pulizia si consiglia di rimuovere il più possibile il muscolo e il grasso corporeo. Inoltre, aumentare la durata della macchia può aiutare a risolvere questo problema con una migliore pulizia.
Problema 6: Il tessuto notum ha un aspetto deformato / rugoso durante l'imaging. La deformazione e le rughe del tessuto provengono da due fonti. In primo luogo, la compressione del notum durante il montaggio causerà la fibbia e la deformazione. La soluzione migliore è quella di rimuovere il più possibile i tessuti laterali in modo che la cupola sia il più corta possibile e possa adattarsi tra i distanziali di copertura. In secondo luogo, se il notum è piegato durante la dissezione, questa curva non si raddrizzerà durante il montaggio, quindi è necessario prestare particolare attenzione a non deformare il notum durante la dissezione. La flessione accidentale del notum è più comune quando si taglia il tegumento lontano dal resto delle pupe. Si è tentati di avere le forbici di dissezione ad un angolo rispetto alle pupe invece di tenerle nel piano campione come le pupe. Tuttavia, le forbici angolate fanno sì che il tegumento si allaccia verso l'alto quando viene tagliato invece di rimanere piatto.
Metodi, limitazioni e applicazioni future esistenti
Wang et al.20 hanno riportato un protocollo di dissezione comparabile per l'isolamento dell'epitelio pupale. Questa tecnica richiede che la pupa rimanga all'interno del suo caso e sia rapidamente tagliata in due con un bisturi. Questo protocollo non è compatibile con i campioni precedentemente ripresi dal vivo, poiché l'imaging dal vivo richiede la rimozione di un'ampia sezione del caso pupale. Poiché le pupe mancano di rigidità, la bisezione pupale al di fuori del caso ha rovinato il tessuto, ispirando la creazione di questo protocollo. La tecnica qui descritta consente l'isolamento e la fissazione del notum e potrebbe essere utilizzata come primo passo per una vasta gamma di altri metodi come la criosezione, l'ibridazione in situ o la microscopia elettronica.
Questa tecnica ha alcune limitazioni. In primo luogo, sezionare, fissare e colorare il notum richiede più tempo rispetto alle proteine marcate fluorescenti nel notum, che richiede solo una semplice dissezione per rimuovere il caso pupale 9,23. In secondo luogo, rispetto alle dissezioni di altri tessuti Drosophila, questa dissezione è più difficile a causa del tessuto sottile e fragile e della cuticola idrofoba. Per la semplice visualizzazione delle proteine negli epiteli di Drosophila, l'immunoistochimica su embrioni fissi, dischi delle ali larvali o ovaie è più facile. Tuttavia, questa tecnica consente di abbinare la potenza dell'imaging dal vivo alla fissazione e alla colorazione, rendendolo uno strumento potente una volta padroneggiato.
Una tecnica di dissezione / fissazione ha alcuni vantaggi rispetto all'imaging dal vivo. Le strutture basali (interne) possono essere risolte meglio con una vista basale (Figura 5L,J). Ancora più importante, l'imaging dal vivo è limitato ai fluorofori che devono essere forniti geneticamente, spesso richiedendo lunghi schemi di incrocio genetico. Al contrario, il presente protocollo consente l'applicazione di macchie, immunoistochimica e altre tecniche che richiedono dissezione e fissazione. Ciò aumenta drasticamente il numero di segnali sondati nel tessuto, riducendo potenzialmente il tempo per i risultati sperimentali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. M. Shane Hutson per aver stabilito il sistema di ablazione laser utilizzato per le ferite delle pupe e il suo contributo e feedback sullo sviluppo del protocollo. Questo lavoro è stato supportato da 1R01GM130130 ad APM e M. Shane Hutson. JW è stato supportato da 2T32HD007502-21.
Materiali
| Name | Company | Catalog Number | Comments |
| ½” Scotch Permanent Double-Sided tape | Scotch 3M | 665 | |
| 0.1-10 µL uTIP pipette tip | Biotix | M-0011-9FC | |
| 22 x 22 mm No. 0 thickness coverslips | Thomas Scientific | 1207Z28 | |
| 24 x 60 mm coverslip | Corning | 2980-246 | |
| 3M VetBond | 3M | 1469SB | Called "adhesive glue" in protocol |
| Anti-FasIII primary Mouse IgG2a | Developmental Studies Hybridoma Bank | 7G10 | |
| Calcium Chloride | Fisher Chemical | c79-500 | |
| Cy3-conjugated AffiniPure Goat Anti-Mouse IgG2a | Jackson ImmunoResearch | 115-165-206 | |
| DAPI | Sigma Aldrich | D9542-1mg | |
| Dumont #5 Fine Tip Forceps | Fine Science Tools | No. 11254-20 | |
| Dumont #5 Fine Tip Forceps: Blunt | Fine Science Tools | No. 11254-20 | Heavily used and unsharpened forceps, or dulled with a whetstone |
| Fisherbrand Double frosted microscope slides | Fisher Scientific | 22-034-486 | |
| Fluorescent Light Source | Lumencor | Celesta 90-10512 | |
| Fly Stock: EGFP-tagged Histone H2A | Bloomington Drosophila Stock Center | 24163 | |
| Fly Vial Foam Plugs "Flugs" | Genesee Scientific | 49-101 | |
| Humidified Chamber: Foil-wrapped small container lined with filter paper saturated with water | Cole-Parmer | 759075D | A great humidified chamber can be made from the styrofoam box containing Cole-Parmer cuvettes, 759075D, filled with 50 ml water. |
| KimWipe | KimTech | 34155 | Called "Absorbent Tissue" in protocol |
| Nikon Ti2 Eclipse | Nikon | Eclipse Ti2-E | |
| NIS Elements Software | Nikon | AR | |
| Parafilm | Pechiney Plastic Packaging | PM-996 | |
| Paraformaldehyde (PFA) 16% | Ted Pella, Inc | 18505 | |
| Plastic Vials | Genesee Scientific | 32-114 | |
| Sodium Azide (NaN3) | Fisher Scientific | 19038-1000 | |
| Stereo Microdissection Scope | Carl Zeiss | STEMI 2000 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | New or freshly sharpened scissors |
| Vecta Shield | Vector Laboratories | H-1000 | Called " antifade mounting medium" in protocol |
| Vecta Shield with DAPI | Vector Laboratories | H-1200 | Not ideal for pupal notum. |
| X-Light V2 Spinning Disc | Crest Optics | V2 L-FOV |
Riferimenti
- Valon, L., et al. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination. Developmental Cell. 56 (12), 1700-1711 (2021).
- Levayer, R., Dupont, C., Moreno, E. Tissue crowding induces caspase-dependent competition for space. Current Biology. 26 (5), 670-677 (2016).
- Couturier, L., et al. Regulation of cortical stability by RhoGEF3 in mitotic sensory organ precursor cells in Drosophila. Biology Open. 6 (12), 1851-1860 (2017).
- Couturier, L., Mazouni, K., Corson, F., Schweisguth, F. Regulation of Notch output dynamics via specific E(spl)-HLH factors during bristle patterning in Drosophila. Nature Communications. 10, 3486 (2019).
- Fujisawa, Y., Shinoda, N., Chihara, T., Miura, M. ROS regulate caspase-dependent cell delamination without apoptosis in the drosophila pupal notum. iScience. 23, 101413 (2020).
- Besson, C., et al. Planar cell polarity breaks the symmetry of par protein distribution prior to mitosis in drosophila sensory organ precursor cells. Current Biology. 25 (8), 1104-1110 (2015).
- Koto, A., Kuranaga, E., Miura, M. Apoptosis ensures spacing pattern formation of drosophila sensory organs. Current Biology. 21, 278-287 (2011).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Moreira, C., Regan, J., Zaidman-Rémy, A., Jacinto, A., Prag, S. Drosophila hemocyte migration: an in vivo assay for directional cell migration. Methods in Molecular Biology. 769, 249-260 (2011).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. Elife. 4, 08519 (2015).
- Cristo, I., Carvalho, L., Ponte, S., Jacinto, A. Novel role for Grainy head in the regulation of cytoskeletal and junctional dynamics during epithelial repair. Journal of Cell Science. 131 (17), 213595 (2018).
- Bellaïche, Y., Gho, M., Kaltschmidt, J. A., Brand, A. H., Schweisguth, F. Frizzled regulates localization of cell-fate determinants and mitotic spindle rotation during asymmetric cell division. Nature Cell Biology. 3 (1), 50-57 (2001).
- Shannon, E. K. Multiple mechanisms drive calcium signal dynamics around laser-induced epithelial wounds. Biophysical Journal. 113 (7), 1623-1635 (2017).
- O'Connor, J. T., et al. Proteolytic activation of Growth-blocking peptides triggers calcium responses through the GPCR Mthl10 during epithelial wound detection. Developmental Cell. 56 (15), 2160-2175 (2021).
- Hartenstein, V., Posakony, J. W. Development of adult sensilla on the wing and notum of Drosophila melanogaster. Development. 107 (2), 389-405 (1989).
- Yeh, E., Zhou, L., Rudzik, N., Boulianne, G. L. Neuralized functions cell autonomously to regulate Drosophila sense organ development. The EMBO Journal. 19 (17), 4827-4837 (2000).
- Loubéry, S., et al. Uninflatable and notch control the targeting of sara endosomes during asymmetric division. Current Biology. 24 (18), 2142-2148 (2014).
- Kawamori, A., Shimaji, K., Yamaguchi, M. Dynamics of endoreplication during Drosophila posterior scutellar macrochaete development. PLoS One. 7 (6), 38714 (2012).
- Couturier, L., Schweisguth, F., Bellen, H. J., Yamamoto, S. . Notch Signaling: Methods and Protocols. , 79-86 (2014).
- Wang, W., Yoder, J. H. Drosophila pupal abdomen immunohistochemistry. Journal of Visualized Experiments. (56), e3139 (2011).
- Kiehart, D. P., et al., Celis, J. E., et al. . Cell Biology (Third Edition). , 87-103 (2006).
- Bailey, E. C., Dehn, A. S., Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. A Drosophila model to study wound-induced polyploidization. Journal of Visualized Experiments. (160), e61252 (2020).
- O’Connor, J. T., S, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protocols. , (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon