Method Article
ניתוח, תיקון והדמיה של ה-Drosophila Pupal Notum
In This Article
Summary
הפרוטוקול הנוכחי מפרט את ההכנה וההדמיה של רקמה קבועה של נוטום דרוזופילה פופאל. זה יכול לשמש עבור רקמה שלמה או פצועה, ואת הארכיטקטורה המקורית של הרקמה נשמרת. ההליכים לניתוח, תיקון וצביעה מתוארים כולם במאמר זה.
Abstract
הגלמים של Drosophila melanogaster אינם משותקים במשך מספר ימים במהלך מטמורפוזה, שבמהלכם הם מפתחים גוף חדש עם כסות בוגרת דקה ושקופה. חוסר התנועה והשקיפות שלהם הופכים אותם לאידיאליים לניסויים בהדמיה חיה in vivo . מחקרים רבים התמקדו במונולייה האפיתל הגבית של ה-pupal notum בגלל הנגישות שלו וגודלו הגדול יחסית. בנוסף למחקרים של מכניקת אפיתל והתפתחות, הנוטום היה רקמה אידיאלית לחקר ריפוי פצעים. לאחר פציעה, ניתן ללכוד את כל תהליך תיקון האפיתל על ידי הדמיה חיה במשך 6-12 שעות. למרות הפופולריות של ה-notum להדמיה חיה, מעט מאוד מחקרים שפורסמו השתמשו בדגימות נוטום קבועות. קיבוע וכתמים הם גישות נפוצות עבור כמעט כל רקמות Drosophila אחרות, תוך ניצול הרפרטואר הגדול של כתמים תאיים פשוטים ונוגדנים. עם זאת, ה-pupal notum שברירי ונוטה לסלסול ועיוות לאחר ההסרה מהגוף, מה שהופך אותו למאתגר להשלים הדמיה חיה. פרוטוקול זה מציע שיטה פשוטה לתיקון וכתם של ה-pupal notum, הן בשלמותו והן לאחר פציעת לייזר. בטכניקה זו, הצד הגחוני של הגלם מודבק כלפי מטה לכיסוי כדי לשתק את הגלם, והנוטום מוסר בקפידה, מקובע ומוכתם. אפיתל הנוטום מותקן על מגלשה או בין שני קליפים כדי להקל על ההדמיה מהצד הגבי או הגחוני של הרקמה.
Introduction
ה-pupal notum של Drosophila melanogaster שימש יותר ויותר למחקרי הדמיה חיים בעשור האחרון מכיוון שהחיה היא גם חסרת תנועה וגם בעלת קוטיקולה שקופה בשלב זה 1,2,3,3,4,5,6,7. עם זאת, קשה לנתח ולתקן את ה-pupal notum, מה שמקשה על השלמת מחקרי הדמיה חיים עם צביעת נוגדנים ותאים. המטרה הכוללת של עבודה זו היא ליצור פרוטוקול הניתן לשחזור לניתוח ותיקון של ה-pupal notum עבור כתמי נוגדנים ותאים על דגימות חדשות או שצולמו בעבר בשידור חי.
כאשר הזחלים מתחילים מטמורפוזה, האפידרמיס מתרחק מציפורן הזחל, ויוצר מקרה pupal קשה8. תוכנית הגוף של הזחל מתפרקת, ותוכנית הגוף הבוגרת החדשה מפותחת. במהלך תקופה זו, הגלמים הם חסרי תנועה, מה שהופך אותם אידיאליים להדמיה חיה. אחת הרקמה הנפוצה היא ה-pupal notum, אפיתל חד-שכבתי בוגר שנוצר בבית החזה הגבי. הנוטום נגיש מבחינה ויזואלית לאחר כריתה פשוטה כדי להסיר את המקרה pupal9. לאחר מכן ניתן להרכיב את החיה כולה, וניתן לצלם את הנוטום בשידור חי במשך שעות או ימים, מה שהופך אותו לרקמה אידיאלית לחקר התנהגויות תאי אפיתל במהלך ההתפתחות, ההומאוסטזיס, ולאחר פציעת 10,11,12,13,14. עם זאת, הנוטום מאתגר לנתח ולתקן מכיוון שהוא שביר ומכוסה בציפורן בוגרת דקה ושקופה שהיא הידרופובית. זה צידוק הידרופובי עושה את זה נוטה סלסול בתמיסות מימיות כאשר מוסרים משאר הגוף. לפיכך, נתיחה וקיבוע של notum דווחו רק לעתים רחוקות והניתוחה אינה מתוארת לעתים קרובות 15,16,17,18. ללא פרוטוקול מפורט בספרות, קשה מאוד לחוקר דרוזופילה להשלים הדמיה חיה עם צביעה של גלמים.
טכניקה זו נועדה לשחזר ולתקן דגימות שצולמו בעבר בשידור חי, כולל אלה שנפצעו בלייזר. מכיוון שהדמיה חיה דורשת הסרה של מארז הפופל, טכניקת דיסקציה זו מתחילה בהסרת נרתיק הפופל הקדמי, בניגוד לפרוטוקולים קודמים שמצמידים או מנתחים גלמים בתוך מארז הפופאל 4,19,20. הנום הוא רקמה שברירית, ופציעה עלולה להחריף את שבריריותה. לכן, כדי לתמוך ברקמה עדינה זו, הכסות (האפיתל והציפורן הבוגר השקוף המחובר) של הנוטום וחלק מהראש והבטן מנותחים הרחק משאר הגלם בעודם שקועים תמיד בסביבה מימית. שיטה זו מפחיתה את הסבירות שהרקמה תסתלסל ותהיה בלתי שמישה. טכניקה זו הכתימה בהצלחה רקמת נוטום פצועה כבר ב-30 דקות לאחר הפציעה (איור 1E-H) וב-3 שעות לאחר הפציעה (איור 1I-L). פרוטוקול זה צפוי להיות יעיל למשך פיתוח נוטום או תיקון פצעים. הטכניקה הנוכחית תסייע לחוקרים המעוניינים לאחד את יכולות ההדמיה החיה של ה-pupal notum עם שפע הריאגנטים האימונוהיסטוכימיה הזמינים.
Protocol
Drosophila melanogaster (זבובי פירות) נשמרו בטמפרטורה של 25 מעלות צלזיוס על מדיום סטנדרטי של קמח תירס-מולסה. המחקרים נערכו על גולמי היסטון H2A המתויגים על ידי EGFP (w[*]; P{w+mC=His2Av-EGFP.C}2/SM6a). הזבובים התקבלו ממרכז מניות ציבורי (ראו טבלת חומרים).
1. שיתוק גלמים
- יש למרוח רצועה בגודל 2 אינץ' של סרט הדבקה דו-צדדי על שקופית מיקרוסקופ.
- זהה פרה-פופים לבנים בבקבוקונים המוגבהים ב-25 מעלות צלזיוס, והשתמש בסמן כדי לציין את מיקומם מחוץ לבקבוקון. החזירו את הבקבוקונים ל-25 מעלות צלזיוס.
הערה: פרה-פופים לבנים מאופיינים בחוסר התנועה שלהם, בצבע הלבן ובספירקלים האוורקטיים שלהם. אלה יוצרים 0-1 שעות לאחר היווצרות puparium (APF), או שלב P18. - 12-15 שעות לאחר מכן, הסר בזהירות 3-4 מהגלמים המצוינים (מבלי להקפיץ אותם) באמצעות היקף דיסקציה ואסוף אותם על שקופית המיקרוסקופ שליד הקלטת.
הערה: הגלמים יהיו כעת שלב P5 עם שק ראש מחודד הנראה בקצה הקדמי של הגלם8. - מניחים את הגלמים במרחק של לפחות רוחב גולם אחד זה מזה על הקלטת כשצדי הגחון שלהם למטה.
- הניחו טיפה של דבק דבק על סרט פרפין (ראו טבלת חומרים) או במכסה צינור צנטריפוגה. טובלים את הקצה של קצה פיפטה של 0.1-10 μL (ללא פיפטה) בטיפה של דבק דבק. הקישו פעמיים על קצה הפיפטה על מכסה בגודל 24 מ"מ על 60 מ"מ (עובי 1.5), במרחק של 1 ס"מ על 1 ס"מ מהפינה, ויצרו קו של דבק דבק באורך של כ-1/2 מאורך הגלם.
- הגדירו מראש פיפטה של 0.2-2 מיקרול(P2) ל-2 מיקרול'ל, ופיפטה של 200 מיקרול' (P200) ל-200 מיקרול', והתאימו להם קצוות כך שיהיו מוכנים למילוי ב-1x PBS + 0.1 mM Ca2+, שימצקו במהירות את הדבק הדבק במגע.
- הכנס מלקחיים (ראה טבלת חומרים) ליד צד הראש והסר בעדינות את המארז מהחלק הקדמיל-9 האחורי. הסר כמה שיותר מהמקרה. תפסו את רגליו המתפתחות של הגלם עם זוג מלקחיים קהים ומשכו בזהירות את הגלם מהנרתיק שלו.
הערה: קרע קטן בחלק הגחוני של הגלמים לא יזיק להליך זה. - הניחו את הגלמים בפינת הכיסוי.
- תפסו את הגלם בבטן האחורית או בכנף המתפתחת עם מלקחיים קהים, הרימו והניחו את הצד הגחוני של הגלם כלפי מטה לתוך קו הדבקה.
- מלא במהירות את הפיפטה P2 עם 2 μL של 1x PBS + 0.1 mM של Ca2+, והחזקתו באוויר, גרש מספיק כדי ליצור בועה קטנה בקצה (0.25-0.5 μL).
- גע בבועה הקטנה של התמיסה לצד אחד של הגלמים בבסיס בית החזה, ואז חזור על הפעולה בצד השני.
הערה: פעולה זו תמצק כמות קטנה של דבק הדבק כדי להחזיק את הגלם במקומו. בדרך כלל, לא ייעשה שימוש בכל הפתרונות. - מלאו את הפיפטה P200 ב-200 μL של 1x PBS + 0.1 mM של Ca2+, ואז הניחו את קצה הפיפטה על בית החזה והוציאו את התוכן כדי להטביע את הגלמים לחלוטין. שארית הדבק יתמצק מיד.
- הסר כ-100 μL של תמיסת PBS, כך שהגלמים בקושי שקועים לפני שהם ממשיכים מיד לשלב הבא.
הערה: עבור דוגמאות שלא שולמו, התחל משלב 1.1. עבור דגימות פצועים שנותחו חלקית, התחל בשלב 1.5. פציעה באמצעות אבלציה בלייזר תוארה בעבר14,21. יש לבצע את שלבי האימוביליזציה, הנתיחה וההרכבה באמצעות מיקרוסקופ דיסקציה.
2. ניתוח הנום
- תפסו זוג מספריים של מיקרו-דיסקציה שמצמידים צד אחד של הידית לאצבע המורה ולאצבע האמצעית של היד הדומיננטית, כך שהאגודל של היד הדומיננטית מפעיל את כוח החיתוך (איור 2A,B).
- ייצבו את צוואר המספריים כנגד האצבע האמצעית של היד הלא דומיננטית תוך כדי ליטוף הכיסוי עם אצבע הטבעת של היד הלא דומיננטית.
- חותכים באמצע הבטן הגבית כדי ליצור חור קטן, ~0.2-0.5 מ"מ. חלק מההמולימף בדרך כלל יישפך החוצה והוא אינדיקציה טובה להפרה.
- בצע חתכים קטנים של 0.5-0.75 מ"מ דרך הכסות האחורית לקדמית, תוך כיתור הרקמה הגבית כדי לבודד אותה. כדי ליצור רקמה שטוחה ככל האפשר, הימנע חיתוך גחוני מדי; יש להסיר רק את 'הכיפה' הגבית של בית החזה יחד עם חלקים קטנים של הראש והבטן.
- חזרו על חתכים אחוריים קדמיים בצד השני של הגלמים.
- סובבו את שלב הנתיחה כדי לאפשר חיתוך נקי בראש במידת הצורך.
הערה: בשלב זה, הכסות הגבית, או נוטום, תופרד משאר הגלמים. אם הוא נראה מופרד אך לא מועבר בקלות, כמה חתכים מתחת לנוטום יכולים לעזור להיפטר ממנו. - הוסיפו כ-200 μL של 1x PBS למרכז הכיסוי וצרו תעלה המחברת אותה לטיפת הנתיחה המקורית על ידי גרירה עדינה של קצה הפיפטה על פני זכוכית הכיסוי מהטיפה החדשה אל המקור.
- באמצעות זוג מלקחיים קהים, דוחפים או גוררים בעדינות את הנוטום המבודד למרכז הכיסוי ומסובבים, כך שהצד הפנימי פונה כלפי מעלה. לעולם אל תסיר את הרקמה מהטיפה.
הערה: חיוני להרחיק את הנוטום מאתר הנתיחה המקורי כדי למנוע שרידים של דבק הדבק שחוסם את הדגימה במהלך הדמיה מאוחרת יותר. - החזיקו את הנוטום עם המלקחיים הבוטים על ידי לחיצה לתוך חלקי הבטן או הראש. באמצעות זוג מלקחיים חדים ו/או גירושים עדינים של 1x PBS מפיפטה של 200 μL, הסר את כל שאריות השומן בגוף, רצועות השרירים או ההמולימפה (אם קיימות) כדי לחשוף באופן מלא את האפיתל החד-שכבתי יותר ולהפוך את הכתם הסופי לאחיד יותר. הנוטום המנותח אמור להופיע כמו באיור 3A.
- לאחר שהרקמה נקייה, השתמש בפיפטה של 200 μL כדי להסיר כמה שיותר מתמיסת ה- PBS (יחד עם פסולת ואת החלק הגחוני של הגלם), ניטור עם היקף דיסקציה כדי למנוע שאיפה לנוטום.
- לאחר שרוב הנוזלים הוסרו, השתמשו ברקמה סופגת כדי לנגב בזהירות את שאר הדבק והגרם, כמו גם כל פסולת אחרת שנשארת על הכיסוי.
הערה: אם נשאר דבק דביק כלשהו על הכיסוי, הוא לא יגרום לבעיה כל עוד הוא דק יותר מהרקמה הגבית עצמה. - הוסף 150-200 μL של 4% PFA (ב 1x PBS) ותקן במשך 20 דקות בטמפ ' החדר. בהתאם למהירות הנתיחה, ניתן לנתח גולם אחד או יותר במהלך הקיבעון של הגלם הראשון.
- הסר את ה- PFA והחלף אותו ב- 1x PBS כדי לשטוף את ה- notum פעם אחת במשך 30 שניות.
- אם ממשיכים עם צביעת נוגדנים, בצע שטיפות של 5 דקות (3 פעמים) ב- 1x PBS או 1x PBST (קובץ משלים 1) כדי לחלחל לרקמה אם האנטיגן הוא תוך תאי.
- אחסן את הדגימה ב- 1x PBS + 0.02% NaN3 למשך הלילה בתא לח, או אם אתה מתכנן להכתים את הרקמה, דגירה למשך הלילה בתמיסת חסימה (קובץ משלים 1).
3. צביעת הנוטום
הערה: לצביעה באמצעות נוגדנים או כתמים תאיים בצע את השלבים הבאים. -אין להסיר את הנוטום מהתמיסה, שכן סביר להניח שהדבר יגרום לרקמה להתכרבל. לפיכך, התאימו את פרוטוקולי הכתם כך שיתנהלו במלואם על הכיסוי ושמרו בתא לח למשך כל שלב ארוך יותר מ-5 דקות. ניטור הדגימות תחת מיקרוסקופ דיסקציה יכול לסייע במניעת שאיפה מקרית של הרקמה במהלך שטיפות.
- כדי לדמיין את גבולות התא, דגירה ב-200 μL של נוגדן IgG2a ראשוני נגד FasIII של העכבר (ראה טבלת חומרים) בריכוז של 1:8 מדולל במאגר חסימה + 0.02% NaN3 לילה ב-4 °C (4 °C).
- שטפו את עודפי הנוגדן הראשוני (3 פעמים) עם 200 μL של 1x PBS + 0.02% NaN3 למשך שעה אחת לכל כביסה בטמפרטורת החדר.
- בצע דגירה משנית של נוגדנים עם 200 μL של ריכוז 1:200 נגד עכבר IgGa2 ב- Cy3 ב- Blocking Buffer + 0.02% NaN3 למשך 2 שעות בטמפ ' החדר.
- שטפו את עודפי הנוגדן המשני (3 פעמים) עם 200 μL של 1x PBS + 0.02% NaN3 למשך שעה אחת לכל כביסה בטמפרטורת החדר.
- כדי לדמיין את הגרעינים, דגירו דגימות ב-1 מיקרוגרם/מ"ל של DAPI למשך 45 דקות כדי לאפשר מספיק זמן לכתם לחדור דרך רצועות השרירים; תיקון במדיום הרכבה המכיל DAPI אינו יעיל עם רקמה זו.
- יש לשטוף את עודפי ה-DAPI (3 פעמים) עם 200 μL של 1x PBS + 0.02% NaN3 למשך 5 דקות לכל כביסה בטמפרטורת החדר, ואז להשאיר ב-200 μL של 1x PBS + 0.02% NaN3 למשך הלילה ב-4 מעלות צלזיוס, או להרכיב מיד.
4. הרכבה והדמיה של הנוטום
- לאחר ההכתמה, הכינו 24 × 60 כיסויים (טופר) חדשים עם תמיכות.
הערה: מכיוון שהנוטום הוא בצורת כיפה, שיטוחו לחלוטין גורם לרקמה מקומטת מעוותת. יצירת רווח בין שני הכיסויים מאפשרת לנוטום לשמור על צורתו הרגילה. - צרו מרווח של כ-200 מיקרומטר על ידי שימוש במרווחים העשויים מ-22 x 22 כיסויים (עובי מס' 0, בעובי של כ-100 מיקרומטר), המודבקים כ-1 ס"מ זה מזה עם לק באמצע הטופר.
- כדי להיצמד, מניחים את המרווחים על הטופר וצובעים את הקצוות הדיסטליים של המרווחים בשכבה דקה של לק. תנו לייבוש.
הערה: השתמש רק בלק לציפורניים דק ומנוזל; לק עבה יוסיף רווח נוסף מיותר בין הכיסויים והטופר. - הסר כמה שיותר מהתמיסה מימית מהמדגם.
- יש למרוח מיד שתי טיפות (כ-100 μL) של מדיום הרכבה נגד דהייה (ראו טבלת חומרים) על הדגימה.
- במידת הצורך, השתמש במלקחיים נקיים וחדים כדי למקם את הנוטום במרכז הטיפה הבינונית המורכבת נגד דהייה.
- הניחו את הכיסוי עם ה-notum על תמיכה של כ-10x40 מ"מ, כגון חתיכת קצף דקה (שנחתכה מחומר האריזה בתוך קופסאות כיסוי), כדי להעלות את הדגימה כך שהיא לא תיצמד למשטח העבודה.
- תחת טווח דיסקציה, הורידו באיטיות את הטופר אל המדגם. ברגע שמדיום ההרכבה נגד דהייה פוגש את הטופר, שחררו בעדינות ואפשרו לפעולה נימית למשוך את החלק העליון למטה.
הערה: במהלך השניות הראשונות, ניתן לבצע התאמות קלות למצב הכיסוי מבלי לפגוע בנוטום. - הניחו פיסת קצף נוספת על הטופר והשתמשו במגלשת מיקרוסקופ סטנדרטית כמשקל כדי לשדל בעדינות את מדיום ההרכבה נגד דהייה בין כיסוי הדגימה, הטופר והמרווחים.
- לאחר 5-10 דקות, השתמשו ברקמה סופגת כדי לנתק כל עודף של מדיום הרכבה נגד דהייה על ידי נגיעה עדינה בשולי הכיסוי.
- יש למרוח בעדינות את הלק על כל פינה של הכיסויים כדי להדביק אותם זה לזה. לאחר הייבוש, צבעו את כל הקצוות של הכיסויים כדי לאטום אותם. הימנעו תחילה מציפוי כל הקצוות, שכן לעתים קרובות זה יכול להזיז את הכיסוי ולפגוע ברקמת הגב.
- דמיינו את הנוטום תחת מיקרוסקופיה פלואורסצנטית (ראו טבלת חומרים) דרך הצד הגבי ו/או הגחון.
תוצאות
הטכניקה המוצגת פועלת היטב על הנוטום הלא-מנודד (איור 1A-D), ומאפשרת לחקור את ההתפתחות וההומאוסטזיס של הרקמה, למשל, היווצרות תאי הזיפים הפוליפלואידיים המכנוזנסוריים18, או הקדמי לזרימה האחורית של תאי אפיתל10. פרוטוקול זה ישים גם לנוטום עם אבלום בלייזר (איור 1E-L), שבו ניתן לנתח את התגובה התאית לפציעה בשידור חי עם פלואורופורים אנדוגניים כמו Histone2-EGFP (איור 1B,F,J). לאחר הכתמה באמצעות אימונוהיסטוכימיה (שלב 3) ניתן לגלות תכונות רבות, כגון Fasciclin III, המסמנת גבולות תאים (איור 1C,G,K). בנוסף, ניתן להשתמש בכתמים כמותיים כגון DAPI (איור 1A,E,I) כדי להעריך שינויים בתכולת הדנ"א, כולל פוליפלואידיה הנגרמת על-ידי פצע22.
הפרוטוקול הנוכחי מועיל במיוחד מכיוון שניתן להשתמש בו לאחר ניסויי הדמיה חיים ארוכי טווח. מכיוון שהגלמים אינם משותקים, ניתן לדמות אותם במשך שעות (איור 4A,B). חשוב לציין שפרוטוקול זה אינו גורם לשינויים משמעותיים בארכיטקטורה הכוללת או במורפולוגיה של אפיתל הפצע לאחר כריתה (איור 4B,C). לפיכך, ניתן היה לדמות תכונות בתוך הרקמה לטווח ארוך ולאחר מכן לחקור אותן עוד יותר באמצעות אימונוהיסטוכימיה או כתמים תאיים.
הדמיה עמוקה בתוך רקמות היא מורכבת בשל האטימות שלהן, ודרוזופילה מצופים בציפוי שעווה8 מה שמקשה עוד יותר על הדמיה עמוקה. עם זאת, בטכניקה זו, ניתן למקם נוטום מנותק בין שני כיסויים המאפשרים הדמיה של מונולאי האפיתל משני הצדדים: הצד האפיקלי דרך הציפורן (איור 5A-D) ו/או הצד הבסיסי של האפיתל הפונה לחלל הגוף (איור 5E-H). השקפות שונות אלה מתאימות באופן אידיאלי כדי לדמיין מבנים שונים בתוך הרקמה. לדוגמה, התצוגה האפיקלית אידיאלית להדמיה של גבולות תאי אפיתל וגרעינים שנמצאים ממש מתחת לציפורן (איור 5A-D). במבט הבסיסי, האותות האפיקליים האלה פחות נראים לעין (איור 5E-H). עם זאת, מבנים בסיסיים נצפים בשולי הפצע (איור 5J,L חצים צהובים ולבנים). מבנים בסיסיים אלה בהירים הרבה יותר מכיוון שיש פחות חסימה בראייה הבסיסית מאשר בראייה האפית.
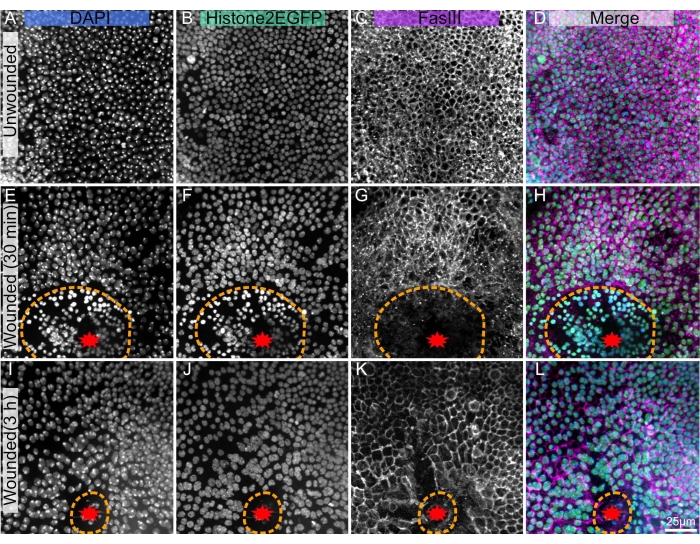
איור 1: דרוזופילה פופאל נוטאה (Drosophila pupal nota) (A-D) לא מנוצחת. (E-H), נוטום פצוע 30 דקות לאחר אבלציה בלייזר. (א-ל) פצוע נוטום 3 שעות לאחר אבלציה בלייזר. (א,ה,א) כתם DAPI מראה גרעינים. (ב,פ,י)) Histone2-EGFP מהונדס, המשמש בהדמיה חיה, נראה לאחר תיקון וצביעה. (ג,ז',ק') הנוגדן anti-FasIII מראה שכתמי נוגדנים פועלים היטב על הנוטום הקבוע. (ד,ח,ל) תמונה ממוזגת. התמונות נלכדות עם מטרה של פי 40 באמצעות מיקרוסקופיית דיסק מסתובבת, הקרנות בעוצמה מרבית של ערימות Z מוצגות עם פרוסות Z של 0.3 מיקרומטר. A-D מייצג 263 פרוסות Z. E-H מייצג 195 פרוסות. I-L מייצג 53 פרוסות Z. הקו המקווקו הכתום מציין את שולי הפצע. סרגל קנה המידה ב-L הוא 25 מיקרומטר, החל על A-L. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
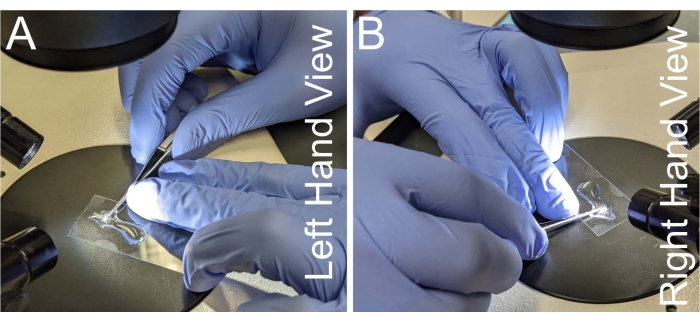
איור 2: מיקום יד עבור כריתת נוטום. (A-B) מבטים שמאליים וימניים על מיקום היד להחזקת מספריים מיקרו-דיסקציה. כדי למנוע רעד יד, צוואר המספריים ממוקם על האצבע האמצעית של היד הלא דומיננטית. מספריים צריכים להיות מקבילים לשקופית המיקרוסקופ כדי למנוע את העיקום של רקמת הנום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
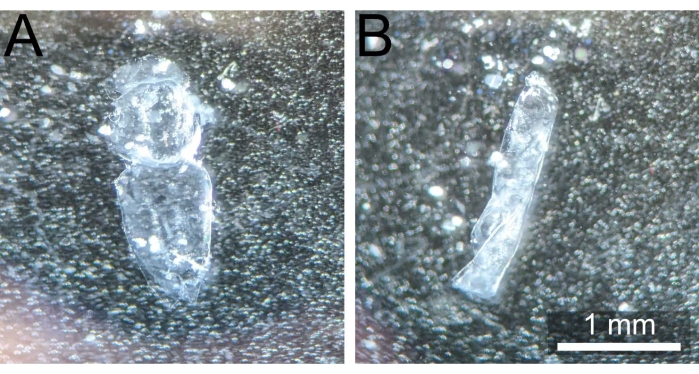
איור 3: נוטום מנותח כהלכה לעומת נוטום מכורבל. (A) Pupal notum לאחר כריתה וניקוי לא מתוחכם ומוכן לקיבוע. (B) Pupal notum התכרבל על עצמו לאחר שהוסר מ-1x PBS, ובכך הפך אותו לבלתי שמיש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
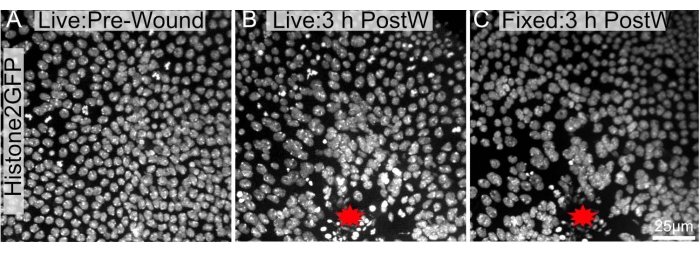
איור 4: תמונות לפני ואחרי תיקון דומות במידה רבה. נואטום פופאל המבטא את Histone2-EGFP בגרעינים צולם (A) חי לפני אבלציה ו-(B) 3 שעות לאחר לייזר-אבלציה. (C) הנוטום אוחזר, נותח ותוקן כאמור בפרוטוקול וצולם מחדש לאחר התיקון. אתר הפצע מסומן בכוכב אדום. התמונות צולמו במטרה של פי 40 באמצעות מיקרוסקופ דיסק מסתובב, פרוסות Z צולמו כל 0.3 מיקרומטר. מוצגות הקרנות בעוצמה מרבית של 34 פרוסות Z לפני הפציעה (A), 48 פרוסות Z 3 שעות לאחר הפציעה (B) ו-103 פרוסות Z לאחר כריתה, קיבוע וצביעה (C). סרגל קנה המידה ב- C הוא 25 מיקרומטר, החל על A-C. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
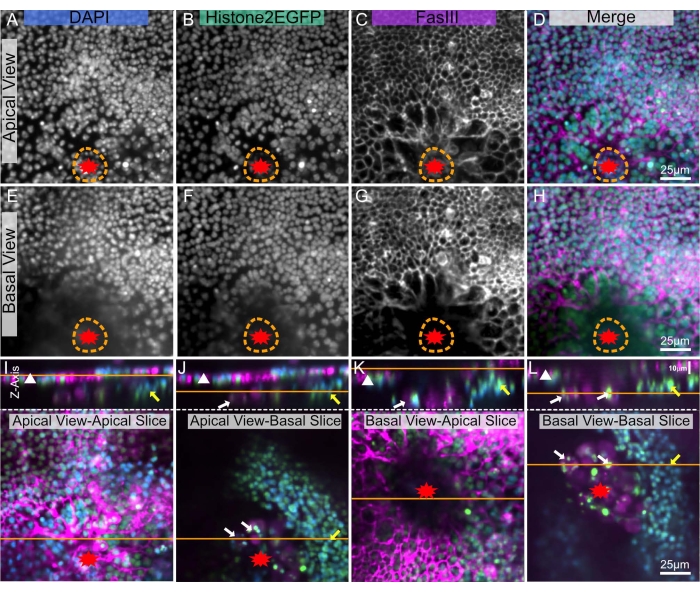
איור 5: הדמיית צדדים אפיים ובסיסיים של נוטום פצוע. אותו פופאל נוטום פצוע מוצג בכל הלוחות. הפצע מסומן בכוכב אדום. הקו המקווקו הכתום מציין את שולי הפצע. (א-ד) הנוטום מצולם מהצד האפיקלי, דרך הציפורן. (ה-ה) הנוטום מצולם מהצד הפנימי הבסיסי. (א-ל) הלוחות העליונים מציגים תמונת X-Z של ה-notum, הצד האפיקלי כלפי מעלה, כאשר יריעת האפיתל מסומנת על-ידי משולש לבן. הקו הכתום מציין את המישור האפיקלי-בסיסי של פרוסת X-Y, המוצג בלוחות התחתונים. בתוך הלוחות התחתונים, הקו הכתום מציג את המישור של תמונת X-Z לעיל. (I) נוטום בתמונה אפית - פרוסה אפיקלית. תצוגת X-Z העליונה מציגה הדמיה מדויקת של יריעת אפיתל האפיתל האפיקלית (משולש לבן). תצוגה זו שקולה לתצוגת הדמיה חיה. (J) נוטום בתמונה אפית - פרוסה בסיסית, חסומה חלקית על ידי רקמה אפית. רקמות אחרות המסומנות על ידי חץ צהוב (רצועת שרירים אפשרית) וחצים לבנים (תאי דם אפשריים) נראות בצד הבסיסי. (K) נוטום בתמונה בסיסית - פרוסה אפית, חסומה חלקית על ידי רקמה בסיסית וגלד פצע (אזור מרכזי כהה). (L) נוטום בתמונה בסיסית - פרוסה בסיסית. תצוגה זו מציגה בצורה הטובה ביותר את רקמות הבסיס המסומנות בחצים צהובים ולבנים. A,E: כתם DAPI, B,F: היסטון-EGFP, C,G: צביעת FasIII. התמונות צולמו עם מטרה של פי 20 עם מיקרוסקופ דיסק מסתובב. פרוסות Z נלקחו כל 0.9 מיקרומטר. A-D מציג את ההקרנה בעוצמה המרבית של 19 פרוסות. E-H מייצג את היטל העוצמה המרבית של 17 פרוסות. פסי קנה מידה של 25 מיקרומטר ב- D,H, L חלים על A-D, E-H, I-L, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קובץ משלים 1: הכנת פתרונות ומאגרים. מתכונים לפתרונות הבאים מפורטים: 1xPBS, 1x PBST, פתרון חוסם, ו paraformaldehyde fixative. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
שלבים קריטיים
אופטימיזציה של שלושה שלבים תגדיל באופן דרמטי את ההצלחה של פרוטוקול זה. ראשית, בשלב 1.5, יש לחסוך עם דבק ההדבקה המוחל על הכיסוי. אם מוסיפים יותר מדי דבק דבק, הגלם יכול להיות דחוס בשכבה עבה של דבק מוצק, מה שיהפוך את הנתיחה לבלתי אפשרית, ואם היא מכסה את הנום עצמו, דבק הדבק יחסום את האור מהדגימה. שנית, במהלך שלבים 2.3-2.6, הקפידו להסיר רק את הכיפה העליונה של הנוטום, למעט כמה שיותר מהרקמה הצידית. אם תיכלל, הרקמה הצידית תידחס במהלך ההרכבה ותגרום לאמצע הנוטום להתכווץ פנימה, ולעתים קרובות תציב אותה מחוץ למרחק העבודה של מטרות צמצם מספריות גבוהות. שלישית, במהלך שלב הניקוי 2.9, יש לנקוט משנה זהירות שלא לפגוע באפיתל החד-שכבתי. אם לרקמה חסרים חלקים גדולים או שלא ניתן לזהות אות, סביר להניח ששלב זה אשם.
פתרון בעיות
גיליון 1: לאחר ההרכבה, הגלם מתרחק מהסרט הדו-צדדי במהלך הנתיחה. זוהי בעיה נפוצה, במיוחד למתחילים. התרופה הטובה ביותר היא להבטיח כי החלק החיצוני של מארז הגלמים יבש לחלוטין / נקי מפסולת מזון. הסרת מזון עם זוג מלקחיים קהים ומתן אפשרות למארז להתייבש באוויר במשך 10-15 דקות יעזרו לדבוק בקלטת. לחלופין, השתמש ביד הלא דומיננטית ובזוג מלקחיים קהים כדי להחזיק את הגלם כנגד הקלטת במהלך הניתוח. אם הבעיה נמשכת, מריחת טיפה קטנה של 5-10 μL של לק לציפורניים על בסיס הקצה האחורי של המארז ומתן אפשרות לו להתקשות בדרך כלל מספקת הידבקות מספקת מספיק הידבקות אפילו לבלתי נסבלים ביותר של הגלמים.
בעיה 2: נוטום קורס במהלך שלב 2.3, או שהפריצה הראשונית דרך הכסות אינה חלקה. אם קשה לפרוץ את הכסות, ייתכן שיש יותר מדי דבק דבק משלבי האימוביליזציה. הצבת הגלמים המנותחים בדבק פחות דביק תשפר את הבעיה. יתר על כן, ודא כי מספריים microdissection הם חדים. מספריים קהים לא יוכלו לחתוך לתוך הכסות ונוטים לגרום לה להתמוטט פנימה. ברגע שההמולימף נשפך מתוך הגלמים, ודא שאחד מלהבי החיתוך יכול להיכנס לגולם מבלי לגרום לנוטום להתעוות. אם הנוטום מתמוטט והלהב אינו נכנס לתוך הגלם, המשך לחתוך עד שהלהב נכנס לגלם.
גיליון 3: במהלך שלב 2.4, מספריים תופסים או גוררים את הכסות. אם המספריים מתחילים לתפוס או לגרור את הכסות, זה לעתים קרובות עוזר לעבור לצד הנגדי של הגלמים ולהמשיך 'לשחרר' את הכסות. מספריים זעירים קהים נוספים יקשו על השגת חתכים נקיים דרך הכסות, ויש להשתמש במספריים מחודדים.
בעיה 4: הדגימה נשאפת בטעות במהלך ההכתמה (שלבים 3.1-3.6). את הנוטום המנותח קשה לראות כי הוא שקוף. זה יכול להיות מועיל למקם גיליון כחול כהה או שחור מתחת לכיסוי כדי לספק ניגודיות (מתלה ישן למחזיק קצה פיפטה עובד היטב.) בנוסף, ניתן לבצע את כל השינויים בתמיסה תחת מיקרוסקופ דיסקציה.
בעיה 5: לא זוהה אות / אות מטושטש מזוהה. לאחר שלילת בעיות ספציפיות לכתם, אם לא זוהה אות או שהוא מטושטש, שלב 2.9 (ניקוי) הוא ככל הנראה האשם. אות נעדר או מטושטש יכול לנבוע מנזק והסרה של רקמת האפיתל במהלך הניקוי. לעומת זאת, אות גרוע יכול להיגרם על ידי חסימה מפסי השרירים / תאי גוף השומן אם הם לא מוסרים, מכיוון שהם יכולים להגביל את פיזור הכתמים והנוגדנים לנוטום ביחס לרקמה הסובבת. אם הרקמה פגומה, להיות עדין יותר במהלך הניקוי הוא הפתרון הטוב ביותר. אם, במקום זאת, הכתם גלוי אך מטושטש, מומלץ להגדיל את המרץ / הזמן המוקדש לשלב הניקוי כדי להסיר כמה שיותר מהשרירים והגוף השמן. יתר על כן, הגדלת משך הכתם יכולה לעזור לפתור בעיה זו עם ניקוי טוב יותר.
בעיה 6: לרקמת הנוטום יש מראה מעוות/מקומט במהלך ההדמיה. עיקום והתפתלות של הרקמה מגיעים משני מקורות. ראשית, דחיסת הנוטום במהלך ההרכבה תגרום לו להתכווץ ולהתעוות. הפתרון הטוב ביותר הוא להסיר כמה שיותר מהרקמות הצדדיות כך שהכיפה תהיה קצרה ככל האפשר ויכולה להתאים בין מרווחי הכיסוי. שנית, אם הנוטום כפוף במהלך הנתיחה, כיפוף זה לא יתיישר במהלך ההרכבה, ולכן יש לנקוט משנה זהירות כדי לא לעקם את הנום במהלך הנתיחה. כיפוף מקרי של הנוטום נפוץ ביותר בעת חיתוך הכסות משאר הגלמים. מפתה להחזיק את מספריים דיסקציה בזווית יחסית לגלמים במקום לשמור אותם במישור הדגימה כגלמים. עם זאת, מספריים זוויתיים גורמים לכסות לחגור כלפי מעלה כאשר הם נחתכים במקום להישאר שטוחים.
שיטות קיימות, מגבלות ויישומים עתידיים
Wang et al.20 דיווחו על פרוטוקול דיסקציה דומה לבידוד אפיתל pupal. טכניקה זו דורשת שהגלם יישאר בתוך המארז שלו וייחתך במהירות עם אזמל. פרוטוקול זה אינו תואם לדגימות שצולמו בעבר בשידור חי, מכיוון שהדמיה חיה דורשת הסרה של חלק גדול ממקרה הפופל. מכיוון שהגלמים חסרים קשיחות, ביזקציה של pupal מחוץ למקרה עיצבה את הרקמה, מה שנתן השראה ליצירת פרוטוקול זה. הטכניקה המפורטת כאן מאפשרת בידוד וקיבוע של הנוטום, והיא יכולה לשמש כצעד ראשון למגוון רחב של שיטות אחרות כגון קריוזקציה, הכלאה באתרה או מיקרוסקופיית אלקטרונים.
לטכניקה זו יש כמה מגבלות. ראשית, ניתוח, תיקון וכתם של הנוטום גוזלים זמן רב יותר מאשר הדמיה חיה של חלבונים המתויגים באופן פלואורסצנטי בנוטום, מה שדורש רק דיסקציה פשוטה כדי להסיר את מקרה הפופל 9,23. שנית, בהשוואה לנתחות של רקמות דרוזופילה אחרות, דיסקציה זו קשה יותר בגלל הרקמה הדקה והשברירית והקוטיקולה ההידרופובית. עבור פשוט הדמיה של חלבונים ב- Drosophila epithelia, אימונוהיסטוכימיה על עוברים קבועים, דיסקיות כנף זחל או שחלות היא קלה יותר. עם זאת, טכניקה זו מאפשרת לשלב את כוחה של הדמיה חיה עם קיבוע וצביעה, מה שהופך אותה לכלי רב עוצמה לאחר שליטה.
לטכניקת דיסקציה/קיבוע יש כמה יתרונות על פני הדמיה חיה. ניתן לפתור טוב יותר מבנים בסיסיים (פנימיים) באמצעות מבט בסיסי (איור 5L,J). והכי חשוב, הדמיה חיה מוגבלת לפלואורופורים שחייבים להיות מסופקים גנטית, ולעתים קרובות דורשים תוכניות חצייה גנטיות ארוכות. לעומת זאת, הפרוטוקול הנוכחי מאפשר יישום של כתמים, אימונוהיסטוכימיה, וטכניקות אחרות הדורשות דיסקציה וקיבוע. זה מגדיל באופן דרמטי את מספר האותות הנחקרים ברקמה תוך שהוא עלול לקצר את הזמן לתוצאות הניסוי.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לד"ר מ. שיין האטסון על הקמת מערכת אבלציה בלייזר המשמשת לפציעת פופאל ועל תרומתו למשוב על פיתוח הפרוטוקול ומשוב עליו. עבודה זו נתמכה על ידי 1R01GM130130 ל- APM ו- M. Shane Hutson. JW נתמך על ידי 2T32HD007502-21.
Materials
| Name | Company | Catalog Number | Comments |
| ½” Scotch Permanent Double-Sided tape | Scotch 3M | 665 | |
| 0.1-10 µL uTIP pipette tip | Biotix | M-0011-9FC | |
| 22 x 22 mm No. 0 thickness coverslips | Thomas Scientific | 1207Z28 | |
| 24 x 60 mm coverslip | Corning | 2980-246 | |
| 3M VetBond | 3M | 1469SB | Called "adhesive glue" in protocol |
| Anti-FasIII primary Mouse IgG2a | Developmental Studies Hybridoma Bank | 7G10 | |
| Calcium Chloride | Fisher Chemical | c79-500 | |
| Cy3-conjugated AffiniPure Goat Anti-Mouse IgG2a | Jackson ImmunoResearch | 115-165-206 | |
| DAPI | Sigma Aldrich | D9542-1mg | |
| Dumont #5 Fine Tip Forceps | Fine Science Tools | No. 11254-20 | |
| Dumont #5 Fine Tip Forceps: Blunt | Fine Science Tools | No. 11254-20 | Heavily used and unsharpened forceps, or dulled with a whetstone |
| Fisherbrand Double frosted microscope slides | Fisher Scientific | 22-034-486 | |
| Fluorescent Light Source | Lumencor | Celesta 90-10512 | |
| Fly Stock: EGFP-tagged Histone H2A | Bloomington Drosophila Stock Center | 24163 | |
| Fly Vial Foam Plugs "Flugs" | Genesee Scientific | 49-101 | |
| Humidified Chamber: Foil-wrapped small container lined with filter paper saturated with water | Cole-Parmer | 759075D | A great humidified chamber can be made from the styrofoam box containing Cole-Parmer cuvettes, 759075D, filled with 50 ml water. |
| KimWipe | KimTech | 34155 | Called "Absorbent Tissue" in protocol |
| Nikon Ti2 Eclipse | Nikon | Eclipse Ti2-E | |
| NIS Elements Software | Nikon | AR | |
| Parafilm | Pechiney Plastic Packaging | PM-996 | |
| Paraformaldehyde (PFA) 16% | Ted Pella, Inc | 18505 | |
| Plastic Vials | Genesee Scientific | 32-114 | |
| Sodium Azide (NaN3) | Fisher Scientific | 19038-1000 | |
| Stereo Microdissection Scope | Carl Zeiss | STEMI 2000 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | New or freshly sharpened scissors |
| Vecta Shield | Vector Laboratories | H-1000 | Called " antifade mounting medium" in protocol |
| Vecta Shield with DAPI | Vector Laboratories | H-1200 | Not ideal for pupal notum. |
| X-Light V2 Spinning Disc | Crest Optics | V2 L-FOV |
References
- Valon, L., et al. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination. Developmental Cell. 56 (12), 1700-1711 (2021).
- Levayer, R., Dupont, C., Moreno, E. Tissue crowding induces caspase-dependent competition for space. Current Biology. 26 (5), 670-677 (2016).
- Couturier, L., et al. Regulation of cortical stability by RhoGEF3 in mitotic sensory organ precursor cells in Drosophila. Biology Open. 6 (12), 1851-1860 (2017).
- Couturier, L., Mazouni, K., Corson, F., Schweisguth, F. Regulation of Notch output dynamics via specific E(spl)-HLH factors during bristle patterning in Drosophila. Nature Communications. 10, 3486 (2019).
- Fujisawa, Y., Shinoda, N., Chihara, T., Miura, M. ROS regulate caspase-dependent cell delamination without apoptosis in the drosophila pupal notum. iScience. 23, 101413 (2020).
- Besson, C., et al. Planar cell polarity breaks the symmetry of par protein distribution prior to mitosis in drosophila sensory organ precursor cells. Current Biology. 25 (8), 1104-1110 (2015).
- Koto, A., Kuranaga, E., Miura, M. Apoptosis ensures spacing pattern formation of drosophila sensory organs. Current Biology. 21, 278-287 (2011).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Moreira, C., Regan, J., Zaidman-Rémy, A., Jacinto, A., Prag, S. Drosophila hemocyte migration: an in vivo assay for directional cell migration. Methods in Molecular Biology. 769, 249-260 (2011).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. Elife. 4, 08519 (2015).
- Cristo, I., Carvalho, L., Ponte, S., Jacinto, A. Novel role for Grainy head in the regulation of cytoskeletal and junctional dynamics during epithelial repair. Journal of Cell Science. 131 (17), 213595 (2018).
- Bellaïche, Y., Gho, M., Kaltschmidt, J. A., Brand, A. H., Schweisguth, F. Frizzled regulates localization of cell-fate determinants and mitotic spindle rotation during asymmetric cell division. Nature Cell Biology. 3 (1), 50-57 (2001).
- Shannon, E. K. Multiple mechanisms drive calcium signal dynamics around laser-induced epithelial wounds. Biophysical Journal. 113 (7), 1623-1635 (2017).
- O'Connor, J. T., et al. Proteolytic activation of Growth-blocking peptides triggers calcium responses through the GPCR Mthl10 during epithelial wound detection. Developmental Cell. 56 (15), 2160-2175 (2021).
- Hartenstein, V., Posakony, J. W. Development of adult sensilla on the wing and notum of Drosophila melanogaster. Development. 107 (2), 389-405 (1989).
- Yeh, E., Zhou, L., Rudzik, N., Boulianne, G. L. Neuralized functions cell autonomously to regulate Drosophila sense organ development. The EMBO Journal. 19 (17), 4827-4837 (2000).
- Loubéry, S., et al. Uninflatable and notch control the targeting of sara endosomes during asymmetric division. Current Biology. 24 (18), 2142-2148 (2014).
- Kawamori, A., Shimaji, K., Yamaguchi, M. Dynamics of endoreplication during Drosophila posterior scutellar macrochaete development. PLoS One. 7 (6), 38714 (2012).
- Couturier, L., Schweisguth, F., Bellen, H. J., Yamamoto, S. . Notch Signaling: Methods and Protocols. , 79-86 (2014).
- Wang, W., Yoder, J. H. Drosophila pupal abdomen immunohistochemistry. Journal of Visualized Experiments. (56), e3139 (2011).
- Kiehart, D. P., et al., Celis, J. E., et al. . Cell Biology (Third Edition). , 87-103 (2006).
- Bailey, E. C., Dehn, A. S., Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. A Drosophila model to study wound-induced polyploidization. Journal of Visualized Experiments. (160), e61252 (2020).
- O’Connor, J. T., S, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protocols. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved