Method Article
Disséquer, fixer et visualiser la nymphe de la drosophile Notum
Dans cet article
Résumé
Le présent protocole détaille la préparation et la visualisation du tissu fixe du notum nymphal de la drosophile . Il peut être utilisé pour les tissus intacts ou blessés, et l’architecture originale du tissu est préservée. Les procédures de dissection, de fixation et de coloration sont toutes décrites dans cet article.
Résumé
Les nymphes de Drosophila melanogaster sont immobiles pendant plusieurs jours pendant la métamorphose, au cours de laquelle elles développent un nouveau corps avec un mince tégument adulte transparent. Leur immobilité et leur transparence les rendent idéales pour les expériences d’imagerie en direct in vivo . De nombreuses études se sont concentrées sur la monocouche épithéliale dorsale du notum nymphal en raison de son accessibilité et de sa taille relativement grande. En plus des études de la mécanique épithéliale et du développement, le notum a été un tissu idéal pour étudier la cicatrisation des plaies. Après une blessure, l’ensemble du processus de réparation épithéliale peut être capturé par imagerie en direct sur 6-12 h. Malgré la popularité du notum pour l’imagerie en direct, très peu d’études publiées ont utilisé des échantillons de notum fixes. La fixation et la coloration sont des approches courantes pour presque tous les autres tissus de la drosophile, tirant parti du vaste répertoire de taches cellulaires simples et d’anticorps. Cependant, le notum nymphal est fragile et sujet au curling et à la distorsion après son retrait du corps, ce qui rend difficile le complément de l’imagerie en direct. Ce protocole offre une méthode simple pour fixer et colorer le notum nymphal, à la fois intact et après une blessure au laser. Avec cette technique, la face ventrale de la nymphe est collée à un couvercle pour immobiliser la nymphe, et le notum est soigneusement enlevé, fixé et taché. L’épithélium du notum est monté sur une lame ou entre deux couvercles pour faciliter l’imagerie de la face dorsale ou ventrale du tissu.
Introduction
Le notum nymphal de Drosophila melanogaster a été de plus en plus utilisé pour des études d’imagerie vivante au cours de la dernière décennie parce que l’animal est à la fois immobile et a une cuticule transparente à ce stade 1,2,3,4,5,6,7. Cependant, le notum nymphal est difficile à disséquer et à réparer, ce qui rend difficile de compléter les études d’imagerie vivantes avec des anticorps et des taches cellulaires. L’objectif global de ce travail est de créer un protocole reproductible pour disséquer et fixer le notum nymphal pour la coloration des anticorps et des cellules sur des échantillons nouveaux ou précédemment photographiés en direct.
Lorsque les larves commencent à se métamorphoser, l’épiderme s’éloigne de la cuticule larvaire, formant un cas de nymphe dure8. Le plan du corps larvaire est décomposé et le nouveau plan du corps adulte est développé. Pendant ce temps, les nymphes sont immobiles, ce qui les rend idéales pour l’imagerie en direct. Un tissu couramment imagé est le notum nymphal, un épithélium monocouche adulte qui se forme dans le thorax dorsal. Le notum est visuellement accessible après une simple dissection pour enlever le cas nymphal9. L’animal entier peut ensuite être monté et le notum peut être imagé en direct pendant des heures ou des jours, ce qui en fait un tissu idéal pour étudier les comportements des cellules épithéliales pendant le développement, l’homéostasie et après la blessure 10,11,12,13,14. Cependant, le notum est difficile à disséquer et à fixer car il est fragile et recouvert d’une fine cuticule adulte transparente et hydrophobe. Cette cuticule hydrophobe la rend sujette à l’enroulement dans des solutions aqueuses lorsqu’elle est retirée du reste du corps. Ainsi, la dissection et la fixation du notum n’ont été rapportées que rarement et la dissection n’est souvent pas décrite 15,16,17,18. Sans protocole détaillé dans la littérature, il est extrêmement difficile pour un chercheur sur la drosophile de compléter l’imagerie vivante par la coloration des pupes.
Cette technique vise à disséquer et à fixer de manière reproductible des échantillons qui ont déjà été photographiés en direct, y compris ceux qui ont été blessés au laser. Parce que l’imagerie en direct nécessite l’ablation du cas nymphal, cette technique de dissection commence par l’ablation du cas nymphal antérieur, contrairement aux protocoles précédents qui épinglent ou coupent en deux les nymphes dans le cas nymphal 4,19,20. Le notum est un tissu fragile, et la blessure peut exacerber sa fragilité. Ainsi, pour soutenir ce tissu délicat, le tégument (l’épithélium et la cuticule adulte transparente attachée) du notum et une partie de la tête et de l’abdomen sont disséqués loin du reste de la nymphe tout en étant toujours immergés dans un environnement aqueux. Cette méthode réduit la probabilité que le tissu s’enroule et soit inutilisable. Cette technique a réussi à colorer le tissu notum blessé dès 30 minutes après la blessure (Figure 1E-H) et à 3 h après la blessure (Figure 1I-L). Ce protocole devrait être efficace pendant toute la durée du développement du notum ou de la réparation des plaies. La technique actuelle sera utile aux chercheurs qui souhaitent unir les capacités d’imagerie en direct du notum nymphal avec l’abondance de réactifs immunohistochimiques disponibles.
Protocole
Drosophila melanogaster (mouches des fruits) ont été maintenues à 25 °C sur un milieu standard de semoule de maïs-mélasse. Les études ont été menées sur des pupes d’histone H2A marquées par l’EGFP (w[*]; P{w+mC=His2Av-EGFP.C}2/SM6a). Les mouches ont été obtenues auprès d’un centre de stockage public (voir Tableau des matériaux).
1. Immobilisation des pupes
- Appliquez une bande de ruban adhésif double face de 2 po sur une lame de microscope.
- Identifiez les prépuces blanches dans les flacons surélevés à 25 °C et utilisez un marqueur pour indiquer leur emplacement à l’extérieur du flacon. Remettre les flacons à 25 °C.
REMARQUE: Les prépupes blancs se caractérisent par leur immobilité, leur couleur blanche et leurs spiracles éventrés. Ceux-ci se forment 0-1 h après la formation du puparium (APF), ou stade P18. - 12-15 h plus tard, retirez soigneusement 3-4 des nymphes indiquées (sans les faire éclater) à l’aide d’une lunette de dissection et collectez-les sur la lame du microscope à côté de la bande.
REMARQUE: Les nymphes seront maintenant au stade P5 avec un sac de tête éventré visible à l’extrémité antérieure8 des nymphes. - Placez les nymphes à au moins une largeur de nymphe sur le ruban adhésif avec leurs côtés ventraux vers le bas.
- Placez une goutte de colle adhésive sur un film de paraffine (voir Tableau des matériaux) ou dans un couvercle de tube de centrifugeuse. Trempez l’extrémité d’une pointe de pipette de 0,1 à 10 μL (pas de pipette) dans la goutte de colle adhésive. Tapotez la pointe de la pipette deux fois sur un couvercle de 24 mm x 60 mm (1,5 d’épaisseur), à 1 cm x 1 cm d’un coin, créant une ligne de colle adhésive ~ 1/2 de la longueur de la nymphe.
- Préréglez une pipette de 0,2 à 2 μL (P2) à 2 μL et une pipette de 200 μL (P200) à 200 μL et installez-les avec des embouts afin qu’ils soient prêts à être remplis avec 1x PBS + 0,1 mM Ca2+, ce qui solidifiera rapidement la colle adhésive au contact.
- Insérez des pinces (voir Tableau des matériaux) près du côté de la tête et retirez doucement le boîtier de l’avant vers le postérieur9. Retirez autant de cas que possible. Saisissez les pattes en développement de la nymphe avec une paire de pinces émoussées et tirez soigneusement la nymphe de son étui.
REMARQUE: Une petite rupture sur la partie ventrale des pupes ne sera pas préjudiciable à cette procédure. - Posez la nymphe dans le coin de la housse.
- Saisissez la nymphe à l’abdomen postérieur ou à l’aile en développement avec une pince émoussée, soulevez-la et placez la face ventrale de la nymphe dans la ligne de colle adhésive.
- Remplissez rapidement la pipette P2 avec 2 μL de 1x PBS + 0,1 mM de Ca2+, et maintenez-la dans l’air, expulsez juste assez pour former une petite bulle à l’extrémité (0,25-0,5 μL).
- Touchez la petite bulle de la solution d’un côté des pupes à la base du thorax, puis répétez de l’autre côté.
REMARQUE: Cela solidifiera une petite quantité de colle adhésive pour maintenir la nymphe en place. Généralement, toutes les solutions ne seront pas utilisées. - Remplissez la pipette P200 avec 200 μL de 1x PBS + 0,1 mM de Ca2+, puis placez la pointe de la pipette sur le thorax et expulsez le contenu pour immerger complètement les nymphes. Le reste de la colle adhésive se solidifiera immédiatement.
- Retirez ~100 μL de la solution PBS, de sorte que la nymphe soit à peine submergée avant de passer immédiatement à l’étape suivante.
REMARQUE : Pour les échantillons non enroulés, commencez à l’étape 1.1. Pour les échantillons blessés partiellement disséqués, commencez à l’étape 1.5. La blessure par ablation au laser a été décrite précédemment14,21. Les étapes d’immobilisation, de dissection et de montage doivent être effectuées à l’aide d’un microscope à dissection.
2. Disséquer le notum
- Saisissez une paire de ciseaux à microdissection qui contremontent un côté du manche contre l’index et le majeur de la main dominante, de sorte que le pouce de la main dominante applique la force de coupe (Figure 2A, B).
- Stabilisez le cou des ciseaux contre le majeur de la main non dominante tout en appuyant la lèvre de couverture avec l’annulaire de la main non dominante.
- Coupez au milieu de l’abdomen dorsal pour créer un petit trou, ~ 0,2-0,5 mm. Une certaine hémolymphe se répand généralement et est un bon indicateur de la brèche.
- Faites de petites coupes de 0,5 à 0,75 mm à travers le tégument du postérieur à l’antérieur, en encerclant le tissu dorsal pour l’isoler. Pour créer un tissu aussi plat que possible, évitez de couper trop ventralement; seul le « dôme » dorsal du thorax doit être enlevé avec de petites sections de la tête et de l’abdomen.
- Répétez les coupures postérieures à antérieures de l’autre côté des nymphes.
- Faites pivoter l’étape de dissection pour permettre une coupe nette à travers la tête si nécessaire.
REMARQUE: À ce stade, le tégument dorsal, ou notum, sera séparé du reste de la nymphe. S’il semble séparé mais n’est pas facile à déplacer, quelques coupes sous le notum peuvent aider à le déloger. - Ajoutez ~200 μL de 1x PBS au centre du couvercle et créez un canal le reliant à la gouttelette de dissection d’origine en faisant glisser doucement la pointe de la pipette sur le verre de couverture de la nouvelle gouttelette à l’original.
- À l’aide d’une paire de pinces émoussées, poussez ou faites glisser doucement le notum isolé vers le centre de la glissière de couverture et faites pivoter, de sorte que le côté intérieur soit orienté vers le haut. Ne retirez jamais le tissu de la gouttelette.
REMARQUE: Il est essentiel de déplacer le notum loin du site de dissection d’origine pour éviter que des restes de colle adhésive obstruent l’échantillon lors d’une imagerie ultérieure. - Maintenez le notum vers le bas avec la pince émoussée en appuyant dans les sections abdominales ou de la tête. À l’aide d’une paire de pinces tranchantes et /ou d’expulsions douces de 1x PBS d’une pipette de 200 μL, retirez tout corps gras restant, les bandes musculaires ou l’hémolymphe (le cas échéant) pour exposer complètement l’épithélium monocouche et rendre la coloration éventuelle plus uniforme. Le notum disséqué doit apparaître comme à la figure 3A.
- Une fois le tissu propre, utilisez une pipette de 200 μL pour éliminer autant de solution de PBS que possible (ainsi que les débris et la partie ventrale des pupes), en surveillant avec une dissection pour éviter d’aspirer le notum.
- Une fois que la majeure partie du liquide a été retirée, utilisez un tissu absorbant pour essuyer soigneusement le reste de la colle adhésive et de la nymphe, ainsi que tout autre débris qui persiste sur le couvercle.
REMARQUE: Si une colle adhésive reste sur le couvercle, cela ne causera pas de problème tant qu’il est plus mince que le tissu dorsal lui-même. - Ajouter 150-200 μL de PFA à 4% (dans 1x PBS) et fixer pendant 20 min à température ambiante. Selon la vitesse de dissection, 1 ou plusieurs nymphes peuvent être disséquées lors de la fixation de la première nymphe.
- Retirez le PFA et remplacez-le par 1x PBS pour laver le notum une fois pendant 30 s.
- Si vous procédez à la coloration des anticorps, effectuez des lavages de 5 minutes (3 fois) dans 1x PBS ou 1x PBST (fichier supplémentaire 1) pour perméabiliser le tissu si l’antigène est intracellulaire.
- Conservez l’échantillon dans 1x PBS + 0,02% NaN3 pendant la nuit dans une chambre humidifiée ou, si vous prévoyez de tacher le tissu, incubez pendant la nuit dans une solution bloquante (dossier supplémentaire 1).
3. Coloration du notum
REMARQUE: Pour la coloration à l’aide d’anticorps ou de taches cellulaires, suivez les étapes ci-dessous. -Le notum ne doit pas être retiré de la solution, car cela entraînerait probablement l’enroulement du tissu. Ainsi, adaptez les protocoles de coloration à effectuer entièrement sur le couvercle et conservez-les dans une chambre humidifiée pendant toutes les étapes supérieures à 5 min. La surveillance des échantillons au microscope à dissection peut aider à prévenir l’aspiration accidentelle des tissus pendant les lavages.
- Pour visualiser les bordures cellulaires, incuber dans 200 μL d’anticorps IgG2a primaire anti-FasIII de souris (voir Tableau des matériaux) à une concentration de 1:8 diluée dans un tampon bloquant + 0,02 % de NaN3 pendant la nuit à 4 °C.
- Laver l’excès d’anticorps primaire (3 fois) avec 200 μL de 1x PBS + 0,02% NaN3 pendant 1 h par lavage à température ambiante.
- Effectuer une incubation secondaire d’anticorps avec 200 μL de concentration de 1:200 IgGa2 anti-souris dans Cy3 dans le tampon bloquant + 0,02% NaN3 pendant 2 h à température ambiante.
- Laver l’excès d’anticorps secondaire (3 fois) avec 200 μL de 1x PBS + 0,02% NaN3 pendant 1 h par lavage à température ambiante.
- Pour visualiser les noyaux, incuber des échantillons dans 1 μg/mL de DAPI pendant 45 min pour laisser suffisamment de temps à la tache pour pénétrer à travers les bandes musculaires; la fixation dans un milieu de montage contenant du DAPI n’est pas efficace avec ce tissu.
- Laver l’excès de DAPI (3 fois) avec 200 μL de 1x PBS + 0,02% NaN3 pendant 5 min par lavage à température ambiante, puis laisser dans 200 μL de 1x PBS + 0,02% NaN3 pendant la nuit à 4 °C, ou monter immédiatement.
4. Montage et visualisation du notum
- Après la coloration, préparez un nouveau couvercle (topper) de 24 × 60 avec supports.
REMARQUE: Parce que le notum est en forme de dôme, l’aplatir complètement entraîne une distorsion des tissus ridés. La création d’un espace entre les deux couvercles permet au notum de conserver sa forme normale. - Créez un espace d’environ 200 μm en utilisant des entretoises faites de 22 x 22 couvercles (épaisseur n ° 0, épaisseur ~ 100 μm), collés à environ 1 cm l’un de l’autre avec du vernis à ongles au milieu du topper.
- Pour adhérer, placez les entretoises sur le surmatelas et peignez les bords distaux des entretoises avec une fine couche de vernis à ongles. Laisser sécher.
REMARQUE: N’utilisez qu’un vernis à ongles fin et coulant; un vernis à ongles épais ajoutera un espace supplémentaire inutile entre le couvercle et le topper. - Retirer autant que possible la solution aqueuse de l’échantillon.
- Appliquez immédiatement deux gouttes (~100 μL) de support de montage anti-décoloration (voir Tableau des matériaux) sur l’échantillon.
- Si nécessaire, utilisez une pince propre et tranchante pour positionner le notum au centre de la gouttelette de milieu de montage anti-décoloration.
- Placez le couvercle avec le notum sur un support d’environ 10 x 40 mm, tel qu’un morceau de mousse mince (coupé dans le matériau d’emballage à l’intérieur des boîtes à glissière de couverture), pour élever l’échantillon afin qu’il n’adhère pas à la surface de travail.
- Sous une portée de dissection, abaissez lentement le topper sur l’échantillon. Une fois que le support de montage anti-décoloration rencontre le topper, relâchez doucement et laissez l’action capillaire tirer le topper vers le bas.
REMARQUE: Dans les premières secondes, des ajustements mineurs peuvent être effectués à la position du couvercle sans endommager le notum. - Placez un autre morceau de mousse sur le topper et utilisez une lame de microscope standard comme poids pour amadouer doucement le support de montage anti-décoloration entre le couvercle de l’échantillon, le topper et les entretoises.
- Après 5 à 10 minutes, utilisez un tissu absorbant pour évacuer tout excès de support de montage anti-décoloration en touchant doucement les bords de la glissière de couverture.
- Appliquez doucement du vernis à ongles sur chaque coin des couvercles pour les coller ensemble. Une fois sec, peignez tous les bords des couvercles pour sceller. Évitez d’abord de recouvrir tous les bords, car cela peut souvent déplacer le couvercle et endommager le tissu dorsal.
- Visualisez le notum en microscopie à fluorescence (voir Tableau des matériaux) à travers la face dorsale et/ou ventrale.
Résultats
La technique présentée fonctionne bien sur le notum non enroulé (Figure 1A-D), permettant d’étudier le développement et l’homéostasie du tissu, par exemple la formation des cellules polyploïdes mécanosensorielles18, ou le flux antérieur au flux postérieur des cellules épithéliales10. Ce protocole est également applicable à un notum ablation au laser (Figure 1E-L), où la réponse cellulaire à la blessure peut être analysée en direct avec des fluorophores endogènes tels que Histone2-EGFP (Figure 1B,F,J). La post-coloration avec immunohistochimie (étape 3) peut révéler de nombreuses caractéristiques, telles que la fascicline III, qui marque les bordures cellulaires (Figure 1C, G, K). De plus, des taches quantitatives telles que DAPI (Figure 1A, E, I) peuvent être utilisées pour évaluer les changements de contenu de l’ADN, y compris la polyploïdie induite par la plaie22.
Le protocole actuel est particulièrement bénéfique car il peut être utilisé après des expériences d’imagerie en direct à long terme. Comme les nymphes sont immobiles, elles peuvent être imagées pendant des heures (Figure 4A,B). Il est important de noter que ce protocole n’entraîne pas de changements considérables dans l’architecture ou la morphologie globale de l’épithélium de la plaie après la dissection (figure 4B, C). Ainsi, les caractéristiques du tissu pourraient être imagées à long terme, puis étudiées plus avant avec l’immunohistochimie ou les taches cellulaires.
L’imagerie profonde dans les tissus est complexe en raison de leur opacité, et les drosophiles sont recouvertes d’une cuticule cireuse8, ce qui rend l’imagerie profonde encore plus difficile. Cependant, avec cette technique, un notum disséqué peut être placé entre deux couvercles permettant l’imagerie de la monocouche épithéliale de chaque côté : le côté apical à travers la cuticule (Figure 5A-D) et/ou le côté basal de l’épithélium qui fait face à la cavité corporelle (Figure 5E-H). Ces différentes vues sont idéales pour visualiser différentes structures dans le tissu. Par exemple, la vue apicale est idéale pour visualiser les bordures des cellules épithéliales et les noyaux qui se trouvent juste en dessous de la cuticule (Figure 5A-D). Avec la vue basale, ces signaux apicaux sont moins visibles (Figure 5E-H). Cependant, des structures basales sont observées au bord de la plaie (Figure 5J, L jaune, flèches blanches). Ces structures basales sont beaucoup plus brillantes car il y a moins d’occlusion dans la vue basale que dans la vue apicale.
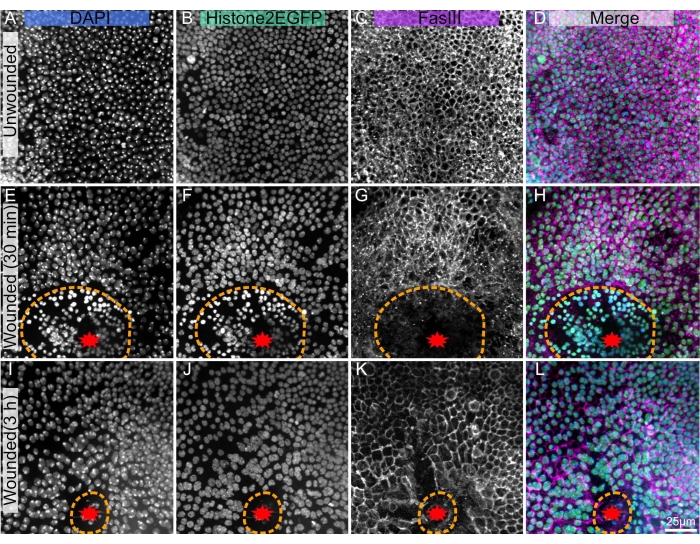
Figure 1 : Nota nymphe disséquée, fixe et colorée de drosophile. (A-D) Notum non enroulé. (E-H), Notum blessé 30 min après l’ablation au laser. (I-L) Notum blessé 3 h après l’ablation au laser. (A,E,I) La coloration DAPI montre des noyaux. (B,F,J) L’Histone2-EGFP transgénique, utilisé en imagerie en direct, est visible après fixation et coloration. (C,G,K) L’anticorps anti-FasIII montre que les taches d’anticorps fonctionnent bien sur le notum fixe. (D,H,L) Image fusionnée. Les images sont capturées avec un objectif 40x en utilisant la microscopie à disque tournant, les projections d’intensité maximale des piles Z sont montrées avec des tranches Z de 0,3 μm. A-D représente 263 tranches Z. E-H représente 195 tranches. I-L représente 53 tranches Z. La ligne pointillée orange indique la marge de la plaie. La barre d’échelle en L est de 25 μm, applicable à A-L. Veuillez cliquer ici pour voir une version agrandie de cette figure.
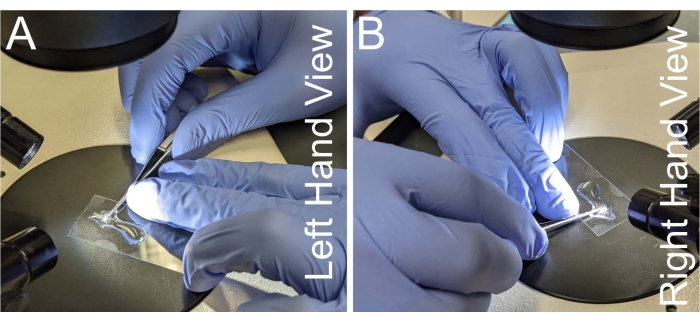
Figure 2: Placement de la main pour la dissection du notum. (A-B) Vues gauche et droite du placement de la main pour tenir les ciseaux à microdissection. Pour éviter les tremblements de main, le cou des ciseaux est placé contre le majeur de la main non dominante. Les ciseaux doivent être parallèles à la lame du microscope pour éviter la déformation du tissu notum. Veuillez cliquer ici pour voir une version agrandie de cette figure.
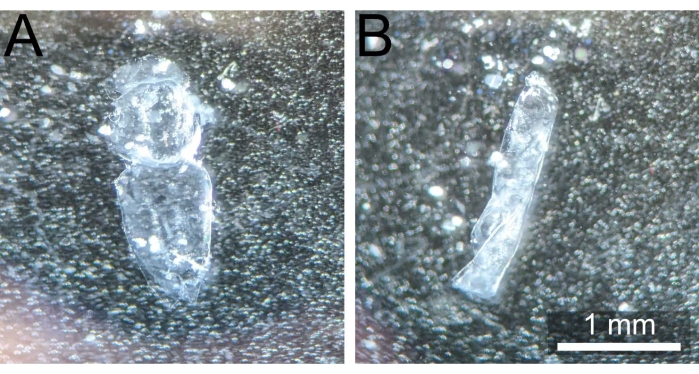
Figure 3 : Notum correctement disséqué vs notum recourbé. (A) Pupal notum post dissection et nettoyage non durci et prêt à être fixé. (B) Pupal notum s’est enroulé sur lui-même après avoir été retiré de 1x PBS, le rendant ainsi inutilisable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
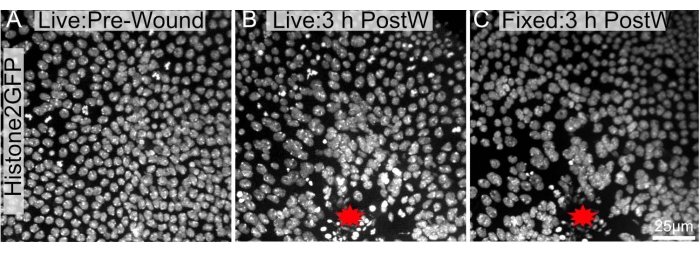
Figure 4 : Les images pré et post-fixes sont en grande partie similaires. Un notum nymphal exprimant Histone2-EGFP dans les noyaux a été imagé (A) en direct avant l’ablation et (B) 3 h après l’ablation au laser. (C) Le notum a été récupéré, disséqué et fixé comme mentionné dans le protocole et ré-imagé après correction. Le site de la plaie est étiqueté avec une étoile rouge. Les images ont été capturées avec un objectif 40x en utilisant la microscopie à disque tournant, des tranches Z ont été prises tous les 0,3 μm. Les projections d’intensité maximale de 34 tranches Z pré-bobinage (A), 48 tranches Z 3 h après la plaie (B) et 103 tranches Z après dissection, fixation et coloration (C) sont montrées. La barre d’échelle en C est de 25 μm, applicable à A-C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
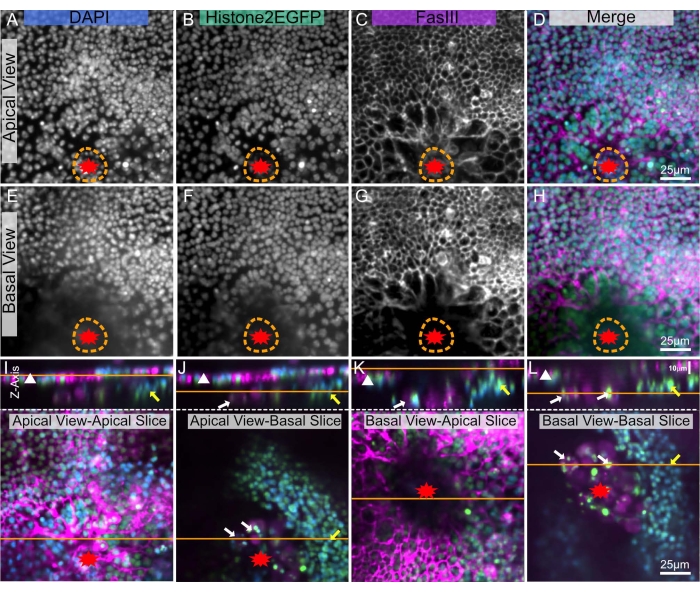
Figure 5 : Imagerie des côtés apical et basal d’un notum blessé. Le même notum nymphal blessé est représenté dans tous les panneaux. La plaie est marquée d’une étoile rouge. La ligne pointillée orange indique la marge de la plaie. (A-D) Le notum est imagé du côté apical, à travers la cuticule. (E-H) Le notum est imagé du côté intérieur basal. (I-L) Les panneaux supérieurs montrent une image X-Z du notum, côté apical vers le haut, avec la feuille épithéliale désignée par un triangle blanc. La ligne orange indique le plan apical-basal de la tranche X-Y, représenté dans les panneaux inférieurs. Dans les panneaux inférieurs, la ligne orange montre le plan de l’image X-Z ci-dessus. (I) Notum imagé apical - tranche apicale. La vue X-Z supérieure montre une imagerie précise de la feuille épithéliale apicale (triangle blanc). Cette vue est équivalente à une vue d’imagerie en direct. (J) Notum imagé apicalement - tranche basale, partiellement obstruée par le tissu apical. D’autres tissus désignés par une flèche jaune (bande musculaire possible) et des flèches blanches (cellules sanguines possibles) sont visibles sur le côté basal. (K) Notum imagé basalement - tranche apicale, partiellement obstruée par le tissu basal et la croûte de la plaie (zone centrale sombre). (L) Notum imagé basalement - tranche basale. Cette vue montre le mieux les tissus basaux désignés par des flèches jaunes et blanches. A,E: coloration DAPI, B,F: Histone-EGFP, C,G: coloration FasIII. Les images ont été capturées avec un objectif 20x avec microscopie à disque tournant. Des tranches de Z ont été prises tous les 0,9 μm. A-D montre la projection d’intensité maximale de 19 tranches. E-H représente la projection d’intensité maximale de 17 tranches. Les barres d’échelle de 25 μm en D,H,L s’appliquent respectivement à A-D, E-H, I-L. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire 1 : Préparation des solutions et des tampons. Les recettes des solutions suivantes sont détaillées: 1xPBS, 1x PBST, solution bloquante et fixateur de paraformaldéhyde. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Étapes critiques
L’optimisation de trois étapes augmentera considérablement le succès de ce protocole. Tout d’abord, à l’étape 1.5, soyez économe avec la colle adhésive appliquée sur le couvercle. Si trop de colle adhésive est ajoutée, les pupes peuvent s’enfouir dans une épaisse couche de colle adhésive solidifiée, ce qui rendra la dissection impossible, et si elle recouvre le notum lui-même, la colle adhésive obstruera la lumière de l’échantillon. Deuxièmement, au cours des étapes 2.3 à 2.6, assurez-vous de ne retirer que le dôme supérieur du notum, en excluant autant de tissu latéral que possible. S’il est inclus, le tissu latéral sera comprimé pendant le montage et provoquera une boucle vers l’intérieur du milieu du notum, le plaçant souvent en dehors de la distance de travail des objectifs à ouverture numérique élevée. Troisièmement, lors de l’étape de nettoyage 2.9, il faut prendre un soin extrême pour ne pas endommager l’épithélium monocouche. Si le tissu a de grandes portions manquantes ou si aucun signal ne peut être détecté, cette étape est susceptible d’être blâmée.
Dépannage
Problème 1 : Après le montage, la nymphe s’éloigne du ruban adhésif double face pendant la dissection. C’est un problème courant, en particulier pour les débutants. Le meilleur remède est de s’assurer que l’extérieur de l’étui des nymphes est complètement sec / exempt de débris alimentaires. Retirer les aliments avec une pince émoussée et laisser le boîtier sécher à l’air libre pendant 10 à 15 minutes aidera à adhérer au ruban adhésif. Alternativement, utilisez la main non dominante et une paire de pinces émoussées pour maintenir les nymphes contre le ruban pendant la dissection. Si le problème persiste, l’application d’une petite goutte de vernis à ongles de 5 à 10 μL à la base de l’extrémité postérieure du boîtier et le laisser durcir fournit généralement une adhérence suffisante pour même les pupes les plus indisciplinées.
Problème 2 : Notum s’effondre à l’étape 2.3, ou la brèche initiale à travers le tégument n’est pas lisse. Si le tégument est difficile à percer, il peut y avoir trop de colle adhésive des étapes d’immobilisation. Placer les pupes disséquées dans de la colle moins adhésive améliorera ce problème. De plus, assurez-vous que les ciseaux de microdissection sont tranchants. Les ciseaux contondants ne pourront pas couper dans le tégument et auront tendance à le faire s’effondrer vers l’intérieur. Une fois que l’hémolymphe se répand hors des nymphes, assurez-vous que l’une des lames de coupe peut pénétrer dans la nymphe sans provoquer de déformation du notum. Si le notum s’effondre et que la lame ne pénètre pas dans la nymphe, continuez à couper jusqu’à ce qu’une lame pénètre dans la nymphe.
Problème 3 : Au cours de l’étape 2.4, les ciseaux attrapent ou font glisser le tégument. Si les ciseaux commencent à attraper ou à traîner le tégument, il est souvent utile de passer du côté opposé des pupes et de « desserrer » le tégument. D’autres ciseaux de microdissection émoussés rendront difficile l’obtention de coupes nettes à travers le tégument, et des ciseaux aiguisés doivent être utilisés.
Problème 4 : L’échantillon est accidentellement aspiré lors de la coloration (étapes 3.1 à 3.6). Le notum disséqué est difficile à voir car il est transparent. Il peut être utile de placer une feuille bleu foncé ou noire sous le couvercle pour fournir un contraste (un vieux porte-embout de pipette fonctionne bien. De plus, tous les changements de solution peuvent être effectués sous un microscope à dissection.
Problème 5 : Aucun signal n’est détecté/un signal inégal est détecté. Après avoir exclu les problèmes spécifiques aux taches, si aucun signal n’est détecté ou s’il est inégal, l’étape 2.9 (nettoyage) est probablement le coupable. Un signal absent ou inégal peut provenir de dommages et de l’ablation du tissu épithélial pendant le nettoyage. Inversement, un mauvais signal peut être causé par l’occlusion des bandes musculaires / cellules du corps adipeux si elles ne sont pas enlevées, car elles peuvent limiter la diffusion des taches et des anticorps dans le notum par rapport au tissu environnant. Si le tissu est endommagé, être plus doux pendant le nettoyage est la meilleure solution. Si, au lieu de cela, la tache est visible mais inégale, il est recommandé d’augmenter la vigueur / le temps consacré à l’étape de nettoyage pour enlever autant que possible le corps musculaire et gras. De plus, l’augmentation de la durée de la tache peut aider à résoudre ce problème avec un meilleur nettoyage.
Problème 6 : Le tissu notum a un aspect déformé/ridé pendant l’imagerie. Le gauchissement et les rides du tissu proviennent de deux sources. Tout d’abord, la compression du notum pendant le montage entraînera sa boucle et sa déformation. La meilleure solution est d’enlever autant de tissus latéraux que possible afin que le dôme soit aussi court que possible et puisse s’adapter entre les entretoises de glissement de couverture. Deuxièmement, si le notum est plié pendant la dissection, cette courbure ne se redressera pas pendant le montage, il faut donc prendre des précautions supplémentaires pour ne pas déformer le notum pendant la dissection. La flexion accidentelle du notum est plus fréquente lors de la coupe du tégument loin du reste des pupes. Il est tentant d’avoir les ciseaux de dissection à un angle par rapport aux nymphes au lieu de les garder dans le plan de l’échantillon comme les nymphes. Cependant, les ciseaux inclinés provoquent la boucle du tégument vers le haut lorsqu’il est coupé au lieu de rester plat.
Méthodes existantes, limites et applications futures
Wang et al.20 ont rapporté un protocole de dissection comparable pour l’isolement de l’épithélium nymphal. Cette technique nécessite que la nymphe reste dans son étui et soit rapidement coupée en deux avec un scalpel. Ce protocole est incompatible avec les échantillons précédemment imagés en direct, car l’imagerie en direct nécessite le retrait d’une grande partie du cas nymphal. Parce que les nymphes manquent de rigidité, la bisection nymphale à l’extérieur du boîtier a mutilé le tissu, inspirant la création de ce protocole. La technique détaillée ici permet l’isolement et la fixation du notum, et elle pourrait être utilisée comme première étape pour un large éventail d’autres méthodes telles que la cryosection, l’hybridation in situ ou la microscopie électronique.
Cette technique a certaines limites. Tout d’abord, la dissection, la fixation et la coloration du notum prennent plus de temps que l’imagerie vivante des protéines marquées par fluorescence dans le notum, qui ne nécessite qu’une simple dissection pour éliminer le cas nymphal 9,23. Deuxièmement, par rapport aux dissections d’autres tissus de la drosophile, cette dissection est plus difficile en raison du tissu mince et fragile et de la cuticule hydrophobe. Pour visualiser simplement les protéines dans l’épithélium de la drosophile, l’immunohistochimie sur des embryons fixes, des disques d’ailes larvaires ou des ovaires est plus facile. Cependant, cette technique permet d’associer la puissance de l’imagerie en direct à la fixation et à la coloration, ce qui en fait un outil puissant une fois maîtrisé.
Une technique de dissection/fixation présente certains avantages par rapport à l’imagerie en direct. Les structures basales (intérieures) peuvent être mieux résolues avec une vue basale (Figure 5L,J). Plus important encore, l’imagerie en direct est limitée aux fluorophores qui doivent être génétiquement fournis, nécessitant souvent de longs schémas de croisement génétique. En revanche, le protocole actuel permet l’application de taches, d’immunohistochimie et d’autres techniques nécessitant une dissection et une fixation. Cela augmente considérablement le nombre de signaux sondés dans le tissu tout en diminuant potentiellement le temps d’obtention de résultats expérimentaux.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aimeraient remercier le Dr M. Shane Hutson d’avoir établi le système d’ablation au laser utilisé pour les blessures nymphales et de ses contributions et commentaires sur l’élaboration du protocole. Ce travail a été soutenu par 1R01GM130130 à APM et M. Shane Hutson. JW était pris en charge par 2T32HD007502-21.
matériels
| Name | Company | Catalog Number | Comments |
| ½” Scotch Permanent Double-Sided tape | Scotch 3M | 665 | |
| 0.1-10 µL uTIP pipette tip | Biotix | M-0011-9FC | |
| 22 x 22 mm No. 0 thickness coverslips | Thomas Scientific | 1207Z28 | |
| 24 x 60 mm coverslip | Corning | 2980-246 | |
| 3M VetBond | 3M | 1469SB | Called "adhesive glue" in protocol |
| Anti-FasIII primary Mouse IgG2a | Developmental Studies Hybridoma Bank | 7G10 | |
| Calcium Chloride | Fisher Chemical | c79-500 | |
| Cy3-conjugated AffiniPure Goat Anti-Mouse IgG2a | Jackson ImmunoResearch | 115-165-206 | |
| DAPI | Sigma Aldrich | D9542-1mg | |
| Dumont #5 Fine Tip Forceps | Fine Science Tools | No. 11254-20 | |
| Dumont #5 Fine Tip Forceps: Blunt | Fine Science Tools | No. 11254-20 | Heavily used and unsharpened forceps, or dulled with a whetstone |
| Fisherbrand Double frosted microscope slides | Fisher Scientific | 22-034-486 | |
| Fluorescent Light Source | Lumencor | Celesta 90-10512 | |
| Fly Stock: EGFP-tagged Histone H2A | Bloomington Drosophila Stock Center | 24163 | |
| Fly Vial Foam Plugs "Flugs" | Genesee Scientific | 49-101 | |
| Humidified Chamber: Foil-wrapped small container lined with filter paper saturated with water | Cole-Parmer | 759075D | A great humidified chamber can be made from the styrofoam box containing Cole-Parmer cuvettes, 759075D, filled with 50 ml water. |
| KimWipe | KimTech | 34155 | Called "Absorbent Tissue" in protocol |
| Nikon Ti2 Eclipse | Nikon | Eclipse Ti2-E | |
| NIS Elements Software | Nikon | AR | |
| Parafilm | Pechiney Plastic Packaging | PM-996 | |
| Paraformaldehyde (PFA) 16% | Ted Pella, Inc | 18505 | |
| Plastic Vials | Genesee Scientific | 32-114 | |
| Sodium Azide (NaN3) | Fisher Scientific | 19038-1000 | |
| Stereo Microdissection Scope | Carl Zeiss | STEMI 2000 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | New or freshly sharpened scissors |
| Vecta Shield | Vector Laboratories | H-1000 | Called " antifade mounting medium" in protocol |
| Vecta Shield with DAPI | Vector Laboratories | H-1200 | Not ideal for pupal notum. |
| X-Light V2 Spinning Disc | Crest Optics | V2 L-FOV |
Références
- Valon, L., et al. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination. Developmental Cell. 56 (12), 1700-1711 (2021).
- Levayer, R., Dupont, C., Moreno, E. Tissue crowding induces caspase-dependent competition for space. Current Biology. 26 (5), 670-677 (2016).
- Couturier, L., et al. Regulation of cortical stability by RhoGEF3 in mitotic sensory organ precursor cells in Drosophila. Biology Open. 6 (12), 1851-1860 (2017).
- Couturier, L., Mazouni, K., Corson, F., Schweisguth, F. Regulation of Notch output dynamics via specific E(spl)-HLH factors during bristle patterning in Drosophila. Nature Communications. 10, 3486 (2019).
- Fujisawa, Y., Shinoda, N., Chihara, T., Miura, M. ROS regulate caspase-dependent cell delamination without apoptosis in the drosophila pupal notum. iScience. 23, 101413 (2020).
- Besson, C., et al. Planar cell polarity breaks the symmetry of par protein distribution prior to mitosis in drosophila sensory organ precursor cells. Current Biology. 25 (8), 1104-1110 (2015).
- Koto, A., Kuranaga, E., Miura, M. Apoptosis ensures spacing pattern formation of drosophila sensory organs. Current Biology. 21, 278-287 (2011).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Moreira, C., Regan, J., Zaidman-Rémy, A., Jacinto, A., Prag, S. Drosophila hemocyte migration: an in vivo assay for directional cell migration. Methods in Molecular Biology. 769, 249-260 (2011).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. Elife. 4, 08519 (2015).
- Cristo, I., Carvalho, L., Ponte, S., Jacinto, A. Novel role for Grainy head in the regulation of cytoskeletal and junctional dynamics during epithelial repair. Journal of Cell Science. 131 (17), 213595 (2018).
- Bellaïche, Y., Gho, M., Kaltschmidt, J. A., Brand, A. H., Schweisguth, F. Frizzled regulates localization of cell-fate determinants and mitotic spindle rotation during asymmetric cell division. Nature Cell Biology. 3 (1), 50-57 (2001).
- Shannon, E. K. Multiple mechanisms drive calcium signal dynamics around laser-induced epithelial wounds. Biophysical Journal. 113 (7), 1623-1635 (2017).
- O'Connor, J. T., et al. Proteolytic activation of Growth-blocking peptides triggers calcium responses through the GPCR Mthl10 during epithelial wound detection. Developmental Cell. 56 (15), 2160-2175 (2021).
- Hartenstein, V., Posakony, J. W. Development of adult sensilla on the wing and notum of Drosophila melanogaster. Development. 107 (2), 389-405 (1989).
- Yeh, E., Zhou, L., Rudzik, N., Boulianne, G. L. Neuralized functions cell autonomously to regulate Drosophila sense organ development. The EMBO Journal. 19 (17), 4827-4837 (2000).
- Loubéry, S., et al. Uninflatable and notch control the targeting of sara endosomes during asymmetric division. Current Biology. 24 (18), 2142-2148 (2014).
- Kawamori, A., Shimaji, K., Yamaguchi, M. Dynamics of endoreplication during Drosophila posterior scutellar macrochaete development. PLoS One. 7 (6), 38714 (2012).
- Couturier, L., Schweisguth, F., Bellen, H. J., Yamamoto, S. . Notch Signaling: Methods and Protocols. , 79-86 (2014).
- Wang, W., Yoder, J. H. Drosophila pupal abdomen immunohistochemistry. Journal of Visualized Experiments. (56), e3139 (2011).
- Kiehart, D. P., et al., Celis, J. E., et al. . Cell Biology (Third Edition). , 87-103 (2006).
- Bailey, E. C., Dehn, A. S., Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. A Drosophila model to study wound-induced polyploidization. Journal of Visualized Experiments. (160), e61252 (2020).
- O’Connor, J. T., S, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protocols. , (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon